Method Article
Um modelo de tecido Pulmão humano 3D para estudos funcionais em
Neste Artigo
Resumo
Human tuberculosis infection is a complex process, which is difficult to model in vitro. Here we describe a novel 3D human lung tissue model that recapitulates the dynamics that occur during infection, including the migration of immune cells and early granuloma formation in a physiological environment.
Resumo
A tuberculose (TB) ainda mantém uma grande ameaça para a saúde das pessoas em todo o mundo, e há uma necessidade de modelos de custo-eficiente, mas de confiança para nos ajudar a compreender os mecanismos da doença e avançar as descobertas de novas opções de tratamento. Culturas celulares in vitro de monocamadas ou co-culturas falta o ambiente tridimensional (3D) e as respostas dos tecidos. Descrevemos um inovador modelo in vitro de um tecido de pulmão humano, o que é uma promessa para ser uma ferramenta eficaz para o estudo dos complexos eventos que ocorrem durante a infecção com Mycobacterium tuberculosis (M. tuberculosis). O modelo de tecido 3D consiste em células epiteliais e fibroblastos específicos de tecido, que são cultivadas numa matriz de colagénio no topo de uma membrana porosa. Após a exposição ao ar, as células epiteliais estratificar e secretam muco no lado apical. Com a introdução de macrófagos primários humanos infectados com M. tuberculose para o modo de tecidol, que têm demonstrado que as células imunes migram para o tecido infectado e formar fases iniciais de granuloma TB. Estas estruturas recapitular a característica distinta da tuberculose humana, o granuloma, que é fundamentalmente diferente ou não comummente observadas em modelos animais experimentais utilizados. Este método de cultura organotípicas permite a visualização 3D e análise quantitativa robusta que fornece informação fundamental sobre as características espaciais e temporais de interações celulares patógeno-hospedeiro. Tomados em conjunto, o modelo de tecido de pulmão proporciona um micro-ambiente fisiologicamente relevante tecidos para estudos sobre a tuberculose. Assim, o modelo de tecido pulmonar tem implicações potenciais para ambos os estudos mecanicistas e aplicadas básicas. Mais importante, o modelo permite a adição ou a manipulação de tipos de células individuais, que, assim, alarga o seu uso para modelar uma variedade de doenças infecciosas que afectam os pulmões.
Introdução
Nos seres humanos, as respostas à infecção, inflamação do tecido, recrutamento celular, remodelamento tecidual e regulação da homeostase do tecido são eventos complexos que envolvem diferentes tipos de células. Assim, estes processos são melhor estudada no ambiente de tecido local. Anteriormente, esta tem sido possível principalmente em modelos animais experimentais. No entanto, os animais experimentais utilizados conter muitos limites como respondem frequentemente de agentes patogénicos de um modo diferente do que os seres humanos e também exibir um curso diferente da doença 1. Um modelo humano in vitro tecido pulmonar mantém a possibilidade de estudar as respostas imunitárias específicas do pulmão humano.
Infecção por tuberculose humana (TB) é uma doença que afecta principalmente os pulmões. Mycobacterium tuberculosis (M. tuberculosis), o agente causador da tuberculose, atinge o pulmão através de gotículas de aerossol que são transportadas para o espaço alveolar, onde as bactérias são engolidos por dendri pulmonarcélulas de tiques e macrófagos alveolares como parte da resposta imune inata a infecção 2,3. Fagocitose do patógeno leva à compartimentação do bug dentro de um phagosome e, idealmente, resulta na neutralização e assassinato do patógeno pelo fagócitos. Até 50% de indivíduos expostos a M. tuberculose são acreditados para ser capaz de eliminar a infecção por meio da resposta imune inata 4. Outros resultados de infecção são apuramento pelo sistema imunológico adaptativo, numa fase posterior, a infecção latente ou no pior dos casos doença crónica activa 5.
Anteriormente, não houve modelos in vitro de tecidos para estudos de tuberculose humana. Culturas de células individuais de macrófagos humanos ou outras células de sangue periférico foram frequentemente utilizados 6,7. A desvantagem desta abordagem é que eles não podem reflectir a dinâmica de diferentes tipos de células que operam em conjunto num tecido pulmonar exposto a M. tuberculose . Assim, existe uma necessidade para um modelo in vitro para ser capaz de realizar estudos funcionais e mecanísticos sobre a tuberculose. O modelo in vitro de tecido de pulmão humano aqui descrita com base nas células foi originalmente criada pelo nosso grupo de estudos sobre as funções das células dendríticas 8. Temos adaptado este método para o estudo dos TB.
O modelo de tecido de pulmão humano aqui apresentada é constituída por células epiteliais e fibroblastos 8 específicos de tecidos. Estas células são cultivadas numa matriz de colagénio no topo de uma membrana porosa Transwell em uma inserção de estruturas e formas semelhantes tecido de pulmão humano normal (Figura 1). Quando exposto ao ar as células começam a segregar muco no lado apical 8. Através da implantação de macrófagos primários humanos infectados com M. tuberculose com o modelo, observou-se a forma como as células do sistema imunológico migrar no tecido e formam fases iniciais de granulomas 9 TB. Este é o primeiro modelo de tecido humano described para TB e representa uma ferramenta promissora para o estudo da resposta imune inata a TB e outras doenças do pulmão. Até à data, utilizou-se apenas monócitos e macrófagos como células do sistema imunológico no modelo, mas o nível de complexidade pode ser aumentada por inclusão de tipos de células relevantes adicionais.
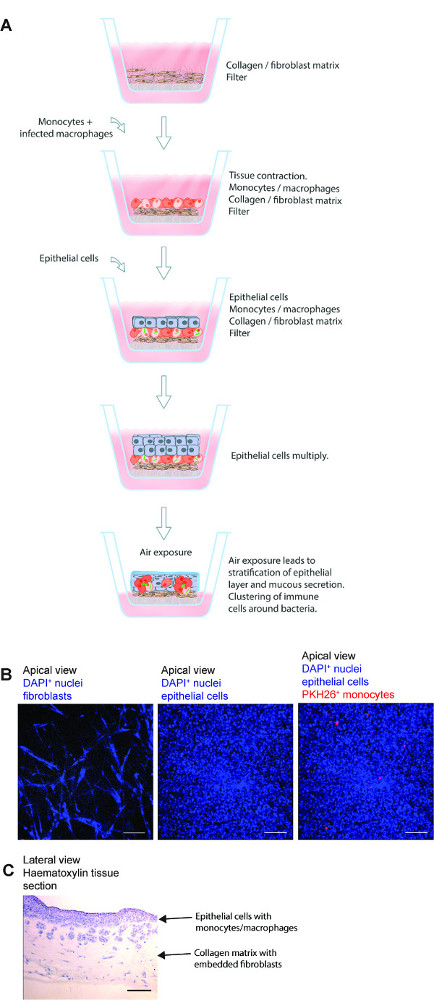
Figura 1. Diagrama esquemático do contorno modelo de tecido de pulmão. (A) O modelo é composto de células epiteliais pulmonares humanas específicas do, M. tuberculose infectados com macrófagos primários e corante vermelho monócitos marcados semeados em colágeno incorporado fibroblastos preparado com um filtro transwell. Exposição do modelo de tecido de ar inicia a produção de proteínas da matriz extra-celular, a secreção de muco e estratificação pelo epitélio. O modelo de tecido 3D assim desenvolvido é uma ferramenta útil para estudar M. infecção por tuberculose em um ambiente que closely se assemelha a um pulmão humano. (B) imagens microscópicas representativas das diferentes etapas na preparação do modelo de tecido. (C) estrutura completa da secção de tecido do modelo de pulmão. Scale -. 100 mm Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
Nota: sangue periférico humano de dadores de sangue saudáveis anónimos comprados no banco de sangue do Hospital Universitário de Linköping, na Suécia foi usado como fonte de células do sistema imunológico para este estudo. Este protocolo é concebido para inserções 24 mm de placa de 6 poços. Adaptação direta para outros formatos assim não é recomendada uma vez que os contratos-tipo de tecido vertical e horizontalmente durante o desenvolvimento.
1. Preparação de Materiais, Mídia e Cultura de Bactérias / Linhas Celulares
- Cultura de bactérias:
- Crescer a estirpe micobacteriana M. tuberculosis H37Rv portadora do plasmídeo pFPV2 para expressar constitutivamente proteína fluorescente verde (GFP), em meio Middlebrook 7H9 contendo 0,05% de Tween-80, 0,5% de glicerol, canamicina (20 ug / ml), e suplementado com Middlebrook albumina, dextrose e catalase enriquecimento ( Middlebrook ADC), a 37 ° C com 5% de CO 2, durante 7-10 dias.
Nota: Todos etapa experimentals envolvendo vivo virulenta M. estirpes de tuberculose deve ser realizado numa instalação de NBS-3.
- Crescer a estirpe micobacteriana M. tuberculosis H37Rv portadora do plasmídeo pFPV2 para expressar constitutivamente proteína fluorescente verde (GFP), em meio Middlebrook 7H9 contendo 0,05% de Tween-80, 0,5% de glicerol, canamicina (20 ug / ml), e suplementado com Middlebrook albumina, dextrose e catalase enriquecimento ( Middlebrook ADC), a 37 ° C com 5% de CO 2, durante 7-10 dias.
- Prepare Meio de Eagle Modificado (DMEM) completo de 1x Dulbecco (suplementado com piruvato a 1 mM de sódio, 2 mM de L-glutamina, 100 U / ml de penicilina, 100 ug / ml de estreptomicina, HEPES 10 mM, 0,1 mM de aminoácidos não essenciais e 10 % de calor-inactivado soro fetal de bovino (FBS)). Prepare também DMEM meio completo antibiótico-livre.
- Prepare 1x Medium (MEM), meio completo Essencial Mínimo (piruvato de sódio 1 mM, 2 mM de L-glutamina, 100 U / ml de penicilina, 100 ug / ml de estreptomicina, 10 mM de HEPES, 0,1 mM de aminoácidos não essenciais e 10% de calor inactivado soro fetal bovino (FBS)).
- Preparação de fibronectina / frascos revestidos com colagénio (total de 10 ml):
- Pipetar 8,8 ml de fosfato de 1x estéril soro fisiológico tamponado (PBS) para um tubo limpo. Adicionar 1 ml de albumina de soro bovino (1 mg / ml), 100 ul de tipo I bovino colagénio (3 mg / ml) e 100 ul recombinante Huhomem fibronectina (1 mg / mL).
- Misture a solução, rodando o tubo de cabeça para baixo 5 vezes. Os frascos são revestidos com uma solução de fibronectina / colagénio (1 ml para um T-25 e 2 ml para um frasco T-75). Deixe-O / N a 37 ° C. Após a incubação, a solução de remover e armazenar os frascos revestidos à TA.
Nota: A solução recolhida pode ser armazenada a 4 ° C e reutilizada por três vezes. Armazenamento por mais de 2 semanas, pode fazer com que o líquido a ficar acastanhada (formação de cristais), em que sobre ela deve ser descartada.
- Cultura de fibroblastos:
- Crescer e manter células MRC-5 (uma linha de células de fibroblasto de pulmão humano derivadas de tecido pulmonar normal de 14 semanas de idade feto masculino), em DMEM completo em 5% de CO2 a 37 ° C. Use os fibroblastos em passagens 24-26 e crescer até 70-80% confluentes.
Nota: MRC-5 na linha de células de passagem> 30 tendem a perder a morfologia e não é recomendado para utilização no modelo de tecido.
- Crescer e manter células MRC-5 (uma linha de células de fibroblasto de pulmão humano derivadas de tecido pulmonar normal de 14 semanas de idade feto masculino), em DMEM completo em 5% de CO2 a 37 ° C. Use os fibroblastos em passagens 24-26 e crescer até 70-80% confluentes.
- Cultura de células epiteliais:
- Obter 16HBE14o- (16HBE), uma linha celular imortalizada humana brônquica epitelial que mantém a morfologia diferenciada e função do epitélio das vias aéreas normais humana, (este foi um presente do Dr. Dieter Gruenert, Mt. Zion Cancer Center, da Universidade da Califórnia, em San Fransisco , EUA. 10). Cultura de células em fibronectina 16HBE / frascos revestidos com colagénio e manter as células em meio MEM completo em 5% de CO2 a 37 ° C.
- Preparação de 5x DMEM
- Prepare 5x DMEM por dissolução de 13,4 g de DMEM em pó e 3,7 g de bicarbonato de sódio em 150 ml de água destilada estéril. Ajustar o pH do meio para 7,3, perfazer o volume de 200 ml e filtrá-la usando 0,22 um filtro de membrana. Recolhe-se o meio filtrado em um recipiente estéril e armazenado até à sua utilização, à TA.
2. Preparação de colagénio fibroblastos embebidos-
- Alíquotas congeladas Thaw de FBS e L-glutamina em um 37 ° C banho de água.Após descongelação manter as amostras em gelo. Coloque bicarbonato de sódio (71,2 mg / mL) e gentamicina (50 mg / ml) a 4 ° C. Pré-cool 50 ml de tubos de centrífuga de 10 ml e pipetas estéreis a 4 ° C.
Nota: Todos os materiais utilizados (excepto o 5x DMEM) são arrefecidas em gelo antes do uso e todos os passos são realizados em gelo. O colagénio bovino tipo I (1,1 mg / mL) deve ser mantido frio, tal como este evita a solidificação de colagénio. - Preparar as células de fibroblasto:
- Tripsina quente em um banho de água ° C e incubar 37 quantidade suficiente com fibroblastos de pulmão (MRC-5), as células durante 10 min a 5% de CO2 a 37 ° C. Neutraliza-se a tripsina por adição de 1x DMEM completo. Aspirar a suspensão celular e centrifugue a 300 xg durante 5 min. Aspirar o sobrenadante e ressuspender as células em 2,3 x 10 5 células / ml em DMEM completo. Colocar as células em gelo até pronto para ser utilizado.
- Prepara-se o pré-mistura:
- Adicionar o seguinte a um tubo rotulado "pré-mistura"; 395ul de 5x de DMEM, 40 mL de L-Glutamina, 120 uL de NaHCO3 (71,2 mg / ml), 440 ul de FBS, 5 uL de gentamicina (50 mg / ml), Volume total de 1.000 ul, em seguida, agita-se o pré-misturar bem e colocar gelo.
Nota: Os volumes indicados são para um 24 de mm de 6 poços inserção de cultura. Calcule os valores específicos necessários para o número total de inserções mas adicionar um extra para ter certeza, o suficiente de pré-mistura é preparada.
- Adicionar o seguinte a um tubo rotulado "pré-mistura"; 395ul de 5x de DMEM, 40 mL de L-Glutamina, 120 uL de NaHCO3 (71,2 mg / ml), 440 ul de FBS, 5 uL de gentamicina (50 mg / ml), Volume total de 1.000 ul, em seguida, agita-se o pré-misturar bem e colocar gelo.
- Prepare a mistura de colágeno acelular:
- Para cada cultura adicionar 1 ml de mistura de colágeno acelular. Adicione o seguinte para um tubo cônico de 50 ml no gelo na ordem dada; 686 ul de 1,1 mg / ml de colagénio, 250 ul de pré-mistura e 64 ul de 1x DMEM completo para um volume total de 1000 ul. Misture a solução assim garantir a ausência de bolhas de ar. Trabalho rápido e adicionar o colagénio na parede do tubo para evitar bolhas de ar.
- Adicionar 1 ml da mistura da camada acelular para o inserto colocado na placa de 6 poços. Não adicione qualquer meio para o bem do lado de fora da inserção. DentroCubate durante 30 minutos num banho a 37 ° C incubadora. Certifique-se a mistura acelular cobre toda a inserção sem quaisquer bolhas de ar.
- Prepare a mistura de colagénio celular:
- Misture os componentes da camada celular em um tubo de 50 ml mantido em gelo na seguinte ordem; 2 ml de colágeno, 615 mL de pré-mistura, 58 ul de 1x DMEM completo e 327 ul de suspensão de células de fibroblastos de pulmão (MRC-5) para compensar o volume total de 3.000 l. Cada cultura requer 3 ml de mistura de colagénio celular.
Passo crítico: Certifique-se de misturar o colágeno e pré-mistura cuidadosamente antes da adição da suspensão celular. Isto irá neutralizar o pH do colagénio para evitar efeitos tóxicos sobre os fibroblastos. - Adicionar a camada celular (3 ml) no topo da camada de colagénio acelular e incubar durante 2 horas num banho a 37 ° C incubadora. Trabalho rápido e adicionar o colagénio na parede do tubo para evitar bolhas de ar.
- Na sequência de polimerização, adicionar 2 ml de DMEM completo para tele parte inferior da placa de 6 poços (sob a inserção) e incuba-se durante 24 h.
NOTA: Se não ocorreu polimerização, descartar as inserções placa contendo a matriz de colagénio e fibroblastos-start-outra vez. A causa mais provável é um erro na adição ou volume incorrecta de um dos reagentes acima mencionados.
- Misture os componentes da camada celular em um tubo de 50 ml mantido em gelo na seguinte ordem; 2 ml de colágeno, 615 mL de pré-mistura, 58 ul de 1x DMEM completo e 327 ul de suspensão de células de fibroblastos de pulmão (MRC-5) para compensar o volume total de 3.000 l. Cada cultura requer 3 ml de mistura de colagénio celular.
3. Cultura contínua da Matriz de fibroblastos de colágeno-
- Levantar cuidadosamente a inserção utilizando um fórceps limpas e aspirar o meio de cultura a partir do fundo do poço. Adicionar 2 ml de DMEM completo para o fundo do poço, seguido por 2 ml de DMEM completo no interior da inserção. Evitar a introdução de bolhas de ar sob a inserção, porque isso vai impedir a difusão de nutrientes entre as câmaras exteriores e interiores. Remova as bolhas de ar com uma ponta de micropipeta.
- Alterar o meio de cultura (dentro e abaixo da inserção) a cada dois dias e cultura para cerca de 5-7 dias. Tome cuidado ao remover a mídia a partir da inserção. Para evitar Contact com a matriz de fibroblastos-colágeno, incline levemente a inserção utilizando uma limpa de fórceps e aspirar a mídia a partir das paredes de inserção.
Passo crítico: Os fibroblastos na matriz de colágeno deve obter um fenótipo alongada e remodelar o colágeno, que então contratos. Em cerca de 5-7 dias, a matriz contraiu para formar uma plataforma (10-14 mm de diâmetro) no centro do inserto. A matriz é contraído pronto para utilização no passo seguinte. Para obter uma contracção uniforme da matriz é essencial que os fibroblastos são bem misturados com o colagénio antes da sementeira (Passo 2.6.1).
4. Sementeira de células imunes (Infected Uninfected monócitos-macrófagos Mistura /)
Nota: Os seguintes passos experimentais envolvem micobactérias virulentas e, portanto, deve ser realizada em uma facilidade BSL-3.
- Preparação de monócitos e macrófagos primários:
- Isolar monócitos do sangue periférico a partir de sangue de doadores utilizando um estabederramado protocolo. Isolar monitos no mesmo dia que a configuração do modelo de cultura de tecidos e diferenciá-los e em macrófagos durante aproximadamente 7 dias antes da infecção com M. tuberculose.
NOTA: Isso irá garantir tanto os macrófagos e a matriz de colagénio de fibroblastos-contratados estão disponíveis após 7 dias. Também isolar monócitos frescos que serão adicionados em conjunto com os macrófagos infectados.
- Isolar monócitos do sangue periférico a partir de sangue de doadores utilizando um estabederramado protocolo. Isolar monitos no mesmo dia que a configuração do modelo de cultura de tecidos e diferenciá-los e em macrófagos durante aproximadamente 7 dias antes da infecção com M. tuberculose.
- Preparação de M. tuberculose infectados por macrófagos
- Colher as bactérias cultivadas, lava-se com 1x de PBS contendo 0,05% de Tween-80, ressuspender em DMEM completo antibiótico livre, passar através de uma estéril truncada agulha G 27 para dispersar aglomerados bacterianas e medir a densidade óptica.
Nota: Pré-determinar a M. tuberculose colónia formando unidades equivalentes de densidade óptica no laboratório. Isto irá dar uma estimativa do número de bactérias a ser utilizado para a infecção. - Incubar os macrófagos durante 4 horas com M. tuberculose, a multiplicidade de infecção (MOI) de 10). Após a infecção, lavar 3x com 1x PBS para remover as bactérias extracelulares. Use macrófagos não infectados cultivadas na mesma maneira mas sem M. tuberculose, como controlos.
- Separar os macrófagos da placa de cultura por tratamento com EDTA a 2 mM durante 10 min a 37 ° C e ressuspenderam-se as células em meio isento de antibiótico DMEM completo.
- Colher as bactérias cultivadas, lava-se com 1x de PBS contendo 0,05% de Tween-80, ressuspender em DMEM completo antibiótico livre, passar através de uma estéril truncada agulha G 27 para dispersar aglomerados bacterianas e medir a densidade óptica.
- Rotulagem de monócitos
Nota: Isolamento e rotulagem de monócitos pode ser realizada na BSL-2 bancada e, em seguida, tomado em BSL-3 instalações para processamento adicional.- Mancha monócitos preparados de fresco (2 x 10 7 células) com uma concentração final de 2 fiM PKH26 corante vermelho durante 5 min, de acordo com as instruções do fabricante. Lavar 3x e ressuspender as células com DMEM isento de antibiótico completo a uma densidade de 1 x 10 7 células / ml.
- A adição de células do sistema imunológico para fibroblastos-Matriz de Colagénio
- UMAepois de 5-7 dias de cultura da matriz de fibroblastos-colágeno, aspirar o meio de cultura das câmaras exteriores e interiores e adicionar 1,5 ml de DMEM fresco antibiótico-livre completo para a câmara exterior.
- Prepara-se uma monócitos-macrófagos marcado (infectados não infectados /) mistura com um rácio de MO: MQ (5: 1) em 50 ul de DMEM completo. Para 50.000 macrófagos, monócitos tomar 250.000 rotulados.
- Adicionar 50 ul MO: MQ mistura com a matriz de colagénio e fibroblastos-incubar durante 1 hora em 5% de CO2 a 37 ° C. Após a incubação, adicionar cuidadosamente 2 ml de meio de cultura para a inserção e incubar durante mais 24 horas adicionais em 5% de CO2 a 37 ° C.
Nota: medida que as células são adicionadas frouxamente ligado, além dos meios de comunicação deve ser lento, adicionando suavemente sobre as paredes da inserção.
5. Plantio de pulmão células epiteliais (16HBE)
Nota: As seguintes etapas devem ser executadas em uma facilidade BSL-3.
- Semente de pulmão ecélulas pithelial (16HBE) em cima do MO:-MQ-de fibroblastos de colágeno camada. Para realizar isto, primeiro dissociar 16HBE células a partir do balão por tratamento com tripsina (como em 2.2.1.) E ressuspender a 4 x 10 6 células / ml em DMEM isento de antibiótico.
- Aspirar o meio de cultura dentro e fora da inserção. Em seguida, adicionar 1,5 ml de DMEM isento de antibiótico completa no fundo do poço do lado de fora do inserto.
- Adicionar 50 ul de 16HBE no topo da matriz de colagénio imune celular de fibroblastos. Deixar durante 2 min na tampa e incubar durante 1 h em 37 ° C incubadora com 5% de CO 2. Após a incubação, adicionar suavemente 2 ml de DMEM isento de antibiótico completa no interior da inserção e cultura a 37 ° C durante 3 dias. O passo de cultura facilita a proliferação de células epiteliais no tecido modelo.
Nota: Como as células adicionados são frouxamente ligados, além dos meios de comunicação deve ser lenta e suave, deslizando pelas paredes da inserção.
6. Air-exposição do Pulmão 3DModelo
Nota: Depois de 5 dias após a adição de macrófagos infectados, os modelos de tecido são expostos ao ar e as seguintes etapas devem ser executadas em uma facilidade BSL-3.
- Aspirar o meio de cultura dentro e fora da inserção.
Nota: Neste passo sobrenadantes podem ser recolhidos para a detecção de factores secretados. Centrífuga, estéril-filtro e armazenar sobrenadantes a -70 ° C. - Adicionar 1,8 ml de DMEM isento de antibiótico completas na câmara exterior e incubar em 5% de CO2 a 37 ° C incubadora durante 2 dias. Não adicione mídia de cultura dentro da inserção.
NOTA: Ar-levantamento do modelo de tecido facilita a formação de epitélio estratificado e a secreção de muco, que fornece a força para o tecido e semelhança fisiológica para tecido pulmonar humano.
7. Colheita e Montagem do modelo de tecido pulmonar 3D
Nota: As seguintes etapas devem ser executadas em uma facilidade BSL-3.
- No dia 7 pós-implantação de macrófagos infectados, os modelos de tecido estão prontos para a colheita. Retire os meios de cultura inteiramente a partir do modelo de tecido. Corrigir o modelo de tecido com 4% de paraformaldeído durante 30 min no escuro à temperatura ambiente. Este passo mata as bactérias e fixa a morfologia do tecido / célula para processamento adicional.
- Utilizando um escalpelo, separar a membrana do poço de inserção. Transferir a membrana contendo o tecido a um poço contendo 1x PBS.
- Cortar e remover os lados do modelo de tecido usando um bisturi limpa. Em seguida, corte o modelo de tecido em 4 pedaços quadrados aproximadamente iguais. Transferir uma peça de tecido para uma lâmina de vidro SuperFrost. Armazenar os pedaços de tecido em 1x PBS a 4 ° C.
- Seque o tecido para 5 min e montar usando prolongar Ouro antifade com DAPI e lamela. Deixe os slides sem perturbar no escuro à temperatura ambiente até secar.
Nota: A espessura do tecido pode variar entre o centro e a periferia, causando ligeira tilting da lamela. Para evitar isto, um espaçador (por exemplo parafilme) pode ser colocado no canto da lâmina de cobertura. - Aplique unha polonês para as bordas da lamela e deixe-a secar. Mergulhe as lâminas em etanol a 70% para torná-las seguras para trazer para fora das instalações BSL-3.
8. Visualization, Aquisição e Análise Quantitativa 3D
- Visualizar as lâminas de tecido, utilizando um sistema de microscópio confocal com laser emitindo a 488 nm para a excitação de GFP (canal verde), 420 nm para DAPI (azul) e 555 nm para os monócitos marcados PKH26 (vermelho), respectivamente.
- Adquirir imagens 3D em uma resolução 512x512 com Z-stacks cobrindo com um mínimo de espessura de 20 mm e com 1-1,5 mm separação entre pilhas. Adquirir 5-10 campos diferentes que abrangem toda a peça de tecido.
Nota: Use a configuração, como Nyqvist para ajustes ideais de resolução óptica (comprimento de onda, laser poder / exposição, tamanho do pixel e zoom). Evite under ou mais de saturação de pixels. - Analisar as imagens confocal com software de processamento de imagem em 3D. Para a quantificação 3D de agrupamentos de células, os passos que se seguem são recomendados para análise óptima.
- Abra o software de processamento de imagem 3D e carregar a imagem. Medem-se as dimensões dos objectos a serem analisados na imagem, por exemplo, do tamanho de um núcleo, monócitos individual e bactérias individuais. Estas observações são úteis para a definição ou filtrando os objectos.
- Usando uma ferramenta de ajuste de exposição, otimizar renderização de volume, ajustando cada canal para o contraste da imagem, brilho e opacidade misturar. Este passo é o de minimizar a interferência de ruído no processamento de volume.
Nota: correção Gamma pode levar à manipulação de imagens e, portanto, deve ser evitado. - Criar superfícies por escolher o canal vermelho (monócitos) e definir o limite (seleção automática ou manual). Se necessário, usar filtros para restringir a selecção de monócitos vermelhos ou excluir a background. Da mesma forma, criar superfícies para verde (M. tuberculosis) e azul (núcleos) canais como descrito acima.
- Exportar os dados para arquivos do MS-Excel. É possível exportar um parâmetro específico ou todos os dados. Os parâmetros que são relevantes para a análise de agrupamento de células são em volume, intensidade, número de objetos, número de voxels e esfericidade.
- Salvar e exportar as imagens em um formato de imagem adequado, de preferência TIFF.
NOTA: As animações também podem ser feitas usando o menu de animação e salva como um arquivo de mídia. - Salve as configurações de análise de cada canal usando a opção Add parâmetros e pode ser recuperada posteriormente usando a função Rebuild. Simultaneamente analisar mais arquivos usando a ferramenta de processamento em lote.
Nota: Todas as imagens a serem comparados devem ser adquiridos, processadas e analisadas do mesmo modo. Por exemplo uma imagem de 8 bits (256 integer) não devem ser comparados de uma imagem de 12 bits (4096 inteiro) com.
Resultados
Um modelo de tecido pulmonar 3D para TB humano pode ser efetivamente usado para estudar as interações patógeno-hospedeiro em M. infecção por tuberculose. Os passos básicos do presente método, imagens representativas microscópicas de diferentes etapas e uma estrutura microscópica geral de uma secção de tecido são apresentadas na Figura 1. O modelo tem vários componentes de tecido de pulmão humano, incluindo os fibroblastos de pulmão, células epiteliais brônquicas e monócitos primários / macróf agos incorporados no ambiente de tecido 3D. Além disso a incorporação de componentes de tecido de pulmão humano, o modelo se assemelha condições fisiológicas ou seja, a estratificação de epitélios e secreção de muco.
Um exemplo para a utilização do modelo de tecido pulmonar no controlo de uma infecção de tuberculose é apresentado na Figura 2. Para visualizar a M. tuberculose migração celular -immune e interação, introduzimos macrófagos infectados com M. tuberculose que expressam GFP(verde), juntamente com os monócitos marcados com PKH26 isoladas de fresco (vermelho) para o modelo de tecido (azul, DAPI coradas para núcleos). No dia 7 pós adição de M. células infectadas com tuberculose para o modelo de tecido, microscopia confocal revela agregação de monócitos vermelhos no local da infecção (verde) (Figura 2), que imita as lesões da indicação de tuberculose humana 9.
Uma série de imagens representativas para visualização 3D de M. tuberculose infectados pelo modelo de tecido e quantificação de grupos de células é mostrada na Figura 3. A visualização 3D proporciona a flexibilidade do usuário para interagir, analisar e quantificar vários recursos em uma imagem 3D. O arranjo espacial de bactérias verdes e vermelhas aglomerados de monócitos pode ser visto a partir do plano apical, rotacional e lateral tal como ilustrado na Figura 3B, o que revela a agregação de monócitos no local da M. Os aglomerados de tuberculose. não foram observido em tecidos não infectados (Figura 3A). Foram quantificados o tamanho e número de aglomerados de células de monócitos e descobriram que o tamanho (volume) de agrupamentos de células é aumentada (p <0,001), enquanto o número de monócitos individuais diminuiu (P <0,01) em M. tuberculose tecidos infectados em comparação com tecidos não infectados modelos (Figura 3C e 3D). Estes dados valida a nossa conclusão anterior de formação de granulomas no início M. infecção tuberculose observada em modelos de tecido pulmonar analisados em secções de tecido 2D 9.
Nossos dados sugerem que o modelo de tecido proporciona um habitat natural 3D para investigar o anfitrião complexo CÉLULA M. rede de comunicação tuberculose. Descobrimos também que a visualização 3D e análise quantitativa são as melhores ferramentas para estudar as características do modelo de tecido (Figura 3). Quantificação de um conjunto de células (granuloma por exemplo) muitas vezes stretc hes a várias camadas de células e pode ser completamente capturado por uma análise quantitativa 3D. Além disso, a visualização de recursos espaciais e temporais exatas de células individuais ou bactérias no modelo permitem live-imagiologia, de migração e de rastreamento de estudos em um laboratório designado.
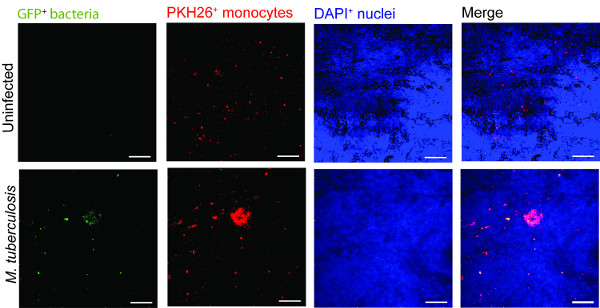
Figura 2. Monocyte no cluster modelo de tecido em torno virulenta M. tuberculose. imagens confocal representativos de não infectado e M. tuberculose modelo de tecido infectado é apresentado. Painéis de verde (GFP M. a tuberculose), vermelho (monócitos marcados com PKH26), azul (núcleos corados DAPI) e canais fundidos mostrar o recrutamento de monócitos no tecido infectado, em comparação com tecidos não infectados. Escala - 100 um.large.jpg "style =" font-size: 14px; line-height: 28px; "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
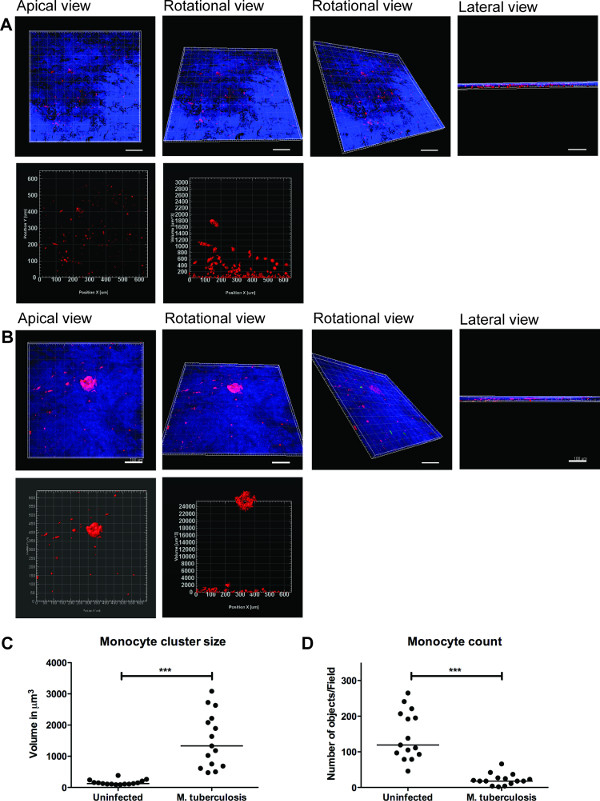
Figura 3. visualização 3D e análise quantitativa do modelo de tecido de fornecer informações úteis. Imagens representativas de visualização 3D do modelo de tecido inteiro (A) de tecido não infectadas, (B) infectadas com M. tuberculose, através de seccionamento óptico usando Zeiss LSM700 microscópio confocal e análise quantitativa por software de processamento de imagem Imaris (versão 7.6.8). Estas imagens foram adquiridas com ampliação de 20x, 14 z-pilhas que cobrem uma espessura do tecido de 19,5 um, com 1,5 um intervalo, permitindo a visualização de apical, horizontal de rotação, vista de rotação vertical e lateral (A e B). (C) melhoanálise ntitative de grupos de células de monócitos revelam melhorado (p <0,0001) o tamanho dos clusters granuloma cedo depois M. infecção por tuberculose, quando comparado com a ausência de infecção. (D) Quantificação do número de monócitos mostraram um declínio (p <0,01) em tecidos infectados em comparação com tecido não infectado, repetindo mais clusters no tecido infectado. Green - M. -GFP tuberculose, Red - monócitos PKH26 marcados, azul - núcleos celulares, Scale -. 100 mm Por favor clique aqui para ver uma versão maior desta figura.
Discussão
The ability to recruit and form organized cell clusters at the site of infection is the hallmark of human TB 11. These dynamic structures known as tubercle granulomas primarily consist of immune cells (macrophages, monocytes, T-cells and B-cells) and multi-nucleated giant cells surrounding M. tuberculosis. The role of the granuloma has long been considered to wall off the infection, preventing local spread of bacteria. However, more recent studies show that granuloma formation is critical for early bacterial survival, growth and dissemination 12. A strategy of new studies is to identify molecules or pathways that could efficiently be targeted to inhibit the cellular migration in granuloma formation and/or TB dissemination.
A caveat for novel studies on TB is the lack of models that recapitulate human TB. The most widely used experimental animals do not form true granuloma upon M. tuberculosis infection, and are therefore not appropriate choices for studies of TB 13-16. Non-human primates have the closest resemblance to human TB 17, but are not the preferred choice owing to high operational costs and ethical issues. Human TB is a complex immunological process and is difficult to model in vitro. Cell cultures of monolayers or co-cultures lack the 3D environment and tissue responses. Therefore, we have developed an innovative lung tissue model based on human primary immune cells and human lung-specific cell lines 8,9. The model displays characteristic features of human lung tissue, including epithelia with evenly integrated macrophages, formation of extracellular matrix, stratified epithelia and mucus secretion 9.
The 3D human lung tissue model has several benefits over the in vitro single or co-cultures seeded on tissue culture plates or transwell inserts. First, the human lung-specific cells (fibroblasts and epithelial cells) are not commonly included in the in vitro single or co-cultures. Second, the immune cells and lung-specific cells are embedded in a 3D physiological context (collagen rich extra-cellular matrix products). The response of cells to a stimulus/infection and the migratory behaviour of cells, for instance formation of a granuloma, differ significantly between a 2D and 3D environment. Furthermore, the described method enables the 3D visualization and robust 3D quantitative analysis that provides pivotal information on spatial distribution and intricate cellular interactions.
Experimental infection in the model tissue with M. tuberculosis resulted in clustering of macrophages at the site of infection, reminiscent of early TB granuloma (Figure 2 and 3). We have recently demonstrated that mutant strains defective in the ability to secrete the virulence factor ESAT-6 or Mycobacterium bovis BCG that lacks ESAT-6 did not induce the clustering of monocytes (no early granuloma), in contrast to the virulent M. tuberculosis 9. These data are consistent with the observations made from Mycobacterium marinum-infected zebrafish embryos, whose transparency allows for elegant live imaging of granuloma formation 12. As there is no gold-standard model for TB, we took advantage of the surgically resected tissue biopsies from TB patients for validation of the method 9. Our in vitro tissue model shares several characteristics with the lung and lymph node biopsies from TB patients, including the aggregation of macrophages in granuloma, the presence of both intra- and extracellular bacteria 18 and induction of necrosis 11.
Although the described model has physiological relevance to human TB and has several advantages over other in vitro models, it has some limitations. For instance, out of more than 20 collagen proteins identified in humans, only type I is included to the model to mimic the extra-cellular matrix. However, type I collagen is a complex mixture of extra-cellular matrix products and is the most abundant collagen in the human body. Further, we have demonstrated the presence of collagen IV and several extra-cellular matrix proteins such as tropoelastin, vimentin and laminin, which are produced by the epithelial cells and fibroblasts in the tissue model, indicating the synthesis of new collagen 8. Presently, the lung tissue model only has monocytes and macrophages, besides lung-specific cells. It lacks neutrophils and lymphocytes that are also known to be present in the granuloma. Remarkably the model is not limited to the introduction of additional immune cells and is of interest to explore how they contribute to the complex cellular interactions in human TB. Implantation of primary alveolar macrophages, skin-specific cells and lung carcinoma cells has already been tested in the model. Since our objective was to use a model that closely resembles human TB, introduction of mouse cells have not been attempted.
In summary, the lung tissue model has implications for both basic mechanistic and applied studies. Potential applications of the lung model include the study of innate immunity, investigating mechanistic aspects of host defences such as phagosomal maturation, autophagy, production of cytokines, chemokines and anti-microbial peptides, and functional characterization of individual cell types. Strikingly, the in vitro tissue model allows manipulation of one or more cells types and provides a relevant tissue micro-environment, not only for studies on TB, but for a variety of infectious and non-infectious diseases that affect the lungs.
Divulgações
The authors declare no competing financial interests.
Agradecimentos
The authors acknowledge the Microscopy core facility at the Faculty of Health Sciences, Linköping University for providing access to advanced imaging systems; Karl-Eric Magnusson (Emeritus Scientist) at the Dept. of Clinical and Experimental Medicine, Linköping University for providing access to Imaris 3D/4D image processing software (Bitplane, Switzerland); and S. Braian for his help with the lung model cartoon. This work was supported by funds from the Swedish Research Council (Alternatives to animal research, 2012-1951) and Swedish Research Council (2012-3349) to M.L. and Swedish Foundation for Strategic Research to S.B. S.B. receive grants from the Karolinska Institutet, Swedish Research Council, the Swedish International Development Cooperation Agency (Sida) and the Swedish Civil Contingencies Agency (MSB), and the Swedish Heart and Lung Foundation (HLF). M.S. received grants from the Karolinska Institutet and Stockholm County Council.
Materiais
| Name | Company | Catalog Number | Comments |
| Cell culture inserts | BD Falcon | 353092 | |
| 6-well culture plates | BD Falcon | 353046 | |
| MRC-5 cells, lung fibroblasts | ATCC#CCL-171 | ||
| 16HBE cells, lung epithelial cells | Gift from Dr. Dieter Gruenert, Mt. Zion Cancer Center, University of California, San Fransisco, USA | ||
| 5 x Dulbecco’s modified Eagle’s medium (5 x DMEM) | Gibco | 12800-082 | Made from powder but add 5 times less water. Adjust pH to 7.3 and filter it using a 0.2 µm filter. |
| Dulbecco’s modified Eagle’s medium with glucose (DMEM) 1x | Gibco | 41965-039 | |
| Minimum Essential Medium (MEM) 1x with Earle’s salts | Sigma | M4655 | |
| Non-Essential Amino Acids Solution, 100x | Life Technologies | 11140-035 | |
| L-glutamine 200 mM (100x) | Gibco | 25030-024 | |
| Sodium Pyruvate | Life Technologies | 11360-039 | |
| NaHCO3 (71.2 mg/ml) | Prepared in house | ||
| Heat inactivated Fetal Bovine Serum (FBS) | Gibco | 10270-106 | Heat inactivated for 30 min, 56 °C |
| Gentamicin (50 mg/ml) | Gibco | 15750-060 | |
| Hepes buffer solution 1M | Gibco | 15630-056 | |
| Penicillin Streptomycin (Pen Strep) | Gibco | 15140-122 | |
| Lymphoprep | Axis-Shield | 7801 | |
| Ultrapure 0.5 M EDTA | Gibco | 15575 | |
| Bovine Collagen PA treated (500 ml) | Organogenesis | 200-055 | |
| Pure col purified Bovine Collagen solution (100 ml) | Advanced biomatrix | 5005-B | |
| Extracellular matrix protein, Fibronectin (1 mg) | BD | 354008 | |
| Primary human monocytes/macrophages | Isolated from human whole blood or buffy coats. | ||
| PKH26 Red fluorescent cell linker | Sigma | MINI26 | |
| Mycobacterium tuberculosis H37Rv expressing green fluorescent protein | M. tuberculosis H37Rv wild type was transformed with the pFPV2 plasmid constitutively expressing GFP. | ||
| Middlebrook 7H9 medium | Difco | 271310 | |
| BBL Middlebrook ADC Enrichment | BBL | 211887 | |
| Tween-80 | |||
| Glycerol | |||
| Kanamycin B sulfate (20 µg/ml) | Sigma | B5264 | |
| Prolong Gold anti=-fade reagent with DAPI | Invitrogen | P36935 | |
| Trypsin -EDTA | |||
| Bovine serum albumin | |||
| Paraformaldehyde | |||
| DAPI | |||
| LSM700 Confocal microscope | Zeiss | ||
| iMaris Scientific 3D/4D image processing software, version 7.6.8 | Bitplane AG |
Referências
- Sakamoto, K. The pathology of Mycobacterium tuberculosis infection. Veterinary pathology. 49, 423-439 (2012).
- Saunders, B. M., Britton, W. J. Life and death in the granuloma: immunopathology of tuberculosis. Immunol Cell Biol. 85, 103-111 (2007).
- Kaufmann, S. H. New issues in tuberculosis. Ann Rheum Dis. Ann Rheum Dis. 63, ii50-ii56 (2004).
- Morrison, J., Pai, M., Hopewell, P. C. Tuberculosis and latent tuberculosis infection in close contacts of people with pulmonary tuberculosis in low-income and middle-income countries: a systematic review and meta-analysis. Lancet Infect Dis. 8, 359-368 (2008).
- Barry 3rd, C. E., et al. The spectrum of latent tuberculosis: rethinking the biology and intervention strategies. Nat Rev Microbiol. 7, 845-855 (2009).
- Puissegur, M. P., et al. An in vitro dual model of mycobacterial granulomas to investigate the molecular interactions between mycobacteria and human host cells. Cell Microbiol. 6, 423-433 (2004).
- Kapoor, N., et al. Human Granuloma In Vitro Model, for TB Dormancy and Resuscitation. PLoS One. 8, e53657 (2013).
- Nguyen Hoang, ., T, A., et al. Dendritic cell functional properties in a three-dimensional tissue model of human lung mucosa. Am J Physiol Lung Cell Mol Physiol. 302, L226-L237 (2012).
- Parasa, V. R., et al. Modeling Mycobacterium tuberculosis early granuloma formation in experimental human lung tissue. Dis Model Mech. 7, 281-288 (2014).
- Cozens, A. L., et al. CFTR expression and chloride secretion in polarized immortal human bronchial epithelial cells. Am J Respir Cell Mol Biol. 10, 38-47 (1994).
- Brighenti, S., Andersson, J. Local immune responses in human tuberculosis: learning from the site of infection. J Infect Dis. 205, S316-S324 (2012).
- Davis, J. M., Ramakrishnan, L. The role of the granuloma in expansion and dissemination of early tuberculous infection. Cell. 136, 37-49 (2009).
- Gupta, U. D., Katoch, V. M. Animal models of tuberculosis. Tuberculosis (Edinb). 85, 277-293 (2005).
- Kashino, S. S., Napolitano, D. R., Skobe, Z., Campos-Neto, A. Guinea pig model of Mycobacterium tuberculosis latent/dormant infection. Microbes Infect. 10, 1469-1476 (2008).
- Singhal, A., et al. Experimental tuberculosis in the Wistar rat: a model for protective immunity and control of infection. PLoS One. 6, e18632 (2011).
- Subbian, S., et al. Phosphodiesterase-4 inhibition alters gene expression and improves isoniazid-mediated clearance of Mycobacterium tuberculosis in rabbit lungs. PLoS Pathog. 7, e1002262 (2011).
- Lin, P. L., et al. Tumor necrosis factor neutralization results in disseminated disease in acute and latent Mycobacterium tuberculosis infection with normal granuloma structure in a cynomolgus macaque model. Arthritis Rheum. 62, 340-350 (2010).
- Rahman, S., et al. Compartmentalization of immune responses in human tuberculosis: few CD8+ effector T cells but elevated levels of FoxP3+ regulatory t cells in the granulomatous lesions. Am J Pathol. 174, 2211-2224 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados