É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Viabilidade de Bioprinted celulares Construções Usando uma impressora cartesiano Dispenser Três
Neste Artigo
Resumo
A Cartesian bioprinter was designed and fabricated to allow multi-material deposition in precise, reproducible geometries, while also allowing control of environmental factors. Utilizing the three-dimensional bioprinter, complex and viable constructs may be printed and easily reproduced.
Resumo
Tissue engineering has centralized its focus on the construction of replacements for non-functional or damaged tissue. The utilization of three-dimensional bioprinting in tissue engineering has generated new methods for the printing of cells and matrix to fabricate biomimetic tissue constructs. The solid freeform fabrication (SFF) method developed for three-dimensional bioprinting uses an additive manufacturing approach by depositing droplets of cells and hydrogels in a layer-by-layer fashion. Bioprinting fabrication is dependent on the specific placement of biological materials into three-dimensional architectures, and the printed constructs should closely mimic the complex organization of cells and extracellular matrices in native tissue. This paper highlights the use of the Palmetto Printer, a Cartesian bioprinter, as well as the process of producing spatially organized, viable constructs while simultaneously allowing control of environmental factors. This methodology utilizes computer-aided design and computer-aided manufacturing to produce these specific and complex geometries. Finally, this approach allows for the reproducible production of fabricated constructs optimized by controllable printing parameters.
Introdução
A engenharia de tecidos utiliza os princípios da biologia e da engenharia, no desenvolvimento de substitutos funcionais para manter, restaurar ou melhorar tecido nativo e. A capacidade de gerar construtos biomiméticos tridimensionais na demanda facilitaria avanços científicos e tecnológicos na engenharia de tecidos, bem como em sensores baseados em celulares, drogas / triagem toxicidade, modelos de tecido ou tumor, e outros. A organização tridimensional das construções da engenharia de tecidos é um componente fundamental do método de fabrico, porque ele deve imitar de perto a interacção altamente organizado de células e matriz extracelular no tecido nativo.
Andaimes tridimensionais biodegradável e formando-forma são factores críticos para a geração de novas construções de tecido porque as células migram para formar uma camada bidimensional de células, mas não têm a capacidade para crescer em favorecida tridimensional. O andaime serve como base temporária para celularadesão e proliferação, por isso deve ser construído a partir de materiais com porosidade controlada e biodegradabilidade, e integrit mecânica suficiente. Os materiais de andaime não deve ser citotóxico ou criar uma resposta adversa do anfitrião. Os hidrogeles têm sido vulgarmente utilizados nas técnicas de engenharia de tecidos, e devido à sua hidrofilicidade, os hidrogéis de permitir o intercâmbio de fluido e gás em toda a estruturação. Ao combinar diferentes hidrogéis, as propriedades do hidrogel sintetizado são modificáveis para cumprir a exigência de aplicação distinta.
A abordagem de engenharia de tecidos convencional envolve a criação de andaimes de sacrifício porosas acelular que são semeadas com células pós-fabricatio. Têm sido empregues várias técnicas, tais como colagem de fibras, moldagem com solvente, e derreter moldagem, mas provou ser bem sucedida minimamente para aplicações de engenharia de tecidos. Métodos de fibra de ligação permitem que as fibras sejam alinhadas em formatos específicos, mas eles só são capazes de pródução muito fina andaime. Métodos de evaporação de solvente produziu construções altamente porosos, no entanto, a maior membrana produzida foi de apenas 3 mm thic. Por conseguinte, a criação de estruturas tridimensionais não é possível utilizar estas técnicas. Técnicas de moldagem Melt foi bem sucedida na produção de suportes tridimensionais, mas tais temperaturas elevadas que são necessários materiais biológicos não pode ser incorporado durante o proces produção. Andaimes semeado pós-fabricação são limitados em sua capacidade de atender aos requisitos de engenharia de tecidos para produzir scaffolds tridimensionais com microestruturas pré-definidos ou controláveis e. Outro grande problema com tecnologias andaime de semeadura sólidos é a deficiência de vascularização e pobres mecânica.
Bioprinting foi estendida para três dimensões através da utilização de não-tóxicos e biodegradáveis, geles termo-reversíveis de superar as desvantagens do convencional. Alguns do sólido freeform fabricação techniques atualmente sendo empregadas são bioprinting e jato de tinta de impressão laser-assistida. Técnicas bioprinting assistida por laser pulsado utilizar uma fonte de laser, uma placa de destino, e um substrato de recepção para gerar tridimensional. No entanto, esta técnica é limitada devido à baixa taxa de transferência, a viabilidade celular baixa, e só pode produzir arranjos limitadas de estruturas fabricadas, porque apenas pré-polímeros foto-reticulável pode ser utilizado para formar um hidrogel reticulado. Impressão de jacto de tinta foi desenvolvido como um método não-contacto, que reproduz os dados de imagem digitais sobre um substrato por deposição de tinta picolitros. No entanto, a impressão a jacto de tinta não produzir uma construção de alta resolução, constrói experiência rápida desnaturação da proteína, e muitas das células são lisadas durante a deposição.
Atualmente, têm sido desenvolvidos novos métodos de fabricação aditiva bioprinting. Nestes sistemas de células, proteínas, factores de crescimento, e os hidrogéis são tipicamente integrados biomiméticos para mater matrizIALS durante o processo de fabricação e simultaneamente depositados utilizando atuadores controlados por computador para gerar estruturas celulares carregados tridimensionais à base de andaime que imitam de perto a microarquitetura de natal. Os hidrogéis de células carregados de constituir o bioink, que pode ser heterogéneo, que consiste em vários tipos de células, ou homogénea. Aditivo sistemas de manufatura depósito bioink gota-a-gota ou camada por camada através de seringas descartáveis e dicas para um palco controlado por computador capaz de se mover nas direções x, ye z. Através de um software de computador, a arquitectura de andaimes impressos pode ser facilmente manipulado, dependendo dos requisitos da aplicação. Ao contrário das técnicas convencionais, tecnologias médicas tridimensionais (ressonância magnética, tomografia computadorizada) podem ser incorporados aos desenhos, gerando construção específica para cada paciente. Estes métodos permitem também a possibilidade de produzir substituições vascularizados porque construções são produzidos com um elevado ldensidade celular ocal, permitindo interacções célula-célula e melhorar a probabilidade de pós-implantação surviva.
A impressora Palmetto é um sistema multi-dispenser tridimensional personalizado construído que usa métodos de fabricação programáveis robóticos para gerar construções de tecido heterogêneos tridimensionais (Figura 1). Ele permite a utilização de uma pluralidade de materiais em combinações únicas para produzir estruturas heterogéneas. A inicialização do bioprinter é um dos passos mais importantes na bioprinting porque permite que você para definir uma variedade de parâmetros para otimizar a capacidade de impressão das construções bioprinted.
O bioprinter compreende um processo tipo de lote com sequências de arranque, operação e encerramento controlado por um controlador lógico programável (PLC), que o usuário opera por meio de um painel de controle de tela interativa sensível ao toque (Figura 1, A). Para evitar a contaminação dos biomateriais lógicos a bioprinter é encerrado em um poli-pressionados positivamente (metacrilato de metilo) (PMMA) com uma câmara de partículas arrestance de elevada eficiência (HEPA) filtrado por sistema de circulação de ar (Figura 1, B, C). O interior da impressora pode ser esterilizada utilizando as fontes de luz ultravioleta embutidos (Figura 1, D). O componente central do bioprinter é um posicionamento robô programável que pode totalmente reprodutível colocar uma ponta conta-gotas com uma precisão de 10 micrometros (Figura 1, E). Existem três distribuidores, os quais são capazes de depositar volumes tão pequenos como 230 nl, utilizando um parafuso rotativo (Figura 1, F). Eles são independentemente programável usando computadores diferentes que regem os parâmetros de impressão para cada distribuidor (figura 1, G). Rotativa de parafuso de distribuição utiliza a rotação de um parafuso motorizado para mover para baixo bioink uma seringa e para fora da ponta da seringa. Estes distribuidores são montados em um pneumáticoNest Ferramenta LY controlada (Figura 2A, B), permitindo que o robô para alternar distribuidor montada sobre o braço robótico do eixo Z sob controlo programado (Figura 1, H).
O robô XYZ recebe instruções de impressão a partir de um computador que executa o software de desenho (Figura 1, I). Cada programa contém os locais de distribuição, rotinas e protocolos de calibração, dispensador de mudança. O desenho das construções gerados essencialmente consiste na coordenadas XYZ, onde cada dispensador vai depositar material. O bioprinter compreende dois sensores de luz ópticos (Figura 2C) que determinam a coordenadas XYZ da extremidade da ponta da seringa. Estes sensores enviam informações para coordenar o robô, que os utiliza para calcular as posições das extremidades ponta distribuidor. Há um laser de deslocamento adicional (Figura 2D) que projeta um diodo 633 nm feixe de laser vermelho de tamanho de ponto 30 x 100 micrômetros para medir a distância com um accuracy de 0,1 micrómetros. Quando o feixe está altamente focada o robô determina a distância Z da superfície de impressão. Esta medida, ea medida sensores de luz óptica da extremidade da ponta em Z, permite o cálculo de Z coordenadas precisas usada para colocar a ponta do aplicador em relação à superfície de impressão. As pontas do distribuidor mover-se lateralmente e verticalmente através do sensor de luz óptica X-eixo orientado para localizar os centros de Y e Z, e lateralmente por meio de um sensor do eixo Y para encontrar o centro do eixo-X. A superfície de impressão é mapeado utilizando a fórmula para uma superfície plana no espaço XYZ: ax + by + cz = d para determinar onde a superfície é em relação à posição da extremidade da ponta de distribuição. A fase de impressão (Figura 1, J) contém uma amostra de uma placa de Petri até 80 mm de diâmetro e utiliza um banho de água com recirculação para manter a temperatura definida (Figura 1, K). Temperatura estágio pode ser ajustado dentro de uma gama de -20 e permanece estável dentro. Há uma câmera USB montadopara o Z-braço robô para proporcionar uma vista ampliada da ponta de aplicação durante o processo de impressão (figura 1, G). Há uma segunda câmara montada na direcção do topo do interior da câmara, que fornece uma visão completa do bioprinter durante o processo de impressão (figura 1, G).
Um software de desenho auxiliado por computador determina o padrão de deposição e permite ao usuário gerar gotículas espaçadas de forma incremental e estruturas complexas (Figura 3). Vias tridimensionais pode ser codificado manualmente no software de desenho de impressora compatível ou importados de um software separado auxiliado por computador desenho (Figura 4, Tabela 1). O software da impressora compatível permite variações de parâmetros de impressão, tais como o método de deposição (deposição ou deposição de gotícula única passagem contínua), a geometria tridimensional das vias, a taxa de deposição, distância entre a extremidade da ponta da seringa e substtaxa de superfície de impressão, a quantidade de tempo para depositar uma gota indivíduo, e a altura e acelerar a seringa é levantada entre a deposição das gotas. Cada programa contém XYZ locais de distribuição, rotinas de calibração ponta e protocolos de dispensador de mudança para proporcionar um ambiente estéril, sem intervenção do operador, durante a impressão. O controlador lógico programável (PLC) do robô recebe instruções do computador que executa o software de desenho e controla o tempo dos eventos dos controladores externos (por exemplo, os distribuidores). Para fazer isso, o PLC utiliza um mecanismo de loop para controlar os dispensadores , dispositivo de posicionamento robótico, e fatores ambientais.
Tridimensional bioprinting e gravação directa utilizando um parafuso rotativo, sistema de distribuição de líquido permite que o processo de depósito de células para ser mais eficiente, precisa e mais fácil do que métodos anteriores. Este estudo mostra a bioprinter personalizado construído é capaz de gerar ceconstruções de hidrogel ll-carregado com alta viabilidade celular.
Protocolo
1. Preparação de gelatina substrato contendo for Three-Dimensional bioprinting de hidrogéis de alginato
- Prepara-se o substrato de cálcio / gelatina seguindo o método do substrato de cálcio / gelatina descrita por Pataky et al 11 para evitar a viabilidade reduzida associada com alto teor. O método de substrato de cálcio / gelatina é listado abaixo.
- Combinar cloreto de cálcio di-hidratado (1,5% em peso), de cloreto de sódio (0,9% em peso), e gelatina porcina (2% em peso) em água destilada e ferver durante 2 minutos para criar uma solução de gelatina a 100 mM.
- Pour 5 ml da solução de gelatina / cálcio em 100 mm placas de petri padrão, agite a solução volta para ter um revestimento uniforme sobre a superfície, e o lugar sobre uma superfície plana no frigorífico de gel de O / N (permitir a gel, pelo menos, 8 hr antes de usar).
- Para aumentar a opacidade da superfície do substrato, adicionar dióxido de titânio (0,3% em peso) para o / CaCl2 solução de gelatina. Agita-se durante 10 min. Autoclave a solução de gelatina / TiO 2 no ciclo de líquidos durante 30 min para esterilizá-lo.
- Adicionar 3 ml de o / TiO2 solução de gelatina para a superfície das placas de gelatina preparados anteriormente. Agite a mistura para garantir que ele é espalhado uniformemente por toda a superfície. Deixa-se em gel a 4 ° C frigorífico S / N (permitir a gel, pelo menos, 8 horas antes da utilização). Os substratos deve ser utilizado no prazo de 3 dias.
2. O alginato Oxidação
- Oxidar o bioink alginato de sódio seguindo o método de alginato parcialmente oxidado por Bouhadir et al 30 descrito abaixo.
- Para fazer uma solução de alginato oxidado 5%, dissolve-se 1 g de alginato de sódio em 100 ml de água destilada. Adicionar uma solução aquosa de periodato de sódio (0,25 M, 0,25 mmol), o agente de oxidação, para produzir uma solução 5% de oxidação. Agita-se durante 19 horas à temperatura ambiente. Adicionar 40 ml de etileno-glicol à solução depois de 24 horas para acabar o Reaction.
- Dissolve-se 2,5 g de cloreto de sódio na solução. Adicionar uma quantidade em excesso de álcool etílico (2: 1) para precipitar os alginatos oxidados. Centrifugar a solução a 1.000 x g para recolher os precipitados e re-dissolve-los em água destilada. Repita a lavagem de etanol.
- Liofilizar as pelotas de alginato oxidados e armazenar a -20 ° C até estar pronto para utilização.
- Determinar o grau de oxidação através da medição da percentagem de periodato de sódio, antes de ser consumido terminada pela etileno glicol.
- Prepara-se uma solução de iodeto de potássio (20% w / v, tampão de fosfato pH 7,0 de sódio) e uma solução thyodene (10% w / v, tampão de fosfato de sódio pH 7,0). Misturar as duas soluções com o alginato oxidado à TA.
- Cair gradualmente a solução de periodato de alginato de sódio e reagiu na mistura de soluções de iodeto de potássio e theodyne. Medir a absorvância da mistura a 426 nm espectrofotometricamente. Quando se atingiu ummáxima, registrar o volume utilizado de solução de periodato de alginato de sódio e como V 1.
- A reacção é
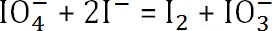 . A quantidade de periodato de sódio que não reagiu é
. A quantidade de periodato de sódio que não reagiu é 
- Subtrair a quantidade de periodato de sódio que não reagiu a partir da concentração inicial para determinar a quantidade de periodato de sódio consumido. Usando a fórmula anterior, determinar o grau de oxidação final do alginato.
3. O alginato Peptide Conjugação
- Ligandos conjugados com uma sequência de arginina-glicina-aspartato exposta (péptido) para dentro do alginato oxidado previamente preparado seguindo o método de conjugação de RGD por Alginato Rowley et al 31 descrito abaixo para promover a adesão e espalhamento.
- Use carbod aquosaquímica iimide com G 4 RGDSPto conjugado 31.
- Dissolve-se 1 g de 5% de alginato oxidado em um 0,1 M de 2- (N-morfolino) etanossulfónico (MES), pH = 4. Adicionar 1-etil- (dimetilaminopropil) carbodiimida (EDC, 0,54 mmol) e N-hidroxissuccinimida ( NHS, 0,27 mmol) a 2: 1 para formar a amida intermediária.
- Adicionar 0,28 mmol de péptido, para acoplamento a espinha dorsal do polímero através de alginato a amina terminal. Agita-se à temperatura ambiente O / N.
- Parar a reacção de acoplamento por adição de cloreto de sódio a 2,5 g para a solução. Adicionar uma quantidade em excesso de álcool etílico (2: 1) para precipitar os alginatos oxidados. Centrifugar a mistura a 4000 xg durante 5 min para recolher os precipitados. Aspirar a mídia na capa de cultura de células e re-dissolver os precipitados em água destilada. Repita a lavagem de etanol.
- Liofilizar os precipitados até que se torne completamente secas (aparecerá como uma substância em pó branca) e armazenar na temperatura de -20 ° C frigorífico para mais tardeusar.
4. adiposo humano estromais Tissue células de cultura celular (de hADSC)
- Culturas adiposo humano de células estromais de tecido (de hADSC) em 75 cm tratados frascos de cultura de células (frascos T75), coberto com 15 ml de baixo DMEM de glucose com 10% de soro fetal bovino e 1% de penicilina-estreptomicina, 1% de glutamina, e 1% antimicina. Alterar a mídia, na capa de cultura de células, a cada dois dias até que tenham atingido a confluência (80-90%).
- Uma vez confluentes, as transferir para frascos T75 a capa de cultura de células e suspender o hADSC utilizando o método de digestão com enzimas de tripsina.
- Na capa, aspirar todo o meio de cultura de células fora das células. Lavar com 5 ml de fosfato de Dulbecco com Solução Salina Tamponada com cálcio e magnésio (DPBS ++). Aspirar o DPBS ++ fora das células.
- Enquanto no capô, fazer uma solução de tripsina e DPBS ++ pela mistura de 1 ml de tripsina e 4 ml DPBS ++. Cada frasco de 5 ml de requer a solutde iões, assim que o volume apropriado para o número de frascos confluentes. Adicionar 5 ml de tripsina / ++ DPBS a cada frasco e colocá-los na incubadora durante 2 min.
- Após 2 min, retire os frascos e bata levemente os lados deles para soltar as células a partir do fundo. Veja cada frasco sob um microscópio para garantir que as células são suspensas. Colocar os frascos de volta no capuz de cultura de células e adicionar 3 ml de meio de cultura celular adequado a cada frasco. Isto termina a reacção de tripsina.
- Transfira a mídia celular carregado de cada frasco e colocar em um cônico de 50 ml. Centrifugar a 1.000 xg los durante 5 min. As células devem aparecer como um pequeno sedimento branco no fundo do cone. Transferência de volta para a capa de cultura de células e aspirar a mídia. Ressuspender as células em 2 ml de meio de cultura celular.
- Contar as células utilizando um hemocitómetro sob o microscópio. Uma vez que as células foram contadas, na capa de cultura, a quantidade aliquota de meio contendo ~ 1,3 million células e transferência para um cônico de 15 ml. Centrifugar a cónico de 15 ml contendo as células mais uma vez durante 5 min a 1000 x g.
- Na capa de cultura, propagar novamente as células restantes em vários frascos T-75, a adição de uma concentração de ~ 350.000 células de cada frasco. Adicionar 15 ml de meio DMEM e retornar à incubadora até confluente novamente.
- Uma vez que o ciclo de centrifugação é completa, o regresso cónico de 15 ml para a cultura de células. Aspirar a mídia do pellet celular e resuspender as células em solução aquosa de alginato a uma concentração de 1,3 milhões de células por mililitro de bioink, terteriating a solução muitas vezes para que haja uma distribuição homogênea de células de todo o bioink. Coloque a solução de células-laden em um estéril seringa de 3 ml e impressora compatível com o parafuso na estéril 22 G ponta de plástico.
5. Configuração bioprinter
- Ligue o bioprinter, cada um dos computadores de dispensador, e o recirculating banho de água.
- Definir manualmente a temperatura do banho de recirculação de água para para o mecanismo de gelificação.
- Manualmente definir parâmetros de impressão para cada distribuidor no computador correlacionando distribuidor. Definir o volume de distribuição a 230 nl, número de backsteps a 0, e a taxa de distribuição de 10 ul -sec.
- Abra o software de projeto e do programa para a visualização de visor da câmera USB no computador.
- Usando o software, insira manualmente as coordenadas para uma matriz de 5 x 5 dot com 2,4 mm de espaçamento entre as quedas.
- Defina os parâmetros de impressão a ser: distância entre a extremidade da ponta e da superfície do substrato = 0,1 mm; altura seringa é levantada entre as deposições = 20 mm; a quantidade de tempo por deposição = 1 seg.
- Salve o programa e enviá-lo para o robô.
- Colocar a cápsula de gelatina / TiO2 molecular contendo Petri na etapa 4 ° C impressora. Feche e tranque a porta da câmara.
- Use o PLC para initialize as fontes de luz ultravioleta, e esterilizar a câmara durante 90 seg.
- Uma vez que a esterilização é completa, abrir a câmara e carregar a seringa contendo de hADSC suspenso em alginato em Gun 1. Feche e tranque a porta da câmara.
- Use o PLC para ligar o sistema de ventilação, espere 30 segundos para a pressão interna equilíbrio.
- No computador, execute o programa que contém os parâmetros de impressão via e geométricas.
- Durante todo o processo de impressão, visualizar o visor da câmera USB no computador para confirmar a impressão precisa e uniforme.
- Uma vez que a impressão terminar, deixe as construções de gel durante 40 min.
Avaliação de Viabilidade 6. celular
- Cubra as construções que não estão indo a ser trabalhada imediatamente pós-impressão em DMEM e guarde na incubadora até à hora de imagem.
- Para quantificar a viabilidade das construções, mancha-los utilizando um ensaio de viabilidade / citotoxicidade fluorescente à base, umaimagem nd usando microscopia confocal.
- Seguindo as instruções do kit, preparar uma solução de coloração contendo calceina AM e homodimero de etidio-1. Para fazer 10 ml de solução de coloração, adicionar 20 ul da etídio homodímero-1 e 5 ul de calceína am a 10 ml de solução estéril, tamponada com fosfato salino de cultura de tecidos de grau de Dulbecco (+ magnésio, + cálcio; DPBS ++).
- Mergulhar os construtos bioprinted na solução de coloração, durante 15 minutos no escuro.
- Imagem as construções coradas utilizando um sistema de microscópio confocal nos dias 0 e 8. Tire várias fotos de cada construção bioprinted, usando parâmetros Z-stack de 30 fatias ópticos sobre uma profundidade de 300 mm, e contar manualmente as células. Se as células aparecem amarelo ou contá-los como verde vivo, e se vermelho, contá-los como mortos.
- Calcula-se a percentagem de viabilidade celular, como o número de células vivas a dividir pelo número total de células na construção; Viabilidade celular = número decélulas vivas (verde + amarelo) / número de células totais (verde + amarelo + vermelho) x 100%.
- Calcula-se a quantidade de proliferação de células para cada amostra como o número de células do dia 8, dividido pelo número de células no dia 0; Proliferação celular = contagem de células vivas no dia 8 / células vivas contar no dia 0 x 100%.
7. RGD Peptide Análise Conjugação
- Para analisar o sucesso de RGD peptídeo conjugação com o alginato, compare alginato RGD-conjugado e alginato não conjugado. Para fazer isso, as construções de imagem impressos utilizando (4 ', 6-diamidino-2-fenilindole, dicloridrato) (DAPI) e faloidina manchas.
- Adicione os phalloidins solução de trabalho por diluição de 5 ul da solução-mãe metanólica com 200 mL de DPBS ++. Armazenar a -20 ° C até o uso.
- Adicione uma solução de 300 uM de estoque a mancha DAPI seguinte equação: (0,10509 g / L) / (350,3 g / mol) = 3 × 10 -4 M = 0,0003 M = 0,300 mm = 300 uM. Faça the DAPI solução de trabalho por diluição da solução-mãe de 1: 100 em DPBS ++ para se obter 3 uM solução. Armazenar a -20 ° C até o uso.
- Completamente imersa a amostra em paraformaldeído a 4%. Incubar durante 1 h à TA. Lavar três vezes com DPBS ++, permitindo que a solução em repouso durante 5 min cada lavagem. Transfira a amostra em gel a partir do bem para uma lâmina de vidro, que lança sobre o gel no processo. Mergulha-se o gel em 0,1% de Triton X-100 (0,1 g / 100 ml) em DPBS ++ durante 10 min. Lavar três vezes com DPBS ++, permitindo 5 minutos para cada lavagem.
- Corar as construções impressas com faloidina por imersão na solução de trabalho. Cubra com papel alumínio e incubar durante 4 horas. Remover a mancha faloidina e lavar três vezes com DPBS ++. A primeira lavagem deve ser rápido, o último lavagens deve sentar-se durante 5 minutos cada.
- Corar as construções impressas com DAPI por imersão na solução de trabalho DAPI. Cubra com folha e incubar à TA durante 30 min. lavagemtrês vezes com DPBS ++, permitindo que cada lavagem para se sentar por 5 min. Observe e imagem das amostras em um sistema de microscópio confocal.
Resultados
Os resultados demonstram a bioprinter é capaz de depositar hidrogéis de células carregadas em localizações tridimensionais específicas com precisão e de forma consistente utilizando software auxiliado por computador. Estes softwares determinar a colocação de cada gotícula e controlar muitos dos parâmetros para a distribuição (Figura 3,4). A repetibilidade do bioprinter para depositar apropriadamente biomateriais é fundamental para o seu sucesso em aplicações de engenharia de tecidos.
Discussão
O foco principal da engenharia de tecidos é fazer a ponte entre a escassez de órgãos e necessidades de transplante através do desenvolvimento de substitutos biológicos capazes de restaurar, manter ou melhorar a functio tecido nativo. Isto levou à fabricação directa de andaimes com um complexo, geometria externa anatomicamente correcto, e o controlo preciso sobre a geometr interna. Bioprinting tridimensional é um método utilizado para gerar as construções tridimensionais de vários tamanhos e formas a partir ...
Divulgações
The authors have nothing to disclose.
Agradecimentos
Este trabalho foi apoiado pelo Suporte Governo sob Grant No. EPS-0903795 concedidas pela Fundação Nacional de Ciência, NIH NIDCR R01-DE019355 (MJY PI), e Grant 8P20 GM103444 (YM PI).
Materiais
| Name | Company | Catalog Number | Comments |
| Positioning Robot (JR2000 XYZ) | Janome | ||
| Dispensers: SDAV Linear Drive SmartDispensers | Fishman Corporation | ||
| Optical Light Sensors: | Keyensce | ||
| Displacement Laser: OD Mini | SICK | ||
| Recirculating Water Bath: Polystat | Cole-Parmer | EW-12122-02 | |
| USB Cameras: Dino-Lite Premier 5MP | AnMo Electrionics/YSC Technologies | AD7013MT | |
| Printer-Compatible Computer Design Software: JR-C Points | Janome | Comes with purchase of Janome Robot | |
| Computer-Aided Design Drawing Software: Visual PathBuilder | RatioServ | Can be downloaded at: www.ratioserv.com/index.php/downloads | |
| Printer 3 cc Syringes: | Fishman Corporation | 122051 | |
| 22 G Dispenser Tips | Fishman Corporation | Z520122 | |
| Calcium Chloride Dihydrate | Sigma-Aldrich | 10035-04-8 | |
| Sodium Chloride | Sigma-Aldrich | 7647-14-5 | |
| Porcine Gelatin | Sigma-Aldrich | 9000-70-8 | |
| Titanium Dioxide | Sigma-Aldrich | 13462-67-7 | |
| Protanal LF 20/40 Alginate (Sodium Alginate) | FMC BioPolymer | 9005-38-3 | |
| Hydrochloric Acid | Sigma-Aldrich | 7647-01-0 | |
| Ethylene Glycol | Mallinckrodt Baker, Inc | 9300-01 | |
| Sodium Periodate | Sigma-Aldrich | 7790-28-5 | |
| hADSC | Lonza | PT-5006 | Store in vials in liquid nitrogen until use. |
| Dulbecco's Modified Eagle's Medium | Gibco Life Technologies | 11965-092 | Warm in 37 °C water before use. |
| Trypsin/EDTA | Lonza | CC-5012 | Warm in 37 °C water before use. |
| Calcein AM | Gibco Life Technologies | C3100MP | Store in the dark at -80 °C until use. |
| Live/Dead Mammalian Viability Assay Kit | Invitrogen Life Technologies | L-3224 | Store in the dark at -80 °C until use. |
| MES Hydrate | Sigma-Aldrich | M2933 | |
| N-Hydroxysuccinimide | Sigma-Aldrich | 130672 | |
| 1-ethyl-(dimethylaminopropyl) carbodiimide (EDC) | Sigma-Aldrich | E1769 | 10 G |
| Dulbecco's Phosphate-Buffered Saline, +Calcium, +Magnesium | Life Technologies | 14040133 | Warm in 37 °C water before use. |
| Dulbecco's Phosphate-Buffered Saline, -Calcium, -Magnesium | Life Technologies | 14190144 | Warm in 37 °C water before use. |
| RGD Peptides | International Peptides | ||
| Alexa Fluor 546 Phalloidin Stain | Invitrogen Life Technologies | A22283 | Store at -20 °C until use |
| (4’, 6-Diamidino-2-Phenylindole, Dihydrochloride) (DAPI) Stain | Life Technologies | R37606 | Store at -20 °C until use |
Referências
- Langer, R., Vacanti, J. P. . Tissue Engineering. Science. 260 (5110), 920-926 (1993).
- Derby, B. Review: Printing and Prototyping of Tissues and Scaffolds. Science. 338 (6109), 921-926 (2012).
- Kachurin, A. M., et al. Direct-Write Construction of Tissue-Engineered Scaffolds. Mat. Res. Soc. Symp. Proc. 698, 10-1557 (2002).
- Sachlos, E., Czernuszka, J. T. Making Tissue Engineering Scaffolds Work. Review on the Application of Solid Freeform Fabrication Technology to the Production of Tissue Engineering Scaffolds. European Cells and Materials. 5, 29-40 (2003).
- Yeong, W. Y., Chua, C. K., Leong, K. F. Rapid Prototyping in Tissue Engineering. Challenges and Potential. Trends Biotechnol. 22 (12), 643-652 (2004).
- Landers, R., Pfister, A., Hubner, U., John, H., Schmelzeisen, R., Mulhaupt, R. Fabrication of Soft Tissue Engineering Scaffolds by means of Rapid Prototyping Techniques. Journal of Materials Science. 37 (15), 3107-3116 (2002).
- Murphy, S. V., Skardal, A., Atala, A. Evaluation of Hydrogels for Bio–Printing Applications. Journal of Biomedical Materials Research Part A. 101A (1), 272-284 (2013).
- Burg, K. J. L., Boland, T. Minimally Invasive Tissue Engineering Composites and Cell Printing. IEEE Eng Med Biol Mag. 22 (5), 84-91 (2003).
- Billiet, T., Vandenhaute, M., Schelfhout, J., Van Vlierberghe, S., Dubruel, P. A Review of Trends and Limitations in Hydrogel-Rapid Prototyping for Tissue Engineering. Biomaterials. 33 (26), 6020-6041 (2012).
- Khalil, S., Nam, J., Sun, W. Multi–Nozzle Deposition for Construction of 3D. Biopolymer Tissue Scaffolds. Rapid Prototyping Journal. 11 (1), 9-17 (2005).
- Pataky, K., Braschler, T., Negro, A., Renaud, P., Lutolf, M. P., Brugger, J. Microdrop Printing of Hydrogel Bioinks into Three–Dimensional Tissue–Like Geometries. Adv Mater. 24 (3), 391-396 (2011).
- Pati, F., Shim, J. H., Lee, J. S., Cho, D. W. Three-Dimensional Printing of Cell–Laden Constructs for Heterogeneous Tissue Regeneration. Manufacturing Letters. 1 (1), 49-53 (2013).
- Gruene, M., et al. Laser Printing of Three–Dimensional Multicellular Arrays for Studies of Cell–Cell and Cell–Environment Interactions. Tissue Eng. 17 (10), 973-982 (2011).
- Khalil, S., Sun, W. Bioprinting Endothelial Cells With Alginate for 3D Tissue Constructs. J Biomed Eng. 131 (11), 1-8 (2009).
- Xu, T., et al. Hybrid Printing of Mechanically and Biologically Improved Constructs for Cartilage Tissue Engineering Applications. Biofabrication. 5 (1), 1-10 (2012).
- Zhang, T., Yan, K. C., Ouyang, L., Sun, W. Mechanical Characterization of Bioprinted in vitro Soft Tissue Models. Biofabrication. 5 (4), 1-10 (2013).
- Chung, J. H. Y., et al. Bio–ink Properties and Printability for Extrusion Printing Living Cells. J. Biomater. Sci., Polym. Ed. 1 (7), 763-773 (2013).
- Yang, S., Leong, K. F., Du, Z., Chua, C. K. The Design of Scaffolds for Use in Tissue Engineering. Part II. Rapid Prototyping Techniques. Tissue Engineering. 8 (1), 1-11 (2002).
- Ferris, C. J., Gilmore, K. G., Wallace, G. G., Panhuis, M. Biofabrication: An Overview of the Approaches Used for Printing of Living Cells. Appl. Microbiol. Biotechnol. 97 (10), 4243-4258 (2013).
- Lu, L., Mikos, A. G. The Importance of New Processing Techniques in Tissue Engineering. MRS Bull. 21 (11), 28-32 (1996).
- Wake, M. C., Gupta, P. K., Mikos, A. G. Fabrication of pliable biodegradable polymer foams to engineer soft tissues. Cell Transplant. 5, 465-473 (1996).
- Mironov, V., Visconti, R. P., Kasyanov, V., Forgacs, G., Drake, C. J. Organ Printing: Tissue Spheroids as Building Blocks. Biomaterials. 30 (12), 2164-2174 (2009).
- Norotte, C., Marga, F. S., Niklason, L. E. Scaffold–free Vascular Tissue Engineering Using Bioprinting. Biomaterials. 30 (30), 5910-5917 (2009).
- Devillard, R., et al. Cell Patterning by Laser–Assisted Bioprinting. Methods Cell Biol. 119, 159-174 (2014).
- Binder, K. W., Allen, A. J., Yoo, J. J. Drop–on–Demand Inkjet Bioprinting: a Primer. Gene Ther Reg. 6 (1), 33 (2011).
- Xu, T., et al. Viability and Electrophysiology of Neural Cell Structures Generated by the Inkjet Printing Method. Biomaterials. 27 (19), 3580-3588 (2006).
- Calvert, P. Inkjet Printing for Materials and Devices. Chem Mater. 13 (10), 3299-3305 (2001).
- Chang, C. C., Boland, E. D., Williams, S. K. Direct–Write Bioprinting Three–Dimensional Biohybrid Systems for Future Regenerative Therapies. J Biomed Mater Res B Appl Biomater. 98 (1), 160-170 (2011).
- Li, M. G., Tian, X. Y. A Brief Review of Dispensing–Based Rapid Prototyping Techniques in Tissue Scaffold Fabrication: Role of Modeling on Scaffold Properties Prediction. Biofabrication. 1 (3), 1-10 (2009).
- Bouhadir, K. H., Lee, K. Y., Alsberg, E., Damm, K. L., Anderson, K. W., Mooney, D. J. Degradation of Partially Oxidized Alginate and its Potential Application for Tissue Engineering. Biotechnol Prog. 17 (5), 945-950 (2001).
- Rowley, J. A., Madlambaya, G. Alginate Hydrogels as Synthetic Extracellular Matrix Materials. Biomaterials. 20 (1), 45-53 (1999).
- Smith, C. M., Christian, J. J., Warren, W. L. Characterizing Environmental Factors that Impact Viability of Tissue–Engineered Constructs Fabricated by a Direct–Write Bioassembly Tool. Tissue Engineering. 13 (2), 373-383 (2007).
- Ozbolat, I., Yu, Y. Bioprinting Towards Organ Fabrication: Challenges and Future Trends. IEEE Trans Biomed Eng. 60 (3), 691-699 (2012).
- Peltola, S. M., Melchels, F. P., Grijpma, D. W., Kellomaki, M. A. A Review of Rapid Prototyping Techniques for Tissue Engineering Purposes. Annals of Medicine. 40 (4), 268-280 (2008).
- Malda, J., et al. 25th Anniversary Article: Engineering Hydrogels for Biofabrication. Adv Mat. 25 (36), 5011-5028 (2013).
- Murphy, S. V., Atala, A. 3D Bioprinting of Tissues and Organs. Nat Biotech. 32 (8), 773-785 (2014).
- Jia, J., et al. Engineering Alginate as Bioink for Bioprinting. Acta Biomaterialia. 10 (10), 4323-4331 (2014).
- Forty, R. A., Steinberg, M. S. The Differential Adhesion Hypothesis: a Direct Evaluation. Developmental Biology. 278 (1), 255-263 (2005).
- Wang, L., Shansky, J., Borselli, C., Mooney, D., Vandenburgh, H. Design and Fabrication of a Biodegradable, Covalently Crosslinked Shape–Memory Alginate Scaffold for Cell and Growth Factor Delivery. Tis Eng Part A. 18 (19-20), 2000-2007 (2012).
- El–Sherbiny, I. M., Yacoub, M. H. Hydrogel Scaffolds for Tissue Engineering: Progress and Challenges. Global Cardiology Science, & Practice. 3 (38), 316-342 (2013).
- Smith, C. M., et al. Three–Dimensional BioAssembly Tool for Generating Viable Tissue-Engineered Constructs. Tissue Engineering. 10 (9–10), 1566-1576 (2004).
- Ozbolat, I. T., Chen, H. Development of a ‘Multi-arm Bioprinter’ for Hybrid Fabrication of Tissue Engineering Constructs. Robotics and Computer–Integrated Manufacturing. 30 (3), 295-304 (2014).
- Kolesky, D. B., Truby, R. L., Gladman, A. S., Busbee, T. A., Homan, K. A. Three-Dimensional Bioprinting of Vascularized, Heterogeneous Cell–Laden Tissue Constructs. Adv Mater. X. Adv Mater. X, x-y (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados