Method Article
Biorreactores de fibras ocas para
Neste Artigo
Resumo
O comportamento funcional de células em cultura pode ser melhorada por cultura em mais in vivo -like ambientes de cultura 3-dimensionais 16-21. Este manuscrito descreve o set-up e operação de um sistema de fibra biorreator oco para in vivo -como mamíferos cultura de tecidos.
Resumo
Tissue culture has been used for over 100 years to study cells and responses ex vivo. The convention of this technique is the growth of anchorage dependent cells on the 2-dimensional surface of tissue culture plastic. More recently, there is a growing body of data demonstrating more in vivo-like behaviors of cells grown in 3-dimensional culture systems. This manuscript describes in detail the set-up and operation of a hollow fiber bioreactor system for the in vivo-like culture of mammalian cells. The hollow fiber bioreactor system delivers media to the cells in a manner akin to the delivery of blood through the capillary networks in vivo. The system is designed to fit onto the shelf of a standard CO2 incubator and is simple enough to be set-up by any competent cell biologist with a good understanding of aseptic technique. The systems utility is demonstrated by culturing the hepatocarcinoma cell line HepG2/C3A for 7 days. Further to this and in line with other published reports on the functionality of cells grown in 3-dimensional culture systems the cells are shown to possess increased albumin production (an important hepatic function) when compared to standard 2-dimensional tissue culture.
Introdução
A cultura de tecidos é uma técnica estabelecida para o crescimento e / ou manutenção de células que tenha sido utilizado há mais de 100 anos 1,2. A conveniência de células que estudam e as respostas ex vivo tem alcance tanto vantagens que permitem experiências que de outra forma seria extremamente difícil, se não impossível, por exemplo, a geração de linhas celulares geneticamente modificadas ea utilização de células repórter em alto throughput screening ensaios 3. Mais recentemente cultura de tecidos deu origem ao campo da engenharia de tecidos, para a geração de modelos in vitro e em medicina regenerativa. Com estas aplicações, o interesse em sistemas de cultura dinâmicas em 3 dimensões (3D) tem crescido significativamente.
Os métodos de cultura em 3D (definido aqui como um substrato de cultura 3D e / ou a introdução de fluxo dinâmico direccional) melhor recapitular a arquitectura do ambiente celular in vivo, importante para atingir umamais uma função fisiológica semelhante. A capacidade de extrair, crescer, se diferenciar e células de transplante com o objectivo de reparar o tecido doente e danificada é um campo de estudo que tem um enorme potencial para o benefício do paciente e oportunidade comercial. Por exemplo, a utilização de queratinócitos autólogos para o tratamento de queimaduras (ver 4) e o uso de terapias à base de células para o tratamento de acidente vascular cerebral (ver 5). Da mesma forma, o mercado para os modelos in vitro abrange a descoberta de drogas para aplicações de medicina estratificada. A convenção em cultura de tecidos é o crescimento de tipos de células dependentes aderentes ou ancoradouro na 2-dimensional (2D) superfície de um balão de cultura de tecidos. Embora atualmente aceito como padrão-ouro em um ambiente de pesquisa, interesse recente em aplicações de engenharia de tecidos tem destacado o fato de que o actual ambiente de cultura de tecidos 2D é inadequado para o aumento de escala necessária na produção de células 6.
Para os tipos de células aderentes uma scaffold é requerido, que irá variar dependendo do uso final, tanto em termos de composição química e as propriedades mecânicas. Alguns sistemas utilizam andaimes como inserções bem-chapa consistindo de matriz altamente poroso formado a partir de templates alta emulsão de fase interna (ver 7) ou fibras electrospun (ver 8) que necessitam de adaptação mínimo de técnicas de cultura 2D convencionais. As células podem ser semeadas em microcarregadores de composições variadas e cultivadas em tanques agitados que fornecem nutrientes e moléculas de sinalização, e levar deteriorantes (transporte de massa) através de um ambiente bem misturado dinâmica 9. No entanto, estes sistemas são limitados em sua no ambiente vivo -como e outras melhorias podem ser feitas no que diz respeito à escala-up custos. Biorreactores de fibra oca (HFBs) é um sistema de cultura 3D que consistem de fibras fixadas em um módulo com células tipicamente semeadas no exterior das fibras porosas e meio entregue através do lúmen de fibra (revisto em 10) (Figura 1). HFBs oferecer um ambiente in vivo -like com as fibras que imitam capilares sanguíneos e protegendo as células a partir das tensões de corte associadas com a entrega dos meios dinâmica, enquanto permitindo corte definida para ser aplicada às células por meio de fluxo de fluido através das portas laterais, se desejado. Isso cria um sistema de cultura versátil com transporte de massa superior em que altas densidades celulares pode ser alcançado 11. O sistema de HFB é bem adequado para a manutenção de tipos celulares dependentes de ancoragem e tem sido utilizado para a cultura de uma variedade de células incluindo ratos ilhéus pancreáticos de Langerhans 12, rato β-TC-3 linha celular de insulinoma 12, hepatócitos humanos primários 13, osso humano As células mononucleares de medula 14, células Madin Darby de rim canino (MDCK) 15 e Caco-2 As células 16 para citar alguns.
Além das vantagens do sistema de transferência de massa e o aumento de escala, as células cultivadas em 3D tissistemas de cultura sue tendem a ser mais in vivo -como na morfologia e mais responsivo aos estímulos experimentais. Por exemplo hepatócitos primários de rato mostram uma morfologia mais cubóide, viabilidade aumentada, maior indução da actividade da enzima do citocromo P450 e aumento da sensibilidade à toxicidade do paracetamol, quando cultivada num andaime de poliestireno comercialmente disponíveis em comparação com células cultivadas em cultura 2D 17. Usando o mesmo andaime também tem sido mostrado a linha celular de hepatocarcinoma HepG2 para aumentar a produção de albumina de 18 um e mostrar mais in vivo -like resposta ao metotrexato em comparação com células cultivadas em 2D 19. Hepatócitos primários humanos demonstraram desdiferenciação retardada, maior atividade do citocromo-P450 e depuração aumentada para 4/5 compostos testados em um sistema de cultura de perfusão 20. Human células estaminais neuronais neurônios derivados e glia cultivadas em um andaime de poliestireno comercialmente disponível exibiu tanto elevada (potencial de ação) e baixa-FrequeNCY (potencial de campo local) actividade espontânea ao passo que nenhuma actividade neuronal foi detectada nas células cultivadas 2D 21. Células Caco-2 demonstraram diferenciação melhorada em comparação com um HFB cultura 2D medido pelo aumento da fosfatase alcalina, γ-glutamil transferase e a actividade de P-glicoproteína e de maior expressão de F-actina e na Zona-1 occludens proteína de 16. Apesar das vantagens, a cultura de rotina de células em outras do que uma superfície de cultura de tecidos balão 2D sistemas ainda não é praticado em muitos laboratórios, embora o número de publicações que mencionam cultura celular 3D é crescente (aumento de 8 vezes nos últimos 10 anos. Fonte : PubMed «resultados por Ano 'ferramenta sondado com" cultura 3D').
Este manuscrito descreve o set-up e as condições de funcionamento de um sistema de HFB para a cultura de células de mamíferos e demonstra a sua utilidade na cultura da linha celular HepG2 hepatocarcinoma / C3A. O objectivo deste método é para a cultura das células emum in vivo -como sistema mais cultura que retém bastante simplicidade para torná-lo receptivo para aqueles que são novos para sistemas de cultura 3D. A lógica por trás da utilização HFBs no pedido descrevem aqui, o que é para melhorar a previsibilidade dos modelos de fígado é que é teoricamente possível imitar uma sinusóide hepático dentro do ambiente HFB 22. Este não é actualmente possível com outros sistemas de cultura.
Protocolo
1. Fibras
- Fabricar as fibras por rotação de inversão de fase Casting (fiação). Os detalhes deste método pode ser encontrado em 23,24.
NOTA: Para este trabalho, as fibras são fabricados em casa usando um polímero não biodegradável proprietária, NMP como solvente e H2O como o não-solvente. Detalhes de outros polímeros adequados podem ser encontrados na discussão. As fibras utilizadas no sistema descrito aqui são 1,05 milímetros de diâmetro externo com um diâmetro do lúmen de 600-700 uM. As fibras são porosas com diâmetros de poros de 2,28 | iM de medição ± 1,5 uM (média ± desvio padrão). Isto é projetado para separar as células da alimentação de mídia na luz de fibra, replicando o sinusoid hepática ou vasculatura de outros tecidos. As fibras também podem ser adquiridos a partir de fornecedores tais como membrana Pall.
2. Módulo de Fabricação
NOTA: Os módulos usados neste estudo são feitos a partir de 1 mm de espessura de vidro de borossilicato com 2 portas laterais(Figura 2A). As fibras do módulo aqui descrito tem uma área de superfície exterior de 4,95 cm2, que é o equivalente a cerca de metade de um poço de uma placa de 6 poços.
- Módulos Siliconize antes da primeira utilização por revestimento da superfície interna com Sigmacote (Tabela 1) e permitindo a secar numa coifa. Autoclave (121 ° C, 1 atm, 20 min) para aumentar a vida do tratamento.
- Usando um bisturi redução de 75 mm de comprimento de fibras e inserir três fibras em cada um dos módulos deixando ~ 7 mm de comprimento em excesso em cada extremidade (Figura 3A).
- Ponto ~ 0,5 ml de cola de silicone (Tabela 1) para um barco de pesagem. Usar uma pipeta de ponta P200 para pegar uma pequena quantidade de silicone e trabalhar a cola nas extremidades do módulo em torno das fibras para formar um tampão de 3-5 mm (Figura 3B). Deixe secar por> 3 hr.
- Usando um bisturi cortar a descarga de silicone com as extremidades do módulo de vidro (Figura 3C).
- enrole umapequena quantidade (~ 4 camadas) de politetrafluoretileno (PTFE) fita em torno de uma porta lateral.
3. Configuração do Sistema e Esterilização
NOTA: de tubulação da bomba e módulos com fibras não são autoclavados e são esterilizados utilizando 70% de etanol. Os autores recomendam a calibração do tubo de bomba, com a bomba a ser usada. O procedimento que se segue é levada a cabo numa chaminé de fluxo laminar.
- Autoclave (como secção 2.1) todos os componentes autoclaváveis antes de set-up.
- Configuração
- Coloque 10 ml de 70% de etanol na garrafa reservatório e set-up do frasco reservatório, cap Q-série, tubo de alimentação, bomba e tubulação da bomba (Tabela 1) como na Figura 4.
- Vagamente colocar uma tampa sobre a porta lateral-gravadas PTFE. Deslize as extremidades dos conectores L módulo / S16 sobre as extremidades do módulo e porta lateral livre. Conectar uma secção de 40 mm do tubo L / S13 no conector do módulo mais próxima da porta do lado tapado (Tabela 1), como na Figura 2B .
- Ligue o módulo para o tubo de bomba, garantindo a sua orientação do módulo para a porta do lado mais próximo é tapado a bomba.
- Ligue a linha do permeado e do retentado linha para os conectores do módulo e o G / S14 do conector Y na garrafa de reservatório (Tabela 1). Certifique-se de que o set-up se assemelha aos esquemas na Figura 4.
- Esterilização
- Bombear etanol através do módulo em 800 mL / h (267 mL / hr por fibra) por tempo suficiente para tratar componentes não autoclavado para> 30 min (ajuste vezes se forem utilizados outros métodos de esterilização; veja 25).
- lavar
- Para lavar o etanol a partir do sistema, primeiro desligar a bomba e drenar o tubo. Primeiro, retire a tubulação da bomba do tubo adaptador de módulo. Segurar o módulo alto para drenar o etanol a partir da linha de fibras e material retido, para dentro do frasco reservatório. Remover a tampa de extremidade porta lateral do módulo para drenar the etanol a partir do módulo em si, e a linha do permeado. Volte a colocar a tampa da porta lateral. Inverter o fluxo dos meios de comunicação na bomba para drenar a tubulação da bomba e linha de alimentação de etanol. Desligue a bomba e reconecte a tubulação da bomba para o adaptador do módulo.
- Desapertar a garrafa de etanol a partir da tampa e substituído por um frasco contendo 10 ml de meio de crescimento celular (tal como EMEM, GMEM, DMEM ou RPMI) sem soro. Bombear o meio através do sistema a 800 ul / h até que a linha de retentado é cheio de meios de comunicação. Prender a linha de retentado para forçar a permeação dos meios de comunicação através das fibras para lavar o módulo. Lavar durante ~ 2 horas.
4. Sementeira
NOTA: A mídia e suplementos utilizados no presente protocolo devem ser aqueles que são estabelecidas para o tipo de célula desejada. Consulte a literatura, European Collection of Cell Cultures (ECACC) e American Type Culture Collection (ATCC) para mais informações. Antes disto células método deve ser maintained de acordo com protocolos estabelecidos para o tipo de célula desejado. Para este trabalho a linha celular HepG2 hepatocarcinoma / C3A subclone foram mantidos de acordo com as recomendações distribuidores (ATCC).
NOTA: O protocolo de sementeira apresentada abaixo também serve para pré-cultura o módulo com meio de cultura de célula antes de o crescimento celular. No caso de uma mais extensiva pré-cultura ser necessária, então esta deve ser efectuada antes da sementeira do módulo por drenagem do meio de lavagem a partir do sistema, substituindo com meio de crescimento e permeando este através do módulo de algumas horas. Consulte a seção 7.5.2.1 para obter detalhes sobre a substituição de mídia no sistema.
- Prepara-se uma suspensão de células individuais por tratamento com tripsina de acordo com protocolos estabelecidos para o tipo de célula desejado. Um protocolo geral para uma cultura T75 é a seguinte:
NOTA: O número de células a utilizar no passo de semeadura devem ser determinadas empiricamente para o tipo de célula desejado. Os biorreactores descritos aqui são semeadas a uma CEL 35 vezes maiordensidade LS (células / cm2) do que o utilizado em 2D plástico de cultura de tecidos para uma cultura de 7 dias.- Lavam-se as células por adição de 10 ml de solução salina de fosfato tamponada (PBS), aspirado, em seguida, adicionar 3 ml de 0,05% de ácido etilenodiaminotetra-tripsina (EDTA) (o suficiente para cobrir as células) e incubar a 37 ° C, 5% de CO 2 durante 5 min.
- Células colheita em 7 ml de meio de crescimento suplementado com 10% de soro fetal de bovino (FBS) para neutralizar a tripsina. Misture bem, adicione 10 ml para a câmara de um hemocitômetro e contar as células.
- Centrifugar a 200 xg durante 5 min para sedimentar as células.
- Aspirar as células sobrenadante e ressuspender em 4x10 6 / ml em meio de crescimento suplementado conforme necessário para o tipo de célula desejada.
- Desligue a bomba e drenar o tubo de alimentação e o módulo como em 3.4.1.
- Retire o módulo dos conectores do módulo e anexar tampas módulo (Tabela 1) pré-esterilizados em etanol 70%, deixando uma porta lateral livre.
- Transferir ~ 500 uL da suspensão de células (2x10 6 células) (4.1.4) para o módulo usando uma seringa de 18 agulha G e 1 ml, tendo o cuidado de evitar a formação de bolhas e não para danificar as fibras.
- Tapar o porta lateral usando uma tampa de extremidade. Incubar as células a 37 ° C, 5% de CO 2 durante 2-4 horas, com viragem manual do módulo de 180 ° em cada 5 min. Em alternativa, os módulos podem ser ligados a um rotor de tubo com uma configuração de mistura intermitente (Tabela 1).
- Após a sementeira, coloque uma tampa sobre uma porta de injeção (Tabela 1) pré-esterilizados em etanol a 70%, e anexar isso para a porta lateral-gravadas PTFE. Remover a tampa de extremidade a outra porta lateral e, lentamente, drenar as células por injecção de ar no orifício de injecção utilizando uma seringa ligada agulha G 27, e de 1 ml.
- Substitua a porta de injeção com uma tampa. Encha lentamente o módulo com a mídia usando a porta lateral gratuito e uma 18 G agulha com uma seringa de 1 ml. Remove as tampas do módulo e anexar o módulo para a tubulação usando os conectores do módulo.
- Substituir o frasco com um meio de lavagem contendo 50 ml de meio de crescimento e os suplementos seguintes o procedimento pormenorizado no 7.5.2.1. Bombear o meio de crescimento através do sistema a 800 ul / h.
5. Proliferação
NOTA: As fibras utilizadas no sistema de pesquisa aqui descritos são definidas para permear a ~ 80 mL / h, com uma taxa de alimentação de 800 mL / hr.
- Use as fibras para crescer as células durante períodos de até 7 dias, numa incubadora humidificada fixada em 37 ° C, 5% de CO 2.
NOTA: Monitoramento de nutrientes e metabólitos durante a fase de crescimento pode fornecer informações úteis sobre a proliferação, a captação metabólica e produção das células e os níveis de nutrientes e metabólitos na mídia. Por exemplo glicose uso e produção de lactato. Kits estão disponíveis a partir de vários fornecedores que possam quantificar esses fatores de mídia (consulte Tabela 1 para as utilizadas neste estudo). as portas de injecção podem ser adicionados à tubagem do permeado e do retentado e meios de amostragem através de uma seringa e agulha G 27, e meios de comunicação podem ser amostrados a partir da garrafa de meios reservatório. Isso dá a informação de nutrientes e metabolismo para a entrada e ambos os fluxos de saída. A amostragem deve ser efectuada numa câmara de fluxo laminar. Esterilizar as portas de injecção antes da amostragem, segurando um rolo azul etanol embebido contra a porta para> 30 seg.
6. Excisão
NOTA: As fibras podem ser excisadas a partir do módulo, no final de uma experiência para a análise.
- Desligue e drene o HFB.
- Insira um bisturi / micro faca (Tabela 1) lâmina entre o vidro e silicone. Ligue o módulo de modo a cortar o silicone a partir do vidro. Repetir este procedimento em ambas as extremidades do módulo.
- Usando a lâmina ligar a ficha de silicone de um lado e puxe. Certifique-se de que as fibras vêm com ele.
Análise 7. celular
- Os números de células
NOTA: Para as células C3A utilizados neste estudo quaisquer pontos de tempo dentro do período de crescimento de 7 dias são apropriados para utilização neste cálculo como taxas de crescimento não modifique substancialmente, sobre as densidades celulares alcançadas neste período de tempo.- Após a excisão (Secção 6) mergulhar as fibras em PBS para lavar e cortá-los em um tubo de 1,5 ml contendo 0,5 ml de Tris EDTA tampão (TE). Sujeite esta a dois ciclos de congelamento e descongelamento num -80 ° C congelador. Medir o teor de ADN utilizando PicoGreen e determinar o número de células, comparando este valor com uma curva padrão feita com o tipo de célula desejado 26.
- taxas de proliferação celular
- Usando os números de células calculados em dois pontos de tempo diferentes calcular a taxa de crescimento específica μ (Equação 1) em que Ln (X1) é o log natural do número de células no primeiro ponto de tempo e Ln (X2) é o logaritmo natural da célula número do segundo ponto de tempo.
μ = (ln (X2) -ln (X1)) / Tempo (h) (1)
Deste calcular os tempos de duplicação da população (dT) (Equação 2) em que μ é a taxa de crescimento específico.
dt = Ln2 / μ (2)
- Usando os números de células calculados em dois pontos de tempo diferentes calcular a taxa de crescimento específica μ (Equação 1) em que Ln (X1) é o log natural do número de células no primeiro ponto de tempo e Ln (X2) é o logaritmo natural da célula número do segundo ponto de tempo.
- Viabilidade celular
- Após a excisão (Secção 6) mergulhar as fibras em PBS para lavar e cortá-los em um tubo de 1,5 ml contendo 500 ul de tripsina a 0,05% de ácido etilenodiaminotetra-acético (EDTA). Incubar a 37 ° C durante 10 min.
- Misturar e adicionar 10 ul de suspensão de células a 10 uL de azul de tripano. Carga 10 ml em um hemocitómetro e contar o número de mortos (azul) e as células vivas.
- imagiologia
- Após a excisão mergulhar as fibras em PBS para lavar e utilize uma tesoura para cortar-los em comprimentos menores em uma placa de 24 poços. Adicionar 400 ul de paraformaldeido a 4% (em PBS) e incuba-se à temperatura ambiente durante 20 min.
- Lavar com PBS por pipetagem 400 mL ligado e desligado. Repita this passo com PBS fresco.
- Adicionar 400 ul de 4 ', 6-diamidino-2-fenilindole (DAPI) diluída em PBS para aprox. 100 ng / ml e incubar à TA durante 20 min. Proteger da luz.
- Lavar duas vezes com PBS (como 7.3.2) e uma vez com H 2 O. Adicionar um meio de montagem de fluorescência para cobrir a fibra e imagem imediatamente para recolher dados antes de as amostras secas (DAPI ex / em; 359/461 nm).
- Captar imagens em diferentes planos focais e usar 'foco empilhamento' software (por exemplo, a pilha de encaixe focalizador para ImageJ, abaixo) para fazer uma imagem composta mostra uma profundidade muito expandida de campo. Isso é necessário porque as fibras não são planas.
- Baixar ImageJ (http://imageJ.nih.gov/ij/) eo plug-in 'empilhar-focuser' (http://rsb.info.nih.gov/ij/plugins/stack-focuser.html).
- No ImageJ abrir as imagens a serem empilhadas. Em seguida, no menu 'Imagem' ir para 'Pilhas' - 'imagens para Stack'. No menu 'Plugins' Ir para 'Pilha Focador'. Especificar um n para o kernel nxn. Tentativa e erro com 'n' pode ser necessário, a fim de gerar uma imagem com pouco "barulho". Valores entre 11 e 77 tendem a funcionar bem.
- secreção de albumina
NOTA: Este é um teste de função celular de hepatócitos e não um teste geral da função das células.- Semear as células (HepG2 / C3A) em 2D tecido de plástico de cultura a 10667 / cm2 e cultivadas durante 6 dias. HFBs semente conforme descrito na Seção 4 e crescer durante 6 dias.
- Após este período de proliferação de mudar os meios de cultura (EMEM + 10% de FBS, 1x glutamina e 1x penicilina / estreptomicina) para o plástico de cultura de tecidos e HFB para uma livre meios de Williams E soro suplementado com glutamina 1x e 1x penicilina / estreptomicina durante 24 horas:
- Escorra o módulo de tubulação e HFB seguindo os passos estabelecidos no 3.4.1. Desapertar a garrafa reservatório e substituir este com um frasco que contém a mídia Williams E. Bombear isso através do HFB às 800? L / h.
- Na sequência de 24 horas, recolher amostras de mídia. Quantificar albumina segregada por ELISA de acordo com as instruções do fabricante (Tabela 1). Dilui-se amostras de meio 1 em 10 a 1 em 40 antes da sua utilização, a fim de trazer as concentrações de albumina dentro da gama da curva padrão.
Resultados
sementeira celular é um passo crítico. A capacidade das células para aderirem à fibra num 3D set-up é consideravelmente menor do que a observada para 2D plástico de cultura de tecidos. Isto é provavelmente devido ao tempo de contacto reduzida entre célula e substrato. No HFB as células cair através do módulo durante as fases estáticas de semeadura. Estes são consideravelmente mais curta no tempo em comparação com a fase de um estática contínua utilizado em 2D. As células têm de fazer conexões com o substrato neste tempo. Além disso, devido à natureza das fibras curvas não há nenhuma superfície plana para as células para descansar e fazer ligações como existe em cultura 2D. Enquanto isso pode ser agravado pela química da fibra empregue sabemos que este não ser o caso para o polímero utilizado neste estudo (dados não mostrados). Aumentando o tempo de semeadura e densidade de sementeira de células leva à formação de agregados de células que caem através do módulo durante as fases estático a uma mais rápida rComeram do que as células individuais e reduz ainda mais o tempo de contacto entre as células e substrato. O aumento do tempo também leva ao amarelecimento dos meios de comunicação, como existe uma elevada densidade de células e meios de comunicação sem troca durante este passo. Usando as condições descritas na Secção 4 taxas de sementeira celular de ~ 15% são consistentemente alcançados com as células HepG2 / C3A (Figura 5A). Enquanto isto pode ser considerado uma baixa fração existem células suficientes para gerar fibras bem povoadas em uma questão de dias (Figuras 5B e 6); após um período de proliferação de sete dias a densidade celular atingiu no HFB aproxima-se 3x10 5 / cm2. Esta é uma densidade adequada para muitos ensaios utilizando hepatócitos e pode ser considerada como atingindo a confluência.
As taxas de proliferação obtidos no HFB são mais lenta quando comparada com a conseguida em cultura de células em 2D (Figura 5C). Este é unsusceptível de ser devido a perda de células no fluxo dinâmico do sistema de contagem de células nos meios de comunicação são baixos (média ± SEM: 20,343 células ± 3.674 células por 24 h a confluência, o qual é 4% das células totais) e esta não aumenta quando a velocidade de permeação é girado até 400 ul / h (dados não mostrados). Além disso, é improvável que seja devido a uma diminuição da viabilidade e subsequente perda de células (ver Figura 5D e abaixo). Isto pode ser explicado, pelo menos em parte, pelo facto de esta linha celular foi derivada por clonagem a partir de células HepG2 e seleccionados na sua capacidade para exibir inibição de contacto da proliferação celular. As células do HFB são semeadas a 6x a densidade das células em 2D que podem levar a taxas de proliferação mais lentas.
Viabilidade permanece elevado durante todo o HFB com células que exibem> 90%. Embora não exista uma ligeira diminuição na viabilidade na extremidade de saída em comparação com a entrada esta não foi encontrado para ser significativa (teste t de p = 0,22).
Monitoramento do consumo de glicose e produção de ácido láctico tem sido usada para ajustar o volume de taxa de alimentação de mídia e meios de comunicação no sistema. Utilizando 800 uL / hr e um volume de suporte total de 50 ml de glucose e os níveis de ácido láctico são mantidas acima e abaixo (respectivamente) às observadas em cultura de plástico de cultura de tecidos padrão.
secreção de albumina é uma função hepática chave realizado pelos hepatócitos. Ela é secretada no soro onde desempenha vários papéis no transporte e na homeostase. A secreção de albumina pelas células cultivadas na HFB é 15 vezes maior do que em células cultivadas em 2D (Figura 7). Isto demonstra que as células são funcionais na HFB e, pelo menos, no caso de secreção de albumina, esta função é elevado no HFB.
jpg "/>
Figura 1. O ambiente in vivo de uma -like HFB. As células são semeadas sobre o exterior das fibras porosas. Mídia é entregue através do lúmen de fibra, imitando um capilar sangue. (A) Corte longitudinal de uma fibra (não está à escala). (B) Seção transversal de um reactor 3 da fibra. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2. O módulo de HFB. (A) As dimensões do módulo usados neste estudo. As dimensões foram escolhidas para caber 3 fibras e satisfazer as necessidades do projeto de pesquisa atual. tamanhos diferentes podem ser fabricados e adaptados para sistemas e fibras individuais. (B) Uma fotografia do mó dulo com conectores da extremidade da tampa e do módulo em anexo. Por favor clique aqui para ver uma versão maior desta figura.
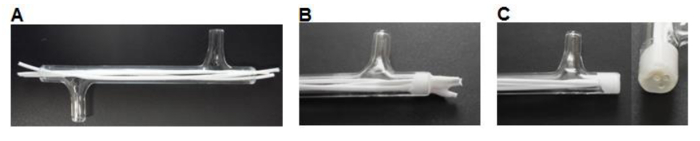
Figura 3. Módulo de fabrico. As fibras (A) são cortadas à medida e inserido no módulo. (B) As fibras são coladas no módulo, deixou-se secar. (C) As extremidades são cortadas nivelada com o vidro. Por favor clique aqui para ver uma versão maior desta figura.
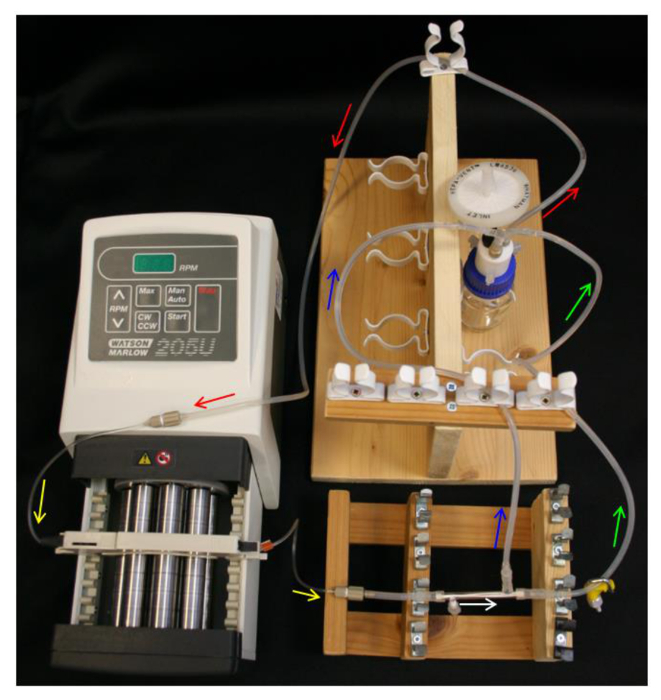
Figura 4. Sistema de HFB set-up. As setas indicam direção do fluxo de mídia. Vermelho = tubo de alimentação. Amarelo = bomba tuestar. Branco = módulo HFB. Verde = tubo de material retido com a braçadeira. Azul = permeiam tubo. Por favor clique aqui para ver uma versão maior desta figura.
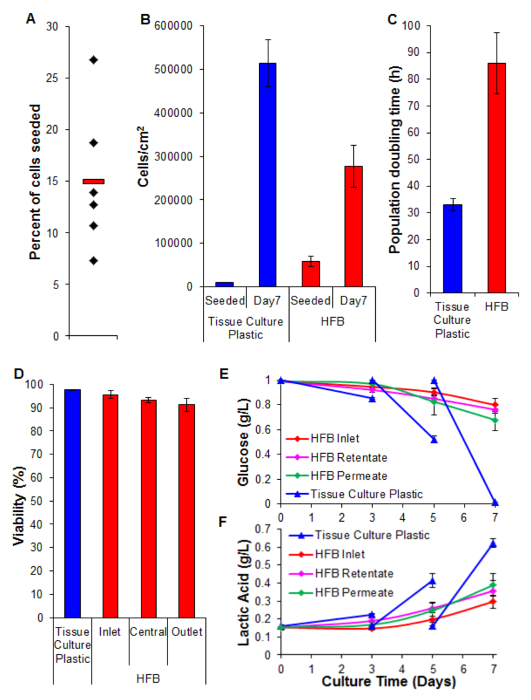
Figura 5. Sementeira, proliferação, viabilidade e análise bioquímica. (A) Percentagem de células semeadas. Os diamantes pretos representam HFBs individuais. A barra vermelha é a média. (B) As células massas volúmicas a semeadura e após um período de proliferação de 7 dias. o número de células em 2D foram determinados por tripsinização e contagem utilizando um hemocitómetro. Os números de células foram determinados HFB utilizando o ensaio de PicoGreen e uma curva padrão produzida a partir de células C3A 26. n = 5-6. Bares = SEM. (C) População tempos de duplicação. n = 5-7. Bares = SEM. (D) Viabilidade determinado pelo Trypuma exclusão de azul no final de uma proliferação de 7 dias. Inlet, central e tomada representam regiões dentro do HFB. n = 3-5. Bares = SEM. (E & F) o consumo de glicose e produção de ácido láctico. Os níveis foram monitorizados para a garrafa de reservatório (entrada), bem como o retido e permeado saídas e compered a cultura de rotina em plástico de cultura de tecidos (meio mudado no dia 3 & 5). n = 3-5. Bares = SEM. Por favor clique aqui para ver uma versão maior desta figura.
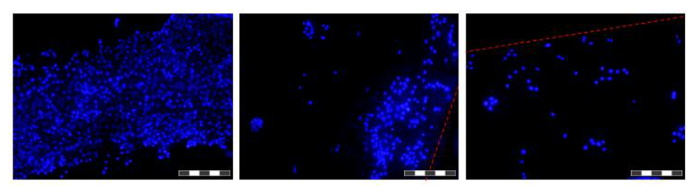
Figura 6. Imagens de células cultivadas em fibras numa HFB. As células foram semeadas e cultivadas durante 48 h antes de fibras foram excisados, lavados em PBS, fixadas em paraformaldeído a 4%, lavadas em PBS e núcleos corados com DAPI. Cada imagem é um composto de 12 "foco empilhado 'imaGES, a fim de aumentar a profundidade de campo da imagem resultante. As áreas de maior e menor densidade de células são encontradas ao longo da fibra, neste ponto de tempo e são apresentados. Onde limites atuais de fibra são indicados com uma linha tracejada vermelha. As imagens foram tiradas num microscópio de fluorescência invertido. Imagem objectivo = 10X. Bar = 200 mm. Por favor clique aqui para ver uma versão maior desta figura.
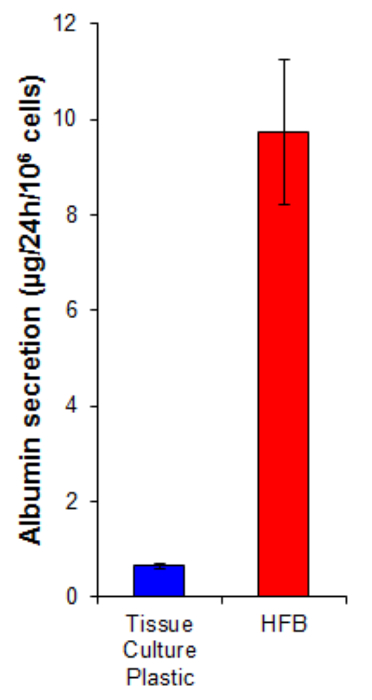
Figura 7. A albumina secreção. As células foram semeadas em plástico de cultura de tecidos em 10.667 / cm 2 e na HFB como descrito na Secção 4. As células foram proliferaram durante 6 dias. Após este período a proliferação dos meios de cultura de tecidos de plástico e cultura HFB foi mudado para um livre media Williams E soro suplementado com glutamina e penicilina / streptomyciN, durante 24 h. Amostras de meio foram retiradas e uma albumina quantificados por ELISA de acordo com as instruções (Tabela 1) fabrica. n = 5-6. Bares = SEM. Por favor clique aqui para ver uma versão maior desta figura.
| Seção | Nome do Equipamento | companhia | Gato. Não. | notas | imagens |
| 2 | Módulo HFB vidro | Soham Scientific | --- | Item personalizado. | |
| 2.1 | Sigmacote® | Sigma-Aldrich | SL2 | ||
| 2.3 | Silicoset 151 | Intertronics | ACCSS151 | Silicuma cola. | |
| 2.5 | fita de PTFE | Sigma-Aldrich | Z104388 | ||
| 3.2.1 | garrafa Reservoir | pescador | 11972619 | ||
| cap-série Q | Kinesis | 00932Q-3V | PTFE as roscas dos adaptadores e porca de ajuste. Anexar ao cap-série Q. Anexar uma secção de 8,5 centímetros da tubagem de PTFE fornecido sob a placa de 1 milímetro e uma secção 4 cm abaixo da placa de 3 mm. |  | |
| Adaptador, Masculino, 1,0 mm de diâmetro | Kinesis | 008NB10-KD5L | |||
| Adaptador, Masculino, 3,0 mm de diâmetro | Kinesis | 008NB30-KD5L | |||
| Nut Fitting | Kinesis | U-350 | |||
| tubo de neoprene | pescador | 10366344 | Anexar o filtro Hepa a 6 cm de tubo de neoprene e anexar isso ao 'porca de ajuste'. Anexar um 2x 30 seções mm de L tubulação / S14 para as duas primeiras farpas do conector Y e uma seção de 3 centímetros de L tubulação / S16 para o fundo. Anexar esta a farpa do adaptador ID 3 mm. (Seção 3.2.1) |  | |
| HEPA-Vent | pescador | 11374634 | |||
| Y-conector, farpado | Cole Parmer | OU-06295-10 | |||
| L / tubo S16 silicone | Cole Parmer | OU-96410-16 | |||
| L / tubo S14 silicone | Cole Parmer | WZ-96410-14 | |||
| L / tubulação S13 Silicone | Cole Parmer | OU-96410-13 | 80 cm para conectar o adaptador farpado 1,0 mm no cap-série Q para a banheira de bomba ing = tubo de alimentação. | ||
| bomba de WM 205U / CA | pescador | 1248-6300 | |||
| tubulação da bomba WM, PVC, azul-laranja, 0,25 milímetros furo | pescador | 12416310 | PTFE a rosca do adaptador macho e ligue o adaptador feminino. Trabalhar a tubulação da bomba sobre uma das farpas. Repetir este definir-se na outra extremidade do tubo. (Seção 3.2.1) |  | |
| Adaptador, Masculino, 1,0 mm de diâmetro | Kinesis | 008NB10-KD5L | |||
| Adapter, Feminino, 1,0 mm de diâmetro | Kinesis | 008NB10-KD2L | |||
| 3.2.2 | tampa Luer fêmea | Cole Parmer | WZ-45508-64 | Colaterais tampas de porta. | blefig4.jpg "/>  |
| L / tubulação S13 Silicone | Cole Parmer | OU-96410-13 | seção de 40 mm para ligar a tubulação da bomba a um conector do módulo. | ||
| L / tubo S16 silicone | Cole Parmer | OU-96410-16 | 3x 30 mm de L / S16 equipado 3x redutores = conectores do módulo. (Seção 3.2.2) | ||
| redutor farpado 1/8 "x 1/16" | Cole Parmer | 30616-43 | |||
| 3.2.4 | L / tubulação S13 Silicone | Cole Parmer | OU-96410-13 | cm secção 55 para conectar o retentado para o L / S14 do conector Y na tampa Q-série. |  |
| L / tubulação S13 Silicone | Cole Parmer | OU-96410-13 | cm secção 45 para ligar o permeado para o L / S14 do conector Y na tampa Q-série. | ||
| união farpado reta | Cole Parmer | WZ-30612-43 | Anexar ao fim do L / S13 que vai ligar com o L / S14 do conector Y. | ||
| 3.4.2 | braçadeira | VWR | 229-0609 | ||
| 4.3 | tubagem de silicone 4 milímetros | pescador | FB68858 | Dobre uma seção 40 milímetros de tubos e prenda com uma braçadeira tampa = Módulo. (Seção 4.3) |  |
| braçadeira de cabo | pescador | 12326377 | |||
| 4.4 | MACSmix rotator tubo | Miltenyi Biotech | 130-090-753 | Uma adaptação pode ser obrigado a ATTACh os módulos. | |
| 4,5 | porta de injeção Leur | Thistle Scientific | IB-10820 | Coloque a tampa da extremidade à porta de injeção. (Seção 4.5) | |
| tampa Luer fêmea | Cole Parmer | WZ-45508-64 | |||
| 5 | kit de ácido L-láctico | Megazyme | K-LATE | ||
| 5 | kit de D-glicose | Megazyme | K-gluc | ||
| 6.2 | Bisturi / micro faca | InterFocus | 10315-12 | ||
| 7.4.3 | albumina ELISA | Bethyl Labs | E80-129 |
Tabela 1. Componentes do HFB set-up. A secção de texto relevantes para cada componente é dada na coluna 1.
Discussão
Este manuscrito descreve o set-up e operação de um sistema oco biorreator de fibra (HFB) para a cultura de células de mamíferos e sua utilidade é demonstrada em proliferando a linha de células de hepatócitos HepG2 / C3A. O sistema é projetado para caber na prateleira de uma incubadora padrão e seu set-up é simples o suficiente para ser levada a cabo por qualquer biólogo celular competente familiarizado com a técnica asséptica.
As fibras utilizadas no sistema de pesquisa aqui descritos são fabricados em casa por rotação de inversão de fase de fundição (fiação) utilizando um polímero não biodegradável proprietária. É possível fazer fibras de fiação a partir de uma variedade de materiais adequados para a cultura de células, tanto biodegradáveis e não biodegradáveis, por exemplo; de policaprolactona (PCL) 27, ácido poli-L-lactido (PLLA) 28, poli (ácido láctico-co-glicólico) (PLGA) 29, polisulfona (PSU) 12 e polieteretercetona (PEEK) 13. Cada um tem diferentes propriedades deND deve ser escolhida com base nas necessidades do sistema. Verifique a compatibilidade da fibra empregue com o etanol utilizado no passo de esterilização. PLGA é conhecido por plastificar com etanol necessitando de um tratamento alternativo, como antibióticos / solução antimicótico 25.
As dimensões dos módulos de vidro usadas aqui foram escolhidos com base nas necessidades da pesquisa actual. tamanhos diferentes pode ser feita por qualquer empresa sopro de vidro respeitável. Uma consideração no tamanho do módulo é o número de células, que está ligado ao número de fibras do módulo e as taxas de fluxo prováveis. As células mais existem no módulo quanto maior a taxa de fluxo terá de ser de modo a manter condições favoráveis de cultivo na extremidade de saída do bioreactor. Isso vai atingir um limite como algum momento e alguma tentativa e erro pode ser necessária com monitoramento das condições da mídia no permeado módulo. modelagem matemática pode fornecer alguns insights sobre as dimen módulo necessáriosões e taxas de fluxo 22.
As dimensões do aparelho utilizado aqui é concebido para se ajustar a uma prateleira incubadora. O comprimento do tubo é ditado pelo comprimento necessário para se atingir entre os conectores enquanto permitindo também o movimento suficiente de componentes para permitir a montagem e operação. Se a amostragem curso de tempo é necessário, por exemplo, no controlo das condições de media no módulo de permear, em seguida, as portas de injecção podem ser adicionados ao retentado e as linhas permear para facilitar isto.
Um pré-requisito para qualquer sistema de cultura de células é a de manter as células vivas e na maioria dos casos em crescimento. À luz de estudos que demonstram uma mais in vivo -like fenótipo em células cultivadas em sistemas de cultura 3D também parece importante para proporcionar um ambiente que imita de perto o ambiente in vivo encontrados pelas células. Este último ponto é muitas vezes negligenciada em cultura de células 2D em favor da conveniência deste sistema de cultura oferece. Tele HFB imita em redes capilares in vivo, fornecendo nutrientes para as células através do lúmen das fibras. Os resíduos de produtos também são removidos do sistema por o fluxo dinâmico. Isto cria um sistema in vivo -como para cultura de células e uma que imita de perto o ambiente in vivo visto pelos hepatócitos, tornando este sistema uma escolha melhor em comparação com 2D tecido de plástico de cultura para a cultura dessas células. Isto é corroborado pelo fato de as células secretam 15 vezes a quantidade de albumina, uma importante função hepática, no sistema de cultura HFB em comparação com aquelas cultivadas em 2D de plástico de cultura de tecidos.
Embora o sistema de HFB é adequada para a maioria se não todos os tipos de células dependentes de ancoragem, o exemplo aqui é para hepatócitos porque existe uma verdadeira necessidade de ser capaz de cultura funcional, in vivo mais -like hepatócitos para utilização no desenvolvimento de medicamentos pela indústria farmacêutica e em dispositivos de fígado bioartificiais para o apoio extracorpóreade pacientes com insuficiência hepática. A necessidade de células funcionais mais se estende para além destes exemplos, particularmente como o campo da medicina regenerativa entra numa fase de trabalho de translação. As vantagens de um ambiente in vivo cultura mais -como não deve ser menosprezada.
Divulgações
MJE is a founder and director of Cellesce Ltd which aims to provide bioprocessing solutions for tissue engineering-based research and industry.
Agradecimentos
This work was funded by the National Centre for the Replacement, Refinement and Reduction of Animals in Research (NC3Rs) CRACK IT funding.
Materiais
| Name | Company | Catalog Number | Comments |
| Glass HFB Module | Soham Scientific | --- | Custom Item. (Section 2) |
| Sigmacote | Sigma-Aldrich | SL2 | (Section 2.1) |
| Silicoset 151 | Intertronics | ACCSS151 | Silicone Glue. (Section 2.3) |
| PTFE tape | Sigma-Aldrich | Z104388 | (Section 2.5) |
| Reservoir bottle | Fisher | 11972619 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Q-series cap | Kinesis | 00932Q-3V | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Adapter, Male, 3.0 mm ID | Kinesis | 008NB30-KD5L | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Fitting Nut | Kinesis | U-350 | PTFE the screw threads of the adapters and fitting nut. Attach to the Q-series cap. Attach an 8.5 cm section of the supplied PTFE tubing under the 1 mm adapter and a 4 cm section under the 3 mm adapter. (Section 3.2.1) |
| Neoprene tubing | Fisher | 10366344 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| HEPA-vent | Fisher | 11374634 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| Y-connector, barbed | Cole Parmer | OU-06295-10 | Attach the Hepa filter to 6 cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S14 Silicone tubing | Cole Parmer | WZ-96410-14 | Attach the Hepa filter to 6cm of neoprene tubing and attach this to the 'fitting nut'. Attach a 2x 30 mm sections of L/S14 tubing to the top two barbs of the Y-connector and a 3 cm section of L/S16 tubing to the bottom. Attach this to the barb of the 3 mm ID adapter. (Section 3.2.1) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 80 cm to connect the 1.0 mm barbed adapter on the Q-series cap to the pump tubing = Feed tube. (Section 3.2.1) |
| WM 205U/CA pump | Fisher | 1248-6300 | (Section 3.2.1) |
| WM pump tubing, PVC, blue-orange, 0.25 mm bore | Fisher | 12416310 | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Male, 1.0 mm ID | Kinesis | 008NB10-KD5L | PTFE the screw thread of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Adapter, Female, 1.0 mm ID | Kinesis | 008NB10-KD2L | PTFE the screw thred of the male adapter and connect the female adapter. Work the pump tubing over one of the barbs. Repeat this set-up at the other end of the tubing. (Section 3.2.1) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Side port end caps. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 40 mm section to connect the pump tubing to a module connector. (Section 3.2.2) |
| L/S16 Silicone tubing | Cole Parmer | OU-96410-16 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| Barbed reducer 1/8"x1/16" | Cole Parmer | 30616-43 | 3x 30 mm of L/S16 fitted to 3x reducers = module connectors. (Section 3.2.2) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 55 cm section to connect the retentate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| L/S13 Silicone tubing | Cole Parmer | OU-96410-13 | 45 cm section to connect the permeate to the L/S14 of the Y-connector on the Q-series cap. (Section 3.2.4) |
| Straight barbed union | Cole Parmer | WZ-30612-43 | Attach to the end of the L/S13 that will connect with the L/S14 of the Y-connector. (Section 3.2.4) |
| Clamp | VWR | 229-0609 | (Section 3.4.2) |
| 4 mm Silicone tubing | Fisher | FB68858 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| Cable tie | Fisher | 12326377 | Fold over a 40 mm section of tubing and secure with a cable tie = Module end cap. (Section 4.3) |
| MACSmix tube rotator | Miltenyi Biotech | 130-090-753 | An adaptation may be required to attach the modules. (Section 4.4) |
| Leur Injection port | Thistle Scientific | IB-10820 | Attach the end cap to the injection port. (Section 4.5) |
| Female Luer cap | Cole Parmer | WZ-45508-64 | Attach the end cap to the injection port. (Section 4.5) |
| L-lactic acid kit | Megazyme | K-LATE | (Section 5) |
| D-glucose kit | Megazyme | K-GLUC | (Section 5) |
| Scalpel / micro knife | InterFocus | 10315-12 | (Section 6.2) |
| Albumin ELISA | Bethyl Labs | E80-129 | (Section 7.4.3) |
Referências
- Lewis, W. H. Experimental evidence in support of the theory of outgrowth of the axis cylinder. American J Anat. 6 (1), 461-471 (1906).
- Harrison, R. G. The development of peripheral nerve fibers in altered surroundings. Wilhelm Roux Arch Entwickl Mech Org. 30 (2), 15-33 (1910).
- Ding, L., et al. A genome-scale RNAi screen for Oct4 modulators defines a role of the Paf1 complex for Embryonic Stem Cell identity. Cell Stem Cell. 4 (5), 403-415 (2009).
- Groeber, F., Holeiter, M., Hampel, M., Hinderer, S., Schenke-Layland, K. Skin tissue engineering -In vivo and in vitro applications. Adv Drug Deliv Rev. 63 (4), 352-366 (2011).
- Sinden, J. D., Vishnubhatla, I., Muir, K. W. Prospects for stem cell-derived therapy in stroke. Prog Brain Res. 201, 119-167 (2012).
- Ouyang, A., Yang, S. -. T. A two-stage perfusion fibrous bed bioreactor system for mass production of embryonic stem cells. Expert Opin Biol Ther. 8 (7), 895-909 (2008).
- Carnachan, R. J., Bokhari, M., Przyborski, S. A., Cameron, N. R. Taloring the morphology of emulsion-templated porous polymers. Soft Matter. 2 (7), 608-616 (2006).
- Deshpande, P., et al. Simplifying corneal surface regeneration using a biodegradable synthetic membrane and limbal tissue explants. Biomaterials. 34 (21), 5088-5106 (2013).
- Storm, M. P., Orchard, C. B., Bone, H. K., Chaudhuri, J. B., Welham, M. J. Three-dimensional culture systems for the expansion of pluripotent embryonic stem cells. Biotechnol Bioeng. 107 (4), 683-695 (2010).
- Wung, N., Acott, S. M., Tosh, D., Ellis, M. J. Hollow fibre membrane bioreactors for tissue engineering applications. Biotechnol Lett. 36 (12), 2357-2366 (2014).
- Ellis, M., Jarman-Smith, M., Chaudhuri, J. B., Chaudhuri, J., Al-Rubeai, Bioreactor systems for tissue engineering: A four-dimensional challenge. Bioreactors for tissue engineering; principles, design and operation. , 1-18 (2005).
- Silva, A. I., Mateus, M. Development of a polysulfone hollow fibre vascular bio-artificial pancreas device for in vitro studies. J Biotechnol. 139 (3), 236-249 (2009).
- De Bartolo, L., et al. Human hepatocyte functions in a crossed hollow fiber membrane bioreactor. Biomaterials. 30 (13), 2531-2543 (2009).
- Schmelzer, E., Finoli, A., Nettleship, I., Gerlach, J. C. Long-term three-dimensional perfusion culture of human adult bone marrow mononuclear cells in bioreactors. Biotechnol Bioeng. 112 (4), 801-810 (2015).
- Tapia, F., et al. Production of high-titer human influenza A virus with adherent and suspension MDKC cells cultured in a single-use hollow fiber bioreactor. Vaccine. 32 (8), 1003-1011 (2014).
- Deng, X., Zhang, G., Shen, C., Yin, J., Meng, Q. Hollow fiber culture accelerates differentiation of Caco-2 cells. Appl Microbiol Biotechnol. 97 (15), 6943-6955 (2013).
- Schutte, M., et al. Rat primary hepatocytes show enhanced performance and sensitivity to acetaminophen during three-dimensional culture on a polystyrene scaffold designed for routine use. Assay Drug Dev Technol. 9 (5), 475-486 (2011).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Novel cell culture device enabling three-dimensional cell growth and improved cell function. Biochem Biophys Res Commun. 354 (4), 1095-1100 (2007).
- Bokhari, M., Carnachan, R. J., Cameron, N. R., Przyborski, S. A. Culture of HepG2 liver cells on three dimensional polystyrene scaffolds enhances cell structure and function during toxicological challenge. J Anat. 211 (4), 567-576 (2007).
- Vivares, A., et al. Morphological behaviour and metabolic capacity of cryopreserved human primary hepatocytes cultivated in a perfused multiwell device. Xenobiotica. 45 (1), 29-44 (2015).
- Smith, I., et al. Human neural stem cell-derived cultures in three-dimensional substrates form spontaneously functional neuronal networks. J Tissue Eng Regen Med. , (2015).
- Davidson, A. J., Ellis, M. J., Chaudhuri, J. B. A theoretical approach to Zonation in a bioartificial liver. Biotechnol Bioeng. 109 (1), 234-243 (2012).
- Mulder, M. . The basic principles of membrane technology. 2nd ed. , (1996).
- Ellis, M. J., Chaudhuri, J. B. Poly(lactic-co-glycolic acid) hollow fibre membranes for use as a tissue engineering scaffold. Biotechnol Bioeng. 96 (1), 177-187 (2007).
- Shearer, H., Ellis, M. J., Perera, S. P., Chaudhuri, J. B. Effects of common sterilization methods on the structure and properties of poly(D,L lactic-co-glycolic acid) scaffolds. Tissue Eng. 12 (10), 2717-2727 (2006).
- Forsey, R. W., Chaudhuri, J. B. Validity of DNA analysis to determine cell numbers in tissue engineering scaffolds. Biotechnol Lett. 31 (6), 819-823 (2009).
- Williamson, M. R., Coombes, A. G. A. Gravity spinning of polycaprolactone fibres for applications in tissue engineering. Biomaterials. 25 (3), 459-465 (2004).
- El-Salmawy, A., et al. Preparation and properties of pronectin F-coated biodegradable hollow fibres. J Artif Organs. 8 (4), 245-251 (2005).
- Meneghello, G., et al. Fabrication and characterization of poly(lactic-co-glycolic acid)/polyvinyl alcohol blended hollow fibre membranes for tissue engineering applications. J Memb Sci. 344 (1-2), 55-61 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados