É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Imagem raciométrica de pH extracelular no biofilme dentário
Neste Artigo
Resumo
Um corante raciométrica sensível ao pH é utilizado em combinação com a microscopia de varrimento a laser confocal e análise de imagem digital para monitorar o pH extracelular em biofilmes dentários em tempo real.
Resumo
O pH em biofilmes bacterianas nos dentes é de importância central para a cárie dentária, uma doença com alta prevalência em todo o mundo. Nutrientes e metabólitos não são distribuídas uniformemente em biofilmes dentais. Uma interacção complexa de sorção de reacção e com a matéria orgânica no biofilme reduz os caminhos de difusão de solutos e cria gradientes íngremes de moléculas reactivas, incluindo os ácidos orgânicos, entre os biofilme. métodos microscópicos fluorescentes quantitativos, tais como a imagiologia de tempo de vida de fluorescência ou ratiometry pH, pode ser utilizado para visualizar o pH em diferentes microambientes de biofilmes dentais. pH ratiometry explora um deslocamento dependente do pH na emissão de fluorescência de corantes sensíveis ao pH. O cálculo da razão de emissão em dois comprimentos de onda diferentes permite a determinação do pH local em imagens microscópicas, independentemente da concentração do corante. Contrariamente ao microeléctrodos a técnica permite monitorar ambos os gradientes de pH verticais e horizontais em tempo real commecanicamente perturbar o biofilme. No entanto, é preciso ter cuidado para diferenciar com precisão entre os compartimentos extra e intracelulares do biofilme. Aqui, o corante raciométrica, seminaphthorhodafluor 4F-5- (e-6) ácido carboxílico (C-SNARF-4) é empregue para monitorizar o pH extracelular in vivo em biofilmes dentais cultivadas espécies de composição desconhecida. Após a exposição a glicose do corante é up-concentrada dentro de todas as células bacterianas nos biofilmes; É, assim, usado tanto como uma mancha universal de bactérias e como um marcador do pH extracelular. Após a aquisição da imagem microscópica confocal, a biomassa bacteriana é removida de todas as fotos usando o software de análise de imagem digital, que permite calcular exclusivamente pH extracelular. ratiometry pH com o corante proporcional está bem adequado para o estudo do pH extracelular em biofilmes finos de até 75 um de espessura, mas está limitada ao intervalo de pH entre 4,5 e 7,0.
Introdução
O método descrito aqui permite a monitorização do pH extracelular em biofilmes dentais na gama entre 4,5 e 7, utilizando o corante raciométrica seminaphthorhodafluor 4F-5- (e-6) ácido carboxílico (C-SNARF-4), em combinação com a microscopia de varrimento a laser confocal e análise de imagem digital. O corante fluorescente empregue é sensível ao pH e exibe uma mudança na sua emissão fluorescente, dependendo do estado de protonação. A emissão fluorescente dos picos de moléculas protonadas a 580 nm, e a emissão da molécula desprotonado em 640 nm 1. A razão entre as intensidades de emissão fluorescente em duas janelas de detecção que compreende os dois picos de emissão (576-608 nm e 629-661 nm) reflecte, portanto, o pH na fase líquida, independentemente da concentração de corante. Com um valor de pKa de 6,4 ~ o corante é adequado para visualização em ambientes de pH moderadamente ácidas.
PH no biofilme bacteriano é de importância central para todos os processos metabólicos.No caso de biofilmes dentais, o pH na matriz extracelular é o factor de virulência chave para o desenvolvimento de cárie dentária. Longos períodos com pH baixo na liderança interface de biofilme-tooth para retardar a desmineralização do esmalte subjacente 2. Devido à arquitectura tridimensional complexa de biofilmes, metabolitos, incluindo os ácidos orgânicos, não são uniformemente distribuídos através do biofilme. Altamente e menos microambientes acidogênicas pode ser encontrada em estreita proximidade espacial 3.
Durante décadas, os gradientes de pH verticais em biofilmes foram gravadas com a ajuda de microeletrodos 4-6. Enquanto eles oferecem uma boa resolução espacial devido ao seu tamanho pequeno ponta, eles não são adequados para monitorar gradientes horizontais. Além disso, a inserção do eléctrodo perturba o biofilme mecanicamente. técnicas microscópicas fluorescentes quantitativos oferecem a vantagem de visualizar mudanças de pH em diferentes áreas de um biofilme sem interferir mecânicance. Diferentes campos de vista microscópico pode ser escolhido livremente e fotografada várias vezes ao longo de períodos prolongados 1,7-9. No entanto, ao interpretar imagens microscópicas de biofilme, é importante fazer a distinção entre a fluorescência derivada da biomassa microbiana e a fluorescência resultante a partir do espaço extracelular. Em condições acídicas, o pH no interior das células bacterianas é diferente do pH na matriz extracelular, como as bactérias transportar activamente protões através sua membrana celular à custa de adenosina trifosfato 10. No contexto da cárie dentária, pH bacteriana intracelular não tem um impacto direto sobre o esmalte subjacentes enquanto baixo pH extracelular leva a desmineralização. Média de pH em imagens microscópicas que contêm ambas as áreas e bactérias livres de bactérias leva a resultados errados. A utilização de outras manchas, juntamente com o corante sensível ao pH, a fim de visualizar a biomassa bacteriana e diferenciar entre as áreas extra e intracelulares traz abo risco de contaminação de fluorescência do espaço extracelular e erros de medição 11.
Por conseguinte, o presente manuscrito descreve a utilização do corante raciométrica numa função dupla; tanto como um marcador de pH e como uma mancha universal de bactérias. Como o corante é-se concentrado em células bacterianas, a combinação de imagem microscópica confocal e um processo de análise de imagem digital preciso permite determinar o pH extracelular no intervalo entre 4,5 e 7,0 em biofilmes finos dentários.
Protocolo
O protocolo experimental foi analisado e aprovado pelo Comitê de Ética de Aarhus County (M-20100032).
1. confocal microscópica Calibração do Ratiometric Dye
- Para aquisição de imagem, use um microscópio invertido confocal equipado com uma incubadora, uma objectiva de imersão em água abertura 63X / 1.2-numérico, uma linha de laser 543 nm e um detector de META.
- Preparar tampão HEPES soluções de reserva (50 mM, ajustado a pH 4,5-8,5 em passos de 0,1 unidades de pH). Pipetar 100 l de cada solução nas cavidades de uma placa de 96 poços de fundo claro, por microscopia de fluorescência.
- Usar luvas de borracha nitrílica ao manusear o corante ratiometric C-SNARF-4. Prepara-se uma solução de estoque 1 mM do corante em sulfóxido de dimetilo. Adicionar 5 uL da solução stock a cada poço com tampão HEPES. Colocar a placa de 96 poços sobre o microscópio.
- Ligue o microscópio. Abra o software microscópio. Clique nos seguintes painéis: Adquirir → Laser; Adquirir → MICRO; Adquirir → Config; Adquirir → Digitalização; Adquirir → Stage. Aquece-se a incubadora a 37 ° C.
- Ligue a linha de laser 543 nm, clicando sobre o laser 543 nm e o botão "On" na janela "Controle Laser". Escolha a objetiva de imersão 63X / 1.2-numérico água abertura na janela "Controle Microscópio".
- Defina o detector META para monitorar simultaneamente a fluorescência dentro de 576- a 608 nm (verde) e 629- a 661 nm intervalos (vermelho) ( "Controle de Configuração" → "ChS"). Ajustar a potência do laser ( "Controle de Configuração" → "Excitação"). Defina o pinhole para produzir uma espessura de corte óptico de 1,6 mm ( "Control Scan" → "Pinhole").
- Adquirir uma imagem de cada solução tampão de HEPES, 5 mm acima do fundo de vidro da placa de 96 poços. Nota: Assim que o plano de focagem está situado por baixo do fundo de vidro, sem luz fluorescente pode ser vistona tela. Depois de cada terceira imagem, defina a potência do laser para zero e ter uma imagem para a subtração de fundo.
- Realizar o experimento de calibração em triplicado (1,2-1,7).
- Determinar a intensidade de fluorescência média e desvio padrão, em todas as imagens vermelhas e verdes.
- Calcula-se a relação R e erro padrão da média, S R, para cada imagem de acordo com as equações (1) e (2)
(1)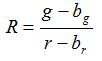
(2)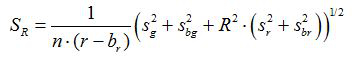
g, r, s g e s r são as médias e desvios-padrão nas respectivas imagens verde e vermelho. b g, b r, s bg e s l são os valores correspondentes para as imagens de fundo. n 2 é o número de pixels fotografada. - Traçar as razões calculadas para cada valor de pH a partir de três experiências de calibração replicar num diagrama e construir uma curva ajustada a partir desta série de pontos de dados (ou seja, utilizando o software SigmaPlot 13). Fazer uma função matemática da curva ajustada, que pode converter proporções em valores de pH 10.
- Calcula-se a relação R e erro padrão da média, S R, para cada imagem de acordo com as equações (1) e (2)
2. Recolha de In Situ Grown amostras Dental biofilme
- Selecione voluntários que preenchem os critérios de inclusão e exclusão relevantes para o estudo. Faça impressões de alginato de sua arcada dentária superior e inferior. Faça modelos de gesso de estas impressões e fabricar um splint de acrílico no maxilar inferior. Projetar a tala com flanges de acrílico bucais ligados por um fio ortodôntico lingual que permite que o voluntário a morder oclusão normal 12.
- Recessões broca nos flanges vestibular do splint de acrílico (Figura 1 ) Com a ajuda de fresas acrílico dental para permitir a inserção de placas de vidro para recolha do biofilme. A profundidade das recessões deve ser de pelo menos 1,5 mm, enquanto a largura e o comprimento das recessões podem variar, dependendo do número de placas de vidro a serem inseridos.
- Para a recolha de biofilme, utilizar placas feitos por medida não fluorescentes de vidro (4 x 4 x 1 mm3), com uma rugosidade da superfície de granalha de 1200, a fim de imitar o padrão de colonização em esmalte natural, 11.
- Esterilizar os pavimentos de vidro por autoclavagem antes da montagem. Montar as placas de vidro com cera pegajoso nas depressões nos flanges bucais de cada lado ligeiramente recuadas para a superfície da superfície de acrílico de modo a proteger o biofilme de forças de cisalhamento exercidas pelo movimento dos mordentes 11.
Nota: O número de placas de vidro colocadas numa recessão pode variar entre 3 e 14, dependendo do objectivo do estudo. - Insira o aparelho na boca do voluntário. Instrua o Volunteer para reter o dispositivo intra-oralmente durante todo o período experimental. Instruir o voluntário para guardar o aparelho em um recipiente retentor ortodôntico com um pedaço de lenço de papel molhado (para mantê-lo húmido) à temperatura ambiente durante a escovação dos dentes e da ingestão de alimentos e outros do que a água bebidas. Instrua o voluntário para não tocar nos flanges acrílico bucais com as placas de vidro enquanto colocar e retirar o aparelho.
Nota: O período experimental podem variar dependendo do objectivo do estudo (um dia a várias semanas). - Cuidadosamente remover as placas de vidro a partir do aparelho no final do período experimental. Remover a cera pegajoso em torno das placas, com uma faca e transferi-los com um par de pinças para um recipiente fechado, o biofilme voltada para cima, até que a análise microscópica. Mantenha o recipiente úmido com lenço de papel molhado. Realizar imagem pH dentro de poucas horas após a coleta do biofilme.
3. biofilme pH de imagem
- Prepararsalivar solução por adição de ditiotreitol à saliva recolhida de acordo com o método de De Jong et ai. 13. Titula-se a solução para pH 7,0 salivar e adicionar glucose a uma concentração de 0,4% (peso / vol). Pipetar 100 ul por biofilmes ser analisadas numa placa de 96 poços com fundo de vidro para microscopia. Adicionam-se 5 ul de corante raciométrica por poço.
- Colocar a placa de 96 poços na platina do microscópio. Ligue o microscópio e a linha de laser 543 nm. Aquece-se a incubadora a 37 ° C. Use as mesmas configurações microscópio como para a calibração do corante (veja as etapas 1,5-1,6). Esperar durante 30 min, até que a placa de 96 poços atingiu a temperatura de trabalho.
- Pegar uma ou mais placas de vidro com um conjunto magro de pinças e colocá-los nos poços cheios de saliva, uma laje por poço, com os biofilmes viradas para baixo.
- Adquirir imagens individuais ( "Control Scan" → "single") ou Z-stacks ( "Control Scan" → "Start") spanning a profundidade dos biofilmes em diferentes áreas. Para adquirir z-stacks escolher o número de fatias a ser trabalhada ( "Scan Control" → "Definições Z" → "Num fatias") e marque o z-position para a primeira e a última fatia no software microscópio ( "Controle de Digitalização "→" Configurações Z "→" Mark First ";" Mark Last ").
Nota: Z-pilhas com uma profundidade de até 75 fim pode ser adquirido com um bom contraste entre as áreas extracelulares e intracelulares. - Para acompanhar as mudanças de pH em um campo de vista microscópico ao longo do tempo, marcar o xy-posição no microscópio software ( "Stage e Controle Focus" → "Mark Pos") e tomar imagens repetidas em momentos consecutivos ( "Control Scan" → " Solteiro"). tomar regularmente imagens com a potência do laser fixada em zero por subtração de fundo.
4. Análise de Imagem Digital
- para export as imagens microscópicas como arquivos TIF, use o lote exportação do arquivo do software microscópio ( "Macro" → "Batch File Export"). Marque os arquivos a serem exportados e salvar imagens dos canais vermelho e verde em pastas separadas como TIF-arquivos ( "Start Batch Export"). Renomear os arquivos em ambas as pastas, dando-lhes números sequenciais.
- Importar a série de imagens vermelho e verde em um software como o daime (análise de imagem digital em ecologia microbiana) 14. Segmento as imagens dos canais verdes com limiares escolhidos individualmente brilho (segmento → segmentação → limiar automático personalizado). Escolha os limiares de brilho com cuidado (tipicamente entre 20 e 80), de modo a que todas as bactérias (mais brilhante do que a matriz extracelular), mas não a matriz será reconhecido como objectos durante segmentação. Verificar visualmente se as regiões reconhecidas como objectos correspondem bem ao biomassa bacteriana.
- Transferir a camada de objeto do g segmentadaimagens reen canal para o canal vermelho imagens correspondentes (segmento → camada objecto de transferência). Use a função de editor de objetos para rejeitar e excluir todos os objetos nas imagens dos canais vermelho e verde. Agora, apenas a matriz extracelular é deixado nas imagens de biofilme. Exportar a série de imagens processadas como arquivos TIF.
- Importar a série de imagem em ImageJ (http://rsb.info.nih.gov/ij; v.1.47). Determinar a intensidade média de fluorescência nas imagens de fundo tomadas com o laser desligado (Analisar → Histograma). Subtrair o fundo adequado a partir das imagens vermelhas e verdes (Processo → Math → Subtrair).
- Ainda em ImageJ, divida a série de imagens verde (G1) por si só (Processo → calculadora de Imagem). Em seguida, multiplique a série imagem resultante (G2) com a série de imagens verde (G1). Isto irá produzir uma série de imagens (G3), onde NaN é atribuído a todos os pixels pertencentes a áreas que foram reconhecidos como objetos em daime. Proceda tele mesmo modo com a série de imagens vermelho (R1 / R1 = R2; R2 x R1 = R3).
Observação: Como a biomassa bacteriana foi removido a partir das imagens no passo 4.3, a intensidade fluorescente é 0 nestas áreas. Etapa 4.5 é necessário para converter o valor de 0 a NaN, o que permite o cálculo proporção no passo 4.6. - Aplique o filtro 'média' (Processo → Filtros → Média; raio: 1 pixel) para compensar o ruído detector. Divida a série de imagens verde pela série imagem vermelha (Processo → calculadora de Imagem). Isto resulta numa proporção verde / vermelho para todos os pixels restantes no espaço extracelular das imagens. Use falsa coloração para representação gráfica das proporções nas imagens (Tabelas Imagem → Lookup). Calcular a relação média para cada imagem (Analisar → Histograma).
- Converter os rácios de verde / vermelho para valores de pH de acordo com a função instalado sob 1.9.2). Nota: Um exemplo para dados de calibração e curva ajustada pode ser visto na Schlafer etal, 2015 11.
Resultados
O método apresentado permite a monitorização extracelular pH cai em diferentes microambientes de biofilmes dentais na gama de pH de 4,5 a 7, em tempo real. Se as condições experimentais são escolhidas como descrito acima, o pH começa a cair em todas as áreas dos biofilmes logo após a exposição à glicose.
Quando o pH em um biofilme gotas, as células bacterianas se tornam visíveis dentro de pouco tempo (<1 min),...
Discussão
Monitorização microscópica de pH biofilme proporciona várias vantagens, como comparado com eléctrodos ou microeléctrodos 4-6 medições. técnicas microscópicas permitir determinar pH com uma alta resolução espacial e permitir a captura gradientes de pH horizontais e verticais em biofilmes sem perturbar o biofilme mecanicamente. As tentativas anteriores de monitoramento do pH microscópico, no entanto, não conseguiram diferenciar entre pH extracelular e intracelular no biofilme 1,7,9. Dev...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Os autores gostariam de agradecer a Javier E. Garcia e Lene Grønkjær de assistência técnica e Merete K. Raarup para discussões frutíferas. Este trabalho foi financiado pelo Aarhus University Research Foundation eo Simon Spies Foundation.
Materiais
| Name | Company | Catalog Number | Comments |
| Zeiss LSM 510 META | Zeiss | N/A | |
| C-Apochromat 63X water immersion objective | Zeiss | N/A | |
| XL Incubator | PeCON | N/A | |
| SNARF-4F 5-(and-6)-Carboxylic Acid | Life Technologies | S23920 | |
| Dimethyl sulfoxide | Life Technologies | D12345 | |
| HEPES | Life Technologies | 11344-041 | |
| Costar 96-well black clear-bottom plate | Fisher Scientific | 07-200-567 | |
| Custom-made glass slabs (4 x 4 x 1 mm3; 1,200 grit) | Menzel | N/A | |
| Alginate impression material | GC Corporation | N/A | |
| Acrylic Adjusting Logic Sets/set of acrylic dental burs | Axis Dental | LS-906 | |
| Orthodontic retainer containers | Spark Medical Equipment Co., Ltd | SK-WDTC01 | |
| Sticky wax | Dentsply | N/A | |
| Chewing paraffin wax | Ivoclar Vivadent AG | N/A | |
| Dithiothreitol | Sigma Aldrich | D0632 | Used during preparation of salivary solution |
| 0.45 µm and 0.2 µm syringe filters | Sigma Aldrich | CLS431220; CLS431219 | |
| daime | University of Vienna, Austria | http://dome.csb.univie.ac.at/daime | |
| ImageJ | NIH, Bethesda, Maryland, USA | http://imagej.nih.gov/ij/ |
Referências
- Hunter, R. C., Beveridge, T. J. Application of a pH-sensitive fluoroprobe (C-SNARF-4) for pH microenvironment analysis in Pseudomonas aeruginosa biofilms. Appl. Environ. Microbiol. 71 (5), 2501-2510 (2005).
- Takahashi, N., Nyvad, B. Caries ecology revisited: microbial dynamics and the caries process. Caries Res. 42 (6), 409-418 (2008).
- Schlafer, S., et al. pH landscapes in a novel five-species model of early dental biofilm. PLoS. One. 6 (9), e25299 (2011).
- von Ohle, O. C., et al. Real-time microsensor measurement of local metabolic activities in ex vivo dental biofilms exposed to sucrose and treated with chlorhexidine. Appl. Environ. Microbiol. 76 (7), 2326-2334 (2010).
- Revsbech, N. P. Analysis of microbial communities with electrochemical microsensors and microscale biosensors. Methods Enzymol. 397, 147-166 (2005).
- Vanhoudt, P., Lewandowski, Z., Little, B. Iridium oxide pH microelectrode. Biotechnol. Bioeng. 40 (5), 601-608 (1992).
- Franks, A. E., et al. Novel strategy for three-dimensional real-time imaging of microbial fuel cell communities: monitoring the inhibitory effects of proton accumulation within the anode biofilm. Energy & Environmental Science. 2 (1), 113-119 (2009).
- Hidalgo, G., et al. Functional tomographic fluorescence imaging of pH microenvironments in microbial biofilms by use of silica nanoparticle sensors. Appl. Environ. Microbiol. 75 (23), 7426-7435 (2009).
- Vroom, J. M., et al. Depth penetration and detection of pH gradients in biofilms by two-photon excitation microscopy. Appl. Environ. Microbiol. 65 (8), 3502-3511 (1999).
- Bender, G. R., Sutton, S. V., Marquis, R. E. Acid tolerance, proton permeabilities, and membrane ATPases of oral streptococci. Infect. Immun. 53 (2), 331-338 (1986).
- Schlafer, S., et al. Ratiometric imaging of extracellular pH in bacterial biofilms using C-SNARF-4. Appl. Environ. Microbiol. 81 (4), 1267-1273 (2015).
- Dige, I., Nilsson, H., Kilian, M., Nyvad, B. In situ identification of streptococci and other bacteria in initial dental biofilm by confocal laser scanning microscopy and fluorescence in situ hybridization. Eur. J Oral Sci. 115 (6), 459-467 (2007).
- de Jong, M. H., van der Hoeven, J. S., van OS, J. H., Olijve, J. H. Growth of oral Streptococcus species and Actinomyces viscosus in human saliva. Appl. Environ. Microbiol. 47 (5), 901-904 (1984).
- Daims, H., Lucker, S., Wagner, M. daime, a novel image analysis program for microbial ecology and biofilm research. Environ. Microbiol. 8 (2), 200-213 (2006).
- Liu, Y. L., Nascimento, M., Burne, R. A. Progress toward understanding the contribution of alkali generation in dental biofilms to inhibition of dental caries. Int. J Oral Sci. 4 (3), 135-140 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados