Method Article
Multi-exão Ignorando usando oligonucleotídeos antisense Cocktail na distrofia muscular canina ligada ao X
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Exon pular é atualmente uma opção terapêutica mais promissora para a distrofia muscular de Duchenne (DMD). Para alargar a aplicabilidade para pacientes com DMD e para optimizar a estabilidade / função das proteínas distrofina truncados resultantes, um multi-exão abordagem pular utilizando oligonucleótidos anti-sentido de cocktail foi desenvolvido e demonstramos salvamento distrofina sistémico num modelo de cão.
Resumo
Distrofia muscular de Duchenne (DMD) é uma das doenças genéticas letais mais comuns em todo o mundo, causadas por mutações no gene da distrofina (DMD). Exon pular emprega DNA curta moléculas / RNA-like chamados oligonucleotídeos antisense (AONs) que restaurar o quadro de leitura e produzem proteínas mais curtas, mas funcionais. No entanto, a terapia salto de exon enfrenta dois grandes obstáculos: aplicabilidade limitada (até apenas 13% dos pacientes podem ser tratados com uma única droga AON), e função incerta de proteínas truncadas. Estas questões foram abordadas com uma abordagem cocktail AON. Enquanto que cerca de 70% dos pacientes com DMD podem ser tratados por uma única exon (todos os exões combinados), pode-se potencialmente o tratamento de mais do que 90% dos pacientes com DMD se exão múltiplos saltando o uso de drogas anti-sentido cocktail pode ser realizado. A distrofia muscular de canino (CXMD) modelo de cão ligada ao X, cujo fenótipo é mais semelhante aos pacientes de DMD humanos, foi utilizado para testar a effic sistémicaACY e segurança dos skipping multi-exão de exons 6 e 8. modelo de cão O CXMD abriga uma mutação de recomposição no intrão 6, levando a uma falta do exão 7 em mRNA de distrofina. Para restaurar o quadro de leitura CXMD requer pular multi-exão de exons 6 e 8; portanto, CXMD é um bom modelo animal de médio porte para testar a eficácia e segurança de salto multi-exão. No estudo atual, um coquetel de morpholinos antisense alvo exão 6 e exon 8 foi projetado e restaurado a expressão de distrofina nos músculos esqueléticos wide-body. Os métodos para a transfecção / injecção de oligos cocktail e avaliação da eficácia e segurança de skipping de multi-exão no modelo de cão CXMD são apresentados.
Introdução
Distrofia muscular de Duchenne (DMD) é uma doença muscular recessiva ligada ao X caracterizada por fraqueza muscular progressiva, descrita pela primeira vez pelo Dr. Guillaume-Benjamin-Amand Duchenne (de Boulogne) 1. DMD é uma doença genética comum que afeta cerca de 1 em cada 3.500 meninos em todo o mundo, com cerca de 20.000 crianças afetadas nascidas a cada ano 2,3. O desenvolvimento motor é atrasada e distúrbios da marcha são vistos na primeira infância 4, seguido por dependência de cadeira de rodas por volta dos primeiros anos da adolescência. A morte geralmente ocorre entre as idades de 20 e 30, devido a insuficiência respiratória ou cardíaca 5-8. Atualmente, não há cura para a DMD. O tratamento com glicocorticóides pode retardar a progressão da degeneração muscular em algum grau, mas está associada a efeitos colaterais significativos, incluindo a obesidade e diabetes mellitus 2,7,8. DMD resulta de mutações no gene da distrofina (DMD), levando a uma perda de protei distrofina funcionaln. DMD é um gene extremamente grande com mais de 2 milhões de pares de bases e 79 exões 9,10. Deleção, absurdo, e duplicação mutações que conduzem a mutações fora do quadro são a causa mais comum do fenótipo DMD. As regiões de exões 3 - 9 exões e 45 - 55 são denominados "pontos quentes" de mutação como a maioria dos pacientes têm mutações de deleção dentro destas porções do gene, conduzindo a distrofina não funcional em pacientes com DMD 3,9,11-16. distrofina funções dentro do complexo da glicoproteína distrofina (DGC), que tem um papel importante na estabilização da membrana muscular. A N- e C-terminais são os domínios mais importantes para a função, enquanto que o domínio da haste central desempenha um papel menos importante 3,9,17. A observância de um fenótipo leve associado com distrofia muscular de Becker (BMD), que em sua maioria resulta de mutações em-frame dentro do gene DMD, inspirou a aplicação do exão pular para o tratamento da DMD. pacientes BMD têm um reduzido, mas functional, a proteína distrofina que mantém ambos os terminais 3,6,18. Exon skipping, em teoria, pode restaurar a grelha de leitura, resultando em proteínas funcionais distrofina encurtados-but-semelhantes aos observados na DMO 3,19.
Vários tipos de oligonucleótidos anti-sentido (AONs) foram testadas em ensaios clínicos, incluindo fosforotioatos 2'-metilados (2'OMePS) e oligómeros fosforodiamidato morfolino (PMOs). Ignorando exons 51 e 53 usando estes AONs foi examinado e enquanto os resultados são promissores,-exão única skipping tem aplicabilidade limitada, uma vez que é de 3, 19, 20,21, 22-26 específicos de mutação. Perguntas também permanecem sobre a estabilidade das proteínas encurtadas distrofina resultantes produzidos a partir de um único salto de exon 22,23. Além disso, alguns pacientes necessitam de mais do que um único exão deve ser omitido, a fim de restaurar a grelha de leitura 3. Embora tecnicamente mais difícil, multi-exon skipping é um método quepoderia resolver esses problemas 3,19. Multi-exon skipping foi anteriormente demonstrada em cães distrófica e linhas de células humanas in vitro. Além disso, mdx52 modelos de ratinho e de cão canino ligados ao X distrofia muscular (CXMD) foram utilizados para estudos in vivo em 22, 24-27. Canine distrofia muscular ligada ao X Japan (CXMD J) beagles foram usados aqui, como o quadro de leitura CXMD J pode ser restaurado por skipping multi-exão de exons 6 e 8, ou exons adicionais (por exemplo, exons 3-9) (Figura 1). Baseado no Beagle CXMD compartilha o mesmo padrão de mutação como o modelo Golden Retriever distrofia muscular (GRMD), mas beagles são menores e mais barato de manter devido ao seu tamanho corporal, proporcionando assim um modelo útil para DMD 28,29. Cães CXMD imitar mais de perto o fenótipo DMD humana do que modelos animais menores, como roedores, e são mais confiáveis para as avaliações toxicológicas 3,22,30,31 (Figura 2). cães CXMD apresentar deterioração progressiva do músculo, distúrbios da marcha, e problemas respiratórios e cardíacos semelhantes aos observados em DMD. Comparado com saltar-exão única, multi-exon skipping é aplicável a uma proporção muito maior de pacientes. Entre os três tipos de mutação mais comum (deleções, absurdo, e duplicações), 80-98% dos pacientes poderiam ser tratados através de multi-salto de exon 14,32,33, enquanto que 45% de todos os pacientes com DMD pode se beneficiar de especificamente pular exons 45 - 55 3,19,22,34.
Com o desenvolvimento de morfolinos modificados, a eficiência de cocktails AON a facilitar exon melhorou. Arginina-ricos PMOs peptídeo conjugado de penetração celulares (PPMOs), e in vivo-morpholinos (vPMOs) são produtos químicos AON que melhoraram significativamente a capacidade e estabilidade 3,35-38 de penetração celular. Subsistem as preocupações de longo prazo toxicidade AON; no entanto, progressos significativostem sido feito. Modificações químicas feitas morpholinos diminuir consideravelmente efeitos fora do alvo e estudos pré-clínicos têm relatado nenhum efeito tóxico significativas 3,22,39,40. Um desafio restante para pular de multi-exão é o requisito de corrente para cada um dos AON para ser testado quanto à toxicidade sozinho, como uma única droga, em vez de juntos como um cocktail 3,19,22,41,42. Em estudos envolvendo DMD single e multi-salto de exon voltado para o coração, tem havido pouca melhoria no tecido cardíaco distrófica. A eficácia de morfolinos no coração é pensado para ser baixa devido à capacidade de penetração celular pobre. PPMOs péptido conjugado melhorou a capacidade de AONs para penetrar nas células cardíacas, aumento da quantidade de proteína distrofina funcional resgatado no coração 3,19,38.
Aqui, a nossa abordagem cocktail AON é discutido em detalhe, incluindo a concepção de sequências de AON usando software ESEfinder 43. PROTOCols para experiências do cão com skipping multi-exão também são descritas. Beagles CXMD J foram utilizados para exons 6 e 8 experiências pular. Multi-exão pular no modelo de cão CXMD mostra resultados promissores, mas os desafios permanecem que precisam ser superados antes que eles são clinicamente aplicável.
Protocolo
Todos os protocolos listados abaixo estão em conformidade com as orientações de cuidados de animais estabelecidos pelo Centro Nacional de Neurologia e Psiquiatria (NCNP) no Japão. Todos os experimentos foram aprovados pelo Comitê Cuidado e Uso Institucional Animal do NCNP.
1. Projeto de antisense Oligos
- Use ESE de resgate e programas ESEfinder para detectar sites de ESE 44, 45-47.
- Design 25 pares de bases (pb) que são sequências anti-sentido para os exões que estão a ser visados. Exons alvo 6 e 8 no modelo de cão (Figura 1).
- Use 25 - 30 sequências pb para PMOs (Tabela 1) ou 25 pb para 2'OMePS. Para projetar 25 sequências pb, selecione sequências que estão dentro da região de destino. Considere estrutura secundária, evasão de heterodímeros, motivos potenciador exão splicing e conteúdo GC para criar sequências estáveis 43. AONs deve atingir, pelo menos, um dos locais ESE como identificado pelo sof supramencionadatware.
- Seleccionar AONs com um teor de GC que é inferior a 65%, com menos de 4 sequências consecutivas 'L' S, e não contêm auto-complementares. Use software Explosão NCBI para prever locais de recozimento off-alvo 22,48,49.
- Selecione uma adequada estrutura química AON. Para os experimentos in vitro usar oligonucleotídeos 2'-metilo (2'OMePS) ou morpholinos. Para os experimentos in vivo, use 2'OMePS, morpholinos ou vPMOs 3,19,48,50.
2. Em experimentos in vitro (exons 6 e 8 de salto no Modelo CXMD)
- 2'OMePS transfecção de mioblastos cão
- Culturas mioblastos CXMD em 3 ml de meio de crescimento em placas de 6 poços. Semente 1-5 x 10 3 células / cm2, com 0,5 ml / cm 2 de meio de mioblastos. Para o meio de crescimento, usar o meio de Eagle modificado por Dulbecco (DMEM) com 10% de soro fetal de bovino (FBS) e 1%penicilina / estreptomicina (P / S) 40.
- Incubar a 37 ° C até 60-80% confluentes. Isto leva cerca de 12 a 24 horas.
- Dilui-se um agente de transfecção catiónico lipossoma a um total de 100 uL em meio de soro reduzido (2: agente transfectante um rácio: AONs, por exemplo, 10 ul de lipofectina vs 5 ug AONs). Permitir mistura em repouso à temperatura ambiente durante 30 - 45 min.
- Diluir AONs (2'OMePS ou morpholinos) para um volume final de 100 uL em meio de soro reduzido.
- Combinar o agente de transfecção diluída com AONs diluído e incuba-se à temperatura ambiente durante 10 - 15 min.
- Enquanto a mistura agente de transfecção / AON está sentado à RT, retire a velha mídia a partir de células através de aspiração e lavar as células com a mídia.
- Adicionar 0,8 ml de mídia para a mistura de agente de transfecção / AON e depois adicionar toda a solução para as células recém-lavadas. Incubar durante 3 h a 37 ° C.
- Após incubação, substituir a mídia com Diferenciadmeios de iões (MS); diferenciação pode demorar até 10 dias. Verificar para ver se a diferenciação ocorreu começando por volta do dia 3. Os meios de diferenciação é DMEM com soro de cavalo a 2%, 200 U / ml de penicilina, 200 mg / mL de estreptomicina, e 10 ug / ml de insulina.
- Morfolino transfecção de mioblastos cão
- Cultura CXMD mioblastos em meio de crescimento como descrito na etapa 2.1.
- Mudar para meio de diferenciação (DM), e adiciona-se 0,1 mM de estoque morfolino a cada poço para tornar a concentração final de 1 uM. morpholinos cocktail de calor a 65 ° C durante 10 min antes da transfecção ou da injecção para evitar a agregação de AON. Adicionar um reagente de entrega péptido 39,51 e ajustar para uma concentração final de 3-6 uM.
- Depois de 16-48 h de incubação, coletar células para a extração de RNA. Adicionar 1 ml de ácido tiocianato de guanidina-fenol-clorofórmio para as células a separar as células da placa. Execute RNA extracção após este passo.
- Alternativamente, adicionar tripsina de modo a cobrir todas as células e incuba-se durante 2 min a 37 ° C.
Nota: Se a intenção é realizar imunoquímica, usar óculos de slides câmaras de cultura. Depois de diferenciação, as células podem ser fixados com paraformaldeído (PFA) (4% durante 10 min).
- Alternativamente, adicionar tripsina de modo a cobrir todas as células e incuba-se durante 2 min a 37 ° C.
- Extração de RNA e Transcrição Reversa de Reacção em Cadeia da Polimerase (RT-PCR)
- Uma vez que as células são diferenciadas em miotubos, remova médio e adicione 1 ml de ácido tiocianato de guanidina-fenol-clorofórmio; incubar durante 10 min à TA.
- Transferir para tubos de 1,5 ml. Combinam-se com 200 ul de clorofórmio e incubar à TA durante 2 min até três camadas separadas podem ser vistos. As três camadas de cima para baixo são: uma camada de ARN, uma camada de DNA, e uma camada de proteína.
- Centrifuga-se a 12000 × g durante 15 min a 4 ° C. Remover o sobrenadante camada superior e coloque em um tubo com 500 & #181; L de isopropanol (se parar aqui, armazenar-se o sobrenadante a -80 ° C). Centrifugar o sobrenadante a 12.000 × g durante 10 min a 4 ° C; após a centrifugação, manter o sedimento de ARN resultante e desprezar o sobrenadante.
- Lava-se a pastilha com etanol e centrifuga-se a 8000 xg durante 5 min a 4 ° C. Evapora-se o etanol residual por inversão do tubo, durante 15 minutos e, em seguida, adicionar 15 - 30 mL de água isenta de RNase. Quantificar a concentração de RNA total usando / VIS espectroscopia de US a 260 nm.
- Combinar os reagentes necessários para uma reacção de RT-PCR: 1,5 ul de 10 mM iniciador directo, 1,5 ul de 10 mM iniciador inverso, dNTPs 1 ul, 5 ul de uma etapa de tampão PCR kit, inibidor de RNase 0,7 ul, 1 ul de mistura de enzimas a partir de um- passo estojo de PCR, e 200 ng de ARN. Uma vez que estes tenham sido misturados, adicionar água até um volume final de 25 ul.
- Coloque a mistura de um termo-cycler. Executar um ciclo de 30 min a 50 ° C, a 15 min0; ciclo a 95 ° C, depois 35 ciclos de 94 ° C durante 1 min, 60 ° C durante 1 min, e 72 ° C durante 1 min. Por último, executar um ciclo de 10 min a 72 ° C. Loja de produtos de PCR num frigorífico a 4 ° C ou -20 ° C
- O DNA complementar (cDNA) Sequenciação
- Identificar exão 6 - bandas de 9 ignorados usando eletroforese em gel de agarose. Carga de 5 ul de cada amostra para os poços de um gel de agarose a 1,5%, são executados 135 V através do gel durante 5 minutos e depois 120 V durante 20 min. Em seguida, a incubação do gel em gel de mancha de ADN à temperatura ambiente durante 30 min. Visualizar as bandas que usam software de imagem.
- Extirpar a banda de interesse usando um kit de extracção de gel.
- Excisar o fragmento de DNA e solubilizar a fatia de gel utilizando 200 mL NTI / 100 gel mg. Deixe este sentar-se por 5 a 10 min num banho de água a 50 ° C. Em seguida, transferir à sílica tubo de membrana.
- Centrifugar a 11.000 xg durante 30 segundos. Lave duas vezes com 700 tampão NT3 ul antes centrifuging novamente a 11000 xg durante 30 seg.
- Seca-se a membrana de sílica por centrifugação a 11000 xg durante 1 min.
- Adicionar 15 - tampão NE 30 ul e deixe-o sentar-se à RT durante 1 min. Em seguida, centrifugar a 11000 xg durante 1 min. Remover o gel de sílica e manter o conteúdo do tubo.
- Usar um kit de sequenciação para determinar a sequência de acordo com o protocolo do fabricante.
3. intramusculares injeções ou Abrir biópsia muscular
- Para a manutenção de condições estéreis durante a cirurgia sobrevivência, remover o cabelo usando cortadores na área em torno do local da cirurgia (membro posterior). Use iodóforos ou de cloro como desinfetante. Use cortinas estéreis para o sítio cirúrgico, colocando e prendendo-os ao longo de todo o animal e mesa de operação.
- Desgaste esfrega limpas, máscaras, cobrir a cabeça, luvas estéreis e sapatos especiais para a sala de cirurgia 52,53.
- Injectar cães CXMD com 20 mg / kg de tiopental sódico para anestesiar-los. Use vet pomada sobre os olhos para evitar que os olhos sequem.
- Use 2-3% inalação de isoflurano para manter a anestesia geral (Figura 3). Verifique reflexos musculares e monitorar coração e taxa de respiração para avaliar a profundidade da anestesia. A taxa normal de respiração (RR), frequência cardíaca (FC), SpO2 sob anestesia geral são as seguintes: RR: 10 - 20 respirações / min; SpO2: 95 - 100%, HR: 80 - 120 batimentos por minuto (bpm).
- Utilizando um bisturi, cortar a pele sobre o crânio tibial (CT), também conhecido como o músculo tibial anterior (TA), e faz um único corte longitudinalmente cerca de 5 cm (para cães adultos jovens). Para marcar os locais de injecção, ponto a fáscia profunda usando uma agulha cirúrgica e fio cirúrgico e fazer dois marcadores de pontos com intervalos de 2 cm.
- Injectar a concentração desejada de AONs no músculo com uma agulha 27 G. A concen desejadotração varia entre as condições de tratamento. Para CT, dar duas injecções de 1 ml de volume cada, para um total de 1,2 mg de PMOs cocktail (0,4 mg cada PMO) ou 0,4 mg de vPMOs cocktail (0,13 mg cada vPMO). Para o músculo extensor do membro anterior ulnar do carpo (ECU), injectar dois volumes de 0,5 ml de cada para um total de 1,2 mg de cocktail PMOs (0,4 mg cada PMO) ou 0,4 mg de cocktail vPMOs (0,13 mg cada vPMO). Deixe o na agulha durante 1 min. Use uma quantidade igual de cada AON para o cocktail.
- Efectuar biopsia muscular abertos pela remoção de uma peça de tecido do músculo de aproximadamente 2 cm de comprimento a partir do músculo CT usando um bisturi cirúrgico.
- Vá para o passo 6.5 para preparação de amostras do músculo.
- Usando uma agulha, administrar uma injecção intramuscular de 0,02 mg / kg de cloridrato de buprenorfina antes de despertar de anestesia geral. Lay fáscia muscular e da pele por cima do músculo e costurar-los usando um fio 3-0 fio absorvível e 3-0 nylon para fascia muscular e fechamento da pele, respectivEly.
- Enquanto mantém a boca aberta, determinar se o reflexo da mordaça voltou; quando o reflexo da mordaça voltou, extubação o cão.
- Administrar 15 a 30 mg / kg de cefazolina ou cefalexina (antibióticos) durante até 3 dias através de injecção intravenosa ou intramuscular para evitar a infecção.
- Remover suturas dentro de sete dias. Não deixe o cão sozinho até que ele recuperou a consciência suficiente para manter decúbito esternal e não permitir que o cão para interagir com outros animais até uma recuperação completa é feita. Mantenha os tubos endotraqueais no lugar o maior tempo possível e removê-los quando o animal começa a mastigar ou engolir. Monitorar o animal frequência cardíaca, respiração e hidratação para se certificar de que eles são estáveis e dentro dos limites normais.
- Para os cuidados pós-cirurgia, proporcionar analgesia durante 3 dias (por exemplo, buprenorfina 0,01 mg / kg) e apoio de enfermagem, incluindo um silencioso, escuro lugar de descanso, ferida adequada e manutenção curativo, um softsuperfície de apoio, reidratação com fluidos oral ou parenteral, e um retorno à alimentação normal através do uso de alimentos altamente palatáveis ou guloseimas. Se quaisquer animais requerem a medicação adicional, dar uma injecção intramuscular de 0,3 mg / kg de tartarato de butorfanol, dependendo dos sintomas de dor.
Nota: Cães em dor pode morder, arranhar ou proteger regiões dolorosas e, se tratada, pode ser extraordinariamente apreensivos ou agressivo. Além disso, a dor em um membro geralmente resulta em claudicação ou segurando-up do membro afetado com as tentativas de usá-lo. Em tais situações, dar uma injecção intramuscular de 0,02 mg / kg de cloridrato de buprenorfina cada 6-8 hr.
4. As injeções sistêmicas
Nota: Este procedimento pode ser repetido semanalmente ou quinzenalmente para o número desejado de semana.
- Contenha cães manualmente e com cuidado, obtendo o cão para se deitar e depois armar braços sobre os ombros e quadris para manter o cão no lugar durante todo tprocedimento ele.
- Injectar AONs; 120 - PMOs 240 mg / kg de cocktail (40 - 80 mg cada AON) utilizando uma agulha de habitação venosa na veia do membro (conhecido como um cefálica ou uma veia safena). A quantidade de AON injectada depende da condição experimental. Use uma quantidade igual de cada AON para o cocktail.
- Usar uma bomba de infusão ou seringa para injectar condutor total de 50 ml a uma taxa de 2,5 ml / min durante 20 min, seguindo as instruções do fabricante. injecções repetidas semanal ou quinzenal (a cada duas semanas), pelo menos, 5 vezes, enquanto a expressão de distrofina se acumulam com injecções repetidas.
- Realizar exames de sangue semanalmente para analisar a toxicidade.
- Usando uma agulha, coletar 3 ml de sangue - 0,5 ml para hemograma completo (CBC) e 2,5 ml para os outros - a partir de uma das veias subcutâneas da frente ou dos membros posteriores. Incluir CBC, gama-glutamil transferase (GGT), aspartato aminotransferase (AST), ureia (BUN), aminotra alaninansferase (ALT), creatina quinase (CK), e as avaliações de creatinina ao testar o sangue coletado, seguindo as instruções do fabricante de kits de teste de sangue 40,54.
5. A classificação clínica de cães
- Configurar uma câmera de vídeo e comportamento do cão registro e da marcha. Grave todo o encontro com o cão, pois isso irá funcionar como uma referência quando classificação o cão; Isso significa que cada vídeo será um comprimento diferente de acordo com as habilidades e vontade do cão. Use parâmetros de gravação padrão. As filmagens cria um registro da classificação para que possa ser revista numa data posterior.
- Grau de marcha e movimento distúrbios.
- Para marcha e movimento distúrbios, utilize os seguintes tipos:
grau 1 = nenhum, grau 2 = sentado com pata traseira estendida, grau 3 = coelho-lúpulo com membros posteriores, grau 4 = baralhar a pé, e o grau 5 = incapaz de andar. - Para perturbação mobilidade, utilize os seguintes graus: grau 1 = nenhum, grade 2 = deitada mais do que o normal, grau 3 = não pode saltar sobre membros posteriores, grau 4 = dificuldade crescente movendo-se, e o grau 5 = incapaz de se levantar e se mover.
- Para marcha e movimento distúrbios, utilize os seguintes tipos:
- Tempo quanto tempo leva o cão a correr 15 m. Medir 15 m, coloque o cão na linha de partida e incentivá-la a funcionar até que a marca de 15 m.
- Determinar a atrofia muscular do membro com a seguinte escala de classificação:
grau 1 = nenhum, grau 2 = dureza suspeito, de grau 3 = pode sentir a dureza ou parece fina, grau 4 = entre graus 3 e 5, e o grau 5 = extremamente fina ou disco. - Grade babando com a seguinte escala: grau 1 = nenhum, grau 2 = ocasionalmente dribla saliva quando sentado, de grau 3 = algum baba quando comer e beber, grau 4 = cordas de baba quando comer ou beber, e grau 5 = baba contínua.
- Grade hipertrofia da língua (macroglossia), utilizando a seguinte escala: grau 1 = nenhum, grau 2 = ligeiramente alargada, de grau 3 = outsi estendidade dentição, grau 4 = alargada e engrossar e grau 5 = alargada e engrossar.
- Grade capacidade do cão de engolir utilizando a seguinte escala: grau 1 = nenhuma dificuldade, grau 2 = leva tempo e esforço, tendo em alimentos, grau 3 = dificuldade em tomar o alimento de um prato, grau 4 = dificuldade na mastigação, deglutição, ou beber e grau 5 = incapaz de comer.
- Calcule nota total pela soma das pontuações de cada categoria (exceto para o teste de corrida de 15 m) 55.
Nota: Os estudos devem ser cego para não introduzir viés.
6. Imagem por Ressonância Magnética (MRI)
- Use a 3 Tesla (3T) MRI e / 18 cm de comprimento bobina extremidade humana 18 cm de diâmetro para obter imagens ponderadas em T2 de hind-membros.
- Anestesiar os animais por injecção de cães CXMD com 20 mg / kg de tiopental. Use vet pomada sobre os olhos para evitar que os olhos sequem. Use 2-3% inalação de isoflurano para manter a anestesia geral.
- Verifique reflexos musculares e monitorar coração e taxa de respiração para avaliar a profundidade da anestesia. A taxa normal de respiração (RR), frequência cardíaca (FC) e SpO2 sob anestesia geral são as seguintes: RR: 10 - 20 respirações / min, SpO2: 95 - 100%, HR: 80 - 120 batimentos por minuto (bpm ).
- Use as seguintes configurações para obter imagens ponderadas em T2: TR / TE = 4.000 / 85 ms, espessura de corte = 6 mm, fatia gap = 0 mm, campo de visão = 18 cm x 18 cm, tamanho de matriz = 256 x 256, e número de aquisições = 3 durante spin echo rápido (Figura 4).
7. Muscle Amostragem e Preparação (necropsia)
Nota: devem ser amostradas Músculos uma ou duas semanas após a última injecção de AON.
- Injectar cães com 20 mg / kg de tiopental de sódio para anestesiar-los. Use vet pomada para os olhos durante a anestesia para evitar a secagem dos olhos.
- Use 2-3% inalação de isoflurano para manter a anestesiatesia. Verifique reflexos musculares e monitorar coração e taxa de respiração para avaliar a profundidade da anestesia. A taxa normal de respiração (RR), frequência cardíaca (FC) e SpO2 sob anestesia geral são as seguintes: RR: 10 - 20 respirações / min; SpO2: 95 - 100%, HR: 80 - 120 bpm.
- Eutanásia cães por sangria sob anestesia geral (apenas para necropsia). Use exsanguinação sob anestesia geral profunda para evitar os efeitos causados por factores derivados do sangue na análise molecular (por exemplo, músculos cardíacos).
- Dissecar os seguintes músculos (Figura 5): CT, extensor longo dos dedos (EDL), femoral gastrocnêmio, sóleo, bíceps femoral, reto, bíceps braquial, tríceps braquial, deltóide, ECU, extensor radial do carpo (ECR), flexor ulnar do carpo (FCU ), flexor radial do carpo (FCR), gracilis, intercostal, músculos abdominais, diafragma, dorsi lateral, esôfago, esternocleidomastóideo e coração. Para examinar a toxicidade, recolher nos rins e liamostras Ver. Use Evans e Alexander de Lahunta (2009) como referência para a técnica de dissecção 56.
- Corte o CT, EDL, gastrocnêmio, sóleo, bíceps femoral, reto femoral, bíceps braquial, tríceps braquial, deltóide, ECU, ECR, FCU, FCR, gracilis, intercostal, músculos abdominais, dorsi lateral, esôfago, esternocleidomastóideo, coração, rim, e fígado em pequenas secções aproximadamente 1-1,5 cm de comprimento. Rolar o diafragma para cima e depois cortá-la em 1 - 1,5 cm seções 56.
- Coloque goma de tragacanto de modo que é de aproximadamente 0,5 - 1 cm de espessura sobre discos de cortiça. discos de etiqueta com o nome de identificação e do músculo do animal, no lado oposto da goma de tragacanto.
- Coloque músculos com o seu eixo longitudinal perpendicular ao cortiça na goma de tragacanto.
- Coloque as rolhas em um recipiente de isopentano que está sentado em azoto líquido. Movê-lo constantemente com uma pinça para 1 min ou até que esteja completamente congelado. músculos armazenam em rolhasem frascos a -80 ° C. Ao transportar, colocar os frascos em gelo seco.
- Preparar lâminas de vidro marcados com animais nome de identificação / muscular e data.
- Em um criostato arrefecido a -25 ° C, montar a cortiça para depor. Defina a espessura de corte para o nível desejado. Use 8 mm para imuno-histoquímica e 12 mm para hematoxilina e eosina (HE). Usar 15 | iM para as amostras de Western blot. Apare cerca de um quarto do músculo para obter um músculo liso para a amostragem muscular adequada.
- Cortar uma seção de músculo de cada vez, colocar cada seção 6º na mesma lâmina de vidro se o planejamento de usar amostras para imuno-histoquímica ou coloração HE. Se usando amostras de manchas de Western, colocar 30 - 40 partes em um tubo e armazenar a -80 ° C.
- Após a preparação das lâminas, as lâminas deixar secar durante 1,5 h à TA. Loja desliza a -80 ° C.
8. A imuno-histoquímica
- Retirar as lâminas preparadas de armazenamento e colocá-los emuma câmara de umidade para manter as lâminas separadas e manter a umidade. Encha a câmara de umidade para que o fundo está coberto com água (aproximadamente 1 mm de água).
- Ar seco durante 0,5 horas. Desenhe um quadrado encerrando a amostra muscular no slide usando uma caneta barreira hidrofóbica.
- Adicionar soro de cabra a 15% em solução salina tamponada com fosfato (PBS) e incuba-se durante 2 horas à temperatura ambiente Em reagente de bloqueio.
- Adicionar anti-distrofina domínio haste (DYS-1) do mouse anticorpo primário monoclonal, ou anticorpo monoclonal C-terminal (DYS-2) para a coloração distrofina cão (diluição 1: 150). Dilui-se usando um agente de bloqueio em 1,25 ml de PBS. Incubar O / N no frigorífico a 4 ° C.
- Lava-se com PBS durante 5 min, repetido três vezes. Adicionar 594 de anticorpo de cabra Alexa anticorpo secundário contra IgG1 de ratinho (por DYS-2) ou IgG2 (por DYS-1) (1: 2500). Dilui-se com um reagente de bloqueamento em PBS contendo 0,1% de etoxilato de octil fenol. Incubar por 0,5 horas à temperatura ambiente.
- Lava-se com PBS durante 5 min, três times. Permitir slides para secar. Adicionar 1 - 2 gotas (3 ng / ml) de 4 ', 6-diamidino-2-fenilindole (DAPI) solução de montagem. Com uma pinça, coloque um pedaço de vidro sobre o topo das seções, evitando bolhas.
- Ver dystrophin- (DYS-1 / DYS-2) fibras positivas sob um microscópio de fluorescência a 594 nm com ampliação de 20x.
9. Western Blotting
- Adicione seções musculares coletadas de crio-seccionamento para 150 mL de tampão de amostra em gelo.
- Usando um homogeneizador lado, homogeneizar brevemente as amostras de proteínas. amostras de calor num tubo de 1,5 ml numa incubadora bloco de aquecimento a 95 ° C durante 3-5 min. Centrifuga-se a 16500 × g durante 15 minutos e recolher o sobrenadante.
- Armazenar aliquotas do sobrenadante a -70 ° C. Use água destilada para diluir até 100x.
- Determinar a concentração de proteína usando um kit comercial de acordo com o protocolo do fabricante. Adicionar tampão Laemmli SDS-carregamento 2x com amostras e calor durante 3 min &# 160; a 95 ° C.
- Carregar amostras em 3-8% gel Tris-acetato antes de ser executado durante 3 h a 150 V. Incluem diversas amostras diluídas de tipo selvagem (WT) (por exemplo, 1%, 10%, e 50%) para a quantificação. Menos de 1% dos níveis WT distrofina deve ser detectada com este método.
- Colocar o gel em tampão de cátodo durante 20 min. Durante este tempo, tomar nove peças de papel de filtro e colocá-los nos buffers de transferência (3 papéis no tampão de cátodo [+], o tampão de ânodo ([-], e o tampão do ânodo concentrado [-], respectivamente) Este. descreve um método de transferência semi-seco, que aumenta a sensibilidade (Figura 6).
- Mergulhe uma membrana PVDF em metanol durante 20 segundos e, em seguida, colocar no buffer ânodo.
Defina-se o gel com a membrana de transferência semi-seca e permitir que ele seja executado 1,5 h a 400 mA em RT ou numa sala fria. - Lava-se a membrana com PBS. Incubar a membrana numa mistura de PBS com Tween 20 (PBST) e 5% de leite em pó durante 2 horas.
- Diluir DYS-1 (anticorpo primário) em PBST e 5% de mistura de leite em pó a uma diluição de 1: 100. Adicionar a membrana e deixou-se incubar durante pelo menos 1 h. Lavar três vezes com 100 ml de PBST, durante 15 min cada.
- Adicionar 65 uL / pista de anticorpo secundário conjugado com HRP (rato anti-IgG2a de DYS1) a 1: 5000 de diluição durante 1 hora à temperatura ambiente numa área escura. Em seguida, lava-se com três vezes com 200 ml de PBST, durante 20 min. Misturar as soluções de um kit de detecção de acordo com as instruções. Incubar durante 1 min.
- Desenvolver o filme para detectar bandas e analisar com o software ImageJ 48,57,58.
Resultados
As experiências in vitro
Os mioblastos foram transfectadas com várias condições de tratamento 2'OMePS, a fim de comparar a eficácia de cada AON. AON tratamentos individuais com 600 nM cada de Ex6A, Ex6B, Ex8A, ou Ex8B foram realizadas, bem como um tratamento de cocktail com 600 nM cada de todas as sequências de AON 4. As amostras de RNA foram colhidos quatro dias após transfecção. Após RT-PCR, as amostras para cada tratamento foram corridos num gel juntamente com amostras não tratadas (NT). Faixas mais altas no gel representam out-of-frame produtos DMD; essas bandas foram vistos em NT, Ex8A e Ex8B mioblastos tratados. Ex6A, Ex6B, Ex8A, e os mioblastos tratados com cocktail mostrou produtos em-frame. O cocktail e Ex6A / B apresentaram 100% de produtos in-quadro, enquanto Ex8A mostrou apenas 30% em-frame produtos (Figura 7). Para confirmar exclusão de exon e restauração dea grelha de leitura, foi realizada sequenciação de ADNc; os resultados indicaram que os exões 6-9 tinha de facto sido ignorado (Figura 7). A imuno-histoquímica mostrou que os cães tratados com AON tinha aumentado fibras distrofina-positiva em comparação com amostras de NT (Figura 8).
Em experimentos in vivo
Para comparar a eficácia de várias condições de tratamento de AON, cães CXMD (0,5 - 5 anos de idade) foram injectados com 1,2 mg uma vez Ex6A ou um cocktail de Ex6A, Ex6B, e Ex8A para várias dosagens. Duas semanas após a injecção, as amostras de músculo foram recolhidas e coradas com dis-1 para comparar o número de fibras distrofina-positiva. Todas as amostras tratadas com cocktail mostraram um aumento da expressão de distrofina em comparação com amostras NT. Fibras distrofina-positivas aumentou com a dosagem AON (Figura 9). seguinte sistemainjecção ic, do tipo selvagem (WT), NT, e amostras do músculo CXMD tratados com cocktail foram coradas com DYS-1 (Figura 10). cães CXMD tratados com cocktail mostraram aumento da expressão de distrofina em comparação com cães NT CXMD, tanto no CT e amostras do músculo cardíaco. No entanto, músculo esquelético tratados com AON (CT) mostraram muito mais elevados de expressão de distrofina em relação ao músculo cardíaco tratado. Um immunoblot comparando WT, NT, e vários músculos tratados com cocktail morfolino levaram à mesma conclusão. Houve também uma grande variedade de expressão de distrofina nas amostras do músculo esquelético tratadas (Figura 10). Hematoxilina e eosina (HE) revelou que tratados CXMD cães apresentaram melhoria da histopatologia, com uma diminuição significativa nas fibras centralmente-nucleadas (CNF), em comparação com os cães NT CXMD (Figura 11). Isto indica que há mais degeneração / regeneração ocorre no cão NT, um sinal de patologia muscular distrófica. Adicionalmente, os cães tratados tinham mais rápidocorrendo tempos e pontuações melhoradas na escala de classificação clínica. Cães CXMD tratados apresentaram melhores resultados do que os cães NT CXMD em todas as categorias (Figura 12).
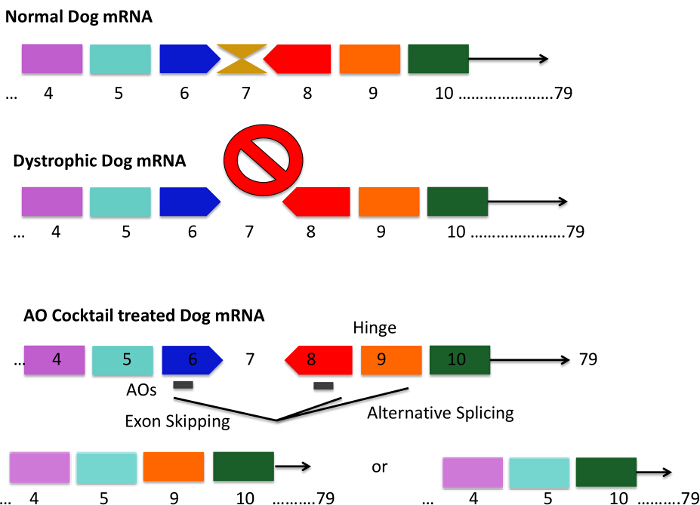
Figura 1. padrão de mutação do cão CXMD e exões 6 -. 8 Skipping estratégias utilizando um cocktail anti-sentido CXMD cães têm uma mutação pontual no exão 6 originando uma perda do exão 7 em ARNm cão distrófica. Isto resulta no ARNm estar fora de grelha e a produção de proteína distrofina é perdida. sequências de AON curtos são concebidos para se ligarem ao exão 6 e 8, que resulta em splicing do mRNA pular eficazmente exões 6 - 8. A barra cinza nos cães tratados com cocktail AON representa sequências de AON curtos. Exon 9 codifica um domínio dobradiça e é por vezes espontaneamente emendados com AONs contra o exão 6 e 8. Os códigos de mRNA resultante da distrofina proteínas que são mais curtos, mas a funçãoal. Por favor clique aqui para ver uma versão maior desta figura.
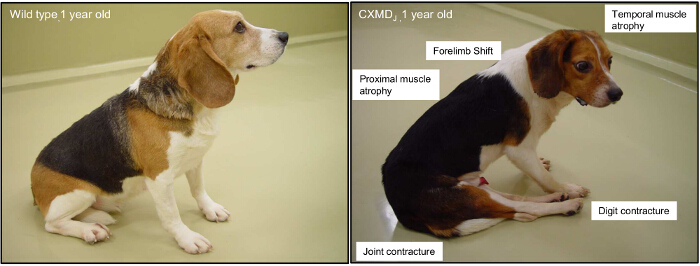
Figura 2. Principais sintomas clínicos de uma animal de 1 ano de idade canina ligada ao X Muscular de Duchenne (CXMD). A 1-year-old de tipo selvagem beagle e um cão CXMD são mostrados. O envolvimento de proximal, membro, e os músculos temporais são tipicamente observado a partir de 2 meses de idade. Contratura conjunta e um deslocamento da pélvis são ostensiva a partir de 4 meses de idade. Por favor clique aqui para ver uma versão maior desta figura.
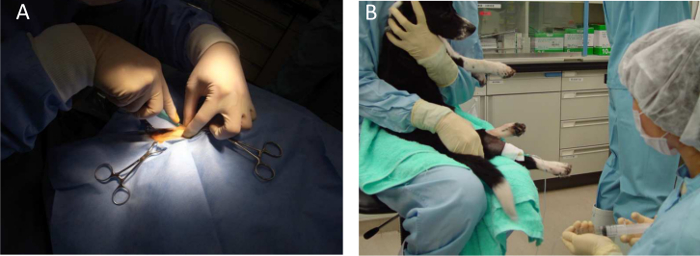
Figura 3. Anestesia Geral para um cão. A) Intramusculinjecções AR e biópsias musculares são realizadas sob anestesia geral com isoflurano. B) exploração do animal para injeções sistêmicas. Por favor clique aqui para ver uma versão maior desta figura.
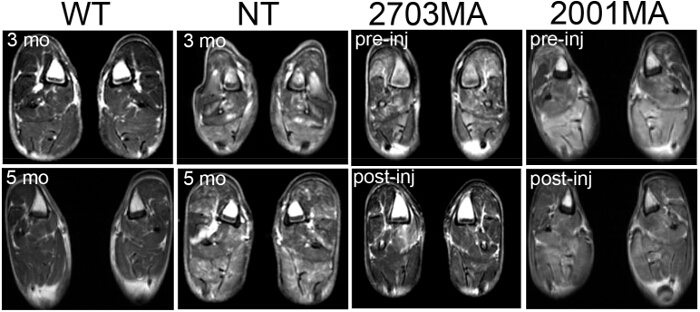
Figura 4. Imagem por Ressonância Magnética (MRI) do tipo selvagem, não-tratados CXMD, e tratado CXMD. Exames de ressonância magnética do membro posterior em 3 meses e 5 meses em cães WT e NT CXMD. Dois exemplos de imagens de tratados posteriores CXMD membros ressonâncias magnéticas pré-(1 semana antes da primeira injecção) e pós-injeção de AON são mostrados. 2703MA foi tratada semanalmente 7x com 200 mg / kg morpholinos cocktail. 2001MA foi tratada com injecção IV semanalmente 5x de 120 mg / kg morpholinos cocktail. Controle e cães tratados foram pareados por idade. cães tratados apresentam diminuição sinais T2. As imagens são adap ted com a permissão de Yokota et al. (copyright 2009, John Wiley & Sons) 40 Por favor, clique aqui para ver uma versão maior desta figura.
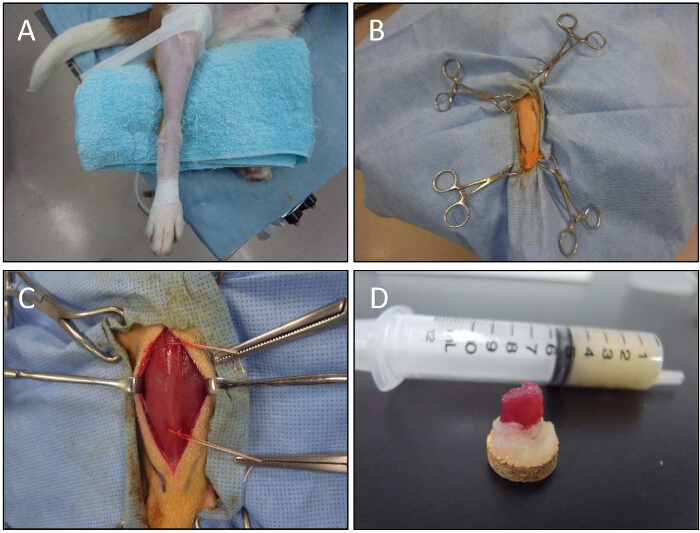
Figura 5. biópsia muscular Procedimento para um cão. A) Um membro inferior é fixado para biópsia muscular. B) Com a ajuda de fórceps, o membro inferior é realizada. C) O músculo CT é exposto. técnica de biópsia aberta é utilizado para obter amostras do músculo de sítios injectados. Tópicos são usados para armazenar amostras de biópsia. Amostras D) do músculo no goma adragante após a dissecação. Por favor clique aqui para ver uma versão maior desta figura.
/53776/53776fig6.jpg "/>
Figura 6. Método de transferência semi-seco. Uma representação do método de transferência semi-seca por transferência de Western são apresentados. Três papéis embebidos em tampão ânodo concentrado está previsto no terminal negativo; 3 papéis embebido em tampão de ânodo são empilhados em cima deste. O papel Mb PVDF é embebida em metanol e em seguida tampão de ânodo antes de ser colocada no topo das 6 papéis. O gel, que foi embebido em tampão de cátodo, é colocada delicadamente sobre o papel PVDF. Finalmente, 3 papéis embebidos em tampão de cátodo são colocados no topo do gel. O terminal positivo está situado no topo. Durante 1 hora, 400 mA é executado através do sistema. Por favor clique aqui para ver uma versão maior desta figura.
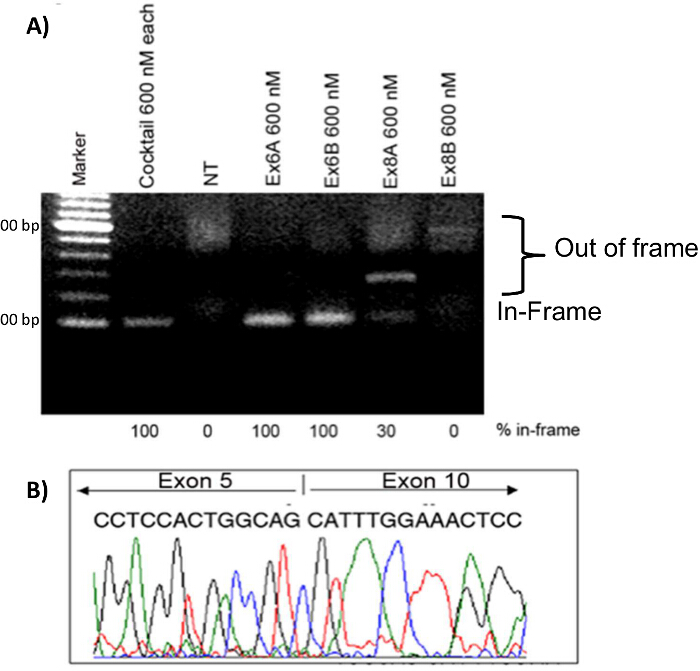
Figura 7. Exon Skipping em CXMD mioblastos. mioblastos CXMD foram transfectadas com Ex6A, Ex6B, Ex8A ou Ex8B sozinho, ou uma mistura de todos os quatro. Um total de 600 nm foi utilizado para as sequências individuais e para o cocktail foram utilizados 600 nM de cada sequência. A) 2'OMePS tratamento em mioblastos cão CXMD. Ex6A, Ex6B, e as amostras tratadas com cocktail mostram fortes bandas na posição esperada de transcritos de exão-ignorados em-quadro. Ex8A mostra uma banda intermediária, Ex8B mostra uma banda fraca, e NT não mostram uma banda na posição em grelha. B) sequenciação de cDNA a partir sozinho Ex6A, 4 dias após a transfecção. As imagens são adaptadas com permissão de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Por favor clique aqui para ver uma versão maior desta figura.

Figura 8. O aumento Dystrophin Expressão em 2'-metilados fosforotioato (2'OMePS) transfectadas CXMD mioblastos. mioblastos CXMD foram transfectadas apenas com Ex6A ou com 2'OMePS cocktail. DYS-2 (vermelho) e DAPI (azul) coloração são mostrados. Os mioblastos tratados são comparados com o tipo selvagem (WT) e mioblastos não tratadas (NT). As imagens são adaptadas com permissão de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Bar = 50 mm. Por favor clique aqui para ver uma versão maior desta figura.
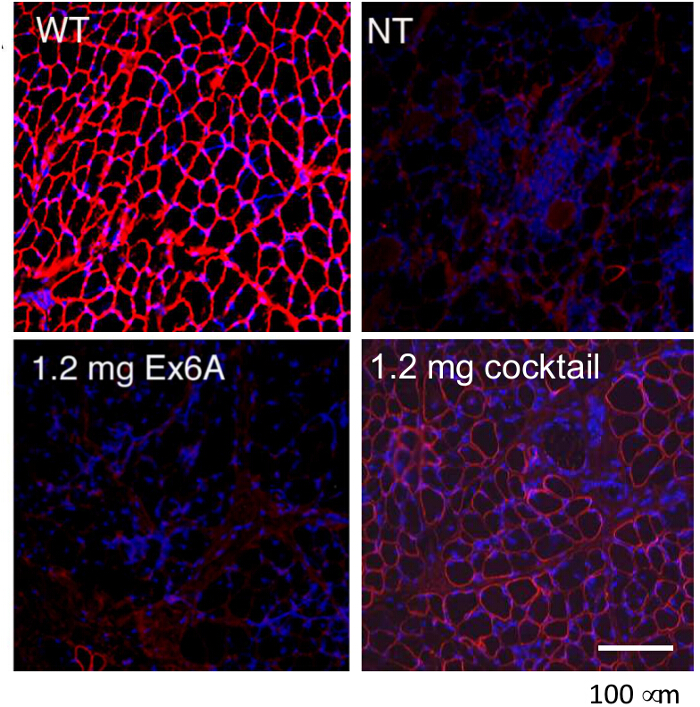
Figura 9. Resgate de distrofina Expression com intramuscular injeções de Morpholinos só em CXMD Dogs. Ou Ex6A ou um coquetel de Ex6A, Ex6B e Ex8A foram injetados nos músculos CT de cães CXMD. A distrofina (DSY-1) coloração de tipo selvagem(WT), não-tratado (NT), e os cães CXMD tratados são mostrados. Os cães ou foram tratados com 1,2 mg Ex6A sozinho ou 1,2 mg de cocktail. As imagens são adaptadas com permissão de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Bar = 100 mm. Por favor clique aqui para ver uma versão maior desta figura.

Figura 10. Aumento da expressão de distrofina Após Cocktail Systemic Morpholino tratamento em CXMD Dogs. Distrofina (DYS-1) coloração foi utilizado para comparar a expressão de distrofina no tipo selvagem (WT) (controle positivo), não-tratado (NT) (controle negativo), e cães CXMD tratados com 120 mg / kg de cocktail morfolino (40 mg / kg de cada AON). O cocktail morfolino contido Ex6A, Ex6B e Ex8A. Os cães foram injectados por via intravenosa 5 vezes nósekly com este cocktail. A) Uma comparação entre a expressão de distrofina em tibial cranial (CT) músculos do WT, NT, e cães tratados. B) A comparação da expressão de distrofina em tecido cardíaco entre NT e os cães tratados com cocktail morfolino. C) Immunoblot para distrofina com desmina como um controle de carga é mostrado para WT, NT, e os cães tratados com cocktail morfolino. Os seguintes músculos são mostradas para os cães tratados: tríceps braquial (TB), bíceps braquial (BB), o diafragma (DIA), esôfago (ESO), CT, adutora (ADD), extensor longo dos dedos (EDL), masseter (MAS), e no coração. As imagens são adaptadas com permissão de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Bar = 200 mm. Por favor clique aqui para ver uma versão maior desta figura.
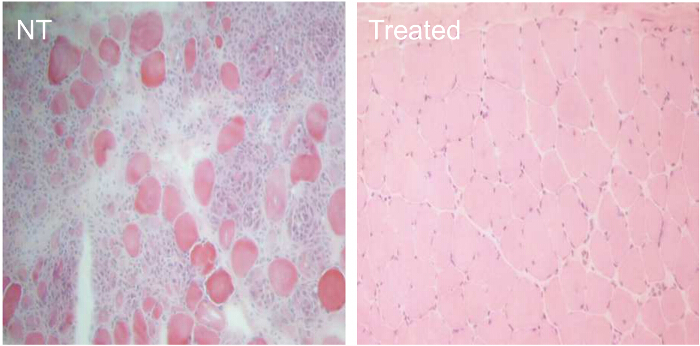
Figura11. Melhoria da histopatologia em CXMD cães tratados durante 7 semanas com 240 mg / kg Morpholino Cocktail. Cães CXMD que variam de metade de um ano a cinco anos de idade foram injectados por via intravenosa com 240 mg / kg morfolino cocktail (Ex6A, Ex6B e Ex8A) uma vez por semana durante 7 semanas. Catorze dias após a última injecção, os músculos do esófago foram tomadas e hematoxilina e eosina (HE) foi feito. Coloração HE dos músculos do esôfago de não-tratadas (NT) e morfolino cocktail-tratada (tratado) cães CXMD (40X lente objetiva). Por favor clique aqui para ver uma versão maior desta figura.
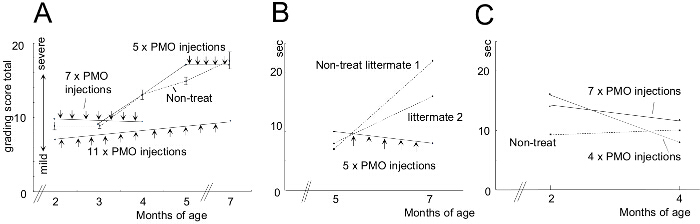
Figura 12. Índices de Melhoria na classificação clínica e 15 m Tempo corrente Depois de cães tratados com Morpholino Morpholino tratamento. Foram comparados aos não tratados com (NT) littermates. As barras de erro no gráfico indicam SEM. A) pontuação total no exame de classificação clínica foi calculada antes e após o tratamento e os animais tratados foram comparados com ninhadas NT. B) Uma comparação de 15 m tempos de execução de cães tratados e NT. C) Semelhante a B; No entanto, foram utilizados cães mais novos. As imagens são adaptadas com permissão de Yokota et al. (Copyright 2009, John Wiley & Sons) 40. Por favor clique aqui para ver uma versão maior desta figura.
| oligonucleótido anti-sentido | sequência nucleotídica |
| Ex6A | GTTGATTGTCGGACCCAGCTCAGG |
| Ex6B | ACCTATGACTGTGGATGAGAGCGTT |
| Ex8A | CTTCCTGGATGGCTTCAATGCTCAC |
Tabela 1. oligonucleótido de estrutura.
Discussão
Exon skipping é uma técnica terapêutica promissora para o tratamento da DMD. Tanto in vitro e in vivo demonstraram que a multi-exon skipping é viável. Aqui, é discutida a utilização do modelo de cão CXMD. Em primeiro lugar, AONs foram projetados usando os-ESE de resgate programas e ESEfinder para direcionar exons distrofina 6 - 8. A química 2'OMePS AON foi usado para CXMD transfecção de mioblastos ea espinha dorsal química morfolino AON foi escolhido para os experimentos in vivo. vPMOs são mais eficientes do que os PMOs não modificados, mas devido à sua toxicidade mais elevada que eles não são adequados para injecções sistémicas. extracção de ARN, a RT-PCR, e sequenciação de ADNc foram realizadas sobre os mioblastos CXMD. Cães injetados com o coquetel de PMO foram clinicamente classificados para avaliar qualquer melhoria nos sintomas clínicos. Após os cães foram humanamente eutanasiados, amostras do músculo foram tomadas e preparados para crio-seccionamento. A meia-vida da proteína distrofina induzida por AONs acredita-se ser cerca de 1-2 meses. cães adultos jovens foram utilizados neste estudo, embora estas experiências podem ser feitas com cães neonatais e cães idosos (> 5 anos). Secções musculares preparados foram usados para avaliar a histopatologia e avaliar salvamento proteína distrofina através de transferência de Western e imuno-histoquímica 48.
É importante assegurar que o volume da solução de PMO está correcta antes de injecções; não fazê-lo terão efeitos significativos sobre os resultados. Durante injecções intramusculares, uma pressão suficiente é necessária para inserir as fibras musculares. Monitoramento da saúde e da inspeção do local da cirurgia cão são importantes para a solução de problemas. Para monitorar a saúde animal, exames de sangue semanais e pesagem deve ser realizada. Após a eutanásia do animal e a preparação de amostras de músculo, um passo crítico para garantir sensibilidade na detecção de proteína distrofina consiste em utilizar tanto o gel Tris-acetato e método de transferência semi-secodurante o procedimento de transferência Western.
Tal como mostrado nos resultados representativos, mioblastos tratados com Ex6A, Ex6B, Ex8A, e o cocktail (contendo Ex6A, Ex6B, Ex8A, e Ex8B) produzido em grelha produtos DMD. Desde Ex8B produzidos sem produtos Exon-ignorado, não foi utilizado na subsequente in vivo. sequenciamento de cDNA mostrou que exons 6-9 skipping ocorreu e imunocitoquímica com DYS-2 coloração mostrou restaurado expressão de distrofina em amostras tratadas. cães tratados com AON mostrou um aumento significativo em fibras distrofina-positiva. Isto indica que os exões 6-8 foram sendo ignorados e uma proteína encurtado foi produzido. A quantidade de fibras distrofina-positivas aumentou quando foi utilizado um cocktail de AONs e foi proporcional à dose AON. Imunotransfer�cias mostraram aumento da expressão de distrofina em cães tratados com morfolino sistémicos. músculo esquelético tinham níveis variáveis de fibras de distrofina; No entanto, o tecido do coração tratado com morfolino mostrou poucamelhoria na expressão de distrofina. Desde distrofina tem um elevado peso molecular (427 kDa), a detecção de pequenas quantidades de distrofina pode ser difícil. Para obter os melhores resultados, foram usadas em gel Tris-acetato e o método de transferência semi-seca. Coloração HE mostrou melhorou histopatologia nos cães tratados com morfolino. fibras centralmente nucleadas (CNFs) são um sinal de músculo saudável e representam ciclos de degeneração e regeneração muscular. CXMD cães tratados com morfolino mostrou uma diminuição na percentagem de CNFs em comparação com os cães CXMD não tratados. classificação clínica revelou uma melhoria nos sintomas, tais como o aumento da capacidade de andar e correr, nos animais tratados com morfolino. A dureza dos músculos se acredita reflectir a atrofia muscular, assim, foi incluído no sistema de classificação 59. A dureza dos músculos da coxa (hind-membro) foi avaliada; No entanto, foram excluídos músculo sartório cranianos porque eles tendem a apresentar hipertrofia em vez de atrofia em CXMD. cães tratados mostrared pontuação de classificação mais baixos e tinha vezes mais rápido no teste de corrida de 15 m. Melhoradas vezes no 15 m de teste são indicativos de melhora da função muscular 40. escores mais altos de classificação globais indicam problemas de saúde e aumento da atrofia muscular.
Embora estes resultados são promissores, multi-exon skipping ainda apresenta muitos desafios que precisam ser superados antes que a técnica tem aplicabilidade clínica. tecido cardíaco ainda exibe absorção reduzida de AONs, provavelmente devido à diferença no tráfico de celular entre o tecido cardíaco e esquelético. Nenhuns efeitos tóxicos foram observados em animais sob os regimes de dosagem actuais; no entanto, mais trabalho precisa ser feito para avaliar a toxicidade de longo prazo antes do uso de cocktails AON pode passar para ensaios clínicos. É difícil conseguir a aprovação de drogas cocktail AON porque as agências reguladoras definir cada sequência de AON como uma droga única. Isto significa que cada sequência em um cocktail teriam de ser testados individualmente para safety, exigindo mais tempo e mais dinheiro. Uma outra barreira para a utilização de skipping de multi-exão num ambiente clínico é uma grande quantidade de produtos de proteína intermediários produzidos com funções desconhecidas. Estas proteínas podem potencialmente levar a efeitos colaterais imprevisíveis, dependendo do indivíduo a mutação 22. Além disso, os padrões de mutação disponíveis dentro de modelos de cão distróficos atuais são limitadas. Existem poucas mutações que ocorrem naturalmente, e nem todas as mutações são úteis para o estudo de multi-exon skipping. O modelo distrófica porco promete ser uma boa alternativa para o futuro DMD salto de exon estudos 33, 34.
Os modelos de cão de DMD têm algumas vantagens sobre outros modelos de DMD. Sendo um maior modelo animal, classificação clínico e ressonância magnética são possíveis, permitindo uma análise mais detalhada. Desde que os cães são animais de grande porte são também mais adequados para estudos toxicológicos e representam mais de perto a doença humana em comparação com o modelo de ratinho. Dog modelos também têm sequências de genes de DMD que são mais semelhantes aos seres humanos 23, 34, 45.
Embora tecnicamente desafiador, a abordagem skipping multi-exão poderia vir a beneficiar> 90% dos pacientes com DMD 24. Isso o torna uma alternativa muito melhor para pular-exão única, as-exão único salto só é aplicável a um pequeno subgrupo de pacientes. Além disso, multi-exon skipping nos permitirá selecionar os padrões de exclusão que otimizam a funcionalidade das proteínas distrofina encurtada. Por exemplo, a exclusão de DMD exons 45 - 55 está associada a sintomas excepcionalmente leves ou assintomáticos 14,19,60-63. O salto multi-exão de exons 45 - 55 já foi demonstrado em um modelo de rato com DMD com uma deleção do exão 52 (mdx52), usando injeções sistêmicas de vPMOs 22,26. O uso de vPMOs cocktail também foi demonstrada em outras formas de distrofia muscular, taiscomo Fukuyama distrofia muscular congênita (FCMD). FCMD é causada por aprisionamento de exões, em que o splicing de mRNA aberrante é causada pela inserção de retrotransposões. vPMOs foram mostrados para resgatar o padrão de splicing em ambos FCMD um modelo de rato e em linhas de células humanas 64. Próxima geração de químicos AON expositoras maior eficácia e menor toxicidade iria facilitar a tradução efectiva da abordagem de salto multi-exão para a aplicação clínica. Além disso, saltando multi-exão poderia potencialmente ser aplicada a outras doenças genéticas, tais como a dysferlinopathies 24, 65.
Divulgações
Open access fees for this article were provided by, Gene Tools, LLC.
Agradecimentos
This work was supported by The University of Alberta Faculty of Medicine and Dentistry, The Friends of Garrett Cumming Research Chair Fund, HM Toupin Neurological Science Research Chair Fund, Muscular Dystrophy Canada, Canada Foundation for Innovation (CFI), Alberta Advanced Education and Technology (AET), Canadian Institutes of Health Research (CIHR), Jesse's Journey - The Foundation for Gene and Cell Therapy, and the Women and Children's Health Research Institute (WCHRI).
Materiais
| Name | Company | Catalog Number | Comments |
| 2'OMePS Transfection of Dog Myoblasts | |||
| 3 ml 6-well plates | IWAKI | 5816-006 | |
| Dulbecco’s modified Eagle’s medium (DMEM) | Gibco | 11965-092 | |
| Fetal bovine serum (FBS) | HyClone | SH30071.01 | |
| Penicillin | Sigma-Aldrich | P4333 | 200 U/ml |
| Lipofectin | Invitrogen | 18292-011 | Total volume of 100 ml in opti-MEM media at a ratio of 2:1 for lipofectin. 10 ml lipofectin for 5 mg RNA. |
| 2’OMePS | Eurogentec | Ex6A (GUU GAUUGUCGGACCCAGCUCAGG), Ex6B (ACCUAUGA CUGUGGAUGAGAGCGUU), and Ex8A (CUUCCUGG AUGGCUUCAAUGCUCAC). | |
| Horse Serum | Gibco | 16050-114 | 2% |
| streptomycin | Sigma-Aldrich | P4333 | 200 μg/ml |
| Bovine serum albumin (BSA) | Sigma-Aldrich | A9418 | |
| Insulin | |||
| Morpholino transfection of dog myoblasts All material from MePS Transfection of Dog Myoblasts for culturing | |||
| Antisense morpholinos | Gene-tools | Ex6A(GTTGATTGTCGGACCCAGC TCAGG), Ex6B(ACCTATGACTGTGGATGAG AGCGTT), Ex8A(CTTCCTGGATGGCTTCAAT GCTCAC) Dilute to a final volume of 100 L in opti-MEM media. 120–200 mg/kg of morpholinos at 32 mg/ml in saline | |
| Endo-Porter | Gene-tools | ||
| guanidinium thiocyanate-phenol-chloroform | Invitrogen | 15596-018 | 1 ml/plate |
| RNA Extraction and Reverse Transcription Polymerase Chain Reaction (RT-PCR) | |||
| guanidinium thiocyanate-phenol-chloroform | Invitrogen | 15596-018 | 1 ml/plate |
| Chloroform | Sigma-Aldrich | P3803 | 200 μl |
| 1.5 ml Tubes | Eppendorf | 22363204 | |
| Centrifuge | Beckman-Coulter | ||
| 75% Ethanol | Sigma-Aldrich | 34852 | |
| UV Spectrometer | |||
| Forward primer in exon 5 | Invitrogen | CTGACTCTTGGTTTGATTTGGA 1.5 μl 10 μM | |
| Reverse primer in exon 10 | Invitrogen | TGCTTCGGTCTCTGTCAATG 1.5 μl 10 μM | |
| dNTPs | Clontech | 3040 | |
| One-Step RT-PCR kit | Qiagen | 210210 | |
| Thermo-cycler | Scinco | ||
| Complementary DNA (cDNA) Sequencing | |||
| Gel extraction kit | Qiagen | 28704 | |
| Centrifuge | |||
| Terminator v3.1 Cycle Sequencing Kit | Applied Biosystems | 4337454 | |
| Intramuscular injections or open muscle biopsy | |||
| Surgical Tools | Scissors, scalpel, needle, surgical thread | ||
| Vet Ointment | |||
| Iodophors | webtextiles | 12190-71-5 | |
| chlorohexidine | Peridex | 12134 | |
| Surgical Drapes | |||
| Scrubs | |||
| Facial Mask | |||
| Surgical Gloves | |||
| Head Covering | |||
| Thiopental sodium | Mitsubishi Tanabe Pharma | 20 mg/kg | |
| Isoflurane | Abbott laboratories | 05260-05 | 2-3% |
| Antisense morpholinos | Gene-tools | Ex6A(GTTGATTGTCGGACCCAGC TCAGG), Ex6B(ACCTATGACTGTGGATGAG AGCGTT), Ex8A(CTTCCTGGATGGCTTCAAT GCTCAC) Dilute to a final volume of 100 L in opti-MEM media. 120–200 mg/kg of morpholinos at 32 mg/ml in saline | |
| 27 G Needles | TERUMO | SG3-2325 | |
| 50 ml syringe | TERUMO | SG2-03L2225 | |
| buprenorphine hydrochloride | |||
| Tongue Depressor | |||
| cephalexin | 15 to 30 mg/kg | ||
| cefazolin | 15 to 30 mg/kg | ||
| buprenorphine | 0.01 mg/kg | ||
| buprenorphine hydrochloride | 0.02 mg/kg | ||
| Systemic Injections | |||
| Syringe infusion pump | Muromachi | ||
| 22 G Indwelling needles | TERUMO | SG3-2225 | |
| 27 G Needles | TERUMO | SG3-2325 | |
| 50 ml syringe | TERUMO | SG2-03L2225 | |
| Saline | Ohtsuka-Pharmaceutical | 28372 | |
| Clinical Grading of Dogs | |||
| Video Camera | |||
| Stop watch | |||
| Magnetic resonance imaging (MRI) | |||
| 3 Tesla MRI l | |||
| 18 cm diameter/18 cm length human extremity coil | |||
| Muscle sampling and preparation (necropsy) | |||
| Thiopental sodium | Mitsubishi Tanabe Pharma | 20 mg/kg | |
| Isoflurane | Abbott laboratories | 05260-05 | 2-3% |
| Tragacanth gum | 10-20 ml | ||
| Liquid Nitrogen | |||
| Cork Discs | Iwai-kagaku | 101412-806 | |
| Dry Ice | |||
| Tweezers | |||
| Poly-L-lysine–coated slides | Fisher | 22-037-216 | |
| Cryostat Microsystem | Leica | cm1900 | |
| Immunohistochemistry | |||
| DYS1 | Novocastra | NCL-DYS1 | 1:150 dilutions |
| DYS2 | Novocastra | NCL-DYS2 | 1:150 dilutions |
| Alexa 594 goat antimouse IgG1 | Invitrogen | A-21125 | 1:2,500 dilutions |
| Alexa 594 goat antimouse IgG2 | Invitrogen | A-11005 | 1:2,500 dilutions |
| DAPI | Invitrogen | D1306 | Contains mounting agent |
| Goat Serum | Invitrogen | 10000C | 15% |
| PBS | |||
| Moisture chamber | Scientific Devise Laboratory | 197-BL | |
| Chamber slide | Lab-tek | 154453 | |
| Cover Glasses | Fisher | 12-540A | |
| Hydrophobic barrier pen | |||
| Fluorescent microscope | 594 nm at 20X magnification. | ||
| Western Blotting | |||
| Distillied Water | |||
| Hand Homogenizer | |||
| 2× Laemmli SDS-loading buffer | 0.1 M Tris–HCl (pH 6.6), 2% (w/v) SDS, 2% (0.28 M) beta-mercaptoethanol, 20% glycerol, 0.01% bromophenol blue | ||
| SDS gels | Bio-Rad | 161-1210 | 5% resolving |
| SDS gels | Invitrogen | Invitrogen, WG1601BOX | 3-8% |
| PVDF membrane | GE | 10600021 | |
| Methanol | |||
| Running buffer (10×) | 250 mM of Tris-Base, 1,920 mM of Glycine | ||
| Running buffer (1×) | 10% 10× buffer, 20% methanol | ||
| 0.05% PBS/Tween 20 (PBST) | 2,000 ml 3× 200 ml for washing | ||
| PBST/5% milk powder | 100 ml | ||
| Protein Assay Kit | BCA | T9650 | |
| Tween 20 | Sigma | P5927 | |
| Urea | Sigma | U5378 | |
| Beta Mercaptoethanol | Millipore | ES-007-E | |
| SDS | Sigma | L3771 | |
| Tris-Acetate | Sigma | ||
| Tris HCl | Sigma | T3253 | |
| Glycerol | Sigma | G8773 | |
| Loading/sample buffer for Western blotting | NuPage Invitrogen | NP007 | |
| NaCl | Sigma | S3014 | |
| PMSF | Sigma | P7626 | |
| Protease cocktail inhibitor | Roche | 11836153001 | |
| Cathode Buffer | 0.025 M Tris base + 40 mM 6-aminocaproic acid + 20% Methanol | ||
| Anode Buffer | 0.03 M Tris Base + 20% Methanol | ||
| Concentred Anode Buffer | 0.3 M Tris base + 20% Methanol | ||
| desmin antibody | Abcam | ab8592 | |
| DYS1 | Novocastra | NCL-DYS1 | 1:150 dilutions |
| ImageJ Software | |||
Referências
- Duchenne, A. The Pathology of Paralysis with Muscular Degeneration (Paralysie Myosclerotique), or Paralysis with Apparent Hypertrophy. Br Med J. 14 (2), 541-542 (1867).
- Zellweger, H., Antonik, A. Newborn screening for Duchenne muscular dystrophy. Pediatrics. 55 (1), 30-34 (1975).
- Echigoya, Y., Yokota, T. Skipping multiple exons of dystrophin transcripts using cocktail antisense oligonucleotides. Nucleic Acid Ther. 24, 57-68 (2014).
- Bushby, R. F., Birnkrant, D. J., et al. Diagnosis and management of Duchenne muscular dystrophy, part 1: diagnosis, and pharmacological and psychosocial management. The Lancet Neurology. 9 (1), 77-93 (2010).
- Eagle, M., Baudouin, S. V., Chandler, C., Giddings, D. R., Bullock, R., Bushby, K. Survival in Duchenne muscular dystrophy: improvements in life expectancy since 1967 and the impact of home nocturnal ventilation. Neuromuscul. Disord. 12 (10), 926-929 (2002).
- Heald, A., Anderson, L. V., Bushby, K. M., Shaw, P. J. Becker muscular dystrophy with onset after 60 years. Neurology. 44 (12), 2388-2390 (1994).
- Stöllberger, C., Finsterer, J. Worsening of heart failure in Becker muscular dystrophy after non-steroidal anti-inflammatory drugs. Med. J. 98 (4), 478-480 (2005).
- Passamano, L., et al. Improvement of survival in Duchenne Muscular Dystrophy: retrospective analysis of 835 patients. Acta Myol. 31 (2), 121-125 (2012).
- Hoffman, E. P., Brown, R. H., Kunkel, L. M. Dystrophin: the protein product of the Duchenne muscular dystrophy locus. Cell. 51 (6), 919-928 (1987).
- Koenig, M., et al. Complete cloning of the Duchenne muscular dystrophy (DMD) cDNA and preliminary genomic organization of the DMD gene in normal and affected individuals. Cell. 50 (3), 509-517 (1987).
- Takeshima, Y., et al. Mutation spectrum of the dystrophin gene in 442 Duchenne/Becker muscular dystrophy cases from one Japanese referral. JHG. 55 (6), 379-388 (2010).
- White, S. J., et al. Duplications in the DMD gene. Hum. Mutat. 27, 938-945 (2006).
- Yokota, T., Duddy, W., Echigoya, Y., Kolski, H. Exon skipping for nonsense mutations in Duchenne muscular dystrophy: too many mutations, too few patients. Expert Opin. Biol. Ther. 12 (9), 1141-1152 (2012).
- Yokota, T., Duddy, W., Partridge, T. Optimizing exon skipping therapies for DMD. Acta Myol. 26 (3), 179-184 (2007).
- Magri, F., et al. Genotype and phenotype characterization in a large dystrophinopathic cohort with extended follow-up. J Neurol. 258 (9), 1610-1623 (2011).
- Yoshida, H. H., Ishikawa-Sakurai, M. Biochemical evidence for association of dystrobrevin with the sarcoglycan- sarcospan complex as a basis for understanding sarcogly- canopathy. Hum. Mol. Genet. 9 (7), 1033-1040 (2000).
- Bies, R. D., Caskey, C. T., Fenwick, R. An intact cysteine-rich domain is required for dystrophin function. J. Clin. Invest. 90 (2), 666-672 (1992).
- Monaco, A. P., Bertelson, C. J., Liechti-Gallati, S., Moser, H., Kunkel, L. M. An explanation for the phenotypic differences between patients bearing partial deletions of the DMD locus. Genomics. 2 (1), 90-95 (1988).
- Aoki, Y., Yokota, T., Wood, M. J. Development of multiexon skipping antisense oligonucleotide therapy for Duchenne muscular dystrophy. Biomed Res Int. 2013 (402369), (2013).
- Cirak, V. A. -. G., Guglieri, M., et al. Exon skipping and dystrophin restoration in patients with Duchenne muscular dystrophy after systemic phosphorodiamidate morpholino oligomer treatment: an open-label, phase 2, dose-escalation study. The Lancet. 378 (9791), 595-605 (2011).
- Goemans, N. M., et al. Systemic administration of PRO051 in Duchenne's muscular dystrophy. N Engl J Med. 364 (16), 1513-1522 (2011).
- Echigoya, Y., et al. Long-term efficacy of systemic multiexon skipping targeting dystrophin exons 45-55 with a cocktail of vivo-morpholinos in mdx52 mice. Mol Ther Nucleic Acids. 4, (2015).
- Hoffman, E. P., et al. Restoring dystrophin expression in Duchenne muscular dystrophy muscle progress in exon skipping and stop codon read through. Am J Pathol. 179 (1), 12-22 (2011).
- Aartsma-Rus, A., et al. Antisense-induced multiexon skipping for Duchenne muscular dystrophy makes more sense. Am J Hum Genet. 74 (1), 83-92 (2004).
- Aartsma-Rus, A., Kaman, W. E., Weij, R., Tden Dunnen, J., van Ommen, G. J., van Deutekom, J. C. Exploring the frontiers of therapeutic exon skipping for Duchenne muscular dystrophy by double targeting within one or multiple exons. Mol. Ther. 14 (3), 401-407 (2006).
- Aoki, Y., et al. Bodywide skipping of exons 45-55 in dystrophic mdx52 mice by systemic antisense delivery. Proc Natl Acad Sci U S A. 109 (34), 13763-13768 (2012).
- McClorey, G., Iversen, P. L., Moulton , H. M., Fletcher, S., Wilton, S. D. Antisense oligonucleotide-induced exon skipping restores dystrophin expression in vitro in a canine model of DMD. Gene Ther. 13 (19), 1373-1381 (2006).
- Sharp, N. J., et al. An error in dystrophin mRNA processing in golden retriever muscular dystrophy, an animal homologue of Duchenne muscular dystrophy. Genomics. 13 (1), 115-121 (1992).
- Shimatsu, Y., et al. Canine X-linked muscular dystrophy in Japan (CXMDJ). Exp Anim. 52 (2), 93-97 (2003).
- Nguyen, F., Cherel, Y., Guigand, L., Goubault Leroux, I., Wyers, M. Muscle lesions associated with dystrophin deficiency in neonatal golden retriever puppies. J Comp Pathol. 126 (2-3), 100-108 (2002).
- Nakamura, A., Takeda, S. Mammalian models of Duchenne Muscular Dystrophy: pathological characteristics and therapeutic applications. J Biomed Biotechnol. 2011 (184393), (2011).
- Yokota, T., et al. A renaissance for anti-sense oligonucleotide drugs in neurology: Exon-skipping breaks new ground. Arch. Neurol. 66, 32-38 (2009).
- Aartsma-Rus, A., et al. Theoretic applicability of antisense-mediated exon skipping for Duchenne muscular dystrophy mutations. Hum. Mutat. 30 (3), 293-299 (2009).
- Yu, X., Bao, B., Echigoya, Y., Yokota, T. Dystrophin-deficient large animal models: translational research and exon skipping. Am. J. Transl. Res. 7 (8), 1214-1231 (2015).
- Yin, H., Moulton, H., Betts, C., Wood, M. CPP-directed oligonucleotide exon skipping in animal models of Duchenne muscular dystrophy. Methods Mol Biol. 683, 321-338 (2011).
- Moulton, H. M., Moulton, J. D. Morpholinos and their peptide conjugates: therapeutic promise and challenge for Duchenne muscular dystrophy. Biochim. Biophys. Acta. 1798 (12), 2296-2303 (2010).
- Morcos, P. A., Li, Y., Jiang, S. Vivo-Morpholinos: a non-peptide transporter delivers Morpholinos into a wide array of mouse tissues. BioTechniques. 45 (6), 613-614 (2008).
- Betts, C., et al. A New Generation of Peptide-oligonucleotide Conjugates With Improved Cardiac Exon Skipping Activity for DMD Treatment. Mol Ther Nucleic Acids. 14 (1), e38 (2012).
- Saito, T., et al. Antisense PMO found in dystrophic dog model was effective in cells from exon 7-deleted DMD patient. PLoS One. 5 (8), e12239 (2010).
- Yokota, T., et al. Efficacy of systemic morpholino exon-skipping in Duchenne dystrophy dogs. Ann Neurol. 65 (6), 667-676 (2009).
- Melacini, P., et al. Cardiac and respiratory involvement in advanced stage Duchenne muscular dystrophy. Neuromuscul. Disord. 6 (5), 367-376 (1996).
- Guncay, A., Yokota, T. Antisense oligonucleotide drugs for Duchenne muscular dystrophy: how far have we come and what does the future hold. Future Med. Chem. 7 (13), 1631-1635 (2015).
- Fairbrother, W. G., Yeh, R. F., Sharp, P. A., Burge, C. B. Predictive identification of exonic splicing enhancers in human genes. Science. 297, 1007-1013 (2002).
- Cartegni, L., Wang, J., Zhu, Z., Zhang, M. Q., Krainer, A. R. ESEfinder: A web resource to identify exonic splicing enhancers. Nucleic Acids Res. 31, 3568-3571 (2003).
- Yokota, T., Hoffman, E., Takeda, S. Antisense oligo-mediated multiple exon skipping in a dog model of duchenne muscular dystrophy. Methods Mol Biol. 709, 299-312 (2011).
- Jenuth, J. P. The NCBI. Publicly available tools and resources on the Web. Methods Mol Biol. 132, 301-312 (2000).
- Yokota, T., et al. Extensive and Prolonged Restoration of Dystrophin Expression with Vivo-Morpholino-Mediated Multiple Exon Skipping in Dystrophic Dogs. Nucleic Acid Ther. , (2012).
- Summerton, J. E. Endo-Porter: a novel reagent for safe, effective delivery of substances into cells. Ann. N. Y. Acad. Sci. 1058, 62-75 (2005).
- Mangram, A. J., et al. Guideline for Prevention of Surgical Site Infection. Am J Infect Control. 27, 97-134 (1999).
- Reichman, D. E., Greenberg, J. A. Reducing Surgical Site Infections. A Review . Rev Obstet Gynecol. 2, 212-221 (2009).
- Mizuno, H., Nakamura, A., Aoki, Y., Ito, N., Kishi, S., Yamamoto, K., Sekiguchi, M., Takeda, S., Hashido, K. Identification of muscle-specific microRNAs in serum of muscular dystrophy animal models: promising novel blood-based markers for muscular dystrophy. PloS one. 6, (2011).
- Shimatsu, Y., et al. Major clinical and histopathological characteristics of canine X-linked muscular dystrophy inJapan, CXMDJ. Acta Myol. , 145-154 (2005).
- Evans, H., de Lahunta, A. Guide to the Dissection of the Dog. SAUNDERS. , (2009).
- Girish, V., Vijayalakshmi, A. Affordable image analysis using NIH Image/ImageJ. Indian J Cancer. 41 (47), (2004).
- Bearer, E. L., et al. Overview of image analysis, image importing, and image processing using freeware. Current protocols in molecular biology. 14, (2003).
- Shimatsu, Y., et al. Major clinical and histopathological characteristics of canine X-linked muscular dystrophy inJapan, CXMDJ. Acta Myol. 24, 145-1454 (2005).
- Beroud, C., et al. Multiexon skipping leading to an artificial DMD protein lacking amino acids from exons 45 through 55 could rescue up to 63% of patients with Duchenne muscular dystrophy. Hum Mutat. 28, 196-202 (2007).
- Ferreiro, V., et al. Asymptomatic Becker muscular dystrophy in a family with a multiexon deletion. Muscle Nerve. 39, 239-243 (2009).
- Nakamura, A., et al. Follow-up of three patients with a large in-frame deletion of exons 45-55 in the Duchenne muscular dystrophy (DMD) gene. J Clin Neurosci. 15, 757-763 (2008).
- Yokota, T., Pistilli, E., Duddy, W., Nagaraju, K. Potential of oligonucleotide-mediated exon-skipping therapy for Duchenne muscular dystrophy. Expert Opin Biol Ther. 7, 831-842 (2007).
- Taniguchi-Ikeda, M., et al. Pathogenic exon-trapping by SVA retrotransposon and rescue in Fukuyama muscular dystrophy. Nature. 478, 127-131 (2011).
- Lee, J. J., Yokota, T. Antisense therapy in neurology. J Pers Med. 3, 144-176 (2013).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados