Method Article
Mecanismo do Regulamento de Números de adipócitos em adultos Organismos através da diferenciação e apoptose homeostase
Neste Artigo
Resumo
Adipose tissue (AT) can influence whole body homeostasis, therefore understanding the molecular mechanisms of adipocyte differentiation and function is of importance. We provide a protocol for gaining new insights into these processes by analyzing adipocyte homeostasis, differentiation and hypoxia exposure as a model for induced adipocyte apoptosis.
Resumo
Considering that adipose tissue (AT) is an endocrine organ, it can influence whole body metabolism. Excessive energy storage leads to the dysregulation of adipocytes, which in turn induces abnormal secretion of adipokines, triggering metabolic syndromes such as obesity, dyslipidemia, hyperglycemia, hyperinsulinemia, insulin resistance and type 2 diabetes. Therefore, investigating the molecular mechanisms behind adipocyte dysregulation could help to develop novel therapeutic strategies. Our protocol describes methods for evaluating the molecular mechanism affected by hypoxic conditions of the AT, which correlates with adipocyte apoptosis in adult mice. This protocol describes how to analyze AT in vivo through gene expression profiling as well as histological analysis of adipocyte differentiation, proliferation and apoptosis during hypoxia exposure, ascertained through staining of hypoxic cells or HIF-1α protein. Furthermore, in vitro analysis of adipocyte differentiation and its responses to various stimuli completes the characterization of the molecular pathways behind possible adipocyte dysfunction leading to metabolic syndromes.
Introdução
De acordo com o relatório de 2014 da Organização Mundial da Saúde, 39% da população adulta do mundo está acima do peso, e 13% é obesa 1. Num futuro próximo, as pessoas com excesso de peso será composto por uma proporção significativa da população idosa. Uma característica importante da obesidade e envelhecimento é desregulação de gordura em relação a mortalidade e morbidade 2. Adipocinas, as proteínas segregadas pelo tecido adiposo (TA), pode desencadear síndromes metabólicas, tais como obesidade e diabetes do tipo 2 3. As doenças metabólicas são na sua maioria causadas por acumulação de energia excessiva nas gotículas lipídicas dos adipócitos, o que resulta em pelo expansão 4. É, portanto, de interesse para determinar as causas e os mecanismos moleculares de expansão a fim de encontrar possibilidades para controlá-lo.
Over-nutrição leva à expansão AT, que é regulada por dois eventos: o armazenamento excessivo de energia para as gotículas lipídicas de adipócitos, um processolevando a hipertrofia (aumento no tamanho dos adipócitos), e aumentou a adipogénese, também conhecida como hiperplasia 5 adipócito. Adipogênese é um processo de diferenciação de células estaminais multipotentes mesenquimais (MSC) em adipócitos. Em primeiro lugar, MSCs desenvolver em pré-adipócitos durante a fase de compromisso. Em segundo lugar, pré-adipócitos diferenciar ainda mais para adquirir as características de adipócitos maduros e funcionais 6. Vários factores de transcrição foram identificados como reguladores mestre para a determinação de pré-adipócitos, tais como a proteína de dedo de zinco 423 (Zfp423) e factor de células B precoce 1 (Ebf1). Considerando que induz Zfp423 compromisso inicial, Ebf1 é necessário para a geração de células progenitoras de adipócitos 6. Diferenciação terminal é rigorosamente controlada por uma cascata de transcrição, através do qual γ PPAR (PPARy) é o factor de transcrição essencial 7. Outros factores de transcrição chave são o / proteína de ligação potenciador CCAAT (CMembros da família / EBP) (ou seja, C / EBPα, C / EBP, e C / EBPδ), fatores Krüppel-like (KLFs), cAMP elemento de resposta a ligação às proteínas (CREB) e da resposta inicial de crescimento de 20 (Krox20) 6.
Recentemente, tem sido demonstrado que a proteína-1 (AP-1) a família activador está envolvido no processo de diferenciação de adipocitos 8,9. A família de AP-1 é formado por um complexo de proteína dimérica, constituída por Fos, Jun e / ou activação de factor de transcrição (ATF) membros. antigénio relacionado com Fos-1 e 2 (Fra-1 e Fra-2) são capazes de regular a diferenciação de adipocitos. Fra-1 prejudica a diferenciação de adipocitos por inibição da C / EBPα 8, enquanto que Fra-2 rotatividade controlos adipócito 9. Fra-2, assim, não só diminui o número de adipócitos reprimindo a expressão PPARγ2 durante a diferenciação dos adipócitos, mas também diminui adipócitos apoptose através da repressão direta dos fatores de hipoxia-induzida expressão (HIFs). A família de HIF é um heterodimeric complexo de factor de transcrição, composto de HIF-1α, HIF-2α e HIF-1β. Os heterodímeros constituídos por uma proteína sensível ao oxigénio HIF-α (HIF-1α ou HIF-2α) e a subunidade HIF-1β oxigénio-10 insensível. Durante a normoxia, proteínas HIF-α são poli-ubiquitinylated e finalmente são degradadas por proteassomas 11. Sob condições hipóxicas, ocorrendo em pelo durante a expansão, proteínas HIF-α não são hidroxilados. Eles, portanto, tornam-se estabilizados e formar dímeros com o HIF-1β constitutivamente expresso. Activação da transcrição de genes controlados por os elementos de resposta do HIF está envolvido na regulação da angiogénese, metabolismo, e inflamação 12. Com efeito, o HIF-1α promove AT disfunção através da indução de tolerância à glicose, inibindo o gasto de energia e da utilização periférica de lípidos, bem como pelo aumento do nível de leptina e HFD-induzida esteatose hepática 13. Além disso, o HIF-1α regula adipocyte a apoptose in vivo e in vitro 9.
O presente protocolo descreve métodos para estudar AT status para desvendar as características moleculares da homeostase dos adipócitos em ratos adultos. Ele mostra como a apoptose, proliferação e diferenciação de adipócitos in vivo e in vitro pode ser regulado por hipoxia. Para fazer isso, usamos ratos com adipócitos eliminação específica de Fra-2 gerado pelo cruzamento de ratinhos que transportam as Fra-2 alelos floxed com FABP4-CreERT ratos 9. Ao utilizar ratinhos ERT FABP4-Cre, a supressão é específico de adipocitos e induzível por injecção 14 tamoxifeno. Para o modelo de adulto, as injecções intra-peritoneal de tamoxifeno são realizadas ao longo de 5 dias consecutivos, começando com a idade de 6 semanas. Assim, os ratos são submetidos a uma dieta rica em gordura ou-dieta normal durante 6 semanas antes da análise é feita. Os ratos utilizados neste estudo eram do sexo masculino com base em um fundo C57BL6 para evitar hormonas femininas, tais como estrogénios, Mostrado para regular a distribuição de gordura corporal 15. Usando um outro fundo genético também pode alterar o fenótipo metabólico, devido a diferenças relacionadas com a tensão em gestão lipídico 16.
Este protocolo demonstra como analisar AT sob hipóxia usando histologia e como quantificar a apoptose dos adipócitos, proliferação e diferenciação in vivo utilizando imunohistoquímica e gene análises de perfis. O estudo é completado por experiências in vitro, que mostram como a analisar a diferenciação de adipócitos primários e apoptose alterada por exposição a hipoxia.
Protocolo
ÉTICA DECLARAÇÃO: Os animais são alojados em condições padronizadas, seguindo as orientações do Welfare Act alemão Animal. Os animais são alimentados com uma dieta padrão e água ad libitum e mantidos com um ciclo de 12 horas dia / noite. Todos os experimentos com animais são autorizados pelo comitê de ética local.
1. Análise in vivo do adipócito homeostase Sexo Masculino
- Para quantificar hipoxia in vivo, em primeiro lugar determinar o peso corporal dos ratinhos, em seguida, injectar 60 mg / kg de peso corporal de cloridrato pimonidazole sólido intraperitonealmente (por exemplo, administração de 1,5 mg num ratinho de 25 g). Pimonidazole é um marcador eficaz hipóxica, que forma aductos com grupos tiol em proteínas, péptidos e aminoácidos e é detectado por um anticorpo específico.
- Sacrifício camundongos e remover as bolsas de gordura perigonadal (Figura 1).
- 45 min após a injecção, sacrificar os ratinhos por asfixia com CO2 e subsequente deslocamento cervical.
- Pin para baixo os membros de ratos (conforme ilustrado na Figura 1) e abrir a cavidade peritoneal. Remova a esquerda ea perigonadal pad (epidídimo) direito gordura no interior da cavidade peritoneal.
Nota: almofada de gordura é obrigado a epidídimo pelos folhetos peritoneais como se mostra na Figura 1 (perigonadal almofadas de gordura são indicados por setas). - Tome cuidado para remover os tecidos gonadais da almofada de gordura. Determinar pesos das camadas de gordura para calcular a relação: peso da almofada de gordura (g) por peso corporal (g).
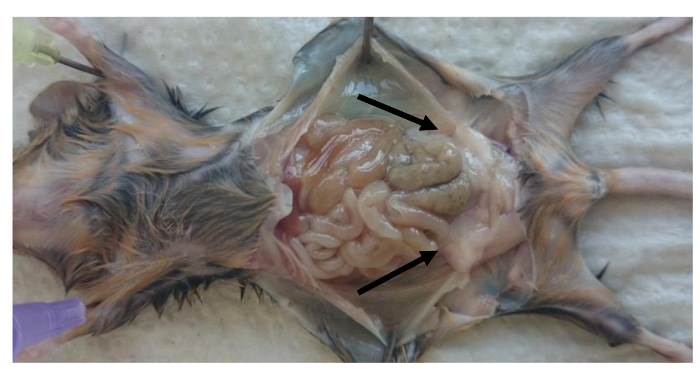
Figura 1: Localização das almofadas de gordura perigonadal na cavidade peritoneal de ratos. Imagem de localização de gordura perigonadal em ratos adultos após o sacrifício. Bolsas de gordura Perigonadal são indicadas pelas setas. Por favor clique aqui para vIEW uma versão maior desta figura.
- Para compilar um perfil de expressão gênica quantitativa, use uma almofada de gordura perigonadal para isolar RNA. Nota: até que o tecido seja processado, armazenar amostras de tecido em solução de estabilização de ARN, a -80 ° C ou em azoto líquido.
- Para homogeneizar a almofada de gordura, adicione a almofada de gordura a uma solução de fase única 1 ml de isotiocianato de guanidina e fenol. Utilize tubos contendo esferas cerâmicas (1,4 mm) para esmagar o tecido em um homogeneizador a 6500 rpm (2 vezes 20 segundos, com 30 segundos de pausa).
- Isolar o ARN do seguinte modo (método de um único passo por Chomczynski e Sacchi 17).
- Para separar as fases, transferir almofada de gordura homogeneizada para um tubo de microcentrífuga, adicionar 0,2 ml de volume de clorofórmio, agita-se durante 15 seg, incubar durante 5 min à temperatura ambiente e centrífuga 12000 xg durante 5 min. Transferir a fase aquosa superior (cerca de 400 ul), que contém o RNA, para um novo tubo de microcentrifugação. Não inclua o DNA-contêming interfase ou na fase de fenol contendo proteína.
- Para precipitar o ARN, adicionar 1 volume de isopropanol, misturar e incubar durante 15 min a 4 ° C (também é possível incubar a -20 ° C durante a noite). Centrifugar a 12000 xg durante 10 min. Remover o isopropanol cuidadosamente o sobrenadante. Lavar duas vezes com etanol a 75% com passos de centrifugação de 12.000 xg durante 10 min.
- Depois de se secar o ARN precipitado durante cerca de 10 min à temperatura ambiente, dissolver em 50 mL de H 2 O (isenta de RNase). Para facilitar este processo, incubar durante 2 min a 65 ° C.
Nota: Manter ARN em 75% de etanol a -80 ° C ou em azoto líquido durante a armazenagem a longo prazo. - Quantificar as preparações de ARN por A 260/280 (quociente óptimo situa-se entre 1,8 e 2,2) e calcular a concentração de A 260:
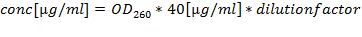
- Para evitar a contaminação de ADN, digest 1 ug da preparação de ARNcom 1 L de DNase I durante 30 minutos a 37 ° C num volume de 10 ul. Inactivar a 65 ° C durante 10 min.
Nota: Esta etapa é opcional. - Utilizar 10 mL de preparação de RNA contendo 1 ug de ARN para a reacção de transcriptase reversa para gerar cDNA de cadeia simples, adequados para a aplicação de PCR quantitativo. Os componentes e as suas quantidades estão listados na Tabela 1.
- Use um PCR Master Mix para um em tempo real reação de PCR quantitativo. Para determinar as alterações metabólicas em toda a almofada de gordura, usa iniciadores específicos para os genes envolvidos na homeostase EM (Tabela 2) e as condições de PCR listados na Tabela 3.
- PCR em tempo real A análise de dados.
- Definir a linha de base (Figura 2), normalmente ciclo de 1 a 15, onde não há nenhuma mudança em sinais de fluorescência. O software de PCR em tempo real sinais de fluorescência normaliza específicos para a fluorescência de base e para o corante de referência interno, ROX, resultando ema magnitude dos sinais específicos pelos iniciadores, delta Rn (ΔRn).
- Definir o limiar dentro da fase exponencial da curva de amplificação. A intersecção define o ciclo limiar (Ct). Com base no valor CT, calcular a expressão relativa (ΔCt) e a mudança de dobragem (ΔΔCt):
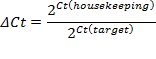
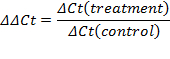
| Componente | Volume ul / reacção |
| Tampão RT 10x | 2.0 |
| 25x de mistura de dNTP (100 mM) | 0,8 |
| 10x RT aleatórios Primers | 2.0 |
| MultiScribe transcriptase reversa | 1.0 |
| Livre de nuclease H2O | 4.2 |
| 1 ugRNA | 10 |
| reacção total por | 20 |
Tabela 1: Componentes com volume respectivo para a reacção de transcriptase reversa para gerar cDNA de cadeia simples.
| nome completo Oficial | Símbolo | Sequência 3 '-> 5' | ||
| para a frente | Reverso | |||
| adipogênese | Delta-like 1 homólogo (pref-1) | Dlk1 | GACACTCGAAGCTCA CCTGG | GGAAGGCTGGGACGG GAAAT |
| fator de célula no início B 1 | Ebf1 | CCACCATCGACTACGG CTTC | TCCTGGTTGTTGTGGGG CATC | |
| proteína dedo de zinco 423 | Zfp423 | GTGCCCAGGAAGAAGA cgtA | GGCGACGTGGATCTGA ATCT | |
| proteína de ligação de ácido gordo 4 (Ap2) | FABP4 | TCACCTGGAAGACAGCT CCTC | AAGCCCACTCCCACTTC TTTC | |
| CCAAT / ligação potenciador de proteínas (C / EBP), alfa | CEBPA | AAGAGCCGCGACA AGGC | GTCAGCTCCAGCACCT tgtg | |
| CCAAT / ligação potenciador de proteínas (C / EBP), beta | Cebpb | TTTCGGGACTTGATGC AATC | CCGCAGGAACATCTTT AAGG | |
| cAMP proteína 1 de ligação elemento responsivo | CREB1 | ACTCAGCCGGGTACT ACCAT | TTGCTGCCTCCCTGTT CTTC | |
| CCAAT / ligação potenciador de proteínas (C / EBP), delta | Cebpd | CAGCGCCTACATTGAC TCCA | GTTGAAGAGGTCGGCG AAAD | |
| Kruppel-like factor 4 | KLF4 | GCAGTCACAAGTCCCC TCTC | TAGTCACAAGTGTGGG TGGC | |
| resposta de crescimento precoce 2 (Krox20) | EGR2 | AGGCGGTAGACAAAATC CCAG | GATACGGGAGATCCAG GGGT | |
| proliferador activado de peroxisoma do receptor gama | PPARG | AGAGGTCCACAGAGCTG ATTC | GATGCACTGCCTATGAGC ACTT | |
| lipogênese | Acetil-coenzima A carboxilase alpha | acaçá | TGGGGACCTTGTCTTCA TCAT | ATGGGCGGAATGGTCTC TTTC |
| ácido graxo sintase | FASN | ACATCCTAGGCATCC GAGÁ | CCGAGTTGAGCTGGGT TAGG | |
| Estearoil-Coenzima A uma dessaturase | SCD1 | CGGGATTGAATGTTCTTG TCGT | TTCTTGCGATACACTCTG concorrência gás a gás | |
| lipólise | containi domínio fosfolipase patatina-likeng 2 | Pnpla2 | AAGGACCTGATGACCA CCCT | CCAACAAGCGGATGGT GAAG |
| absorção de ácidos graxos | lipoproteína lipase | LPL | GTATCGGGCCCAGCAA CATTATCC | GCCTTGCTGGGGTTTTC TTCATTC |
| antígeno CD36 | CD36 | GTCTTCCCAATAAGCATGT CTCC | ATGGGCTGTGATCGGA ACTG | |
| hipóxia | A hipoxia fator induzível 1, subunidade alfa | HIF1a | CCTGCACTGAATCAAGAG concorrência gás a gás | CCATCAGAAGGACTTGCT GGCT |
| proteína do domínio endotelial PAS 1 (também conhecido como: HIF-2alfa) | Epas1 | CAAGCTGAAGCTAAAG CGGC | TTGGGTGAATTCATCG GGGG | |
| supressor de tumor de Von Hippel-Lindau | BVS | ACCGAGGTCATCTTTG GCTC | TTCCGCACACTTGGGT AGTC | |
| translocador nuclear do receptor de hidrocarboneto de arilo (também conhecida como: HIF-1 beta) | Arnt | TGGGTCATCTTCTCGC GGTT | TGTCCTATCTGAGCAT CGTG | |
Tabela 2: Lista de genes com sequência dos respectivos primers utilizados para a análise dos adipócitos homeostase.
| Passo | Temperatura (° C) | Time (min: seg) | ||
| activação da polimerase | Aguarde | 95 | 10:00 | |
| PCR | 40 ciclos | Denaturize | 95 | 00:15 |
| Annealing / Extensão | 60 | 01:00 | ||
| curva de fusão | 60 a 95 | 0,5 ° C / seg | ||
Tabela 3: Real-time PCR condições.
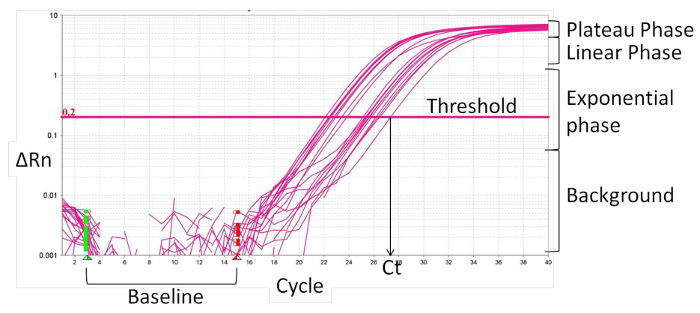
Figura 2:. Características de tempo real curva de amplificação PCR Por favor clique aqui para ver uma versão maior desta figura.
- Para realizar a análise histológica da homeostase dos adipócitos, use a segunda almofada de gordura perigonadal. Não dessecar o tecido!
- Fixar a almofada de gordura em 3,7% de formaldeído PBS-tamponada durante a noite, incorporar em parafina (siga as instruções conforme descrito em outro lugar 18) e cortar o tecido incorporado em 2-5 mm de espessura (máximo de 5 m).
- Determinar o número de adipócitos por campo e tamanho dos adipócitos em um microscópio de campo brilhante depois de hematoxilina e eosina (H & E):
- Desparafinar secções por lavagem 3 vezes durante 5 minutos em xileno e re-hidratar a secção 2 vezes durante 2 minutos em 100% de etanol e 2 vezes durante 2 min em 96% de etanol. Finalmente, lava-se a secção em H2O destilada durante 5 min.
- Mancha com hematoxilina, diluída 1: 5 com H2O destilada, durante 10 min à temperatura ambiente e lavar com H 2 O durante 5 min. Mancha com uma solução de eosina (20 ml 5% eosina Y / 210 ml de H2O / 25 mL de ácido acético glacial destilada) durante 30 segundos e lavar novamente com H2O durante 5 min.
- Desidratar secções utilizando etanol a 96% e 100% de etanol 2 vezes cada uma durante 2 min, e xileno 3 vezes durante 5 min. Montar as seções com agente de montagem anidro.
- Avaliar as seções sob um microscópio de campo brilhante. Um exemplo representativo de como analisar adipócitos com ImageJ 1.48v 19 é mostrado na Fig. 3: número de células por área (^ m 2), a área de células (10 x 3 micrómetros dois ), o tamanho da célula (um).
- Abra a imagem da seção com 1.48v ImageJ. Se os parâmetros de imagem são indicados em pixels, em vez de uma unidade de comprimento, ajustar a escala.
- Selecione * Reta * na barra de ferramentas e ajustar a linha a uma distância conhecida por referência à barra de escala. Ir para Analisar -> Set Scale A distância da linha é mostrado em pixels;. adicionar a distância conhecida e a unidade de comprimento, por exemplo, um. Confirme com OK. O tamanho da imagem e a análise dos parâmetros são indicados na unidade de determinado comprimento.
- Para determinar os parâmetros dos adipócitos, ajustar o limiar. Vá em Image -> Ajuste -> Threshold para abrir a janela Threshold. Selecione as seguintes configurações: Método Limiarização: Padrão; cor Threshold: B & W; Espaço de cores: HSB. A imagem agora é mostrado em preto e branco. Ajusta aBrilho para limpar adipócitos brancos e para fechar os espaços intercelulares preto, como na Fig. 3-B.
- Contar o número de adipócitos por mm 2 (Figura 3e) com o multi-ponto * * seleção na barra de ferramentas e marque cada célula para a contagem.
- Para determinar o tamanho dos adipócitos, selecione * Reta * novamente na barra de ferramentas e desenhar o diâmetro de um dos adipócitos (Figura 3c). Ir para Analisar -> medida e uma nova janela aparece, com o comprimento do diâmetro em um.
- Para determinar a área de adipócitos, selecione * A ferramenta Wand (rastreamento) * e clique dentro do adipócito. A parede interna do adipócito é seleccionado no vermelho (Figura 3D). Ir para Analisar -> Medida e uma nova janela irá aparecer, com a área deste adipócitos em mm 2.
- para immunohistochemistry, prepare a secção de anticorpo e TdT mediada dUTP-biotina nick final rotulagem (TUNEL) coloração da seguinte forma:
- Desparafinar secções por lavagem 3 vezes durante 5 minutos em xileno e re-hidratar a secção 2 vezes durante 2 minutos em 100% de etanol e 2 vezes durante 2 min em 96% de etanol. Finalmente, lava-se a secção em H 2 O. destilada
- Para recuperação de antigénios, digerir a secção de tecido, durante 30 min a 37 ° C com proteinase K solução de trabalho (20 ug / ml em Tris / HCl 10 mM, pH 7,4-8) e enxaguar com PBS.
- Execute coloração de anticorpos em câmaras húmidas:
- Para bloquear a peroxidase endógena, usar 3% de peróxido de hidrogénio em PBS durante 10 minutos, com lavagem subsequente 2 vezes durante 5 minutos em PBS. Para bloquear a ligação não específica de anticorpos, utilizar 10% de soro em PBS. Use o soro do hospedeiro do anticorpo secundário, neste caso cabra.
- Para a coloração, utilizar os anticorpos para a apoptose, proliferação e detecção de hipóxia ( Tabela 4). Dilui-se os anticorpos no soro de cabra / 10% PBS. Incubar a 4 ° C durante a noite. Lavam-se as secções 3 vezes durante 5 min em PBS.
- Para melhorar o sinal de utilizar um anticorpo secundário biotinilado, com a diluição, tal como listados na Tabela 5. Para a detecção de hipóxia, usar HRP de coelho conjugado com anti-FITC como o anticorpo secundário. Incubar durante 1 h à temperatura ambiente. Lavar as seções 2 vezes 5 min com PBS.
Nota: Para a coloração hipóxia com FITC-MAb1, pule a etapa 1.4.4.4) e continue com a etapa 1.4.4.5). - Para cada lâmina, pré-incubar 50 ul de solução de avidina com 50 ul de peroxidase biotinilado H durante 30 min à temperatura ambiente (este método também é referido como avidina biotina formulação ABC / complexo) e em seguida, adicionar às secções durante mais 45 minutos. Lavar 2 vezes durante 5 min com PBS.
- Incubam-se as secções numa solução de substrato de peroxidase até que a coloração se tornam mais intensos (entre 5 a 10 min). Lavar durante 5 minutos com água destiladaH 2 O.
- Para contracoloração, mancha com hematoxilina diluída 1: 5 com H2O destilada durante 10 min à temperatura ambiente e lavar com H 2 O durante 5 min.
- Desidratar secções em etanol a 96% e 100% de etanol 2 vezes cada uma durante 2 min, e xileno 3 vezes durante 5 min. Selar as seções com lamelas e agente de montagem anidro. Avaliar as seções sob um microscópio de campo brilhante.
- Determinar a apoptose pelo ensaio de TUNEL e siga as instruções do fabricante:
- Adicionar solução de enzima em 50 ul a 450 ul de solução de marca. Em seguida, aplicam-se 50 ul de mistura reaccional de TÚNEL em secções histológicas e incubar durante 60 min a 37 ° C numa atmosfera humidif içada no escuro. Lavam-se as secções 3 vezes com PBS durante 5 min e de montagem com meio de montagem, incluindo fluorescência de DAPI (4 ', 6-diamidino-2-fenilindol) para contracoloração.
- Avaliar a seção sob um microscópio de fluorescência com 100 Magnificat dobra íon. Para a medição da Fluoresceína usar um comprimento de onda de excitação de 488 nm e detectar entre 515-565 nm (laser verde); DAPI excita a cerca de 360 nm e emite um a cerca de 460 nm, quando ligado ao DNA (laser azul).
- Quantificar as sobreposições de DAPI e Fluoresceína:
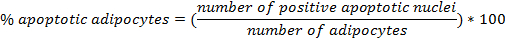

Figura 3:. Analisando as características de adipócitos em seções almofada de gordura seção Imagens da almofada de gordura perigonadal de ratos machos tratados com uma dieta rica em gordura (DFH) ou dieta normal (ND) com um microscópio de campo brilhante (a); o limiar é ajustado em preto e (b) o branco e o tamanho dos adipócitos (comprimento; C), a área (d) e o número de células de adipócitos por mm 2 (e) são quantificados com 1.48v ImageJ.f = "https://www.jove.com/files/ftp_upload/53822/53822fig3large.jpg" target = "_ blank"> Clique aqui para ver uma versão maior desta figura.
| da concentração | diluição | |
| apoptose | Caspase-3 (Asp175) (5A1E) Coelho mAb | 1: 2000 |
| Proliferação | Purificada rato anti-humano Ki-67 Clone B56 (ORALL) | 01:50 |
| hipóxia | HIF-1 alfa Anticorpo | 1: 100 |
| FITC-MAb1 | 1: 100 |
Tabela 4: Anticorpos com respectiva diluição utilizado para a coloração imuno das secções AT.
| Anticorpo | diluição |
| anti biotiniladoIgG de ratinho (H + L) | 1: 200 |
| IgG de rato biotinilado anti (H + L) | 1: 200 |
| HRP anti-coelho conjugados com FITC | 1: 100 |
Tabela 5: anticorpos secundário de diluição utilizados para a coloração imuno-histológica.
2. Análise in vitro do adipócito homeostase Influenciado por hipóxia
- Sacrificar os ratinhos e remover o tecido adiposo subcutâneo.
- Sacrificar os ratos por asfixia com CO2 e subsequente deslocamento cervical.
- Pin para baixo os membros de ratos, tal como ilustrado na Figura 4. Retire a pele a partir da parte superior da perna e um lombo e flanco e fixá-lo com agulhas como na Figura 4. Em seguida, remover o tecido adiposo subcutâneo, que está localizado posterior na base do patas traseiras, que rodeiam os nodos linfáticos inguinais (como mostrado na Figura 4, à esquerda: almofada de gordura subcutâneas é indicado pelas setas; direita: linfonodo inguinal indicado pela seta).

Figura 4: Localização das almofadas de gordura subcutânea. Imagem de almofada de gordura subcutânea; as setas esquerda indicam a almofada de gordura subcutânea ea seta para a direita indica o nó de linfa inguinal. Por favor clique aqui para ver uma versão maior desta figura.
- Isolar células estaminais derivadas de tecido adiposo (adsc) como previamente descrito 20.
- ADSC Semente 4.000 células / cm2 em Dulbecco modificado de Eagle da média Ham F-12 suplementado com 10% de soro normal de bezerro, 1% de penicilina / estreptomicina, 0,5% de anfotericina B, 16 uM de biotina, 18 uM de ácido pantoténico e 100 ácido uM ascórbico e cultura crescer até à confluência em torno de 70 a 80%, O que é atingido após 4 a 6 dias de cultura.
- Induzir Adipog�ica Diferenciação.
- Remover o ADSC aderente a partir da superfície por tratamento com tripsina.
- Remover o meio, lava-se com PBS e adicionar uma solução de tripsina a 0,025% (pré-aquecido a 37 ° C) durante 2 min (até as células separar da superfície). Imediatamente adicionar meio e lavar as células.
- Contar as células usando uma câmara de Neubauer.
- Coloque a tampa de vidro sobre a zona central da câmara de Neubauer. Dilui-se a suspensão de células 1:10 e carregar a câmara com 10 ul de suspensão de células diluídas. Contar as células em 4 quadrados localizados nos cantos, cada um composto por 16 quadrados mais pequenos. Calcular o número de células por ml:
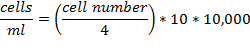
- Coloque a tampa de vidro sobre a zona central da câmara de Neubauer. Dilui-se a suspensão de células 1:10 e carregar a câmara com 10 ul de suspensão de células diluídas. Contar as células em 4 quadrados localizados nos cantos, cada um composto por 16 quadrados mais pequenos. Calcular o número de células por ml:
- ADSC semente (tal como descrito no ponto 2.2) em placas de cultura de 12 poços e crescem cultura até à confluência em torno de 70 a 80% (obtido após 4 a 6 dias).
- induzir adipogenic diferenciação pela adição de 5 ug / ml de insulina, dexametasona 1 | iM e 5 uM de 3-isobutil-1-metilxantina (IBMX) para as culturas. Renovar o meio a cada 2 dias. As células serão totalmente diferenciadas após 7 dias.
- Remover o ADSC aderente a partir da superfície por tratamento com tripsina.
- Para analisar a diferenciação adipogênica, mancha com Oil Red O, que mancha triglicéridos de adipócitos maduros.
Nota: O trabalho deve ser realizado sob um exaustor!- Remover o meio, lavar os adipócitos suavemente com PBS e fixar as células durante 60 minutos com 2 ml de formalina a 10%.
- Para preparar a solução corante Oil Red O, mistura 3 partes da solução de vermelho de óleo O estoque (300 mg Oil Red O pó dissolvido em 100 ml de 99% de isopropanol) com 2 partes de H2O destilada e incubar durante 10 min à temperatura ambiente. Filtra-se a solução de trabalho de Oil Red O injecção através de um filtro de 0,2 um.
Nota: A solução de trabalho é estável durante 2 horas. - Para a coloração com Oil Red O, remover a formalina, lavar com H 2 adipócitos O, incubar com 2 ml de 60% de isopropanol durante 5 minutos, remover o isopropanol e adiciona-se 2 ml de solução de trabalho de Oil Red O durante 5 min. Lavar as células com água da torneira até que a água é clara. Contracoloração com hematoxilina como no ponto 1.4.4.5).
- Avaliar as placas sob um microscópio de contraste de fase com 100 ampliação vezes. Os lípidos dos adipócitos aparecerá vermelho e os núcleos aparecem em azul.
- Etapa opcional: silenciar o gene de interesse por transfecção com shRNA.
- Alterar a médio e adicione meio livre de soro.
- Para a transfecção de adipócitos, usar lipofecção. Seguir as instruções do fabricante e usar um shRNA ug por placas de tecido de 12 poços. Após a adição do lípido-ADN-complexo, adipócitos incubar durante 48 horas a 37 ° C.
- Para analisar adipócitos submetidas à hipoxia, usar uma estação de trabalho ou hipóxico incubadora hipóxico para manter as células em condições de hipóxia. Dependendo do estudo, hipoxia could ser 0,5, 1 ou 2% de oxigénio.
- Analisar por apoptose Anexina V marcada com FITC e fluxo posterior análises de citometria.
- Reunir adipócitos com um raspador de células extra macio, lava-se com PBS e adicionar 1 x 10 6 células a 100 ul de tampão de anexina-V de ligação (Hepes 10 mM / NaOH, pH 7,4; 140 mM de NaCl; 2,5 mM CaCl2). Adicionar a quantidade de anexina V-FITC recomendado pelo fabricante e incubar à temperatura ambiente durante 15 min.
- Para a citometria de fluxo de medição, adicionar 200 uL de tampão de ligação a anexina V e 1 uM de contraste nuclear. Determinar a fluorescência no canal verde e violeta. Células contracoloração + / + nuclear anexina V são definidos como necrótico secundário e anexina V + / contraste nuclear - células são definidas como células apoptóticas (Figura 5).
- Quantitativamente analisar nível de RNA de adipócitos para determinar a homeostase em condições de hipóxia.
- AdicionarSolução de 1 ml de fase única de isotiocianato de guanidina e fenol a cada poço e isolar o ARN [utilizando o método de um único passo por Chomczynski e Sacchi 17 (passo 1.3.2)] e proceder como nas etapas 1.3.2.1) para 1.3.5.2) .
- Analisar por apoptose Anexina V marcada com FITC e fluxo posterior análises de citometria.
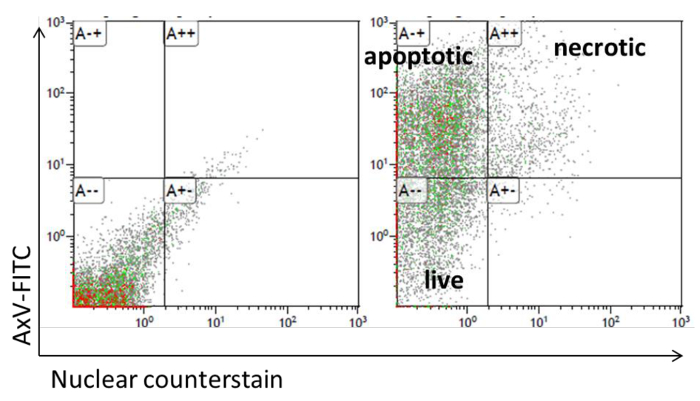
Figura 5: Análise de apoptose por citometria de fluxo de adipocitos. Apresentações gráfico de pontos dos FACS para anexina V-FITC e TO-PRO-3 coloração dos adipócitos. Por favor clique aqui para ver uma versão maior desta figura.
Resultados
Mostramos como determinar adipócito homeostase in vivo e in vitro, usando o exemplo de Fra-2 fl / FL ratinhos FABP4-CreERT comparados com crias da mesma ninhada de tipo selvagem. Nosso protocolo define como o aumento da expressão de HIF por hipoxia está correlacionada com a disfunção do adipócito, tal como indicado pelo aumento da apoptose de adipócitos.
camundongos aumento do tamanho dos adipócitos e área em dieta rica em gordura (DFH) tratados
Sobre-nutrição, entre outros factores, resulta em hipertrofia de adipócitos, devido a um armazenamento de energia excessiva nas gotículas lipídicas. O tamanho dos adipócitos e a área é um indicador de hipertrofia. Seções da almofada de gordura do normal (ND; Figura 6A) e dieta rica em gordura (HFD; Figura 6b) ratos, bem como quantificações do tamanho dos adipócitos e na área mostram claramente a hipertrofia dos adipócitos após seis semanass de DH, o que é indicado pelo aumento do tamanho dos adipócitos nos ratinhos tratados HFD (Figura 6C e D).
O aumento da hipoxia no tecido adiposo (TA) de adulto Fra-2 fl / FL-FABP4 CreERT ratinhos leva a um aumento do nível de HIF-1α e apoptose de adipócitos
Para determinar o estado in vivo de hipoxia em AT, A partir de 2-fl / FL ratinhos FABP4-CreERT são analisados 6 semanas após Fra-2 deleção com a idade de 12 semanas e comparados com crias da mesma ninhada de tipo selvagem. Pimonidazole é administrada aos ratos por via intraperitoneal como um marcador eficaz hipoxia; que é não tóxico e capaz de distribuir em AT. Adipócitos hipóxicos no AT in vivo são definidos pela coloração de anticorpos imuno-histoquímica (Figura 7a). Além disso, o aumento do estado hipóxico do AT em ratinhos é acompanhada por um aumento positivo ADIP HIF-1αocytes como indicado pela coloração imuno-histoquímica Figura 7b), o que é confirmado pela quantificação dos níveis de expressão de HIF-1α e seus Objectivos genes 9. Além disso, a coloração TUNEL de seções a de Fra-2 fl / fl ratos FABP4-CreERT e littermates controle (Figura 7C) mostra que o aumento da apoptose dos adipócitos está correlacionada com a presença de hipóxia e de expressão HIF-1α.
A expressão aumentada de HIF-1α em adipócitos primários através de hipoxia induzida apoptose de adipócitos
Para a análise dos adipócitos apoptose in vitro, usamos adipócitos gerados a partir de almofadas de gordura subcutânea conforme já descrito 20. Como esperado, a expressão de HIF-1α nos adipócitos é aumentada após 24 horas de hipoxia (Figura 8a). Para analisar melhor as atividades de HIF-1α, os níveis de ARN de alvo HIFgenes tais como Inos (indutível da sintase do óxido nítrico) são quantificados por qPCR. A Figura 8B mostra que a expressão aumentada de HIF-1α sob condições hipóxicas leva ao aumento do nível de ARNm Inos. Uma vez que já foi demonstrado in vivo (Figura 8) que a expressão aumentada de HIF-1α em adipócitos se correlaciona com um aumento da apoptose de adipócitos, a apoptose também é quantificada em culturas in vitro por coloração com anexina V sob condições hipóxicas. Consistente com os dados in vivo (Figura 7), um aumento do nível de HIF-1α é acompanhada por um aumento da apoptose de adipócitos induzida por condições hipóxicas (Figura 8b). Além disso, para provar que a apoptose induzida por hipoxia HIF-é dependente; HIF-1α ou HIF-2α é silenciada pela interferência de RNA em adipócitos derivados de tipo selvagem ou Fra-2 camundongos deficientes. O aumento da apoptose de adipócitos é restaurada por silenciamento de HIF-1α ou HIF-2α como mostrado por Anexina Coloração V na Figura 8b, provando que o sensor de hipoxia HIF-α regula a apoptose de adipócitos.
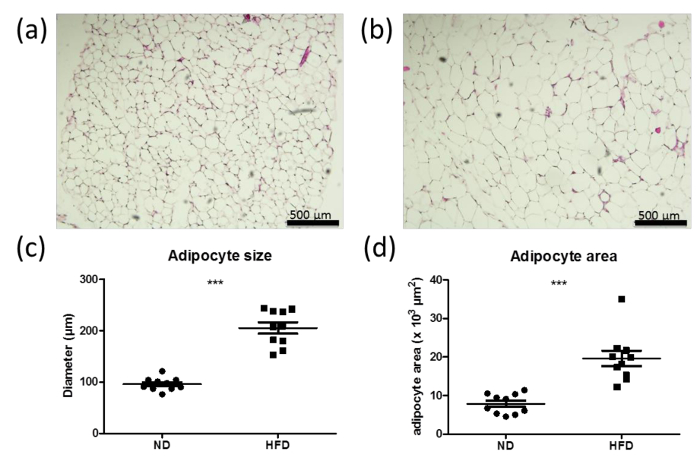
Figura 6: Aumento do tamanho dos adipócitos e área na dieta rica em gorduras os ratos (HFD) (a, b) H & E coloração de secções de almofada de gordura perigonadal de ratinhos de tipo selvagem machos alimentados com dieta normal (ND) (a) ou alta. dieta -fat (HFD) (b) durante 6 semanas. As barras representam a 500 um. (C, d) quantificações de tamanho dos adipócitos (C) e na área (d) a partir da almofada de gordura perigonadal de ratinhos de tipo selvagem, alimentados com ND (a) ou DH (b) durante 6 semanas. n = 10. Os dados são apresentados como valores médios ± SEM. A análise estatística foi realizada utilizando Student t -test. *** P <0,0001.: //www.jove.com/files/ftp_upload/53822/53822fig6large.jpg "Target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
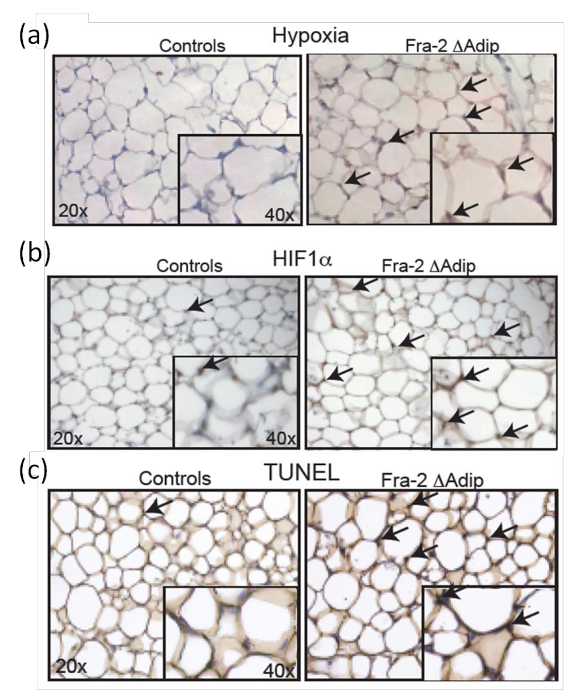
Figura 7: Aumento do nível HIF-1α e apoptose em adipócitos de adulto FRA-2 fl / fl ratos FABP4-CreERT. A hipoxia (a), e HIF-1α (b) coloração em AT de Fra-2 fl / FL ratinhos FABP4-creERT e crias da mesma ninhada de controlo machos de 6 semanas após a injecção tamoxifeno macho. Ampliação 20X, insira 40X. Setas pretas indicam áreas de hipóxia e células positivas HIF-1α. (C) coloração TUNEL em Fra-2 fl / fl ratos FABP4-CreERT e littermates controle em 6 semanas após a injeção de tamoxifeno. Ampliação 20X, insira 40X. Setas pretas indicam células positivas TUNEL. Este valor foi modificado a partir de Luther etal. 9. Por favor clique aqui para ver uma versão maior desta figura.
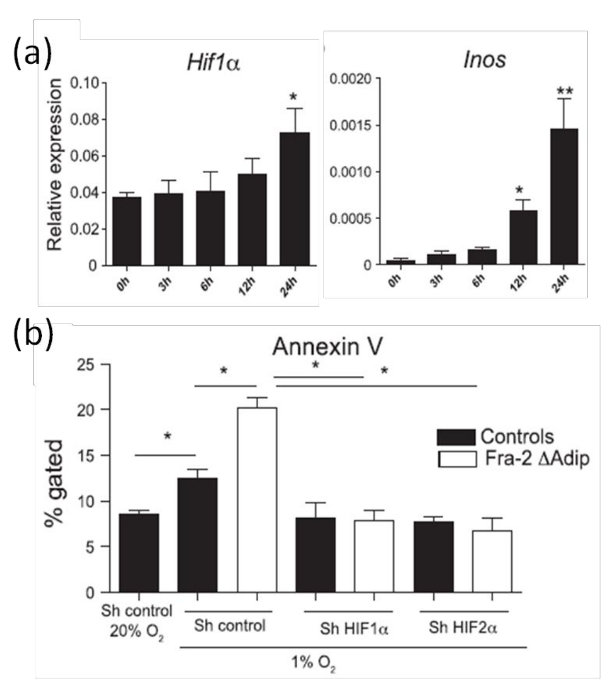
Figura 8:. Expressão HIF-1α Aumento e adipócitos apoptose em adipócitos primários induzidos por hipoxia (a), em tempo real A análise de PCR dos níveis de mRNA Inos alvo HIFs HIF-1α e em adipócitos primários colocados em câmaras hipóxicas analisados nos pontos de tempo indicados. (B) Quantificação da apoptose por coloração anexina V FACS em adipócitos primários isolados de Fra-2 fl / fl ratos FABP4-CreERT ou controles do tipo selvagem transfectadas com controle sh ou plasmídeo sh contra HIF-1α ou HIF-2α e colocados sob hipóxia (1% de O2) durante 24 h. Este valor foi modificado a partir de Luther et al. 9. Os dados são apresentados como valores médios ± análise estatística SD foi utilizado o teste t de Student. * P <0,05 e ** P <0,01 foram aceitos como significativo. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Adipócitos são caracterizados fenotipicamente pelo seu tamanho, números e área, revelando hiperplasia dos adipócitos e hipertrofia, induzida pelo armazenamento excessivo de energia devido ao excesso de nutrição 5. Estes eventos que levam a desregulação de ácidos graxos e subsequentes síndromes metabólicas são também afirma de aumento da massa gorda com metabolismos preservadas, que também é referido como a expansão de gordura "saudável". Por exemplo, Kusminski et al. 21 mostraram que ratos com expansão de gordura enorme permanecem metabolicamente saudáveis, sugerindo que a expansão de gordura não está necessariamente ligada a síndromes metabólicas e precisa ser cuidadosamente determinados para avaliar as características dos adipócitos. O tecido adiposo (TA) desempenha um papel central na regulação do metabolismo do corpo. AT é o maior órgão endócrino que possa influenciar dislipidemia, aterosclerose, hiperinsulinemia e hiperglicemia 3. Avaliando AT homeostase e da m molecularecanismos regulam que poderia permitir uma melhor compreensão dos distúrbios do sistema metabólico. Portanto, desvendar os mecanismos que regulam a diferenciação dos adipócitos, o tamanho dos adipócitos e massa almofada de gordura iria ajudar a desenvolver novos tratamentos terapêuticos para transtornos de obesidade. Usando in vivo e in vitro, é possível determinar o papel de impactos de alimentos e de expressão de genes em diferenciação de adipocitos e actividade. Para determinar a homeostase AT, determinação do equilíbrio entre a diferenciação de adipócitos, proliferação e apoptose, tal como sugerido pelo nosso protocolo é tão importante como a analisar a glucose e insulina resposta metabólica 22-24.
Expression profiling análises de genes envolvidos na adipogénese, a lipogénese, a lipólise, absorção de ácidos gordos, hipoxia, apoptose e a proliferação em adipócitos primários e TA visceral é um método de alto rendimento para a obtenção de uma visão geral sobre a homeostase de adipócitos e a sua possibilidade de disfunção.candidatos interessantes deve ser ainda analisada ao nível proteico por western blot ou coloração imuno-histológica. Para obter os melhores resultados através do sistema de PCR em tempo real com corantes de cianina não simétricos, as concentrações de ADNc que variam de 1 a 10 ng de iniciadores e as concentrações óptimas variando de 50 a 900 nm, deve ser testado para minimizar a amplificação não específica. Os componentes críticos são os iniciadores; para cada ensaio, as curvas de fusão têm de ser rigorosamente controladas para assegurar a especificidade e exclui a formação de dimeros de iniciadores. Portanto, utilizando-se um controlo negativo com H2O em vez de cDNA é recomendado. Além disso, comerciais disponíveis corantes de cianina não simétricas são fornecidos como misturas principais que contêm um corante de referência passiva (tais como ROX) para proporcionar um sinal de referência interno. O sinal de ADNc é normalizada durante a análise de dados para os sinais de ROX para corrigir as flutuações do sinal bem-a-poço. Outro ponto a ser considerado, a fim de estabelecer um good qPCR sistema é a escolha do gene de manutenção. Para cada condição, vários genes de manutenção são utilizados, por exemplo, HPRT, β-actina, GAPDH, β-2-MG ou HSP90.
Proteínas HIF estabilizados por meio de condições de hipóxia são master reguladores que determinam não só adipócitos sobrevivência, mas também alterações metabólicas, tais como glucose, tolerância à insulina e do metabolismo lipídico 11,25,26. Para determinar áreas de hipóxia na almofada de gordura, HIF-1α é determinado no AT secções por imuno-histoquímica. Desde proteínas HIF são rapidamente degradados dentro de 5 a 10 minutos, sob condições de normóxia, o processo e a fixação da almofada de gordura para análise histológica deve ser rigorosamente controladas para evitar um tempo de latência. Portanto, para assegurar a hipoxia não só através de coloração de HIF, pimonidazole é utilizado para determinar as áreas hipóxicas em AT. Pimonidazole é capaz de distribuir em tecidos, tal como já foi mostrado na ossos 27, E efectivamente marcar as áreas hipóxicas através da ligação a proteínas contendo tiol especificamente em células hipóxicas, que é ainda detectados em secções histológicas de ligação do anticorpo específico 28. No entanto, outros marcadores e métodos podem ser utilizados para analisar a via de hipóxia. Por exemplo, o envolvimento da enzima prolil hidroxilase (PHD), que induzem a hidroxilação de resíduos de prolina sob normoxia, bem como a proteína de von Hippel-Lindau (VHL), que reconhecem prolinas hidroxilados e induzir o poli-ubiquitinação de mediar proteossómica HIF degradação, precisam ser analisados para obter uma visão completa da via de 29,30. Além disso, a detecção de ubíqua HIFs também iria determinar a estabilidade da proteína e degradação que podem ser alterar 31,32.
Além disso, a proliferação de Ki67 e apoptose por coloração TUNEL são determinados in vivo através da coloração de cortes histológicos AT. A quantificação da proliferação de Ki67 e umpoptosis por TUNEL ou V coloração Anexina através de análise de citometria de fluxo é também levada a cabo 33. A proliferação pode, evidentemente, ser medido por outras técnicas, tais como as análises do ciclo celular dos adipócitos, o que não é tratado na medição das células positivas Ki67. Além disso, o estudo apoptose por TUNEL pode ser completado por FACS análise de anexina V e TOP-PR-3, que vai determinar os níveis de necrose versus o processo de morte celular apoptose. A apoptose é um processo fundamental para o programa de morte celular, o que é importante para a AT homeostase. Com efeito, a desregulação da apoptose de adipócitos tem sido implicado anteriormente em processos que contribuem para a obesidade e lipodistrofia 34. Além disso, em 2011, Keuper et ai. Ligada a inflamação do tecido adiposo a apoptose de adipócitos. Eles mostraram que os macrófagos induziu apoptose em pré-adipócitos e adipócitos, que por sua vez atrair macrófagos. O recrutamento de macrófagos acelera a inflamação, que contributes a síndromes metabólicas, tais como glicose e insulina tolerância 35. No entanto, a apoptose de adipócitos ainda é um fenómeno pouco estudada, apesar da hipótese de que a apoptose induzida por adipócitos pode causar a redução de peso.
O presente protocolo utiliza abordagens imuno-histoquímica para estudar fenómeno diferente, como a proliferação, apoptose e hipóxia in vivo. Portanto, o tecido foi fixada com formaldeído a 4%, o que é um passo crítico. Um tempo de fixação do tecido prolongado leva à mudança dos epitopos, que se tornam não acessíveis para o anticorpo. Em contraste, um curto tempo de fixação aumenta a sensibilidade dos epítopos para os reagentes. O tempo óptimo é recomendado de fixação 24 h. Além disso, a espessura das secções também influencia os anticorpos que se ligam aos seus epitopos; espessura óptima situa-se entre 2 e 5 um. As secções mais espessas do que 5 um se obter resultados falsos positivos devido a locais de ligação aumentadas. Em contraste, sexões mais fino do que 2 um conter locais de ligação e menos áreas positivas não são bem definidas. Outros factores importantes são o próprio anticorpo, tempo de incubação, concentração e temperatura, mesmo, que influenciam a qualidade da ligação para os epitopos específicos. Portanto, a validação concentração e tempo de incubação de anticorpo é necessário para cada condição.
Para concluir o estudo, nós fornecemos uma in vitro adipócitos protocolo de diferenciação, o que poderia ser prorrogado por tratamentos diferentes, a estimulação ou co-culturas. Ao usar em culturas de adipócitos in vitro, é possível determinar defeitos de diferenciação de adipócitos e funções. Para obter resultados confiáveis, como para todas as células primárias, o comportamento saudável e aparência das ADSCs e adipócitos é muito importante. A granularidade, vacuolations e / ou descolamento citoplasmática são sinais de deterioração, indicando meio inadequado, contaminação microbiana ou senescência das primáriascélulas. Este protocolo é utilizando adipócitos isolados a partir do tecido almofada de gordura, que é também possível utilizar células estaminais mesenquimais isoladas da medula óssea, como descrito por outros protocolos 36. A mais recente inclui células progenitoras do estroma, o que pode refletir problemas de diferenciação adicionais que ocorrem na fase muito inicial de diferenciação dos adipócitos, isso pode ser desperdiçada em nosso protocolo atual. Além disso, ADSCs pode ser expandido rapidamente (mais de 10 vezes dentro de uma semana), e ADSCs cultivadas a longo prazo após algumas passagens ainda mantêm a sua pluripotência mesenquimais 37,38. Outra vantagem usando ADSCs é que se pode facilmente mudar para humana, uma vez que ADSCs podem ser colhidas de pacientes por lipoaspiração, que é um método simples e minimamente invasivo.
Como AT influencia vários outros órgãos de forma endócrina, o protocolo deve ser alargado a adipocinas. Adipocinas, tais como leptina, adiponectina, factor de necrose tumoral-α (TNF), umaND resistina, segregada por adipócitos são conhecidos por afectar as doenças metabólicas, controlando o metabolismo da gordura, homeostase energética e 39 da sensibilidade à insulina. Por conseguinte, as análises do soro e secretoma adipócito deve ser realizada. No caso da EM, disfunção adipocitoquinas e citocinas pró-inflamatórias, tais como IL-6, pode levar a distúrbios de órgãos tais como o fígado e o pâncreas, e da função do músculo 4. A fim de excluir a disfunção de órgãos sistémica, modelos animais ou culturas de células podem ser testadas quanto à sua resposta à glicose estimulação e absorção.
Aqui nós fornecemos um protocolo para analisar o estado básico da AT e adipócitos in vivo e in vitro para revelar os mecanismos moleculares da homeostase dos adipócitos e funcionalidade.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Os autores gostariam de agradecer amavelmente Dr. J. Luther e K. Ubieta para preparar os dados e Dr. B. Grötsch pela revisão do manuscrito. Este trabalho foi apoiado pelo Deutsche Forschungsgemeinschaft (BO3811 / 1-1-Emmy Noether).
Materiais
| Name | Company | Catalog Number | Comments |
| RNAlater solution | Ambion | AM7021 | RNA stabilization solution |
| High-Capacity cDNA Reverse Transcription Kit | Applied Biosystems | 4368813 | |
| SYBR Select Master Mix | 4472908 | ||
| Purified Mouse Anti-Human Ki-67 | BD Biosciences | 550609 | Clone B56 (RUO) |
| Purified Mouse Anti-Human Ki-67 Clone B56 (RUO) | 550609 | Proliferation marker | |
| FITC Annexin V | BioLegend | 640906 | |
| Cleaved Caspase-3 Rabbit mAb | Cell signalling | 9664S | Clone 5A1E |
| Cleaved Caspase-3 (Asp175) (5A1E) Rabbit mAb | 9664 | Apoptosis marker | |
| Lipofectamine2000 Reagent | Invitrogen | 11668-027 | |
| TO-PRO-3 Iodide | T3605 | Nuclear counterstain, Monomeric cyanine nucleic acid stain, Excitation⁄Emission: 642⁄661 nm | |
| Mayer’s hemalum | Merck | 109249 | hematoxylin |
| pegGOLD TriFast | Peqlab | 30-2030 | TRIzol, single-phase solution of guanidine isothiocyanate and phenol |
| Percellys Ceramic Kit 1.4 mm | 91-PCS-CK14 | tubes containing ceramic beads (1.4 mm) | |
| Precellys 24 | 91-PCS24 | homogenizer | |
| HIF-1 alpha Antibody | Pierce | PA1-16601 | |
| HIF-1 alpha Antibody, 16H4L13 | 700505 | Hypoxia marker | |
| In Situ Cell Death Detection Kit, Fluorescein | Roche | 11 684 795 001 | TdT-mediated dUTP-biotin nick end labeling (TUNEL) |
| Eosin | Sigma | 318906 | |
| DNase I Solution (1 unit/µl) | Thermo Scientific | EN0525 | |
| biotinylated anti mouse IgG (H+L) | Vector Laboratories | BA-9200 | |
| biotinylated anti mouse IgG (H+L) | BA-1000 | ||
| Vectastain ABC Kit | PK-4000 | ||
| VECTASHIELD Mounting Medium with DAPI | H-1200 |
Referências
- Obesity and Overweight. Fact Sheet °113. WHO. , (Jan 2014) (2014).
- Gong, Z., Muzumdar, R. H. Pancreatic function, type 2 diabetes, and metabolism in aging. Int J Endocrinol. , 320482(2012).
- Deng, Y., Scherer, P. E. Adipokines as novel biomarkers and regulators of the metabolic syndrome. Ann N Y Acad Sci. 1212, 1-19 (2010).
- Rezaee, F., Dashty, M. Role of Adipose Tissue in Metabolic System Disorders Adipose Tissue is the Initiator of Metabolic Diseases. J Diabetes Metab. , 008(2013).
- Rutkowski, J. M., Stern, J. H., Scherer, P. E. The cell biology of fat expansion. J Cell Biol. 208, 501-512 (2015).
- Ma, X., Lee, P., Chisholm, D. J., James, D. E. Control of adipocyte differentiation in different fat depots; implications for pathophysiology or therapy. Front Endocrinol (Lausanne). 6, 1(2015).
- Farmer, S. R. Transcriptional control of adipocyte formation. Cell Metab. 4, 263-273 (2006).
- Luther, J., et al. Elevated Fra-1 expression causes severe lipodystrophy. J Cell Sci. 124, 1465-1476 (2011).
- Luther, J., et al. Fra-2/AP-1 controls adipocyte differentiation and survival by regulating PPARgamma and hypoxia. Cell Death Differ. , (2014).
- Semenza, G. L. Regulation of mammalian O2 homeostasis by hypoxia-inducible factor 1. Annu Rev Cell Dev Biol. 15, 551-578 (1999).
- Kim, W., Kaelin, W. G. The von Hippel-Lindau tumor suppressor protein: new insights into oxygen sensing and cancer. Curr Opin Genet Dev. 13, 55-60 (2003).
- Aragones, J., Fraisl, P., Baes, M., Carmeliet, P. Oxygen sensors at the crossroad of metabolism. Cell Metab. 9, 11-22 (2009).
- Sun, K., Halberg, N., Khan, M., Magalang, U. J., Scherer, P. E. Selective inhibition of hypoxia-inducible factor 1alpha ameliorates adipose tissue dysfunction. Mol Cell Biol. 33, 904-917 (2013).
- Imai, T., Jiang, M., Chambon, P., Metzger, D. Impaired adipogenesis and lipolysis in the mouse upon selective ablation of the retinoid X receptor alpha mediated by a tamoxifen-inducible chimeric Cre recombinase (Cre-ERT2) in adipocytes. Proc Natl Acad Sci U S A. 98, 224-228 (2001).
- Clegg, D. J., Brown, L. M., Woods, S. C., Benoit, S. C. Gonadal hormones determine sensitivity to central leptin and insulin. Diabetes. 55, 978-987 (2006).
- Haluzik, M., et al. Genetic background (C57BL/6J versus FVB/N) strongly influences the severity of diabetes and insulin resistance in ob/ob mice. Endocrinology. 145, 3258-3264 (2004).
- Chomczynski, P., Sacchi, N. Single-step method of RNA isolation by acid guanidinium thiocyanate-phenol-chloroform extraction. Analytical biochemistry. 162, 156-159 (1987).
- Paraffin Processing of Tissue. Protocolsonline. , Available from: http://protocolsonline.com/histology/sample-preparation/paraffin-processing-of-tissue/ (2012).
- Schneider, C. A., Rasband, W. S., Eliceiri, K. W. NIH Image to ImageJ: 25 years of image analysis. Nat Methods. 9, 671-675 (2012).
- Planat-Benard, V., et al. Plasticity of human adipose lineage cells toward endothelial cells: physiological and therapeutic perspectives. Circulation. 109, 656-663 (2004).
- Kusminski, C. M., et al. MitoNEET-driven alterations in adipocyte mitochondrial activity reveal a crucial adaptive process that preserves insulin sensitivity in obesity. Nat Med. 18, 1539-1549 (2012).
- Trajcevski, K. E., et al. Enhanced lipid oxidation and maintenance of muscle insulin sensitivity despite glucose intolerance in a diet-induced obesity mouse model. PLoS One. 8, 71747(2013).
- Montgomery, M. K., et al. Mouse strain-dependent variation in obesity and glucose homeostasis in response to high-fat feeding. Diabetologia. 56, 1129-1139 (2013).
- de Queiroz, K. B., et al. Molecular mechanism driving retroperitoneal adipocyte hypertrophy and hyperplasia in response to a high-sugar diet. Mol Nutr Food Res. 58, 2331-2341 (2014).
- Ye, J. Emerging role of adipose tissue hypoxia in obesity and insulin resistance. Int J Obes (Lond). 33, 54-66 (2009).
- Xiong, Y., et al. The local corticotropin-releasing hormone receptor 2 signalling pathway partly mediates hypoxia-induced increases in lipolysis via the cAMP-protein kinase A signalling pathway in white adipose tissue. Mol Cell Endocrinol. 392, 106-114 (2014).
- Bozec, A., et al. Osteoclast size is controlled by Fra-2 through LIF/LIF-receptor signalling and hypoxia. Nature. 454, 221-225 (2008).
- Varia, M. A., et al. Pimonidazole: a novel hypoxia marker for complementary study of tumor hypoxia and cell proliferation in cervical carcinoma. Gynecol Oncol. 71, 270-277 (1998).
- Park, M. H., Choi, K. Y., Jung, Y., Min do, S. Phospholipase D1 protein coordinates dynamic assembly of HIF-1alpha-PHD-VHL to regulate HIF-1alpha stability. Oncotarget. 5, 11857-11872 (2014).
- Tennant, D. A., et al. Reactivating HIF prolyl hydroxylases under hypoxia results in metabolic catastrophe and cell death. Oncogene. 28, 4009-4021 (2009).
- Kim, J., So, D., Shin, H. W., Chun, Y. S., Park, J. W. HIF-1alpha Upregulation due to Depletion of the Free Ubiquitin Pool. Journal of Korean medical science. 30, 1388-1395 (2015).
- Amelio, I., et al. TAp73 opposes tumor angiogenesis by promoting hypoxia-inducible factor 1alpha degradation. Proceedings of the National Academy of Sciences of the United States of America. 112, 226-231 (2015).
- Suga, H., et al. Adipose tissue remodeling under ischemia: death of adipocytes and activation of stem/progenitor cells. Plast Reconstr Surg. 126, 1911-1923 (2010).
- Moreno-Indias, I., Tinahones, F. J. Impaired adipose tissue expandability and lipogenic capacities as ones of the main causes of metabolic disorders. J Diabetes Res. 2015, 970375(2015).
- Keuper, M., et al. An inflammatory micro-environment promotes human adipocyte apoptosis. Mol Cell Endocrinol. 339, 105-113 (2011).
- Sera, Y., et al. Hematopoietic stem cell origin of adipocytes. Experimental hematology. 37, 1108-1120 (2009).
- Zuk, P. A., et al. Multilineage cells from human adipose tissue: implications for cell-based therapies. Tissue engineering. 7, 211-228 (2001).
- Zuk, P. A., et al. Human adipose tissue is a source of multipotent stem cells. Molecular biology of the cell. 13, 4279-4295 (2002).
- Scherer, P. E. Adipose tissue: from lipid storage compartment to endocrine organ. Diabetes. 55, 1537-1545 (2006).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados