Method Article
Aplicações da sonda Individual: Imagem Espectrometria de Massa e Análise única célula sob condições ambientais
Neste Artigo
Resumo
Here, we present protocols to perform both ambient mass spectrometry imaging (MSI) of tissues and in-situ live single cell MS (SCMS) analysis using the single-probe, which is a miniaturized multifunctional device for MS analysis.
Resumo
Mass spectrometry imaging (MSI) and in-situ single cell mass spectrometry (SCMS) analysis under ambient conditions are two emerging fields with great potential for the detailed mass spectrometry (MS) analysis of biomolecules from biological samples. The single-probe, a miniaturized device with integrated sampling and ionization capabilities, is capable of performing both ambient MSI and in-situ SCMS analysis. For ambient MSI, the single-probe uses surface micro-extraction to continually conduct MS analysis of the sample, and this technique allows the creation of MS images with high spatial resolution (8.5 µm) from biological samples such as mouse brain and kidney sections. Ambient MSI has the advantage that little to no sample preparation is needed before the analysis, which reduces the amount of potential artifacts present in data acquisition and allows a more representative analysis of the sample to be acquired. For in-situ SCMS, the single-probe tip can be directly inserted into live eukaryotic cells such as HeLa cells, due to the small sampling tip size (< 10 µm), and this technique is capable of detecting a wide range of metabolites inside individual cells at near real-time. SCMS enables a greater sensitivity and accuracy of chemical information to be acquired at the single cell level, which could improve our understanding of biological processes at a more fundamental level than previously possible. The single-probe device can be potentially coupled with a variety of mass spectrometers for broad ranges of MSI and SCMS studies.
Introdução
Mass spectrometry imaging (MSI) is a relatively new molecular imaging technique to provide the spatial distribution of the compounds of interest on surfaces. During the MSI analysis, mass spectrometry (MS) measurements are recorded across the surface on an individual pixel basis to create a 2D image of the species of interest 1. MSI techniques have the ability to provide a spatially resolved feature distribution for a large range of metabolites, allowing a much greater amount of information to be obtained from a sample than from using traditional molecular imaging techniques, and they have the potential to greatly improve the analysis of biological samples for biological and pharmacology studies 2. MSI can be broadly separated into non-ambient and ambient approaches. The non-ambient MSI analysis techniques, such as matrix assisted laser desorption ionization (MALDI) MS 3 and time of flight secondary ion MS (ToF SIMS) 4, are capable of high spatial resolution (around 5 µm and 100 nm, respectively) and high sensitivity. However, these methods require extensive sample preparation, such as the application of matrix molecules to the sample surface, and a vacuum sampling environment, which could introduce artifacts to the data obtained. Ambient techniques such as desorption electrospray ionization (DESI) MS 5, laser ablation electrospray ionization (LAESI) MS 6, and nano-DESI MS 7 are capable of MSI of samples with little to no prior preparation under the ambient environment, which is able to produce MS images that potentially reflect the sample in its most native state. However, most of these techniques generally lack the high spatial resolution and detection sensitivity compared with the non-ambient techniques, with experiments typically conducted at around 150 µm per pixel 8.
Single cell analysis (SCA) is a growing field that has the ability to characterize the chemical composition of biological samples at the cellular level. SCA enables the analysis of biological systems at a more fundamental level than traditional cell analysis techniques, which produce an averaged result of a population of cells, potentially providing insights that are previously intractable 9. MS techniques have recently been applied to SCA (termed single cell mass spectrometry or SCMS) using non-ambient techniques such as MALDI MS 10 and ToF SIMS 11 in which cells are pretreated before analysis, and with ambient techniques such as LAESI MS 12 and direct extraction methods, such as live single-cell video-MS 13, 14, to analyze a wide variety of cell types such as egg, plant, and cancer. Ambient techniques have the advantage of being applied to live cells, which again minimizes the artifacts, leading to a better representation of the metabolites in the live cells. The direct extraction based methods described above, however, perform the sample extraction and analysis process at two different steps, which result in a time gap during the analysis that could potentially alter the metabolites present within the sample.
The single-probe, a miniaturized multifunctional device that is capable of conducting high spatial resolution ambient MSI on biological tissue sections 15 and near real-time in-situ SCMS on live single cells 16. The single-probe has an integrated construction that is made up of a pulled dual-bore quartz capillary coupled with a solvent providing inlet and a nano-ESI emitter made from fused silica capillaries, enabling solvent delivery and analyte extraction to be performed from a single device. In the ambient MSI mode, the single-probe is placed over the sample tissue and surface micro-extraction occurs, allowing a rastered MS image to be made at high spatial resolution. Particularly, the tapered tip of the single-probe is small enough to be inserted into live eukaryotic cells for in-situ SCMS analysis, where the metabolite detection takes less than two seconds between probe insertion and MS detection, allowing chemical information to be taken in near real-time. Here are the protocols to fabricate the single-probe device and to conduct both the ambient MSI and SCMS modes using the single-probe MS techniques.
Protocolo
uso de animais e bem-estar devem aderir ao Guia do NIH para o Cuidado e Uso de Animais de Laboratório seguindo protocolos analisados e aprovados pelo Comitê de Cuidado e Uso Institucional Animal (IACUC). amostras de tecido de rato foram fornecidos pelo colaborador Dr. Chuanbin Mao.
1. Rato Tissue Seção Preparação
- Coloque um órgão inteiro do rato de interesse (cérebro, rim, fígado, etc.) no centro de um pequeno poço de plástico (por exemplo, de 12 poços da placa de cultura de células), e submergir no tecido incorporação composto até cerca de 10 mm de altura. Certifique-se de que não há bolhas formadas no composto incorporação de tecidos e de que o órgão é colocado na orientação desejada (isto é, sagital, coronal, etc).
- Imediatamente coloque tecidos em nitrogênio líquido para o flash de congelamento. Para armazenamento a longo prazo, armazenar as amostras congeladas num congelador de -80 ° C.
- Tome o órgão congelada mouse e descongelar a -15 ° C em uma temperature cryomicrotome controlada.
- tecido seguro sobre uma base de aço com cerca de 500 ul de composto incorporação de tecido e colocar para uma cryomicrotome seccionamento montagem de modo que a orientação do corte desejada é apresentada à faca.
- Secção do tecido com uma espessura de 12 um. Coloque fatias de tecido seccionados em lâminas de microscópio de policarbonato e deixa-se secar durante 30 minutos à temperatura ambiente. Para armazenamento a longo prazo, a corrediça armazenar congelada num congelador de -80 ° C.
Cultura 2. celular
Nota: A cultura de células foi realizada em cabine de segurança biológica (Nível de Biossegurança II) em condições estéreis. A linha de células HeLa foi usada como um sistema modelo, e as células foram cultivadas em meio de cultura completo com os seguintes protocolos convencionais:
- Reagentes quentes (isto é, a tripsina, a solução salina tamponada com fosfato (PBS), e meio de cultura celular) a 37 ° C.
Nota: O meio de cultura de células contém SA inorgânicolts, aminoácidos, vitaminas e outros. Para uma lista completa dos componentes, referem-se a formulação a partir do fabricante. - Obter amostra celular (por exemplo, 1 ml de suspensão de células HeLa) e adicioná-lo em 9 ml de meio de cultura celular completo numa placa de cultura de células padrão de 10 cm. O número inicial de células é de cerca de 0,5 X 10 6 células / ml. Manter as células em cultura a 37 ° C com 5% de CO 2 durante 2-3 dias até que a superfície de cultura é coberto a 70-80% na placa de cultura celular. número de passagens celulares registro para cada rodada sucessiva.
- Realizar Passaging celular (ou seja, divisão de células) na placa de cultura celular.
- Aspirar o meio de crescimento, e utilizar 5 ml de 1x PBS para lavar as células. Remover PBS utilizando uma ponta de aspiração estéril, e incuba-se as células com 2,5 ml de tripsina (0,25%) durante ~ 5 min a 37 ° C para separar as células da placa de cultura.
Nota: precisa do tempo de tratamento de tripsina real a ser otimizado de acordo com a produ tripsina específicact comprados do fabricante. tempo de tratamento inadequado deixa as células ligadas à placa, enquanto que o tratamento excessivo conduz à morte celular. - Pare a actividade da tripsina por adição de 7,5 ml de meio de cultura celular completo, e em seguida uniformemente ressuspender as células (volume total 10 ml). Use a suspensão de células para a cultura (passo 2.2) ou preparação de amostras SCMS (passo 2.4).
- Aspirar o meio de crescimento, e utilizar 5 ml de 1x PBS para lavar as células. Remover PBS utilizando uma ponta de aspiração estéril, e incuba-se as células com 2,5 ml de tripsina (0,25%) durante ~ 5 min a 37 ° C para separar as células da placa de cultura.
- Prepare as amostras de células para experiências SCMS.
- Colocar as lâminas de cobertura de micro individuais numa placa de 12 poços, e adicionar 1,8 ml de meio de cultura de células e 0,2 ml de suspensão de células no poço.
- Misturar suavemente as células com agitação suave da placa, e incuba-se num ambiente de 5% de CO2 a 37 ° C durante ~ 24 horas. Para realizar o tratamento de droga para as células em cultura, adicionar uma solução do composto de fármaco (por exemplo, no seio de DMSO (sulfóxido de dimetilo)) em 12 poços da placa de cultura de células.
Nota: A concentração de fármaco final (por exemplo, 10 nM, 100 nM, 1 pM e 10 uM) e ttempo ratamento (por exemplo, 4 horas) são variados de acordo com a finalidade específica de estudos. As células são ligados às lâminas de cobertura micro e pronto para as experiências CSMS (passo 6).
Fabrication 3.-sonda Individual
- Coloque o tubo de quartzo dual-furo (diâmetro interno (ID) 127 mm, diâmetro externo (OD) 500 mm) em uma micropipeta extrator laser e puxar uma agulha de quartzo dual-furo. Utilize os seguintes parâmetros como pontos de partida: Calor = 400, Fil = 3, Vel = 80, Del = 150, e Pul = 250 (todas as unidades são unidades do fabricante). Certifique-se de que a agulha dual-furo de quartzo puxou tem uma ponta afilada para propriedades de sonda ideais. Cortar a ponta puxado de modo que não é aproximadamente 5 mm de comprimento da dupla-unpulled furo capilar de quartzo à esquerda na outra extremidade.
Nota: Os parâmetros reais do puxador de laser deve ser optimizado de acordo com as condições específicas do instrumento. - Cortar uma secção de ~ 80 mm capilar de sílica fundida (ID 40 um, OD. 105 mm) como solvente proporcionando capilar, e inseri-lo em um furo na extremidade plana da agulha quartzo dual-furo.
- Corte um pedaço ~ 40 mm capilar de sílica fundida (ID 40 mm, OD 105 mm) e usar um aparelho de barbear para raspar ~ 5 milímetros de revestimento de poliimida do ponto médio. Use uma chama de propano para aquecer rapidamente e puxe o capilar fundidos em um emissor de ionização de nano-electrospray (ESI) com uma inclinação bem. Corte um emissor de nano-ESI (~ 7-10 mm de comprimento), e inseri-lo em outro furo na extremidade plana da agulha quartzo dual-furo. Em alternativa, usar o extrator de laser para produzir uma multa de estreitamento.
- Aplicar uma quantidade mínima de (~ 1-2 ul) de resina de cura por UV sobre a extremidade plana de quartzo a agulha dupla de calibre, e solidificar a resina utilizando uma lâmpada de UV de LED para ~ 20 seg para fixar o solvente proporcionando o capilar e nano- emissor ESI. Os procedimentos para montar as peças individuais em um único-sonda são apresentados na Figura 1a.
- Corte um gl microscópio padrãoslides ass (1 "x 3") ao meio no sentido do comprimento. Coloque a single-sonda para uma das extremidades da placa de vidro de modo a que o emissor de nano-ESI é apontada para o exterior. Aplicar o epóxi normal para o corpo do single-sonda de modo que torna-se fixada sobre a lâmina de vidro (Figura 1b). Deixe durante a noite para o endurecimento. Acoplar a-sonda única fabricado com a configuração-sonda integrado único (Figura 1C), o qual está ligado a um espectrómetro de massa, tal como ilustrado na Figura 1D.
4. Criar o Integrated Single-sonda Setup MS
- Modificar a flange de interface fonte de iões do espectrómetro de massa e fabricar o suporte (com posição ajustável e altura) do estereoscópio digitais (Figuras 1e e 1f).
- Perfurar um flange de interface fonte de íons com dois buracos que permitem a fixação de uma placa óptica de alumínio. Faça um dispositivo de trilho deslizante e uma haste de ajuste de altura (anexo aouma plataforma XY para ajuste fino de posição), de tal modo que o sistema estereoscópico digital pode ser ligado à placa óptica de alumínio (Figura 1E).
- Anexar o microscópio modificado estéreo digital, um microscópio digital USB, um manual miniatura XYZ fase de tradução com um suporte de fixação flexível, o sistema de fase de tradução motorizado XYZ à placa óptica de alumínio, que é montado no flange de interface fonte de íons personalizada do espectrômetro de massa (Figuras 1C e 1F). Use o suporte do grampo flexível de fixar a lâmina de vidro anexado com uma única sonda.
- Fixe o setup-sonda única para o espectrómetro de massa (Figura 1F). Ajustar o suporte de fixação flexível e a fase XYZ miniatura para colocar o emissor do single-sonda em frente da entrada do espectrómetro de massa. Use o microscópio digital USB (com ângulo de visão ajustável) na lateral do single-sonda para fornecer uma imagem zoom-in do single-pponta veste ou o emissor de nano-ESI, eo estereoscópio digitais (com altura regulável) acima do single-sonda para ver as células e a ponta da sonda.
Nota: O uso da flange fonte de iões correspondente, este sistema de sonda única integrada pode ser acoplado a quaisquer outros tipos de espectrómetros de massa de ionização equipadas com fontes ambientais.
5. Ambient MSI
- Descongelar o ponto de amostra à temperatura ambiente e colocá-lo no sistema de fase de tradução motorizado XYZ debaixo do single-sonda. Ajuste a posição da amostra, alterando as coordenadas no software de controle.
- Usando a seringa para bombear o solvente de amostragem a uma taxa adequada (por exemplo, 0,2 mL / min), e aplicar a voltagem de ionização (por exemplo, 5 kV). A selecção do solvente amostragem é flexível, e as mais comuns incluem MeOH: água (9: 1) e acetonitrilo. O volume morto do emissor nano-ESI foi estimada como sendo ~ 3 nl, e o tempo entre a sonda-surfacontato ce e observação de sinais de iões é geralmente menos de 1 seg 15.
Nota: A flange de interface fonte de íons personalizado permite que a tensão de ionização para ser entregue a partir do espectrômetro de massa para uma união condutor através de um clipe de crocodilo. A voltagem de ionização é então transmitido através de uma união condutora para o solvente no interior do capilar e os canais de sonda simples, e aplicada sobre o emissor de nano-ESI para ionizar os analitos na amostra. Certifique-se de que a tensão de ionização é desligada quando ligar o clipe de crocodilo com a união condutora. - Ajustar a altura do single-sonda de modo a que ele fique ligeiramente acima da superfície da amostra e capaz de realizar à superfície de extracção de metabolitos. Levante cuidadosamente a Z-estágio, e depois usar o microscópio digital USB (no lado do single-sonda) para monitorar a mudança distância entre a ponta-sonda única e superfície de tecido. Monitorar mudanças no espectro de massa durante este ajuste de altura, e parar de elevadoring o Z-fase em que se observa uma mudança do sinal de iões de fundo solvente para metabolitos de tecido.
- Repita o passo 5.3 três vezes para definir três pontos diferentes dentro do programa de controle do estágio de adaptação achatamento superfície automatizado. Colocar a ponta da sonda única em três pontos na superfície da amostra a uma distância de cerca de 10 mm uns dos outros. Execute o ajuste de altura, pressionando para cima e para baixo ícones, e bloquear os três pontos para a posição no método "Plano".
- Defina outros parâmetros para A varredura em toda a seção de interesse dentro da amostra utilizando este programa. Para as seções do mouse renais aqui apresentados, utilize a / s de velocidade de A varredura 10.0 mm e 20 mm distância entre as linhas. O sistema de platina motorizada tem um movimento mínimo de 0,1 um incremento. A distância entre a ponta da sonda única e do tecido é obtido a partir do passo 5.3.
- Defina-se a um método para a aquisição automatizada dos espectros de MS do espectrómetro de massa. for resolução massa de alta MSI na amostra do mouse rim, use os seguintes parâmetros: resolução de massa 60.000 (m / Dm), ~ modo positivo 5 kV, 1 MicroScan, tempo de injeção 150 ms max, e AGC diante. Todos os espectros de MS adquiridos representam linhas individuais da imagem MS tinha o mesmo número de varrimentos com espaçamento uniforme entre o tempo de cada varrimento, indicando que os tamanhos de pixel para as imagens produzidas foram uniformemente distribuída.
- Iniciar a aquisição de dados MSI. Iniciar a sequência de aquisição MS para o espectrômetro de massa, em seguida, iniciar a seqüência de A varredura para o programa de controle da XYZ.
- Por exemplo, no programa de aquisição de dados MS utilizada aqui, vá para "setup Sequence", selecione "New sequência", gerar um conjunto de arquivos para uma nova sequência numerada de 01 a X, onde X é o número de linhas utilizadas para o imagem MS desejado a ser tomada, e em seguida, pressione "sequência Run".
- Use um dispositivo eletrônico caseiro para permitir que o software para produzir uma Contasinal de fechamento ct para o espectrômetro de massa para coletar os dados. O diagrama de circuito é mostrado na figura complementar (Figura S1) como uma referência.
- Construir imagens MS a partir de arquivos do MS-primas que utilizam software de visualização MSI apropriado. Por exemplo, quando se utiliza o pacote de software desenvolvido pelo grupo de Laskin em PNNL 17, execute os seguintes passos.
- Clique em "Brows arquivo". Selecione o primeiro arquivo obtido a partir da experiência MSI. Especifique onde o arquivo começa e termina em "Número de linhas". Selecione um intervalo de valores de m / z para o intervalo de imagem MS em "Enter Faixa MZ".
- Pressione o botão "Iniciar" para iniciar o processo de criação da imagem. Depois que a imagem MS é feito, clique em "Salvar imagem" em "barra de ferramentas" para armazenar as imagens no computador.
6. in situ vivo SCMS
- Configuração do sistema de sonda única como por instruiríons de MSI. Ajustar o solvente (por exemplo, MeOH / H2O ou acetonitrilo) a taxa de fluxo (por exemplo, ~ 25 nl / min).
- Lave as células cultivadas, que são anexadas nos slides tampa de vidro micro, com PBS para remover a mídia cultural e componentes de drogas extracelulares. Coloque célula que contém lâmina de vidro no sistema fase de tradução motorizado XYZ para o experimento.
Nota: Em alternativa, utilizar o meio de cultura celular fresco (sem contendo soro fetal de bovino) para lavar as células cultivadas. supressão ion menos tem sido observado. Além disso, células podem sobreviver durante um tempo mais longo durante a experiência, em que a temperatura ambiente (~ 20 ° C) é significativamente mais baixa do que a temperatura da cultura (37 ° C). O tipo de droga, a concentração da solução, e tempo de tratamento varia em diferentes estudos. - Concentre o microscópio estéreo digital (por cima da amostra) para a ponta da sonda única para controlar a penetração celular durante a análise. Use o microscópio digital USB (no side do single-sonda) para monitorar as condições de trabalho do emissor nano-ESI no single-sonda.
- Use o programa de controle de fase XYZ motorizada e microscópio estéreo digital (acima de células) para localizar uma célula de interesse, e posicionar precisamente a ponta-sonda única acima da amostra. Iniciar a aquisição de dados MS antes da ponta de sonda única é inserido na célula.
- Utilize os seguintes parâmetros como referência para a análise de MS usando um espectrômetro de massa de alta resolução: resolução de massa 100.000 (m / Dm), ~ modo de 3 kV positivo e negativo, 1 MicroScan, 150 ms max tempo de injeção, o modo AGC diante. aquisição automatizada de MS espectros é feito clicando em "Iniciar" no programa de aquisição de dados MS.
- Levantar o Z-platina motorizada clicando no icone para penetrar na membrana da célula e manter a gravação do sinal de MS gerado a partir da célula. Um atraso de tempo de 1-2 segundos é normalmente observado entre a inserção de sonda e o sinal de detecção de MS. Como outro confirmação dea penetração celular, uma mudança dramática dos sinais de MS pode ser observada sobre a penetração da membrana da célula. Os sinais de MS de compostos intracelulares geralmente pode durar ~ 15-20 seg antes de uma diminuir significativamente.
- Mais abaixo, a célula que contém placa para puxar a ponta-sonda única para fora da célula. Toma geralmente <15 seg para os sinais iónicos dos compostos celulares para aproximar o nível de ruído. Deixe o fluxo de solvente para ~ 3 min para lavar completamente a single-sonda. Enquanto isso, posicionar o sistema de estrado XYZ motorizado para localizar a célula seguinte a ser analisado. Cada experimento célula requer ~ 3 min a ser realizado.
Resultados
O single-sonda foi usada com sucesso para a análise MSI ambiente de rato seccionado tecido renal 15. O dispositivo utiliza o mecanismo de líquido da superfície das micro-extracção (Figura 1a), o qual proporciona extracção de analito altamente eficiente a partir de uma pequena área, levando a abundantes sinais iónicos intensidades nos resultados MSI. Por exemplo, as intensidades de sinal de mais do que 10 7 foram alcançados para alguns metabolitos abundantes (Figura 2A). Um grande número de metabolitos foram detectados desta maneira, incluindo uma série de esf ingomielina (SM) e a fosfatidilcolina (PC) espécies, tais como [Sm (34: 1) + Na] + (725,5575 m / z), [PC (32: 0) + H] + (734,5700 m / z), [PC (34: 1) + Na] + (782,5696 m / z), e [PC (38: 5 + Na)] + (814,5726 m / z). Estes compostos foram identificados com massa de alta resolução e precisão em massa quando acoplado tespectrômetro de massa de alta resolução OA. Por exemplo, a identificação foi conseguida com menos do que 4 ppm m / z precisão de massa (isto é, a diferença entre os valores observados e teóricos) para cada metabolito (Figura 2b) nos resultados aqui apresentados. Além disso, em tandem MS análises (isto é, MS / MS) foram também conduzidos para a identificação de espécies mais confiante de interesse 15.
Devido à capacidade de realizar eficiente de micro-extração líquido sobre uma área pequena, o dispositivo de sonda única pode ser usado para executar as experiências de alta resolução espacial MSI sob condições ambiente de 15. Por exemplo, imagens detalhadas MS de secções de rim de rato foram obtidos ilustrando a distribuição espacial dos metabolitos seleccionados (Figura 2C). A resolução espacial da imagem de MS foram determinados para ser 8,5 fiM, seguindo a métrica amplamente utilizado de ter a transiti. no ponto de uma característica dentro de um determinado afiado 20-80% de alteração de intensidade do sinal de MS 18 No caso de fosfolípido [PC (38: 5 + Na)] + na secção de rim de rato, o recurso de transição entre a medula interna ea medula externa tem lugar através de um ciclo de scan no cronograma, mostrando uma mudança de intensidade superior a 20-80 gama%. Com base na velocidade de amostra em movimento (10,0? M / seg) e MS taxa de aquisição de dados (0,85 seg / espectro), a amostra em movimento distância em uma MS digitalizar ciclo (8,5 ^ M), isto é, a resolução espacial MSI, pode ser calculado (Figura 2d). Esta resolução espacial é das mais elevadas ainda alcançado por técnicas MSI ambientais realizados em amostras biológicas.
Para SCMS o single-sonda foi capaz de alcançar a análise de células HeLa vivas individuais 16. O tamanho da ponta da sonda única é normalmente inferior a 10 uM (Figure 3a), que é suficientemente pequeno para ser directamente inserida em vários tipos de células eucarióticas, dos quais o diâmetro é de aproximadamente 10 uM, para a extracção e análise por MS. O processo de inserção da ponta de sonda única para uma célula pode ser visualmente monitorizado utilizando um microscópio estéreo digital (Figura 3b), e a penetração da membrana celular pode ser confirmada através da mudança rápida e significativa dos espectros de massa de PBS (ou de cultura de células fresco médio) para compostos intracelulares (Figuras 3C e 3D). As experiências pode ser realizado em ambos os modos de iões positivos e negativos para detectar tipos de espécies moleculares mais amplas. Por exemplo, 18 espécies de lípidos diferentes foram identificados no modo positivo, incluindo esf ingomielinas (SM) e fosfatidilcolinas (PC), ao passo que os fosfatos de adenosina (AMP, ADP e ATP) foram detectados no modo de ião negativo (Figuras 3C e d). O retardo de tempo entre a sonda única inserção into uma célula e o sinal de detecção era tipicamente menos de dois segundos, permitindo uma detecção quase em tempo real dos metabolitos celulares. SCMS também foi aplicada a experiências onde as células foram tratadas com fármacos anti-cancro (por exemplo, OSW-1, paclitaxel, doxorrubicina) e 19]. Os medicamentos correspondentes podem ser detectados dentro de células HeLa após tratamento de 4 horas a uma série de concentrações (isto é, 10 nM, 100 nM, 1 pM e 10 pM) em DMSO (dimetil sulfóxido), utilizando as células não tratadas (adicionar apenas DMSO ), como os controlos. Os sinais de MS de drogas não estavam presentes dentro do PBS extracelular ou o controlo (Figura 3e), mas foi detectada dentro das células individuais utilizando a técnica MS-sonda única (apenas a 100 nM resultados do tratamento são mostrados na Figura 3F). Como as células foram enxaguadas com PBS (ou meio de cultura celular fresco) para remover compostos extracelulares e contaminações, a detecção de metabolitos endógenos (por exemplo, lípidos celulares and fosfatos de adenosina) e de compostos exógenos (por exemplo, fármacos anti-cancerígenos) indica que a técnica de MS-sonda standard pode ser utilizado para analisar compostos intracelulares.
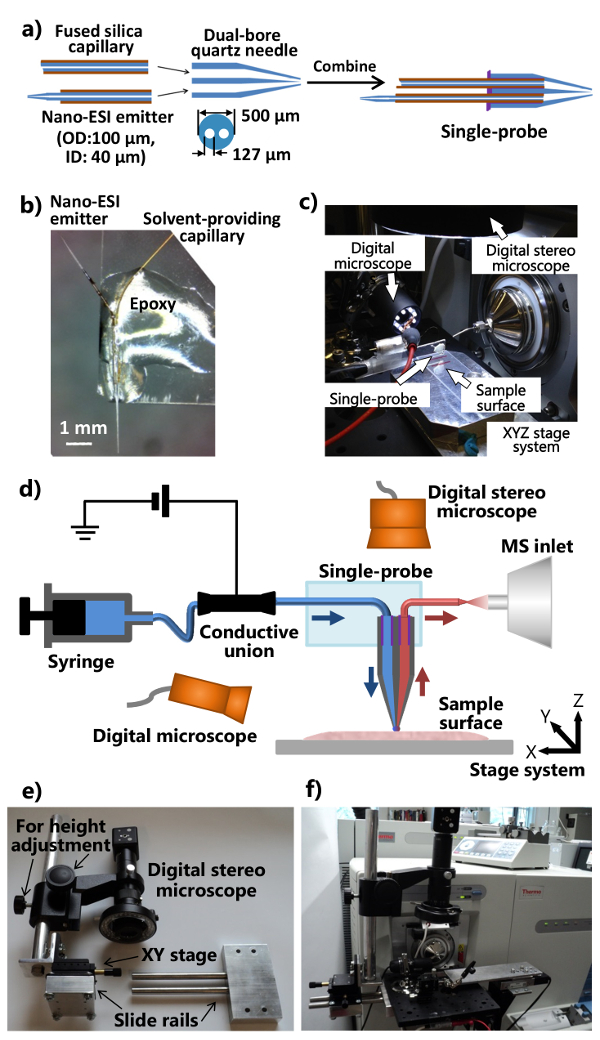
Figura 1. Fabricação e configuração da sonda única para análise MSI e SCMS ambiente. A) procedimentos de fabricação do single-sonda. B) Fotografia de uma única sonda fabricada ligado a uma lâmina de vidro. C) Fotografia da única configuração de sonda ligada a uma massa espectrômetro. d) Diagrama do setup-sonda única acoplado com um espectrômetro de massa. Durante uma experiência, o solvente de amostragem é fornecida continuamente a partir da seringa, a voltagem de ionização é aplicada para a união condutora do espectrómetro de massa, dois microscópios digitais são utilizados para monitorizar a colocação da amostra, a fase XYZ motorizadosistema é utilizado para controlar o movimento da amostra, e um espectrômetro de massa é usada para análise. e) fotografia do sistema de estereoscópio digitais personalizados. f) Fotografia que mostra o estereoscópio digital anexada à flange interface de fonte de íons através de uma placa óptica. Por favor clique aqui para ver uma versão maior desta figura.
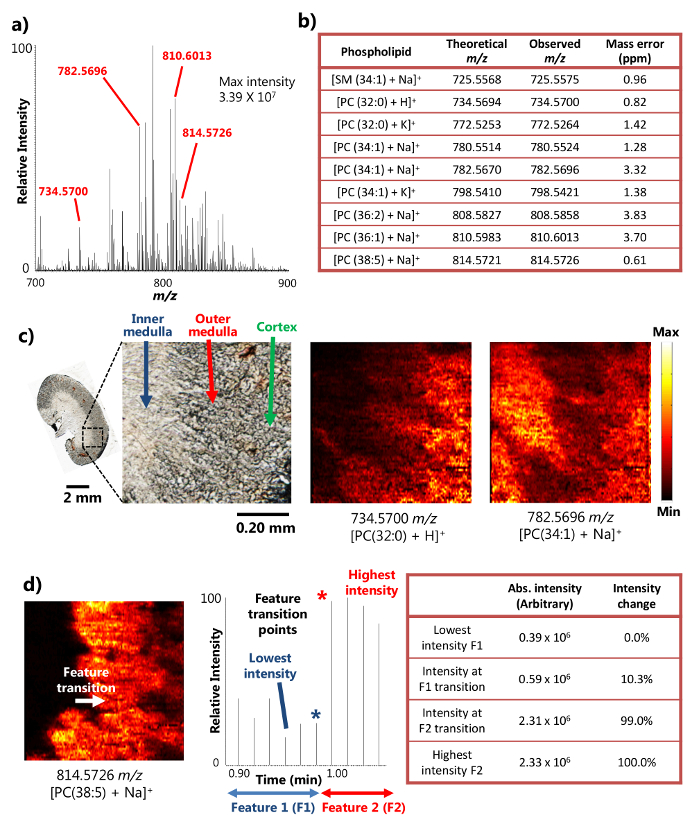
Figura 2. Resultados de um estudo MSI ambiente de uma seção do mouse rim com alta resolução espacial e de massa. A) Um espectro de massa representante do single-sonda MSI. A intensidade máxima de metabólitos detectados pode chegar a 3,39 x 10 7 (unidades arbitrárias). B) A seleção dos metabólitos detectados apresentados com sua precisão em massa. C)MS imagens de [PC (32: 0) + H] + e [PC (34: 1) + Na] + tomadas a partir de uma secção de rim de rato em 8,5 uM resolução espacial. PC: fosfatidilcolina. Barra de escala: 2 mm; 0,20 mm (no detalhe) d) Determinação da resolução espacial da imagem MS para. [PC (38: 5) + Na] + (adaptado com permissão de referência 15). Por favor clique aqui para ver uma versão maior desta figura.

Figura 3. Resultados de uma análise SCMS ambiente de drogas células HeLa tratadas com alta resolução de massa. A) zoom de fotografia da ponta da sonda única que mostra um tamanho típico de <10 um de diâmetro. B) A fotografia feita no ponto de inserção-sonda única para uma célula HeLa. Barra de escala: 50 ^ m.C) Um espectro de massa típico positiva modo de iões com as identificações de um número de PC (fosfatidilcolina) espécies. d) Uma lista representativa dos metabolitos detectados a partir da análise de SCMS de células HeLa, tanto no modo de iões positivos e negativos. EF) Os espectros de massa para o controle e tratada (100 nM OSW-1) células (adaptado com permissão de referência 16). por favor clique aqui para ver uma versão maior desta figura.
Figura S1. Diagrama do circuito do dispositivo eletrônico usado para produzir o sinal de fechamento de contato para espectrômetro de massa para coletar dados. Por favor clique aqui para visualizar ou baixar este valor.
Discussão
O single-sonda é um dispositivo multifuncional que pode ser usado para ambos os experimentos MSI e SCMS. A configuração-sonda única (incluindo sistemas de fase de tradução, microscópios, flange interface de fonte de íons, etc.) é concebido como um componente add-on que podem ser flexivelmente adaptado para o espectrómetro de massa existente. A troca rápida entre o setup-sonda única e a fonte de iões convencional ESI pode ser realizado dentro de um minuto. Em princípio, usando a flange de interface fonte de iões apropriado, a configuração-sonda única pode ser adaptado para as outras espectrómetros de massa. Além disso, o solvente de amostragem contendo uma variedade de reagentes pode ser usado com a configuração-sonda única para experiências MSI e SCMS reactivos, o que aumenta a detecção de intervalos mais amplos de biomoléculas. Em adição aos tecidos de animais e linhas de células, a única sonda é também capaz de analisar outros sistemas biológicos, tais como plantas. Portanto, com a mesma configuração experimental eformação de utilizador semelhante, uma variedade de estudos podem ser realizados usando um único aparelho e pelos mesmos utilizadores, permitindo experiências eficiente e versátil para ser realizada com o mínimo de tempo de formação e custo da instrumentação.
O componente chave da técnica MS-sonda única é a própria sonda. A qualidade do single-sonda tem uma influência significativa sobre o seu desempenho, que determina em grande parte a qualidade de ambos os experimentos MSI e SCMS. Para a confecção de sondas individuais, certifique-se que os capilares dentro do tubo dual-furo estão firmemente coladas para eliminar a possibilidade de vazamento de solvente durante os experimentos. É crítico para usar uma quantidade mínima de UV epoxi curável, de tal modo que os orifícios e os capilares não são obstruídas durante a fabricação sonda.
A única sonda foi utilizada para realizar a resolução espacial e de massa de alta ambiente MSI em 15 amostras biológicas. A principal vantagem da MSI ambiente durantemétodos não ambiente é que a preparação da amostra é mantida a um mínimo, sem necessidade de um meio de amostragem de vácuo, que permite que a amostra a ser analisada num próximo estado nativo 8. Um dos principais obstáculos para a técnica MSI maioria outro ambiente tem sido uma falta de resolução espacial 1. Em comparação com a dessorção com base MSI técnicas (tais como DESI e LAESI), o pequeno tamanho da ponta do single-sonda permite que um líquido superfície micro-extracção mais robusto e eficiente para ser realizada sobre uma área pequena, levando a uma elevada resolução espacial de 8,5 mm, que está entre os mais altos obtidos utilizando técnicas MSI ambiente 15. Além disso, o ajuste dos componentes do solvente de amostragem proporciona flexibilidade adicional para realizar as experiências. Por exemplo, a amostragem de solventes contendo reagentes (por exemplo, compostos dicationic) têm sido utilizados para realizar experiências MSI reactivos, permitindo um aumento significativo no número de metabolitos identificados peexperimento r 20. A outra vantagem da única sonda é a concepção integrada, que proporciona a facilidade de operação durante todo o processo de aquisição de dados. Uma vez que a distância entre a ponta e a superfície do tecido é muito sensível para a intensidade de sinal e a estabilidade de iões, obtendo-se uma secção de tecido plano e condução de superfície achatamento ajustamento para minimizar a variância distância é uma chave para experiências MSI alta qualidade. Daqui resulta que as técnicas de MSI-sonda única não são adequados para obter altas imagens espaciais MS de superfícies irregulares.
Além disso para o fabrico de uma sonda de alta qualidade, ajustando cuidadosamente o instrumento é essencial para um experimento MSI bem sucedida. Entre todos os passos de ajuste, o ajuste da altura da ponta da sonda única acima da superfície da secção de tecido é o mais crítico. Ao ajustar a altura da sonda, bombear o solvente de amostragem e ligue a tensão de ionização, de modo que somente os sinais de íon de fundo solvente pode ser observEd. Em seguida, monitorar a alteração do espectro de massa, reduzindo cuidadosamente a distância sonda-superfície, levantando o Z-platina motorizada até que podem ser observados os sinais iónicos fortes e estáveis da secção de tecido; esta altura da sonda será utilizada para a coleta de dados MSI durante o experimento. Além disso, uma taxa de fluxo de solvente optimizada é essencial para experiências MSI. Ajustar o caudal com a altura da sonda optimizado. Certifique-se de que não há nenhuma propagação solvente sobre a superfície do tecido (isto é, taxa de fluxo é muito alta) ou formação de bolhas no interior do emissor de nano-ESI (isto é, taxa de fluxo é muito baixa).
O single-sonda é um dispositivo multifuncional para bioanalysis. Além das experiências MSI, é capaz de realizar quase em tempo real in situ SCMS para elucidar informação química detalhada a partir de células eucarióticas vivas 16, que é uma grande vantagem em comparação com outros vácuo técnicas SCMS base (tais como MALDI 10 e SIMS 21 ). O tamanho pequeno da ponta da sonda proporciona a capacidade de ser inserido numa célula eucariótica viva e para extrair e ionizar os compostos intracelulares para análise MS imediato. Do mesmo modo, os solventes de amostragem contendo reagentes (por exemplo, compostos dicationic) pode ser usado nas experiências SCMS, e uma gama mais ampla de constituintes celulares pode ser detectado numa célula única ao vivo do que nunca antes (investigação em curso, os dados não são apresentados). Embora a análise em tempo real irá fornecer os perfis químicos de células únicas vivas, devido à penetração de células de membrana e de extracção dos conteúdos celulares, a célula sob investigação serão mortos após a experiência, o que implica que a técnica de SCMS-sonda único ainda é um método destrutivo. Além disso, a ponta da sonda e nano-ESI emissor no single-sonda pode ser facilmente obstruídos para usuários inexperientes. Para reduzir a possibilidade de entupimento do dispositivo, certifique-se para evitar tocar o núcleo ao inserir a ponta-sonda única em um celeu. Se ocorre o entupimento, o dispositivo pode ser regenerado por aquecimento até a ponta da sonda entupido ou nano-ESI emissor utilizando um homebuilt bobina de aquecimento 16. Outra limitação da técnica SCMS-sonda única é que apenas as células adesivas (isto é, as células estão associadas a superfícies) podem ser analisados usando o programa de configuração corrente. No entanto, através da incorporação do sistema de manipulação de células para dentro do aparelho MS-sonda única, os tipos mais amplas de células podem ser estudados no futuro.
Semelhante à experiência MSI, obtendo-se uma sonda de elevada qualidade e uma taxa de fluxo de solvente optimizado é crítica para estudos SCMS. Ao ajustar a taxa de fluxo de solvente, a ponta da sonda único é colocado por cima da amostra (isto é, sem contacto com o meio de células ou cultura), e garantir que não existe qualquer gotejamento do solvente a partir da ponta da sonda ou a formação de bolhas no interior do nano-ESI emissor.
Divulgações
We have no conflict of interest to declare with the work presented here.
Agradecimentos
The authors would like to thank Dr. Laskin (the Pacific Northwest National Laboratory) for sharing the motorized stage control software and MSI visualization program. We also thank Dr. Mao (the University of Oklahoma) for providing mouse organ samples and Mr. Chad E. Cunningham (the University of Oklahoma) for the assistance in machining and electronics work. This research was supported by grants from the Research Council of the University of Oklahoma Norman Campus, the American Society for Mass Spectrometry Research Award (sponsored by Waters Corporation), Oklahoma Center for the Advancement of Science and Technology (Grant HR 14-152), and National Institutes of Health (R01GM116116).
Materiais
| Name | Company | Catalog Number | Comments |
| Single-probe fabrication | |||
| Dual bore quartz tubing, 1.120’’ × 0.005” × 12” | Friedrich & Dimmock, Inc, Millville, NJ | MBT-005-020-2Q | |
| Micropipette laser puller | Sutter Instrument Co., Novato, CA | Model P-2000 | |
| Fused silica capillary, ID: 40 µm, OD: 110 µm | Molex, Lisle, IL | TSP040105 | |
| UV curing resin | Prime Dental, Prime-Dent, Chicago, IL, USA | Item No. 006.030 | |
| LED UV lamp | Foshan Liang Ya Dental Equipment, Guangdong, China | LY-C240 | |
| Epoxy resin | Devcon, Danvers, MA | Part No. 20945 | |
| Inline MicroFilter | IDEX Health & Science LLC, Lake Forest, IL | M-520 | |
| Microunion | IDEX Health & Science LLC, Lake Forest, IL | M-539 | |
| Microscope slide (glass) | C & A Scientific - Premiere, Manassas, VA | 9105 | |
| Syringe | Hamilton, Reno, NV | 1725LTN 250UL | |
| Mass spectrometer | |||
| LTQ Orbitrap Mass sprectrometer | Thermo Fisher Scientific, Inc., Waltham, MA | LTQ Orbitrap XL | |
| Xcalibur 2.1 Software | Thermo Fisher Scientific, Inc., Waltham, MA | XCALIBUR21 | |
| Fance Stage Control | Pacific Northwest National Laboratory, Richland, WA | ||
| MSI QuickView | Pacific Northwest National Laboratory, Richland, WA | ||
| Contact closure device | |||
| USB-6009 Multifunction DAQ | National Instruments, Austin, TX | 779026-01 | |
| DR-5V SDS Relay | Panasonic, Kadoma, Japan | DR-SDS-5 | |
| Logic Gates 50 Ohm Line Driver | Texas Instruments, Dallas, TX | SN74128N | |
| Single-probe setup | |||
| Motorized linear stage and controller (3 sets) | Newport, Irvine, CA | Conex-MFACC | |
| Miniature XYZ stage | Newport, Irvine, CA | MT-XYZ | |
| Translation XY stage | ThorLab, Newton, NJ | PT1 and PT102 | |
| Thermo LTQ XL ion source interface flange | New Objective, Woburn, MA | PV5500 | |
| Digital stereo microscope, 250X - 2,000X | Shenzhen D&F Co., Shenzhen, China | Supereyes T004 | |
| USB Digital Photography Microscope | DX.com, HongKong, China | S02 25~500X | |
| Syringe pump | Chemyx Inc., Stafford, TX | Nexus 3000 | |
| Solid Aluminum Optical Breadboard, 8" x 8" x 1/2" | Thorlabs, Newton, NJ | MB810 | |
| Flexible clamp holder | Siskiyou, Grants Pass, OR | MXB-3h | |
| Solvents | |||
| Methol | Sigma-Aldrich, St. Louis, MO | 34860 Chromasolv | |
| Water | Sigma-Aldrich, St. Louis, MO | W4502 | |
| Acetonitrile | Sigma-Aldrich, St. Louis, MO | 34967 Chromasolv | |
| Cell culture | |||
| Dulbecco’s Modified Eagle’s Medium (DMEM) | Cellgro, Manasas, VA | 10-013-CV | |
| 10% heat-inactivated fetal bovine serum (FBS) | Gibco/Life Technologies, Long Island, NY | 10100-139 | |
| Penicillin/Streptomycin | Cellgro, Manasas, VA | 30-002-CI | |
| 10 mM HEPES (pH 7.4) | Cellgro, Manasas, VA | 25-060-CI | |
| Phosphate Buffered Saline (PBS) | Cellgro, Manasas, VA | 46-013-CM | |
| TrypLE Express | Thermo Fisher Scientific, Waltham, MA | 12604-013 | |
| 12-well plates | Corning Inc., Corning, NY | Falcon 351143 | |
| T25 flask | Corning Inc., Corning, NY | Falcon 3055 | |
| Micro Cover Glasses, Round, No. 1 | VWR International, Radnor, PA | 48380-046 | |
| DMSO (Dimethyl Sulfoxide) | VWR International, Radnor, PA | BDH1115-1LP | |
| Tissue imaging | |||
| Cyro-Cut Microtome | American Optical Coporation | ||
| Tissue-Tek, Optimum cutting temperature (OCT) | Sakura Finetek Inc., Torrance, CA | 4583 | |
| Microscope slide (polycarbonate) | Science Supply Solutions, Elk Grove Village, IL | P11011P | |
Referências
- Vickerman, J. C. Molecular imaging and depth profiling by mass spectrometry-SIMS, MALDI or DESI?. Analyst. 136 (11), 2199-2217 (2011).
- Schwamborn, K. Imaging mass spectrometry in biomarker discovery and validation. J. Proteomics. 75 (16), 4990-4998 (2012).
- Schwamborn, K., Caprioli, R. M. MALDI Imaging Mass Spectrometry - Painting Molecular Pictures. Mol Oncol. 4 (6), 529-538 (2010).
- Kraft, M. L., Klitzing, H. A. Imaging lipids with secondary ion mass spectrometry. Biochim. Biophys. Acta. 1841 (8), 1108-1119 (2014).
- Wiseman, J. M., et al. Desorption electrospray ionization mass spectrometry: Imaging drugs and metabolites in tissues. Proc Natl Acad Sci U S A. 105 (47), 18120-18125 (2008).
- Nemes, P., Woods, A. S., Vertes, A. Simultaneous imaging of small metabolites and lipids in rat brain tissues at atmospheric pressure by laser ablation electrospray ionization mass spectrometry. Anal. Chem. 82 (3), 982-988 (2010).
- Laskin, J., Heath, B. S., Roach, P. J., Cazares, L., Semmes, O. J. Tissue Imaging Using Nanospray Desorption Electrospray Ionization Mass Spectrometry. Anal. Chem. 84 (1), 141-148 (2012).
- Wu, C., Dill, A. L., Eberlin, L. S., Cooks, R. G., Ifa, D. R. Mass spectrometry imaging under ambient conditions. Mass. Spectrom. Rev. 32 (3), 218-243 (2013).
- Altschuler, S. J., Wu, L. F. Cellular heterogeneity: do differences make a difference?. Cell. 141 (4), 559-563 (2010).
- Amantonico, A., Urban, P. L., Fagerer, S. R., Balabin, R. M., Zenobi, R. Single-Cell MALDI-MS as an Analytical Tool for Studying Intrapopulation Metabolic Heterogeneity of Unicellular Organisms. Anal. Chem. 82 (17), 7394-7400 (2010).
- Passarelli, M. K., Ewing, A. G., Winograd, N. Single-cell lipidomics: characterizing and imaging lipids on the surface of individual Aplysia californica neurons with cluster secondary ion mass spectrometry. Anal. Chem. 85 (4), 2231-2238 (2013).
- Shrestha, B., et al. Subcellular metabolite and lipid analysis of Xenopus laevis eggs by LAESI mass spectrometry. PLoS One. 9 (12), e115173 (2014).
- Mizuno, H., Tsuyama, N., Harada, T., Masujima, T. Live single-cell video-mass spectrometry for cellular and subcellular molecular detection and cell classification. J. Mass. Spectrom. 43 (12), 1692-1700 (2008).
- Zhang, L., et al. In Situ metabolic analysis of single plant cells by capillary microsampling and electrospray ionization mass spectrometry with ion mobility separation. Analyst. 139 (20), 5079-5085 (2014).
- Rao, W., Pan, N., Yang, Z. High Resolution Tissue Imaging Using the Single-probe Mass Spectrometry under Ambient Conditions. J. Am. Soc. Mass. Spectrom. 26 (6), 986-993 (2015).
- Pan, N., et al. The single-probe: a miniaturized multifunctional device for single cell mass spectrometry analysis. Anal. Chem. 86 (19), 9376-9380 (2014).
- Thomas, M., et al. Visualization of High Resolution Spatial Mass Spectrometric Data during Acquisition. 2012 Annual International Conference of the Ieee Engineering in Medicine and Biology Society (Embc). , 5545-5548 (2012).
- Luxembourg, S. L., Mize, T. H., McDonnell, L. A., Heeren, R. M. High-spatial resolution mass spectrometric imaging of peptide and protein distributions on a surface. Anal. Chem. 76 (18), 5339-5344 (2004).
- Zhou, Y., et al. OSW-1: a natural compound with potent anticancer activity and a novel mechanism of action. J Natl Cancer Inst. 97 (23), 1781-1785 (2005).
- Rao, W., Pan, N., Tian, X., Yang, Z. High-Resolution Ambient MS Imaging of Negative Ions in Positive Ion Mode: Using Dicationic Reagents with the Single-Probe. J. Am. Soc. Mass. Spectrom. 27 (1), 124-134 (2016).
- Ostrowski, S. G., Kurczy, M. E., Roddy, T. P., Winograd, N., Ewing, A. G. Secondary ion MS imaging to relatively quantify cholesterol in the membranes of individual cells from differentially treated populations. Anal. Chem. 79 (10), 3554-3560 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados