Method Article
Formando polymersomes de tamanho gigante usando hidratação Gel-assistida
Neste Artigo
Resumo
We present a protocol to rapidly form giant polymer vesicles (pGVs). Briefly, polymer solutions are dehydrated on dried agarose films adhered to coverslips. Rehydration of the polymer films results in rapid formation of pGVs. This method greatly advances the preparation of synthetic giant vesicles for direct applications in biomimetic studies.
Resumo
Polymer vesicles, or polymersomes, are being widely explored as synthetic analogs of lipid vesicles based on their stability, robustness, barrier properties, chemical versatility and tunable physical characteristics. Typical methods used to prepare giant-sized (> 4 µm) vesicles, however, are both time and labor intensive, yielding low numbers of intact polymersomes. Here, we present for the first time the use of gel-assisted rehydration for the rapid and high-yielding formation of giant (>4 µm) polymer vesicles (polymersomes). Using this method, polymersomes can be formed from a wide array of rehydration solutions including several different physiologically-compatible buffers and full cell culture media, making them readily useful for biomimicry studies. This technique is also capable of reliably producing polymersomes from different polymer compositions with far better yields and much less difficulty than traditional methods. Polymersome size is readily tunable by altering temperature during rehydration or adding membrane fluidizers to the polymer membrane, generating giant-sized polymersomes (>100 µm).
Introdução
Criação de vesículas, sintéticos de tamanho de células gigantes unilamelares (GUVs) é de interesse crescente na reconstrução in vitro de diferentes processos celulares para construir uma estrutura para a geração de um sistema de célula de 1,2-como artificial. Enquanto GUVs compostos de membranas lipídicas são excelentes imitadores de membranas naturais, biológicos, eles são instáveis contra flutuações ambientais e têm uma vida útil relativamente curta. Devido a estas limitações, copolímeros em bloco anfifílicos têm sido usados como mímicos de lípidos de modo a formar vesículas de polímero, ou polymersomes. Dentro deste contexto, polymersomes são vantajosas no desenvolvimento de sistemas de células de biomiméticos devido à sua estabilidade aumentada 3, versatilidade química 4,5 e características físicas modificáveis 6 - 8.
Os métodos atuais para formar polymersomes tamanho gigante incluem eletroformação 9 e reidratação modelada 10, ambos which são demorados, equipamentos de trabalho intensivo, exigem especializada e produzir baixos rendimentos de polymersomes gigantes intactas. Um método de re-hidratação assistida-gel simples foi recentemente desenvolvido para a produção de lípidos GUVs 11. Aqui, nós descrevemos uma adaptação da técnica de hidratação assistida-gel para criar polymersomes gigantes com composições poliméricas diferentes, de tamanho controlado e, em várias composições de tampão.
Resumidamente, 1% w / v de gel de agarose de ADN filmes electroforese padrão são desidratados para uma lamela de vidro. As soluções de polímero preparadas em clorofórmio, em seguida, são distribuídos através da película de agarose desidratado e deixou-se evaporar. Após a remoção do solvente total, películas de polímero são re-hidratadas em tampão de escolha do com aquecimento moderado (40-70 ° C) e gigante (> 4 mm) polymersomes tamanho são formados dentro de 30 min. Este método produz rapidamente centenas de totalmente intactas, polymersomes bem formadas utilizando equipamentos de laboratório padrão e Reagents a custos mínimos.
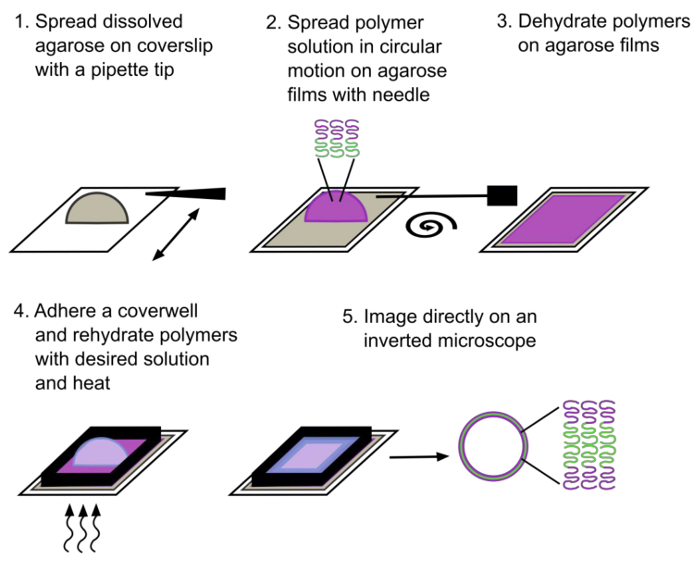
Figura 1. Esquema que descreve o método de re-hidratação assistida-gel. Polymersomes gigantes compostas de um copolímero dibloco são formados após a ~ 30 min de re-hidratação. O bloco hidrofílico é indicado em magenta e o bloco hidrofóbico é indicado em verde. Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
1. Polímeros e agarose Preparação
Nota: Luvas e um jaleco deve ser usado em todos os momentos ao longo deste protocolo. óculos de segurança também são necessários durante o trabalho com qualquer solvente orgânico ou em qualquer fase com possibilidade de respingos.
- Prepara-se uma solução / ml 5 mg de polímero em clorofórmio. Adicionar 1 ml de clorofórmio a 5 mg de poli sólido (óxido de etileno) - poli B- (butadieno) (PEO-PBD, 22 EO -BD 37) copolímero dibloco num frasco de vidro e agitar para dissolver totalmente. Executar todas as etapas usando clorofórmio em um exaustor química.
- Misturar num lípido marcado por fluorescência (adquirido já dissolvido em clorofórmio), a uma concentração final de 0,5% mol em 99,5 mole% de polímero não marcado.
- Por exemplo, pipeta ~ 12 ul de 1 mg / ml de lípido marcado por fluorescência em clorofórmio num 997,58 ul de PEO-PBD, 22 EO -BD 37 de polímero em clorofórmio (com um peso molecular de 2.950 Daltons) para uma concentração final de 0.5% molar de lípido marcado misturado e 99,5% de polímero mole.
- Guardar a solução em um tubo vedado com uma tampa resistente à clorofórmio a -20 ° C. Enrole encanadores fita na borda frasco onde os parafusos tampa sobre o frasco e segura a tampa do frasco. Enrole outro pedaço de fita de canalizadores do lado de fora da tampa e finalmente enrolar Parafilm do lado de fora da fita para assegurar a evaporação mínima.
- Adicione um 1% w / v de solução de agarose por mistura de 0,5 mg de agarose padrão em 50 ml de água (ou de sacarose a 50 ml de 100 mM) num balão de Erlenmeyer de 250 mL. Ferva a solução de agarose no microondas padrão para ~ 1 min (ou até completamente dissolvido como observou o clearing da solução).
Nota: A solução de agarose pode ser utilizado depois de alguns minutos de arrefecimento ou deixada solidificar, armazenadas e re-fundidos, usando o mesmo procedimento.
2. Preparação de Cinema de agarose
- Corte a extremidade fora de uma ponta de pipeta de 1000 mL para evitar o entupimento. Usando a ponta de corte, pipeta 300 ml de solução de agarose derretido sobre um quadrado lamela de vidro 25 milímetros diretamente do fabricante.
- Permitir que a agarose-se arrefecer a ~ 65-75 ° C antes da deposição. Se a agarose é muito legal, ele vai começar a se acumular na superfície durante o processo de propagação. Por outro lado, se a agarose é muito quente, que vai exigir mais espalhando a aderir a agarose para a superfície.
- Mantenha apenas a borda da lamela com os dedos enluvados e usar a borda longa de outra ponta da pipeta de 1000 mL de espalhar a agarose uniformemente em toda a superfície da lamela. Mova a ponta da pipeta e para trás através da lamela até que a agarose adere totalmente ao e cobre a lamela.
- Coloque a lamela revestida de agarose para um pedaço de Parafilm com a agarose voltado para cima. Uma vez que o número desejado de lamelas são revestidos, colocar o Parafilm com as lamelas em uma incubadora a 37 ° C para se desidratar a agarose para a superfície durante pelo menos 1 h.
Nota: A desidrataçãoé determinada pelo desaparecimento de a camada visível de agarose; a lamela deve olhar plana e clara. Uma vez que os filmes são totalmente desidratada, loja de lamelas com a superfície da agarose para cima em um plástico descartável placa de Petri.
Formação 3. Polymer Film
- Pipetar 30 ul de solução de polímero preparada sobre a película de agarose.
- Mantenha apenas a borda da lamela com os dedos enluvados e usar a borda longa de uma agulha de 18 G para espalhar a solução através dos filmes de agarose usando um movimento de difusão circular. Continuar até espalhando a solução é evaporada.
Nota: Tenha cuidado com a ponta da agulha. - Coloque as películas de polímero no lado polímero placa de Petri de plástico um virado para cima e colocar a placa de Petri num exsicador de vácuo casa padrão coberta em folha de alumínio (para evitar a fotodegradação do lípido marcado) durante pelo menos 1 h para remover inteiramente qualquer solvente residual.
4. Formação de Polymersomes
- Aderir a coverwell, seja um polidimetilsiloxano caseira (PDMS) bem (um ~ 0,5 centímetros de espessura bloco de PDMS curado com ~ 1 cm de diâmetro de meio socou para fora) ou um disponível comercialmente bem à lamela revestida com a película de polímero. Pressionar a coverwell suavemente sobre a lamela recoberta com o polímero com o polímero virada para cima até uma vedação hermética é formada entre a coverwell e a lamela. Tenha cuidado para não pressionar demasiado duro e quebrar a lamela.
- Adicionar solução de re-hidratação 200-500 ul (água é bom, mas uma variedade de tampões ou meios também funciona) para a câmara (volume de rehidratação depende do tamanho do coverwell aderido).
- Criar uma câmara de humidade para reduzir a evaporação da solução de re-hidratação. Coloque, um Kimwipe molhada rolou ao longo das bordas de uma placa de Petri de vidro. Colocar o filme de polímero com a coverwell aderida para dentro da câmara de humidade e cobrir com uma tampa. Cubra o prato de Petri com papel de alumínio para minimizar a fotodegradação. Lugara placa de Petri sobre uma placa quente a 40 ° C durante pelo menos 30 min.
- Ajustar a temperatura da placa quente durante a re-hidratação 24-70 ° C para ajustar o tamanho das vesículas formadas (Figura 5). 70 ° C é perto da Tm da agarose por isso deve ser tomada precaução quando procedendo para além desta temperatura.
5. Caracterização do polymersomes por recuperação de fluorescência após Fotodegradação (FRAP)
- Mova a lamela com o respeitado coverwell diretamente a um microscópio invertido para a imagem latente.
- Escolha do conjunto de filtros apropriado com base no lípido fluorescente incluído na solução de polímero. Para lipídios Rodamina-rotulados dopado para as soluções de polímero, use uma 560/25 nm filtro de excitação e um filtro de 607/36 nm de emissão ou conjuntos de filtros comparáveis.
- Usar uma objectiva em óleo de 100X para se concentrar na superfície superior da lamela onde os polymersomes será aderido. Se os polymersomes são especialmentegrandes (> 20 um) ou se a película de polímero é muito grosso, um objectivo de alimentação inferior (por exemplo, 40X) deve ser utilizado para visualizar melhor as polymersomes.
- Identificar os polymersomes usando microscopia de fluorescência. Identificar polymersomes pela vesícula característica oca, esférica, com um diâmetro> 5 mm.
- Caracterizar a fluidez da membrana utilizando recuperação de fluorescência após a fotodegradação (FRAP) num microscópio de fluorescência contendo um condensador ajustável. Devido à natureza aderente de embalagem e apertado de polymersomes sobre os substratos, o movimento natural das polymersomes é limitado, aumentar a qualidade de imagem FRAP.
- Concentre-se o microscópio sobre a polymersome de interesse. Feche o condensador a uma pequena região e garantir que a aresta de um polymersome está dentro da região da imagem de interesse.
- Aumentar a exposição da câmara e garantir que todos os filtros de densidade neutros são removidos de forma eficaz photobleach da região de interesse. Permitir que a membrana FL uorescência intensidade para photobleach durante 30-60 segundos ou até que a intensidade de fluorescência é significativamente diminuída.
- Desligue a lâmpada e abrir totalmente o condensador. Diminuir a exposição volta para as configurações iniciais e começar imediatamente a captura de imagens a cada 30 seg por 3 min.
- Calcular coeficientes de difusão de membrana usando métodos padrão de 12. Se a região branqueada recupera a intensidade de fluorescência dentro de 3-5 min, isto indica que a membrana é fluido.
6. Caracterização de Polymersome Tamanho
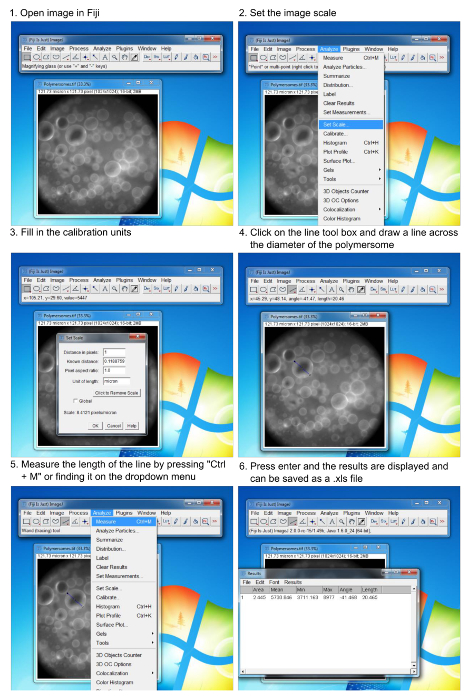
Figura 6. Processo para a análise do tamanho de polymersomes usando software de imagem. Passo-a-passo sobre como medir o diâmetro das vesículas formadas. O usuário deve conhecer as unidades de calibração em pixels / mm do microscópio usado.ove.com/files/ftp_upload/54051/54051fig6large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
- Abra as imagens adquiridas de polymersomes na imagem software de análise 13.
- Defina a escala para a imagem clicando na caixa de analise cair para baixo e a "escala set" clicando.
- Calibrar a escala para o microscópio, utilizando métodos convencionais (isto é, um micrómetro).
- Preencha das unidades de calibragem e clique em "ok".
- Clique na caixa de ferramentas da linha e desenhar uma linha que mede o diâmetro de uma vesícula.
- Recolher as medidas de comprimento, clicando na caixa de analise suspensa e clicar em "medida".
- Continuar a medir vesículas individuais após o procedimento acima e cada nova medição será adicionado à janela de dados medições.
- Pressione "Ctrl + D" depois de desenhar cada linha e medição do comprimento para imprimir a linha traçada sobre oimagem, tornando mais fácil para controlar quais vesículas foram analisadas.
Resultados
Polymersomes foram formados utilizando o procedimento descrito acima (Figura 1) e o equipamento de laboratório corrente mostrado na Figura 2. Polymersomes foram re-hidratadas com água desionizada (Figura 3) e visualizados num microscópio invertido em epifluorescência utilizando uma objectiva em óleo de 100X. Note que se polymersomes não são visíveis, eles podem ter se formado em tamanhos muito grandes para capturar com um objetivo em óleo de 100X; um objectivo potência menor pode precisar de ser utilizado. Uma das vantagens da utilização de reidratação assistida-gel é a versatilidade de formar polymersomes em uma variedade de soluções de re-hidratação. Polymersomes foram formados com sucesso em água desionizada, um meio de cultura de células de mamífero completa, as soluções de sacarose e as duas soluções tampão f isiologicamente relevantes (solução salina tamponada com fosfato (PBS) ou solução salina tamponada com Tris (TBS)), como mostrado na Figura 4. Sob condições normais (reidrataçãocom água a 40 ° C durante 1 hora), maior do que 70 ~ polymersomes são normalmente encontradas por 40 x 40 um 2 o campo de visão. Enquanto a produção superfície da polymersomes não é homogêneo, há dezenas de campos de visão com este rendimento representativo. Além disso, polymersomes eram estável em solução durante pelo menos 24 h.
tamanho polymersomes foi facilmente sintonizado através da hidratação filmes de polímeros a temperaturas variadas. Polymersomes formados em água desionizada a temperatura ambiente tinha um diâmetro médio de 2,9 ± 0,7 um. Medida que a temperatura aumenta durante a re-hidratação, o tamanho médio das polymersomes também aumenta (Quadro 1). A temperaturas elevadas (> 60 ° C), polymersomes formados com tamanhos ainda maior do que 100 um (figura 5).
Todo o processamento de imagem foi concluída usando software de imagem de código aberto (Figura 6).Imagens coletadas foram abertas no programa de software. O tamanho do pixel calibrada foi inserido na caixa escala definida. Usando a ferramenta de linha, linhas foram desenhadas entre os diâmetros. Depois de cada linha individual foi elaborado, o comprimento calibrado foi medido e adicionado à caixa de resultados. Os dados podem então ser representados graficamente no software matemático de escolha (por exemplo, Excel, prisma, origem, etc.)
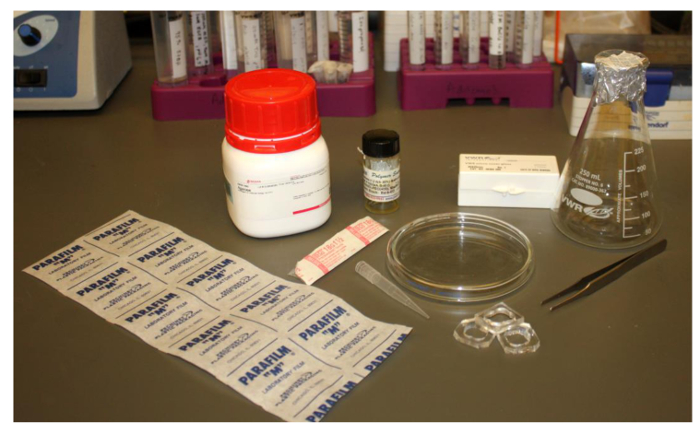
. Figura 2. Imagem dos materiais de laboratório comuns e baratos necessários para a formação de polymersomes os itens necessários são: Parafilm, 18,5 g de uma agulha, de polímero em clorofórmio ou outro solvente adequado, uma ponta de pipeta de 1.000 ul, num balão de Erlenmeyer, pinças, agarose, 25 mm lamelas quadrados, poços de imagem PDMS e uma placa de Petri de vidro. Por favor clique aqui paraver uma versão maior desta figura.

Figura 3. Imagens do método de re-hidratação assistida-gel. Dissolvido agarose é espalhada sobre uma lamela quadrado 25 milímetros até um até mesmo filmes de revestimento toda a lamela. Lamelas são então colocados em um 37 ° C incubadora e filme é desidratado. Uma solução de polímero é depositada sobre a película de agarose desidratado e espalhado utilizando uma agulha num movimento circular. A lamela é então colocar num exsicador O / N para evaporar totalmente quaisquer resíduos de solventes. Finalmente, e câmara de imagem é aderida ao substrato e polímeros são re-hidratados com uma solução de escolha e colocado numa placa de Petri a 40 ° C durante pelo menos 25 minutos para permitir a formação de polymersomes. Por favor clique aqui para ver uma versão ampliada da presente figura. >
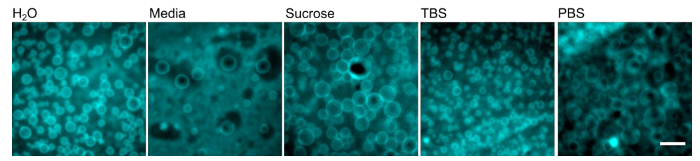
Figura 4. polymersomes pode formar numa variedade de diferentes tampões. Filmes de polímeros PEO-PBD foram re-hidratadas com o tampão indicado a 40 ° C durante 1 h. Barra de escala = 10 mm. Por favor clique aqui para ver uma versão maior desta figura.
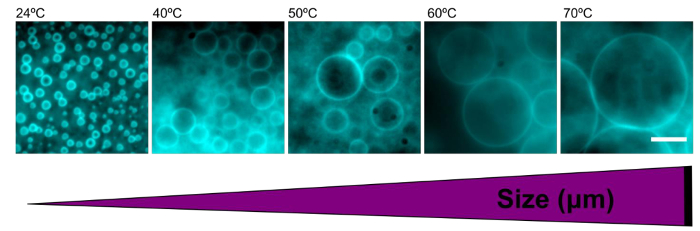
Figura 5. O aumento da temperatura durante a re-hidratação aumenta o tamanho das polymersomes. Imagens de epifluorescência representativos de polymersomes formados em água às temperaturas indicadas reidratação. O aumento da temperatura resulta na polymersomes maiores. Barra de escala = 10 mm._blank "> Por favor clique aqui para ver uma versão maior desta figura.
| Temperatura (° C) | Tamanho médio (uM) |
| 24 | 2,93 ± 0,7 |
| 40 | 5,76 ± 2,5 |
| 50 | 6,65 ± 2,4 |
| 60 | 11,46 ± 5,8 |
| 70 | 14,04 ± 7,0 |
Tabela 1. O aumento da temperatura durante resultados de reidratação em tamanho aumentado polymersome. Diâmetros média para mais de 100 polymersomes na água por condições de temperatura diferentes foram calculados e são descritos aqui. Erro é o desvio padrão.
Discussão
Polymersomes estão sendo amplamente explorados como mímicos de membranas biológicas. As propriedades robustas e versáteis de polímeros torná-los amplamente atraente para estudos que necessitem de funcionalização da membrana, longevidade e capacidade de resposta atento. Os métodos tradicionais de formação de tamanho gigante polymersomes 9,10 (> 4 mm) são de trabalho intensivo e exigem equipamentos caros e especializados. Aqui, nós apresentamos pela primeira vez, um método rápido, versátil e robusto para formar polymersomes tamanho gigante utilizando reagentes de laboratório padrão de baixo custo e equipamentos.
Usando reidratação assistida-gel, polymersomes unilamelares podem ser formados rapidamente (<30 min), em uma variedade de soluções de re-hidratação (incluindo meios de cultura de células) e com uma variedade de polímeros diferentes (dados não mostrados). A formação de vesículas multilamelares ou assimétricas não foi observada usando esta técnica. Ao longo deste trabalho, utilizou-se poli (óxido de etileno) - poli b- (butadieno) (PEO-PBD, 22 EO -BD 37) copolímero dibloco neutro. Muitas composições poliméricas diferentes (incluindo copolímeros de dibloco carregadas) funcionam bem utilizando este método (não mostrado). No entanto, alguns copolímeros tribloco disponíveis comercialmente e copolímeros de dibloco de peso molecular mais elevado (~> 5,000 daltons) não formam polymersomes distintas. Para todas as experiências neste manuscrito, uma baixa concentração de lípido marcado foi dopada para as soluções de polímero, apenas para fins de visualização. Outros métodos para a visualização, incluindo polímeros funcionalizados directamente com um corante fluorescente também pode ser usado. Polymersomes podem também ser visualizados com microscopia de campo claro, embora a microscopia de fluorescência oferece maior resolução.
A maioria das pequenas modificações para o protocolo normalmente não alterar os resultados. Por exemplo, pequenas diferenças na concentração da solução de polímero espalhada sobre as lamelas não alteram a formação do polímero de film formado. Enquanto o intervalo completo de concentração não foi determinada, formação polymersome ocorrerá com sucesso com uma grande gama de concentrações de película de polímero (por exemplo, 1-10 mg / ml). No entanto, existem algumas alterações de protocolo que não afectam negativamente a formação polymersome. O mais notável é que lamelas de vidro redondas (em vez de quadrado) resultam em muito pobre formação de polymersomes. Atribuímos isso ao mesmo extremamente camada de agarose no vidro que realmente impede a formação de polymersomes.
Um dos desafios mais notáveis da presente técnica é a capacidade de recuperar os polymersomes a partir da superfície com um rendimento elevado. Existem certos casos em que a remoção dos polymersomes a partir da superfície original pode ser vantajosa. Devido ao elevado ruído de fundo de fluorescência do filme de polímero desidratado, removendo polymersomes individuais e aderindo-lhes para limpar lamelas irá aumentar a qualidade de imagem e caracterização (particularmente durante a análise FRAP). Para fazer isso, pipetagem suave com uma pipeta de ponta na qual a extremidade tem sido cortada irá dessorver os polymersomes a partir da superfície (embora o número de vesículas recuperados é significativamente mais baixa do que aqueles originalmente formado). Polymersomes pode então ser colocado em superfícies lamela modificados, permitindo que o polymersome para interagir com a nova lamela. Tipicamente, para neutras polymersomes PEO-PBD, lamelas tratadas com ozono durante 15 min permitir que os polymersomes a cair para baixo para a superfície para imagiologia. Modificação de superfície diferente é necessária para composições polymersome diferentes (por exemplo, negativa ou positivamente carregada polímeros).
A maioria dos materiais utilizados neste protocolo são armazenados com sucesso e usado para dias ou semanas. A agarose solidificada pode ser reboiled e reutilizado até que a agarose começa a ter agregados mesmo após a ferver, ou a agarose solidificada começa a secar. As lamelas com películas de agarose secas podem ser armazenadas e a utilizaçãod indefinidamente (por exemplo, meses). O polímero foi dissolvido em clorofórmio pode ser armazenado a -20 ° C durante vários meses. Uma vez que o filme de polímero é seco sobre os filmes de agarose, no entanto, os filmes devem ser armazenadas sob vácuo e utilizado no prazo de duas semanas (armazenamento a longo prazo não foi determinada directamente, mas há diferenças apreciáveis em polymersomes formados a partir de películas de polímero mais de dois semana).
Usando o protocolo de re-hidratação assistida-gel apresentado aqui, centenas de polymersomes em forma de uniforme são formados rapidamente com apenas algumas horas de trabalho por meio de equipamentos padrão e reagentes de laboratório de baixo custo. Além disso, polymersomes pode ser formada numa variedade de soluções tampão fisiológico e a partir de composições poliméricas diferentes (não mostrado). Pequenas alterações ao método não alteram negativamente a formação de polymersomes, tornando reidratação assistida-gel de uma técnica versátil e acessível para cientistas com variando e técnicaxpertise.
A capacidade de criar facilmente polymersomes gigantes na escala de tamanho das células é essencial para a construção de sistemas de células-like artificiais. A facilidade de utilização e a versatilidade de reidratação assistida-gel para fazer essas polymersomes oferece um grande avanço no campo biomiméticos para a criação de imitadores de células-membrana robustos. Por exemplo, utilizando esta técnica, as estratégias para a encapsulação de diferentes componentes intracelulares, a funcionalização do polímero com proteínas e incorporação de proteínas transportadoras de membrana da membrana celular, só para citar alguns, pode ser concebido para construir células artificiais à base de polymersome.
Divulgações
Sandia National Laboratories is a multi-program laboratory managed and operated by Sandia Corporation, a wholly owned subsidiary of Lockheed Martin Corporation, for the U.S. Department of Energy's National Nuclear Security Administration under contract DE-AC04-94AL85000.
Agradecimentos
We would like to gratefully acknowledge Dr. Ian M. Henderson, Andrew Gomez and Dr. Walter F. Paxton for their technical expertise, advice and help in this work. This work was supported by the U.S. Department of Energy, Office of Basic Energy Sciences, Division of Materials Sciences and Engineering (BES-MSE). ACG, DYS and GDB were supported by BES-MSE. This work was performed, in part, at the Center for Integrated Nanotechnologies, an Office of Science User Facility operated for the U.S. Department of Energy (DOE) Office of Science (user project number RA2015A0004, PI: ACG).
Materiais
| Name | Company | Catalog Number | Comments |
| 125 ml Erlenmeyer flask | VWR | 89000-360 | |
| 18 guage needle | VWR | BD-305196 | |
| 25 mm square coverslips | VWR | 48366-089 | |
| Agarose | Sigma | A9539 | A standard agarose for DNA gel electrophoresis |
| Chloroform | Sigma | 288306-2L | |
| Commerical coverwell | Electron Microscopy Sciences | 70336 | Press-to-Seal Silicone Isolators |
| Fiji Image Analysis Software | ImageJ | Free Download: http://fiji.sc/Fiji | |
| Glass vial with Teflon Lid | VWR | 66009-556 | 1.9 ml capacity, case of 144 |
| Liss-rhodamine B PE Lipid | Avanti Polar Lipids | 810150C | 1 mg of lipid at 1 mg/ml concentration in chloroform |
| Parafilm | VWR | 52858-000 | 10.2 cm x 38.1 m |
| poly(ethylene oxide)-b-poly(butadiene) or PEO-PBD (with a molecular weight of 2,940) | Polymer Source | P2904-BdEO | http://polymersource.com/dataSheet/P2904-BdEO.pdf |
| Pastic Petri Dish | VWR | 25384-092 | |
| Teflon tape | VWR | 300001-057 | 1/2" width |
Referências
- Streicher, P., et al. Integrin reconstituted in GUVs: A biomimetic system to study initial steps of cell spreading. Biochim. Biophys. Acta. 1788 (10), 2291-2300 (2009).
- Paxton, W., Bouxsein, N. F., Henderson, I., Gomez, A., Bachand, G. Dynamic Assembly of Polymer Nanotube Networks via Kinesin Powered Microtubule Filaments. Nanoscale. , (2015).
- Bermudez, H., Brannan, A. K., Hammer, D. a., Bates, F. S., Discher, D. E. Molecular weight dependence of polymersome membrane structure, elasticity, and stability. Macromolecules. 35 (21), 8203-8208 (2002).
- Amos, R. C., Nazemi, A., Bonduelle, C. V., Gillies, E. R. Tuning polymersome surfaces: functionalization with dendritic groups. Soft Matter. 8 (21), 5947-5958 (2012).
- Egli, S., et al. Biocompatible functionalization of polymersome surfaces: A new approach to surface immobilization and cell targeting using polymersomes. J. Am. Chem. Soc. 133 (12), 4476-4483 (2011).
- Kim, K. T., Cornelissen, J. J. L. M., Nolte, R. J. M., Van Hest, J. C. M. A polymersome nanoreactor with controllable permeability induced by stimuli-responsive block copolymers. Adv. Mater. 21 (27), 2787-2791 (2009).
- Paxton, W. F., Price, D., Richardson, N. J. Hydroxide ion flux and pH-gradient driven ester hydrolysis in polymer vesicle reactors. Soft Matter. 9, 11295-11302 (2013).
- Henderson, I. M., Paxton, W. F. Salt, shake, fuse - Giant hybrid polymer/lipid vesicles through mechanically activated fusion. Angew. Chem. Int. Ed. 53 (13), 3372-3376 (2014).
- Discher, B. M. Polymersomes: Tough Vesicles Made from Diblock Copolymers. Science. 284 (5417), 1143-1146 (1999).
- Howse, J. R., et al. Templated formation of giant polymer vesicles with controlled size distributions. Nat Mat. 8 (6), 507-511 (2009).
- Horger, K. S., Estes, D. J., Capone, R., Mayer, M. Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength Films of Agarose Enable Rapid Formation of Giant Liposomes in Solutions of Physiologic Ionic Strength. J. Am. Chem. Soc. , 1-24 (2009).
- Axelrod, D., Koppel, D. E., Schlessinger, J., Elson, E., Webb, W. W. Mobility measurement by analysis of fluorescence photobleaching recovery kinetics. Biophys. J. 16 (9), 1055-1069 (1976).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat meth. 9 (7), 676-682 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados