Method Article
Gravação induzida pela temperatura actividade neuronal através de monitoramento das alterações de cálcio no bulbo olfativo de
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Here we describe a protocol for measuring and analyzing temperature responses in the olfactory bulb of Xenopus laevis. Olfactory receptor neurons and mitral cells are differentially stained, after which calcium changes are recorded, reflecting a sensitivity of some neural networks in the bulb to temperature drops induced at the nose.
Resumo
The olfactory system, specialized in the detection, integration and processing of chemical molecules is likely the most thoroughly studied sensory system. However, there is piling evidence that olfaction is not solely limited to chemical sensitivity, but also includes temperature sensitivity. Premetamorphic Xenopus laevis are translucent animals, with protruding nasal cavities deprived of the cribriform plate separating the nose and the olfactory bulb. These characteristics make them well suited for studying olfaction, and particularly thermosensitivity. The present article describes the complete procedure for measuring temperature responses in the olfactory bulb of X. laevis larvae. Firstly, the electroporation of olfactory receptor neurons (ORNs) is performed with spectrally distinct dyes loaded into the nasal cavities in order to stain their axon terminals in the bulbar neuropil. The differential staining between left and right receptor neurons serves to identify the γ-glomerulus as the only structure innervated by contralateral presynaptic afferents. Secondly, the electroporation is combined with focal bolus loading in the olfactory bulb in order to stain mitral cells and their dendrites. The 3D brain volume is then scanned under line-illumination microscopy for the acquisition of fast calcium imaging data while small temperature drops are induced at the olfactory epithelium. Lastly, the post-acquisition analysis allows the morphological reconstruction of the thermosensitive network comprising the γ-glomerulus and its innervating mitral cells, based on specific temperature-induced Ca2+ traces. Using chemical odorants as stimuli in addition to temperature jumps enables the comparison between thermosensitive and chemosensitive networks in the olfactory bulb.
Introdução
Over the last years, temperature sensitivity has no longer been described as a somesthetic sense only, but also as a physiological function relevant for the olfactory system. In rodents, the main olfactory bulb receives input from the Grueneberg ganglion (GG), an organ in the nasal cavity, consisting of thermosensitive neurons. GG neurons respond to cool temperatures1 as well as to chemical stimuli, and their chemosensitivity is modulated by temperature fluctuations2. These observations suggest that the olfactory bulb may integrate chemical and temperature information collected at the nose. In order to explore this hypothesis, we present here a set of experiments enabling the detection of temperature responses in the olfactory bulb of non-transgenic animals, using the Xenopus laevis larva as a model. The organization of the olfactory system in these animals closely resembles that of mammals. The olfactory receptor neurons of premetamorphic X. laevis terminate in tufts, and make synaptic contacts with the dendrites of second-order neurons, the mitral cells. Pre- and postsynaptic fibers intermingle and form skein-like neuropil structures called glomeruli3. The abundant synapses of the glomerular layer represent the first processing center of olfactory information. Mitral cells further integrate the sensory input and convey it to higher olfactory areas.
We have developed a protocol combining electroporation of olfactory receptor neurons (ORNs) with calcium-sensitive and non-sensitive dyes followed by bolus loading of the postsynaptic network of glomeruli and mitral cells. The staining by electroporation of two spectrally distinct dyes loaded in the nasal cavities serves to single out the γ-glomerulus3 through its bilateral innervation by ORNs from both olfactory epithelia. Thus, the location of the γ-glomerulus is identified prior to further measurements. Subsequently, bolus loading4 with Fluo-8 acetoxymethyl (Fluo-8 AM) is carried out in a volume comprising the γ-glomerulus. Imaging calcium changes with fast confocal microscopy allows the visualization of temperature responses in the 3D neuropil surrounding the γ-glomerulus, a unique temperature-sensitive glomerulus in this system5. Mitral cells innervating this specific structure can also be identified by their Ca2+ signals responsive to induced temperature drops. Next, activity correlation imaging6 uses the specific Ca2+ traces of these cells to reveal the dendritic morphology of thermosensitive mitral cells. Alternating repeated applications of cold Ringer solution and chemical odorants in one measurement can be used to visualize the mitral cell networks for odor and temperature processing surrounding the γ-glomerulus and identify potential overlaps. To unambiguously assign the responses to either the chemical or the temperature stimulus, we constantly monitor temperature at the olfactory epithelium.
Protocolo
Todas as experiências com girinos Xenopus laevis foram realizadas de acordo com as diretrizes aprovadas pelo Comitê Universidade de Göttingen de Ética em Experimentação Animal.
1. Eletroporação
- Escolha animais de estágios 49-54 de acordo com Nieuwkoop e Faber 7.
- Certifique-se de que a configuração de gravação é composta de um estereomicroscópio com uma grande distância de trabalho e um dispositivo de electroporação, que pode aplicar impulsos de tensão de 20 V durante 20 ms a uma frequência de, pelo menos, 2 Hz. Aplicar os impulsos de voltagem através de dois eléctrodos de platina com um diâmetro aproximada de 200 um de modo a que possam ser inseridas nas narinas dos girinos, sem causar danos.
- Preparar cristais de um corante de conjugado de dextrano (por exemplo, Calcium Green 10 kDa Dextrano, ou Alexa Fluor 647 de 10 kDa de dextrano) por dissolução da quantidade normalmente entregue de 5 mg em cerca de 100 ul de água destilada e deixando pequenas gotículas de2 ul secos em uma folha de Parafilm.
Nota: Os cristais de secar em menos de um dia e pode ser armazenado depois à temperatura de -18 ° C no congelador durante um período de mais de um ano. - Anestesiar os animais colocando-os em água da torneira contendo 3% tricaina metano-sulfonato de 1-2 min até atingir o estado de anestesia cirúrgica caracterizada por diminuição da frequência cardíaca, a perda de todos os movimentos e ausência de respostas a estímulos mecânicos.
- Mergulhe o animal anestesiado para 10 segundos na água da torneira puro.
- Colocar o animal em uma almofada de gel e corrigi-lo, colocando agulhas em torno dele sem prejudicá-lo.
Nota: Não fixe o animal picando agulhas através de sua pele. - Seque suavemente a área ao redor das narinas com um lenço de papel.
- Colocar o animal, ao microscópio estereoscópico e se concentrar nas narinas.
- Use uma pinça para pegar um cristal de corante de tamanho correspondente ao buraco narina, coloque-o em uma das cavidades nasais e esperar até que se dissolva completamente, which leva menos de 1 min. Se os cristais são menores, adicionar dois ou três em cada cavidade até produzir uma solução de alta concentrada não-translúcida.
- Coloque o cátodo sobre a pele do girino e do ânodo para uma das narinas.
Nota: Esta configuração especial aplica-se aos corantes citados no passo 1.3. Para corantes com uma polaridade diferente, os resultados de coloração pode ser melhorado por colocação do cátodo nas narinas. Se não estiver seguro sobre a polaridade do corante, ambos os eléctrodos podem ser colocados simultaneamente nas narinas (um por cada narina), e a polaridade alternada entre pulsos únicos de tensão. - Aplicar seis pulsos de 20 V e 20 ms, com aproximadamente 0,5 segundos de intervalo de estímulo.
Nota: As pequenas bolhas deve aparecer à volta do eléctrodo na narina durante a electroporação, desde que os eléctrodos estão em contacto com a pele e a solução na narina. Se não houver bolhas são visíveis verificar os cabos de ligação e certifique-se a devic electroporatinge está entregando o pulso de tensão desejado. - Repetir o procedimento (1,9-1,11) para a segunda narina.
- Transferir o girino electroporado em um recipiente cheio com água da torneira à temperatura ambiente. Aguarde de 5 a 10 minutos até que o animal recupere a consciência e retoma a sua natação. Alimentá-lo e deixá-la recuperar durante pelo menos um dia durante o qual o corante é transportado ao longo do nervo olfactivo ao bolbo olfactivo.
- Use os animais eletroporados dentro de 1-7 dias após a eletroporação para os melhores resultados de imagem. Dê pelo menos 24 tempo hr para o transporte de corante e recuperação antes de imagem.
2. Whole Mount Preparação
- Anestesiar o animal na água da torneira contendo 3% tricaina metano sulfonato até que todos os movimentos pararam e já não responde a estímulos mecânicos.
- Transferir o girino a uma almofada de gel sob um microscópio estereoscópico e corrigi-lo firmemente picando agulhas através da pele de cada lado da forebrain.
- Sacrificar o girino, cortando sua medula espinhal.
- Use um bisturi para dissecar um bloco de tecido contendo ambas as fossas nasais, os nervos olfativos e bulbos olfatórios (Figura 1A). Fazer a primeira incisão perto de esquerda narina-sem tocá-lo e mover o corte frente da lâmina ao lado do nervo olfativo esquerda e lâmpada até a fronteira telencefálico-diencephalic. Faça o mesmo no lado direito. Isolar a preparação a partir do resto do sistema nervoso, fazendo uma posterior redução final ao telencéfalo.
- Descarte o corpo do girino e inverter cuidadosamente o bloco de tecido de cabeça para baixo para que o lado ventral da preparação cérebro virado para cima.
- Pin o bloco de tecido novamente através da inserção de duas agulhas entre os nervos olfativos.
- Colocar uma gota de solução de rã de Ringer (NaCl a 98 mM, KCl 2 mM, CaCl2 1 mM, MgCl2 2 mM, glucose a 5 mM, Na-piruvato 5, HEPES 10 mM, ajustado para pH 7,8, osmolarança de 230 mOsmol / L) sobre o tecido.
- Retire as meninges que cobrem a zona de classificação axônio e os bulbos olfatórios, fazendo três incisões usando uma tesoura fina. A partir da borda posterior do bloco de tecido, corte caudorostrally estreitamente ao longo do bulbo olfativo para a esquerda até o ponto de entrada dos nervos olfativos para as lâmpadas (a triagem zona axônio).
- Repita o passo 2.8 para o hemisfério direito.
- Levantar as meninges com uma pinça e tornar o terceiro corte, perpendiculares aos anteriores na zona de classificação axónio.
Nota: O lado ventral do bulbo olfativo é agora acessível para a imagem latente e de ataque em bolus. - Para melhorar a qualidade da imagem na imagem de luz transmitida, repita o procedimento para o lado dorsal. Estes passos adicionais podem facilitar a navegação da micropipeta para o carregamento bolus, mas não são estritamente necessárias.
- Transferir a amostra para uma câmara de gravação preenchido com Ringer-rã para posterior processamento e tratamento de imagens. Faz com queure que o lado ventral está virado para cima e fixar a amostra com um líquido de fibras de nylon estende por mais de um pequeno quadro de platina.
- Para uma aplicação mais fácil de estímulos colocar as cavidades nasais na parte superior de uma das fibras de nylon.
3. Bolus Carregando
- Dissolve-se 50 g do corante de cálcio AM (por exemplo, Fluo-8:00) em 20 uL de sulfóxido de dimetilo (DMSO), contendo 20% de Pluronic F-127 (w / v) para preparar uma solução stock de corante AM. Congelar as soluções de reserva em pequenas aliquotas de 1-2 mL de volume. A solução estoque é estável durante pelo menos meio ano, mas evitar ciclos de congelamento-descongelamento.
- Use um extrator micropipeta e puxe pipetas com uma resistência de 5-8 mohms e um diâmetro de ponta 1-2 mm.
- Dissolve-se a solução stock de preparados do corante em solução de Ringer de rã a uma concentração de 250-500 uM.
- Adicionar MK571 para atingir uma concentração de 500 uM para bloquear os transportadores resistência a múltiplas drogas.
- Encher a micropipeta com 10 ul da solução utilizando uma pipeta de ponta alongada e remover todas as bolhas de ar por um movimento súbito da micropipeta.
- Montar o micropipeta no suporte da pipeta e certificar-se de que a pressão pode ser aplicada quer manualmente com uma seringa ou um dispositivo de ejecção pneumática da droga e controlar a pressão aplicada com um calibrador.
- Se possível, usar uma configuração de microscópio com a capacidade de excitar o corante injectado de modo a que o escoamento a partir da ponta da micropipeta pode ser visualizadas e ajustadas. Idealmente, usar uma configuração de imagem confocal. Use um microscópio vertical com uma objectiva de imersão para que o tecido pode ser alcançado com a micropipeta.
- Coloque toda a preparação de montagem sob o microscópio, siga o nervo olfactivo até que a lâmpada e concentrar para a área de interesse no bolbo olfactivo.
- Perfundir solução de Ringer fresca através da câmara de gravação, a fim de aumentar a viabilidade da preparação e lavar o vazamento corantea partir da ponta da micropipeta.
- Diminuir a pipeta sobre a superfície do bolbo olfactivo, com a ponta voltada para o sentido rostral da preparação.
- Aplicar um pequeno e constante de pressão positiva (~ 25 hPa) para a micropipeta para evitar o entupimento da pipeta e inseri-lo suavemente para dentro do tecido.
- Uma vez que a pipeta violou as camadas de tecido exteriores, movê-lo em uma direção rostro-dorsal para a camada de células mitral. (Note-se que um contra-coloração de neurónios receptores olfactivos por electroporação é útil para ajustar a posição da micropipeta.) Idealmente, colocar a ponta da pipeta a uma distância de 50-100 uM a partir do local de gravação desejada.
- Para a coloração do glomérulo-γ sensível à temperatura, uma área alvo cerca de 50 um rostral a partir da posição do neuropil pré-sináptico da γ-glomérulo.
- Aplicar uma pressão positiva na gama de 100-200 hPa. Ajustar a força de pressão, dependendo do tamanho dea ponta micropipeta. Confirme a saída da pipeta prestando atenção para movimentos leves de tecidos visíveis sob iluminação Brightlight quando a pressão é aplicada pela primeira vez.
- Manter uma pressão constante durante cerca de 10 min enquanto a micropipeta permanece no tecido. Se possível, verifique a neurópilo, entretanto, para o carregamento de células sob iluminação fluorescente como o carregamento bem sucedido resultará em coloração somata celular visível com intensidade crescente ao longo do tempo.
Nota: Muitas vezes, a razão para o carregamento vencida pipeta de entupimento devido ao tecido inserindo a ponta ou agrupamentos de corante agregados. Algumas vezes é possível para resgatar a pipeta por quebrar suavemente a ponta contra a superfície inferior da câmara de gravação. No entanto, a ponta da pipeta não deve ser superior a alguns micrômetros. Compensar aberturas de pipetas maiores através da aplicação de pressão mais baixa durante o carregamento bolus. - Após os 10 min de carregamento, reduzir a pressão aplicada a zero e verificar a coloração.
Nota: O tamanho da área manchada varia significativamente e depende de vários parâmetros tais como a quantidade de corante injectado e localização do local de ejecção. Uma boa coloração cobre uma área de cerca de 100 um x 100 fim. - Se a área manchada é muito pequena ou não cobrir o local de gravação desejado, repita os passos de 3,10-3,13. Use o mesmo micropipeta para a próxima injecção, caso ainda não tenha obstruído.
- Espere pelo menos 30 minutos após a última injecção antes de iniciar quaisquer experiências para permitir a absorção do corante e desesterificação. Continue a perfundir a câmara de gravação com a solução de Ringer fresca em todos os momentos.
4. Configurações de Medição
- Certifique-se de que a configuração de medição consiste em um microscópio confocal com velocidade suficiente para gravar três volumes tridimensionais. Escolha uma taxa de aquisição de pelo menos 1 Hz por pilha.
Nota: configurações adequadas incluem, por exemplo, microscópios line-iluminação de varredura da linha-sábio em vez de ponto, p amostraonto. Uma simples realização de uma configuração tal, tem sido anteriormente descrito 6. Outras opções estão girando microscópios de disco. Se não houver essa configuração está disponível, ainda é possível medir áreas menores com uma configuração normal de ponto-de digitalização. - Defina os parâmetros de medição de modo a que um volume grande o suficiente para caber o tamanho de um glomérulo podem ser cobertos.
Nota: A espessura típica de um volume de gravação se encontra no intervalo de 20 um, que devem ser cobertas por, pelo menos 5 camadas. - Verifique todas as medições pré-sinápticos para o branqueamento. Ajustar a potência de laser até que a intensidade de fluorescência média das imagens gravadas não cai sobre o curso de tempo da gravação.
- Limitar o tempo de medição e para a área de gravações no lado pós-sináptico para evitar o branqueamento tanto quanto possível, embora para as medições que excedam 20-30 seg branqueamento é provável que ocorra.
5. Aplicação de odores e Experiências de temperatura
- Despeje 25ml de solução de Ringer fresca (previamente armazenados a 4 ° C) em um tubo de 50 ml. Colocar o tubo em um balde de gelo.
- Monitorar a temperatura da campainha arrefecida através da inserção da sonda de um termómetro limpo para dentro do tubo. Aguardar até que a temperatura cai abaixo de 1 ° C antes de iniciar a experiência.
- Preparar 50 ml de L-histidina dissolvida em solução de Ringer numa concentração de 10 uM.
- Usar um aplicador funil 8 ou sistemas de aplicação semelhantes, permitindo a entrega de estímulo concomitantemente com a campainha de perfusão de modo que o fluxo de água na câmara continua a ser constante e ininterrupta durante o lançamento da solução estímulo. Posicionar o funil de tal maneira que a saída distai é menor do que 1 mm de distância do epitélio olfactivo.
- Coloque um sensor de temperatura de NiCr-Ni ligada a um termómetro digital para fechar o epitélio e a saída do aplicador funil. Ligar a porta de saída termômetro para um computador para gravar e visualmente disjogar variações de tensão que refletem pequenas oscilações de temperatura.
- Antes de iniciar a experiência, um outro sensor térmico para ligar um termómetro padrão para estabelecer o factor de escala de voltagem para temperatura.
- Levantamento da temperatura do banho na câmara de gravação e garantir que não exceda 22 ° C.
- Iniciar a aquisição de imagem e aplicam-se sequencialmente 200-400 ul de Ringer frio, a L-histidina e campainha à temperatura ambiente (20-22 ° C) por meio de uma pipeta electrónico com um intervalo interstimulus de 20-30 seg. Para um melhor controlo da aplicação do estímulo, libertar o estímulo com um sinal de disparo enviado pela estrutura de imagem escolhido para a pipeta se possível. Repita o protocolo de pedido de reprodutibilidade dos resultados.
- Tome conjuntos de gravações mais longas com várias rodadas de estímulo, uma vez que são preferíveis para análise pós-imagem com a imagem correlação atividade.
Nota: Um compromisso entre o tempo de gravação e a viabilidade fatia tema ser encontrado. Medições de cerca de 2 min, cobrindo 6 aplicações de estímulo proporcionar uma actividade suficiente para uma boa reconstrução da rede.
6. Processamento de Imagem Usando Atividade de Correlação de imagem (ACI)
- Processamento de Imagem das gravações pré-sinápticos
- Em gravações com estimulação por solução de Ringer frio e histidina, distinguir o γ-neurópilo sensível à temperatura do glomérulo sensível ao histidina vizinho por seus perfis de resposta diferentes (ver Kludt et al. 5).
- Criar uma projecção de intensidade máxima na direcção axial a partir de gravações de a preparação do cérebro na qual ORNs foram electroporadas com dois corantes diferentes de visualizar a inervação bilateral do γ-glomérulo.
- Processamento de Imagem dos Gravações pós-sinápticos usando a atividade de correlação de imagem (ACI)
- Seleccione gravações com pontos tempo suficiente (mais de 100 quadros) e uma quantidade razoável de atividade (pelo menos dois eventos).
Nota: A actividade pode ser tanto espontânea para revelar os processos de células mitrais individuais ou induzida por vários estímulos aplicações de gravação durante o mesmo para revelar as redes celulares activadas por estímulos olfactivos. - Escolha gravações onde as estruturas medidos mover não mais do que 2-3 pixels ao longo do curso tempo da gravação.
Nota: Gravações com muito movimento pode ser resgatado pela aplicação de um procedimento de correção turno descrito no Kludt et al 5. - Verifique se as gravações sofrem de branqueamento. Se a intensidade média de toda a imagem cai ao longo do tempo da gravação, correção de lixívia é necessário, caso contrário, pule as próximas duas etapas.
- Calcula-se a tendência linear para o tempo de traço de cada pixel através da realização de uma regressão linear.
- Subtrair o resultado de cada pixel individualmente para eliminar o componen linearT do branqueamento.
Observação: Como uma montagem alternativa de Legendre pode ser usado como descrito por Bao and Schild 9. - Baixe o script MATLAB de usar pronto, juntamente com um guia passo-a-passo para a imagem latente correlação atividade (ACI), como descrito por Junek et al. 6
Nota: Seguir os passos descritos em Junek et ai 6, como uma alternativa ao uso do script MATLAB fornecida.. - Mova os arquivos 'aci.m', 'matVis.m' e 'aci_roiSelector.m' do recipiente baixado para o caminho MATLAB do sistema utilizado para a avaliação dos dados.
- Carregar os dados brutos adquiridos no passo 5.8 como uma variável de espaço de trabalho do utilizador do MATLAB organizada como uma -matrix [X, Y, Z, T] com X e Y, referindo-se as dimensões laterais, Z, na direcção axial e t, o curso de tempo .
- Chamada 'ACI' a partir da linha de comando do MATLAB.
- Na interface de usuário (UI)que aparece, selecione "Prepare Dados 'e depois selecione a variável que contém os dados e um diretório no qual os resultados serão salvos.
Nota: Para uma descrição completa da interface do usuário, consulte o manual que acompanha o script aci. - Percorra os z-camadas medidos movendo o controle deslizante correspondente na interface do usuário para obter uma visão geral do mapa variância exibido.
- Digite o tamanho da região de interesse (ROI) para a UI. Para uma célula Soma mitral ajustar o ROI para abranger cerca de 10 mm na lateral e 5 mm na direcção axial. Para um glomérulo, os valores ligeiramente mais elevados de 20 uM e 10 uM lateralmente axialmente são apropriados.
Nota: O tamanho ROI deve ser introduzido como um número de pixels, a qual depende do dimensionamento do pixel escolhido para a gravação. - Selecione um ROI contendo a γ-glomérulo e regiões adicionais para cada soma visível das células mitral circundantes, clicando com o botão do meio do mouse para o centeR da célula / glomérulo.
- Feche a principal interface do usuário que aciona o cálculo dos mapas de correlação para todos os traços de referência. O resultado é automaticamente guardado e apresentado.
- Seleccione gravações com pontos tempo suficiente (mais de 100 quadros) e uma quantidade razoável de atividade (pelo menos dois eventos).
Resultados
A eletroporação de neurônios receptores olfativos (ORNs) foi alcançada com corantes Alexa Fluor ou indicadores de cálcio conjugadas com moléculas de dextrano para a rotulagem anterógrada via transporte axonal ativa. Enquanto a primeira corantes fornecer coloração brilhante dos neurónios sensoriais e os seus terminais de axónios de ramificação na camada glomerular do bolbo, este último permite a medição da actividade neuronal nestas células (Figuras 1 e 2). Em primeiro lugar, a posição do glomérulo-γ termossensível e o seu padrão de inervação foi visualizado por electroporating Alexa Fluor 647 Dextrano e Alexa Fluor 546 Dextrano no epitélio olfactivo esquerda e direita, respectivamente (Figura 1A). Vinte e quatro horas após o procedimento, os ORNs nas narinas, os dois nervos olfativos e glomérulos em ambos os hemisférios eram visíveis sob microscopia fluorescente. Os aglomerados foram glomerulares diferentes identifiavel por suas respectivas posições, nomeadamente, o pequeno aglomerado compreendendo o γ-glomérulo (Figura 1B). Um pequeno número de fibras olfactivas contralateral correu através do bulbo olfatório contralateral, atravessou a comissura anterior e encerrou na ipsilateral γ-glomérulo (Figura 2A).
A fim de registar as respostas de cálcio das fibras pré-sinápticas da γ-glomérulo, Calcium Green Dextran foi electroporado em ORNs, de acordo com o mesmo procedimento. saltos de temperatura negativo foram induzidas na narina através da libertação controlada de solução de Ringer com gelo (0-1 ° C). Um volume 3D compreendendo o γ-glomérulo foi visualizada sob uma linha-iluminação microscópio confocal rápido. ΔTs de -1 ° C foram suficientes para desencadear respostas frias no γ-glomérulo e seus aferentes, reconhecível como picos reversíveis nas Af / F Ca 2+ traços (Figura 2B </ strong>, C).
Outros passos experimentais foram realizadas para medir a actividade induzida pelo frio nas células mitrais ligados à glomérulo-γ através das suas terminações dendríticas ramificados. Estas fibras e pós-sinápticos do neuropil circundante foram efectivamente corada por carregamento de bolus do corante sensível ao cálcio Fluo-08:00, realizado em alguns dias após a Alexa 647 Dextrano foi electroporado em ORNs (Figura 3A, B). células mitral foram preenchidos com Fluo-08:00, eo epitélio olfativo foi estimulada por duas vezes de acordo com o seguinte paradigma: Ringer frio, histidina (10 mM) e à temperatura ambiente Ringer, aplicado posteriormente. Dois rastreios de referência foram tomadas a partir de regiões de interesse no volume registado, um de responder exclusivamente a temperatura cai, o outro, apenas para histidina. Imaging correlação Atividade (ACI) 6 foi calculado com base na referência selecionadatraça de visualizar com alto contraste a morfologia dendrítica das redes pós-sinápticos que correspondem quer a uma temperatura ou o sinal de histidina-responsivo de Ca2 + (Figura 3C e D). Finalmente, mapas termossensíveis e quimiossensíveis eram codificados por cores e sobreposto em cima uns dos outros, que mostra como a temperatura e a informação química é transportado a partir glomérulos individuais para os neurónios de segunda ordem olfativos (Figura 3E). Para uma descrição da integração e processamento de ambos os tipos de informações em redes olfativas compartilhadas, consulte Kludt et al. 5
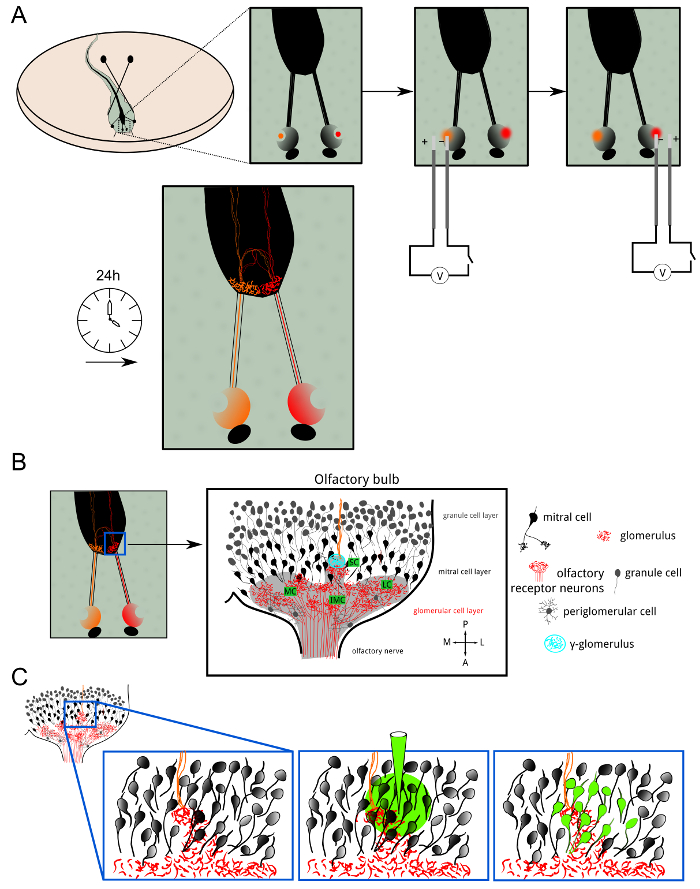
Figura 1: Visão geral da eletroporação ORN e bolus de carga (A) neurônios receptores olfativos em ambas as cavidades nasais de X.. laevis larvas foram electroporadas com corantes Alexa ou Calciucorantes sensíveis ao m acoplados a moléculas de dextrano. Os indicadores fluorescentes foram transportados até a anterogradamente arborização axonal terminal. 24 horas após a electroporação, a camada glomerular em ambos os hemisférios apresentaram coloração fluorescente. (B) Esquema da organização celular do bulbo olfativo em um hemisfério. A camada glomerular abrange a lâmpada em clusters: clusters medial, pequenas, médias e laterais. informação olfativa é transferido dos neurônios receptores para mitral células através de sinapses excitatórias em glomérulos. periglomerular células e as células granulares são neurónios inibidores que modulam o processamento olfactivo e codificação. A γ-glomérulo (ciano) foi facilmente identificada como a pequena neurópilo onde ipsilateral (vermelho) e contralateral fibras olfactivas (laranja) se fundiram. (C) de carga em bolus foi conseguida na vizinhança do glomérulo-γ para corar o neurópilo pós-sináptica que consiste principalmente de células mitrais e os seus dendriárvores tic ramificação consideravelmente na camada glomerular. Por favor clique aqui para ver uma versão maior desta figura.
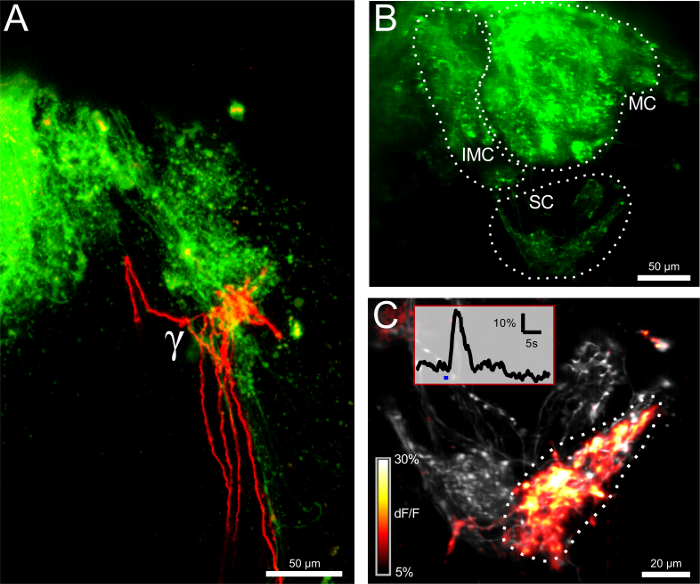
Figura 2: Eletroporação de ORNs revela a conectividade estrutural e funcional (A) inervação bilateral do γ-glomérulo por ipsilateral (verde) e neurônios receptores contralateral (vermelho) olfativos (ORNs).. Barra de escala = 50 mm. (B) O bolbo olfactivo após a electroporação com o corante sensível ao cálcio Calcium Green Dextran. O intermedial (IMC), medial (MC) e do pequeno aglomerado (SC) são visíveis. A imagem é uma projeção máxima de 100 volume de medição mm de espessura. Barra de escala = 50 mm. (C) Opinião do Close-up do pequeno cluster. O volume registado (12 uM) estárepresentado de uma projecção máxima. A imagem descreve o nível de fluorescência basal em cinza eo Af codificados por cores mapa / F como uma sobreposição. A máxima resposta à estimulação com solução de Ringer fria é representada graficamente. A γ-glomérulo reagiu fortemente, enquanto os dois glomérulos vizinhos permanecer em silêncio. A inserção mostra o traçado Af / F para o γ-glomérulo correspondente à região indicada de interesse. A barra azul representa a aplicação de estímulo. Barra de escala = 20 mm. Por favor clique aqui para ver uma versão maior desta figura.
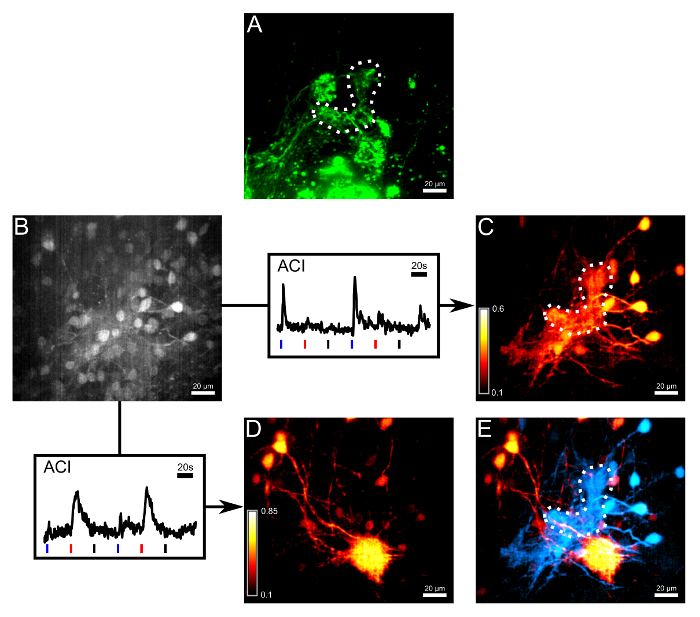
Figura 3:. Bolus carga e ACI dissociar termossensível e redes quimiossensíveis (A) Os axônios dos ORNs terminam no pequeno aglomerado foram coradas por eletroporação com o não-calcihum corante sensível Alexa 647 dextrano. A linha pontilhada descreve o γ-glomérulo. (B) Imagem da mesma região como em (A) no segundo canal de medição após o carregamento de bolus com o corante sensível ao cálcio Fluo-08:00. Alguns somata célula mitral eram visíveis, mas o contraste era limitado. Seguindo as setas, dois traços de resposta foram representados, os quais foram utilizados para imagiologia de correlação actividade (ACI). Azul, barras vermelhas e pretas abaixo os traços representam o início da aplicação de Ringer frio, histidina (10 mM) e à temperatura ambiente Ringer como controlo negativo, respectivamente. Os dois Ca 2+ vestígios foram tomadas a partir de diferentes regiões de interesse do volume medido. (C) O resultado ACI do traço em (B) destacando as áreas que respondem predominantemente a campainha frio. (D) O resultado ACI do traço em (B) destacando as áreas que respondem predominantemente a histidina. (E) Sobreposição dos dois mapas ACI. células mitral respondendo ao histidine e glomérulo inervado (vermelho) eram facilmente distinguíveis das células mitrais termossensíveis e o γ-glomérulo (ciano). Todas as imagens desta figura são projeções de intensidade máxima de um volume de 28 mm de espessura. Barra de escala = 20 mm. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Os métodos aqui apresentados visam processamento de registro da temperatura no bulbo olfativo de Xenopus laevis girinos. As manchas de protocolo primeiras e segundas neurônios ordem no bulbo olfativo e proporciona uma preparação de amostras em que o sistema olfativo permanece essencialmente intacto. Assim, a activação do glomérulo-γ sensível à temperatura pode ser monitorizada e comparada com os seus vizinhos glomérulos sensível à quimioterapia. A inervação bilateral única deste glomérulo é visualizado por eletroporação celular com espectralmente diferentes corantes. Além disso, permite o carregamento de bolus para a coloração das células mitrais que abrangem uma grande volume no interior do bolbo olfactivo. Os sinais induzida pela temperatura de processamento de rede neuronal é revelado, tomando as medidas de cálcio com aplicações de estímulo repetidas e, posteriormente, analisar os dados com imagens de correlação atividade.
O protocolo destaca dois sofisticada proce coloração mentos, ambos os quais requerem a manipulação e a prática cautelosa, de modo a conseguir resultados satisfatórios e reprodutíveis. Durante a eletroporação qualquer ferimento dos animais tem de ser evitada, especialmente quando o posicionamento dos eletrodos nas narinas. Idealmente, nenhum contato com o epitélio olfativo deve ocorrer. Note-se que os animais ainda estão vivos após o procedimento de electroporação e o seu tempo de recuperação deve ser tida em conta. Se a coloração permanece muito fraco após um ciclo de electroporação, o que pode acontecer, dependendo dos tipos de corantes utilizados, a sua intensidade pode ser aumentada através do aumento da concentração do corante nas narinas. Uma vez que as moléculas acoplado-dextrano são transportadas através de vários mecanismos incluindo transporte axonal lenta (a uma velocidade de 1-2 mm / dia 10) e difusão passiva, uma outra alternativa é de esperar 48 horas após a electroporação antes de sacrificar os animais. Alternativamente, a electroporação pode ser repetido ao fim de um dia de recuperação.
jove_content "> Bolus de carregamento é um passo crítico desde que a quantidade de corante entrar nas células mitral é difícil de regular e depende de vários parâmetros como o tamanho da ponteira e a localização da aplicação. Acompanhamento do processo sob um microscópio de fluorescência confocal prova ser útil para ajustar a duração de aplicação de corante e, assim, a geração de resultados de coloração semelhantes em preparações. para além disso, os girinos anteriormente electroporadas deve ser utilizado para determinar a melhor posição para a aplicação do corante através da identificação da posição do pequeno aglomerado (que compreende o γ-glomérulo). o mais passo crítico durante as medições consiste em evitar tanto deslocamento e de branqueamento da amostra. o deslocamento pode ser evitada posicionando cuidadosamente o fluxo de Ringer sob o microscópio. Tal como para limitar o branqueamento da área de interesse, o tempo de medição deve ser reduzida ao essencial .Bolus de carga coloração com corantes sensíveis ao cálcio fornece apenas muitocontraste limitado, já que as células saudáveis geralmente têm baixos níveis de cálcio e, assim, mostrar fraca fluorescência basal. Aplicando imagem correlação atividade contorna essa limitação através da geração de contraste com base em estruturas de actividade e realces com sinais de cálcio semelhantes. Este método de análise pós-aquisição calcula o factor de correlação entre o sinal de cálcio de uma região de interesse seleccionada (traço de referência) e de que de cada pixel individual do volume 3D. Portanto, os resultados obtidos dependem fortemente o padrão de actividade seleccionada como traço de referência. Se o foco principal é a visualizar os padrões de inervação células mitrais, um sinal de referência derivado de uma actividade neuronal espontânea é o preferido, e a escolha das células mitrais mais activos produzirá os melhores resultados. Para revelar as redes quimio ou termossensíveis de células mitral, os traços de referência contendo apenas respostas a qualquer histidina ou Ringer frio deve ser selecionada. A selecção da totalidade de um glomérulo ór soma célula mitral como a região de interesse nem sempre pode fornecer um traço de referência clara, especialmente se as estruturas que respondem aos dois estímulos diferentes são deitado em cima uns dos outros. Em tal caso, é muitas vezes útil para seleccionar uma área menor do glomérulo ou corpo celular como a região de interesse.
Nas últimas décadas, electroporação tem sido descrito como um método eficiente para corar células únicas ou múltiplas 11,12. Aqui ele é usado para rotular especificamente neurônios receptores olfativos. Moléculas de dextrano conjugado dar a maior eficiência, e para corantes não sensíveis ao cálcio, o intervalo de selecção é amplo e cobre o espectro completo tipicamente usado em microscopia de fluorescência 13. No entanto, corantes sensíveis ao cálcio que são electroporadas com sucesso em neurônios receptores olfativos estão no momento limitado a dextrano de cálcio-verde, e Fluo-4 dextrano se ainda disponível no mercado. Além disso, as gravações alvo principalmente superficial camadas na superfície ventral de apenas o bulbo olfativo, uma vez que a profundidade de penetração de técnicas de medição rápida é limitado. imagens de dois fótons podem, em parte, superar essa limitação, mas muitas vezes não tem velocidade e restringe a quantidade de corantes sensíveis ao cálcio selecionáveis ainda mais.
Descrevemos aqui um protocolo para medir a actividade induzida pela temperatura no bolbo olfactivo. O neurópilo cérebro é explorado como um volume tridimensional para visualizar as redes celulares complexas envolvidas no processamento olfativo da temperatura. Medindo a actividade induzida pela temperatura no bolbo olfactivo foi muito recentemente relatado 5 e requer um processo especialmente personalizado combinação de técnicas diferentes. Um trunfo importante das técnicas apresentadas acima é que centenas de células são fotografadas em três dimensões em uma preparação em que a maior parte do sistema olfactivo permanece intacta. Estas vantagens colocar elevadas exigências sobre as técnicas de coloração, bem como o cérebro preparação e de imagem. Por exemplo, a electroporação de células e de ataque em bolus atingido grandes quantidades de células no epitélio olfactivo e do bulbo, e, assim, permitir a visualização de redes celulares completos. Além disso, a entrega de indicadores químicos por meio de ataque em bolus em vez de fluoróforos geneticamente codificados permite medições em um conjunto de espécies potencialmente maior. Outras alternativas, como a incubação de banho com corantes AM trabalhar principalmente em fatias que danificam o bulbo olfativo severamente, deixando apenas algumas centenas de micrômetros de tecido intacto. Em comparação, toda a preparação montagem utilizado em nosso protocolo garante, por exemplo, que a inervação bilateral da γ-glomérulo permanece intacto e as gravações são, assim, tomado em um sistema ainda operatório. Finalmente, a própria imagem é feito por microscopia de linha-de iluminação que permite a aquisição de volumes 3D. Microscopia Line-iluminação é uma das técnicas confocal proporcionando as mais altas taxas de aquisição possíveis 6 </ Sup>, que são necessários para cobrir uma grande fração do bulbo olfativo. sistemas de aquisição mais lentos podem ser utilizados, mas tem a desvantagem de que o tamanho do volume gravado deve ser reduzida. Nos últimos anos, outros métodos para a aquisição de imagem rápida têm sido desenvolvidos e podem ser utilizados como alternativas 14,15. No entanto, microscopia line-iluminação continua sendo um dos métodos mais fáceis para ganhar velocidade e resolução suficiente. Aqui seguem algumas informações como diretrizes para selecionar configurações de imagem adequados. Desde imagem de cálcio é feito dentro das preparações cerebrais grossas, a instalação deve fornecer confocalidade decente e os objetivos devem ter aberturas numéricas de 1,0 ou superior. Para um ponto de referência, as gravações feitas com o microscópio linha de iluminação correspondem a imagens tiradas com um microscópio de varredura a laser padrão com um tamanho de pinhole de 0,5-1 unidades arejados. A velocidade rápida aquisição é desejável. Um volume com uma espessura de 20 um coberto por, pelo menos, 5 lAyers, um campo lateral de visão de 100 mm x 100 mm e um tamanho de pixel de 0,5 mm ou menores devem ser verificados a uma velocidade mínima de 1 Hz por pilha. A redução do confocalidade pode aumentar a quantidade de fotões contados e, assim, permite a aquisição mais rápidos se for necessário, mas tem o inconveniente de gravação de mais luz para fora de foco. No entanto, uma vez que uma tal abordagem aumenta a espessura das fatias ópticos, que podem, na verdade, facilitar o rastreio dos dendritos através de diferentes z-planos após a aplicação de ACI 6.
As ferramentas necessárias para estudar extensivamente processamento de temperatura em redes bulbo olfativo são aqui apresentados. atividade induzida pela temperatura devem ser registados nos primeiros e segundo neurônios de ordem via corantes e ambos os sinais que chegam e partem do γ-glomérulo sensível ao cálcio. Além disso, na medida em que as células individuais mitral processar tanto informações químicas e de temperatura podem ser avaliadas. Desde o lea preparaçãova-se o bolbo olfactivo intacta, o papel da inervação bilateral no processamento olfactivo podem ser mais bem estudadas. O processo também é útil para revelar se e como termo-chemoinformation e é codificado em sobreposição redes olfactivos 5. Finalmente, as técnicas acima mencionadas não estão limitados ao estudo das respostas de temperatura no bolbo olfactivo, mas pode ser aplicado para uma avaliação mais geral do sistema olfactivo, em especial as redes celulares de processamento de grandes volumes de três dimensões. Ataque em bolus e imagem correlação atividade são ferramentas poderosas para observar e comparar a atividade de dezenas de neurônios, tornando-as aplicáveis a diferentes redes cerebrais 16.
Divulgações
The authors have nothing to disclose.
Agradecimentos
This project was funded by the DFG Excellence Cluster 171, the Center for Nanoscale Microscopy and Molecular Physiology of the Brain, the Bernstein Center for Computational Neuroscience and the ENC-Network, an Erasmus Mundus Joint Doctoral Program. The authors thank Stephan Junek, Mihai Alevra and Guobin Bao for providing MATLAB codes and custom-written programs for image evaluation and data analysis.
Materiais
| Name | Company | Catalog Number | Comments |
| Reagents | |||
| Sodium chloride | Merck Millipore | 1064040500 | |
| Potassium chloride | Merck Millipore | 1049360250 | |
| Calcium chloride dihydrate | Merck Millipore | 1023820250 | |
| Magnesium chloride hexahydrate | Merck Millipore | 1058330250 | |
| D(+)-Glucose | Merck Millipore | 1083371000 | |
| Sodium pyruvate | Sigma-Aldrich | P2256 | |
| HEPES | Merck Millipore | 1101100250 | |
| Calcium Green 10 kDa Dextran | Thermo Fisher Scientific | C-3713 | |
| Dextran, Alexa Fluor 647 | Thermo Fisher Scientific | D-22914 | |
| Dextran, Alexa Fluor 546 | Thermo Fisher Scientific | D-22911 | |
| Fluo-8 AM | TEFlabs | 203 | |
| MK571 | Alexis Biochemicals | 340-021-M005 | |
| MS-222 | Sigma-Aldrich | E10521 | |
| Pluronic acid F-127 | Sigma-Aldrich | P2443 | powder |
| L-Histidine monohydrochloride monohydrate | Sigma-Aldrich | 53370 | |
| DMSO | Merck Millipore | 1029522500 | |
| Equipment | |||
| Electronic pipette | BrandTech | HandyStep Electronic Repeating Pipette | |
| NiCr-Ni thermocouple | Greisinger Elektronik | GTF 300 | |
| Micropipette puller | Narishige | Model PC-10 | two-step puller |
| Funnel applicator | (Custom-made) | ||
| Line-illumination microscope | (Custom-made) | otherwise, a commercially available spinning disk microscope | |
| Objective W Plan-Apochromat 63X/1.0 | Zeiss | 441470-9900-000 | |
| Objective W Plan-Apochromat 40X/1.0 DIC | Zeiss | 441452-9900-000 | |
| Software | |||
| MATLAB | The MathWorks | from R2010b upwards |
Referências
- Mamasuew, K., Breer, H., Fleischer, J. Grueneberg ganglion neurons respond to cool ambient temperatures. Eur J Neurosci. 28 (9), 1775-1785 (2008).
- Brechbühl, J., Moine, F., Broillet, M. -C. Mouse Grueneberg ganglion neurons share molecular and functional features with C. elegans amphid neurons. Front. Behav. Neurosci. 7 (193), (2013).
- Gaudin, A., Gascuel, J. 3D atlas describing the ontogenic evolution of the primary olfactory projections in the olfactory bulb of Xenopus laevis. J Comp Neurol. 489 (4), 403-424 (2005).
- Stosiek, C., Garaschuk, O., Holthoff, K., Konnerth, A. In vivo two-photon calcium imaging of neuronal networks. Proc Natl Acad Sci U S A. 100 (12), 7319-7324 (2003).
- Kludt, E., Okom, C., Brinkmann, A., Schild, D. Integrating temperature with odor processing in the olfactory bulb. J Neurosci. 35 (20), 7892-7902 (2015).
- Junek, S., Chen, T. W., Alevra, M., Schild, D. Activity correlation imaging: visualizing function and structure of neuronal populations. Biophys J. 96 (9), 3801-3809 (2009).
- Nieuwkoop, P. D., Faber, J. Normal Table of Xenopus laevis. , Garland Publishing Inc. New York. (1994).
- Schild, D. A computer-controlled device for the application of odors to aquatic animals. J Electrophysiol Tec. 12 (2), 71-79 (1985).
- Bao, G., Schild, D. Fast and Accurate Fitting and Filtering of Noisy Exponentials in Legendre Space. PLoSONE. 9 (3), (2014).
- Terasaki, M., Schmidek, A., Galbraith, J. A., Gallant, P. E., Reese, T. S. Transport of cytoskeletal elements in the squid giant axon. Proc Natl Acad Sci U S A. 92 (25), 11500-11503 (1995).
- Haas, K., Sin, W. C., Javaherian, A., Li, Z., Cline, H. T. Single-Cell Electroporationfor Gene Transfer In Vivo. Neuron. 29 (3), 583-591 (2001).
- Haas, K., Jensen, K., Sin, W. C., Foa, L., Cline, H. T. Targeted electroporation in Xenopus tadpoles in vivo-from single cells to the entire brain. Differentiation. 70 (4-5), 148-154 (2002).
- Paredes, R. M., Etzler, J. C., Watts, L. T., Lechleiter, J. D. Chemical Calcium Indicators. Methods. 46 (3), 143-151 (2008).
- Salome, R., et al. Ultrafast random-access scanning in two-photon microscopy using acousto-optic deflectors. J Neurosci Methods. 154 (1), 161-174 (2006).
- Keller, P. J., Ahrens, M. B., Freeman, J. Light-sheet imaging for systems neuroscience. Nature Methods. 12 (1), 27-29 (2015).
- Hjorth, J. J., et al. Detection of silent cells, synchronization and modulatory activity in developing cellular networks. Dev Neurobiol. , (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados