Method Article
Método eletrofisiológico para respostas gravação intracelular de tensão
Neste Artigo
Resumo
Sharp microelectrodes enable accurate electrophysiological characterization of photoreceptor and visual interneuron output in living Drosophila. Here we show how to use this method to record high-quality voltage responses of individual cells to controlled light stimulation. This method is ideal for studying neural information processing in insect compound eyes.
Resumo
Voltage responses of insect photoreceptors and visual interneurons can be accurately recorded with conventional sharp microelectrodes. The method described here enables the investigator to measure long-lasting (from minutes to hours) high-quality intracellular responses from single Drosophila R1-R6 photoreceptors and Large Monopolar Cells (LMCs) to light stimuli. Because the recording system has low noise, it can be used to study variability among individual cells in the fly eye, and how their outputs reflect the physical properties of the visual environment. We outline all key steps in performing this technique. The basic steps in constructing an appropriate electrophysiology set-up for recording, such as design and selection of the experimental equipment are described. We also explain how to prepare for recording by making appropriate (sharp) recording and (blunt) reference electrodes. Details are given on how to fix an intact fly in a bespoke fly-holder, prepare a small window in its eye and insert a recording electrode through this hole with minimal damage. We explain how to localize the center of a cell's receptive field, dark- or light-adapt the studied cell, and to record its voltage responses to dynamic light stimuli. Finally, we describe the criteria for stable normal recordings, show characteristic high-quality voltage responses of individual cells to different light stimuli, and briefly define how to quantify their signaling performance. Many aspects of the method are technically challenging and require practice and patience to master. But once learned and optimized for the investigator's experimental objectives, it grants outstanding in vivo neurophysiological data.
Introdução
A mosca da fruta (Drosophila melanogaster) olho composto é um grande sistema modelo para investigar a organização funcional dos fotorreceptores e interneurônio matrizes para a amostragem de imagem neural e processamento, e para a visão animal. O sistema tem o esquema de ligações mais completa 1,2 e é amável a manipulações genéticas e monitoramento da atividade neural preciso (de alta relação sinal-ruído e hora resolução) 3-10.
O olho Drosophila é modular, contendo ~ 750 estruturas cobertas de lente aparentemente regulares chamados ommatidia, que juntos fornecem a um campo visual panorâmico que cobre quase todas as direções ao redor de sua cabeça voar. Informação primária do olho amostragem unidades são seus fotorreceptores rabdoméricos 7,8,11. Cada omatídeo contém oito células fotorreceptoras (R1-R8), que compartilham a mesma lente faceta, mas estão alinhados com sete direções diferentes. Embora os fotorreceptores exteriores R1-R6 ARe mais sensível à luz azul-verde, sensibilidades espectrais das células internas R7 e R8, que se encontram em cima uns dos outros e apontam para a mesma direcção, apresentam três subtipos distintos: pálido, amarelo e a área de rebordo dorsal (DRA) 12- 15.
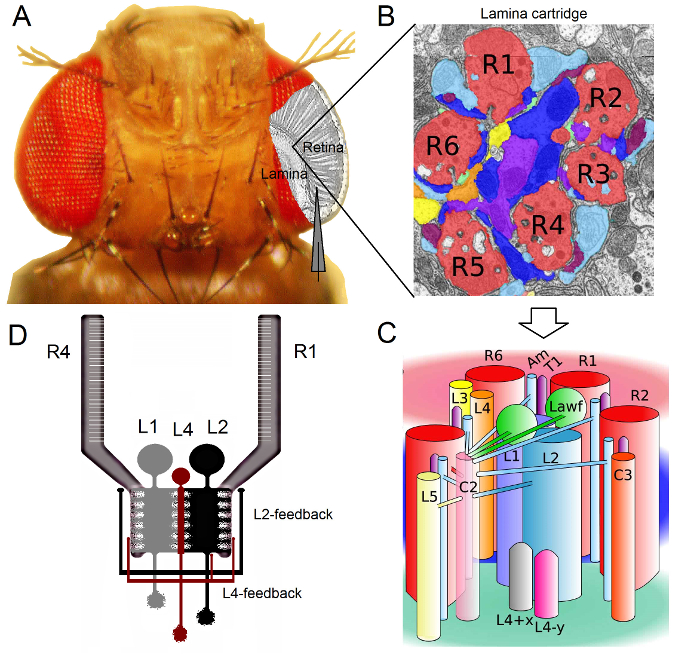
Figura 1. Organização Funcional do Olho Drosophila. (A) Os dois primeiros gânglios óptico, retina e lâmina, são destacadas em cinza no interior do olho da mosca. Fotorreceptores da retina R1-R6 e lâmina grandes células monopolar (LMCs: L1-L3) são facilmente acessíveis in vivo para gravações microeletrodos afiada convencionais. O eletrodo esquemática destaca o caminho normal para gravar a partir de R1-R6 na retina. Um caminho para gravar a partir de LMCs na lâmina é deslocar paralelamente o eletrodo para a esquerda. (B) lâmina é uma matriz de órgão retinotopicallyized cartuchos, cada um dos quais é embalado com neurónios que processa informação a partir de uma pequena área específica no espaço visual. Devido à superposição neural, seis fotorreceptores de diferentes ommatidia vizinhos enviam seus axónios (R1-R6) para o mesmo cartucho de lâmina, formando sinapses de saída histamin�gicos para L1-L3 e uma célula amacrine (Am). (C) A difusão de informação entre os terminais de axónios neuronais R1-R6 e os interneurónios visuais (incluindo L4, L5, Lawf, C2, C3 e T1), no interior de um cartucho de lâmina é complexa. (D) R1-R6 axônios fotorreceptoras receber feedbacks sinápticos de células monopolares L2 e L4. (B) e (C) modificado a partir de Rivera-alba et al 2. Por favor clique aqui para ver uma versão maior desta figura.
O olho Drosophila é do tipo neural superposição 16. Isto significa tchapéu de sinais neurais de oito fotorreceptores pertencentes a sete ommatidia vizinha, que olham para o mesmo ponto no espaço, são agrupados em um cartucho de neural nos próximos dois neuropils: a lâmina e medula. Enquanto os seis fotorreceptores exteriores projecto R1-R6 seus terminais de axónios para colunas neurais na lâmina (Figura 1), as células R7 e R8 ignorar essa camada e fazer contactos sinápticos com a sua coluna correspondente medula 17-19. Estas fiações exactas produzir o substrato neural para o mapeamento de mosca retinotópica visão inicial, após o que cada lâmina (Figuras 1A-C) e medula coluna (cartucho) representa um único ponto no espaço.
Entradas directas de fotorreceptores R1-R6 são recebidos pelos grandes células monopolar (LMCs: L1, L2 e L3) ea célula amácrina (AM) na lâmina 1,2,20. Destes, L1 e L2 são as maiores células, mediadores principais vias de informação (Figura 1D), WHIch respondem a on e bordas Off-movimento, e, assim, formar a base computacional do detector de movimento 21,22. Experimentos comportamentais sugere que pelo contraste intermediária, as duas vias facilitar a percepção do movimento de sentidos opostos: back-to-frente em L1 e para frente e para trás em células L2 23,24. Conectividade implica ainda que os neurônios L4 pode desempenhar papel fundamental na comunicação lateral entre cartuchos vizinhos 25,26. sinapses recíprocas foram encontradas entre as células L2 e L4 localizados na mesma e dois cartuchos adjacentes. Jusante, cada célula L2 e seus três células L4 associados projetam seus axônios para um objectivo comum, o neurônio Tm2 na medula, onde se acredita entradas de cartuchos vizinhos para ser integrado para o processamento do movimento 27 de front-to-back. Embora os neurônios L1 receber entrada a partir do mesmo cartucho L2s via ambas as junções comunicantes e sinapses, eles não estão diretamente ligados à cartuchos de lâmina L4s e, portanto adjacentes.
Comentários Synaptic para axónios fotorreceptoras R1-R6 são fornecidas apenas pelos neurónios pertencentes aos circuitos / L4 L2 mas não a via de 1,2 L1 (Figura 1D). Enquanto as conexões do mesmo cartucho são seletivamente de L2 a R1 e R2 e de L4 a R5, todos os fotorreceptores R1-R6 receber feedback sináptica de L4 de um ou de ambos os cartuchos vizinhos. Além disso, existem fortes ligações sinápticas de AM para R1, R2, R4 e R5, e células gliais, também estão sinapticamente ligado à rede e pode, assim, participar na neural de processamento de imagem 6. Finalmente, axonais-gap junctions, ligando vizinha R1-R6 e entre R6 e R7 / R8 fotorreceptores na lâmina, contribuir para a representação da informação assimétrica e o processamento em cada cartucho 14,20,28.Gravações de tensão intracelulares de fotorreceptores individuais e interneurônios visuais em Drosophila quase intacto fornecer alta r sinal-ruídodados ATIO com resolução sub-milissegundo 3,5,7-10,29, que é necessário para dar sentido às computações neurais rápidas entre os neurônios conectados. Este nível de precisão é impossível por técnicas de imagem ópticos atuais, que são significativamente mais ruidoso e tipicamente operam em 10-100 resolução ms. Além disso, porque os eletrodos têm muito pequenas e afiadas pontas, o método não é restrito aos corpos celulares, mas pode fornecer gravações diretas de estruturas neurais ativas pequenas; tais como árvores dendríticas os LMCs 'ou axônios fotorreceptoras, que não podem ser acessados por muito maiores pontas dos eletrodos de patch-clamp. É importante ressaltar que o método também é estruturalmente menos invasivo e prejudicial do que a maioria das aplicações de patch-clamp, e assim afectam menos intracelular meio e informações de amostragem das células estudadas. Assim, as técnicas de microeletrodos afiada convencionais têm contribuído, e continuar a contribuir, descobertas fundamentais e uma visão original em infor neuralprocessamento de infor- na escala de tempo apropriado; melhorar o nosso entendimento mecanicista de visão 3-10.
Este artigo explica como em gravações intracelulares vivo a partir de Drosophila fotorreceptores e LMCs R1-R6 são realizados no laboratório Juusola. Este protocolo irá descrever como construir uma plataforma de eletrofisiologia adequada, preparar a mosca, e realizar as gravações. Alguns dados representativo é apresentado, e alguns problemas comuns e as possíveis soluções são discutidas que podem ser encontrados quando utilizando este método.
Protocolo
O protocolo a seguir está em conformidade com todas as orientações de cuidados de animais da Universidade de Sheffield e Universidade Normal de Pequim.
1. Reagentes e Equipamentos para Preparação
- Gravação e Configuração Luz Estimulação Equipment
- Escolha pelo menos uma área de gravação 2,5 x 2,5 m para a realização de experimentos eletrofisiológicos em um quarto que tem ar condicionado com umidade regulamentado e meios para proporcionar condições de gravação escuros. Certifique-se de que esta área é grande o suficiente para caber confortavelmente a: (i) 1 x 1 m mesa de vibração-isolamento que abriga o equipamento [voar estímulo e aparelhos de gravação], lupa e uma fonte de luz fria com dois pescoços de ganso, todos fechados dentro de um grandes> 180 cm de altura gaiola de Faraday; (Ii) um equipamento de rack de 38U para a habitação de um computador pessoal com um monitor LCD de tela plana, amplificador de microeletrodos, drivers de LED, filtros, unidades de controle de temperatura, osciloscópios e outros instrumentos elétricos necessários; e (iii) umpequena mesa e uma cadeira para o investigador.
- Coloque o equipamento longe de fontes de ruído elétricos e mecânicos, tais como refrigeradores, centrífugas e elevadores. Use protetores contra surtos separados para proteger os dispositivos elétricos da plataforma de picos de tensão que ocorrem na rede eléctrica. Idealmente, conectar o equipamento à sua própria fonte de alimentação ininterrupta (UPS bateria) para minimizar o ruído.
- Construir um fly-titular cónica de bronze e plástico preto (Figura 2). Faça um furo pequeno afunilamento através da unidade de bronze com o seu estreitamento aro externo para ~ 0,8 mm de diâmetro (igual a largura do tórax de uma mosca típico).
Nota: Este buraco deve afunilar em direção à ponta do fly-titular da forma que uma maior que a média Drosophila, que é projetada a partir de baixo pelo fluxo de ar, iria ficar na altura dos ombros preso na borda superior. - Projetar e construir um estímulo e aparelhos de gravação mecanicamente robusto e preciso, voar (Figura 3). Construir fora of alumínio ou latão (metais de alta condutividade) uma mosca plataforma preparação pólo e em torno dele um sistema de cardan de braço, com rolamentos de esferas incorporadas, para fornecer suaves e precisas x, y-posicionamento e de bloqueio da luz de estímulo.
Nota: Este projeto composto integrado minimiza as vibrações mecânicas, que de outro modo poderia desalojar a ponta do eletrodo de gravação fora da célula estudada. Ele pode ainda incorporar um sistema de controle de temperatura de circuito fechado baseada em Peltier-elemento, permitindo que os investigadores para usar construções genéticas sensíveis à temperatura, como shibire TS, para avaliar os cálculos de circuitos sinápticos 9,30. Anodize aparelho ou pintar de preto para minimizar estímulo dispersão de luz.- Corrigir a estimulação mosca e aparelhos de gravação na placa de ensaio da mesa de anti-vibração; por exemplo, por M6-parafusos, utilizando os seus furos métricas. Use uma placa de ensaio preto ou cobri-lo com tecido preto para minimizar a dispersão de luz durante as experiências.
- Position e bloqueio (usando um parafuso de bloqueio) uma preparação mosca pólo plataforma ajustável verticalmente no centro de um sistema de Cardan-braço. Coloque o fly-preparação (dentro de fly-titular, consulte o passo 2) no pólo plataforma de modo que a fonte de luz ligado ao Cardan-braço radialmente aponta para a cabeça da mosca. Certifique-se de que o centro dos olhos mosca é exactamente no ponto de intersecção (0, 0) da X- do Cardan-braço e eixos y, como este permite que X precisos, Y-posicionamento do estímulo de luz para qualquer ponto dentro da mosca da campo visual.
Nota: Esta funcionalidade é necessária para mapear as propriedades de resposta das células individuais para locais oculares específicos; por exemplo, ao procurar por evidência eletrofisiológica para adaptações estruturais, tais como zonas claras ou aguda, que mostram aumento da sensibilidade ou a resolução, respectivamente 31.
- Montar o microscópio estereoscópico por trás da estimulação mosca e aparelho de gravação na tabela de anti-vibração de modoque proporciona uma visualização de alta ampliação confortável do olho da mosca.
- Montar a fonte de luz fria no topo do microscópio com guias da fonte de luz dupla cabeça semi-rígidas de pescoço de ganso de luz que aponta para baixo para o suporte da preparação mosca. Livremente móvel dois iluminação feixe torna mais fácil visualizar a ponta do eletrodo de gravação quando dirigi-lo através de uma pequena abertura no olho da mosca.
- Anexar um apropriado x, y, z definida-micromanipulador (grossa e fina) para o eletrodo de registro ea cabeça-estágio na mesa de anti-vibração, no lado direito do aparelho de estimulação mosca e gravação, usando M6-parafusos ou magnético stands.
Nota: No laboratório Juusola, diferentes plataformas estão equipados com diferentes manipuladores; para mais detalhes veja a tabela de materiais e reagentes. Todos estes fornecem gravações intracelulares de alta qualidade. - Montar um pequeno manual micromanipulador de 3 eixos para o titular do eletrodo de referência na f ajustável verticalmentely pólo plataforma de preparação. Orientar o eletrodo de referência de modo a que ele está apontando para a preparação mosca.
- Construir um blindado leve gaiola de Faraday free-standing de aço-painéis torno da mesa de anti-vibração, em torno do aparelho de estimulação mosca e gravação, para evitar interferências electromagnéticas exteriores. Deixar a frente da gaiola aberta, proporcionando um acesso para transportar a preparação mosca para os experimentos. Anexar cortinas pretas de tecido (com cobre-alumínio ou de malha implantados dentro deles para aterramento) na frente para proteger o ruído e luz. Pintar o interior da gaiola preto para minimizar a dispersão de luz e aparafusar os pés da gaiola no chão para evitar vibrações.
- Ligue a tensão e saídas de corrente do circuito de alta impedância amplificador de microeletrodos intracelular para as entradas de dois filtros passa-baixa separados (Bessel ou similares) utilizando BNC cabos. Da mesma forma, conecte as saídas de filtro para os canais apropriados dos blo AD-conectorCKS / tábuas do sistema de aquisição de dados (DA / DA cartões). Conecte o cartão DA / AD (s) em um computador pessoal por cabos especializados, de acordo com os manuais de fornecedores.
- Instalar o software de aquisição apropriado para o sistema de aquisição de dados de escolha no computador pessoal. Certifique-se de que os controladores de aquisição de dados são compatíveis com o sistema operacional no computador pessoal.
- Chão eletricamente a estimulação mosca e aparelhos de gravação, gaiola de Faraday, malha de cobre (dentro das cortinas), microscópio, micromanipuladores, fonte de luz fria, rack de 38U equipamento com todos os seus instrumentos (o amplificador intracelular, os filtros, a unidade de controle de temperatura, PC e monitor LCD etc.) a um único ponto de terra central por meio de fio de aterramento do equipamento e M6 friso extremidades do anel de aterramento. Use um multímetro elétrica para testar se todas as peças estão no mesmo terreno.
Nota: Para obter os melhores possíveis condições de gravação de baixo ruído, as configurações de aterramento normalmente variam from um set-up para o outro.- Se necessário, ligue o ponto de terra central ainda ao piso do edifício, e / ou terra central do amplificador de microeletrodos. Depois de testar o sistema em pleno funcionamento durante experimentos eletrofisiológicos reais, estar preparado para alterar a configuração de ligação à terra, conforme necessário para minimizar o ruído nas gravações.
- Configurar amplificação software (1 - 10x), filtragem de sinais (tipicamente filtros passa-baixa fixada em 500 Hz, que é adequado tanto para dados R1-R6 e LMC), ea taxa de amostragem (pelo menos 1 KHz). Certifique-se de que as definições de obedecer Nyquist-Shannon amostragem teorema 32; por exemplo, quando a aquisição de dados que é de baixo pass-filtrada em 500 Hz, utilizar uma frequência de amostragem de 1 kHz ou superior para minimizar os efeitos de aliasing.
- Como respostas de tensão característicos de fotorreceptores R1-R6 são 40 - 65 mV, e aqueles de LMC 20 - 45 mV, definir a amplificação e visor, para permitir às escalas de alta resolução sampling e visualização de dados.

Figura 2. cónico Fly-holder A mosca-holder é feito de duas peças:. A unidade de bronze central e seu revestimento de plástico preto cônica. O orifício central no interior da unidade de latão se reduz a um diâmetro pequeno que mal permite que o fly through. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3. Visão geral do Rig eletrofisiológica. O set-up contém um blindado leve gaiola free-standing Faraday, a tabela de anti-vibração, o aparelho de estimulação mosca e gravação, e cortinas de tecido preto com cobre-alumínio ou de malha para dentro para aterramento. as inscremalheira trument é eletricamente conectada à mesma terra central com todos os equipamentos dentro da gaiola de Faraday. Por favor clique aqui para ver uma versão maior desta figura.
- fabricação Microeletrodos
- Puxe o microeletrodo referência de borosilicato filamentado (diâmetro externo: 1,0 mm; diâmetro interno de 0,6 mm) ou de vidro de quartzo (diâmetro externo: 1,0 mm; diâmetro interno de 0,5, 0,6 ou 0,7 mm) tubulação usando um instrumento pipeta extrator. Tente conseguir uma pequena vela gradual.
Nota: As configurações exatas do programa pipeta extrator variar de instrumento para instrumento; mais detalhes na Tabela de Materiais e regentes. O tamanho do poro na ponta não é crucial porque a ponta do eléctrodo de referência irá ser quebrado antes de ser inserido na preparação mosca. - Puxe o microeletrodos de gravação a partir de (diâmetro externo de borosilicato filamentado: 1,0 mm; diâmetro interno de 0,6 mm) ou de vidro de quartzo (diâmetro externo: 1,0 mm; diâmetro interno de 0,5, 0,6 ou 0,7 mm) tubulação usando um instrumento pipeta extrator. Tente conseguir um longo (10 - 15 mm) cone bem gradual.
- Inspecione com um microscópio de luz que os eletrodos de registro mostram afilamento correta. Monte o eletrodo em uma lâmina de vidro com cola moldável e usar objetivo ar 40X para inspecionar sua ponta.
Nota: Um bom eletrodo afila suavemente até à sua forma invisível ponta pequena, em torno do qual mais escura paralela contínua e padrões de interferência mais leves podem ser vistos. Algumas configurações do extrator gerar eléctrodos de alta resistência, que não pode produzir penetrações de células bem sucedidos porque suas dicas assemelham "trombetas". Assim, a inspecção visual dos eléctrodos é importante. - Anexar os eletrodos horizontalmente em uma grande placa de Petri com massa de modelar (ou adesivo moldável similar) para a custódia e transporte para o equipamento de eletrofisiologia. Certifique-se de que as pontas dos eléctrodos umestá sempre no ar e não acidentalmente tocar em nada.
- Back-encher os eléctrodos de registo e de referência, pouco antes da experiência com a solução de sal apropriado. Use uma pequena seringa de 5 ml conectado a um filtro de partículas pequeno, com uma ponta de plástico fino (como um microloader).
- Para experimentos de fotorreceptores, encher o eléctrodo de registo até completo (forma-se uma gotícula na sua extremidade mais larga) com 3 M KCl como esta solução minimiza o efeito do potencial de junção líquida à tensão gravado.
- Para investigar os LMCs histaminérgicos, que respondem a entrada sináptica de fotorreceptores R1-R6 por mudanças de cloreto de-condutância, preencha os eletrodos de gravação com 3 M acetato de potássio e KCl 0,5 mM, já que esta solução tem menos efeito sobre a bateria de cloreto da célula. Encha o eléctrodo de referência com a mosca Ringer, contendo em mM: 120 NaCl, 5 KCl, 10 TES (C 6 H 15 NO 6 S), 1,5 CaCl 2, 4 MgCl2, e 30 sacarose 5.
- Testar a resistência de um eléctrodo de registo recentemente puxada no sistema de registo.
- Certifique-se de que os fios de prata dentro do eléctrodo titulares são uniformemente revestido com cloreto de prata (aparecendo roxo-cinza - não brilhante prateado) para minimizar artefatos de gravação (como a deriva no potencial de junção). Se não, substituí-los com cabos devidamente chloridized.
- Se necessário, chloridize novos fios de prata. Limpe cuidadosamente os fios (passando-os rapidamente através de uma chama) para que estes aparecem prata brilhante na cor. Evitar tocar-los com os dedos, de modo a depositar sobre uma camada uniforme de AgCl. Mergulhe os fios em água sanitária força total para 15 - 30 minutos até que eles aparecem de cor roxo-cinza. Alternativamente, galvanizar cada fio (por tornando-positiva com respeito a uma solução contendo 3 M KCl e passagem de uma corrente através dele a uma taxa de 1 mA / cm2 de área de superfície) em 10 - 15 segundos até que adequadamente revestidos.
- Conectar-se a gravação cheia de trás e eletrodos de referência aos seus titulares eletrodo. Coloque banho de solução de uma pequena campainha na plataforma preparação mosca pólo verticalmente ajustável. Conduzir as pontas dos eléctrodos para a solução de Ringer e medir resistência de ponta do eletrodo de registro.
Nota: Esta etapa só é necessária quando testar as propriedades resistivas de eletrodos, que são puxados a partir de um novo lote de tubos de vidro, ou quando otimizar os programas de instrumentos de microeletrodos extrator através de iteração. - Antes de executar as medições de resistência, leia as instruções no manual do usuário do fabricante amplificador para as configurações adequadas de medição. Para um bom eletrodo de registro, têm uma resistência de ponta de ~ 100-220 mohms.
- Puxe o microeletrodo referência de borosilicato filamentado (diâmetro externo: 1,0 mm; diâmetro interno de 0,6 mm) ou de vidro de quartzo (diâmetro externo: 1,0 mm; diâmetro interno de 0,5, 0,6 ou 0,7 mm) tubulação usando um instrumento pipeta extrator. Tente conseguir uma pequena vela gradual.
2. Preparação Drosophila
- Colete 5 - 10 dias moscas idade (após a eclosão) e colocá-los em um tubo limpo mosca contendo stalimentos Andard. É possível conseguir boas gravações da mais jovem voa muito, até mesmo dos "recém-nascidos"; mas por causa dos seus olhos mais suaves, o corte de uma abertura da córnea para o eléctrodo de registo é mais difícil.
- Construir um tubo de captura da mosca e uma preparação mosca pé (Figura 4). Veja a Figura 4 para a idéia geral de como essas ferramentas self-made foram colocados juntos.
- Para fazer um tubo de captura da mosca, cortou a ponta de fundo cónico de 50 ml de tubo de centrífuga de plástico. Em seguida, insira e cole a grande final de 1 ml ponteira sobre esta nova abertura.
- Finalmente, cortar a extremidade pequena pipeta para um tamanho que facilmente permite que uma mosca para percorrer. Consulte um oficina mecânica para montar uma pequena mosca fase de preparação que permite a rotação de 2 eixos e travamento da mosca-suporte para diferentes posições a.

Figure 4. Ferramentas e Devises necessários para tornar a preparação Fly. Voe tubo de captura é feita por meio de colagem a 1 ml ponta de plástico da pipeta para a 50 ml tubo de plástico de centrífuga. Encomenda suporte preparação mosca permite livre de rotação e bloqueio da mosca-titular e de uma posição preferida para a preparação da mosca. A mosca é fixado por cera de abelha, usando a cera-aquecedor elétrico. Vaselina é aplicada por um pequeno aplicador feito conectando um fio de cabelo tipo de espessura em uma alça. Por favor clique aqui para ver uma versão maior desta figura.
- Recolha uma mosca para o experimento em um 1 ml ponteira, que mal permite que uma mosca para passar. Anexar a mosca tubo de captura, com a ponta da pipeta sobre ele, ao tubo de mosca. Na captura uma mosca, tirar proveito de sua tendência inerente para subir para cima (antigravitaxis) na ponta da pipeta. De preferência, escolha a maior do sexo feminino, como o tamanho importas em eletrofisiologia.
Nota: Quanto maior a mosca, quanto maior as suas células e melhor as chances de gravações intracelulares de alta qualidade. moscas menores (machos e fêmeas) podem também proporcionar gravações excelentes, mas a preparação é mais difícil de fazer. Uma vez que a mosca é preso em um grande ponta de pipeta, lembre-se de fechar o tubo mosca para parar outras moscas de escapar. - Ligar uma seringa de 100 ml com um tubo de plástico flexível para a maior abertura da ponta da pipeta - com a mosca ainda nele.
- Coloque a extremidade mais estreita na grande ponta da pipeta, a qual é ampliada para deixar apenas um de Drosophila através de, para a abertura na parte inferior da mosca-titular o e apertar um pequeno volume de ar a partir da seringa para ejectar a voar em mosca-titular o .
- Olhe através do microscópio estereoscópico e gentilmente administrar mais ar até que a cabeça da mosca é saliente da extremidade cónica de fly-titular. Certifique-se de que a mosca está firmemente preso a partir do seu tórax para o pequeno opeNing no topo da mosca-da titular.
- Use um aquecedor de cera para fixar a mosca com cera de abelha de seus "ombros" a mosca-titular. Ajustar a temperatura do aquecedor de cera para ser tão baixa quanto possível de forma limpa ainda derretendo a cera.
Nota: Quando a temperatura está correta, a cera aparece transparente. Muito alto de uma temperatura faz com que a cera "queimar"; muito baixo mantém a dura cera. Ao fixar a mosca, ser precisa e breve como exposição ao calor prolongado pode danificá-lo. Usando cola dental fotopolimerizável não é recomendado aqui como sua aplicação é muito lento.

Figura 5. Preparação da mosca por experimentos in vivo. À esquerda, uma cabeça de Drosophila está posicionada em linha reta na fly-titular da e fixa a partir de sua tromba, olho direito e ombros para fly-titular ser aquecido aeswax. Direita, A pequena abertura é cortada na parte mais grossa do olho, um pouco acima do equador e apenas uma ommatidia poucos longe da cutícula para trás, usando uma borda de lâmina afiada. Um pedaço de córnea é cuidadosamente removida e o furo é vedado com vaselina para evitar o olho de secando. Por favor clique aqui para ver uma versão maior desta figura.
- Imobilizar a cabeça da mosca. Aplicar cera de abelha para a tromba (Figura 5) e no canto do olho direito, evitando a córnea, e fixar a cabeça de um desses pontos para fly-titular.
- Produzir um micro-faca. Fixe uma lâmina de barbear não de aço inoxidável com dois suportes de lâmina / disjuntores (ambos com aperto plana) e crack uma pequena faixa de sua borda afiada. Para a saúde e segurança, usar óculos para proteção dos olhos (mesmo que é altamente improvável que as peças seriam ricochete quando a lâmina estiver rachada). Idealmente,produzir uma borda de lâmina afiada que se assemelha a uma torre. Certifique-se de que esta "agulha" está firmemente ligado à porta-lâmina, mas tenha cuidado para evitar qualquer auto-lesão!
- Usando o micro-faca, preparar um pequeno tamanho da abertura de alguns ommatidia no olho esquerdo da mosca - em cerca de 4-5 ommatidia da cutícula dorsal logo acima do equador do olho para fornecer a passagem para o microeletrodos de gravação. Executar sob um microscópio estereoscópico, vendo a preparação com ampliação elevada.
Nota: Como o olho da mosca se sente elástico e resistente à sondagem, o buraco é melhor corte com um -knife "torre". A técnica de corte é bastante desafiador, então preste muita atenção para a demonstração em vídeo. Mantendo fly-titular e de determinadas linhas de orientação (no stand preparação fly) pode fazer a dissecção mais fácil. Inicialmente, a microcirurgia pode sentir difícil de aprender, mas uma vez comprometida, a adaptação neural melhora gradualmente 3D-percepção e destreza do investigador. - Remove cuidadosamente o pequeno pedaço de córnea a partir da abertura que acabou de ser cortado, expondo a retina por baixo. Rapidamente cobrir o buraco no olho com uma pequena gota de vaselina usando o cabelo fino do aplicador vaselina.
Nota: Vaselina serve múltiplos papéis aqui. Ele evita a desidratação de tecido e coagulação da hemolinfa que iria quebrar o eletrodo de registro inserido. Reveste também Aliás, o microeletrodos, reduzindo sua capacitância intramural. Isto pode melhorar a resposta de frequência do sistema de gravação, e por isso a resolução temporal dos sinais neurais registadas. Evitar manchas de vaselina sobre o resto do olho, pois isso confunde as ópticas.
3. Gravar a partir de R1-R6 fotorreceptores ou LMCs
- Sempre ser aterrado ao operar o amplificador de microeletrodos (por exemplo, tocando na superfície metálica da gaiola de Faraday ou mesa anti-vibração), já que esta se opõe a uma acidentalmente entregaring uma carga estática para a cabeça-stage, o que poderia danificar o circuito.
- Iluminar a plataforma pólo preparação mosca do alto por dois guias de luz pescoço de ganso (Figura 6A) (com a fonte de luz fria dentro da gaiola de Faraday) para que fly-titular da pode ser colocado no pólo na posição preferida sob controle visual de perto .
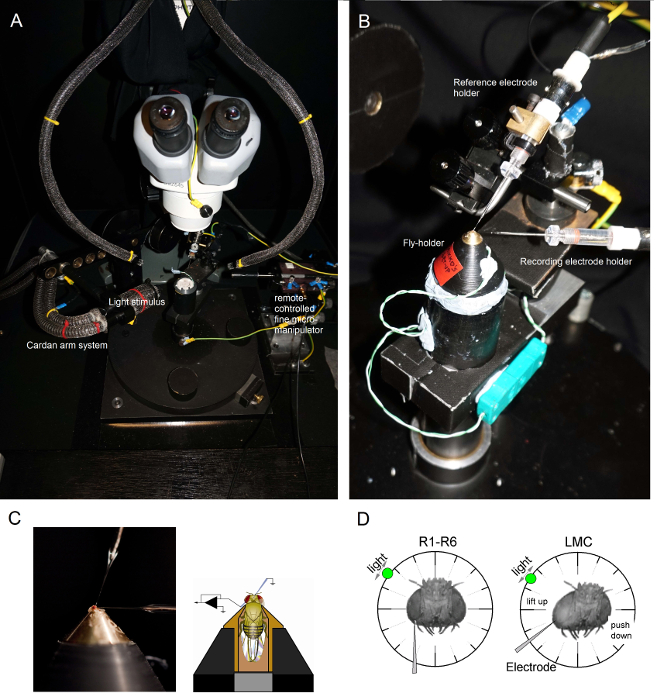
Figura 6. Posicionamento Fly-detentor e as Eletrodos para os Experimentos (AB) A mosca-caixa será colocada na plataforma de gravação que também fornece controle de temperatura através de um elemento Peltier (A: plataforma redonda branca no centro).. A Cardan-braço permite um posicionamento exacto do estímulo da luz a uma distância igual (através de X, Y-rotação) em torno da mosca, com a fonte de luz (uma extremidade de feixe de fibras ópticas de líquidos ou de quartzo) que aponta directamente para o olho. Em muitos dos UOplataformas de r, a estimulação de luz é gerada por LEDs (com correntes-drivers lineares) ou por um monocromador. Assim, seus estímulos levar um conteúdo específico espectral (passou-band), selecionados entre 300-740 nm e cobrir 4-6 log gama unidade de intensidade (como atenuada por filtros de densidade neutra separadas). (C) Dois microeléctrodos, controlado por micromanipuladores separadas, são posicionadas na cabeça mosca: o eléctrodo de referência (acima) através do ocelos; o eléctrodo de registo (esquerda) através da pequena abertura no olho esquerdo. (D) Para a obtenção de um número máximo de gravações de fotorreceptores, o microeléctrodo de gravação é conduzido para o buraco, paralela ao eixo tromba-ocelo. Quando os penetra ponta do eléctrodo e selos para um fotorreceptor, a fonte de luz é fixada pode rodar livremente para a posição em que a célula produz a resposta máxima tensão a um dado estímulo de luz. Este ponto encontra-se no espaço no centro do campo receptivo da célula. Se o i buracos perto da cutícula, penetrações LMC pode ainda ser alcançada com este mesmo ângulo eléctrodo (esquerda). Se o buraco é mais longe da cutícula, um outro ângulo abordagem eletrodo útil para obter gravações LMC também é mostrado (direita). Por favor clique aqui para ver uma versão maior desta figura.
- Montar fly-titular da (com a mosca na mesma!) No pólo mosca plataforma de preparação. Gire fly-titular da forma que o olho esquerdo do fly está enfrentando diretamente o investigador (Figura 6B).
- Insira o eletrodo de referência sem corte suavemente através Occelli da mosca dentro da cápsula cabeça usando uma pequena micromanipulador grossa enquanto observa a preparação através do microscópio estereoscópico (Figura 6C). Não empurre o eletrodo muito profundo, pois isso pode danificar o cérebro da mosca.
- Alternativamente, inserir o eléctrodo de referência para a parte de trás do tórax. Sempre, garantir que a mosca parece vegetação rasteira (move suas antenas) e seus olhos estão intactos; não acidentalmente danificado. Se a preparação parece menos do que imaculado, preparar uma nova mosca para os experimentos.
- Conduzir o microeletrodos de gravação afiada no olho esquerdo através da vaselina coberta pequena abertura preparada anteriormente. Use alta ampliação no microscópio estereoscópico e mover as guias de luz e o plano focal de modo que o local ponta do eletrodo se torna aparente em 3D por seus padrões de reflectância.
Nota: A Figura 6D mostra como cabeça da mosca deve ser posicionado de forma ligeiramente diferente (em relação ao ângulo do microeletrodos de gravação entra no olho) para fotorreceptores e gravações LMC. Conduzir o eletrodo dentro do olho sem quebrá-lo é a fase mais difícil do experimento. Se a ponta do eletrodo perde a pequena abertura no olho, atingindo a córnea, que normalmente rompe. - Ligue o amplificador de microeletrodosuma vez que os dois eléctrodos estão firmemente dentro da preparação, em contacto eléctrico com os fluidos corporais da mosca.
- Desligue a fonte de luz fria (dentro da gaiola de Faraday) e desligue-o da tomada. Conecte seu plug no chão central para minimizar o rés-do-circuito induzida ruído eléctrico, e mover as guias de luz pescoço de ganso afastado para que o sistema Cardan-braço pode ser movido livremente ao redor da mosca. Desligue as luzes da sala para garantir que a preparação mosca está agora em relativa escuridão.
- Meça a resistência do eletrodo de registro no olho (conforme indicado no manual do usuário do amplificador). Use eletrodos única gravação em que a resistência é 100-250 mohms.
Nota: É praticamente impossível conseguir gravações intracelulares de alta qualidade por <70 eletrodo mohms. Se a resistência for <80 mohms, é provável que a extremidade do eléctrodo é quebrado. Neste caso, desligue o amplificador e mudar o eletrodo de registro.- Uma vez que o eléctrodoe é substituído no olho, ligar o amplificador para medir a sua resistência. Por vezes, a ponta do eléctrodo pode tornar-se bloqueado por alguns detritos, uma vez que entra no tecido. Isto pode ser resolvido usando as funções de zumbido capacitivo e pulso de corrente do amplificador que normalmente claro que por ressonância rápida ou repulsão.
- Definir o amplificador à corrente-clamp (CC) ou modo de gravação ponte. Cancelar qualquer diferença de tensão arbitrária entre os eléctrodos de registo e de referência, como ambos estão agora descansando no espaço extracelular eletricamente interligados, definindo o desvio de sinal (tensão de gravação) para zero. Siga o deslocamento de sinal alterações usando leitura de tela do amplificador ou tela de um osciloscópio.
- Espere 2-3 min para o olho da mosca para dark-se adaptar.
- Conduzir a ponta do eletrodo de gravação gradualmente mais profundo no olho com pequenos passos mícron 0,1 a 1. Faça isso com um eixo-x piezo-passo de um micromanipulador ou b por controle remotoy suavemente girando o botão de resolução fina de um manipulador manual.
- Estimular o olho da mosca com um breve (1-10 ms) flashes de luz como o eletrodo de registro está sendo avançado no tecido.
Nota: Se o eléctrodo de registo está posicionado na retina e as funções do olho, normalmente, cada um flash de luz irão provocar uma queda breve e pequena na tensão (0,2-5 mV hiperpolarização), chamado o electrorretinograma (ERG). Esta mudança no potencial de campo do espaço extracelular é causada por resposta colectiva as células da retina 'à luz. No entanto, uma vez que a ponta do eletrodo entra a lâmina, fechando nos LMCs, o ERG inverte, mostrando respostas despolarizantes. - Mover a fonte de luz em torno do olho da mosca, utilizando o sistema de Cardan-braço e a posição onde a luz provoca a maior resposta do ERG.
Nota: Esta posição marca a pequena área no espaço visual onde os fotorreceptores (ou LMC), que estão localizados ao lado da ponta do eléctrodo de registo, Provar a sua entrada de luz. - Penetrar uma célula com o eléctrodo de registo.
Nota: A penetração pode ocorrer espontaneamente, ou quando o eletrodo é micro-se adiantou. Pode ser ainda mais facilitada batendo suavemente o sistema micromanipulador ou usando a função zumbido do amplificador; essas ações ressoar a ponta do eletrodo no tecido. Quando o eletrodo espeta a membrana de fotorreceptores, entrando em seu espaço intracelular, a diferença de tensão entre a gravação e eletrodo de referência cai repentinamente de 0 mV para ~ -65 mV (entre -55 e -75 mV); Considerando que, durante as penetrações LMC, essa queda é tipicamente menor (entre -30 e -50 mV). Estas diferenças de tensão representam os potenciais de repouso das células negativas dadas. Dependendo da qualidade do eléctrodo de registo (a sua nitidez) e o processo celular que penetrou, a leitura da voltagem do eléctrodo de registo pode estabilizar rapidamente ou gradualmente para o potencial de repouso, como a membrana celularvedações para a camada exterior do eléctrodo. Mas se a penetração é apenas parcial ou pobres, o eléctrodo normalmente desliza para fora da célula com o potencial escalar gravado volta para zero. - Localizar o centro do campo receptivo da célula penetrou quando o eletrodo aparece devidamente selado, mostrando o potencial de membrana estável (potencial de repouso escuro). Mova o estímulo luminoso intermitente em torno do olho da mosca, utilizando o sistema de Cardan-braço, para encontrar o ponto no espaço visual, onde o flash de luz evoca resposta tensão máxima da célula. Bloquear a Cardan-braço quando o estímulo luminoso enfrenta diretamente (pontos em) o centro campo receptivo.
Nota: Na escuridão, fotorreceptores Drosophila responder aos pulsos de luz brilhantes com 40 - 65 mV respostas despolarizantes tensão de 4,5, enquanto que gravações LMC estáveis mostrar 20 a 45 respostas hiperpolarizantes mV 9,10,14. penetrações glia pode acontecer raramente, indicado por <-80 mV potenciais de repouso e muito mais lentoe mais pequeno (~ 5 mV) despolarizações induzidas pela luz saturado. Fotorreceptores Drosophila com diferentes pigmentações oculares, tais como white-eye 7 e cinábrio, mostrar tamanhos de resposta ao tipo selvagem. - Usando o modo do amplificador de corrente-clamp (CC), compensar a capacitância do eléctrodo de registo através da injeção de pequena 0,1 nA e breve (100 - 200 ms) pulsos de corrente para dentro da célula estudada para minimizar artefatos de gravação durante o carregamento da membrana.
Nota: Este procedimento importante é explicado em detalhe no manual do utilizador do amplificador, e deve ser praticado com uma célula de modelo eléctrico antes das experiências reais. - respostas de tensão registro a pulsos de luz e outros estímulos de interesse, tendo diferentes qualidades estatísticos ou físicos (como naturalista séries temporais de intensidade de luz ou padrões de contraste aleatórios). Teste, por exemplo, como as respostas gravadas mudar com claras ou escuras-adaptação.
Nota: Pode-se com precisão liluta-se adaptar a célula estudada por luz contínua de intensidade pré-selecionado pela adição de filtros de densidade neutra no caminho da luz 4,5. Alternativamente, para dark-adaptação prolongado desligar o estímulo luminoso durante um tempo pré-definido. Por causa da estabilidade mecânica do sistema de gravação, a qualidade dos eléctrodos de registo e o intacto da preparação, condições de gravação estáveis por vezes pode durar várias horas. Assim, em um dia bom, é possível a recolha de uma grande quantidade de dados em diferentes condições de adaptação por uma única célula. Quando o eléctrodo desliza para fora da célula, as respostas registadas e diminuir a tensão média começa a aproximar-se de zero. - Avançar cuidadosamente o eléctrodo de gravação com a multa de controle do eixo-x do micromanipulador até o eletrodo faz contato e penetra na célula seguinte (este é normalmente o vizinho mais próximo neural). Não mova o eletrodo ao longo do eixo z y ou como estas manobras faria o eletrodo para "plough o tecido "de lado, danificando as estruturas do olho!
Nota: Com um bom eléctrodo e uma preparação saudável, pode-se registar as respostas de alta qualidade a partir de muitas fotorreceptores (mas raramente a partir de muitas LMC) na mesma mosca ao longo de um período de várias horas; Ocasionalmente, durante todo o dia de trabalho (> 8 horas), sem deterioração sinal claro. - Salve arquivos de dados periodicamente com informações de identificação, tais como data, genótipo, e o tipo de célula gravado. Por causa da grande quantidade de dados que podem ser recolhidos em uma sessão de gravação de sucesso, manter bons registros escritos em um laboratório-book para análise de dados futuros.
Resultados
O método de gravação de microeletrodos afiada, tal como adaptado aqui para o olho Drosophila, pode ser usado para quantificar de forma fiável de amostragem neural de informação e processamento nas células da retina e lâmina, e comunicação entre eles 4,5,7,8,10,33. Ao usá-lo para estudar a codificação em diferentes estoques de tipo selvagem, mutantes ou linhagens de moscas geneticamente modificadas, o método tem provado o seu valor; não só para quantificar os efeitos de uma mutação, temperatura, dieta ou de expressão seleccionado 3,4,6,9,10,14,30,34, mas também em revelar razões mecanística para comportamentos visuais alteradas 14,34. O método também é facilmente aplicável a outras preparações de insetos 35,36, capacitando estudos visão neuroetológica. Em seguida nós mostrar alguns exemplos de suas aplicações bem sucedidas.
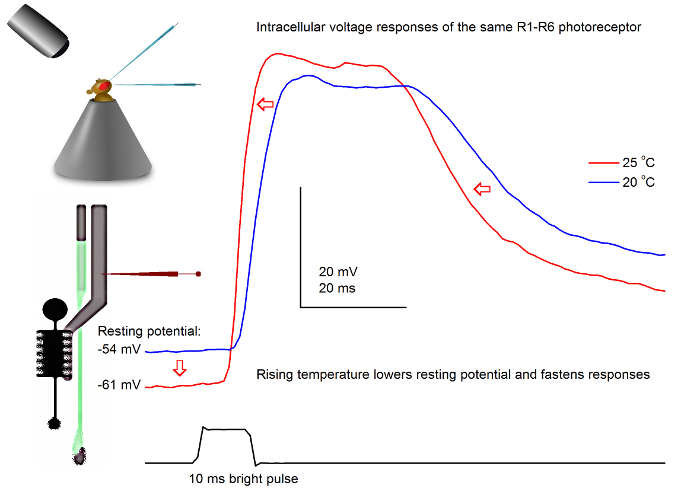
Figura 7. TensãoRespostas de uma mosca da fruta R1-R6 fotorreceptores a um pulso de luz a 20 e 25 ° C. Uma vez que as penetrações microeléctrodo afiadas são, frequentemente, muito estável, é possível gravar as respostas tensão da mesma fotorreceptores R1-R6 a um dado estímulo a luz diferentes temperaturas ambiente pelo aquecimento ou arrefecimento da mosca. Em nossos set-ups, fly-titular da é colocada em um sistema de controle de temperatura de circuito fechado baseada Peltier-element-. Isso nos permite alterar a temperatura da cabeça da mosca em segundos. Temperatura mais elevada acelera as respostas de tensão e caracteristicamente reduz o potencial de repouso de fotorreceptores R1-R6 (como indicado pelas setas vermelhas). Por favor clique aqui para ver uma versão maior desta figura.
Estudando o efeito da temperatura na saída de fotorreceptores
Com um bem concebido e sistema de gravação isolada de vibrações, o método pode ser utilizado para medir o efeito da temperatura na saída de uma célula neural indivíduo por aquecimento ou arrefecimento da mosca. O exemplo dado mostra as respostas de tensão a um pulso de 10 ms de comprimento brilhante, registrados no mesmo fotorreceptor R1-R6 em 20 e 25 o C (Figura 7). Quantificada antes de 4,9, o aquecimento reduz potencial de repouso de um fotorreceptor na escuridão, e acelera as respostas de tensão.
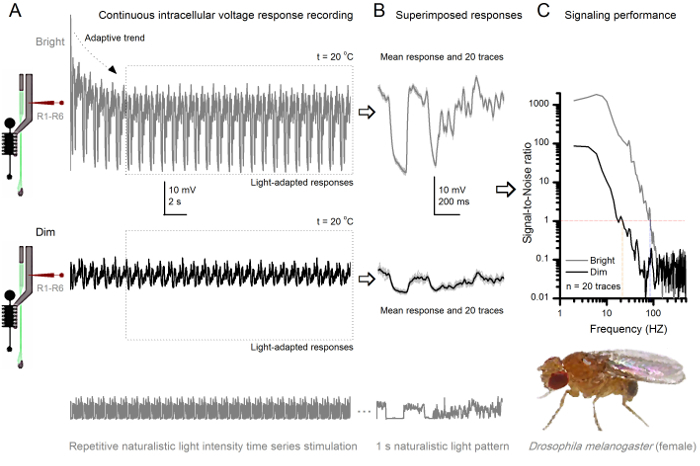
Figura 8. Desempenho sinalizando uma Fruit Fly R1-R6 fotorreceptores melhora com a intensidade de luz (A) a saída de fotorreceptores para escurecer (abaixo) e brilhantes. (Acima; 10.000 vezes uma luz mais brilhante) repetiu naturalista séries temporais de intensidade de luz registado pela mesma microeletrodosna mesma célula a 20 ° C. As respostas ao estímulo luminoso são maiores, porque integram mais amostras, respostas elementares (solavancos) para fótons individuais 4,5,7,8. (B) 20 respostas tensão de um segundo de duração consecutivos são sobrepostos. As respostas individuais (cinza claro) foram tomadas após as tendências adaptativas (seta em A) tinha diminuído (caixa pontilhada em A). Os meios de resposta correspondente (os sinais) são os vestígios mais escuras. A diferença entre o sinal e as respostas individuais é o ruído. (C) As células 'desempenho sinalização foi quantificada pelas gravações de' relações sinal-ruído (SNR) usando os métodos padrão 4,5,7,8. Saída de fotorreceptores tem cerca de 64 Hz mais ampla gama de sinalização de confiança no estímulo luminoso ( '≥1 brilhante, até 84 Hz do que no dim (SNR SNR)' Dim ≥1, até 20 Hz), com signal-to-noise ratio melhorando consideravelmente; de SNR Dim MAX = 87 a SNR brilhante MAX = 1.868. Por favor clique aqui para ver uma versão maior desta figura.
Estudar Adaptação e codificação neural por repetitivo Estimulação
O noninvasiveness do método, causando relativamente pouco dano nas estruturas da retina e da lâmina, faz com que seja ideal para estudar o desempenho de sinalização de células individuais a diferentes estímulos luminosos no seu próximo estado fisiológico natural in vivo. A Figura 8 mostra respostas de tensão de um R1- R6 fotorreceptor a um repetido naturalista série estímulo luminoso tempo de intensidade fraca e brilhante a 20 ° C, enquanto que a Figura 9 mostra as respostas de outro fotorreceptor R1-R6 e uma LMC a um estímulo naturalista diferente a 25 o C. As gravações pré e pós-sinápticos foram realizadas separadamente a partir de duas moscas diferentes, porque as gravações intracelulares simultâneos entre dois microeletrodos afiada na mesma mosca, um na retina e o outro na lâmina, são muito difíceis de ser viável 30.
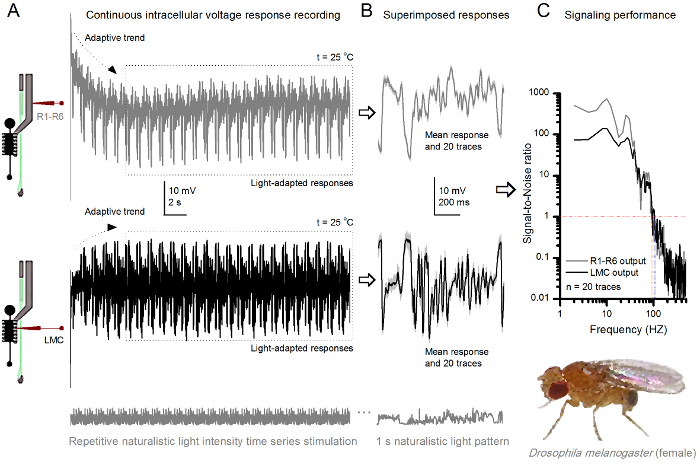
Figura 9. Respostas tensão de uma mosca de fruto R1-R6 fotorreceptores e LMC à Estimulação naturalista repetida a 25 o C. (A) R1-R6 (cinza) e LMC (preto) Saídas gravada por diferentes microeletrodos de diferentes moscas. (B) 20 totalmente pré-luz adaptado consecutivo (acima) e pós-sinápticos (abaixo) as respostas ao mesmo padrão de estímulo naturalista com respostas individuais, mostrado em cinzento claro de umd os correspondentes meios de resposta (os sinais) como os traços mais escuros. A diferença entre o sinal e as respostas individuais é o ruído. (C) As células 'desempenho sinalização foi quantificada pelas gravações de' relações sinal-ruído (SNR). Saída LMC tem cerca de 10 Hz mais ampla gama de sinalização confiável (SNR 'LMC ≥1, até 104 Hz) do que a produção R1-R6 (SNR' R ≥1, até 94 Hz). Ambos os rácios de sinal-para-ruído são elevados (SNR LMC MAX = 142, SNR R MAX = 752), e como o ruído de gravação era baixa, as suas diferenças refletem diferenças de codificação reais entre as células. Por favor clique aqui para ver uma versão maior esta figura.
Após o início do estímulo, as gravações típicoly mostrar rápida adaptação tendências que em grande parte desaparecem dentro de 5-6 seg. A partir de então, as células produzem respostas altamente consistentes para cada apresentação longa estímulo 1 segundo (cada caixa pontilhada inclui 20 destes). A reprodutibilidade das medidas torna-se óbvio quando estes são sobrepostos (Figura 8B e Figura 9B). As respostas individuais são os traços cinzas finas, e sua significa o traço mais escura mais grosso. A resposta média é tomada como o sinal neuronal, ao passo que o ruído neural é a diferença entre a média e cada resposta individual 4,5,9,37,38. As respectivas relações sinal-para-ruído no domínio da frequência (Figura 8C e Figura 9C) foram obtidos por Fourier-transformar os fragmentos de dados de sinal e de ruído na espectros de potência, e dividindo-se o espectro de potência do sinal significativo com o correspondente espectro de potência média de ruído 4, 5,9,37,38. Caracteristicamente, as proporções máximas de sinal-para-ruído óf as saídas neurais registados para estimulação naturalista são elevadas (100 - 1000), e nas preparações mais estáveis com muito baixo ruído de gravação pode atingir valores >> 1000 (por exemplo, Figura 8C.). Observe também que o aquecimento expande as células "largura de banda de confiança sinalização 4 (SNR 'brilhante ≥ 1); por exemplo, a diferença relativa entre os dois R1-R6s nas Figuras 8 e 9, respectivamente, é de 10 Hz (84 a 20 o C e 94 Hz a 25 o C).
Pode-se estimar a taxa de mais de cada célula de transferência de informação a partir da sua relação sinal-ruído através da utilização da equação de Shannon 32, ou através do cálculo da diferença entre as taxas de entropia entropia e de ruído das respostas através do método de extrapolação triplo 39. Mais detalhes sobre as informações de análises teóricas, e seu uso e limitaçõess especificamente com este método são apresentados nas publicações anteriores 7,8,39.
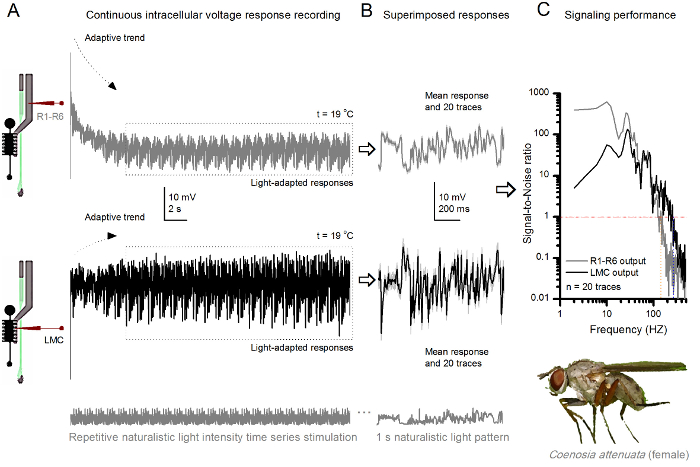
Figura 10. Respostas tensão de uma mosca assassina R1-R6 fotorreceptores e LMC à Estimulação naturalista repetida a 19 o C. (A) R1-R6 (cinza) e LMC (preto) envia registado pela mesma microeletrodos da mesma mosca; primeira pós-sinapticamente e, posteriormente, pré-sináptico, como eletrodo foi avançado no olho. (B) 20 pré consecutiva (acima) e pós-sinápticos (abaixo) as respostas (traços cinza claro) para o mesmo padrão de estímulo naturalista foram capturados após a adaptação inicial (caixa pontilhada em A). Seus meios são os sinais (os traços mais escuros no topo), enquanto as suas respectivas diferenças para as respostas individuais dão o barulho. (C) O correspondente SignaRácios l-a-ruído (SNR) foram calculados como nas Figuras 8C e 9C. Saída LMC tem cerca de uma faixa de 100 Hz mais amplo de sinalização confiável (SNR 'LMC MAX ≥1, até 234 Hz) do que a produção R1-R6 (SNR' R MAX ≥1, até 134 Hz). Ambos os rácios de sinal-para-ruído são elevados (SNR LMC MAX = 137, SNR R MAX = 627), e como o mesmo microeletrodos foi utilizado nas gravações, suas diferenças refletem diferenças reais nas saídas pré e pós-sinápticos neurais. Estes resultados implicam que o sistema de gravação tinha baixo nível de ruído, e sua influência sobre as análises foi marginal. Por favor clique aqui para ver uma versão maior desta figura.
Estudos Visão neuroetológica
O método também pode ser utilizado para registar as respostas pré- e pós-sinápticos de tensão dos olhos compostos de diferentes espécies de insectos 7,8,35,36 (Figura 10), que permite estudos comparativos neuroetológica de processamento de informações visuais. Para o sistema de gravação apresentada, a única adaptação necessária é de preparação titulares novos, cada um com uma abertura de dimensões adequadas para as espécies estudadas. Estas gravações exemplares são provenientes de um assassino fêmea de mosca (Coenosia attenuata). Eles mostram respostas intracelulares de tensão de um fotorreceptor R1-R6 e LMC à estimulação repetitiva de luz idêntica, tal como se utiliza para os homólogos de Drosophila na Figura 9, mas a 19 o C. Neste caso, tanto o pré- e pós-sinápticos, os dados foram registados a partir do mesmo mosca; uma após a outra, com o mesmo eléctrodo de registo (cheia com 3 M KCl) primeiro avançando através da lâmina lateral, antes de entrarção da retina frontal. Em comparação com os dados de Drosophila a 25 ° C, os dados Coenosia - até à temperatura de refrigerador - mostra as respostas com dinâmica mais rápidos; expandir a gama de sinalização fiável (relação sinal-ruído >> 1) ao longo de uma gama de frequência mais ampla. Essas adaptações funcionais na codificação neural de estímulos naturalistas são consistentes com estilo de vida predatório 's Coenosia 36, que exigem alta precisão informações espaço-temporal para alcançar rápidos comportamentos caça aérea.
Discussão
We have presented the basic key steps of how to use sharp conventional microelectrodes to record intracellular responses of R1-R6 photoreceptors and LMCs in intact fly eyes. This method has been optimized, together with bespoke hardware and software tools, over the last 18 years to provide high-quality long-lasting recordings to answer a wide range of experimental questions. By investing time and resources to construct robust and precise experimental set-ups, and to produce microelectrodes with favorable electrical properties, high-quality recordings can become the norm in any laboratory working on Drosophila visual neurophysiology. Whilst well-designed recording and light stimulation systems are important for swift execution of different experimental paradigms, there are three procedural steps that are even more critical to achieving successful recordings: (i) to make the fly preparation with minimal eye damage, (ii) to pull microelectrodes with the right electrical properties, and (iii) to drive the recording electrode into the eye without breaking its tip. Ultimately, to record meaningful data, the investigator has to understand the physical basis of electrophysiology and how to fabricate suitable microelectrodes for the targeted cell-types.
Therefore, the limitations of this technique are primarily set by the patience, experience and technical ability of the investigator. Because this technique can take a long time to master for small Drosophila cells, it is advisable for trainee electrophysiologists to first practice with larger insect eyes, such as the blowfly36 or locust35, using the same rig. Once performing high-quality intracellular recordings from the larger photoreceptors and interneurons becomes routine, it is time to move on to the Drosophila eye. Another limitation of the technique concerns cellular identification. Penetrated Drosophila cells can be loaded electrophoretically with dyes, including Lucifer yellow or neurobiotin. However, because of the small tip size of the microelectrodes, electrophoresis works less efficiently than with lower resistance electrodes, such as patch-electrodes. Furthermore, the dye-filled microelectrodes characteristically have less favorable electrical properties, making it much harder to record high-quality responses with them from Drosophila photoreceptors and LMCs.
A technical problem that occurs sometimes is unstable input signal, or a complete lack of it. This is often associated with the voltage signal being either constantly drifting or higher/lower than the amplifier's recording range. On most occasions, this behavior is caused by the recording electrode being blocked (or its tip being too fine - having too high a resistance or intramural capacitance - to properly conduct fast signal changes). Although one can try to unblock the tip by buzzing the electrode capacitance, which sometimes works, often the situation is best resolved by simply changing the recording electrode. This may further require parameter adjustments in the microelectrode puller instrument to lower the tip resistance of the new electrodes. The electrode tip can also become blocked in preparations, for which it took too much time to cover the corneal hole by petroleum jelly. Prolonged air-contact can dry up the freshly exposed retinal tissue, turning its surface layer into a glue-like substance. If this is the case, the investigator typically sees a red blob of tissue stuck on the recording electrode when pulling it out of the eye. The only solution here is to make a new preparation. Petroleum jelly may provide many benefits for electrophysiological recordings: (i) it prevents the coagulation of the hemolymph that could break the electrode tip; (ii) it coats the electrode tip reducing its intramural capacitance, which lowers the electrode's time constant, and thus has the potential to improve the temporal resolution of the recorded neural signals40,41; (iii) it keeps the electrode tip clean, facilitating penetrations; and after penetration, (iv) it may even help to seal the electrode tip to the cell membrane42.
The signal can further be unstable or lost when the silver-chloride wire of the electrode-holder is broken or dechloridized; in which case just replace or rechloridize the old wire. The missing signal can also result from one (or both) of the electrode-holders not being securely connected to their jacks. However, it is extremely unusual that a piece of equipment would be malfunctioning. If signal is undetectable and all other possibilities have been exhausted, test that each part of the recording apparatus, including the headstage, amplifier, low-pass filters and AD/DA-converters, are connected properly and functioning normally. One way to achieve this is to replace each instrument with another from a rig that is known to operate normally. Alternatively, use a signal generator to check the performance of the electronic components one by one.
But perhaps the most common technical problem facing the electrophysiologist is that of recording noise. Broadly, recording noise is the observed electrical activity other than the direct neuronal response to a given stimulus. Because the fly preparation, when properly done, is very stable, the observed noise (beyond the natural variably of the responses) most often results from ground-loops in the recording equipment, or is picked up from nearby electrical devices. Such noise is typically 50/60 Hz mains hum and its harmonics; but sometimes composed of more complex waveforms. To work out the origin of the noise, remove the fly preparation holder from the set-up, connect the recording and reference electrodes through a drop of fly Ringer (or place them in a small Ringer's solution bath; see step 1.2.6) and record the signal in CC- or bridge-mode. If noise is observable on the recorded signal, this likely means that the noise is external to the fly preparation.
Another good test for identifying the origin of noise is to replace the electrode-holders with an electric cell model connected to the amplifier. In an ideally configured and grounded set-up, the recorded signal should now be practically noise-free, showing only stochastic bit-noise from the AD-converter (in the best case not even that!). If noise is still present, then recheck that all rig equipment is properly grounded. A convenient approach to detect ground-loops is to: (i) disconnect all the grounding wires from all the parts within the rig; (ii) ensure that, after doing this, every single part is actually isolated from ground, by means of an ohm-meter; (iii) connect the parts, one by one, to the central ground directly, not through any other part of the rig. Try also changing the equipment configurations. For example, sometimes moving the computer and monitor further away from the rig can reduce noise; yet at other times, moving the computer inside the equipment rack reduces noise. It is also worth unplugging nearby equipment to see if noise is reduced, or shield additional components. Furthermore, try unplugging or replacing different components of the recording equipment, especially BNC cables (which can have faulty ground connections). If only bit-noise is observed when using the cell model, the initial noise source is either the electrodes or the fly preparation itself. For example, it could be that the reference electrode is inadvertently touching a motor nerve or active muscle fibers inside the head capsule (or disturbing flight muscles in the thorax - if placed there). It is usually simplest to prepare a new fly for recording, taking care to minimize damage to the fly. But if the noise persists and is broadband, it is likely that the electrodes are suboptimal for the experiments; too sharp/fine (hence too noisy) or just wrong for the purpose; we have even seen quartz-electrodes acting as antennas - picking up faint broadcasting signals! Although iteration of the puller-instrument parameter settings to generate the just right microelectrodes for consistent high-quality recordings from specific cell-types can take a lot of effort, it is worth it. Once the recording electrodes are well-tailored for the experiments, they can provide long-lasting recordings of outstanding quality.
Sharp microelectrode recording techniques can be similarly applied to study neural information processing in multitude of preparations, including different processing layers in the insect eyes and brain43,44. Because the microelectrode tips can be made very fine, these typically damage the studied cells less than most patch-clamp applications. Importantly, the modern sample-and-hold microelectrode amplifiers enable good control of the tips' electrical properties40,45-47. Thus, when correctly applied, this technique can provide reliable data from both in vivo3,5,7-10,44 or in vitro48 preparations with high signal-to-noise ratio at sub-millisecond resolution. Such precision would be impossible with today's optical imaging techniques, which are noisier and slower. Moreover, the method can be used to characterize small cells' electrical membrane properties both in current- and voltage-clamp configurations5,29,33,36,40-42,49, providing valuable data for biophysical and empirical modeling approaches7,8,11,33,49-54 that link experiments to theory.
Divulgações
The authors have nothing to disclose
Agradecimentos
The authors thank Mick Swann, Chris Askham and Martin Gautrey for their important contributions in designing and building many electrical and mechanical components of the rigs. MJ's current research is supported by the Biotechnology and Biological Sciences Research Council (BBSRC Grant: BB/M009564/1), the State Key Laboratory of Cognitive Neuroscience and Learning open research fund (China), High-End Foreign Expert Grant (China), Jane and Aatos Erkko Foundation Fellowship (Finland), and the Leverhulme Trust grant (RPG-2012-567).
Materiais
| Name | Company | Catalog Number | Comments |
| Stereo Zoom Microscope for making the fly preparation | Olympus | SZX12 DFPLFL1.6x PF eyepieces: WHN30x-H/22 | Capable of ~150X magnification with long working distance; bespoke heavy steel table mount stand |
| Stereomicroscope in the intracellular set-up | · Olympus | Olympus SZX7; eyepieces: WHN30x-H/22 | 30X eyepieces are needed for seeing the electrode tip reflections well when driving it through the small corneal hole into the eye |
| Nikon microscope | Nikon SMZ645; eyepieces: C-W30x/7 | ||
| Anti-vibration Table | Melles Griot | With metric M6 holes on the breadboard | Our bespoke rigs have a large hole drilled through the thick breadboard that lets in the fly preparation platform pole (houses a copper heatsink with electronics) from below |
| Newport | |||
| Micromanipulators | Narishige | Narishige NMN-21 | In our intracellular set-ups, different micromanipulator systems are used for driving the shap recording electrodes into the fly eye. All the listed manipulators are succesfully providing long-lasting stable recordings from Drosophila photoreceptors and LMCs. |
| Huxley Bertram | Huxley xyz-axis with fine manual control | ||
| Sensapex | Sensapex triple axis | ||
| Märzhäuser | Märzhäuser DC-3K with additional x-axis piezo stepper and MS 314 controller | ||
| Magnetic Stands | Any magnetic base with on/off switch will do | For example, to manage cables inside the Faraday cage | |
| Electrode Holders | Harvard Apparatus | ESP/W-F10N | |
| Silver Wire | World Precision Instruments | AGW1510 | 0.3 - 0.5 mm diameter; needs to be chloridized for the electrode holders |
| Fiber Optic Light Source | Many different, including Olympus | ||
| Fiber Optic Bundles | UltraFine Technology | To deliver the LED light stimulus to the Cardan arm system. We use both liquid and quartz light guides (range from UV to IR) | |
| Thorn Labs | |||
| Fly Cathing Tube | P80-50P 50ml Cent. Tube PP., Pack of 100 Pcs | Cut the conical bottom off from 50 ml Plastic Centrifuge Tube and glue a 1 ml pipette tip on it. | |
| Digital Acquisition System | National Instruments | ||
| Single-electrode current/voltage-clamp microelectrode amplifier | npi SEC-10LX | http://www.npielectronic.de/products/amplifiers/sec-single-electrode-clamp/sec-10lx.html | Outstanding performer! |
| Head-stage | Standard (+/- 150 nA) | For npi SEC-10LX | |
| LED light sources and drivers | 2-channel OptoLED (Cairn Research Ltd., UK) | Many of our stimulus systems are in-house built | |
| Self-designed and constructed | |||
| Acquisition and Analyses Software | Many companies to choose from | Biosyst; custom written Matlab-based system for experimental and theoretical work in the Juusola laboratory | |
| Personal Computer or Mac | Ensure that PC or Mac is compatible with data acquisition system and software | ||
| Cardan arm system | Self-designed and constructed | Providing accurate x,y,z-positioning of the light stimuli | |
| Peltier temperature control system | Self-designed and constructed | ||
| Faraday Cage | Self-constructed | Electromagnetic noise shielding | |
| Filamented Borosilicate Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Filamented Quartz Glass Capillaries | Outer diameter: 1 mm | ||
| Inner diameter: 0.5 - 0.7 mm | |||
| Pipette Puller | Sutter Instrument Company | Model P-2000 laser Flaming/Brown Micropipette Puller | For borosilicate reference electrodes, use the preset program #11 (patch electrodes): Heat = 350; Filament = 4; Velocity 36; Delay = 200).1.2.1). For borosilicate recording electrodes, use the preset program #12 (this typically pulls good conventional sharps for photoreceptor recordings): Heat = 355; Filament = 4; Velocity 50; Delay = 225; Pull = 150. For LMC recordings, which require electrodes with finer tips, these values need to be adjusted. For pulling quartz capillaries, P-2000 manual suggests programs for fine tipped microelectrodes. These programs’ preset parameters serve as useful starting points for systematic modifications to generate electrodes with good penetration success and low recording noise. |
| Extracellular Ringer Solution for the reference electrode | Chemicals from Fisher Scientific | 10326390, NaCl 10010310, KCl 10147753, TES 10161800, CaCl2 10159872, MgCl2 10000430, sucrose | See the recipe in the protocol section |
| 3 M KCl solution for filling the filamented recording microelectrode | Salts from Fisher Scientific | 10010310, KCl | |
| Petroleum jelly | Vaselin | ||
| Non-stainless steel razor blades | |||
| Blade holder/breaker | Fine Science Tools By Dumont | 10053-09 | 9 cm |
| Blu-tack | Bostik | Alternatively, use molding clay | |
| Forceps | Fine Science Tools By Dumont | 11252-00 | #5SF (super-fine tips) |
Referências
- Meinertzhagen, I. A., O'Neil, S. D. Synaptic Organization of Columnar Elements in the Lamina of the Wild-Type in Drosophila-Melanogaster. J Comp Neurol. 305, 232-263 (1991).
- Rivera-Alba, M., et al. Wiring Economy and Volume Exclusion Determine Neuronal Placement in the Drosophila Brain. Curr Biol. 21, 2000-2005 (2011).
- Abou Tayoun, A. N., et al. The Drosophila SK Channel (dSK) Contributes to Photoreceptor Performance by Mediating Sensitivity Control at the First Visual Network. J Neurosci. 31, 13897-13910 (2011).
- Juusola, M., Hardie, R. C. Light adaptation in Drosphila photoreceptors: II. Rising temperature increases the bandwidth of reliable signaling. J Gen Physiol. 117, 27-41 (2001).
- Juusola, M., Hardie, R. C. Light adaptation in Drosophila photoreceptors: I. Response dynamics and signaling efficiency at 25 degrees. C. J Gen Physiol. 117, 3-25 (2001).
- Pantazis, A., et al. Distinct roles for two histamine receptors (hclA and hclB) at the Drosophila photoreceptor synapse. J Neurosci. 28, 7250-7259 (2008).
- Song, Z., Juusola, M. Refractory sampling links efficiency and costs of sensory encoding to stimulus statistics. J Neurosci. 34, 7216-7237 (2014).
- Song, Z., et al. Stochastic, Adaptive Sampling of Information by Microvilli in Fly Photoreceptors. Curr Biol. 22, 1371-1380 (2012).
- Zheng, L., et al. Feedback network controls photoreceptor output at the layer of first visual synapses in Drosophila. J Gen Physiol. 127, 495-510 (2006).
- Zheng, L., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye I Dynamics. Plos One. 4, (2009).
- Hardie, R. C., Juusola, M. Phototransduction in Drosophila. Curr opin neurobiol. 34, 37-45 (2015).
- Clandinin, T. R., Zipursky, S. L. Making connections in the fly visual system. Neuron. 35, 827-841 (2002).
- Wernet, M. F., et al. Homothorax switches function of Drosophila photoreceptors from color to polarized light sensors. Cell. 115, 267-279 (2003).
- Wardill, T. J., et al. Multiple Spectral Inputs Improve Motion Discrimination in the Drosophila Visual System. Science. 336, 925-931 (2012).
- Hardie, R. C. Progress in Sensory Physiology. Ottoson, D. 5, Springer. 1-79 (1985).
- Borst, A. Drosophila's View on Insect Vision. Curr Biol. 19, 36-47 (2009).
- Kirschfeld, K. Die Projektion Der Optischen Umwelt Auf Das Raster Der Rhabdomere Im Komplexauge Von Musca. Exp Brain Res. 3, 248-270 (1967).
- Morante, J., Desplan, C. Photoreceptor axons play hide and seek. Nat Neurosci. 8, 401-402 (2005).
- Fischbach, K. F., Hiesinger, P. R. Optic lobe development. Adv Exp Med Biol. 628, 115-136 (2008).
- Shaw, S. R. Early Visual Processing in Insects. J Exp Biol. 112, 225-251 (1984).
- Joesch, M., Schnell, B., Raghu, S. V., Reiff, D. F., Borst, A. ON and OFF pathways in Drosophila motion vision. Nature. 468, 300-304 (2010).
- Clark, D. A., Bursztyn, L., Horowitz, M. A., Schnitzer, M. J., Clandinin, T. R. Defining the Computational Structure of the Motion Detector in Drosophila. Neuron. 70, 1165-1177 (2011).
- Rister, J., et al. Dissection of the peripheral motion channel in the visual system of Drosophila melanogaster. Neuron. 56, 155-170 (2007).
- Vogt, N., Desplan, C. The first steps in Drosophila motion detection. Neuron. 56, 5-7 (2007).
- Strausfeld, N. J., Braitenberg, V. Compound Eye of Fly (Musca-Domestica) - Connections between Cartridges of Lamina Ganglionaris. Z Vergl Physiol. 70, 95-104 (1970).
- Strausfeld, N. J., Campos-Ortega, J. L4-Monopolar Neuron - Substrate for Lateral Interaction in Visual System of Fly Musca-Domestica (L). Brain Res. 59, 97-117 (1973).
- Takemura, S. Y., et al. Cholinergic Circuits Integrate Neighboring Visual Signals in a Drosophila Motion Detection Pathway. Curr Biol. 21, 2077-2084 (2011).
- Shaw, S. R., Frohlich, A., Meinertzhagen, I. A. Direct Connections between the R7/8 and R1-6 Photoreceptor Subsystems in the Dipteran Visual-System. Cell Tissue Res. 257, 295-302 (1989).
- Wolfram, V., Juusola, M. Impact of rearing conditions and short-term light exposure on signaling performance in Drosophila photoreceptors. J Neurophysiol. 92, 1918-1927 (2004).
- Nikolaev, A., et al. Network Adaptation Improves Temporal Representation of Naturalistic Stimuli in Drosophila Eye II Mechanisms. Plos One. 4, (2009).
- Land, M. F. Compound eye structure: Matching eye to environment. Adaptive Mechanisms in the Ecology of Vision. , Springer. Netherlands. (1999).
- Shannon, C. E. A Mathematical Theory of Communication. At&T Tech J. 27, 379-423 (1948).
- Niven, J. E., et al. The contribution of Shaker K+ channels to the information capacity of Drosophila photoreceptors. Nature. 421, 630-634 (2003).
- Randall, A. S., et al. Speed and sensitivity of phototransduction in Drosophila depend on degree of saturation of membrane phospholipids. J Neurosci. 35, 2731-2746 (2015).
- Faivre, O., Juusola, M. Visual Coding in Locust Photoreceptors. Plos One. 3, e2173(2008).
- Gonzalez-Bellido, P. T., Wardill, T. J., Juusola, M. Compound eyes and retinal information processing in miniature dipteran species match their specific ecological demands. P Natl Acad Sci USA. 108, 4224-4229 (2011).
- Juusola, M., Kouvalainen, E., Järvilehto, M., Weckström, M. Contrast Gain, Signal-to-Noise Ratio, and Linearity in Light-Adapted Blowfly Photoreceptors. J Gen Physiol. 104, 593-621 (1994).
- Juusola, M., Uusitalo, R. O., Weckstrom, M. Transfer of Graded Potentials at the Photoreceptor Interneuron Synapse. J Gen Physiol. 105, 117-148 (1995).
- Juusola, M., de Polavieja, G. G. The rate of information transfer of naturalistic stimulation by graded potentials. J Gen Physiol. 122, 191-206 (2003).
- Weckstrom, M., Kouvalainen, E., Juusola, M. Measurement of Cell Impedance in Frequency-Domain Using Discontinuous Current Clamp and White-Noise-Modulated Current Injection. Pflug Arch Eur J Phy. 421, 469-472 (1992).
- Juusola, M. Measuring Complex Admittance and Receptor Current by Single Electrode Voltage-Clamp. J Neurosci Meth. 53, 1-6 (1994).
- Juusola, M., Seyfarth, E. A., French, A. S. Rapid coating of glass-capillary microelectrodes for single-electrode voltage-clamp. J Neurosci Meth. 71, 199-204 (1997).
- Haag, J., Borst, A. Neural mechanism underlying complex receptive field properties of motion-sensitive interneurons. Nat Neurosci. 7, 628-634 (2004).
- Rien, D., Kern, R., Kurtz, R. Synaptic transmission of graded membrane potential changes and spikes between identified visual interneurons. Eur J Neurosci. 34, 705-716 (2011).
- Muller, A., et al. Switched single-electrode voltage-clamp amplifiers allow precise measurement of gap junction conductance. Am J Physiol-Cell Ph. 276, C980-C987 (1999).
- Polder, H. R., Swandulla, D., Konnerth, A., Lux, H. D. An Improved, High-Current Single Electrode Current Voltage Clamp System. Pflug Arch Eur J Phy. 402, R35-R35 (1984).
- Richter, D. W., Pierrefiche, O., Lalley, P. M., Polder, H. R. Voltage-clamp analysis of neurons within deep layers of the brain. J Neurosci Meth. 67, 121-131 (1996).
- Juusola, M., French, A. S. The efficiency of sensory information coding by mechanoreceptor neurons. Neuron. 18, 959-968 (1997).
- Vähäsöyrinki, M., Niven, J. E., Hardie, R. C., Weckström, M., Juusola, M. Robustness of neural coding in Drosophila photoreceptors in the absence of slow delayed rectifier K+ channels. J Neurosci. 26, 2652-2660 (2006).
- Friederich, U., Coca, D., Billings, S., Juusola, M. Data Modelling for Analysis of Adaptive Changes in Fly Photoreceptors. Lect Notes Comput Sc. 5863, 34-48 (2009).
- Asyali, M. H., Juusola, M. Use of Meixner functions in estimation of Volterra kernels of nonlinear systems with delay. Ieee T Bio-Med Eng. 52, 229-237 (2005).
- French, A. S., et al. The Dynamic Nonlinear Behavior of Fly Photoreceptors Evoked by a Wide-Range of Light Intensities. Biophys J. 65, 832-839 (1993).
- Juusola, M., French, A. S. Visual acuity for moving objects in first- and second-order neurons of the fly compound eye. J Neurophysiol. 77, 1487-1495 (1997).
- Juusola, M., Weckstrom, M., Uusitalo, R. O., Korenberg, M. J., French, A. S. Nonlinear models of the first synapse in the light-adapted fly retina. J Neurophysiol. 74, 2538-2547 (1995).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados