É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Implementação de um sistema coerente Anti-Stokes Raman Scattering (CARS) em Ti: Safira e OPO Laser Based Laser Standard Scanning Microscope
Neste Artigo
Resumo
Coherent dispersão anti-Stokes Raman (CARS) Microscopia baseado em vibração inerente de títulos molécula permite imagens de células vivas quimicamente seletiva sem rótulo. Este trabalho apresenta a implementação de uma técnica de microscopia complementar sobre um microscópio de varredura a laser padrão multiphoton baseado em um Ti femtosecond: laser de safira e um laser OPO.
Resumo
microscópios de varredura a laser, combinando a Ti femtosecond: laser de safira e uma óptica oscilador paramétrico (OPO) para duplicar a linha de laser tornaram-se disponíveis para os biólogos. Estes sistemas são projetados principalmente para a microscopia de fluorescência de dois fotões multi-canal. No entanto, sem qualquer modificação, microscopia óptica não-linear complementar, como segundo harmônico geração (SHG) ou terceira geração harmônica (THG) também pode ser realizada com este set-up, permitindo que imagens sem rótulo de moléculas estruturados ou médio aquosa interfaces de lípidos. Estas técnicas são bem adequados para a observação in vivo, mas estão limitados na especificidade química. Quimicamente imagiologia selectivo pode ser obtido a partir de sinais de vibração inerentes com base na dispersão de Raman. A microscopia confocal Raman fornece resolução espacial 3D, mas requer alta potência média e tempo de aquisição de comprimento. Para superar essas dificuldades, avanços recentes na tecnologia laser permitiram a develmento de microscopia óptica vibracional não-linear, em particular coerente anti Stokes-espalhamento Raman (CARS). CARROS microscopia, portanto, surgiu como uma ferramenta poderosa para imagens de células biológicas e ao vivo, por lipídios quimicamente mapeamento (através da vibração de estiramento CH), água (através de vibrações de estiramento OH), proteínas ou DNA. Neste trabalho, descrevemos a implementação da técnica CARROS em um microscópio multiphoton varredura a laser acoplado a OPO padrão. Baseia-se a sincronização em tempo das duas linhas de laser, ajustando o comprimento de um caminho do feixe de laser. Nós apresentamos uma implementação passo-a-passo desta técnica em um sistema multiphoton existente. A formação básica em óptica experimental é útil e o sistema apresentado não requer equipamento adicional caro. Também ilustram CARROS imaging obtidos em bainhas de mielina do nervo ciático de roedor, e mostra-se que esta imagem pode ser realizado simultaneamente com outra imagem óptica não linear, tal como o padrão two-photon técnica de fluorescência e geração de segundo harmônico.
Introdução
A microscopia óptica tornou-se uma importante técnica para visualização não destrutiva de processos dinâmicos em sistemas biológicos vivendo com uma resolução subcelular. Microscopia de fluorescência é atualmente o contraste de imagem mais popular usado em células vivas, devido à sua alta especificidade e sensibilidade 1. Uma grande paleta de sondas fluorescentes (corantes emergiu exógenos, proteínas geneticamente codificados, nanopartículas de semicondutores). Várias técnicas fluorescente à base de iluminação da amostra floresceram (tal como microscopia confocal ou de dois fotões) realizar imagem 3D e para reduzir uma principal desvantagem desta técnica é que a fotodegradação 2. Outras limitações incluem a exigência de rotulagem fluoróforo porque a maioria das espécies moleculares não são intrinsecamente fluorescente e, portanto, essas fluoróforos tem que ser introduzido artificialmente na amostra trabalhada. Esta manipulação artificial pode ser prejudicial, especialmente para pequenas moléculas ou induz potcial foto-toxicidade. Estas razões fazem microscopia de fluorescência não adequado para observações in vivo em. Por isso, a utilização de técnicas de imagiologia óptica com alta sensibilidade e contrastes moleculares específicas, sem a utilização de moléculas fluorescentes é altamente desejável em ciências biomédicas.
Várias técnicas de imagem óptica não linear, sem rotulagem ou coloração surgiram, incluindo segundo harmônico geração (SHG) 3,4 e geração de terceiro harmônico (THG) 5. Microscopia SHG foi usado para arranjos estruturais de imagem ao nível supramolecular microtúbulos tais como colagénio ou 6. THG é gerado a partir de heterogeneidades ópticas, tais como a interface entre o meio aquoso e lípidos 7. THG também foi demonstrada para a imagem de mielina 8,9. Ambas as técnicas podem ser aplicadas sobre um microscópio de fluorescência de dois fotões e requerem apenas um feixe de laser. No entanto, eles exigem intensidade do laser de alta potência (normalmente 50mW a 860 nm para SHG 10, 25 - 50 mW a 1180 nm para THG 9), que é deletério em amostras de vida, e não proporcionam a especificidade química que é necessária para inequivocamente imagem estruturas biológicas específicas.
Quimicamente imagiologia selectivo pode ser obtido a partir de sinais de vibração molecular inerentes com base na dispersão de Raman. Quando um feixe de luz atinge matéria, fotões pode ser absorvida e dispersada pelos átomos ou moléculas. A maior parte dos fotões dispersos terão a mesma energia, ou seja, a frequência, tal como os fotões incidentes. Este processo é chamado de espalhamento Rayleigh. No entanto, um pequeno número de fótons serão espalhadas com uma frequência óptica diferente da frequência dos fótons incidentes, ou seja, com um processo de espalhamento inelástico chamado de espalhamento Raman. A diferença entre a energia provém de excitação de modos vibracionais, dependendo da estrutura molecular e do ambiente. Portanto, Raman espontâneo prov espalhamentoides imagiologia química selectiva como moléculas diferentes têm freqüências vibratórias específicas. No entanto, é limitada por causa de seu sinal extremamente fraco. A microscopia confocal Raman tem sido desenvolvido e fornece resolução espacial 3D, mas requer tempo de alta potência média e longa aquisição 11. Para superar essas dificuldades, avanços recentes na tecnologia laser têm permitido o aumento da microscopia óptica vibracional não-linear, em particular coerente dispersão anti-Stokes Raman (CARS) 11,12,13.
CARS é um processo óptico não-linear de terceira ordem. Três feixes de laser, compostas por um feixe de bomba a ω frequência P, um feixe de Stokes na freqüência ω S e um feixe de sonda (na maioria das vezes sendo a bomba) estão focados em uma amostra e gerar um feixe de anti-Stokes na freqüência ω AS = ( 2ω P - ω S) 14. O sinal anti-Stokes podem ser significativamente aumentada, quando a diferença de frequênciaentre a bomba eo Stokes vigas está sintonizado numa Raman molecular vibração Ω R = (ω P - ω S). sinal de CARS é baseado em múltiplos interação fóton. Ele gera, por conseguinte, um sinal coerente ordens de magnitude mais forte do que a dispersão de Raman espontânea.
Microscopia CARS foi primeiro demonstrada experimentalmente por Duncan et al. 15. Zumbusch et al., Em seguida, melhorou a técnica, usando dois focados feixes de laser femtosegundo do infravermelho próximo com uma lente objetiva de alta abertura numérica, permitindo que a condição de casamento de fase de carros e evitando a dois fótons não-ressonante de fundo 16. CARROS microscopia, portanto, surgiu como uma ferramenta poderosa para imagens de células e tecidos ao vivo, através da detecção quimicamente moléculas como lipídios (através da vibração de estiramento CH) 17,18, água (através de vibrações de estiramento OH), proteínas, DNA em células vivas 19,20 mas também deuterado composto químicos para farmacêutico 21 e aplicações cosméticas 22.
A principal limitação da microscopia não-linear origina a partir da complexidade e do custo das fontes ópticas. Um sistema CARS requer dois lasers ajustáveis comprimento de onda com durações de pulso curto e com trens de pulso temporal e espacialmente sincronizados. Os carros adiantados microscópios foram baseadas em dois picosecond sincronizado Ti: lasers de safira 20. CARROS imagem também foi obtido a partir de um único Ti femtosecond: laser de safira gerando uma fonte de luz supercontínuo 23. Recentemente, fontes de laser compostas por um único Ti femtosegundo: laser de safira que bombeia um ópticos osciladores paramétricos sintonizável (OPO) têm sido utilizados para microscopia CARS. Esta configuração permite intrinsecamente temporalmente sincronizado vigas com uma diferença de frequência entre a bomba e o feixe de Stokes que cobre o espectro completo de vibração molecular 24. Além disso, microscópios de varredura de laser baseado num volume de negócioschave a laser fs e um OPO, usado principalmente para dois fótons de fluorescência (TPF) estão agora disponíveis para os não-físicos. O potencial de tais set-ups pode ser muito maior sem a necessidade de investimento adicional pela incorporação de outra imagem óptica não-linear, uma vez que cada modalidade de imagem não-linear (NLO) é sensível às estruturas ou moléculas específicas. Portanto Multimodal NLO imagem capitaliza o potencial da microscopia NLO para amostras biológicas complexas 25. O acoplamento destas técnicas permitiu a investigação de muitas perguntas biológicas, em particular sobre o metabolismo de lípidos, a pele ou o cancro de desenvolvimento 26, desenvolvimento muscular esquelética 27, 28 lesões ateroscleróticas. Além disso, a implementação de leitura por feixe de laser com CARS dá a capacidade de processamento de imagem de alta velocidade, ou seja, uma ferramenta atraente para estudar processos dinâmicos in vivo.
O objetivo deste trabalho é mostrar cada passo para implementar ttécnica que ele CARROS em um microscópio padrão de varredura a laser multiphoton. O microscópio é baseado numa Ti FSEC: laser de safira e um OPO (bombeado pelo Ti: Safira laser) operado por um software para biólogos. A integração foi realizada por ajustamento do comprimento de um caminho do feixe de laser, a fim de sincronizar em tempo os dois feixes. Descrevemos a implementação passo-a-passo desta técnica que requer apenas conhecimentos básicos na óptica experimentais. Nós também ilustram CARS Imaging obtidas em bainhas de mielina do nervo ciático de roedores, e nós mostrar-lhe a imagem pode ser realizada simultaneamente com outra imagem óptica não-linear, como técnica de fluorescência de dois fotões padrão e segundo harmônico geração.
Access restricted. Please log in or start a trial to view this content.
Protocolo
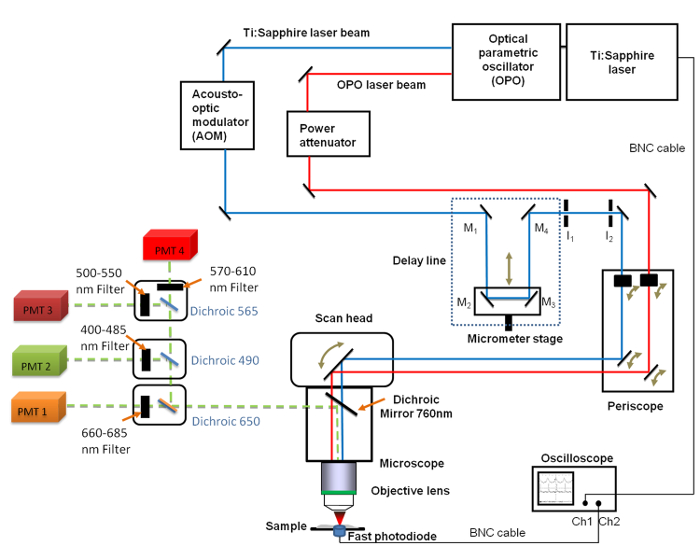
Figura 1. Representação esquemática do geral set-up Ele inclui a Ti:. Safira (680 - 1080 nm) e a OPO (1.050 - 1.300 nm) lasers, a linha de atraso com os 4 espelhos (M 1 a M 4), o osciloscópio rápido, o fotodiodo e duas íris fixa diafragmas I 1 e I 2. Espelhos M 2 e M 3 são fixados numa fase de translação linear que permite modificar o comprimento da linha de atraso com uma resolução micrómetro. A 660 -. 685 filtro de passagem de banda nm foi posicionado em frente ao tubo fotomultiplicador (PMT) usado para imagens CARS Por favor clique aqui para ver uma versão maior desta figura.
1. Inicialização do Sistema Laser
- Verifique se o Ti: comprimento de onda de safira está definido para 800 nm ou definireste comprimento de onda na Ti: safira controlador de fonte de alimentação. Gire a chave do modo de espera para Ligado para ligar o Ti: safira laser.
- Ligue o laser OPO na parte de trás do controlador OPO e abrir o Ti: safira obturador na Ti: Safira controlador de fornecimento de energia.
- Ligue o computador tablet para bombear a OPO. Clique nos ícones OPO conectado e remoto conectado no tablet. Espere por 30 - 40 min para aquecer.
- Ligue o computador microscópio e ligar os interruptores "Microscópio componentes". Inicie o software clicando duas vezes no ícone na área de trabalho.
- Na guia Acquisition software, abra a ferramenta Laser no Gerenciador de instalação para operar os dois lasers a partir do software. Selecione Ti: safira laser sobre a laser e OPO On. Verificar o valor da potência do laser óptico (valores típicos de 3.700 mW a 800 nm e 700 mW a 1000 nm).
- Para configurar o caminho do feixe e lasers,abra a ferramenta Path Luz no grupo de ferramentas Gerenciador de instalação e marque a caixa primeiro tubo fotomultiplicador (PMT).
- Para verificar a Ti: ponto de laser de safira na saída do objectivo, abra a ferramenta Canais no grupo ferramenta de aquisição de parâmetros. Seleccione a Ti: o poder de safira de baixo valor (cerca de 1%), reduzir o ganho para 0 (nenhuma imagem é necessária nesta fase) e clique no botão contínua para iniciar o processo de digitalização para lançar o feixe de laser através da objetiva do microscópio. Verifique a presença de uma mancha vermelha por observação directa através do posicionamento do cartão de visualização do laser de IV na saída do objectivo microscópio ar (10X).
- Para verificar o ponto de laser OPO, interromper a verificação do laser de Ti: safira, clicando no botão Parar. Selecione a fonte de OPO a baixo valor na janela de Canais e clique no Cbotão ontinuous.
2. Configurações Microscópio
- colocar manualmente o espelho dicróico com um comprimento de onda de corte a 760 nm no controle deslizante porta lateral no espaço infinito acima do revólver objectivo de lançar a luz até 760 nm da amostra com os PMT em detecção de não-descanned modo (NDD).
- Ajuste a faixa filtro de passagem estreita no 660-685 nm no reflector cubo NDD na frente de PMT1 para gravar apenas os CARROS sinalizar a 670 nm para reproduzir os resultados apresentados neste trabalho.
- Colocar um filtro de banda estreita compreendida entre 500 e 550 nm no cubo reflector NDD em frente PMT3 para observação de fluorescência da mielina. Colocar um filtro de banda estreita variando 565-610 nm no cubo refletor na frente de PMT4 para observação SHG.
- Para selecionar no software da gravação do sinal no detector com o filtro de passagem ad hoc banda, abrir a ferramenta Path Luz no menu de configuração do Gestor na guia Acquisition. Ative a PMT desejado (caixa de seleção) e selecione uma cor para este canal. Neste trabalho, o verde foi escolhida para carros, vermelhos por fluorescência e magenta para SHG.
3. Sincronização Temporal
Nota: Os dois feixes de laser são originários do mesmo laser de Ti: safira mas o feixe OPO é retardada quando é gerado de modo que os dois feixes não estão sincronizadas no tempo, quando alcançam o microscópio. O objectivo aqui é o de atrasar um dos dois feixes para re-sincronizar-los a tempo, antes que elas cheguem ao microscópio.
- Conecte-se com cabos BNC do canal de entrada CH1 do osciloscópio para o eléctrico de saída do laser BNC (Sync. Fora). Ligue o canal de entrada CH2 do osciloscópio para o fotodiodo e escolher o canal CH1 como o canal de gatilho pressionando MENU TRIGGER, então o menu principal botão Source e, em seguida, o botão de menu lateral que corresponde ao canal selecionado CH1.
- Posição e fixe com postes de montagem ópticos fotodiodo no plano focal de uma objetiva de microscópio de ar (10X) ou no caminho do feixe do microscópio depois de retirar a objectiva. Nota: Se necessário, retirar o refrigerante e o seu veículo.
- Na ferramenta Canais (grupo de ferramentas de Aquisição de parâmetros), definir a Ti: comprimento de onda do laser de safira a 830 nm em baixa potência (ou seja, menos de 1% da potência total). Na ferramenta Modo de Aquisição, reduzir a área de digitalização para um ponto, a fim de iluminar o fotodiodo com o feixe mais ínfimo. Ligue a varredura a laser, clicando no botão Contínuo.
- Pressione AUTOSET no painel frontal e o osciloscópio mover manualmente a posição do fotodiodo para obter os trens de impulsos na tela. Pressione o botão RUN / STOP para congelar a exibição.
- Para salvar uma cópia da tela do osciloscópio, inserir um 3.5polegada disquete na unidade de disquete ou conectar a porta GPIB no painel traseiro para um computador. Em seguida, pressione a tecla SHIFT MENU HARDCOPY, prima Format (principal) para selecionar o formato de imagem TIFF e especifique no menu Porto o canal de saída. Pressione o botão HARDCOPY para gravar a tela do osciloscópio dos trens de pulso do Ti: safira laser.
- Desligue a Ti: varredura a laser de safira, clicando no botão Parar. Ao clicar ferramenta Canais definir o sinal OPO em 1107 poder nm e baixa. Ligue o scanner a laser OPO e registrar os trens de pulsos de laser OPO no osciloscópio. Desligue o scanner a laser OPO.
- Compare a mudança temporal entre a Ti: safira e os sinais OPO.
NOTA: O deslocamento deslocamento temporal, t dá o comprimento da linha de retardo L DelayLine que tem de ser executada em conformidade com a equação: L = C delayLine5; t deslocar em que c é a velocidade da luz. - Escolha uma das linhas de laser.
NOTA: Neste trabalho, o Ti: linha de laser de safira foi escolhido porque o espaço livre disponível próximo desta linha laser. Além disso, esta escolha permite alcançar o re-alinhamento da linha de laser com uma luz laser visível. - Abrir a linha de laser, removendo os tubos de protecção na posição em que a linha de retardamento será implementada.
Atenção! Utilizar óculos de protecção adequados e remover pulseiras cadeia ou assistir a partir pulsos. - Seleccionar um comprimento de onda na gama do visível, a fim de ser capaz de observar facilmente o feixe de laser (700 nm, por exemplo, a baixa potência na ferramenta Canais do software). Ligue a varredura a laser.
- Coloque e definir com postes de montagem ópticos duas íris diafragmas ao longo da linha de laser aberto. Posição uma íris na saída da linha de atraso e colocar os outros íris na entrada do periscópio.
NOTA: O pecontrolos riscope por dois espelhos motorizados pilotados pelo software o ângulo de entrada do feixe de laser para a cabeça de leitura do microscópio de varrimento laser. - Diminuir o diafragma de íris de abertura e ajustar as posições de diafragma para ajustar o caminho do feixe laser. Corrigi-los sobre a mesa óptica. Ajustar a posição vertical de um terceiro diafragma móvel, para verificar a altura do feixe de laser, enquanto sucessivamente posicionar os quatro espelhos da linha de retardo.
NOTA: Estes diafragmas de íris servirá como controle para o processo de re-alinhamento, mostrando o caminho a seguir. - Coloque o espelho M1 montado sobre um espelho cinemática compacto montar na entrada da linha de retardo (como mostrado na Figura 1) e ajustar a sua posição e a sua orientação para manter a altura da viga, com a utilização do diafragma de íris móvel. Ponto espelha M2 e M3 (também montada sobre elementos de espelho cinemáticos compactos) a 90 ° para a fase de tradução que será posicionado no Midcourse. Posicioná-los para ajustar o comprimento da linha de atraso, calculada anteriormente.
- Ajustar a orientação de M2 e M3 com o uso do diafragma de íris móvel. Definir M4 (também fixo em uma montagem compacta) na saída da linha de retardo (imediatamente antes da íris I 1 como mostrado na Figura 1) e cuidadosamente ajustar a sua posição e o ângulo para ajustar o trajecto do feixe de laser através dos dois diafragmas íris fixa.
- Posicione o cartão de visualização de laser na saída da objetiva do microscópio e verificar o perfil de feixe de laser, clicando em contínua para ligar o scanner a laser. Observar um disco brilhante uniforme. Se necessário, ajuste ligeiramente a orientação da M4.
- Posição novamente o fotodíodo rápido sob o feixe de laser no plano de foco amostra do microscópio. Observe a mudança temporal entre a Ti: feixe de laser de safira e o feixe OPO no osciloscópio.
Nota: Se necessário, altere o comprimento da linha de atraso, movendo o sistema inteiro M2, M3 montado nofase de tradução (sem mudar a fase de afinação de tradução) para sincronizar ambos os pulsos. Alterações de alguns centímetros pode ser necessária.
4. Spatial Sobreposição dos feixes
Nota: Para produzir um sinal de automóveis, é requerido a sobreposição espacial dos dois feixes de laser. A iluminação alternada de ambos os feixes sobre os mesmos ao longo de pérolas coradas com dois corantes fluorescentes diferentes podem ser usados para indicar o deslocamento espacial. ajustes finos das posições espelho pode minimizar a mudança.
- Use pré-montada microesferas fluorescentes. Ou montar microesferas em suspensão em lâminas de microscópio limpas conforme descrito abaixo:
- Antes de amostragem, mix (em um misturador córtex ou por sonicação) a solução contas para ter certeza de que as contas são uniformemente suspenso.
- Aplicar 5 ul da suspensão de esferas para a superfície de uma lâmina de espalhar e com a ponta da pipeta. Aguarde até que a gota para secar e em seguida, aplicar 5 ul de montageming médio, tal como o glicerol, água ou óleo de imersão sobre a amostra seca de grânulos. Cobrir a amostra com uma lamela e selar a lamela com cola de secagem rápida ou parafina derretida.
- Coloque as esferas de poliestireno fluorescentes fixadas numa lâmina de microscópio no âmbito do objectivo de água 20X. Adicione algumas gotas de água para imergir o objetivo.
- Para alcançar o foco sobre as contas, abra a guia Localize no software para alternar entre o modo de varredura a laser para a observação direta da amostra com o olho, pressionando o botão Online. Abra a ferramenta Ocular para selecionar o filtro ad hoc e ligar a lâmpada de halogéneo, clicando nos ícones.
- remover manualmente o espelho dicróico no controle deslizante porta lateral no espaço infinito e usar o mecanismo de focagem do microscópio para focar o plano da amostra, observando as contas com as oculares. Substituir o espelho dicróico.
- NoGuia localizar, mudar para o modo de varredura a laser, premindo o botão Off-line. Vá até a aba Aquisição para definir os parâmetros para a digitalização: selecione o tamanho do quadro para 512 pixels, uma velocidade de digitalização de 9, uma média de 1, uma profundidade de 8 bits bit e aumentar a área de digitalização ao máximo.
- Na ferramenta Canais da guia Acquisition, adicionar uma faixa (faixa 1) se não já criado. Escolha o comprimento de onda a 830 nm e baixo consumo de energia para o Ti:. Feixe de laser de safira Assinale a cor para verde na caixa Track 1 da janela de Canais e na caixa de PMT4 da janela Caminho de Luz PMT3 ou.
- Na ferramenta Canais da guia Acquisition, adicionar uma segunda faixa (faixa 2). Selecione o comprimento de onda em 1107 poder nm e baixa para o feixe de laser OPO. Assinale a cor para vermelho na caixa Track 2 da janela de Canais e na caixa PMT3 do janela Caminho de Luz.
- Ajuste o ganho de ambas as faixas para 600. Em seguida, aplicam-se sequencialmente a digitalização dos dois feixes sobre a amostra clicando em contínuo.
- Observe a imagem na área de ecrã para a visualização 2D. Na Tela de Vista bloco de controle Opção, ajustar a intensidade de exibição.
Nota: Se necessário, mova ligeiramente o mecanismo de focagem para encontrar o plano de foco das esferas. Ajuste a colheita e ampliar a imagem em um único grânulo ou em um grupo de esferas adjacentes. - Use o controlador periscópio para sobrepor os feixes no plano xy. No software, abra a guia Manutenção. Clique nas Opções do sistema e exibir janela da ferramenta motorizada Periscópio. Use os ajustes finos e grossos dos espelhos periscópio do Ti: feixe de laser de safira, a fim de sincronizar no espaço ambas as imagens.
- Para a manipulação periscópio, use as primeiras barras de ajuste para vertical ea secoND um no sentido horizontal para o feixe de laser. Mova o feixe com o espelho de entrada até que a imagem é um pouco visível, e depois compensar a intensidade do laser com o espelho do periscópio de saída, clicando em "input" e "output".
- A fim de se sobrepõem verticalmente as vigas, na guia Manter, abrir a ferramenta colimador e ajustar o valor da distância focal do Ti: feixe de laser de safira.
- Mova suavemente a posição objetiva vertical para verificar a diferença de foco em ambas as imagens. Ou, dê uma z-stack da amostra pela abertura na guia Acquisition a ferramenta Z-Stack e escolher os diferentes parâmetros (range, número de fatias). Imprensa Ortho na área da tela imagem para ver as vigas em corte transversal axial. Maximizar o z-sobreposição, fazendo o mesmo procedimento várias vezes.
5. ajustes finais e coerente Anti-Stokes espalhamento Raman (CARS) a observação de sinais de Olive Oil Droplets
- Coloque uma gota de azeite de oliva em uma placa de vidro e cubra-o por uma lamela de vidro. Adicione algumas gotas de água para imergir a objetiva de imersão 20X de água. Concentre-se na borda da lamínula usando as oculares (como explicado anteriormente em 4.2).
- Na ferramenta Canais da guia Acquisition, selecione na Pista 1 o comprimento de onda de 830 nm para o Ti: feixe de laser de safira e em 1107 nm para a OPO. Assinale ambos os lasers em Track 1 para obter uma varredura simultânea de ambos os lasers. Definir poderes de baixo valor para um começo.
- Na janela Caminho de Luz, selecione PMT1. Ligue as varreduras a laser, clicando no botão Contínuo. Mover-se ligeiramente o foco para fornecer a luz de laser para a camada fina de óleo.
- Se necessário, aumentar a potência óptica de ambos os lasers. Ajuste a intensidade da afixação no Mostrador Ver bloco de controle Opção. Mova lentamente a fase de tradução da linha de atraso até que o sinal se torna sigcativamente reforçada.
- Após os alinhamentos finas são completo, verificar se ele é realmente um CARS sinalizar: Mover ligeiramente a fase de tradução; a intensidade do sinal devem tornar-se mais fraca. E / ou desligar um do feixe de laser, ou laser de Ti: safira ou OPO. Mais uma vez, deve haver uma deterioração na intensidade forte em comparação com o sinal de CARS.
- Para alcançar o máximo sinal CARS, selecione a opção no software para fornecer um valor da intensidade média de toda a imagem (no modo de exibição Histo da guia área da tela). Ajustar o comprimento de onda (nm poucos), em seguida, x, y, z posições de focagem do feixe para maximizar o valor de intensidade média.
6. Protecção de o caminho da luz da linha de atraso
- Uma vez que o sistema final é dedicado a não-físicos, coloque o caminho de luz da linha de atraso com tubos ou uma caixa de gabinete, para evitar acesso directo ao pico elevado feixe de laser de energia não-visível prejudicial. Tome cuidado para fornecer um acesso à fase de traduçãobotão.
7. Comprimento de onda Ajuste de CARS
- Use a equação
 para ajustar os comprimentos de onda do laser para a vibração Raman desejado. Para reproduzir os resultados apresentados neste trabalho para CARS imagem Sinal de ligações CH com vibração de alongamento de 3015 cm-1, selecione λ Ti: safira = 830 nm e λ OPO = 1,095 nm.
para ajustar os comprimentos de onda do laser para a vibração Raman desejado. Para reproduzir os resultados apresentados neste trabalho para CARS imagem Sinal de ligações CH com vibração de alongamento de 3015 cm-1, selecione λ Ti: safira = 830 nm e λ OPO = 1,095 nm.
NOTA: frequências vibratórias característicos Raman observadas em amostras biológicas, tais como a água, ligação CH podem ser encontrados em Evans et ai, em 13 ou 29 de Ellis et ai... - Use a equação
 para determinar o comprimento de onda de emissão de sinal de CARS. Para CH imagem vínculo por carros, escolha um filtro de banda estreita a 670 nm desde CARS X = 670 nm com comprimentos de onda do laser apresentado em 7.1.
para determinar o comprimento de onda de emissão de sinal de CARS. Para CH imagem vínculo por carros, escolha um filtro de banda estreita a 670 nm desde CARS X = 670 nm com comprimentos de onda do laser apresentado em 7.1.
NOTA: uma aplicação do telefone móvel é avdisponív eis para calcular CARS X de λ P e λ S valores (ver referência 30).
8. Observação de CARS de Sinais e manchado Mielina de cortes nervo ciático
Nota: Todos os experimentos com animais foram conduzidos de acordo com as normas institucionais.
- Prepare os cortes do nervo ciático axial e longitudinal sobre uma lâmina de microscópio como apresentado na Ozcelik et al. 31.
- Preparar a solução de coloração vermelho fluoromyelin por diluição da solução de reserva de 300 vezes em PBS. Inundar os cortes nervosas com a solução de coloração, durante 20 min à TA. Remover a solução e lava-se 3 vezes durante 10 min com PBS.
- Posicione os cortes no âmbito do objectivo de imersão em água 20X. Coloque uma lamela. Adicione algumas gotas de PBS para imergir o objetivo e ajustar o foco do objetivo de obter uma imagem clara dos cortes através das oculares (como anteriormente indicado em secção 4.2).
- Na Pista 1, selecione a Ti: safira eo OPO lasers e definir seus comprimentos de onda de 830 nm e 1095 nm, respectivamente. Na janela Caminho de Luz, selecione PMT1 e cor verde.
- No Track 2, selecione o laser OPO somente (comprimento de onda de 1095 nm). Na janela Caminho de Luz, selecione PMT4 e cor vermelha.
- Para ambos os lasers, selecione baixa potência e definir o ganho de 600 para um começo. Ligue as varreduras a laser e ajustar os parâmetros a seguir para melhorar a CARS e sinal de fluorescência contrasta: valores de potência, botão de fase de tradução (muito ligeiramente), comprimentos de onda (alguns nm), a intensidade de exibição.
- Para gravar imagens finais em alta resolução, selecione na ferramenta Modo de Aquisição os seguintes parâmetros: tamanho do quadro de 1.024 pixels, velocidade de digitalização de 7, a média de 4. Clique no botão snap para gravar uma única imagem. Salve a imagem na forma de propriedadeem para gravar a imagem e os parâmetros de aquisição completos.
9. Observação de carros e sinais de SHG de cortes nervo ciático
- Prepara-se o nervo ciático como apresentado na Özçelik et ai. 31.
- Siga o procedimento conforme explicado em parte 8 para obter uma imagem através das oculares e selecionar CARS parâmetro de sinal (faixa 1).
- No Track 2, selecione o laser OPO somente (comprimento de onda de 1095 nm). Na janela Caminho de Luz, selecione PMT3 e cor magenta.
- Siga o procedimento conforme explicado em parte 8 para ligar as varreduras a laser e salvar imagens de alta resolução.
Access restricted. Please log in or start a trial to view this content.
Resultados
A frequência de trem de pulsos de Ti padrão: laser de safira é normalmente em torno de 80 MHz. A OPO tem a mesma frequência, uma vez que é bombeado pelo Ti: Safira laser. Por conseguinte, é necessário um osciloscópio de jejum de pelo menos 200 MHz. Um fotodíodo rápido na gama de 600 também é necessária a 1100 nm. A mudança temporais máxima ocorre quando o Ti: safira e os sinais OPO são deslocados de 1 / (2 × 80 × 10 6) = 6,2 nanossegundos. Isso correspo...
Access restricted. Please log in or start a trial to view this content.
Discussão
A parte mais desafiadora do trabalho é a sincronização temporal dos feixes de laser. Exige um fotodíodo rápido combinado com um osciloscópio rápido, mas apenas uma sobreposição áspera no tempo pode ser realizada em primeiro lugar. Em seguida, é necessário um novo ajustamento de alguns cm. Finalmente, micrômetro se move por uma fase de tradução linear permite realizar o ajuste fino do final do comprimento da linha de atraso para acionar o sinal de CARS. Este sinal é mantida numa gama estreita de cerca de ...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors declare that they have no competing financial interests.
Agradecimentos
The authors want to thank Dr. Philippe Combette (IES, UM, Montpellier, France) for the loan of the fast oscilloscope and acknowledge financial supports from Montpellier RIO Imaging (MRI). HR acknowledges ANR grants France Bio Imaging (ANR-10-INSB-04-01) and France Life Imaging (ANR-11-INSB-0006) infrastructure networks for coherent Raman imaging developments. This work was mainly supported by an European Research Council grant (FP7-IDEAS-ERC 311610) and an INSERM - AVENIR grant to NT.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Oscilloscope | Tektronix | TDS 520D | 500 MHz |
| Photodetector | Thorlabs | DET08C/M, T4290 | 5 GHz InGaAs, 800 - 1,700 nm |
| Ti:Sapphire laser Chameleon Ultra Family II | Coherent | ||
| Optical parametric oscillator OPO Compact Family | APE Berlin | ||
| Axio Examiner microscope LSM 7 MP | Carl Zeiss | ||
| Motorized periscope | Newport | ||
| Objective W Plan-Apochromat 20X/1.0 | Carl Zeiss | ||
| Beam combiner | Carl Zeiss | ||
| Acousto-optic modulator | Carl Zeiss | ||
| OPO power attenuator | Carl Zeiss | ||
| Photomultiplier tube | Carl Zeiss | ||
| ZEN software | Carl Zeiss | ||
| Bandpass filters | Carl Zeiss | LSM BiG 1935-176 | 400 - 480 nm; 500 - 550 nm; 465 - 610 nm |
| Dichroic mirror | Carl Zeiss | Cutoff wavelength 760 nm | |
| Silver mirrors | Newport | 10D20ER.2 | λ/10, 480 - 20,000 nm, Quantity 4 |
| Single-axis translation stage with standard micrometer | Thorlabs | PT1/M | Quantity 1 |
| Aluminium breadboard | Thorlabs | MB1015/M | Quantity 1 |
| Mirror mount | Thorlabs | KMSS/M | Quantity 4 |
| Mirror holder for Ø1" Optics | Thorlabs | MH25 | Quantity 4 |
| Iris diaphragms | Thorlabs | ID8/M | Quantity 3 |
| Protective box | Thorlabs | TB4, XE25L900/M, T205-1.0, RM1S | Quantity 1 |
| Optical posts | Thorlabs | TR40/M, PH50/M, PH75/M, BA2/M | Quantity 8 (lengths depending on the set-up) |
| 661 - 690 nm bandpass filter | Semrock | 676/29 nm BrightLine® single-band bandpass filter | Quantity 1 |
| Fluorescent beads | ThermoFisher | TetraSpeck™ Fluorescent Microspheres Size Kit | |
| Laser viewing card | Thorlabs | IR laser viewing card | |
| Laser safety glass | Newport | LV-F22.P5L07 | |
| FluoroMyelin™ Red Fluorescent Myelin Stain | ThermoFisher | F34652 |
Referências
- Valeur, B., Berberan-Santos, M. N. Molecular Fluorescence: Principles and Applications. , 2nd Edition, Wiley-VCH Verlag GmbH. (2012).
- Denk, W., Strickler, J. H., Webb, W. W. Two-photon laser scanning fluorescence microscopy. Science. 248 (4951), 73-76 (1990).
- Moreaux, L., Sandre, O., Mertz, J. Membrane imaging by second-harmonic generation microscopy. JOSA B. 17 (10), 1685-1694 (2000).
- Zoumi, A., Yeh, A., Tromberg, B. J. Imaging cells and extracellular matrix in vivo by using second-harmonic generation and two-photon excited fluorescence. Proc. Natl. Acad. Sci. USA. 99 (17), 11014-11019 (2002).
- Yelin, D., Silberberg, Y. Laser scanning third-harmonic-generation microscopy in biology. Opt. Express. 5 (8), 169-175 (1999).
- Campagnola, P. J., Millard, A. C., Terasaki, M., Hoppe, P. E., Malone, C. J., Mohler, W. A. Three-dimensional high-resolution Second-Harmonic Generation imaging of endogenous structural proteins in biological tissues. Biophys. J. 81 (1), 493-508 (2002).
- Olivier, N., et al. Cell lineage reconstruction of early zebrafish embryos using label-free nonlinear microscopy. Science. 329 (5994), 967-971 (2010).
- Farrar, M. J., Wise, F. W., Fetcho, J. R., Schaffer, C. B. In vivo imaging of myelin in the vertebrate central nervous system using third harmonic generation microscopy. Biophys. J. 100 (5), 1362-1371 (2011).
- Lim, H., Sharoukhov, D., Kassim, L., Zhang, Y., Salzer, J. L., Melendez-Vasquez, C. V. Label-free imaging of Schwann cell myelination by third harmonic generation microscopy. Proc. Natl. Acad. Sci. U.S.A. 111 (50), 18025-18030 (2014).
- Strupler, M., Pena, A. M., Hernest, M., Tharaux, P. L., Martin, J. L., Beaurepaire, E., Schanne-Klein, M. C. Second harmonic imaging and scoring of collagen in fibrotic tissues. Opt. Express. 15 (7), 4054-4065 (2007).
- Cheng, J. X., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: Instrumentation, theory, and applications. J. Phys. Chem. B. 108 (3), 827-840 (2004).
- Volkmer, A. Vibrational imaging and microspectroscopies based on coherent anti-Stokes scattering microscopy. J. Phys. D: Appl. Phys. 38, R59-R81 (2005).
- Evans, C. L., Xie, X. S. Coherent anti-Stokes Raman scattering microscopy: chemical imaging for biology and medicine. Annu. Rev. Anal. Chem. 1, 883-909 (2008).
- Mukamel, S. Principles of nonlinear optical spectroscopy. , Oxford University Press. New York. (1995).
- Duncan, M. D., Reintjes, J., Manuccia, T. J. Scanning coherent anti-Stokes Raman microscope. Opt. Lett. 7 (8), 350-352 (1982).
- Zumbusch, A., Holtom, G. R., Xie, X. S. Three-dimensional vibrational imaging by coherent anti-Stokes Raman scattering. Phys. Rev. Lett. 82 (20), 4142-4145 (1999).
- Folick, A., Min, W., Wang, M. C. Label-free imaging of lipid dynamics using Coherent Anti-Stokes Raman Scattering (CARS) and Stimulated Raman Scattering (SRS) microscopy. Curr. Opin. Genet. Dev. 21 (5), 585-590 (2011).
- Wang, P., Liu, B., Zhang, D., Belew, M. Y., Tissenbaum, H. A., Cheng, J. X. Imaging lipid metabolism in live Caenorhabditis elegans using fingerprint vibrations. Angew. Chem. Int. Ed. Engl. 53 (44), 11787-11792 (2014).
- Min, W., Freudiger, C. W., Lu, S., Xie, X. S. Coherent nonlinear optical imaging: beyond fluorescence microscopy. Annu. Rev. Phys. Chem. 62, 507-530 (2011).
- Cheng, J. X., Jia, Y. K., Zheng, G., Xie, X. S. Laser-scanning coherent anti-Stokes Raman scattering microscopy and applications to cell biology. Biophys J. 83 (1), 502-509 (2002).
- Chiu, W. S., Belsey, N. A. N., Garrett, L., Moger, J., Delgado-Charro, M. B., Guy, R. H. Molecular diffusion in the human nail measured by stimulated Raman scattering microscopy. Proc Natl. Acad. Sci. U.S.A. 112, 7725-7730 (2015).
- Chen, X., Grégoire, S., Formanek, F., Galey, J. -B., Rigneault, H. Quantitative 3D molecular cutaneous absorption in human skin using label free nonlinear microscopy. J. of Control. Release. 200, 78-86 (2015).
- Kano, H., Hamaguchi, H. In vivo multi-nonlinear optical imaging of a living cell using a supercontinuum light source generated from a photonic crystal fiber. Opt. Express. 14 (7), 2798-2804 (2006).
- Brustlein, S., Ferrand, P., Walther, N., Brasselet, S., Billaudeau, C., Marguet, D., Rigneault, H. Optical parametric oscillator-based light source for coherent Raman scattering microscopy: practical overview. J. Biomed. Opt. 16 (2), 021106(2011).
- Chen, H., et al. A multimodal platform for nonlinear optical microscopy and microspectroscopy. Opt. Express. 17 (3), 1282-1290 (2009).
- Yue, S., Slipchenko, M. N., Cheng, J. X. Multimodal nonlinear optical microscopy. Laser Photonics Rev. 5 (4), 496-512 (2011).
- Sun, Q., Li, Y., He, S., Situ, C., Wu, Z., Qu, J. Y. Label-free multimodal nonlinear optical microscopy reveals fundamental insights of skeletal muscle development. Biomed Opt Express. 5 (1), 158-166 (2013).
- Le, T. T., Langohr, I. M., Locker, M. J., Sturek, M., Cheng, J. X. Label-free molecular imaging of atherosclerotic lesions using multimodal nonlinear optical microscopy. J. Biomed. Opt. 12 (5), 054007(2007).
- Ellis, D. I., Cowcher, D. P., Ashton, L., O'Hagana, S., Goodacre, R. Illuminating disease and enlightening biomedicine: Raman spectroscopy as a diagnostic tool. Analyst. 138, 3871-3884 (2013).
- A•P•E Angewandte Physik & Elektronik GmbH. , Germany. Available from: http://www.ape-berlin.de/en/page/calculator (2015).
- Ozçelik, M., et al. Pals1 is a major regulator of the epithelial-like polarization and the extension of the myelin sheath in peripheral nerves. J Neurosci. 30 (11), 4120-4131 (2010).
- Heinrich, C., Hofer, A., Ritsch, A., Ciardi, C., Bernet, S., Ritsch-Marte, M. Selective imaging of saturated and unsaturated lipids by wide-field CARS-microscopy. Opt. Express. 16 (4), 2699-2708 (2008).
- Kyriakidis, N. B., Skarkalis, P. Fluorescence spectra measurement of olive oil and other vegetable oils. J. AOAC Int. 83 (6), 1435-1439 (2000).
- King, R. Microscopic anatomy: normal structure. Handb. Clin. Neurol. 115, 7-27 (2013).
- Monsma, P. C., Brown, A. FluoroMyelin Red is a bright, photostable and non-toxic fluorescent stain for live imaging of myelin. J. Neurosci. Methods. 209 (2), 344-350 (2012).
- Wang, H., Fu, Y., Zickmund, P., Shi, R., Cheng, J. X. Coherent anti-stokes Raman scattering imaging of axonal myelin in live spinal tissues. Biophys. J. 89 (1), 581-591 (2005).
- Wang, H. W., Fu, Y., Huff, T. B., Le, T. T., Wang, H., Cheng, J. X. Chasing lipids in health and diseases by coherent anti-Stokes Raman scattering microscopy. Vib. Spectrosc. 50 (1), 160-167 (2009).
- Jung, Y., Tam, J., Jalian, H. R., Anderson, R. R., Evans, C. L. Longitudinal, 3D in vivo imaging of sebaceous glands by coherent anti-stokes Raman scattering microscopy: normal function and response to cryotherapy. J. Invest. Dermatol. 135 (1), 39-44 (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados