É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Tridimensional Cultura Ensaio para Explorar Cancer Invasividade celular e formação de tumor Satélite
Neste Artigo
Resumo
Cancer cells are embedded in a collagen gel and then sandwiched in an acellular fibrin gel to generate a 3D culture system in which the invasiveness and formation of satellite tumors may be monitored.
Resumo
a cultura de células de mamífero em monocamadas é amplamente utilizado para estudar vários processos fisiológicos e moleculares. No entanto, esta abordagem para estudar as células que crescem frequentemente gera artefactos indesejados. Portanto, a cultura de células em um ambiente tridimensional (3D), muitas vezes o uso de componentes da matriz extracelular, surgiu como uma alternativa interessante devido à sua estreita semelhança com o nativo no tecido vivo ou órgão. Foi desenvolvido um sistema de cultura celular 3D utilizando dois compartimentos, a saber, (i) um compartimento central contendo células cancerosas embebidas numa actuação gel de colagénio como um tumor macrospherical pseudo-primário e (ii) um compartimento livre de células periférica feita de um gel de fibrina, isto é, um componente de matriz extracelular diferente do utilizado no centro, no qual as células cancerígenas podem migrar (invasão frente) e / ou formar microparticulas tumores representam tumores secundários ou satélite. A formação de tumores satélite no compartimento periférico énotavelmente correlacionados com a agressividade conhecido ou origem metastático das células tumorais nativas, que faz com que este sistema de cultura 3D original. Esta abordagem de cultura de células pode ser considerada para avaliar a capacidade de invasão de células do cancro e a motilidade, as interacções célula-matriz extracelular e como um método para avaliar as propriedades de drogas anti-cancro.
Introdução
Investigando as características fundamentais e biomédicas de invasão da célula cancerosa / migração e subsequente criação metástase é objecto de um 1,2 intensa pesquisa. A metástase é o último estágio do câncer e seu manejo clínico permanece indefinida. Uma melhor compreensão de metástases nos níveis celulares e moleculares permitirá o desenvolvimento de terapias mais eficazes 3.
Várias propriedades de células metastáticas pode ser explorada in vitro, incluindo a sua stemness 4 e potencial para adquirir um estado de transição (por exemplo, a transição epitelióide-mesenquimal) para migrar e invadem dentro e a partir do tumor primário 5. No entanto, a avaliação in vitro de processos / metástase de invasão tem sido um desafio, uma vez que praticamente exclui a contribuição da circulação de sangue / linfático. culturas organotípicas que incorporam fragmentos de tumor em géis de colagénio têm Previously sido utilizada para monitorizar a agressividade do cancro. Embora a complexidade dos tumores é preservada (por exemplo, a presença de células não-cancerosas), fragmentos tumorais são expostas a difusão forma limitada, a variação de amostragem, e a um crescimento excessivo de células estromais 6. Um método alternativo consiste em crescer as células cancerosas no interior de componentes da matriz extracelular (ECM), que imita o ambiente celular tridimensional (3D). A proliferação de linhas celulares de cancro da mama num gel de colagénio e / ou uma matriz de membrana basal é derivada entre os exemplos mais bem caracterizados de cultura de células 3D. Através da utilização de ambientes de cultura de células específicas 3D, o conjunto desorganizado observado para as células de cancro da mama cultivadas sob condições padrão pode ser revertida para a formação espontânea de ácinos mamaria e estruturas tubulares 7-10. Além disso, a formação de esferóides multicelulares de tumores derivados de células de cancro de adenocarcinoma congregados utilizando técnicas diferentes (por exemplo, pendurado gotas, esferóides flutuante, agar embedment) constitui agora o ensaio de cultura de células 3D mais utilizada 11-13. No entanto, este ensaio é limitado pelo conjunto restrito de linhas celulares de cancro que podem formar esferóides e pela curto período disponível para estudar células nestas condições.
Nesta técnica visualizada, que aqui se introduzir um ensaio de cultura de células 3D sofisticado, onde as células cancerosas de interesse são incorporados num gel de colagénio para permitir a formação in vitro de um tumor pseudo-primário que pode ser alternativamente revestido com uma matriz derivada de membrana basal. Uma vez formado, o tumor pseudo-primário é, em seguida, colada em uma matriz acelular (gel de fibrina, no presente caso), o que permite que as células cancerosas para atravessar a interface entre os dois compartimentos da matriz (ver Figura 1). Curiosamente, as estruturas semelhantes a tumores, secundárias provenientes do tumor pseudo-primário, juntamente com as células cancerosas agressivas aparecem nagel de fibrina. Um tal sistema de cultura 3D oferece a flexibilidade necessária para investigar, por exemplo, fármacos anti-cancerígenos, de expressão de genes e célula-célula e / ou interacções célula-ECM 14-16.
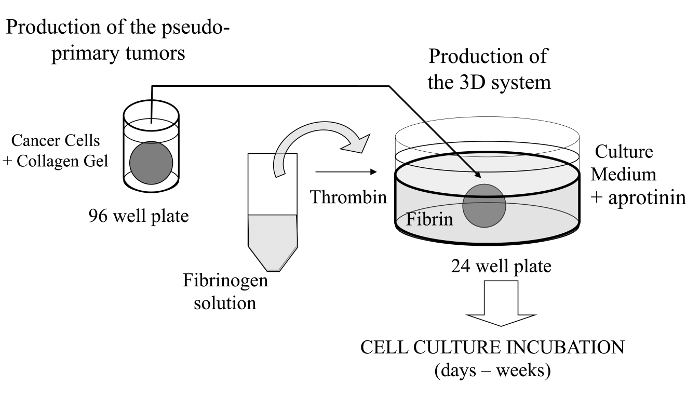
Figura 1:.. Visão Geral do Método resumo esquemático do método para gerar o sistema de cultura celular 3D como um modelo para estudos de câncer Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
NOTA: Não ética consideração, pois as células cancerosas em animais e humanos foram adquiridos ou gentilmente cedido para nós.
1. Fazendo Collagen Plugs (Tumor Pseudo-primário)
- Prepara-se uma dispersão de colagénio. Colágeno tipo I de tendões da cauda de rato (RTT) podem ser extraídos e esterilizados conforme relatado anteriormente 17, ou comprada. Dispersar colagénio liofilizado RTT (3,25-3,50 mg / ml em 0,02 N de ácido acético) usando um misturador (ajuste de alta velocidade; cinco mínimo de duas vezes), para uma mistura uniforme.
- Colheita (tripsina-EDTA, geralmente) e usar a exclusão de azul de tripano para a contagem de células viáveis utilizando um hemacitómetro. Ajustar a densidade celular desejada (5 x 10 4 culas por tampão).
- Preparar todas as soluções (NaOH, soro de bovino fetal, meio DMEM 5x, NaHCO3) separadamente (Tabela 1) sob condições estéreis e mantê arrefecida em gelo. Nota: A ordem de adição dos vários soluções é importante para evitar choques osmóticos ou ácidas em células.
- Realizar dispersão de células (1,25 x 10 6 células) na solução de colagénio final (5 ml) tão rapidamente quanto possível. Misture bem (por pipetagem para cima e para baixo), evitando bolhas de ar, e, em seguida, distribuir rapidamente 200 pi da solução pronta para uso, em cada poço de uma placa de 96 poços. Suavemente atacar a placa multi-poços na superfície da capa de cultura de célula a área de trabalho para remover as bolhas de ar e para espalhar a solução uniformemente dentro dos poços.
- Depois de preencher todos os poços (esta etapa leva cerca de 15-20 minutos por placa de 96 poços), armazená-lo para a incubadora.
- Incubar a placa a 37 ° C a partir de 2 horas até durante a noite. O colagénio de gelificação (ou seja, a fibrilogénese) ocorre dentro de 30 min. Adicionar meio de cultura (100 ul / cavidade) à cultura para realizar uma incubação de um dia para o outro.
2. primeira camada de fibrina Gel
- Fibrinogênio Preparação Solution.
NOTA: O mesmo lote de gel de fibrina devem, idealmente, ser utilizado para Resul mais reprodutívelTS, como formação de gel de fibrina pode variar entre os diferentes lotes de fibrinogénio liofilizado comercial.- Sempre use uma solução de fibrinogénio preparados na hora. Traga o fibrinogénio liofilizado até à temperatura ambiente antes de abrir o frasco para evitar a formação de cristais de hidrato.
- Progressivamente dissolver o fibrinogénio em pré-aquecido (37 ° C) Solução Salina Equilibrada de Hank (HBSS) com Ca2 + / Mg2 + a uma concentração de trabalho de 3 mg / ml (considerar a preparação de um excesso de 15% do volume final mínima necessária : por exemplo, 17,25 mg em 5,75 ml de uma solução 5 ml).
- Adicionar pré-aquecido, gota a gota HBSS em primeiro lugar para solubilizar fragmentos de fibrinogénio. Quebrar fragmentos maiores com uma espátula no copo. Agitar o recipiente de tempos a tempos para facilitar a mistura. Não use um disco de agitação durante o procedimento. Dissolver o pó restante pipetando a suspensão para cima e para baixo.
- Manter a solução de fibrinogénio morna enquanto SteriLIZING a solução por passagem através de um filtro de 0,22 um. Nota: Se o HBSS não está suficientemente quente ou o fibrinogênio não completamente dissolvido, a solução pode obstruir o filtro. Se for o caso, substituir o filtro de uma ou duas vezes, o que pode diminuir a concentração de fibrinogênio e rigidez, assim, coágulo de fibrina.
- Suspender as células de interesse (por exemplo, células endoteliais) em solução de fibrinogénio pronto-para-uso durante o ajuste do seu volume final, tal como um procedimento alternativo.
- Preparar as soluções de trombina.
- Prepara-se uma solução estoque em ddH2O (50 NIH unidades / ml), em seguida, esterilizá-lo utilizando um filtro de 0,22 um.
- Usar uma proporção / trombina do fibrinogénio ≥1: 0,0075 (v / v), a fim de gerar o gel de fibrina.
- Gerando o gel de fibrina.
- Mantenha o fibrinogênio estéril e trombina soluções estoque em gelo durante todas as etapas seguintes. Os geles de fibrina são permitidos para formar em placas de 24 poços.
- th prontamente sobreposiçãoe a superfície de cada cavidade com a solução de fibrinogénio (200 ul / poço), evitando a formação de bolhas de ar. Processo 6 poços a uma hora.
- Uma vez que a solução de fibrinogénio cobre completamente a superfície dos poços, inclinar a placa a um ângulo de 45 ° e adicionar 1,5 ml de solução de trombina para o primeiro poço soltando a trombina para o centro do poço, e em seguida rodar suavemente a placa horizontalmente para 1-2 seg.
- Deixar a placa numa posição estável sob a câmara de fluxo laminar (5-10 minutos) até que o processo de gelificação / coagulação foi concluída (NB: o processo de polimerização não deve ser perturbado, por exemplo, através do transporte da placa para a incubadora).
- Uma vez que os primeiros seis poços polimerizado, repetir a mesma sequência (ou seja, as 3 etapas anteriores) para os próximos seis poços até que todos os poços foram processadas.
3. segunda camada de fibrina Gel e imprensado Collagen plug
- OpçãoA: (A utilização do colágeno Ligue imediatamente).
- Certifique-se de que a primeira camada de gel de fibrina polimerizada em todos os poços por delicadamente da inclinação da placa. Colocar a placa de 96 poços contendo lado os tampões de gel de colagénio a lado com a placa de 24 cavidades (contendo os geles de fibrina) para facilitar a transferência das fichas de colagénio.
- Adicionar uma gota de HBSS a cada poço da placa contendo as fichas de colagénio.
- Remover cada vela de colagénio do poço com uma agulha fina montado numa seringa (usado como um identificador) ou usando um micro-colher (veja o vídeo). Transfira cada vela de colágeno para a primeira camada de gel de fibrina usando um ou dois micro-colheres, assegurando ao mesmo tempo que a ficha colágeno é bem centrado no poço e que a esterilidade é bem conservado.
- Overlay o gel de fibrina previamente formada com a segunda camada de solução de fibrinogénio (300 ul / poço) e introduzir a trombina como descrito em 2.3, mantendo um mínimo de 1:. Relação de 0,0075 e uma sequência de seis poços de cada vez
- Opção B (Revestimento do Collagen Plug com uma fina camada de Fator de Crescimento reduzido membrana basal (GFRBM)).
- Frescos todas as soluções preparadas e instrumentos de antemão e mantê-los a 4 ° C ou em gelo (por exemplo, pipetas, pontas, tubos de ensaio) durante o manuseio desde alíquotas congeladas de GFRBM são muito sensíveis à taxa de aquecimento excessivo durante a descongelação (siga as instruções do fabricante) .
- Após a remoção a partir dos poços da placa, mergulhar cada vela de colagénio durante 2 min num tubo de centrífuga de 1,5 ml em gelo contendo 100 uL de uma solução GRFBM puro.
- Transferir cada vela revestida sobre a primeira camada de fibrina, enquanto assegurando que é bem centralizada, tal como descrito anteriormente. Incubar as placas contendo os plug a 37 ° C durante 5 min para permitir a GRFBM para formar um gel. Adicione a segunda camada de fibrina como no passo 3.1.4.
4. Cultura Celular condições do meio
- Encher cada poço com meio de cultura (quatro00 uL). Os meios de cultura e suplementos serão seleccionados com base na linha celular e as condições experimentais.
- Adicionar aprotinina, um agente antifibrinolítica, ao meio de cultura a uma concentração final de 100 unidades de inibidor de calicreína (KIU) / ml.
NOTA: Armazenar as placas numa incubadora de cultura de células de acordo com as condições utilizadas para a linha de células testada. - Reabastecer culturas com meio fresco a cada dois dias ou de acordo com o programa experimental, e adicionar aprotinina. Antes de adicionar meio fresco, inclinar ligeiramente a placa (com um ângulo de 30-35 °) e inclinar a pipeta contra o lado de aspiração do poço, enquanto cuidadosamente o meio condicionado sob observação constante.
Resultados
Como mencionado anteriormente, uma característica interessante deste ensaio de cultura de células 3D é que as células de cancro não só podem migrar a partir do bujão de colagénio para o gel de fibrina adjacente, mas também estabelecer tumores secundários (por exemplo, estruturas, por satélite tumoral). Isto pode ser directamente observado com um microscópio de contraste de fase invertida com ampliações de baixa e alta, através da espessura do gel, especialmente co...
Discussão
Como uma nota importante técnica, é essencial que nenhum intervalo está presente na interface entre a central e os géis periféricos. Caso contrário, pode reduzir a capacidade das células para migrar / invadem o gel de fibrina. Um espaço entre o colagénio e os geles de fibrina podem formar durante as primeiras 24 h de cultura, se a trombina não foi apropriadamente diluído. É também possível que a linha de células testada pode levar o gel de colagénio para contrair durante a cultura, fazendo assim com que ...
Divulgações
The authors have no disclosure.
Agradecimentos
Work partially funded by Prostate Cancer Canada (grant # D2014-4 to SG and CJD) and the Canadian Institutes of Health Research (grant # MOP-111069 to SG). We would like to thank Dr. Richard Poulin for editorial assistance and Mrs. Chanel Dupont for technical assistance.
Materiais
| Name | Company | Catalog Number | Comments |
| Freeze-dried collagen | Sigma-Aldrich | C7661 | from rat tail tendon (soluble dispersion) or home-made (see Rajan et al., ref.#14) |
| Fibrinogen (freeze-dried) | Sigma-Aldrich | F8630 | Type I-S, 65 - 85% protein with ≥ 75% of protein is clottable |
| Thrombin | EMD Chemicals Inc. | 605157 | Gibbstown, NJ; NIH units/mg dry weight |
| Growth factor-reduced Matrigel | Corning | 356234 | Previously from BD Biosciences |
| Aprotinin | Sigma-Aldrich | A6279 | solution at 5 - 10T IU/ml (Trypsin Inhibitor Unit) |
| Micro-spoons | Fisher Scientific | 2140115 | Fisherbrand Handi-Hold Microspatula |
| 96 well plate, round base | Sarstedt | 3925500 | |
| 24 well plate | Sarstedt | 3922 | |
| Dulbecco's modified Eagle's Medium | Sigma Chemical, Co. | D5546 | DMEM |
| Fetal Bovine Serum | VWR | CAA15-701 | FBS, Canadian origin. |
| Trypsin-EDTA | Sigma Chemical, Co. | T4049 | |
| Hank’s Balanced Salt Solution | Sigma Chemical, Co. | H8264 | HBSS |
Referências
- Alizadeh, A. M., Shiri, S., Farsinejad, S. Metastasis review: from bench to bedside. Tumour Biol. 35 (9), 8483-8523 (2014).
- Roudsari, L. C., West, J. L. Studying the influence of angiogenesis in in vitro cancer model systems. Adv Drug Deliv Rev. , (2016).
- Bill, R., Christofori, G. The relevance of EMT in breast cancer metastasis: Correlation or causality. FEBS Lett. 589 (14), 1577-1587 (2015).
- Kimlin, L. C., Casagrande, G., Virador, V. M. In Vitro Three-Dimensional (3D) Models in Cancer Research: an Update. Mol Carcinog. 52 (3), 167-182 (2013).
- Obenauf, A. C., Massagué, J. Surviving at a Distance Organ-Specific Metastasis. Trends Cancer. 1 (1), 76-91 (2015).
- Sykes, J. A., Fogh, J. Separation of Tumor Cells from Fibroblasts. Human Tumor Cells In Vitro. 1, 1-22 (1975).
- Lang, S. H., Stark, M., Collins, A., Paul, A. B., Stower, M. J., Maitland, N. J. Experimental Prostate Epithelial Morphogenesis in Response to Stroma and Three-Dimensional Matrigel Culture. Cell Growth Differ. 12 (12), 631-640 (2001).
- Debnath, J., Muthuswamy, S. K., Brugge, J. S. Morphogenesis and Oncogenesis of MCF-10A Mammary Epithelial Acini Grown In Three-Dimensional Basement Membrane Cultures. Methods. 30 (3), 256-268 (2003).
- Shaw, L. M. Tumor cell invasion assays. Methods Mol. Biol. 294, 97-105 (2005).
- Nelson, C. M., Bissell, M. J. Modeling Dynamic Reciprocity: Engineering Three-Dimensional Culture Models of Breast Architecture, Function, and Neoplastic Transformation. Semin Cancer Biol. 15 (5), 342-352 (2005).
- Hedlund, T. E., Duke, R. C., Miller, G. J. Three-Dimensional Spheroid Cultures of Human Prostate Cancer Cell Lines. Prostate. 41 (3), 154-165 (1999).
- Le, V. M., Lang, M. D., Shi, W. B., Liu, J. W. A Collagen-Based Multicellular Tumor Spheroid Model for Evaluation of the Efficiency of Nanoparticle Drug Delivery. Artif. Cells Nanomed Biotechnol. 15, 1-5 (2014).
- Neto, A. I., et al. A Novel Hanging Spherical Drop System for the Generation of Cellular Spheroids and High Throughput Combinatorial Drug Screening. Biomater Sci. 3 (4), 581-585 (2015).
- Janvier, R., Sourla, A., Koutsilieris, M., Doillon, C. J. Stromal Fibroblasts are Required for PC-3 Human Prostate Cancer Cells to Produce Capillary-like Formation of Endothelial Cells in a Three-dimensional Co-culture System. Anticancer Res. 17 (3A), 1551-1557 (1997).
- Doillon, C. J., Gagnon, E., Paradis, R., Koutsilieris, M. Three-dimensional Culture System as a Model for Studying Cancer Cell Invasion Capacity and Anticancer Drug Sensitivity. Anticancer Res. 24 (4), 2169-2177 (2004).
- Gobeil, S., Zhu, X., Doillon, C. J., Green, M. R. A Genome-Wide shRNA Screen Identifies GAS1 as a Novel Melanoma Metastasis Suppressor Gene. Genes Dev. 22 (21), 2932-2940 (2008).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation Of Ready-To-Use, Storable And Reconstituted Type I Collagen From Rat Tail Tendon For Tissue Engineering Applications. Nat Protoc. 1 (6), 2753-2758 (2007).
- Horie, M., et al. Characterization of Human Lung Cancer-associated Fibroblasts in Three-dimensional In Vitro Co-culture Model. Biochem Biophys Res Commun. 423 (1), 158-163 (2012).
- Banyard, J., et al. Identification of Genes Regulating Migration and Invasion Using a New Model of Metastatic Prostate Cancer. BMC Cancer. 30 (14), 387 (2014).
- Palumbo, J. S., Degen, J. L. Fibrinogen and Tumor Cell Metastasis. Haemostasis. 31, 11-15 (2001).
- Dvorak, H. F. Tumor Stroma, Tumor Blood Vessels, and Antiangiogenesis Therapy. Cancer J. 21 (4), 237-243 (2015).
- Luoto, K. R., Kumareswaran, R., Bristow, R. G. Tumor Hypoxia as a Driving Force in Genetic Instability. Genome Integr. 4 (1), 5 (2013).
- Das, V., Bruzzese, F., Konečný, P., Iannelli, F., Budillon, A., Hajdúch, M. Pathophysiologically Relevant In Vitro Tumor Models for Drug Screening. Drug Discov Today. 20 (7), 848-855 (2015).
- Longati, P., et al. 3D Pancreatic Carcinoma Spheroids Induce a Matrix-rich, Chemoresistant Phenotype Offering a Better Model for Drug Testing. BMC Cancer. 13 (95), (2013).
- Tan, P. H., Chia, S. S., Toh, S. L., Goh, J. C., Nathanm, S. S. Three-dimensional Spatial Configuration of Tumour Cells Confers Resistance to Chemotherapy Independent of Drug Delivery. J Tissue Eng Regen Med. , (2013).
- Koutsilieris, M., Reyes-Moreno, C., Choki, I., Sourla, A., Doillon, C., Pavlidis, N. Chemotherapy Cytotoxicity of Human MCF-7 and MDA-MB 231 Breast Cancer Cells is Altered by Osteoblast-Derived Growth Factors. Mol Med. 5 (2), 86-97 (1999).
- Lang, N. R., et al. Biphasic Response of Cell Invasion to Matrix Stiffness in Three-Dimensional Biopolymer Networks. Acta Biomater. 13, 61-67 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados