Method Article
Usando resposta ao toque evocadas e locomoção Os ensaios para avaliar o desempenho muscular e funcional de Zebrafish
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Zebrafish are an excellent model to study muscle function and disease. During early embryogenesis zebrafish begin regular muscle contractions producing rhythmic swimming behavior, which is altered when the muscle is disrupted. Here we describe a touch-evoked response and locomotion assay to examine swimming performance as a measure of muscle function.
Resumo
desenvolvimento muscular Zebrafish é altamente conservada com sistemas de mamíferos, tornando-os um excelente modelo para estudar a função muscular e doença. Muitas miopatias que afetam a função do músculo esquelético pode ser rápida e facilmente avaliada no peixe-zebra ao longo dos primeiros dias da embriogênese. Por 24 horas pós-fertilização (hpf), wildtype peixe-zebra espontaneamente contrair seus músculos da cauda e em 48 hpf, comportamentos de natação controlada apresentam peixe-zebra. Redução na frequência de, ou outras alterações nos, esses movimentos podem indicar uma disfunção do músculo esquelético. Para analisar o comportamento de natação e avaliar o desempenho muscular no desenvolvimento do peixe-zebra no início, nós utilizamos ambos os ensaios de resposta e locomoção de fuga evocada pelo toque.
ensaios de resposta de fuga evocada-Touch pode ser usado para avaliar o desempenho muscular durante os movimentos de ruptura curtas resultantes da contração das fibras musculares de contração rápida. Em resposta a um estímulo externo, o qual neste caso é uma torneira decabeça, peixe-zebra tipo selvagem em 2 dias pós-fertilização (DPF) normalmente exibem um poderoso mergulho explosão, acompanhada de curvas fechadas. O nosso método quantifica a função do músculo esquelético através da medição da aceleração máxima durante um movimento de ruptura natação, a aceleração sendo directamente proporcional à força produzida pela contração muscular.
Em contraste, os testes de locomoção durante o desenvolvimento das larvas de peixe-zebra cedo são utilizados para avaliar o desempenho muscular durante períodos prolongados de actividade muscular. Usando um sistema de rastreamento para monitorar o comportamento de natação, obtém-se um cálculo automatizado da frequência de atividade e distância em 6 dias zebrafish de idade, reflexo de sua função do músculo esquelético. As medições de desempenho natação são valiosas para a avaliação fenotipica de modelos de doenças e de rastreio de alto rendimento de mutações ou tratamentos químicos que afectam a função do músculo esquelético.
Introdução
Ao longo da última década peixe-zebra tem sido cada vez mais usado para estudar a biologia das células musculares e doenças. O desenvolvimento rápido externo do embrião do peixe-zebra, juntamente com a sua clareza óptica, permite a visualização directa da formação de músculo, crescimento e função. O processo de desenvolvimento muscular é altamente conservada no peixe-zebra e isto permitiu a modelagem bem sucedida de uma gama de doenças musculares incluindo distrofias musculares e miopatias congénitas 1-8. A análise detalhada dos modelos de peixe-zebra tem não só proporciona novos insights sobre a pathobiology destas condições, mas também proporcionou uma plataforma para o teste de terapias adequadas 6,9-13.
A análise de modelos de peixe-zebra de doenças musculares depende de ensaios confiáveis e reprodutíveis para medir o desempenho muscular. Estudos anteriores já haviam medido com sucesso a capacidade de geração de força do músculo tronco peixe-zebra em peixes entre 3 e 7 dpf porestimular eletricamente contração de um peixe do imobilizado ligado a um sistema de forças de transdução de 14. Isto pode fornecer medições detalhadas de força, mas não são ideais para experimentos de rendimento mais elevados e há vantagens para medir o desempenho muscular durante a natação. Às 2 dpf muscular peixe-zebra é totalmente funcional e os peixes podem provocar movimentos explosão de natação em resposta a estímulos. O ensaio de resposta de fuga toque-evocar é usado para medir a aceleração durante um movimento de ruptura natação, que pode ser usado como uma medida da força contráctil.
Uma das medidas mais utilizadas da função muscular em pacientes com miopatia é o teste de caminhada de 6 min, que registra a distância total percorrida em uma superfície plana e dura 15,16. Nós aplicamos um teste semelhante para medir a função muscular em 6 dpf larvas do peixe, que nos monitorar a distância total nadado, eo número total de movimentos realizados por cada larva por um período de 10 min. Esta é realizadausando um sistema de seguimento automático, que permite medições fiáveis e de alto rendimento de desempenho muscular. Ambos os testes musculares são altamente reprodutíveis e têm sido usados para quantificar as diferenças no desempenho muscular em modelos miopatia zebrafish 8.
Protocolo
1. Ensaio de resposta evocada-Touch
- Preparação de 2 dpf embriões para ensaio de resposta evocada-Touch
- Certifique-se de que a hora do dia em que o ensaio é efectuado é consistente entre experiências porque a actividade pode variar dramaticamente ao longo do dia 17,18.
NOTA: O experimento deve ser realizado cego e a ordem de ensaio randomizado para minimizar artefatos experimentais. - Atribuir o peixe estirpes um número, que é desconhecida para o indivíduo realizar o experimento. Em seguida, usando ferramentas online disponíveis gratuitamente gerar uma lista aleatória que determina a ordem de ensaio.
- Pelo menos uma hora antes do teste, os embriões dechorionate por rasgando um buraco no cório e puxando o cório além usando um par de pinças finos. Remova todos os detritos da placa de petri antes de voltar ao 28 ° C incubadora.
- Certifique-se de que a hora do dia em que o ensaio é efectuado é consistente entre experiências porque a actividade pode variar dramaticamente ao longo do dia 17,18.
- Execução de ensaio de resposta evocada-Touch
- sta calorGE a 28 ° C, pelo menos, 15 min antes de se iniciar o teste.
NOTA: Esta etapa é temperatura controlada e permanecerá em 28 ° C durante a duração do teste. Temperatura irá afectar a actividade e por isso é importante para manter uma temperatura constante. Se uma fase de aquecimento não está disponível, então a temperatura da água deve ser monitorizada e todas as experiências deve ser conduzido à mesma temperatura. - Coloque uma placa de petri preenchida com meio embrião (NaCl 5 mM, 0,17 mm de KCl, CaCl2 0,33, MgSO 0,33 mM 4 em água) para um estágio iluminado e montar a câmera de alta velocidade através da placa de Petri.
- O lançamento do software de vídeo de gravação da câmera (como o fluxo Pix 5, descrito aqui) e sob a guia "espaço de trabalho", selecione 1.000 quadros por segundo (fps 1000) como a velocidade de captura para assegurar que a ação natação rápida do peixe é gravado.
- Trabalhando com um embrião de cada vez, colocar o embrião no middle do prato Petri com o peixe-zebra claramente visível no campo de visão.
NOTA: Se o embrião nada para longe antes do início do experimento substituí-la por outra, como recapturar e posicionamento do embrião pode resultar em ele se tornar insensíveis ao estímulo e respostas estouro repetidas podem promover a fraqueza muscular em alguns modelos de doenças. - Iniciar a gravação clicando no botão "record" e, entregar o estímulo mecanosensorial ao embrião por tocá-lo suavemente com uma agulha sem corte na parte superior da cabeça.
- Parar a gravação depois que o embrião tem nadado fora do campo de visão ou devolvidos para descansar.
NOTA: Os picos de aceleração dentro do primeiro 0,2 seg da resposta de fuga explodiu após o estímulo mecânico. Por conseguinte, assegurar que, pelo menos durante o primeiro 0,2 seg da resposta de fuga a gravar o peixe é no campo de visão. Usando o software descrito no passo 1.2.3, os dados serão automaticamente salvoscomo um arquivo de vídeo AVI. software de captura de vídeo alternativo, como Captura Free Video ou Softonic, ambos os quais estão disponíveis gratuitamente para download, também poderia ser usado. - Devolver o embrião para uma nova placa de Petri e selecione outro embrião para o teste. Realizar testes em um mínimo de 15 peixes.
- sta calorGE a 28 ° C, pelo menos, 15 min antes de se iniciar o teste.
- Quantificação de comportamento de natação
- Para quantificar o comportamento de natação, inicie o software e selecione o "Single Larvas Locomotion sem subtração de fundo" módulo para abrir o arquivo de vídeo salvo .avi.
- Usando a "mão livre" ou "polígono" ferramenta na barra de menu áreas selecionadas do filme a ser utilizado para a análise. Certifique-se de que a região engloba tanto a posição original do peixe e da área que os peixes vão nadar em. Certifique-se de que a sonda é excluído da área a ser analisada. O software irá automaticamente rastrear a trajetória dos peixes dentro da área desejada.
- Para executar tanálise ele, clique em "experiência" na barra de menu e selecione "executar". Quando solicitado, salve o arquivo de análise de dados em bruto (.phr formato) no local desejado. Uma vez salvo, clique em "Iniciar" para iniciar a análise. Terminar a análise, clicando em "stop" no âmbito do "experimento" no menu suspenso. Uma janela contendo os resultados serão exibidos.
- Role para a direita para obter o valor "aceleração máxima". Se desejar, exportar esses dados, fechando a janela de resultados e clicando no botão "Exportar resultados instantâneos", sob os "resultados" no menu suspenso. Selecione o arquivo de análise de dados em bruto apropriado e clique em aberto. Um arquivo de texto que pode ser aberto em um programa de planilha será salvo na pasta de destino.
- Repita esse processo para cada peixe individual e média para obter a aceleração máxima média para cada estirpe (ver Figura 1).
NOTA: Como uma alternativa para using o software descrito aqui, embalagens semelhantes, tais como o software ImageJ livremente disponível pode ser usado para extrair os dados de movimento relevantes. O plug-in 3D Particle perseguidor pode ser usado para rastrear trajetórias de natação.
2. Locomotion Ensaio - 10 min Swim Teste
- Preparação de 6 dpf embriões para Análise de Natação
- Se necessário, tipo embriões para o genótipo necessário, por exemplo, examinando a expressão de uma proteína fluorescente ou por fenótipo, e colocar numa placa de petri separada (25-30 embriões por placa). Alternativamente, o genótipo pode ser determinado após a conclusão do ensaio de locomoção.
- Aos 3 dpf, re-examinar placas de Petri e remover todos os embriões não eclodidos e detritos. Retorno placas de petri de 28 ° C incubadora até 6 dpf.
- Realizar testes de todas as estirpes entre as 9 e as 12 horas, que é o tempo em que larvas do peixe são mais ativos. Aleatória a ordem de testes e posição no ptardio de tipo selvagem e mutantes amostras para minimizar os efeitos das diferenças circadianos e outros desvios experimentais.
NOTA: É importante que o tempo de teste é consistente entre experiências porque a actividade pode variar dramaticamente ao longo do dia. - Pelo menos 30 minutos antes do teste, as larvas lugar em uma placa de 48 poços com uma larva por poço. Após a transferência, encher os poços de modo a que a superfície da água é logo abaixo da parte superior do poço, assegurando que não existem bolhas. Retorno placas a 28 ° C incubadora.
- Aqui as placas para fora da incubadora e aclimatar à luz durante cinco minutos antes do teste.
- Realizando Locomotion Assay
- Colocar a placa de 48 poços para dentro da câmara de gravação, que está equipado com uma câmara digital infravermelho, capturando-se a 60 quadros / segundo, de modo que as larvas podem ser detectados no escuro. Verificar que todas as cavidades são colocadas dentro da grade circular no software de locomoção e de que todas as larvas são CLEarly detectável.
- O lançamento do software e selecione o módulo "tracking". No "Arquivo", clique em "gerar um novo protocolo" e editar o número de poços utilizados para o experimento. Definir a duração da experiência e do período de integração de 10 min, clicando nos "parâmetros" no menu suspenso e selecionar os "parâmetros de protocolo" e, posteriormente, na guia "tempo". Na mesma caixa de diálogo "parâmetros de protocolo", clique na aba "Opções" e garantir a caixa de seleção "Numeriscope" é clicado após o que, o "parâmetros de protocolo" caixa de diálogo pode ser fechada.
- Para definir as áreas de gravação destacar toda a rede e clique duas vezes em um dos poços. Clique no botão "áreas desenhar" e desenhar em torno do canto superior esquerdo, superior direito, e os poços inferior esquerdo e clique em "construção", que permite que o software para determinar automaticamente a posição de cada poço. Também desenhar em uma escalabar e clique em "aplicar ao grupo". Depois de concluído, clique no botão "desenhar áreas".
- Visualmente determinar o limiar de detecção, deslizando a barra de "limiar de detecção" a um nível em que apenas os movimentos de peixe são realçados com ausência de sinais de fundo.
NOTA: O limiar de detecção irá variar entre linhagens e, assim, os limites têm de ser determinados, sempre que uma nova cepa é testada. Nos dados representativos apresentaram um limiar de detecção de 25 mm / seg foi usada. - Antes de iniciar o teste introduzir limiares de movimento para a detecção de inatividade, e pequenas e grandes movimentos.
NOTA: Nos dados representativos apresentou um limite de inatividade de 6 mm / seg e uma actividade limiar explosão de 30 mm / seg foi usado. Os limiares determinar o movimento mínimo a ser considerado ativo e o nível necessário para ser considerado atividade de explosão e permitir a classificação de atividade em pequena (ativo, mas abaixo activi explosãolimiares ty) e grandes (maior do que o limite de atividade de explosão movimentos). Os limiares podem ser alterados, dependendo da actividade das estirpes particulares de peixes analisados.
Nota: Embora o ensaio pode ser realizado tanto em condições claras ou escuras, larvas de peixe-zebra foram mostrados para ser mais activos no escuro 18. - Definir a intensidade da luz no interior da câmara para ser em 0%, clicando no botão "Configurações de condução de luz", sob os "parâmetros" no menu suspenso. Na caixa de diálogo resultante, adicione as configurações de luz necessários.
NOTA: A intensidade da luz no interior da câmara pode ser acionado para ligar e desligar durante o tempo de teste para estimular a atividade larval - Feche a porta da câmara de gravação e iniciar a gravação de vídeo.
- Quantificação de comportamento de natação
- Após o experimento for concluída, clique em "stop" no âmbito do "experimento" no menu suspenso. A bo diálogox com todos os resultados serão exibidos.
- Para aceder a estes resultados em Excel, clique em "abrir contendo pasta" e abra o arquivo excel que aparece na pasta resultante. Os parâmetros importantes são "smlct" (pequena contagem de movimento), "larct" (grande contagem de movimento), "smldist" (distância total percorrida pelo peixe em pequenos movimentos) e "lardist" (distância total percorrida pelos peixes em grandes movimentos ).
NOTA: Após a gravação, o software retorna também dois ficheiros de saída adicionais sob a forma de um ficheiro de avi (contendo um vídeo da gravação de 10 min) e um ficheiro de imagem PNG (contendo uma representação visual da locomoção durante a 10- min experiência; veja a Figura 2). - Uma vez que os valores de locomoção são calculados, repetir os arquivos .avi e .png a avaliar se os valores de locomoção calculados com precisão retratam os movimentos de natação do peixe (veja a Figura3).
NOTA: Como uma alternativa para usar o software descrito aqui, pacotes, tais como o software ImageJ livremente disponível pode ser usado para controlar o comportamento locomotor.
Resultados
Toque evocado ensaio de resposta pode ser utilizado para determinar a velocidade e aceleração dos movimentos de natação que é uma medida proporcional da força muscular. Em resposta a um estímulo mecânico, tal como uma pequena batida na cabeça 2 dpf tipo selvagem exibem zebrafish uma ação de natação rápida. Vídeos foram capturadas e analisadas por dois diferentes modelos de peixe-zebra: miopatia Tg (ACTA1 D286G -eGFP), um modelo de miopatia nemalínica que tem sido mostrado ter a fraqueza muscular significativa, e um modelo de distrofia muscular de Duchenne onde defeitos musculares graves têm sido descrito a 5 dpf 19,20. Imagens de um vídeo de um toque típico evocado ensaio estão representados na Figura 1A. Aceleração do peixe-zebra foi examinado e considerado de pico no primeiro 0,2 seg da resposta estouro natação escape (Figura 1B). Esta aceleração máxima pico fornece uma medida que é proporcional à força generating capacidade do músculo esquelético. Os valores máximos de aceleração-se a média para se obter um valor máximo de aceleração média (± erro padrão da média) para cada estirpe: Tg (ACTA1 D286G -eGFP): média = 276,0 ± 28,8 m / s 2, n = 3 experiências independentes em duplicado que compreende 15 peixes individual; controle de tipo selvagem: média = 500,8 ± 50,28 m / s 2, n = 3 experiências duplicadas independentes que compreendem 15 peixes individual; DMD PC2 - / - mutante: média = 249,9 ± 19,1 m / s 2, n = 3 experiências duplicadas independentes que compreendem 12-19 peixes individual; DMD PC2 +/- heterozigotos: média = 235,9 ± 8,7 m / s 2, n = 3 experiências duplicadas independentes que compreendem 16-27 peixes individuais; DMD homozigotos PC2 + / + de tipo selvagem: média = 230,9 ± 8,7 m / s 2, n = 3 experiências duplicadas independentes que compreendem 8-27 peixes individuais (Figura 1C). Como esperado, a Tg (D286 ACTA1G -eGFP) peixes foram encontrados para ter uma diminuição significativa na aceleração máxima indicando a função muscular reduzida, o que é consistente com modelos de ratos e os dados dos pacientes 8,21,22. O PC2 DMD - / - peixes mutantes no entanto, não mostrou diferença em aceleração máxima, a 2 dpf, consistente com a detecção de defeitos musculares de 3 dpf 20 (Figura 1D).
Os ensaios foram realizados de locomoção em 6 dpf para determinar a actividade e nadado distância por estirpes de peixes-zebra como uma indicação do desempenho muscular. Após o teste, uma representação em diagrama dos movimentos de natação ao longo do período de teste de dez minutos foi gerado, com linhas vermelhas e verdes representam períodos de movimento lento e rápido, respectivamente, e as linhas pretas representam períodos de inactividade (Figura 2). Individual wildtype alta atividade show de peixe-zebra com relativamente sem períodos de inactividade como opposed para Tg (ACTA1 D286G -eGFP) de peixe, que são menos ativas durante o período de testes (Figura 2B).
O comportamento de natação foi quantificada calculando a média dos valores individuais do número de movimentos ea nadado distância por cada peixe (Figura 3). Ambos, Tg (ACTA1 D286G -eGFP) peixe (Figura 3A e 3B) e DMD PC2 - / - peixe mutante (Figura 3C e 3D) foram encontrados para ter uma diminuição significativa no número médio de movimentos e nadado distância em relação ao seu respectivo controles: Tg (ACTA1 D286G -eGFP) fish: número médio de movimentos = 94,3 ± 13,6, meio distância nadada = 112,9 ± 18,4 mm, de n = 3 experiências duplicadas independentes que compreendem 45 peixes; controles de tipo selvagem: número médio de movimentos = 177,4 ± 14,0, média distância nadada = 300,2 ± 22,8 mm, de n = 3 r independenteexperimentos eplicate que compreendem 45 peixes; DMD PC2 - / - mutante: número médio de movimentos = 163,3 ± 30,0, média distância nadada: 298,4 ± 60,37 mm n = 3 experiências duplicadas independentes que compreendem 12-20 peixes; DMD PC2 +/- heterozigotos: número médio de movimentos = 362,3 ± 38,8, média distância nadada: 660,3 ± 86,1 milímetros n = 3 experiências duplicadas independentes que compreendem 17-27 peixes; DMD homozigotos PC2 + / + de tipo selvagem: número médio de movimentos = 341,9 ± 91,6, média distância nadada = 574,3 ± 170,9 milímetros n = 3 experiências duplicadas independentes que compreendem 8-25 peixe.
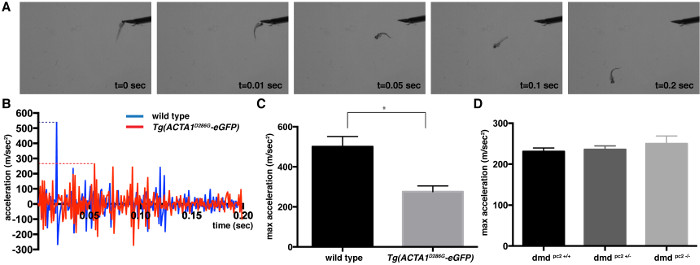
Figura 1:. Quantificação de touch-evocar ensaio de resposta de 2 dpf embriões de peixe-zebra imagens (A) instantâneo de um peixe-zebra controle durante touch-evocar ensaios de 2 dpf. (B) perfil de aceleração para o primeiro 0,2 seg de umúnica Tg (ACTA1 D286G -eGFP) (vermelho) e peixe-zebra de controle único (azul) após a aplicação do estímulo táctil. A aceleração máxima é representado pelas linhas a tracejado. (C, D) Quantificação da aceleração máxima (m / s 2) gravada a partir de ensaios de resposta evocada pelo toque de (C) Tg (ACTA1 D286G -eGFP) e peixe-zebra (D) PC2 DMD - / - peixes mutantes em relação ao controle de peixe-zebra em 2 dpf. As barras de erro representam ± SEM por 3 experiências duplicadas, * p <0,05. Por favor clique aqui para ver uma versão maior desta figura.
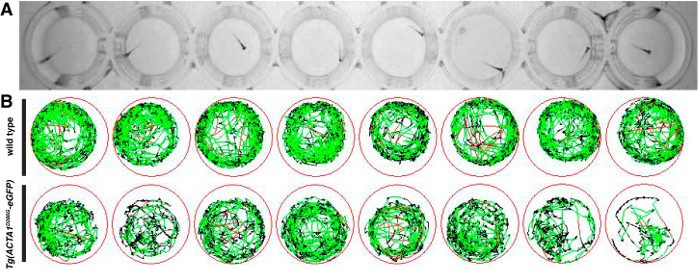
Figura 2:. Representação de ensaios de locomoção para embriões de peixe-zebra (A) Zebrafish embriões são colocados em placas de 48 poços e locomoção é gravado a partir de cima utilizando uma câmara digital infravermelho. (B) Esquema de circulação peixe-zebra durante o período de testes com linhas vermelhas representando movimentos rápidos, linhas verdes que descrevem movimentos lentos e linhas pretas que descrevem inatividade (como determinado pelos limiares de detecção inseridos no software). Por favor clique aqui para ver uma versão maior esta figura.
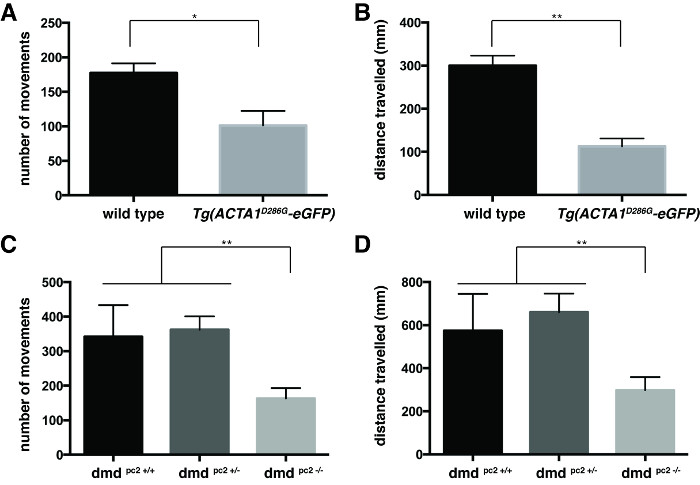
Figura 3:. Quantificação dos ensaios de locomoção para 6 dpf larvas do peixe Quantificação do (A) número de movimentos e (B) distância percorrida pelo Tg peixe-zebra (ACTA1 D286G -eGFP) em relação ao controle de peixe-zebra em 6 dpf.Quantificação do número (C) dos movimentos e (D) distância percorrida pela DMD PC2 - / - peixes mutantes em relação ao controle de peixe-zebra em 6 dpf. As barras de erro representam ± SEM por 3 experiências duplicadas, * p <0,05, ** p <0,01. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Muitos modelos animais diferentes, incluindo ratos, cães, peixes-zebra, moscas e vermes têm contribuído para o nosso entendimento da base genética e molecular de doenças musculares, e ajudou no desenvolvimento de abordagens terapêuticas para combatê-las. O peixe-zebra possui várias vantagens para o estudo da doença muscular. O peixe-zebra fornece um sistema geneticamente manipulável para avaliar padrões músculo complexa em um ambiente fisiológico adequado, o que não é possível em sistemas de cultura in vitro. Ao contrário de outros modelos animais vertebrados, o grande número de peixes produzidos, juntamente com a sua claridade óptica, facilita a rápida, de alto rendimento em química vivo e rastreio genético.
Aqui nós descrevemos o desenvolvimento de ensaios de circulação de peixe-zebra para fornecer um alto throughput e método automatizado para avaliar o desempenho muscular durante a embriogênese peixe-zebra. Para ambos os ensaios deve-se reconhecer que os ritmos circadianos eestímulos ambientais externos irá afectar significativamente o comportamento de natação do peixe-zebra 17,18. Teste repetido do mesmo peixe-zebra também irá conduzir a habituação causando uma diminuição da resposta ao estímulo táctil 23. Por conseguinte, a fim de obter resultados reprodutíveis entre experiências, cada embrião do peixe-zebra só deve ser testado uma vez, o tempo de dia e as condições de iluminação deve ser normalizada, e a temperatura da água tem de ser fortemente regulada.
Usando o toque evocado análise em 2 dpf podemos medir directamente a aceleração máxima de uma acção de ruptura de natação, a qual é proporcional à força muscular. As técnicas anteriores em peixes-zebra foram examinados força muscular, amarrando ambas as extremidades dos embriões a seguinte equipamento experimental que a contração do músculo é estimulado utilizando um campo eléctrico e a capacidade de geração de força do músculo 14 é medido. Embora este método mede a força de capacidade de geração de tele muscular larval, não mede a força real gerada pelo músculo larval durante a natação. Assim, desenvolvemos um método para avaliar indirectamente a força gerada durante o movimento normal de natação das larvas para fornecer uma medida geral de saúde do músculo. O sistema de vídeo de alta velocidade, capaz de gravar os movimentos de peixe-zebra individuais em uma taxa de quadros de 1.000 frames / seg pode ser usado para identificar pequenas, mas significativas diferenças na função muscular, que não são diretamente distinguíveis a olho nu. Será de interesse para ver como relatado anteriormente mudanças na eletroestimulado força geração se correlacionam com mudanças no desempenho de natação.
Além disso, o toque evocado ensaios de resposta também pode ser usado para avaliar a cinemática de natação, tais como a forma e a velocidade de onda do corpo durante o movimento de natação 24, para dar uma medição quantitativa do comportamento locomotor.
Devido ao movimento espontâneo de zebraflarvas ish após 3 dpf, não fomos capazes de realizar os ensaios de toque-evocar para medir a função muscular. Por outro lado, nós medimos o desempenho muscular durante um longo período por determinação da distância nadada por larvas do peixe às 6 dpf. Este teste, embora uma medida indirecta da função muscular, pode ser utilizada para identificar peixes que apresentem o desempenho muscular prejudicada 8 ou neurodegeneração 25,26. Este teste não só fornece uma medição análoga ao teste de 6 min, mas é também adequado para automatizado de alto rendimento em telas de drogas ou de mutagénese in vivo.
Divulgações
The authors have nothing to disclose.
Agradecimentos
We thank Viewpoint for their kind sponsorship of this manuscript. This work was funded by an Australian National Health and Medical Research Council (NHMRC) Project Grant (APP1010110).
Materiais
| Name | Company | Catalog Number | Comments |
| 21 G x 1' Blunt Needle | Terumo/Admiral Medical Supplies | TE2125 | |
| 48-well plates | Sigma | M8937 | |
| 90 mm Petri Dishes | Pacific Laboratory Products PT | S90001 | |
| High Speed Camera | Baumer | HXC20 | |
| http://www.randomization.com | N/A | Steps 1.1.2, 2.1.3 | |
| Incubator | Thermoline Scientific | TEI-43L | |
| Plastic Pipette | VWR | 16001-188 | |
| StreamPix5 | NorPix | Step 1.2.3 | |
| Temperature Control Unit | Viewpoint | ||
| Tweezers, style 8 | ProSciTech | T04-821 | |
| Zebrabox System | Viewpoint | ||
| Zebralab | Viewpoint | Steps 1.3.1, 2.2.1 |
Referências
- Bassett, D. I., Bryson-Richardson, R. J., Daggett, D. F., Gautier, P., Keenan, D. G., Currie, P. D. Dystrophin is required for the formation of stable muscle attachments in the zebrafish embryo. Development. 130 (23), 5851-5860 (2003).
- Gupta, V. A., Kawahara, G., et al. A splice site mutation in laminin-α2 results in a severe muscular dystrophy and growth abnormalities in zebrafish. PLoS ONE. 7 (8), e43794 (2012).
- Gupta, V., Kawahara, G., et al. The zebrafish dag1 mutant: a novel genetic model for dystroglycanopathies. Hum Mol Genet. 20 (9), 1712-1725 (2011).
- Kawahara, G., Karpf, J. A., Myers, J. A., Alexander, M. S., Guyon, J. R., Kunkel, L. M. Drug screening in a zebrafish model of Duchenne muscular dystrophy. Proc Natl Acad Sci. 108 (13), 5331-5336 (2011).
- Telfer, W. R., Nelson, D. D., Waugh, T., Brooks, S. V., Dowling, J. J. neb: a zebrafish model of nemaline myopathy due to nebulin mutation. Dis Model & Mech. 5 (3), 389-396 (2012).
- Ruparelia, A. A., Oorschot, V., Vaz, R., Ramm, G., Bryson-Richardson, R. J. Zebrafish models of BAG3 myofibrillar myopathy suggest a toxic gain of function leading to BAG3 insufficiency. Acta Neuropathol. 128 (6), 821-833 (2014).
- Sztal, T. E., Sonntag, C., Hall, T. E., Currie, P. D. Epistatic dissection of laminin-receptor interactions in dystrophic zebrafish muscle. Hum Mol Genet. 21 (21), 4718-4731 (2012).
- Sztal, T. E., Zhao, M., et al. Zebrafish models for nemaline myopathy reveal a spectrum of nemaline bodies contributing to reduced muscle function. Acta Neuropathol. 130 (3), 389-406 (2015).
- Pichler, F. B., Laurenson, S., Williams, L. C., Dodd, A., Copp, B. R., Love, D. R. Chemical discovery and global gene expression analysis in zebrafish. Nat Biotechnol. 21 (8), 879-883 (2003).
- Peterson, R. T., Shaw, S. Y., et al. Chemical suppression of a genetic mutation in a zebrafish model of aortic coarctation. Nat Biotechnol. 22 (5), 595-599 (2004).
- Kawahara, G., Serafini, P. R., Myers, J. A., Alexander, M. S., Kunkel, L. M. Characterization of zebrafish dysferlin by morpholino knockdown. Biochem Bioph Res Co. 413 (2), 358-363 (2011).
- Zon, L. I., Peterson, R. T. In vivo drug discovery in the zebrafish. Nat Rev Drug Discov. , (2005).
- Smith, L. L., Beggs, A. H., Gupta, V. A. Analysis of skeletal muscle defects in larval zebrafish by birefringence and touch-evoke escape response assays. J Vis Exp. (82), e50925 (2013).
- Sloboda, D. D., Claflin, D. R., Dowling, J. J., Brooks, S. V. Force measurement during contraction to assess muscle function in zebrafish larvae. J Vis Exp. (77), (2013).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test as a new outcome measure in Duchenne muscular dystrophy. Muscle Nerve. 41 (4), 500-510 (2010).
- McDonald, C. M., Henricson, E. K., et al. The 6-minute walk test and other clinical endpoints in duchenne muscular dystrophy: reliability, concurrent validity, and minimal clinically important differences from a multicenter study. Muscle Nerve. 48 (3), 357-368 (2013).
- Hurd, M. W., Debruyne, J., Straume, M., Cahill, G. M. Circadian rhythms of locomotor activity in zebrafish. Physiol Behav. 65 (3), 465-472 (1998).
- MacPhail, R. C., Brooks, J., Hunter, D. L., Padnos, B., Irons, T. D., Padilla, S. Locomotion in larval zebrafish: Influence of time of day, lighting and ethanol. Neurotoxicology. 30 (1), 52-58 (2009).
- Berger, J., Berger, S., Jacoby, A. S., Wilton, S. D., Currie, P. D. Evaluation of exon-skipping strategies for Duchenne muscular dystrophy utilizing dystrophin-deficient zebrafish. J Cell Mol Med. 15 (12), 2643-2651 (2011).
- Berger, J., Sztal, T., Currie, P. D. Quantification of birefringence readily measures the level of muscle damage in zebrafish. Biochem Bioph Res Co. 423 (4), 785-788 (2012).
- Ravenscroft, G., Jackaman, C., et al. Mouse models of dominant ACTA1 disease recapitulate human disease and provide insight into therapies. Brain. 134 (4), 1101-1115 (2011).
- Ravenscroft, G., Wilmshurst, J. M., et al. A novel ACTA1 mutation resulting in a severe congenital myopathy with nemaline bodies, intranuclear rods and type I fibre predominance. Neuromuscular Disord. 21 (1), 31-36 (2011).
- Wolman, M. A., Jain, R. A., Liss, L., Granato, M. Chemical modulation of memory formation in larval zebrafish. Proc Natl Acad Sci. 108 (37), 15468-15473 (2011).
- Müller, U. K., van Leeuwen, J. L. Swimming of larval zebrafish: ontogeny of body waves and implications for locomotory development. J Exp Biol. 207 (Pt 5), 853-868 (2004).
- Cheng, W., Tian, J., Burgunder, J. M., Hunziker, W., Eng, H. L. Myotonia congenita-associated mutations in chloride channel-1 affect zebrafish body wave swimming kinematics. PLoS ONE. 9 (8), e103445 (2014).
- Moggio, M., Colombo, I., et al. Mitochondrial disease heterogeneity: a prognostic challenge. Acta Myol. 33 (2), 86-93 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados