É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A Síntese de hidrogéis RGD-funcionalizado como uma ferramenta para aplicações terapêuticas
Neste Artigo
Resumo
We present a protocol for the synthesis of RGD-functionalized hydrogels as devices for cell and drug delivery. The procedure involves copper catalyzed alkyne-azide cycloaddition (CuAAC) between alkyne-modified polyacrylic acid (PAA) and a RGD-azide derivative. The hydrogels are formed using microwave-assisted polycondensation and their physicochemical properties are investigated.
Resumo
The use of polymers as biomaterials has provided significant advantages in therapeutic applications. In particular, the possibility to modify and functionalize polymer chains with compounds that are able to improve biocompatibility, mechanical properties, or cell viability allows the design of novel materials to meet new challenges in the biomedical field. With the polymer functionalization strategies, click chemistry is a powerful tool to improve cell-compatibility and drug delivery properties of polymeric devices. Similarly, the fundamental need of biomedicine to use sterile tools to avoid potential adverse-side effects, such as toxicity or contamination of the biological environment, gives rise to increasing interest in the microwave-assisted strategy.
The combination of click chemistry and the microwave-assisted method is suitable to produce biocompatible hydrogels with desired functionalities and improved performances in biomedical applications. This work aims to synthesize RGD-functionalized hydrogels. RGD (arginylglycylaspartic acid) is a tripeptide that can mimic cell adhesion proteins and bind to cell-surface receptors, creating a hospitable microenvironment for cells within the 3D polymeric network of the hydrogels. RGD functionalization occurs through Huisgen 1,3-dipolar cycloaddition. Some PAA carboxyl groups are modified with an alkyne moiety, whereas RGD is functionalized with azido acid as the terminal residue of the peptide sequence. Finally, both products are used in a copper catalyzed click reaction to permanently link the peptide to PAA. This modified polymer is used with carbomer, agarose and polyethylene glycol (PEG) to synthesize a hydrogel matrix. The 3D structure is formed due to an esterification reaction involving carboxyl groups from PAA and carbomer and hydroxyl groups from agarose and PEG through microwave-assisted polycondensation. The efficiency of the gelation mechanism ensures a high degree of RGD functionalization. In addition, the procedure to load therapeutic compounds or biological tools within this functionalized network is very simple and reproducible.
Introdução
Os hidrogéis são redes tridimensionais formadas por polímeros reticulados hidrófilos, que são naturais ou sintéticos, e caracteriza-se por uma estrutura tridimensional diferente. Estes dispositivos são cada vez mais atraente nos domínios biomédicos da entrega da droga, engenharia de tecidos, portadores do gene e sensores inteligentes 1,2. Com efeito, o seu elevado teor de água, bem como as suas propriedades reológicas e mecânicas torná-los candidatos adequados para imitar microambientes dos tecidos moles e os tornam ferramentas eficazes para citocina solúvel em água ou entrega do factor de crescimento. Um dos usos mais promissor é como um biomaterial injectável transportando células e compostos bioactivos. Os hidrogeles podem melhorar a sobrevivência de células e o destino celular haste de comando, mantendo e entregar precisamente sinais reguladores de células estaminais de um modo fisiologicamente relevante, tal como observado in vitro e em experiências in vivo 3,4. A vantagem principal da presente é a possibilidadepara manter as células injectadas no interior da zona de inoculação (in situ), minimizando a quantidade de células que deixa a área e extravasa na corrente circulatória, a migração em todo o corpo e perder a baliza 5. A estabilidade das redes tridimensionais de hidrogel é devido aos seus sítios de ligação cruzada, formadas por ligações covalentes ou forças de coesão entre as cadeias de polímero 6.
Neste quadro, química selectiva ortogonal aplicada a cadeias poliméricas é uma ferramenta versátil capaz de melhorar o desempenho de hidrogel 7. Com efeito, a modificação de polímeros com grupos químicos adequados podem contribuir para fornecer químico apropriado, propriedades físicas e mecânicas para aumentar a viabilidade das células e a sua utilização na formação de tecido. Do mesmo modo, entre as técnicas para carregar células ou factores de crescimento no interior da matriz de gel, o uso do péptido RGD permite melhorias na adesão celular e na sobrevivência. RGD é um tripéptido compostade arginina, glicina e ácido aspártico, que é de longe o mais eficaz e, muitas vezes empregue tripéptido devido à sua capacidade para lidar com mais do que um receptor de adesão de célula e o seu impacto na ancoragem biológica de células, o comportamento e a sobrevivência 8,9. Neste trabalho, a síntese de hidrogeles funcionalizada-RGD é estudada com o objectivo de conceber redes caracterizados por propriedades bioquímicas suficientes para um microambiente celular hospitaleiro.
A utilização de radiação de microondas na síntese de hidrogel oferece um procedimento simples para minimizar as reacções laterais e obter taxas de reacção mais elevadas e rendimentos em um período de tempo mais curto em comparação com os processos térmicos convencionais 10. Este método não requer passos de purificação e rendimentos hidrogéis estéreis devido às interacções dos polímeros e na ausência de solvente orgânico no sistema reaccional 11. Por isso, ele garante altas porcentagens de RGD ligados à rede polimérica porque nenhuma modificaçãoficações são necessários para os grupos químicos de polímeros envolvidos na formação de gel. Os grupos carboxilo, a partir de PAA e carbómero, e grupos hidroxilo, a partir de PEG e de agarose, para dar origem a estrutura tridimensional de hidrogel através de uma reacção de policondensação. Os polímeros mencionados são usados para a síntese de hidrogeles na lesão medular tratamentos de reparação 12. Estes dispositivos, como relatado em trabalhos anteriores 13,14, mostram elevada biocompatibilidade, assim como propriedades mecânicas e físico-químicas que se assemelham às de muitos tecidos vivos e na natureza tixotrópica. Além disso, eles permanecem localizadas in situ, na zona de injecção.
Neste trabalho, os grupos carboxilo são PAA modificada com uma porção alcino (Figura 1), e um composto de RGD-azida é sintetizado explorar a reactividade do grupo terminal tripéptido -NH2 com um composto químico com a estrutura preparada (CH 2) n - N 3 ( Figura 2). Subsequentemente, o PAA modificada reage com o derivado azida por meio de RGD CuAAC reacção clique 15-17 (Figura 3). O uso de um catalisador (I) de cobre conduz a uma significativa melhoria tanto na taxa de reacção e a regio-selectividade. A reacção CuAAC é amplamente utilizado em síntese orgânica e em ciência de polímeros. Combina elevada eficiência e elevada tolerância para os grupos funcionais, e não é influenciada pelo uso de solventes orgânicos. A alta seletividade, um tempo de reacção rápida e um procedimento de purificação simples permitem a obtenção de polímeros em estrela, copolímeros em bloco ou cadeias de enxerto fracções desejadas 18. Esta estratégia torna possível clique para modificar polímeros após a polimerização de personalizar as propriedades físico-químicas de acordo com a aplicação bioquímica final. As condições experimentais são CuAAC facilmente reprodutível (a reacção é insensível à água, enquanto que a oxidação de cobre pode ocorrer minimamente), e a natureza dotriazol formado assegura a estabilidade do produto. O uso de metal de cobre pode ser considerado um ponto crítico, devido ao seu possível efeito tóxico contra as células e no microambiente biológica, mas a diálise é utilizado como um método de purificação a fim de permitir a remoção completa dos resíduos catalíticos. Finalmente, o PAA modificada RGD é utilizado na síntese de hidrogel (Figura 4) e as propriedades físico-químicas das redes resultantes são investigados, a fim de verificar o potencial de funcionalidade desses sistemas como células transportadoras ou drogas.
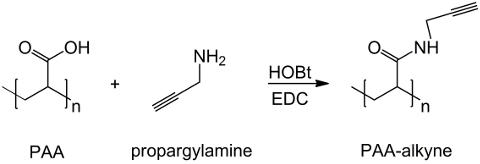
Figura 1: PAA modificado síntese alcino Um esquema de funcionalização PAA com o grupo alcino;. "n" indica os monómeros com um grupo carboxilo reagir com propargilamina. Por favor clique aqui para veruma versão maior desta figura.

Figura 2:.. RGD-azida síntese A síntese de derivado RGD-azida Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: Clique reacção Esquema de reação clique entre derivado RGD-azida e alcino-PAA.. Por favor clique aqui para ver uma versão maior desta figura.

Figura 4: Hidrogel Synthesis. RGD funcionalizado procedimento de síntese hidrogel. Por favor clique aqui para ver uma versão maior desta figura.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Nota: Os produtos químicos são utilizados como recebidos. Linear RGD é adquirida, mas ele pode ser preparado por síntese de péptidos em fase sólida de Fmoc padrão 16,19. Os solventes são de grau analítico. A diálise requer a utilização de membranas com um M W de corte igual a 3500 Da. Os compostos sintetizados são caracterizados por espectros de 1 H RMN registados num espectrómetro de 400 MHz utilizando clorofórmio (CDCl 3) ou óxido de deutério (D 2 O), como solventes, e os desvios químicos são reportados como valores de ô em partes por milhão. Além disso, os hidrogéis são submetidas a análise por FT-IR utilizando uma técnica grânulo de KBr e sua caracterização física envolve estudos de gelificação avaliadas usando o tubo de ensaio invertido a 37 ° C.
1. Síntese de 4-cloreto de 1 Azidobutanoyl
- Dissolve-se 500 mg de 4-azidobutanoic ácido (3,90 mmol) em 10 ml de diclorometano e 0,5 ml de dimetilformamida.
- Arrefece-se a solução a 0 ° C, Usando um banho de gelo.
- Adicionar 505 ul de cloreto de oxalilo (5,85 mmol) a 5 ml de diclorometano e adiciona-se lentamente gota a gota, ao sistema de reacção, enquanto se agitava.
- Após 1 h a 0 ° C usando um banho de gelo, de regresso à temperatura ambiente.
- Remover o solvente sob pressão reduzida utilizando um evaporador rotativo.
- Caracterizar o produto obtido por 1 H-RMN espectroscopia, dissolvendo a amostra em CDCl3 16.
2. Síntese de RGD-azida derivado de 2
- Dissolve-se 50 mg de RGD (0,145 mmol) em 1 ml de NaOH 1M.
- Dissolve-se 24 mg de 1 (0,16 mmol) em 2 ml de tetra-hidrofurano.
- Adicionar toda a solução de RGD a solução 1 gota a gota a 0 ° C usando um banho de gelo.
- Regressar até à temperatura ambiente e agitar durante a noite.
- Adicionar 1 ml de HCl 1M.
- Remover o solvente sob pressão reduzida utilizando um evaporador rotativo.
- Caracterizar a obtained produto por 1 H-NMR espectroscopia, dissolvendo a amostra em D 2 O 16.
3. PAA Alcino Modificação 3
- Dissolve-se 200 mg de 35% w / w solução de PAA (2,8 mmol) em 15 ml de água destilada.
- Adicionar 15,4 mg de cloridrato de propargilamina (0,20 mmol).
- Dissolve-se 42,8 mg de hidrato de 1-hidroxibenzotriazole (HOBt, 0,28 mmol) em 14 ml de uma mistura 1: 1 v / v de acetonitrilo: solução de água destilada por aquecimento a 50 ° C.
- Adicionar toda a solução de HOBt a uma solução de PAA à temperatura ambiente.
- Adicionar 53,6 mg de ethyldimethylaminopropylcarbodiimide (EDC, 0,28 mmol) à mistura de reacção.
- Use HCl a 1 M para ajustar o pH a 5,5 e agita-se o sistema reaccional durante a noite à temperatura ambiente.
- Dializar a solução. Dissolve-se 11,2 g de cloreto de sódio em 2 L de água destilada e, em seguida, adicionar 0,2 ml de 37% w / w de HCl. Dializar a solução através de uma membrana com um M W de corte de 3,5 kDa.
- Perfodiálise rm por três dias. Alterar a solução de diálise por dia com 2 L de água destilada recentemente preparada contendo 0,2 ml de 37% w / w de HCl.
- Armazenar a solução final à temperatura de -80 ° C. Liofilizar-lo num liofilizador de acordo com os protocolos do fabricante.
- Caracterizar o polímero funcionalizado por 1 H-RMN espectroscopia, dissolvendo a amostra em D 2 O 16.
4. Síntese de PAA-RGD 4 Polymer
- Dissolve-se 78 mg de PAA modificada alcino 3 (1,083 mmol) em 10 ml de água destilada.
- Dissolve-se 25 mg de azida do RGD derivado 2 (0,0722 mmol) em 5 ml de tetra-hidrofurano.
- Adicionar toda a solução de RGD com a solução polimérica.
- Adicionar 2,2 mg de iodeto de cobre (0,0116 mmol) e 2,2 mg de ascorbato de sódio (0,0111 mmol).
- Levar ao refluxo a mistura resultante durante a noite a 60 ° C, com agitação.
- Arrefece-se a mistura a 25 ° C.
- DialyzE é a solução. Dissolve-se 11,2 g de cloreto de sódio em 2 L de água destilada e, em seguida, adicionar 0,2 ml de 37% w / w de HCl. Dializar a solução através de uma membrana com um M W de corte de 3,5 kDa.
- Executar a diálise durante três dias. Alterar a solução de diálise por dia com 2 L de água destilada recentemente preparada contendo 0,2 ml de 37% w / w de HCl.
- Armazenar a solução final à temperatura de -80 ° C. Liofilizar-lo num liofilizador de acordo com os protocolos do fabricante.
- Caracterizar o produto obtido por 1 H-RMN espectroscopia, dissolvendo a amostra em D 2 O 16.
5. Hidrogel-RGD funcionalizado Síntese
- Prepare o PBS. Dissolve-se 645 mg de sal de PBS em 50 ml de água destilada.
- Misturar 40 mg de carbómero e 10 mg de 4 PAA funcionalizado em 9 ml de PBS (passo 5.1), à temperatura ambiente, até à dissolução completa (30 min).
- Adicionar 400 mg de PEG para a solução e manter a agitação durante 45 min.
- Pare a agitação e permitir que o sistema se contentar com 30 min.
- Use NaOH 1 N para ajustar o pH para 7,4.
- Para 5 ml da mistura obtida, adicionar 25 mg de pó de agarose.
- Irradiar o sistema com a radiação de microondas a 500 W até ferver, durante um tempo geralmente entre 30 segundos e 1 minuto, e electromagneticamente aquecer até 80 ° C.
- Deixar a mistura exposta a temperatura ambiente até a sua temperatura diminui para 50 ° C e adicionam-se 5 ml de PBS (passo 5.1), a fim de obter uma solução com uma razão de 1: 1 volumétrico.
- Prepare 12 placa contendo cilindros de aço com múltiplas cavidades com um diâmetro de 1,1 cm.
- Aqui alíquotas de 500 ul da solução e coloca-los uns aos cilindros de aço.
- Deixar em repouso durante 45 minutos até completa gelificação do sistema.
- Remover os cilindros utilizando um fórceps de aço inoxidável para se obter os hidrogeles.
6. O carregamento de ferramenta terapêutica (Drug ou células)
- Repita steps 5,1-5,7.
- Quando a mistura (já no estado sol) atinge 37 ° C, adicionam-se 5 ml da solução contendo a cultura de células ou solução de fármaco desejado, a fim de se obter um sistema final numa proporção de 1: 1 volumétrico.
- Repita os passos 5,9-5,12 obter redes poliméricas com biocompostos fisicamente retidas dentro do gel.
7. Hidrogel Caracterização
- Análise de FT-IR
- Após a formação do gel, embeber um dos hidrogéis sintetizados em 2,5 ml de água destilada, durante 24 h.
- Retire os meios aquosos, onde hidrogel é submersas e congelar-seco com líquido N 2.
- Laminar a amostra de hidrogel de acordo com a técnica de grânulo de KBr.
- Adicionar uma espátula cheia de KBr num almofariz de ágata. Aqui uma pequena quantidade da amostra de hidrogel (cerca de 0,1-2% da quantidade KBr, ou apenas o suficiente para cobrir a ponta da espátula) e misturar com o pó de KBr.
- Moer a mistura até que o pó é fina e homogênea.
- Usar o kit grânulo de KBr para formar o pellet IR. Pressionar o pó usando uma prensa de laboratório manual: durante 3 min a capacidade de pressão igual a 5 toneladas e, em seguida, durante 3 min a capacidade de pressão de 10 toneladas.
- Solte a pressão para obter o sedimento final como homogênea e transparente na aparência. Insira o pellet no suporte de amostra do IR e executar o espectro 16.
- Estudos de gelificação
- Encha 2 ml tubo de microcentrífuga com 900 jil de PBS e equilibrar a 37 ° C.
- Adicionar 100 ul da solução de polímero preparada para formar o hidrogel e incubar a 37 ° C.
- Inverter o tubo e observar se o gel flui a 1, 2, 5, 10 e 20 min. Gravar o momento em que o gel não flui como o tempo de gelificação.
Access restricted. Please log in or start a trial to view this content.
Resultados
O derivado de alcino PAA é eficientemente sintetizados a partir do ácido poliacrílico e propargilamina, como mostrado na Figura 1 em que n rotula os monómeros cujos grupos carboxilo reagem com a amina. A identidade do produto é confirmada por 1H-RMN espectroscopia. A Figura 5 mostra o 1 H-RMN espectro de PAA modificada com ligação tripla.
Access restricted. Please log in or start a trial to view this content.
Discussão
The PAA post-polymerization modification with alkyne moieties and the RGD functionalization with the azide group guarantee the formation of a stable bond between the polymer and the peptide. Indeed, triazole serves as a rigid linking unit among the carbon atoms, attached to the 1,4 positions of the 1,2,3-triazole ring and it cannot be cleaved hydrolytically or otherwise. In addition, triazole is extremely difficult to oxidize and reduce, unlike other cyclic structures such as benzenoids and related aromatic heterocycles<...
Access restricted. Please log in or start a trial to view this content.
Divulgações
The authors state no conflict of interest and they have not received any payment in preparation of this manuscript.
Agradecimentos
Autores gostariam de agradecer ao Prof. Maurizio Masi para discussão frutífera e Miss Chiara Allegretti para edição idioma. pesquisa dos autores é apoiado pelo Bando Giovani Ricercatori 2010 (Ministero della Salute GR-2010- 2312573).
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Poly(acrylic acid) solution average Mw ~100,000, 35 wt% in H2O | Sigma Aldrich | 523925 | CAS 9003-01-4 |
| Poly(ethylene glycol) 2,000 | Sigma Aldrich | 84797 | CAS 25322-68-3 |
| Carbomeer 974P | Fagron | 1387083 | |
| Agarose | Invitrogen Corp. | 16500-500 | UltraPure Agarose |
| RGD peptide | abcam | ab142698 | |
| 4-azidobutanoic acid | Aurum Pharmatech | Z-2421 | CAS 54447-68-6 |
| Oxalyl chloride | Sigma Aldrich | O8801 | CAS 79-37-8 |
| Propargylamine hydrochloride 95% | Sigma Aldrich | P50919 | CAS 15430-52-1 |
| Copper(I) iodide | Sigma Aldrich | 3140 | CAS 7681-65-4 |
| Sodium ascorbate | Sigma Aldrich | Y0000039 | CAS 134-03-2 |
| Phosphate buffered saline | Sigma Aldrich | P4417 | |
| Dialysis Membrane | Spectrum Laboratories, Inc. | 132725 | Spectra/Por 3 Dialysis Membrane Standard RC Tubing MWCO: 3.5 kD |
Referências
- Slaughter, B. V., Khurshid, S. S., Fisher, O. Z., Khademhosseini, A., Peppas, N. A. Hydrogels in Regenerative Medicine. Adv. Mater. 21 (32-33), 3307-3329 (2009).
- Rossi, F., Perale, G., Papa, S., Forloni, G., Veglianese, P. Current options for drug delivery to the spinal cord. Expert Opin. Drug Deliv. 10 (3), 385-396 (2013).
- Huebsch, N., et al. Harnessing traction-mediated manipulation of the cell/matrix interface to control stem-cell fate. Nat. Mater. 9 (6), 518-526 (2010).
- Mothe, A. J., Tam, R. Y., Zahir, T., Tator, C. H., Shoichet, M. S. Repair of the injured spinal cord by transplantation of neural stem cells in a hyaluronan-based hydrogel. Biomaterials. 34 (15), 3775-3783 (2013).
- Khetan, S., et al. Degradation-mediated cellular traction directs stem cell fate in covalently crosslinked three-dimensional hydrogels. Nat. Mater. 12 (5), 458-465 (2013).
- Ashley, G. W., Henise, J., Reid, R., Santi, D. V. Hydrogel drug delivery system with predictable and tunable drug release and degradation rates. Proc. Natl. Acad. Sci. U S A. 110 (6), 2318-2323 (2013).
- Rossi, F., van Griensven, M. Polymer Functionalization as a Powerful Tool to Improve Scaffold Performances. Tissue Eng. Part A. 20 (15-16), 2043-2051 (2014).
- Gould, S. T., Darling, N. J., Anseth, K. S. Small peptide functionalized thiol-ene hydrogels as culture substrates for understanding valvular interstitial cell activation and de novo tissue deposition. Acta Biomater. 8 (9), 3201-3209 (2012).
- Azagarsamy, M. A., Anseth, K. S. Wavelength-Controlled Photocleavage for the Orthogonal and Sequential Release of Multiple Proteins. Angew. Chem. Int. Edit. 52 (51), 13803-13807 (2013).
- Larrañeta, E., et al. Microwave-Assisted Preparation of Hydrogel-Forming Microneedle Arrays for Transdermal Drug Delivery Applications. Macromol. Mater. Eng. 300 (6), 586-595 (2015).
- Cook, J. P., Goodall, G. W., Khutoryanskaya, O. V., Khutoryanskiy, V. V. Microwave-Assisted Hydrogel Synthesis: A New Method for Crosslinking Polymers in Aqueous Solutions. Macromol. Rapid Comm. 33 (4), 332-336 (2012).
- Perale, G., et al. Multiple drug delivery hydrogel system for spinal cord injury repair strategies. J. Control. Release. 159 (2), 271-280 (2012).
- Rossi, F., Perale, G., Storti, G., Masi, M. A Library of Tunable Agarose Carbomer-Based Hydrogels for Tissue Engineering Applications: The Role of Cross-Linkers. J. Appl. Polym. Sci. 123 (4), 2211-2221 (2012).
- Frith, J. E., et al. An injectable hydrogel incorporating mesenchymal precursor cells and pentosan polysulphate for intervertebral disc regeneration. Biomaterials. 34 (37), 9430-9440 (2013).
- Kolb, H. C., Finn, M. G., Sharpless, K. B. Click chemistry: Diverse chemical function from a few good reactions. Angew. Chem. Int. Edit. 40 (11), (2001).
- Sacchetti, A., Mauri, E., Sani, M., Masi, M., Rossi, F. Microwave-assisted synthesis and click chemistry as simple and efficient strategy for RGD functionalized hydrogels. Tetrahedron Lett. 55 (50), 6817-6820 (2014).
- Ossipov, D. A., Hilborn, J. Poly(vinyl alcohol)-based hydrogels formed by "click chemistry". Macromolecules. 39 (5), 1709-1718 (2006).
- Truong, V., Blakey, I., Whittaker, A. K. Hydrophilic and Amphiphilic Polyethylene Glycol-Based Hydrogels with Tunable Degradability Prepared by "Click" Chemistry. Biomacromolecules. 13 (12), 4012-4021 (2012).
- Hou, R. Z., et al. New synthetic route for RGD tripeptide. Prep. Biochem. Biotechnol. 36 (3), 243-252 (2006).
- Rossi, F., Chatzistavrou, X., Perale, G., Boccaccini, A. R. Synthesis and Degradation of Agar-Carbomer Based Hydrogels for Tissue Engineering Applications. J. Appl. Polym. Sci. 123 (1), 398-408 (2012).
- Mauri, E., Rossi, F., Sacchetti, A. Tunable drug delivery using chemoselective functionalization of hydrogels. Mater. Sci. Eng. C. 61, 851-857 (2016).
- Joaquin, A., Peppas, N. A., Zoldan, J. Hydrogel Polymer Library for Developing Induced Pluripotent Stem Cell Derived Cardiac Patches. Tissue Eng. Part A. 20, S55-S55 (2014).
- Rossi, F., et al. Tunable hydrogel-Nanoparticles release system for sustained combination therapies in the spinal cord. Colloids Surf. B Biointerfaces. 108, 169-177 (2013).
- Kolb, H. C., Sharpless, K. B. The growing impact of click chemistry on drug discovery. Drug Discov. Today. 8 (24), 1128-1137 (2003).
- Ossipov, D. A., Yang, X., Varghese, O., Kootala, S., Hilborn, J. Modular approach to functional hyaluronic acid hydrogels using orthogonal chemical reactions. Chem. Commun. 46 (44), 8368-8370 (2010).
- Anderson, S. B., Lin, C. C., Kuntzler, D. V., Anseth, K. S. The performance of human mesenchymal stem cells encapsulated in cell-degradable polymer-peptide hydrogels. Biomaterials. 32 (14), 3564-3574 (2011).
- Caron, I., et al. A new three dimensional biomimetic hydrogel to deliver factors secreted by human mesenchymal stem cells in spinal cord injury. Biomaterials. 75, 135-147 (2016).
- Lee, J. W., Kim, H., Lee, K. Y. Effect of spacer arm length between adhesion ligand and alginate hydrogel on stem cell differentiation. Carbohyd. Polym. 139, 82-89 (2016).
- Liu, Y., Fan, Z., Wang, Y., Yu, L. Controlled Release of Low Molecular Protein Insulin-like Growth Factor-1 through Self-Assembling Peptide Hydrogel with Biotin Sandwich Approach. J.Biomed. Eng. 32 (2), 387-392 (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados