Method Article
Imagiologia G protein-coupled receptor mediada por quimiotaxia e seus eventos de sinalização em células de HL60 de Neutrófilos-like
Neste Artigo
Resumo
ensaios de quimiotaxia visuais são essenciais para um melhor entendimento de como as células eucarióticas controlar a migração celular mediada por direccional quimioatractor. Aqui, descrevemos métodos detalhados para: 1) em tempo real, monitoramento de alta resolução de vários ensaios de quimiotaxia, e 2) visualizando simultaneamente o gradiente quimioatrativo ea dinâmica espaço-temporais de eventos de sinalização em células HL60 neutrófilos-like.
Resumo
Eukaryotic cells sense and move towards a chemoattractant gradient, a cellular process referred as chemotaxis. Chemotaxis plays critical roles in many physiological processes, such as embryogenesis, neuron patterning, metastasis of cancer cells, recruitment of neutrophils to sites of inflammation, and the development of the model organism Dictyostelium discoideum. Eukaryotic cells sense chemo-attractants using G protein-coupled receptors. Visual chemotaxis assays are essential for a better understanding of how eukaryotic cells control chemoattractant-mediated directional cell migration. Here, we describe detailed methods for: 1) real-time, high-resolution monitoring of multiple chemotaxis assays, and 2) simultaneously visualizing the chemoattractant gradient and the spatiotemporal dynamics of signaling events in neutrophil-like HL60 cells.
Introdução
As células eucarióticas sentir e se mover em direção a concentração mais elevada dentro de um gradiente de quimioatrativo, um processo celular referido como quimiotaxia. Quimiotaxia desempenha um papel crítico em diversos processos fisiológicos, tais como a embriogénese 1, neurónio padronização 2, a metástase de células cancerosas 3, o recrutamento de neutrófilos a locais de inflamação 4, e o desenvolvimento do organismo modelo Dictyostelium discoideum 5. Em geral, as células eucarióticas sentir quimioatractores utilizando receptores acoplados à proteína G 5. O acoplamento de quimioatractores com estes receptores promove a dissociação das proteínas G heterotriméricas Gu e Gβγ, que por sua vez activam as vias de transdução de sinal a jusante que, em última instância regulam a organização espaço-temporal do citoesqueleto de actina para dirigir a migração de células 9/5.
biólogos celulares têm vindo a desenvolver e melhorar chemotaxé ensaios para examinar o modo como medeia receptor acoplado a proteína G (GPCR) de sinalização dirigidas a migração celular. O ensaio de câmara ou migração transpoço Boyden foi desenvolvido em 1960 por Boyden 10. O ensaio funciona através da criação de um gradiente de compostos quimioatractivas entre dois poços que são separados por uma membrana microporosa. A sua simplicidade e facilidade de uso tornam o ensaio de quimiotaxia mais utilizado até à data. No entanto, o ensaio não permite que o processo de migração das células para ser visualizado. A câmara de Zigmond é o primeiro dispositivo microfluídico visual que permite imagens claras da migração celular em uma lamela através de uma constrição estreita em direção a um quimioatrativo fonte 11. Dunn 12 e 13 Insall modificada e melhorada a alta-resolução e capacidade de imagiologia de longo prazo do ensaio de quimiotaxia câmara Zigmond. Devido às características altamente previsíveis, difusão dominante de fluxo de fluido, microfluídica tem sido fornecendo soluções para a próxima geraçãem ensaios de quimiotaxia, tais como o EZ-TAXIScan (um dispositivo de análise de mobilidade celular).
Com a estabilidade do gradiente assegurada, o dispositivo permite seis ensaios de quimiotaxia de ser realizadas simultaneamente (Figura 1A). Em contraste com os gradientes direccionalmente fixos gerados nos vários ensaios câmara acima, o ensaio de agulha ou micropipeta desenvolvido por Guenther Gerisch gera um gradiente com uma fonte de móvel 14. No ensaio, quimioatractora é libertado a partir de uma micropipeta móvel para gerar um gradiente estável. Com este ensaio agulha, os pesquisadores descobriram que as células diferentes gerar pseudopods com características fundamentalmente diferentes. Aplicando a microscopia fluorescente, fomos capazes de visualizar a inclinação para facilitar a sua medição quantitativa todo 15. Neste estudo, descrevemos métodos detalhados para preparar HL60 quimiotático células (leucemia promielocítica humana), o monitoramento simultâneo múltiplos assa quimiotaxiays com o dispositivo de análise da mobilidade celular, e visualizando a dinâmica espaço-temporais mediada por GPCR de moléculas de sinalização, tais como a proteína quinase D1 em células vivas individuais, em resposta a estímulos visíveis quimioatractivas, espaço-temporalmente controlável. Os nossos métodos avançados de imagem pode ser aplicado a estudos de quimiotaxia gerais, e são especialmente adequados para os sistemas de células de mamíferos.
Protocolo
1. Cultura e diferenciação de neutrófilos humanos, como células HL60
- Prepare RPMI (Roswell Park Memorial Institute) 1640 meio de cultura que contém RPMI 1640, 10% (v / v) de soro fetal de bovino (FBS), piruvato de sódio 0,1 mM e HEPES 25 mM (ácido 4- (2-hidroxietil) -1 ácido -piperazineethanesulfonic). Aquece-se a cultura meio RPMI 1640-37 ° C.
- Usando um hemocitómetro determinar a densidade celular de células HL60 para se certificar que as células estão na fase de crescimento log-fase.
NOTA: As células são geralmente em fase log no terceiro dia após passaging. A densidade de células em fase logarítmica é geralmente 6-8 x 10 5 culas / ml. A densidade celular necessária para iniciar uma nova cultura é de cerca de 1,5 x 10 5 culas / ml.
NOTA: Por exemplo, para um 10 ml de nova cultura num balão plana T-75, se a densidade celular de células em fase logarítmica é 6 x 10 5 culas / ml, em seguida, 2,5 ml de células em fase logarítmica (6 x 10 5 ) é diluído a 1,5 x 10 5 culas / ml em 10 ml nova cultura. Para fazer um volume final de 10 ml de cultura, 7,5 ml de meio de cultura RPMI 1640 é adicionado. - Colocar o volume calculado de meio de cultura RPMI 1640 aquecido num balão plana. Para um balão de cultura T-75 plana, do volume total da cultura de células é de 10 ml.
- Adicionar o volume calculado de células HL60 log-fase de crescimento para o balão plana para atingir uma densidade celular de 1,5 x 10 5 culas / ml.
- Incubar as células a 37 ° C numa incubadora humidificada com 5% de CO 2.
NOTA: O tempo de duplicação de HL60 é quase 24 horas. - Passagem as células com meio de cultura RPMI 1640 a cada 2-3 dias. É importante que a densidade celular das células HL60 nunca excede 1,5 x 10 6 culas / ml e a passagem de células não mais de 2 meses dura.
- Diferenciar as células HL60 5 dias antes das experiências.
NOTA: meio RPMI 1640 diferenciação contém RPMI 1640, 10% (v / v) de soro fetal de bovino (FBS), piruvato de sódio 0,1 mM, H 25EPES, e 1,3% de dimetilsulfóxido (DMSO). Em outras palavras, é de 1,3% de DMSO em meio de cultura RPMI 1640.- Para diferenciar as células HL60, pré-aquecer o meio de cultura RPMI 1640 e 37 ° C. Adicionar o meio de cultura RPMI 1640 aquecido num balão plana.
- Para uma 10 ml de cultura final diferenciação de HL60, adicionar 130 ul de DMSO directamente ao meio de cultura RPMI 1640 no balão plana durante a agitação do balão de modo a que o DMSO é rapidamente diluída por o meio de cultura RPMI 1640.
- Adicionar células HL60 log-fase para uma densidade celular final de 1,5 x 10 5 culas / ml em 10 ml de meio RPMI 1640 a diferenciação final. Cultura das células HL60 em meio RPMI 1640 diferenciação a 37 ° C numa incubadora humidificada com 5% de CO 2 durante 5 dias.
2. revestindo a superfície da tampa de vidro da Câmara 4well
- Pegue a garrafa da solução de gelatina a 2% do frigorífico, limpá-lo com álcool 70%, e colocá-lo na capa. Take solução de gelatina 1 ml de 2% e retornar a solução de gelatina restante para o frigorífico imediatamente.
- Permitir que a solução de gelatina para liquefazer completamente a 37 ° C e pipeta-lo completamente. Dilui-se a solução de gelatina a 2% da solução de sal equilibrada com 9 ml pré-aquecido 1x de Hanks (HBSS) tampão até uma concentração final de 0,2% de gelatina.
- Adicionar 0,5 ml ou 2 ml de 0,2% de gelatina em HBSS para as duas cavidades meio de uma câmara de quatro poços ou de uma câmara 1 poços com uma tampa de vidro na parte inferior, respectivamente. Inclinar as placas em várias direcções de modo a que o líquido cobre toda a superfície.
- Colocar as placas num incubador a 37 ° C. As placas estará pronto para utilização em 1 h. Eles podem ser usados para até 5 dias. Pouco antes de células de semeadura, remova a solução de gelatina a partir dos 4 poços ou 1-bem câmaras.
3. Ensaio de Quimiotaxia Usando celular dispositivo de análise Mobilidade
- Preparar e aquecer RPMI 1640 fome médio, que é RPMImeio contendo piruvato de sódio 0,1 mM (facultativo) e HEPES 25 mM.
- Preparação de 100 ul de 100 nM de fMLP (N-formilmetionilo-leucil-fenilalanina) em RPMI 1640 meio de fome.
- Preparar 3 ml de 1% de albumina de soro bovino (BSA) / meio RPMI 1640 que contém 1% de BSA em meio RPMI 1640 fome meio e 10 ml de BSA a 0,1% / RPMI 1640.
- Revestimento uma lamela quadrado 22 mm e um chip de mobilidade celular dispositivo de análise com 5 uM recentemente preparada BSA a 1% / meio RPMI 1640 durante 1 h à TA.
- Monte o suporte, usando o seguinte procedimento:
- Posicione a base do porta com as alavancas na posição vertical, de modo que as alavancas pode inclinar em direção ao usuário. Aplicar a solução de etanol a 70% para a superfície do vidro de 41 milímetros. Cuidadosamente limpe as superfícies com um pano, tomando cuidado para não arranhar-los.
- Insira o vidro 41 mm dentro da base do porta. Coloque a lamela quadrado 22 milímetros BSA revestido na parte superior do vidro 41 milímetros na base do suporte.
NOTA: O quadrado revestido coverslip entre o vidro de 41 milímetros e o chip permite a quimiotaxia de ocorrer no substrato da superfície de revestimento. - Inserir o anel de vedação (pequena) para o fundo do alojamento de bolacha, e a montar a cobertura da bolacha para a base de suporte, com o furo elíptico na parte traseira. Puxe a nível interior da base do porta para a frente para a posição horizontal para bloquear a caixa wafer na posição.
- Funda o pó do interior do alojamento da bolacha com um espanador de ar. Adicionar 4 ml de BSA a 0,1% / RPMI 1640 para dentro do alojamento da bolacha.
- Montar o chip do dispositivo de análise da mobilidade celular BSA-revestidos no centro do alojamento da bolacha com a face para baixo estrutural em contacto com o vidro.
NOTA: que o chip tem de ser inserido com a marca de posicionamento (o furo no topo do chip) na parte traseira. - Apor o anel de vedação de borracha para o fundo do grampo bolacha ajustando as duas saliências sobre a junta de vedação de borracha para os buracos.
- Montar o anel de vedação (grande) parao topo do alojamento da bolacha. Montar a braçadeira de wafer com o orifício do sensor na parte traseira. Puxe a alavanca externa da base da caixa para a frente para a posição horizontal para bloquear a braçadeira de wafer no lugar.
- Após a montagem do suporte, colocar o fundo do recipiente na caixa de luz para confirmar que não há bolhas de ar nos poços. Se forem detectados bolhas de ar, removê-los utilizando a seringa de plástico fornecido equipado com uma ponta de carregamento de amostra.
- Remover a tampa e colocar o conjunto na placa na parte superior da unidade de dispositivo de análise da mobilidade celular. Fixe o bloco do sensor ao titular.
- Preparar células HL60 para Ensaio de Quimiotaxia:
- Calcula-se a densidade celular das células HL60 diferenciadas com um hemocitómetro. Após 5 dias de diferenciação, a densidade das células é de cerca de 1,0 X 10 6 células / ml.
- Calcular o volume final de células HL60 a uma densidade celular final de 2 x 10 6 culas / ml. Por exemplo, se a densidade celular docélulas HL60 diferenciadas é de 1,0 X 10 6 células / ml, em seguida 10 ml de células HL60 diferenciadas vai ser ressuspensas com 5 ml de 0,1% de BSA médio / RPMI 1640 para atingir 2 x 10 6 culas / ml.
- Centrifugar células HL60 diferenciadas em 200 xg durante 5 min à TA. Remover o sobrenadante e ressuspender as células com o volume calculado de 0,1% BSA / meio RPMI 1640, no passo 3.6.2) para uma densidade celular final de 2 x 10 6 culas / ml.
- Inicie a unidade dispositivo de análise da mobilidade celular e PC para aquisição de imagem. Conecte o aparelho ao PC. Ligue o dispositivo de análise de mobilidade celular. Ligue o PC.
- Inicie o celular Análise Mobility Device Software.
- Observe 5 painéis de controle: as imagens da câmera, aquecedor, tiro, memorando, e câmera.
- No painel de controle da imagem da câmera, use "linha horizontal" ou "linha vertical" para ajustar a posição titular / vista em tempo real para centralizar a câmera no painel de imagem da câmara.
- No painel de controle da câmera, selecione CH1 a CH6 para mover a câmera para o canal definido. Para centralizar a visão campos de um canal, clique em "Move L" ou "Mover R" para ajustar a coordenada X da câmera e centralizar a posição da câmera horizontalmente.
- Ajuste a coordenada Y da câmera girando o botão de posição no painel frontal da unidade de dispositivo de análise da mobilidade celular para ajustar verticalmente a imagem para o centro da tela.
- No painel de controlo do aquecedor, definir o "Temp suporte" a 37,0 ° C e a "temperatura placa" a 39 ° C. Clique em "Heat" para iniciar o aquecimento. Também clique em "suporte" para controlar a temperatura usando o sensor térmico ligado ao suporte.
- No painel de tiro, digite "15 sec" no "Intervalo" e "30 min" a "Time" para os intervalos e a duração do ensaio de quimiotaxia. Marque a opção "aquecedor desligado no final do tiro" por razões de segurança. Designar um detino para as imagens armazenadas.
- No painel de notas, de entrada as especificidades das experiências, como a linha celular utilizada, com ou sem tratamento foi aplicado, e a concentração de quimio-atrativos aplicada.
- Confirmar a posição do centro de todos os canais que serão utilizados nas experiências, e repetir o ajuste de todos os canais, se necessário.
- Injectar e alinhar as células da seguinte forma:
- Remover o tampão a partir do suporte, e tirar 8 ul de tampão do terceiro poço a partir do topo para cada canal.
- Utilize uma seringa para injectar 2 uL de células para o segundo poço no mesmo canal ao mesmo tempo o controlo da tela em tempo real para controlar o número de células e fluir durante a injecção. Depois que as células estão bem alinhados, imediatamente adicionar 8 mL de tampão de volta. Repetir o mesmo procedimento para os outros canais (Figura 1B).
- Adicionar 2 ml de tampão de volta para o titular, e adicionar 1 ml de 100 nM fMLP para o terceiro poço a partir do topo. Comece aquisição de imagem e salvar os dados. Analisar os dados obtidos utilizando o rastreio de software 9 imagem (Figura 2).
4. A transfecção com electroporação
- Diferenciar células HL60 5 dias antes do experimento, como descrito na Seção 1. O revestimento 4 poços ou 1-bem câmaras conforme as instruções na Seção 2.
- Preparar e meio RPMI 1640 recuperação electroporação quente, que contém RPMI 1640, 20% (v / v) de FBS, piruvato de sódio 0,1 mM e HEPES 25 mM, a 37 ° C.
- Logo antes de iniciar a experiência de transfecção, quer adicionar 300 uL ou 3 ml de meio de cultura RPMI 1640 nas cavidades dos quatro poços ou câmaras 1 poços pré-revestidas, respectivamente.
- Incubar as câmaras numa atmosfera humidificada a 37 ° C incubadora com 5% de CO 2. Use estas câmaras imediatamente ou loja na incubadora para uso futuro (duas semanas).
- Contagem de a densidade celular do HL6 diferenciada0 células com um hemocitómetro.
NOTA: A densidade celular atinge muitas vezes cerca de 1,0 X 10 6 células / ml. A densidade celular maior do que 3,0 x 10 6 células / ml, normalmente dá eficiência de transfecção indesejável. Como as células HL60 são células em suspensão, sem resuspensão é necessária. - Centrifugar as células em 200 xg durante 5 min à TA. Remover o sobrenadante e ressuspender 2 X 10 6 células HL60 em 100 ul de reagente de transfecção.
- Adicionar 4 g de GFP-PKD1 plasmídeo 9 para a mistura de 100 ul de células e reagentes de transfecção e misturar suavemente e cuidadosamente. Adicionar a mistura na cuvete prevista.
- Seleccionar o programa pré-estabelecido pelo fabricante para a linha celular de leucócitos humanos e realize a eletroporação.
NOTA: Mais informações estão disponíveis no site do fabricante. - Após a electroporação, imediatamente e cuidadosamente adicionar pré-aquecido a 500 ul de RPMI 6140 meio de recuperação electroporação para as células, egentilmente transferir as células da cuvete para um tubo de 1,6 mL com as pipetas de plástico fornecidos.
- Incubam-se as células durante 30 min numa atmosfera humidificada de 37 ° C incubadora com 5% de CO 2. Semente de 100 uL ou de 500 uL de células em um poço de uma 4-poço ou uma câmara 1 poços, respectivamente.
- Adicionar meio de cultura RPMI 1640 para um volume final de 1 ml ou 4 ml a que mesmo um poço de quatro poços ou de uma câmara 1-poço, respectivamente. Incubam-se as células numa atmosfera humidificada a 37 ° C incubadora com 5% de CO 2 durante 3 h. Pré-quente RPMI 1640 morrendo de 37 ° C.
- Usando uma pipeta de 1 ml, remover suavemente 0,8 ml ou 3 ml de meio RPMI 1640 a cultura a partir do poço de uma câmara de quatro poços ou de uma câmara 1-poço, respectivamente. Seja gentil e evitar sugando as células HL60 aderentes.
NOTA: As células HL60 crescer e se diferenciam em meios de suspensão. Depois de ser diferenciadas ou com certos tratamentos, as células HL60 aderir ao substrato revestido com polilisina, colagénio, gelatina, ou fibronectin. - Adicionar 0,8 ml ou 3 ml de meio RPMI 1640 esfomeados meio para dentro do poço de uma câmara de quatro poços ou de um bem-, respectivamente. Espera 1 h.
NOTA: Neste ponto, as células estão prontos para experimentos com imagens 9.
5. Acompanhamento GPCR mediada Membrane translocação de PKD1 pela Multi-channel Microscopia fluorescente
- Prepara-se uma nova mistura de 100 nM de fMLP e 1 ug / mL de Alexa 594 em RPMI 1640 meio de fome como estímulos.
NOTA: A mistura de fMLP e Alexa 594 precisa ser acabado de fazer para assegurar a máxima eficácia. - Monte uma câmara de 4 poços semeados com células de mais de uma lente de óleo de 40X.
- Defina o Fluorescente Microscópio na Configuração Multichannel da seguinte forma:
- Defina o canal verde de emissão (500-530 nm) para GFP PKD1, canal de emissão vermelha (580-620 nm) para quimioatrativo fMLP (Alexa 594) e canal de luz transmitida para a identificação de células HL60 aderentes.
- Comece aquisição "ao vivo" eotimizar as condições de aquisição dos três canais:
- Afinar entre intensidade e potência do laser para todos os três canais para minimizar photobleach por um longo período de imagem.
- Se necessário, média a cada 2 a 4 quadros para diminuir o ruído de fundo para melhor qualidade das imagens. Usar um intervalo de 1 seg.
- Pesquisar por células que expressam forte PKD1-GFP na vista do canal GFP e DIC (diferencial de contraste de interferência) aderindo. As células aderentes são morfologicamente plana e não se movem rapidamente.
- Após a identificação de células que aderem HL60 que altamente expressa GFP-PKD1, optimizar a condição de aquisição, diminuindo a potência do laser, enquanto aumenta o ganho do detector para cada canal para diminuir o fotobranqueador para imagiologia de longo prazo (Figura 3A).
- Tome-se 100 ul de fMLP / Alexa 594 solução com uma pipeta ul 200 e reserve. Seleccione a "aquisição de lapso de tempo" e definir os intervalos para2 segundos e o número de quadros a adquirir a 100.
NOTA: os intervalos e número de quadros para adquirir dependem fins de experimentação. 1-2 intervalos seg e 100 quadros são muitas vezes utilizados para experiências de imagiologia, tal como na Figura 3. Para as células de migrar lentamente, intervalos mais longos são necessários para a imagem latente a longo prazo. Em contraste, as células para migrar rapidamente, intervalos mais curtos são requeridos para observar os detalhes contínuas da migração celular. - Cuidadosamente tirar a tampa de uma câmara de quatro poços de modo a que a posição da câmara não é alterado. Começar imediatamente a aquisição e adquirir 3-5 imagens das células não estimuladas ao posicionar a pipeta 200 uL directamente sobre as células, utilizando o ponto de luz laser como um guia.
- Pipeta a mistura fMLP / Alexa 594 sobre as células a ser fotografada com um rápido e até mesmo fluxo e terminar o conjunto completo de aquisição de lapso de tempo. Nomear e salvar os dados que vão ser submetidos a uma análise mais aprofundada dos dados.
6. As células de imagem Chemotaxing em Estímulos quimio-atrativo visíveis e controláveis
- Usando um 10 jul micropipetter e injeção dicas, aterrar uma micropipeta com 30 ul mistura de fMLP e Alexa594 preparados na hora.
- Anexar a micropipeta com uma micropipeta suporte montado no topo de uma fase de microscópio e ligue o tubo à unidade de fornecimento de pressão, um aparelho que proporciona uma pressão constante para libertar solução fMLP / Alexa594 da micropipeta para gerar um gradiente constante.
- Ligue a alimentação de pressão e ajustar a pressão de compensação (Pc) a 70 hPa.
- Montar uma lamela 1-septadas bem semeadas com células HL60 que expressam PKD1-GFP sobre uma lente de 40X em óleo de um microscópio confocal ou o seu equivalente microscópio de fluorescência.
- Definir aquisição no modo de canal na seguinte configuração: canal verde (500-530 nm) para PKD1 GFP; canal vermelho (580-620 nm) para quimioatrativo fMLP (Alexa594); e transmetidos canal de luz para a identificação de células HL60 aderentes.
- Comece aquisição "ao vivo" e optimizar as condições de aquisição para os três canais: ajustar as intensidades de cada canal para análise quantitativa de dados de imagem; Afinar entre intensidade e potência do laser para todos os três canais para obter imagens com a melhor qualidade e minimizar o foto-branqueamento. Se necessário, em média, a cada 2 a 4 quadros para uma melhor qualidade de imagem. Normalmente, usamos um intervalo de 1 seg.
- Comece aquisição "ao vivo" e procurar por células que expressam forte PKD1-GFP na visão da GFP e os canais de luz transmitida aderindo. Usando óptica de campo claro, o centro de micropipeta no centro do campo de visão (figura 4A), a fim de visualizar o gradiente de fMLP e as células HL60 que expressam aderentes PKD1-GFP.
- Escolha aquisição de lapso de tempo e definir os intervalos para intervalos de 2 segundos e o número de quadros para adquirir a 100.
NOTA: Depois de recolher cada tsérie ime-lapso, nome e salvar os dados que vão ser submetidos a uma análise mais aprofundada dos dados.
Resultados
imagiologia simultânea de quimiotaxia de várias células HL60 usando o dispositivo de análise da mobilidade celular
Com base no princípio de microfluidos 16, o fabricante tem proporcionado perfis simulados de gradientes: um gradiente é gerado dentro de 1 min, estabilizado dentro de 5 min, e mantido durante 2 horas. Os perfis altamente previsíveis dos gradientes estáveis gerados por múltiplos ensaios de microfluidos permitir quimiotaxia para ser levada a cabo simultaneamente. No presente estudo, observou-se três ensaios de quimiotaxia simultâneas (Figura 2A e Filme 1). Verificou-se que células HL60 chemotaxing começou imediatamente após o quimioatraente foi injectada na cavidade do quimioatractor, e manteve chemotaxing num caminho recto para os 60 minutos seguintes, consistente com os resultados da simulação para estabilidade gradiente. Traçando o caminho de viagens e morfologiadas células permite medições quantitativas e posterior comparação dos comportamentos de quimiotaxia utilizando um índice de quimiotaxia que inclui comprimento total caminho, velocidade, direccionalidade, e arredondamento das células (Figura 2B). comprimento do percurso total é a soma dos comprimentos dos segmentos de linha que liga o centróide do caminho. A velocidade é obtida dividindo-se o comprimento total do caminho pelo tempo. Direccionalidade é medido para cima e é definida como: (coordenada Y do final do caminho menos coordenada Y do início) dividido pelo comprimento total do caminho. Isto dá 1,0 para um objeto em movimento diretamente para cima. O grau de arredondamento da célula é uma medida (em percentagem) de aumento da eficiência de uma dada quantidade de perímetro inclui a área. Um círculo tem a maior área para um dado perímetro e tem um parâmetro de arredondamento de 100%. Uma linha reta encerra nenhuma área e tem um parâmetro de arredondamento de 0%. Nós mostramos o comportamento quimiotaxia quantitativamente medido como descrito pelos parâmetros de quimiotaxia selecionados(Figura 2C).
Monitorização de PKD localização subcelular das células HL60 sob um estímulo fMLP espaço-temporalmente visível e controlável
É um grande avanço técnico relativas fluorescente etiquetado e estimulação quimioatrativo controlável a um sistema experimental. Historicamente, temos aplicado tanto a estimulação homogênea (também chamado de uniforme) ou estimulação gradiente para observar a resposta celular e comportamentos. No entanto, a estimulação "cego" não só não fornece nenhuma informação espácio-temporal sobre como o estímulo atinge as células, mas também lança dúvidas sobre todas as observações "anormais" de resposta celular à estimulação, simplesmente porque não vemos o estímulo. Nós mostramos anteriormente que corante fluorescente (Alexa594) pode ser aplicado com quimioatractor para estabelecer uma relação linear entre a concentração de quimioatraente e monitored intensidade corante fluorescente 15. Com uma configuração de aquisição da proteína fluorescente verde (GFP), uma emissão vermelha do corante fluorescente (Alexa594), e luz transmitida, que são capazes de monitorizar as células aderentes, a aplicação do estímulo e a resposta celular ao estímulo (Figura 3A). Proteína quinase D é uma família de serina / treonina-quinases que desempenham papéis essenciais na migração celular dirigida 9,17. Em resposta a estimulação aplicada uniformemente fMLP (vermelho), células HL60 mediar uma translocação membrana robusta de GFP marcada com proteína cinase D1 (verde) (Figura 3B e Filme 2). Em um gradiente de fMLP (vermelho) (Figura 4A), células HL60 recrutamento activo de PKD1 para a extremidade superior (Figura 4B e Filme 3). Uma comparação cuidadosa da localização sub-celular de GFP na saliência da borda anterior indica que a PKD1 localiza na parte de trás do bordo de ataque (A Figura 4C).
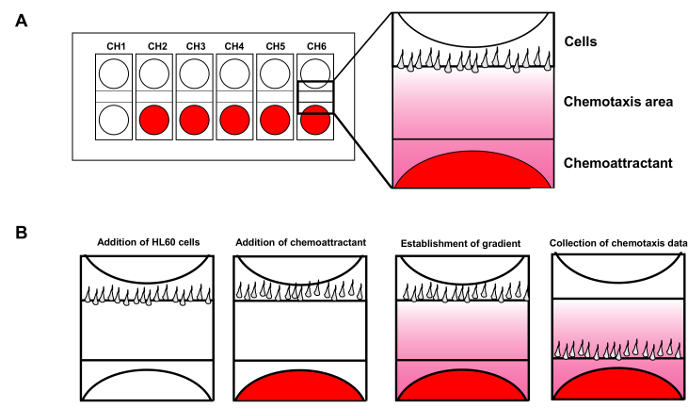
Figura 1. celular dispositivo de análise mobilidade permite até 6 ensaios de quimiotaxia simultâneas. (A) Esquema mostra o desenho de um chip dispositivo de análise da mobilidade celular para a monitorização simultânea de 6 ensaios de quimiotaxia independentes. mostra vermelho quimioatraente adicionado aos poços. (B) Introdução de células HL60 aos poços de células enquanto o quimioatrativo difunde para estabelecer um gradiente fMLP constante. Por favor clique aqui para ver uma versão maior desta figura.
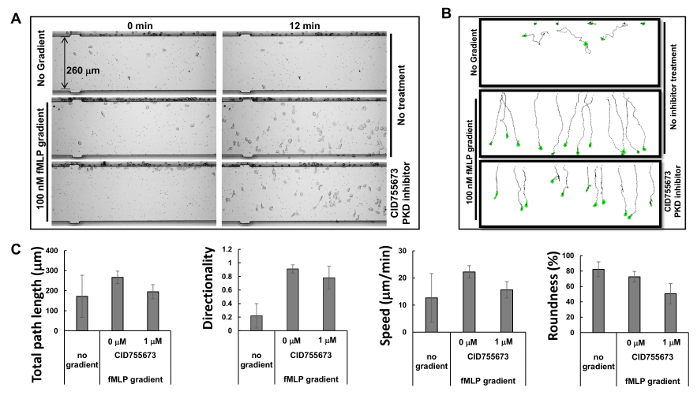
Figura 2. monitorização simultânea de múltiplos ensaios de quimiotaxia com células HL60. (A ) Montagem mostra imagens do dispositivo de análise de ensaio de quimiotaxia mobilidade celular para examinar os efeitos inibidores de inibidores de PKD específicos de sobre a quimiotaxia em tempos de 0 e 12 minutos após a aplicação do gradiente. quimiotáctica células HL60 foram pré-tratados com o inibidor de PKD 1 uM CID755673 durante 30 min. células HL60 com ou sem o tratamento de inibidor de PKD foram autorizados a chemotax em qualquer fome gradientes 100 nM de fMLP durante 12 minutos ou meio RPMI1640. (B) Esquema mostra o comprimento do caminho de viagem e morfologia das células HL60 rastreados. (C) Quantificação da quimiotaxia como comprimento total caminho, velocidade, direcionalidade, e redondeza. A média ± SD é mostrado; n = 10, 12 ou 11 para nenhum gradiente, gradiente de fMLP sem tratamento CID755673 e tratamento fMLP com o tratamento CID755673, respectivamente. Por favor clique aqui para ver uma versão maior desta figura.
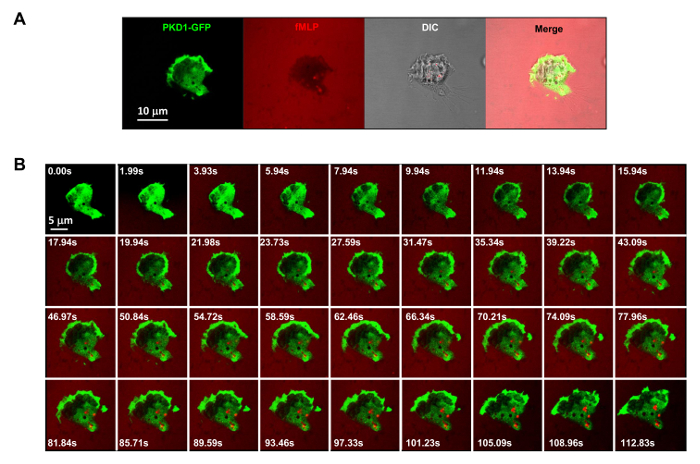
Figura 3.-GPCR mediada translocação membrana robusta de PKD1 em resposta a estímulos de fMLP aplicado uniformemente. (A) monitorização de PKD1 Multicanal-GFP (verde), quimioatractor (1? M de fMLP misturado com 0,1 ug / ml de corante fluorescente Alexa 594, vermelho) , e DIC (contraste de interferência diferencial) para identificar as células HL60 que aderem em um poço de uma câmara de 4well revestidos com gelatina a 0,2% em meio RPMI 1640. Barra de escala = 10 mm. (B) Montagem mostra que fMLP aplicada uniformemente (vermelho) induz a translocação de membrana robusta de PKD1-GFP (verde). Por favor clique aqui para ver uma versão maior desta figura.
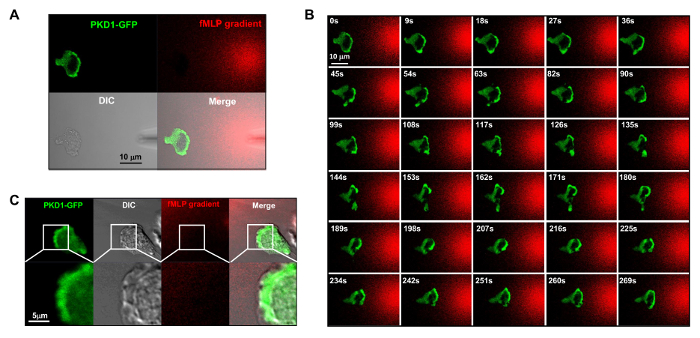
Figure 4. Levando localização beira de PKD1 em chemotaxing células HL60. (A) Canal de configuração aquisição modo facilita a visualização do gradiente de fMLP e da dinâmica espaço-temporais de PKD1. Em A - C, as células HL60 expressa transientemente PKD1 GFP; para visualizar o gradiente fMLP gerado a partir de uma micropipeta (DIC), 100 nM de fMLP (vermelho) foi misturado com 0,1 ug / ml de corante fluorescente Alexa 594. (B) localização enriquecida de PKD1 na vanguarda da célula chemotaxing. Barra de escala = 10 mm. (C) mostram imagens fundidas que PKD1 localiza na parte de trás da aresta principal em células HL60. Verde mostra PKD1 localização celular, e a imagem DIC mostra a área saliente da aresta principal. Scale bar = 5 mm. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
No presente estudo, nós mostram dois exemplos de ensaios de quimiotaxia: em primeiro lugar, a monitorização simultânea de vários ensaios de quimiotaxia por o dispositivo de análise da mobilidade celular; e segundo, a visualização do gradiente quimioatractor e a dinâmica espaço-temporais de eventos de sinalização nas mesmas células em tempo real.
dispositivo de análise da mobilidade celular para vários ensaios de quimiotaxia simultâneas
No presente estudo, nós introduzimos um protocolo detalhado para executar vários ensaios de quimiotaxia em simultâneo, utilizando um dispositivo de análise da mobilidade celular. Este dispositivo permite ao usuário observar o comportamento quimiotaxia celular com uma lente objetiva de 10X na observação de campo claro convencional. Por causa das características de difusão-dominante do fluxo de fluido, o dispositivo de análise da mobilidade celular gera gradientes altamente previsível, estável e permite até seis ensaios de quimiotaxia de ser efectuados simultaneamente. As etapas críticas do protocolo sãoobter gradientes confiáveis e alinhar as células na linha terraço. O usuário deve seguir rigorosamente as instruções do fabricante para a montagem de suporte e injeção de chemoattractants e células. Instruções detalhadas também estão disponíveis online. Comparado com os métodos alternativos de quimiotaxia 11-13,15, este dispositivo melhora significativamente a eficiência e fiabilidade de ensaios de quimiotaxia. Quatro tamanhos de mobilidade celular chip de dispositivo de análise de tamanhos de 4, 5, 6, e 8 uM estão disponíveis para acomodar diferentes tipos e tamanhos de células. Descobrimos que um chip de mobilidade celular dispositivo de análise 4 ou 5 mm é adequado para o HL60 e D. células discoideum, que são cerca de 10-15 um de diâmetro. No entanto, uma limitação é que este dispositivo não é adequado para todos os tipos de células. Tivemos pouco sucesso usando o ensaio de quimiotaxia dispositivo de análise da mobilidade celular com células Raw267.4. A razão pode ser que as células Raw267.4 migra muito lentamente. O tempo necessário para che eficientemotaxis de células Raw267.4 pode ser muito mais longo do que o tempo de um gradiente é mantida pelo dispositivo. Em vez disso, um ensaio de migração Transwell funcionou bem para células Raw267.4 9. Outra limitação é que a observação de fluorescência não é possível com o dispositivo de corrente. A direção futura é monitorar imagens fluorescentes com maior ampliação. Isso é possível com o dispositivo de análise da mobilidade celular melhorada, que está equipado com detecção fluorescente e uma lente objectiva 100X. Além disso, o número de ensaios simultâneos também é aumentada para 12. Todas estas melhorias facilitar a transferência melhorada de ensaios de quimiotaxia e a observação da dinâmica subcelulares em células migratórias.
Elevada eficiência de transfecção de células HL60 para expressar a proteína marcada com proteína fluorescente
células HL60 são uma linha celular de leucemia dividindo activamente e crescer em suspensão. Como relatado anteriormente 18-20, células HL60 são resistentes a Gtransferência eno. Tanto o lípido e a transferência de genes de electroporação foram testados, e maior eficiência de transfecção foi obtida com electroporação, como descrito em detalhe na secção 4. Obtendo a alta viabilidade após a electroporação é crítico para a obtenção de alta eficiência de transfecção por causa do dano grave que resulta da electroporação. Posteriormente, a manipulação de células profunda e suave são necessárias, especialmente após a eletroporação. Todos os suportes têm de ser pré-aquecido e gentilmente adicionado às células em todos os passos após a electroporação. Também é crítico para minimizar o tempo de exposição das células ao reagente de electroporação. Para evitar a morte celular, após a electroporação, meio RPMI 1640 recuperação electroporação tem de ser adicionada às células imediatamente. Verificou-se que 20% de FBS em meio de recuperação dá uma taxa de recuperação de células muito mais elevada do que 10% de FBS. Após a eletroporação, incubação em meio RPMI recuperação 1640 eletroporação para 30 min é fundamental para uma maior viabilidade e transfecçãoeficiência. Para aumentar ainda mais a eficiência da transfecção, foi também utilizado 4 ug de DNA de plasmídeo por transfecção, que é quase o dobro da quantidade de plasmídeo recomendado pelo fabricante.
Existem duas grandes limitações à transfecção de electroporação: a fugacidade da expressão da proteína e o limite do número de células (2 x 10 6 culas por transfecção). Em células indiferenciadas, a expressão é detectável apenas durante o primeiro par de divisões celulares, uma vez que o plasmídeo vector é diluído pela metade após cada divisão celular. Para HL60 diferenciadas células sobreviver não mais do que 48 h. Como resultado, qualquer experiência requer transfecções frescos 6 horas antes da experiência. O número de células para uma eletroporação apenas atende ao requisito mínimo para todos os ensaios bioquímicos. Para efeitos do uso repetitivo ou grande quantidade, é altamente recomendável que uma linha de células HL60 indiferenciado ser estabelecido que expressa de forma estável a proteína de interesse whiCH foi marcado com uma proteína fluorescente por um vector viral, um vector viral, se está disponível ou pode ser construído.
Divulgações
The authors declare no competing financial interest for this work.
Agradecimentos
This work is supported by the intramural fund of NIAID, NIH.
Materiais
| Name | Company | Catalog Number | Comments |
| RPMI 1640 Medium GlutaMAX | Life technologies | 61870-036 | |
| Sodium pyruvate | Thermo Fisher Scietific | 11360-070 | |
| Fetal bovine serum | Gemini Bio-Products | 100-106 | |
| 1 M HEPES sterile solution, pH 7.3 | Quality Biological Inc. | A611-J848-06 | |
| Penicillin streptomycin solution | Fisher Scientific | 15140122 | |
| NucleofectorTM 2b | Lonza | AAB-1001 | |
| AmaxaTM Cell Line NucleofectorTM Kit V including NucleofectorTM Solution, Singe use pipettes, AmaxaTM certified 100 ml aluminum electrode cuvettes | Lonza | VCA-1003 | |
| Lab-Tek chambered #1.0 Borosilicate Coverglass | Nalge Nunc International Inc | 155383 | |
| 2% Gelatin solution | Sigma-Aldrich | G1393 | |
| Fibronectin | Sigma-Aldrich | F1141 | |
| HBSS (Hanks’ Balanced Salt Solution) | Life technologies | 14025-076 | |
| Bovine serum albumin | Sigma-Aldrich | A3803 | |
| Single well Lab-Tek II coverglass chambers | Nalge Nunc International Inc | 155361 | |
| Four-well Lab-Tek II coverglass chambers | Nalge Nunc International Inc | 155383 | |
| Alexa 594 | Thermo Fisher Scientific | A-10438 | |
| fMLP | Sigma -Aldrich | F3506-5MG | |
| Cover glass thickness (2) 22 mm x 22 mm | Corning | 2855-22 | |
| EZ-TAXIScan | Effector Cell Institute, Inc. | MIC-1001 | |
| EZ-TAXIScan chip (5 mm) | Effector Cell Institute, Inc. | EZT-F01-5 | |
| 1701RN 10 μl syringe | Hamilton | 80030 | |
| Femtotips II Injection tips | Eppendorf | 5242956003 | |
| Femtotips II | Eppendorf | 930000043 | |
| TransferMan NK2, including motor module, X head with angle adjuster, and Positioning aids. | Eppendorf | 5188900056 | |
| DIAS software | Solltech Inc. | ||
| LSM 780 META or equivalent confocal microscope with a 40X 1.3 NA or 60X 1.4 NA oil DIC Plan-Neofluar objective lens | Carl Zeiss |
Referências
- Pocha, S. M., Montell, D. J. Cellular and molecular mechanisms of single and collective cell migrations in Drosophila: themes and variations. Annual review of genetics. 48, 295-318 (2014).
- Wen, Z., Zheng, J. Q. Directional guidance of nerve growth cones. Current opinion in neurobiology. 16, 52-58 (2006).
- Bravo-Cordero, J. J., Hodgson, L., Condeelis, J. Directed cell invasion and migration during metastasis. Current opinion in cell biology. 24, 277-283 (2012).
- Zigmond, S. H. Chemotaxis by polymorphonuclear leukocytes. The Journal of cell biology. 77, 269-287 (1978).
- Jin, T., Xu, X., Hereld, D. Chemotaxis, receptors and human disease. Cytokine. 44, 1-8 (2008).
- Dong, X., et al. P-Rex1 is a primary Rac2 guanine nucleotide exchange factor in mouse neutrophils. Current biology : CB. 15, 1874-1879 (2005).
- Li, Z., et al. Directional sensing requires G beta gamma-mediated PAK1 and PIX alpha-dependent activation of Cdc42. Cell. 114, 215-227 (2003).
- Van Haastert, P. J., Devreotes, P. N. Chemotaxis: signalling the way forward. Nature reviews: Molecular cell biology. 5, 626-634 (2004).
- Xu, X., et al. GPCR-Mediated PLCbetagamma/PKCbeta/PKD Signaling Pathway Regulates the Cofilin Phosphatase Slingshot 2 in Neutrophil Chemotaxis. Mol Biol Cell. , (2015).
- Boyden, S. The chemotactic effect of mixtures of antibody and antigen on polymorphonuclear leucocytes. The Journal of experimental medicine. 115, 453-466 (1962).
- Zigmond, S. H. Ability of polymorphonuclear leukocytes to orient in gradients of chemotactic factors. The Journal of cell biology. 75, 606-616 (1977).
- Zicha, D., Dunn, G. A., Brown, A. F. A new direct-viewing chemotaxis chamber. Journal of cell science. 99 (Pt4), 769-775 (1991).
- Muinonen-Martin, A. J., Veltman, D. M., Kalna, G., Insall, R. H. An improved chamber for direct visualisation of chemotaxis. PloS one. 5, e15309(2010).
- Bozzaro, S., Fisher, P. R., Loomis, W., Satir, P., Segall, J. E. Guenther Gerisch and Dictyostelium, the microbial model for ameboid motility and multicellular morphogenesis. Trends in cell biology. 14, 585-588 (2004).
- Xu, X., Jin, T. Imaging G-protein coupled receptor (GPCR)-mediated signaling events that control chemotaxis of Dictyostelium discoideum. Journal of visualized experiments : JoVE. , (2011).
- Lin, F., et al. Generation of dynamic temporal and spatial concentration gradients using microfluidic devices. Lab Chip. 4, 164-167 (2004).
- Eiseler, T., et al. Protein kinase D1 regulates cofilin-mediated F-actin reorganization and cell motility through slingshot. Nature cell biology. 11, 545-556 (2009).
- Roddie, P. H., Paterson, T., Turner, M. L. Gene transfer to primary acute myeloid leukaemia blasts and myeloid leukaemia cell lines. Cytokines Cell Mol Ther. 6, 127-134 (2000).
- Schakowski, F., et al. Novel non-viral method for transfection of primary leukemia cells and cell lines. Genet Vaccines Ther. 2, 1(2004).
- Uchida, E., Mizuguchi, H., Ishii-Watabe, A., Hayakawa, T. Comparison of the efficiency and safety of non-viral vector-mediated gene transfer into a wide range of human cells. Biol Pharm Bull. 25, 891-897 (2002).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados