É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Utilizando os ácidos biliares e multi-fluorados
Neste Artigo
Resumo
Ferramentas para diagnosticar má absorção de ácidos biliares e medir o transporte de ácidos biliares in vivo são limitadas. Uma abordagem inovadora de animais vivos é descrito que utiliza protões combinado (1 H), além de flúor (19 F) ressonância magnética; esta nova metodologia tem potencial de translação para o rastreio de má absorção de ácidos biliares, na prática clínica.
Resumo
Junto com seu papel tradicional como detergentes que facilitam a absorção de gordura, literatura emergente indica que os ácidos biliares são moléculas sinalizadoras potentes que afetam vários órgãos; modulam a motilidade intestinal e produção hormonal, e alterar o tom vascular, o metabolismo da glicose, metabolismo lipídico e utilização de energia. Alterações em ácidos biliares fecais podem alterar a microbiota intestinal e promover o cólon patologia incluindo diarreia cholerrheic e cancro do cólon. reguladores-chave da composição de ácidos biliares fecal são a pequena intestinal apical dependente de sódio Bile Ácido Transporter (ASBT) e de crescimento de fibroblastos fator-19 (FGF19). Reduzida expressão e função de ASBT diminui o ácido biliar intestinal up-take. Além disso, os dados in vitro sugerem que alguns medicamentos aprovados pela FDA inibir a função ASBT. liberação FGF19 deficiente aumenta a síntese de ácido biliar hepática e liberação para o intestino para níveis que sobrecarregam ASBT. De qualquer disfunção ou ASBT deficiência aumenta FGF19 fácidos biliares e ECAL pode causar diarreia crónica e promover a neoplasia do cólon. Lamentavelmente, ferramentas para medir má absorção de ácidos biliares e as ações de drogas no transporte dos ácidos biliares in vivo são limitadas. Para compreender as acções complexos dos ácidos biliares, são necessárias técnicas que permitem a monitorização simultânea de ácidos biliares no intestino e tecidos metabólicos. Isso nos levou a conceber um método inovador para medir o transporte de ácidos biliares de animais vivos usando uma combinação de protões (1H) e flúor (19 F) imagens de ressonância magnética (MRI). Marcadores novos para flúor (19F) à base de ressonância magnética animal vivo foram criadas e testadas, tanto in vitro como in vivo. Pontos fortes desta abordagem incluem a falta de exposição à radiação e potencial translacional ionizante para a investigação e prática clínica.
Introdução
Juntamente com o seu papel clássico como detergentes que facilitam a absorção de gordura no intestino, ácidos biliares têm emergido como moléculas de sinalização potentes que afectam vários órgãos para além dos associados com a sua circulação entero-hepática 1,2. Além de controlar o seu próprio metabolismo, ácidos biliares modular vários aspectos da fisiologia gastrointestinal (por exemplo, motilidade intestinal e produção da hormona incretina, fisiologia cólon e suscetibilidade ao câncer) e ter efeitos sistémicos sobre o tônus vascular, glicose e metabolismo lipídico, e utilização de energia. Embora alguns destes efeitos são mediados no intestino, outras são devidas a alterações pós-prandial nos níveis de ácidos biliares sistémicos, como observado em pacientes obesos ou após cirurgia gástrica de by-pass. Para elucidar as acções metabólicas complexos dos ácidos biliares é necessária nova tecnologia que permite a monitorização simultânea dos níveis de ácidos biliares em diferentes compartimentos anatómicos, no tracto gastrointestinal e metaBolic tecidos (fígado, pâncreas, músculo esquelético e tecido adiposo). Obtenção de informações, tais temporal e espacial requer uma tecnologia inovadora - in vivo de imagens usando marcadores de ácidos biliares novos como aqui descrito é uma abordagem tão romance.
composição de ácidos biliares e distribuição em compartimentos anatômicos são regulados por fatores que modulam a sua síntese hepática e absorção ileal, incluindo dieta, cirurgia, uso de antibióticos e alterações na flora intestinal. Um regulador chave da absorção de ácidos biliares do intestino para a sua circulação entero-hepática 3 (Figura 1) é o ileal apical dependente de sódio Ácido Biliar transportador (ASBT; SLC10A2). Embora a absorção passiva ocorre ao longo do intestino, ASBT medeia a captação de 95% dos ácidos biliares do intestino de modo que normalmente há derrame limitado de ácidos biliares nas fezes. ASBT-deficiente (Slc10a2 - / -) ratos aumentaram ácidos biliares fecais e um aci biliar diminuídad pool 4.
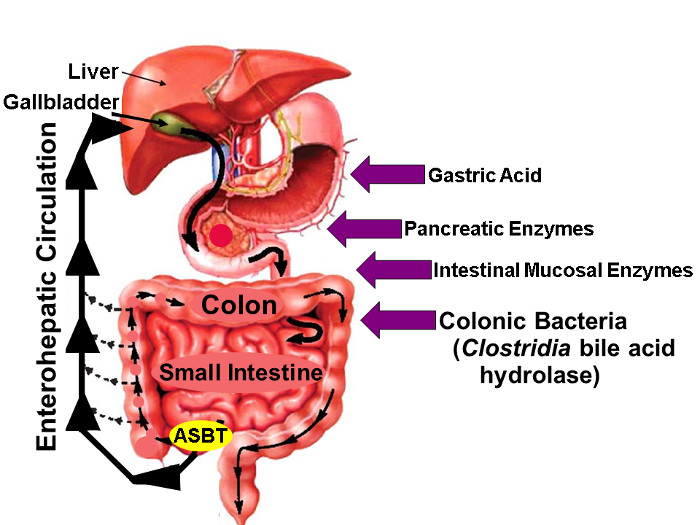
Figura 1: Circulação entero-hepática dos ácidos biliares.
Ilustração de entero-hepática Circulação pelo qual ácidos biliares são sintetizados no fígado, excretada na biliar Árvore, armazenada na vesícula biliar, Lançado no intestino delgado proximal com as refeições, e ativamente absorvido através ASBT na distal do íleo. Considerando que as pequenas quantidades de ácidos biliares são absorvidos passivamente em todo o intestino, aproximadamente 95% de ácidos biliares intestinais são transportados activamente pelo ASBT resultando em perda mínima (cerca de 5%) nas fezes, que é compensada por uma quantidade semelhante de síntese de ácidos biliares de novo na o fígado, mantendo assim um estado estacionário conjunto de ácidos biliares. As setas à direita identificar os fatores que podem afetar a estabilidade do ácido biliar nativa e marcada com flúor, incluindo o ácido gástrico, enzimas pancreáticas e da mucosa intestinal e, mais importantly, enzimas hidrolíticas liberadas por espécies clostridiais que colonizam o intestino delgado e cólon distal. (Modificado com a permissão 16) Por favor clique aqui para ver uma versão maior desta figura.
má absorção de ácidos biliares podem ser classificados em três tipos, cada um dos quais aumenta ácidos biliares fecais dihidroxi, causando assim diarreia intermitente ou crónica. Digite 1 resultados de patologia ileal bruta (por exemplo, a ressecção, doença de Crohn) 5. Tipo 3 resultados de colecistectomia, vagotomia, doença celíaca, supercrescimento bacteriano, e insuficiência pancreática. Em contraste, as pessoas com (Tipo 2) má absorção de ácidos biliares "primário" colocam um desafio formidável diagnóstico porque faltam tais condições antecedentes e não têm sinais de patologia no íleo. Assim, má absorção de ácido biliar primária é normalmente diagnosticada como diarreia-psíndrome do intestino irritável redominant (IBS-D), talvez a razão mais comum para visitas relacionadas com a gastroenterologia de ambulatório. Estimou-se que um terço dos pacientes com SII-D tem má absorção de ácido biliar primária; em os EUA, isso pode representar vários milhões de pessoas 5. Conhecimentos recentes indicam que BAM primário deriva de inibição do feedback prejudicada de síntese de ácidos biliares no fígado por intestinal de crescimento de fibroblastos fator-19 (FGF19), e não de expressão ou função de ASBT reduzida.
Em má absorção de ácidos biliares primários, os níveis plasmáticos baixos de FGF19 falhar para desligar a síntese hepática de ácidos biliares - o aumento resultante em ácidos biliares intestinais satura os transportadores de ácido biliar, incluindo ASBT, e o derrame aumentada de ácidos biliares nas fezes provoca diarreia 6 (Figura 2). Ratos deficiente em Fgf15 (FGF19 murina) têm um conjunto de ácidos biliares expandiu e aumentou os ácidos biliares fecais 7.

Figura 2: Mecanismos de Intestinal Bile ácido má absorção.
Normalmente, como se mostra no painel A, de aproximadamente 95% de ácidos biliares intestinais são absorvidos por transporte activo no íleo distai através ASBT. Quando a expressão ou actividade ASBT é diminuída (painel B), com deficiência intestinais absorção de ácidos biliares resulta em derrame de ácidos biliares no cólon. Com a sinalização FGF19 prejudicada (painel C), a falta de inibição do feedback de bile hepática resultados de síntese de ácido num aumento das concentrações de ácidos biliares intestinais que sobrecarregam a capacidade de transporte ASBT com o derramamento de ácidos biliares no cólon. Por favor clique aqui para ver uma versão maior esta figura.
Longo prazo, elevação crônica em aci biliar fecalds pode promover a neoplasia do cólon. Neoplasia do cólon resulta de displasia da mucosa progressiva associada com mutações somáticas do gene, mas os factores ambientais que aumentam ácidos biliares fecais pode acelerar e aumentar este processo. Nos roedores, o aumento ácidos biliares fecais, quer como uma consequência da administração exógena ou deficiência ASBT displasia promover a formação de tumor do cólon e 8-10.
Notavelmente, os resultados provocantes indicam que as drogas comumente usadas aprovados pela Food and Drug Administration (FDA) inibem potencialmente transporte de ácido biliar por ASBT in vitro 11. Se estes medicamentos reduzem pequena transporte de ácido biliar intestinal in vivo e aumentar os níveis de ácidos biliares fecais, o impacto potencial sobre a patologia do cólon seria preocupante. Até mesmo um pequeno aumento na patologia do cólon, devida à utilização de uma tal droga pode ter um impacto maior para a saúde. Um conjunto de ferramentas que pode avaliar a plausibilidade destes em resultados in vitro e ob epidemiológicaservações iria estimular pesquisas adicionais, incluindo estudos de segurança pós-comercialização.
Apesar da necessidade, ensaios práticos para identificar as pessoas com má absorção de ácidos biliares estão faltando. Medição direta de ácidos biliares fecais foi rejeitado anos atrás como pesado, pouco prático, e não confiável 5. Abordagens alternativas incluem a medição de retenção de um derivado radioactivo marcado com selénio ácido eólico (75 SeHCAT) e os níveis plasmáticos de 7α-hidroxi-4-colesteno-3-ona (C4), ou um ensaio terapêutico de ligantes de ácidos biliares. 75 testes SeHCAT possui disponibilidade limitada na Europa e não está aprovado pela FDA ou disponíveis para uso em os EUA Além disso, mesmo a exposição à radiação modesta (0,26 mSv / 75 teste SeHCAT) a partir de testes de diagnóstico levanta preocupações e crescimento excessivo de bactérias e doença hepática avançada pode confundir 75 resultados SeHCAT. testes de C4 é potencialmente atractivo uma vez que apenas é necessário de plasma, mas tem baixa Val-positivo preditivoue e teste não está amplamente disponível. Medição dos níveis séricos de FGF19 tem limitações semelhantes. Freqüentemente os médicos recorrem a um processo terapêutico de sequestrantes dos ácidos biliares, mas esta abordagem não pode fornecer um diagnóstico definitivo de má absorção de ácidos biliares 5.
Por estas razões, uma nova abordagem MRI foi concebido para medir o transporte de ácido biliar e distribuição in vivo utilizando ácidos biliares multi-fluorados inovadores (MFBA-MRI). MFBA contendo três átomos de flúor (19F), um isótopo estável de 100% de abundância natural, são transportados de forma semelhante aos ácidos biliares nativas 12, e pode ser utilizada para visualizar o transporte de ácido biliar com uma combinação de protão (1H) e de flúor ( 19 F) MRI, um método seguro sensível, sem exposição à radiação ionizante 13,14.
Protocolo
O protocolo seguinte adere às diretrizes aprovadas pelo Comitê Institucional de Animal Care and Use (IACUC) da Universidade de Maryland School of Medicine (IACUC Protocolo # 0415011, aprovado 18 de junho de 2015).
1. Ratos Gavaging com 19 F-Rotulado Bile Acids
- Ratinhos gavagem com 150 mg / kg de peso corporal 19 ácidos biliares F-rotulados. Encher uma seringa de 1 ml ao volume necessário com 19 solução mãe de ácido biliar F marcado com [ácido eólico-trifluoro-acetil lisina (CA-Lys-TFA; em 1: 1 de polietileno glicol 400: fosfato de Dulbecco solução salina tamponada) ou cholylsarcosine- trifluoro-N-metil-acetamida (CA-Sar-TFMA; em 60% de polietileno-glicol 400 e 40% de salino tamponado com fosfato de Dulbecco] e anexar um calibre 20 de agulha de gavagem 1,5 polegadas curvo com ponta de bulbo gástrica Certifique-se de que a agulha de gavagem. é o tempo suficiente para atingir o nível de cartilagem xifóide do rato quando inserido no esófago até ao cubo da agulha
- firmemente graspar o animal pela pele solta na parte de trás do pescoço entre o polegar eo dedo indicador e use os dedos restantes para agarrar a pele na parte inferior das costas e cauda.
- Segure o mouse vertical e passe a agulha gavage ao longo do lado e do céu da boca para o esôfago e para baixo para o estômago. Se a resistência for encontrado na faringe, reposicionar a agulha até que o animal 'engole' it - não empurre contra a resistência.
- Se a anestesia é necessário para gavage, coloque o mouse em uma redoma de vidro contendo 5 ml de isoflurano e fechar. Quando o rato cai de lado, esperar 7 segundos, retire o mouse e executar gavage. Para proteger o pessoal dos vapores anestésicos, use a redoma apenas em uma coifa.
- Observar o animal se recuperar de isoflurano em alguns minutos.
NOTA: Uma vez que o isoflurano é metabolizado pelo fígado, um sinal de flúor que emana da droga intacta ou de seus metabólitos excretados no sistema biliar e vesícula biliar podem confundir fluoRine sinais a partir de 19 ácidos biliares marcados com F-15. Uma alternativa é usar a cetamina mais xilazina (ver secção 3.1 para doses).
2. A colheita da vesícula biliar, o fígado e sangue para medições de ácidos biliares Usando Cromatografia Líquida / Espectrometria de Massa
- Para atingir o enchimento da vesícula biliar máxima, ratinhos rápido durante pelo menos 6 horas antes da colheita dos órgãos. Prepare cetamina e xilazina em solução salina tamponada com fosfato (100 mL de cetamina, xilazina 62,5 ul, 840 ul de PBS).
- Usando uma seringa esterilizada de 1 ml, injectar uma HR rato por via subcutânea 1 antes da colheita de órgãos com 15 ul / g de peso corporal de solução de cetamina / xilazina (150 mg de cetamina e xilazina 18 mg por kg de peso corporal).
- Uma hora após a administração de cetamina / xilazina confirmar anestesia adequada por pitada dedo do pé e coloque o supino anestesiado mouse.
- Use 5 ou 6 polegadas tesoura para fazer uma incisão na pele abdominal na linha média do púbis ao xifóide e fine tesoura (4 polegadas) para cortar o revestimento peritoneal e expor órgãos abdominais - que não perfure o diafragma.
- Compreender o processo xifóide com uma braçadeira de 5 polegadas e levantar para o outro lado do peito para expor a cavidade abdominal superior. Use uma pinça e um instrumento rombo para dissecar e mover o fígado de lado, expondo a vesícula biliar.
NOTA: Não lacerar o fígado ou toque na vesícula biliar como o primeiro vai causar hemorragia grave e esta pode estimular a contração da vesícula biliar e esvaziamento. - Coloque um grampo de 4 polegadas através do ducto biliar comum (Figura 3, setas a tracejado). Cortar o ligamento prender o pólo superior da vesícula biliar para o diafragma e mover-se suavemente a vesícula biliar para o lado direito do abdômen.
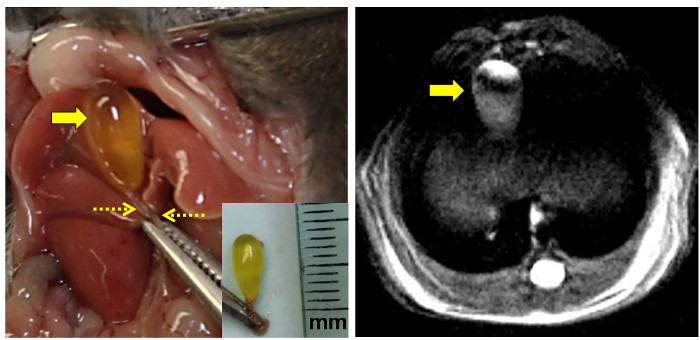
Figura 3: anatômicas e Proton ressonância magnética Vistas do rato da vesícula biliar.
O painel esquerdo mostra o mous expostae vesícula biliar para a esquerda da linha média abdominal após a incisão. O grampo agarra o processo xifóide. A vesícula biliar jejum encheu-se indicado pela seta grande e do ducto biliar comum preso pelas setas tracejadas. [Detalhe: excisadas vesícula intacta com o ducto biliar comum apertada. O governante é marcada em milímetros (mm).] O painel da direita mostra uma imagem da vesícula biliar murino jejum (seta) MRI de alta resolução de prótons densidade ponderada. Por favor clique aqui para ver uma versão maior desta figura.
- Antes de excisão da vesícula biliar realizar punção cardíaca, sangue colheita, e desangrar o animal para verificar a eutanásia.
NOTA: A colheita da vesícula biliar primeira podem lacerar o fígado causando colapso cardiovascular e insuficiência para obter uma amostra de sangue adequada (≥ 200 mL). - Expor o lado de baixo do diafragma e esquerdaidentificar a superfície de batida do coração. No ponto de pulsação cardíaca máxima perfurar o diafragma e coração com uma agulha de calibre 23 ligada a uma seringa de 1 ml.
- Lentamente retirar a seringa enquanto aspiração. Quando o sangue começa a encher a seringa, parar de retirar e manter a sucção para recolher 0,2-0,6 ml de sangue. Delicadamente girando a agulha ou retirá-la ligeiramente pode restabelecer o fluxo se cessa.
- Transferir o sangue para um tubo heparinizado de 1,5 ml e centrifugar a 2000 xg durante 15 min. Precipitar o plasma com quatro partes de acetonitrilo e centrifugar a 12000 xg durante 10 min. Analisar o sobrenadante por / espectroscopia de massa de cromatografia líquida (LC / MS / MS) 11-1312-1412-1412-1412-14. Se necessário, armazenar o plasma a -80 ° C antes da análise.
- Utilizando uma dissecção romba, libertar a vesícula biliar a partir do fígado. Transecto do ducto biliar comum abaixo da braçadeira, remoção e pesagem da vesícula biliar, e colocá-lo em um microcen 1,5 mltubo trifuge. Colher o fígado.
- Homogeneizar a cerca de 100 mg de fígado e vesícula biliar toda a sobre gelo em um tamanho de 21-homogeneizador de tecidos de vidro. Extrai-se com 75% de acetonitrilo e 25% de água (800 ul para 300 ul fígado, vesícula biliar para) e centrifugar a 12000 xg durante 10 min. Diluir extractos como necessário e quantificar o conteúdo de ácido biliar utilizando LC / MS / MS 13/11.
3. Ao vivo animal Proton (1 H) e flúor (19 F) Imagem por Ressonância Magnética
- Para alcançar o enchimento da vesícula biliar máxima, camundongos rápido durante pelo menos 6 horas antes de imagem. Usando cetamina e xilazina, anestesiar ratos para prevenir movimento no scanner de ressonância magnética. Prepara-se uma solução estoque de cetamina mais xilazina em salino tamponado com fosfato (130 mL de cetamina, xilazina 42,5 ul, 827 ul de PBS). Uma hora antes de MRI, utilizar uma seringa esterilizada de 1 ml e injectar subcutaneamente um rato com 5 ul / g de peso corporal desta solução (65 mg de cetamina e 4,25 mg xylazINE por kg de peso corporal). Para evitar a secura sob anestesia aplique pomada veterinária para os olhos do animal.
- Após a indução com cetamina / xilazina como acima, cortar uma área de 1,5 cm 2 na metade inferior esquerdo do mouse abdómen usando # 40 ou mais finas lâminas clipper elétrico. Após a remoção da pele, preparar a área com 8 - solução matagal 12% diluída de iodo cirúrgica e lave com álcool a 70% - repita as duas etapas. Insira um 24-gauge de 0,75 polegadas agulha por via subcutânea / cateter e túnel para dentro da cavidade abdominal. Certifique-se o cateter não é no ceco ou outro órgão abdominal puxando para trás o êmbolo - não deve haver nenhum sangue ou de material fecal no cateter.
- Remover a agulha e deixar o cateter intraperitoneal. Posicione o mouse sobre uma almofada térmica, com temperatura controlada na câmara de scanner de animais MRI.
- Prepara-se uma seringa de 1 ml estéril contendo cetamina e xilazina em solução salina tamponada com fosfato (1000 mL de cetamina, xilazina 300 ul, 6700 ul de PBS) e encher o comprimento desejado do tubo estéril de 72 polegadas. Conectar o cateter intraperitoneal ao tubo esterilizado pré-cheia e estendê-lo para fora do scanner de ressonância magnética. Para manter a anestesia injetar 50 ul desta solução a cada 20 minutos, se os sinais vitais do rato são estáveis.
NOTA: Antes de imagem, certifique-se de não metais estão perto do scanner de ressonância magnética. - Usar uma bobina de ressonância magnética 19F / 1 H-sintonizado duplo volume de linear para transmitir e receber sinais de frequência de rádio a 300,283 MHz para o 1 H e 282,524 MHz para núcleos de 19 F.
- Executar a calibração do sistema 11, 13 e localização animal com três fatia (axial, sagital médio, e coronal) imagens de escoteiros utilizando uma sequência de tiro rápido de baixo ângulo (FLASH). Para iniciar o experimento, clique no botão 'semáforo' na janela de Controle de Digitalização no console do software.
- Adquirir multislice 1 imagens H MR usando aquisição rápida com o relaxamento melhorarmento sequência (RARA) na visão transversal da amostra ou o corpo do animal com tempo de repetição 2.200 ms, tempo de eco 8,9 ms, fator RARE 8, campo de visão 4 x 4 cm2, fatia de espessura 1,0 mm, dimensão de matriz 266 x 266, resolução no plano 150 x 150 mm 2, eo número de médias 6. Para iniciar o experimento, clique no botão 'semáforo' na janela de Controle de digitalização no console do software.
- Adquirir 19 imagens F usando uma sequência FLASH na mesma região do 1H RM com tempo de repetição 220 ms, flip ângulo = 30 °, tempo de eco 3.078 ms, tamanho de matriz de 32 x 32, no plano resolução 1,25 x 1,25 mm2, fatia de espessura 4,0 mm e número de médias 768. Para iniciar o experimento, clique no (o n- P ipeline G o-) botão na janela Ferramenta de Controle Spectrometer na consola software "GOP".
- Depois de ressonância magnética, eutanásia o mouse com injecti intraperitonealem de 15 ul / g de peso corporal de cetamina / xilazina solução (150 mg de cetamina / xilazina 18 mg por kg de peso corporal) seguida por punção cardíaca, para exsanguinação.
- Para recuperar um rato da anestesia, remover o cateter intraperitoneal, mas não deixe o animal sem supervisão até que ele recupera a consciência suficiente para manter decúbito esternal.
- 19 Para medir as concentrações de ácidos biliares marcados com F-11-13 a partir de colheita de órgãos, manter a anestesia com quetamina mais xilazina como descrito acima.
Resultados
O uso de MFBA para in vivo ressonância magnética para "ver" o transporte de ácido biliar em tempo real tem um grande potencial tanto para pesquisa e uso clínico. Além disso, os métodos descritos aqui para a ressecção da vesícula biliar e a análise bioquímica do seu conteúdo, utilizando a cromatografia líquida e espectrometria de massa de fornecer um meio de confirmar os resultados de imagiologia. No entanto, a eficácia destes métodos requer uma dosagem p...
Discussão
A síntese de CA-Lys-TFA e CA-Sar-TFMA e a análise in vitro de seu transporte utilizando células de rim canino Madin-Darby transfectadas de forma estável que expressam ASBT e células embrionárias de rim humano que expressam o polipéptido de sódio / taurocolato de co-transporte (NTCP) são detalhadas noutro local 13,14. Aqui, o foco é a administração oral de MFBA por sonda aos animais vivos, seguido de colheita da vesícula biliar, fígado e sangue para análise do teor MFBA, e, nomeadamente...
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Este trabalho foi financiado pelos Institutos Nacionais de Saúde, Instituto Nacional de Diabetes e Doenças Digestivas e Renais (números de subvenção R21 DK093406 e T32 DK067872 para JP.R.) e um prémio de mérito VA (número de concessão 1BX002129 para JP.R.).
Materiais
| Name | Company | Catalog Number | Comments |
| Duall size-21 all glass tissue grinder | Kimble Chase Life Science, Vineland, NJ | 885351-0022 | |
| Bruker BioSpec 70/30USR Avance III 7T horizontal bore MR Scanner | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Bruker 40 mm 19F/1H dual-tuned linerar volume coil | Bruker Biospin MRI GmbH, Germany | Use companion Paravision Version 5.1 software (see step 3.5) | |
| Waters Acquity UPLC System with Quadrupole Detector | Waters Corporation, Milford, MA | ||
| Waters Acquity UPLC ethylene bridged hybrid C8 1.7 μm 2.1 x 50 mm column | Waters Corporation, Milford, MA | ||
| Gavage Needle | Braintree Scientific, INC. | N-010 | 20 G-1.5" curved 2.25 mm ball |
| 2 Stainless Steel Hemostats | VWR | 10755-018 | 4 and 5 inch, straight |
| Ketamine | MWI Veterinary Supply | 501090 | Ketamin zetamine 100 mg/ml |
| Xylazine | Akorn, Inc. | 20 mg/ml | |
| Intraperitoneal Catheter | Abbott | AbbocathTM-T.I.V. G720-A01 4535-42 | 24-G x 0.75" |
Referências
- Thomas, C., Pellicciari, R., Pruzanski, M., Auwerx, J., Schoonjans, K. Targeting bile-acid signalling for metabolic diseases. Nat Rev Drug Discov. 7, 678-693 (2008).
- Vallim, T. Q., Edwards, P. A. Bile acids have the gall to function as hormones. Cell Metab. 10, 162-164 (2009).
- Dawson, P. A., Karpen, S. J. Thematic Review Series: Intestinal Lipid Metabolism: New Developments and Current Insights Intestinal transport and metabolism of bile acids. Journal of Lipid Research. 56, 1085-1099 (2015).
- Dawson, P. A., et al. Targeted deletion of the ileal bile acid transporter eliminates enterohepatic cycling of bile acids in mice. J Biol Chem. 278, 33920-33927 (2003).
- Pattni, S., Walters, J. R. Recent advances in the understanding of bile acid malabsorption. Br Med Bull. 92, 79-93 (2009).
- Walters, J. R., et al. A new mechanism for bile acid diarrhea: defective feedback inhibition of bile acid biosynthesis. Clin Gastroenterol Hepatol. 7, 1189-1194 (2009).
- Hofmann, A. F., Mangelsdorf, D. J., Kliewer, S. A. Chronic diarrhea due to excessive bile acid synthesis and not defective ileal transport: a new syndrome of defective fibroblast growth factor 19 release. Clin Gastroenterol Hepatol. 7, 1151-1154 (2009).
- Flynn, C., et al. Deoxycholic acid promotes the growth of colonic aberrant crypt foci. Mol Carcinog. 46, 60-70 (2007).
- Glinghammar, B., Rafter, J. Carcinogenesis in the colon: interaction between luminal factors and genetic factors. Eur J Cancer Prev. 8, S87-S94 (1999).
- Bernstein, C., et al. Carcinogenicity of deoxycholate, a secondary bile acid. Arch Toxicol. 85, 863-871 (2011).
- Zheng, X., Ekins, S., Raufman, J. P., Polli, J. E. Computational models for drug inhibition of the human apical sodium-dependent bile acid transporter. Mol Pharm. 6, 1591-1603 (2009).
- Vivian, D., et al. Design and characterization of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile Acid transporter activity. Pharm Res. 30, 1240-1251 (2013).
- Vivian, D., et al. Design and evaluation of a novel trifluorinated imaging agent for assessment of bile acid transport using fluorine magnetic resonance imaging. J Pharm Sci. 103, 3782-3792 (2014).
- Vivian, D., et al. In vivo performance of a novel fluorinated magnetic resonance imaging agent for functional analysis of bile acid transport. Mol Pharm. 11, 1575-1582 (2014).
- Raufman, J. P., et al. In Vivo Magnetic Resonance Imaging to Detect Biliary Excretion of 19F-Labeled Drug in Mice. Drug Metab Dispos. 39, 736-739 (2011).
- Ridlon, J. M., Kang, D. J., Hylemon, P. B. Bile salt biotransformations by human intestinal bacteria. J Lipid Res. 47, 241-259 (2006).
- Frisch, K., et al. N-methyl-11C]cholylsarcosine, a novel bile acid tracer for PET/CT of hepatic excretory function: radiosynthesis and proof-of-concept studies in pigs. J Nucl Med. 53, 772-778 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados