Method Article
Carregando uma tintura de cálcio em terminação de nervo de sapo através do coto nervoso: Registro de transientes de cálcio na união neuromuscular de sapo
Neste Artigo
Resumo
Aqui, descrevemos um método para carregar um corante sensível ao cálcio através do coto nervoso do sapo nas terminações nervosas. Também apresentamos um protocolo para a gravação e análise de transientes de cálcio rápidos nas terminações nervosas periféricas.
Resumo
Um dos métodos mais viáveis de medir os níveis de cálcio pré-sinápticos nos terminais do nervo pré-sináptico é a gravação óptica. Baseia-se no uso de corantes fluorescentes sensíveis ao cálcio que alteram a intensidade de emissão ou o comprimento de onda dependendo da concentração de cálcio livre na célula. Existem vários métodos utilizados para colorir células com corantes de cálcio. Os mais comuns são os processos de carregamento de corantes através de uma micropipeta ou pré-incubação com as formas de ésteres de acetoximetilo das corantes. No entanto, esses métodos não são bastante aplicáveis às junções neuromusculares (NMJs) devido a problemas metodológicos que surgem. Neste artigo, apresentamos um método para carregar um corante sensível ao cálcio através do tronco nervoso do nervo no nervo da rã nas terminações nervosas. Uma vez que a entrada de cálcio externo nos terminais nervosos e a subsequente ligação ao corante de cálcio ocorrem dentro da escala de tempo do milissegundo, é necessário usar um sistema de imagem rápido para registrar essas interaçõesNs. Aqui, descrevemos um protocolo para registrar o transiente de cálcio com uma câmera CCD rápida.
Introdução
Os íons de cálcio (Ca 2+ ) participam de muitos processos de sinalização neuronal, incluindo a iniciação, manutenção e plasticidade da libertação do mediador 1 , 2 , 3 , 4 , 5 . Após a chegada do potencial de ação, o Ca 2+ extracelular entra no terminal nervoso e inicia a liberação do neurotransmissor. Em algumas sinapses, a corrente de cálcio pode ser medida diretamente por métodos eletrofisiológicos 6 , 7 , 8 . No caso da junção neuromuscular (NMJ), não se pode usar pinça direta e técnicas de grampo de tensão de dois eletrodos devido ao tamanho minúsculo das terminações nervosas.
As gravações das correntes internas de Ca 2+ das terminações nervosas no NMJ podem ser feitas por eletrofícios indiretosMétodos 9 , 10 . No entanto, estes métodos requerem o pré-tratamento da sinapse pelos bloqueadores dos canais de iões de sódio e potássio. Os métodos ópticos não requerem a separação farmacológica das correntes iónicas no terminal nervoso e permitem gravações do influxo de Ca 2+ , desencadeadas por potenciais de ação e a elevação subseqüente de íons Ca 2+ no axoplasma 11 , 12 , 13 , 14 . Esses métodos são baseados em gravações de alterações na fluorescência de corantes sensíveis ao Ca 2 + específicos após a ligação de íons livres de Ca 2 + 15 , 16 , 17 , 18 , 19 .
Os indicadores de Ca 2+ podem ser carregados no cAtravés de uma variedade de métodos, dependendo da finalidade do experimento. Os pesquisadores usam a aplicação do banho de formas de corante permeáveis à membrana 20 , 21 , carregando através da pipeta 22 , ou microinjeção 23 , 24 , 25 . No entanto, todos esses métodos têm algumas limitações no caso do NMJ devido às suas peculiaridades em arquiteturas sinápticas. Para o NMJ, o método mais conveniente e bem sucedido é carregar o corante através do tronco nervoso, um método de preenchimento direto 26 , 27 , 28 , 29 . Esta técnica pode ser usada para carregar vários corantes de fluorescência nas terminações nervosas periféricas. Este método foi utilizado com sucesso para os terminais do nervo Drosophila 28 , o nervo do motor de lagarto28 e terminais do nervo do motor rã 17 , 26 , 27 , 30 . Dependendo do objeto em estudo, os detalhes metódicos podem variar. Uma micro-pipeta de vidro pode ser empregada para pequenos nervos das larvas 28 . Vários pesquisadores descreveram um método 27 , 28 em que uma extremidade recém-cortada de nervo inervando um músculo é imerso em um pré-cheio com um corante. A preparação é deixada por várias horas para absorver o corante. O corante é absorvido pelos axônios e transportado para os terminais do nervo. Neste artigo, descrevemos um método de carregar um indicador de fluorescência em terminais do nervo do motor de rã através do tronco nervoso. Nosso protocolo usa uma ponta de pipeta de plástico para a incubação do tecido com um corante. Também descrevemos como adquirir e analisar o traço de fluorescência de Ca 2+Nsients.
Protocolo
Experimentos foram realizados em preparações isoladas do músculo nervoso do peito cutâneo musculus do Rana ridibunda rrog . O tamanho dos animais de ambos os sexos era de cerca de 5-9 cm. Os procedimentos experimentais foram realizados de acordo com as diretrizes para o uso de animais de laboratório da Universidade Federal de Kazan e da Universidade Médica de Kazan, de acordo com o Guia NIH para o Cuidado e Uso de Animais de Laboratório. O protocolo experimental atendeu aos requisitos da Directiva 86/609 / CEE do Conselho das Comunidades Europeias e foi aprovado pelo Comitê de Ética da Universidade Médica de Kazan.
1. Preparação das soluções
- Preparação da solução de Ringer.
- Prepare a solução de Ringer: NaCl 113,0 mM, KCl 2,5 mM, NaHCO3 3,0 mM e CaCl2 1,8 mM. Ajuste o pH para 7.2-7.4.
- Prepare a solução de Ringer com um baixo Ca 2+ e alto teor de Mg 2+ : NaCl 113,0 mM, KCl 2,5 mM, NaHCO3 3,0 mM, MgCl2 6,0 mM, CaCl2 0,9 mM. Ajuste o pH para 7.2-7.4.
- Preparação da solução de carga de corantes.
- Prepare a solução à base de água contendo HEPES-Na a 10 mM (pH 7,2-7,4).
- Adicione 14 μL da solução HEPES a um frasco com o corante 30 .
NOTA: o tinte indicador de Ca 2+ vem em um frasco de 500 μL com 500 μg de pó. - Vortex e gire para baixo para misturar bem.
- Diluir a solução para reduzir a concentração final do indicador de Ca 2 + para 30 mM. Evite a exposição à luz e armazene a -20 ° C.
2. Procedimento de carregamento de tintura
- Dissecar o músculo cutâneo do peito com um pedaço do nervo do peitoral .
NOTA: O procedimento de dissecação está disponívelEm um download gratuito do artigo de Blioch et al. , 1968 31 .- Para o procedimento de dissecação, use duas pinças finas e tesoura corneana (veja a Tabela de Materiais ). Transfira o tecido dissecado para uma placa de Petri revestida com elastômero de silício pré-cheia com a solução de Ringer e conserte o tecido com finos parafusos de aço inoxidável, de modo que este seja levemente esticado no prato.
- Recoloque a placa de Petri com uma alíquota fresca da solução da Ringer. Remova os tecidos conjuntivos. Não danifique o nervo.
- Prepare a pipeta de enchimento: usando uma lâmina de barbear, corte uma peça de aproximadamente 2 mm de comprimento da parte cônica de uma ponta de pipeta de plástico padrão de 10 μL.
- Prepare um pedaço de argila de modelagem para montar a pipeta de enchimento na placa de Petri.
- Conecte a parte traseira da pipeta de enchimento a uma seringa de plástico através de tubos de silicone e adaptadores de conexão de plástico feitos de pontas de pipeta.
- Antes da dProcedimento de carregamento, remova a solução do Ringer da placa de Petri usando uma pipeta de plástico. Secar a preparação do nervo muscular usando uma seringa fina; Isto impedirá a diluição do corante de Ca2 + após o carregamento subsequente da pipeta de enchimento.
- Remova o frasco indicador do Ca 2+ do congelador e deixe descongelar a temperatura ambiente em um local escuro.
- Sob o controle do estereomicroscópio com baixa ampliação (10 ×), detectar a junção entre o músculo e o nervo. Com pinças e tesouras finas, corte o nervo peitoral proprio perto da superfície muscular (ver passo 2.1). Deixe um tronco nervoso com cerca de 2 mm de comprimento.
- Corrigir a pipeta de enchimento anexada à tubulação e a seringa na placa de Petri usando argila de modelagem.
- Mova a ponta da pipeta perto do coto nervoso.
- Sem comprimir, suavemente aspirar o toco nervoso na ponta da pipeta de enchimento.
- Remova o tubo de sucção do blunT final da pipeta de enchimento.
- Retire cuidadosamente o excesso de solução da pipeta de enchimento usando uma seringa com uma agulha longa (veja a Tabela de Materiais ). Não puxe o tronco do nervo.
- Elevar verticalmente a ponta da pipeta de enchimento, mantendo o tronco nervoso aspirado na ponta.
- Isolar a parte aspirada do coto nervoso do lado de fora da ponta da pipeta de enchimento com vaselina.
- Secar o tronco nervoso isolado na pipeta de enchimento se necessário: aspirar suavemente o excesso de solução da pipeta de enchimento usando uma seringa com uma agulha longa.
- Desenhe 0.5 μL da solução de carga de corantes (ver passo 1) usando uma pipeta com uma ponta longa de pipeta.
- Insira suavemente a ponta da pipeta com a solução de carga na pipeta de enchimento. Ejetar a mistura diretamente no coto nervoso.
- Selar a extremidade aberta da pipeta de enchimento com vaselina.
- Adicione uma pequena alíquota de Ringer's sOlution para a placa de Petri para manter a preparação molhada.
- Incubar a preparação à temperatura ambiente em condições escuras e úmidas durante 5 h.
- Remova a pipeta de enchimento com solução de carga, enxágue a preparação com a solução de Ringer e mantenha-a durante a noite na geladeira a 8 ° C.
3. Preparando o Tecido para Microscopia
- Monte a preparação na câmara revestida com elastômero de silicone e conserte-a com micro-agulhas de aço, de modo que esteja levemente esticada.
- Enxaguar o tecido com uma alíquota da solução de Ringer fresca.
- Use um eletrodo de sucção para estimular o nervo; A construção do eletrodo está disponível a partir do download gratuito do documento por Kazakov et al. 2015 32 . Posicione a ponta do eletrodo perto da extremidade cortada do nervo e aspirar o toco do nervo no orifício do eletrodo.
- Monte a câmara de preparação no estágio do microscópio. PlacE a sonda de temperatura e os disparos de entrada e saída na câmara.
- Ligue o cabo de alimentação ao elemento Peltier.
- Para superar a preparação, use um sistema simples de controle de gravidade. Para remover o excesso de solução, ligue a bomba de sucção de perfusão.
- Ligue a unidade termodinâmica.
- Defina o controle de temperatura para 20 ° C.
- Monte o escudo de proteção ultravioleta.
- Conecte o eletrodo de fio estimulante ao estimulador elétrico e observe as contrações musculares no microscópio com uma lente objetiva 4x.
- Preencha o sistema de perfusão com a solução do Ringer com baixo teor de Ca 2+ e alto teor de Mg 2+ .
NOTA: Esta solução é usada para prevenir contrações musculares. Uma diminuição na concentração de cálcio externo e uma elevação do magnésio externo resultam na redução da amplitude dos transientes de Ca 2+. No entanto, com base na experiência anterior, CaCl 0,9 mM 2 e 6 mM de MgCl2 ainda são suficientes para resolver de forma fiável a amplitude dos transientes de Ca 2+ . Vale ressaltar que existem algumas outras formas de diminuir as contrações musculares sem reduzir a concentração de Ca 2+. Por exemplo, o uso de d-tubocurarina ou alfa-bungarotoxina, bloqueadores específicos de receptores nicotínicos de acetilcolina, bloquearia total ou parcialmente bloqueios musculares 17 , 27 , 28 , 30. No entanto, a adição dessas toxinas também pode afetar a entrada de cálcio pré-sináptica 33 . Para evitar isso, a μ-conotoxina GIIIA pode ser usada 27 . - Ligue a bomba e comece a superfusão da preparação com a solução Ringer com baixo Ca 2 + e alto Mg 2+ .
- Mude para a lente objetiva 40 × no microscópio.
- Ligar em t Ele monocromador (veja a Tabela de Materiais ).
- Selecione um comprimento de onda de emissão de 488 nm e um modo contínuo de iluminação no software de controle de monocromador.
- Sob alta ampliação no modo de fluorescência, assegure-se de que os terminais nervosos foram carregados com o corante.
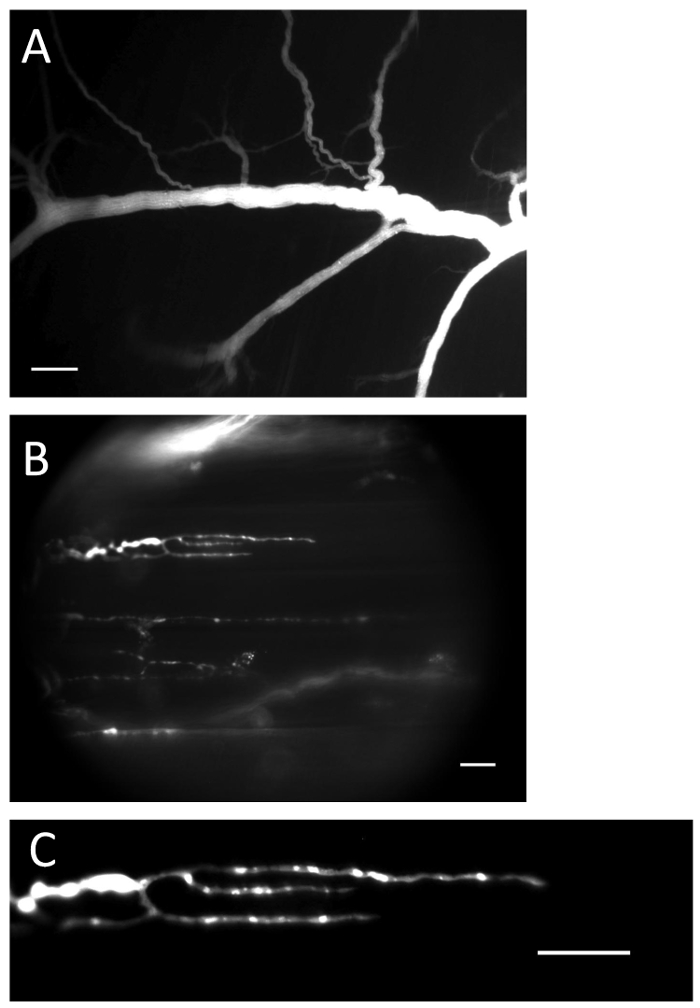
Figura 1 : Nervo e terminais com indicador de Ca 2+ carregado. ( A ) Nervo preenchido com indicador de Ca 2 + após o procedimento de carregamento. Barra de escala = 200 μm. ( B ) terminações nervosas cheias com indicador de Ca 2+ . Barra de escala = 20 μm. ( C ) A fluorescência de Ca 2+ -indicador é claramente visível na terminação do nervo. Barra de escala = 20 μm._blank "> Clique aqui para ver uma versão maior desta figura.
- Permitir que a preparação se equilibre durante pelo menos 30 minutos na solução baixa de Ca 2+ e alta Mg 2+ .
4. Captura de vídeo com a câmera digital CCD
Nota: Os detalhes da captura de sinais de fluorescência são específicos para cada microscópio e tipo de câmera, mas a consideração de chave é a velocidade de captura de imagem.
- Use 1 kHz como a freqüência de captura mínima para gravações de transientes de Ca 2+ no NMJ.
NOTA: câmeras CCD digitais rápidas são necessárias para imagens de fluorescência (consulte a Tabela de Materiais ). O sistema de aquisição de dados e o software (veja a Tabela de Materiais ) foram utilizados aqui para a sincronização da câmera, monocromador e estimulador. Em resumo, este protocolo permite a geração de pulsos de sincronização em saídas digitais dos dadosSistema de aquisição para abrir o obturador, capturar o sinal de vídeo e iniciar a estimulação. Todos os parâmetros temporais podem ser configurados nos protocolos e / ou nos aparelhos. Um protocolo típico é uma série de 500 quadros adquiridos a 1 kHz (80 x 80 pixels). A iluminação com luz de excitação pode lixiviar o indicador de Ca 2+ e fotodemar o tecido celular. Assim, evite exposições prolongadas à luz de excitação. Neste protocolo, o obturador está aberto apenas pelo tempo necessário para capturar o vídeo. Adquira vinte séries por terminal nervoso específico. O objetivo aqui é monitorar os mesmos sites no grupo de controle e após a entrega do medicamento. - Sob a lente objetiva 4X de um microscópio, use o regime de campos brilhantes para visualizar os ramos musculares e nervosos.
- Mude para a lente objetiva 40X e, usando o regime de epifluorescência e um comprimento de onda de excitação de 488 nm, procure por terminações nervosas carregadas com tintas. Identifique uma região de interesse nervoso de interesse.
- No tubo trinocular oNo microscópio, selecione os níveis de permuta do caminho da luz: 100% da luz para a câmera.
- Inicie o software de aquisição para a câmera CCD.
- No modo "Live", encontre o ROI e ajuste o foco.
- Selecione o menu "Alterar" as configurações.
- Use a "Configuração básica" em 1.000 quadros por segundo (fps), com uma resolução de 80 x 80.
- Defina o número de quadros de entrada para 500.
- Digite o nome da experiência.
- Escolha "Disparador externo".
- Defina o tempo de pré-disparo até 10 ms.
- Defina o número de repetições para 20.
- No software de controle de monocromador, selecione um comprimento de onda de emissão de 488 nm e modo de "iluminação do gatilho externo".
- Execute o software de aquisição de dados.
- Carregue o protocolo de estimulação.
- Antes de gravar o vídeo, capture o quadro escuro usando o software de aquisição de vídeo.
- Execute o protocolo de estimulação.
- Selecione o ROI e checK o sinal gravado.
5. Análise de dados
NOOTE: Para análise de dados, use o software da câmera CCD e o ImageJ; Os dados são representados como uma curva em uma planilha eletrônica. No software da câmera CCD, a média 20 repete e exporta os resultados para um arquivo de suporte ImageJ. No ImageJ, selecione o ROI e o plano de fundo. Subtrair o plano de fundo do ROI. Representar os dados como uma proporção: (ΔF / F 0 -1) x 100%, onde ΔF é a intensidade da fluorescência durante a estimulação e F 0 é a intensidade da fluorescência em repouso.
- No software de aquisição para a câmera CCD, clique em Arquivo> Arquivos médios. Selecione os arquivos e mande-os.
- Salve o arquivo médio como um arquivo .fit clicando em "Salvar como arquivo de ajuste".
- Execute o software ImageJ. Execute as seguintes etapas:
- Clique em Imagem> ajustar> brilho / contraste.
- Clique em Imagem> pilhas> ferramentas>; Classificador de pilha.
- Clique em Análise> ferramentas> Gerenciador de ROI.
- Arraste e solte o arquivo .fit em média na janela ImageJ.
- Amplie a janela para uma visão melhor.
- Ao mover o cursor, selecione a última moldura e exclua-a (esta é a moldura escura)
- Selecione um ROI retangular sobre a área que se acredita ser o plano de fundo. Adicione-o ao gerente de ROI
- Mude o fundo clicando em Mais> Multi Medida. Observe o MEAN. Copie os dados, exporte-o para um programa de planilha e calcule o valor médio do limite para uma proporção.
- Subtrair o limite das pilhas clicando em Processar> Main> Subtrair. Digite o valor médio do limite.
- Selecione um ROI retangular em torno de um terminal nervoso. Adicione-o ao gerente de ROI.
- Medir clicando em Mais> Múltipla. Observe o MEAN. Copie e exporte para uma planilha eletrônica.
- Média do deslocamento dos sinais.
NOTA: use oPrimeiras dúzias de pontos que demonstram fluorescência de corante base sem estimulação; Esta é a fluorescência em repouso. - Divida os sinais pela fluorescência em repouso.
- Subtrair "1" e multiplicar por 100%.
- Traçar o sinal e calcular a amplitude do transiente Ca 2+ .
Resultados
Após o carregamento do corante e após a estimulação do nervo motor, um aumento na amplitude do sinal fluorescente (Ca 2+ transitório) pode ser detectado nos terminais nervosos (ver Figura 2 ). Os parâmetros dos transientes de Ca 2+ são apresentados na Tabela 1 . Quantitativamente, os parâmetros dos transientes de Ca 2+ medidos em nosso estudo são próximos dos dados obtidos por outros cientistas em sinapses de animais de sangue frio 15 , 34 . Os parâmetros dos transientes de Ca 2+ dependem da taxa de ligação de Ca 2+ com o corante e a subsequente dissociação. A taxa de entrada de Ca 2 + na terminação do nervo, a interação com o corante e a difusão no citoplasma afetam o tempo de subida do transiente Ca 2+ . O tempo de decaimento do sinal fluorescente depende da afinidade do corante,A velocidade da interação do Ca 2+ com tampões intracelulares e a remoção por bombas de íons 35 . A análise de amplitude dos transientes de Ca 2+ pode ser utilizada para estudar a influência de várias substâncias na entrada de cálcio que participa na liberação do neurotransmissor 33 .

Figura 2 : Ca2 + médio Transiente medido no sapo NMJ. O transiente de Ca 2+ foi calculado com base na média de sinais de 13 NMJ de sapo. Clique aqui para ver uma versão maior dessa figura.
| PicoΔF / F (%) | Tempo de ascensão 20% -80% (ms) | Τ (ms) |
| 12,6 ± 1,1 (n = 13) | 4,6 ± 0,5 (n = 13) | 115,3 ± 8,3 (n = 13) |
Tabela 1: Os parâmetros médios do transiente Ca 2+ . Os dados são apresentados como a média ± SE; N é o número de medidas em NMJs distintos. O pico ΔF / F é a amplitude média de ΔF / F.
Discussão
Neste artigo, apresentamos o método de realização de carvão de corante sensível ao Ca 2 + nas terminações nervosas dos rãs através do tronco nervoso. Ao final do procedimento de carregamento, todos os terminais na parte proximal do nervo possuem níveis significativos de fluorescência. Estima-se que a concentração intra-terminal da sonda varia entre 40 e 150 μM 17 .
O procedimento de incubação é realizado em duas etapas: à temperatura ambiente e depois a uma temperatura mais baixa no refrigerador. É importante controlar o tempo de incubação do tecido com o corante à temperatura ambiente. Dependendo do comprimento real do coto nervoso, do corante específico e da temperatura, o tempo de incubação pode variar. Se sobreposto, os terminais nas partes proximais próximas ao tronco nervoso podem ser sobrecarregados. No entanto, na parte central do nervo, ainda é possível encontrar terminais carregados satisfatoriamente. Durante o períodoE longa incubação na geladeira, o corante é uniformemente distribuído nas terminações nervosas.
Nossas próprias observações 33 , 35 , bem como os dados de outros pesquisadores 30 , comprovam a falta de qualquer influência apreciável do procedimento de carregamento na amplitude da resposta pós-sináptica ou na freqüência dos potenciais de placa final em miniatura. Uma boa longevidade foi documentada nos preparativos carregados. Existem alguns pontos importantes sobre os quais gostaríamos de chamar a atenção. É muito essencial colocar o coto nervoso na solução de carga de tintas dentro de alguns minutos após a excisão para permitir que o corante entre nos axônios do nervo cortado; Os atrasos podem causar um carregamento ineficaz, presumivelmente devido ao resealing dos axônios nervosos 27 , 36 . Alguns investigadores imergem o tronco nervoso em 100 mM de EDTA (um Ca2 + e Mg 2 + -chelator) Imediatamente após a excisão do nervo para impedir que os axônios cortados se fechem novamente. O buffer é removido após 1-2 min e substituído por uma solução de carga de corante 37 . O uso de um poço de gelatina de petróleo em vez de tubos de plástico para o procedimento de carregamento permite o uso de um tronco nervoso mais curto. Ao usar esta abordagem, o nervo é cortado depois de ser imerso na solução de HEPES com corante e os axônios não são ressuscitados por causa da falta de íons divalentes na solução de corante 27 , 28 .
Em nosso estudo, utilizamos a forma de sal solúvel em água do indicador de Ca 2 + em vez de dextrano. Os conjugados de dextrano difundem no axônio mais lentamente do que as formas de sal. No entanto, o uso do conjugado de dextrano reduz a compartimentação e manuseio de corantes pelo nervo e NMJs. O cálcio Green 1-3,000 MW dextrano conjugado tem uma boa taxa de difusão e demonstra compartimentação reduzida Up class = "xref"> 38.
É muito importante evitar um longo período de iluminação fluorescente do tecido, pois isso afeta sua saúde e sobrevivência. Usamos a óptica Nomarski no canal de luz visível para procurar terminais nervosos. Durante a gravação, limitamos o campo iluminado usando um diafragma.
Vale ressaltar que este método de carga é adequado apenas para preparações que podem suportar incubações longas. Para reduzir o tempo de carregamento de corantes quando estudos estão sendo realizados em tecidos mais frágeis ( por exemplo, sinapses de animais de sangue quente), é necessário reduzir o comprimento do toco nervoso e usar micropipetas para carregar 29 , 39 .
Esta técnica de carga é adequada para alterações de imagem no Ca 2+ citosólico, com indicadores fluorescentes sob estimulação com um único nervo e atividade sináptica rítmicaEfetuado "17 , 27 , 35. A análise da amplitude transitória do Ca2 + pode ser utilizada para estudar a influência de diferentes substâncias na entrada de cálcio que participa na liberação do neurotransmissor 33 .
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Esta pesquisa foi realizada no âmbito do Programa do Governo Russo para o Crescimento Competitivo da Universidade Federal de Kazan e uma doação da Fundação Russa para Pesquisas Básicas (16-04-01051; 16-34-00817; 15-04-02983). Agradecemos a quatro revisores anônimos por fornecer comentários úteis sobre rascunhos anteriores do manuscrito. Expressamos nossa gratidão a Yuliya Aratskaya pela gravação de voz. Agradecemos ao Dr. Victor Ilyin por muitos comentários úteis e ajuda com a edição final do manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| Ca2+ indicator | Molecular Probes, USA | Oregon Green 488 BAPTA-1 hexapotassium salt, O6806 | 500 μg |
| Silicone Elastomer | Dow Corning, USA | Sylgard 184 elastomer | |
| Pipette | Biohit, Russia | 720210 | 0.5-10µL |
| Pipette tip | Fisher Scientific, USA | 02-707-175 | 10µL |
| Pipette tip | Biohit, Russia | 781349 | 10µL |
| Razor Blade | Fisher Scientific, USA | 12-640 | |
| Minutien Pins | Fine scince tools, Canada | 26002-20 | |
| Corneal Mini-Scissors | MT MEDI CORP, Canada | S-1111 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9610 | |
| Jeweler Forceps | MT MEDI CORP, Canada | F-9611 | |
| Modelling clay | local producer | can be replaced by any local producer | |
| Petroleum jelly | local producer | can be replaced by any local producer | |
| Microspin FV 2400 | Biosan, Latva | BS-010201-AAA | |
| Multi-spin MSC 3000 | Biosan, Latva | BS-010205-AAN | |
| Single-use hypodermic needles | Bbraun | 100 Sterican | 0.4×40mm |
| Syrynge | local producer | 0.5 ml | |
| HEPES | Sigma-Aldrich, USA | H0887 | 100ml |
| Microscope, BX51 | Olympus, Japan | ||
| Data acquisition system | Molecular Devices, USA | Digitdata 1550 | |
| software | Molecular Devices, USA | pClamp software, Version 10 | protocol can be download from : http://kpfu.ru/portal/docs/F_230007060/Video.capture.with. RedShirt.Neuro.CCD.camera.pro |
| Bath and bath temperature controler | Experimental Builder | can be replaced by any chamber with temperature control. For example from https://www.warneronline.com/ | |
| Monochromator | Till Photonics, Germany | Polychrome V | no longer available, can be replaced by other sutable stable light source 488 nm |
| monochromator control software | Till Photonics, Germany | Polycon | |
| Digital CCD camera | Redshirt imaging, USA | Neuro CCD SMQ | |
| Model 2100 Isolated Pulse Stimulator | A-M Systems, USA | ||
| Acquisition software for CCD camera | Redshirt imaging, USA | Turbo SM software | |
| ImageJ | National Institutes of Health, USA | http://rsb.info.nih.gov/ij/download.html | |
| Spreadsheet program | Microsoft, USA | Microsoft Office Excel |
Referências
- Llinás, R., Sugimori, M., Silver, R. B. Microdomains of high calcium concentration in a presynaptic terminal. Science. 256, 677-679 (1992).
- Augustine, G. J. How does calcium trigger neurotransmitter release? Curr Opin Neurobiol. 11, 320-326 (2001).
- Burnashev, N., Rozov, A. Presynaptic Ca2+ dynamics, Ca2+ buffers and synaptic efficacy. Cell Calcium. 37, 489-495 (2005).
- Schneggenburger, R., Neher, E. Presynaptic calcium and control of vesicle fusion. Curr Opin Neurobiol. 15, 266-274 (2005).
- Pang, Z. P., Südhof, T. C. Cell biology of Ca2+-triggered exocytosis. Curr Opin Cell Biol. 22, 496-505 (2010).
- Borst, J. G., Sakmann, B. Calcium influx and transmitter release in a fast CNS synapse. Nature. 383, 431-434 (1996).
- Borst, J. G., Sakmann, B. Calcium current during a single action potential in a large presynaptic terminal of the rat brainstem. J Physiol. 506, 143-157 (1998).
- Yazejian, B., DiGregorio, D. A., Vergara, J. L., Poage, R. E., Meriney, S. D., Grinnell, A. D. Direct measurements of presynaptic calcium and calcium-activated potassium currents regulating neurotransmitter release at cultured Xenopus nerve-muscle synapses. J Neurosci. 17, 2990-3001 (1997).
- Molgó, J., Mallart, A. Effects of Anemonia sulcatatoxin II on presynaptic currents and evoked transmitter release at neuromuscular junctions of the mouse. Pflugers Arch. 405 (4), 349-353 (1985).
- Slutsky, I., Rashkovan, G., Parnas, H., Parnas, I. Ca2+-independent feedback inhibition of acetylcholine release in frog neuromuscular junction. J Neurosci. 22 (9), 3426-3433 (2002).
- Haugland, R. P. Indicators for Ca2+, Mg2+, Zn2+ and other metal ions. Handbook of fluorescent probes and research products. Gregory, J. , MolecularProbes. Eugene,Oregon. 771-826 (2002).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Tsien, R. Y. Fluorescent indicators of ion concentrations. Methods Cell Biol. 30, 127-156 (1989).
- Adams, S. R. How calcium indicators work. Cold Spring Harb Protoc. 2010 (3), (2010).
- DiGregorio, D. A., Vergara, J. L. Localized detection of action potential-induced presynaptic calcium transients at a Xenopus neuromuscular junction. J Physiol. 505, 585-592 (1997).
- Sabatini, B. L., Regehr, W. G. Optical measurement of presynaptic calcium currents. Biophys J. 74, 1549-1563 (1998).
- Suzuki, S. Ca2+ dynamics at the frog motor nerve terminal. Pflug Arch Eur J Phisiol. 440, 351-365 (2000).
- Sabatini, B. L., Oertner, T. G., Svoboda, K. The life cycle of Ca2+ ions in dendritic spines. Neuron. 33, 439-452 (2002).
- Luo, F., Dittrich, M., Stiles, J. R., Meriney, S. D. Single-pixel optical fluctuation analysis of calcium channel function in active zones of motor nerve terminals. J Neurosci. 31, 11268-11281 (2011).
- Regehr, W. G. Monitoring presynaptic calcium dynamics with membrane-permeant indicators. Imaging in neuroscience and development: a laboratory manual. Yuste, R., Konnerth, A. , Cold Spring Harbor Laboratory Press. New York. 307-314 (2005).
- Macleod, G. T. Topical Application of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 786-790 (2012).
- Eilers, J., Konnerth, A. Dye loading with Patch Pipettes. Cold Spring Harb Protoc. 2009 (4), 277-281 (2009).
- Coleman, W. L., Bill, C. A., Simsek-Duran, F., Lonart, G., Samigullin, D., Bykhovskaia, M. Synapsin II and calcium regulate vesicle docking and the cross-talk between vesicle pools at the mouse motor terminals. J Physiol. 586 (19), 4649-4673 (2008).
- Macleod, G. T. Direct Injection of Indicators for Calcium Imaging at the Drosophila Larval Neuromuscular Junction. Cold Spring Harb Protoc. 2012 (7), 797-801 (2012).
- Talbot, J. D., David, G., Barrett, E. F., Barrett, J. N. Calcium dependence of damage to mouse motor nerve terminals following oxygen/glucose deprivation. Exp Neurol. 234 (1), 95-104 (2012).
- Peng, Y. Y., Zucker, R. S. Release of LHRH is linearly related to the time integral of presynaptic Ca2+ elevation above a threshold level in bullfrog sympathetic ganglia. Neuron. 10, 465-473 (1993).
- Tsang, C. W., Elrick, D. B., Charlton, M. P. alpha-Latrotoxin releases calcium in frog motor nerve terminals. J Neurosci. 20 (23), 8685-8692 (2000).
- Newman, Z., Malik, P., Wu, T. Y., Ochoa, C., Watsa, N., Lindgren, C. Endocannabinoids mediate muscarine-induced synaptic depression at the vertebrate neuromuscular junction. Eur J Neurosci. 25 (6), 1619-1630 (2007).
- Macleod, G. T. Forward-filling of dextran-conjugated indicators for calcium imaging at the drosophila larval neuromuscular junction. Cold Spring Harb Protoc. 2012 (7), 3440-3450 (2012).
- Wu, L. G., Betz, W. J. Nerve activity but not intracellular calcium determines the time course of endocytosis at the frog neuromuscular junction. Neuron. 17 (4), 769-779 (1996).
- Blioch, Z. L., Glagoleva, I. M., Liberman, E. A., Nenashev, V. A. A study of the mechanism of quantal transmitter release at a chemical synapse. J Physiol. (1), 11-35 (1968).
- Kazakov, A., Aleksandrov, M., Zhilyakov, N. V., Khaziev, E. F., Samigullin, D. V. A simple suction electrode for electrical stimulation of biological objects. Mezhdunarodnyj nauchno-issledovatel'skij zhurnal. 40 (9), In Russian 13-16 (2015).
- Khaziev, E. Acetylcholine-induced inhibition of presynaptic calcium signals and transmitter release in the frog neuromuscular junction. Front Physiol. 7 (621), 1-10 (2016).
- Bélair, E. L., Vallée, J., Robitaille, R. Long-term in vivo modulation of synaptic efficacy at the neuromuscular junction of Rana pipiens frogs. J Physiol. 569 (1), 163-178 (2005).
- Samigullin, D., Fatikhov, N., Khaziev, E., Skorinkin, A., Nikolsky, E., Bukharaeva, E. Estimation of presynaptic calcium currents and endogenous calcium buffers at the frog neuromuscular junction with two different calcium fluorescent dyes. Front Synaptic Neurosci. 6 (29), 1-10 (2015).
- Angleson, J. K., Betz, W. J. Intraterminal Ca2+ and spontaneous transmitter release at the frog neuromuscular junction. J Neurophysiol. 85 (1), 287-294 (2001).
- Shahrezaei, V., Cao, A., Delaney, K. R. Ca2+ from one or two channels controls fusion of a single vesicle at the frog neuromuscular junction. J Neurosci. 26 (51), 13240-132499 (2006).
- Troncone, L. R., et al. Promiscuous and reversible blocker of presynaptic calcium channels in frog and crayfish neuromuscular junctions from Phoneutria nigriventer spider venom. J Neurophysiol. 90 (5), 3529-3537 (2003).
- Samigullin, D. V., Khaziev, E. F., Zhilyakov, N. V., Sudakov, I. A., Bukharaeva, E. A., Nikolsky, E. E. Calcium transient registration in response to single stimulation and during train of pulses in mouse neuromuscular junction. BioNanoSci. 7 (1), 162-166 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados