É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Preparação e Avaliação de
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Here, we describe a protocol for radiolabeling and in vivo testing of tridentate 99mTc(I) chelate-tetrazine derivatives for pre-targeting and bioorthogonal chemistry.
Resumo
Pre-targeting combined with bioorthogonal chemistry is emerging as an effective way to create new radiopharmaceuticals. Of the methods available, the inverse electron demand Diels-Alder (IEDDA) cycloaddition between a radiolabeled tetrazines and trans-cyclooctene (TCO) linked to a biomolecule has proven to be a highly effective bioorthogonal approach to imaging specific biological targets. Despite the fact that technetium-99m remains the most widely used isotope in diagnostic nuclear medicine, there is a scarcity of methods for preparing 99mTc-labeled tetrazines. Herein we report the preparation of a family of tridentate-chelate-tetrazine derivatives and their Tc(I) complexes. These hitherto unknown compounds were radiolabeled with 99mTc using a microwave-assisted method in 31% to 83% radiochemical yield. The products are stable in saline and PBS and react rapidly with TCO derivatives in vitro. Their in vivo pre-targeting abilities were demonstrated using a TCO-bisphosphonate (TCO-BP) derivative that localizes to regions of active bone metabolism or injury. In murine studies, the 99mTc-tetrazines showed high activity concentrations in knees and shoulder joints, which was not observed when experiments were performed in the absence of TCO-BP. The overall uptake in non-target organs and pharmacokinetics varied greatly depending on the nature of the linker and polarity of the chelate.
Introdução
99m Tc continua a ser o radioisótopo dominante usada na medicina nuclear de diagnóstico, com mais de 50 milhões de procedimentos de imagem realizados por ano em todo o mundo 1, 2, 3. A maioria dos 99m agentes Tc utilizadas clinicamente são do tipo de perfusão radiofármacos. Há um número limitado de compostos-alvo de forma activa em que o 99mTc é dirigido para se ligar a um biomarcador específico através da ligação a uma construção de direccionamento. A criação de 99m alvo radiofármacos Tc é frequentemente prejudicado pela influência de 99m de complexos de Tc-ligando sobre a capacidade da molécula de direccionamento para ligar o biomarcador de interesse, ou os isótopos de meia-vida não é suficiente para utilização com biomoléculas peso molecular mais elevado tais como anticorpos. O último requer tipicamente vários dias antes de as imagens são adquiridas para que a biomolécula para limpar a partir de não-alvo tiss ues. Pré-segmentação oferece uma abordagem alternativa para superar esses desafios.
Pré-segmentação combinada com a química bioorthogonal tem demonstrado ser uma forma eficaz de desenvolver novas sondas imagem molecular para ambos fluorescência e radio-imagiologia 4, 5, 6, 7, 8. A reacção inversa de electrões demanda de Diels-Alder (IEDDA) entre derivados -cicloocteno trans (TCO) 1,2,4,5-tetrazina (Tz) e, como se mostra na Figura 1, tem sido demonstrado ser particularmente eficaz 6. A reação IEDDA com estes componentes podem apresentar cinética rápida na PBS (k 2 ≈ 6.000 M -1 s -1) e alta seletividade, sendo ideal para aplicações in vivo pré-segmentação 9, 10.
e_content "> A abordagem mais comum utilizado envolve a administração de um vector de TCO-derivado de segmentação e depois de um período de atraso suficiente, uma tetrazina radiomarcado é administrado. tetrazinas marcados radioactivamente com base em 11 C, 18 F, 64 Cu, 89 Zr, e 111 no foram relataram 11, 12, 13, 14, 15. em contraste, há apenas um relatório de um marcado com 99m Tc Tz, o qual foi preparado usando um tipo de ligando HYNIC requerendo o uso de co-ligandos para prevenir a ligação e degradação de proteínas in vivo 16. Como alternativa, relatamos aqui a síntese de 99m Tc (I) marcado tetrazinas usando uma família de ligandos que formam complexos estáveis com um tridentados [99mTc (CO) 3] + núcleo. 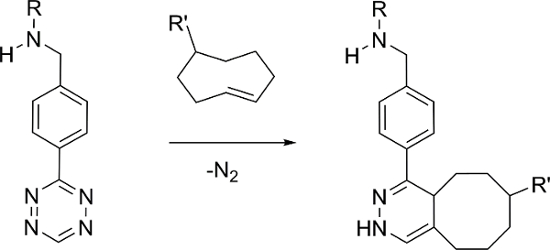
Figura 1: A reacção IEDDA bioorthogonal entre tetrazina e -cicloocteno trans. Por favor clique aqui para ver uma versão maior desta figura.
A família de ligandos preparados contêm quelatos tridentados que variam em polaridade e da natureza do grupo de ligação entre a região de ligação do metal e a Tz (Figura 2). O objetivo foi identificar a 99m Tc-tetrazina construir que poderiam efetivamente localizar e reagir com os locais TCO marcados in vivo e rapidamente claro, não ligadas, a fim de produzir alta meta-se não-alvo rácios. Para testar os ligandos, um TCO-derivado de um bisfosfonato (TCO-PA) foi utilizado 17. Nós mostramos anteriormente que TCO-BP localiza a áreas do metabolismo ósseo activo e pode reagir comtetrazinas radiomarcados in vivo 18. É um reagente conveniente para testar novas tetrazinas, porque ele pode ser preparado num único passo e experiências podem ser realizadas em ratinhos normais onde a localização ocorre principalmente nas articulações (joelhos e ombros).
Protocolo
Os estudos em animais foram aprovados pelo Conselho de Ética em Pesquisa Animal da Universidade McMaster, em conformidade com a Canadian Council on Animal Care (CCAC) orientações.
1. A radiomarcação de ligandos TZ-tridentados com 99m Tc
CUIDADO: Os seguintes procedimentos requerem o uso de compostos radioactivos. O trabalho só deve ser feito em um laboratório licenciado com a adesão a normas de segurança e eliminação. reacções de micro-ondas deve ser realizada num forno de microondas especificamente concebido para a síntese química.
- Síntese de [99mTc (CO) 3 (H 2 O) 3] + 19, 20
- Em um frasco de microondas, combinar 8 mg de K 2 [BH 3 CO 2], 15 mg de Na 2 CO 3, 20 mg de Na 2 B 4 O 7 · 10H 2 O e 25 mg KOCO [CH (OH)]2 COONa · 4H 2 O. Purge o frasco durante 10 min com gás argônio.
- Adicionar 4 ml de 99m TcO ~ 4 - (1.100 MBq, ~ 30 mCi) em 0,9% de solução salina para o frasco.
- Aquece-se a reacção num micro-ondas durante 3,5 minutos a 110 ° C, após 10 s de agitação para garantir uma mistura completa dos reagentes.
- Ajuste o pH da solução para 3,5-4 com ~ 400 mL de HCl 1M. Verifique utilizando papel de pH.
- Radiomarcação de tetrazina ligantes 1-5
- Dissolve-se 2 mg de cada ligando (compostos 1-5) em 250 mL de MeOH 21.
- Adicionar 250 uL de [99mTc (CO) 3 (H 2 O) 3] + (~ 74 MBq, ~ 2 mCi) a cada solução.
- Aquece-se a mistura de reacção utilizando um forno de microondas durante 20 min a 60 ° C.
NOTA: Este passo foi idêntico para todos os 5 tetrazinas. - Para os compostos 2 a 5, evapora-se o solvente e re-dissolve os produtos resultantes em 1 mL de 1: v / v 1 DCM: TFA.
- Aquecer os produtos de reacção dissolvidos (2-5) a 60 ° C em um micro-ondas durante 6 min (2-4) ou 10 min (5).
- Após arrefecimento até à temperatura ambiente, evapora-se o solvente usando um evaporador (36 ° C, 8 mbar, 3 min, 6000 rpm) e dissolve-se o composto seco em 1: 1 de ACN: H 2 O ou 1: 1 de MeOH: H2O, antes da purificação por HPLC.
- Purifica-se os compostos marcado com 99m Tc (1-5), incluindo a separação do produto marcado do ligando não marcado tetrazina, utilizando HPLC (C 18 de fase inversa). Tipicamente, usar um gradiente de eluição de 30:70 ACN: H 2 O (ambos com 0,1% de TFA) a 40:60 ACN: H2O ao longo de 20 min (18 min) e uma coluna analítica C 18 4,6 x 100 mm. Use tanto UV (254 nm) e detecção gama.
- Aqui uma pequena amostra de cada produto marcado e comparar o seu tempo de retenção HPLC para o de um co-injected, não radioactiva, marcada com Re padrão (0,125 mg em 20% de metanol-H2O). O padrão marcado com Re é identificada no rastreio de UV HPLC, e eluir, ao mesmo tempo que o composto 99m Tc-rotulada no rastreio γ-HPLC. Esta co-injecção mostra picos em tempos de retenção semelhantes, o que confirma a identidade do composto de 99m Tc-rotulados.
- Evapora-se o solvente a partir das fracções de HPLC utilizando um evaporador (36 ° C, 8 mbar, 3 min, 6000 rpm).
- Formular o composto purificado, a uma concentração de 7,4 kBq / mL em PBS, contendo BSA a 0,5% e 0,01% de Tween-80.
- Para garantir os compostos marcados são estáveis, realizar um estudo de estabilidade in vitro. Incubar o composto formulado a 37 ° C durante 1, 4 e 6 h, injectando uma pequena quantidade (3,7 MBq) da mistura em HPLC em cada ponto de tempo para avaliar a estabilidade.
2. Estudos Bio-distribuição Pré-alvo
- Preparação de animais
- Utilizando ratos fêmeas de 7-9 semanas de idade, ratinhos Balb / c (n = 3), administrar TCO-BP formulado em solução salina (20 mg / kg) (5 mg / mL), por via de injecção na veia da cauda-.
- Coloque o mouse no dispositivo de contenção física, e identificar as veias localizadas nas superfícies laterais da cauda e limpe com um algodão embebido em álcool. Em cerca de 2 cm da extremidade da cauda, inserir uma agulha de calibre 30 a um ângulo raso, paralelo à veia. Lentamente pressionar o êmbolo para injetar, remova a agulha e aplicar gaze limpa no local da injecção com uma ligeira pressão até o sangramento parar.
- A 1 h após a injecção de TCO-BP, administrar ~ 0,74 MBq (20 uCi) de 99m Tc-tetrazina formulados em 100 ul de 0,5% de BSA, 0,01% de Tween-80 em PBS, através de injecção na veia da cauda.
- Estudos biológicos e de distribuição
- No ponto de tempo desejado (t = 6 H), anestesiar os ratos utilizando 3% de isoflurano e mistura gasosa de oxigénio de 2%. Demonstrar uma parae pitada retirada no rato anestesiado para garantir que eles estão em plano cirúrgico de anestesia.
- Recolha de sangue (1 mL) através de punção cardíaca utilizando uma seringa pré-tratada com heparina. Colocar o mouse sobre as suas costas com o nariz no cone do nariz para anestesia continuou e localizar o apêndice xifóide no animal.
- Inserir uma agulha G 25, ligeiramente à esquerda da linha média do animal no âmbito do processo xifóide, em um ângulo de 20 °. Totalmente inserir a agulha, e, lentamente, puxar o êmbolo para ver sangue no centro da agulha se o coração foi perfurado. Ligeiramente reajustar a agulha, mantendo o êmbolo, se necessário, para perfurar o coração. Lentamente extrair o sangue para dentro da seringa.
- Eutanásia do animal por deslocamento cervical, sob anestesia.
- Coloque cada animal em um saco plástico e usar um calibrador de dose (configuração Tc 99m) para medir todo o nível de atividade do corpo.
- Coletar os seguintes tecidos e fluidos em pré-pesamed contando tubos: sangue, osso (joelho e ombro), vesícula biliar, rins, fígado, estômago (com conteúdo), intestino delgado (com conteúdo), intestino grosso e ceco (com conteúdo), tireóide e traqueia, bexiga com urina , e cauda.
- Lavar tecidos apropriados (excluindo sangue, vesícula biliar e bexiga urinária) em PBS para remover o sangue e secar antes de colocar os tecidos em tubos de contagem adequadas.
- Coloque carcaça de animal em um saco plástico e medir a atividade do corpo inteiro residual usando um calibrador de dose.
- Pesar cada tubo que contém uma amostra de tecido. Subtrair o peso inicial do tubo para obter uma massa de tecido.
- Usar um calibrador de dose (99m Tc definição) para medir a quantidade de actividade de uma amostra de teste (100 uL) no momento da injecção para cada rato.
NOTA: Esta amostra teste é igual ao volume de injecção, dando, assim, a contagem de actividade no momento da injecção. - Na altura da medição do tecido, umaliquot 5 uL da amostra de teste utilizado anteriormente. Utilizar um contador de raios gama múltiplos detectores (configuração Tc 99m) e contam para obter a contagem por minuto (CPM) para a amostra de teste de 5 mL.
- Use os dois valores obtidos em 2.2.9 e 2.2.10 para calcular a atividade e relacionamento CPM usando a equação 1 para obter um factor de conversão (CPM uCi -1).
(1)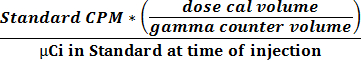
- Utilizar o contador gama para medir a quantidade de radioactividade em cada tecido ou amostra de fluido.
- Use equação 1 para calcular a quantidade de actividade em cada tecido ou fluido no momento da medição em relação à dose total injectada. Este valor é em seguida normalizado pelo peso do órgão e relatados como percentagem da dose injectada por grama (ou seja,% ID / g) de tecido.
- Siga os passos 2.1.2 a 2.2.13 para conduzir um experimento de controle negativo usando os marcado com 99m Tc ligantes tetrazina na Absence de TCO-BP. Sacrifício ratinhos (n = 3) em 0,5, 1, 4 e 6 h pós-injecção e obter o tecido ou fluido, tal como descrito acima.
Resultados
Os ligandos foram sintetizados utilizando diferentes ligantes e agentes quelantes através de um simples estratégia de aminação redutiva (Figura 2), seguido por acoplamento do produto a um tetrazina comercialmente disponíveis 22, 23. A marcação radioactiva foi realizada utilizando o mesmo método para todos os compostos e era altamente reprodutível. O processo foi optimizado variando o pH, a quantidade de ...
Discussão
Uma colecção de quelatos tridentados ligada-tetrazina de polaridades diferentes foi preparado, e a utilidade dos seus complexos 99mTc na reacção com um derivado IEDDA TCO in vivo foi avaliada. Um método eficaz e reprodutível rotulagem 99m Tc foi desenvolvido para cinco tetrazina-quelatos, onde a concentração de ligando foi 10 -3 M. A etapa de marcação foi seguida por desprotecção de t- butilo (para os compostos 2-5). A elevada concentração...
Divulgações
The authors declare they have no competing financial interests.
Agradecimentos
This work supported by research grant funding from the Natural Sciences and Engineering Research Council (NSERC) of Canada, the Ontario Institute for Cancer Research (OICR, #P.SI.015.8), and the Canadian Cancer Society (CCS, #703857). The authors acknowledge the contributions of Dr. Denis Snider who provided assistance in preparing the manuscript.
Materiais
| Name | Company | Catalog Number | Comments |
| Argon gas | Alphagaz | --- | --- |
| Na2CO3 | EMD Millipore | 106395 | --- |
| Na2B4O7·10H2O | Anachemia | S9640 | --- |
| KNaC4H4O6·4H2O | Anachemia | 217255 | --- |
| Technelite 99mTc generator | Lantheus medical imaging | --- | Source of 99mTcO4- |
| 0.9% Saline | Lantheus medical imaging | --- | To elute generator |
| 1 M HCl | Lab Chem | --- | --- |
| MeOH | Caledon | --- | --- |
| ACN | Caledon | --- | HPLC grade |
| Millipore H2O | Thermo Fisher Scientific | Barnstead Nanopure | --- |
| DCM | Caledon | --- | --- |
| TFA | Caledon | --- | --- |
| PBS | Thermo Fisher Scientific | 10010023 | pH 7.4 1x |
| BSA | Sigma Aldrich | A7906 | --- |
| Tween80 | Sigma Aldrich | P8047 | --- |
| Isoflurane | CDMV | 108737 | Supplier: Fresenius Kabi Animal Health |
| HPLC | Waters | 1525 Binary Pump, 2998 Photodiodde Array Detector, E-SAT/IN, Bioscan Flowcount PMT detector (item # 15590) | --- |
| HPLC column for analysis and purification of compounds 2-4 | Phenomenex | 00G-4435-E0 | Gemini® 5 µm C18 110 Å, LC Column 250 x 4.6 mm |
| HPLC column for analysis and purification of compounds 1 and 5 | Waters | 186003115 | XBridge BEH C18 Column, 130 Å, 5 µm, 4.6 mm x 100 mm |
| Microwave Reactor | Biotage | Initiator 8 | --- |
| Biotage V10 Evaporator | Biotage | Serial # V1041 | --- |
| Dose calibrator | Capintec, Inc. | CRC-25R | --- |
| Gamma counter | Perkin Elmer | Wizard 1470 Automatic Gamma Counter | --- |
| Animal room scale | Mettler Toledo | XP105 Delta Range | --- |
| Microwave vials | Biotage | 355629 | 0.5-2 mL |
Referências
- Jurisson, S. S., Lydon, J. D. Potential Technetium Small Molecule Radiopharmaceuticals. Chem. Rev. 99 (9), 2205-2218 (1999).
- Kluba, C. A., Mindt, T. L. Click-to-chelate: Development of Technetium and Rhenium-Tricarbonyl Labeled Radiopharmaceuticals. Molecules. 18, 3206-3226 (2013).
- Amato, I. Nuclear Medicines Conundrum. Chem. Eng. News. 87 (36), 58-70 (2009).
- Hnatowich, D. J., Virzi, F., Rusckowski, M. Investigations of Avidin and Biotin for Imaging Applications. J. Nucl. Med. 28 (8), 1294-1302 (1987).
- Blackman, M. L., Royzen, M., Fox, J. M. Tetrazine Ligation: Fast Bioconjugation Based on Inverse-Electron-Demand Diels-Alder Reactivity. J. Am. Chem. Soc. 130 (41), 13518-13519 (2008).
- Devaraj, N. K., Weissleder, R., Hilderbrand, S. A. Tetrazine-Based Cycloadditions: Application to Pretargeted Live Cell Imaging. Bioconjugate Chem. 19 (12), 2297-2299 (2008).
- Rossin, R., et al. In Vivo Chemistry for Pretargeted Tumor Imaging in Live Mice. Angew. Chem., Int. Ed. 49 (19), 3375-3378 (2010).
- Zeglis, B. M., et al. Optimization of a Pretargeted Strategy for the PET Imaging of Colorectal Carcinoma via the Modulation of Radioligand Pharmacokinetics. Mol. Pharmaceutics. 12 (10), 3575-3587 (2015).
- Rossin, R., et al. Highly Reactive trans-Cyclooctene Tags with Improved Stability for Diels-Alder Chemistry in Living Systems. Bioconjugate Chem. 24 (7), 1210-1217 (2013).
- Rossin, R., Robillard, M. S. Pretargeted Imaging Using Bioorthogonal Chemistry in Mice. Curr. Opin. Chem. Biol. 21, 161-169 (2014).
- Denk, C., et al. Development of a 18F-Labeled Tetrazine with Favorable Pharmacokinetics for Bioorthogonal PET Imaging. Angew. Chem., Int. Ed. 53 (36), 9655-9659 (2014).
- Herth, M. M., Andersen, V. L., Lehel, S., Madsen, J., Knudsen, G. M., Kristensen, J. L. Development of a 11C-labeled Tetrazine for Rapid Tetrazine-Trans-Cyclooctene Ligation. Chem. Commun. 49 (36), 3805-3807 (2013).
- Li, Z., et al. Tetrazine-Trans-Cyclooctene Ligation for the Rapid Construction of 18F Labeled Probes. Chem. Commun. 46 (42), 8043 (2010).
- Nichols, B., Qin, Z., Yang, J., Vera, D. R., Devaraj, N. K. 68Ga Chelating Bioorthogonal Tetrazine Polymers for the Multistep Labeling of Cancer Biomarkers. Chem. Commun. 50 (40), 5215-5217 (2014).
- Zeglis, B. M., et al. A Pretargeted PET Imaging Strategy Based on Bioorthogonal Diels-Alder Click Chemistry. J. Nucl. Med. 54 (8), 1389-1396 (2013).
- García, M. F., et al. 99mTc-Bioorthogonal Click Chemistry Reagent for In Vivo Pretargeted Imaging. Bioorg. Med. Chem. 24 (6), 1209-1215 (2016).
- Russell, R. G. G. Bisphosphonates: The First 40 Years. Bone. 49 (1), 2-19 (2011).
- Yazdani, A., et al. A Bone-Seeking Trans-Cyclooctene for Pretargeting and Bioorthogonal Chemistry: A Proof of Concept Study Using 99mTc and 177Lu-Labeled Tetrazines. J. Med. Chem. , (2016).
- Alberto, R., et al. A Novel Organometallic Aqua Complex of Technetium for the Labeling of Biomolecules: Synthesis of [99mTc(OH2)3(CO)3]+ from [99mTcO4]- in Aqueous Solution and its Reaction with a Bifunctional Ligand. J. Am. Chem. Soc. 120 (31), 7987-7988 (1998).
- Alberto, R., Ortner, K., Wheatley, N., Schibli, R., Schubiger, A. P. Synthesis and properties of boranocarbonate: A convenient in situ CO source for the aqueous preparation of [99mTc(OH2)3(CO)3. J. Am. Chem. Soc. 123 (13), 3135-3136 (2001).
- Lu, G., et al. Synthesis and SAR of 99mTc/Re-labeled Small Molecule Prostate Specific Membrane Antigen Inhibitors with Novel Polar Chelates. Bioorg. Med. Chem. Lett. 23 (5), 1557-1563 (2013).
- Maresca, K. P., et al. Small Molecule Inhibitors of PSMA Incorporating Technetium-99m for Imaging Prostate Cancer: Effects of Chelate Design on Pharmacokinetics. Inorg. Chim. Acta. 389, 168-175 (2012).
- Bartholomä, M. D., et al. Insight into the Mode of Action of Re(CO)3 Thymidine Complexes. ChemMedChem. 5 (9), 1513-1529 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados