É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A
Neste Artigo
Resumo
Aqui descrevemos um método de diálise de equilíbrio rápido (RED) para medir a ligação do fármaco ao caseu de lesões e cavidades de tuberculose pulmonar. O protocolo também é usado com uma matriz espumosa derivada de macrófagos que é um substituto efetivo do caseu.
Resumo
A erradicação da tuberculose requer regimes medicamentosos que possam penetrar as múltiplas camadas de lesões pulmonares complexas. A distribuição de fármacos nos núcleos caseosos de cavidades e lesões é especialmente crucial porque abrigam subpopulações de bactérias tolerantes a fármacos também vulgarmente referidas como persisters. Os métodos existentes para a medição da penetração de fármaco em lesões de tuberculose envolvem costosos e demorados estudos farmacocinéticos in vivo acoplados a técnicas bioanalíticas ou de imagem. A medida in vitro da ligação do fármaco às macromoléculas de caseu foi proposta como uma alternativa a essas técnicas, uma vez que esta ligação dificulta a difusão passiva de moléculas de fármaco através do caseu. A diálise de equilíbrio rápido é um sistema rápido e confiável para realizar estudos de ligação a proteínas plasmáticas e tecidos. Neste protocolo, usamos um dispositivo de diálise de equilíbrio rápido (RED) para medir a ligação do fármaco a homogenatos de caseu que é excised das lesões e as cavidades de coelhos infectados com tuberculose. O protocolo também descreve como gerar uma matriz de substituição de lípido carregado THP-1 macrófagos para usar em lugar de caseum. Este ensaio de ligação caseum / substituto é uma ferramenta importante na descoberta de drogas tuberculose e pode ser adaptado para ajudar o estudo da distribuição de drogas em lesões ou abcessos causados por outras doenças.
Introdução
O tratamento da doença pulmonar tuberculosa requer distribuição eficaz de fármacos em diferentes tipos de lesões. As lesões necróticas e as cavidades contêm centros caseosos que abrigam subpopulações de bactérias tolerantes a drogas ou "persistentes". 1 , 2 A doença cavitária está associada a taxas de cura inferiores e mau prognóstico. 3 , 4 Estudos anteriores mostraram, usando técnicas quantitativas e de imagem, que a capacidade de penetrar o caseu varia significativamente de uma classe de droga para outra. 5 , 6 Estes métodos, no entanto, exigem o uso de modelos de infecção animal que são lentos e tediosos. Foi concebido um ensaio in vitro que mede a ligação do fármaco ao caseu ex vivo . Verificou-se que esta ligação estava inversamente correlacionada com a penetração do fármaco em granulomas caseosos e, por conseguinte, éusado como uma ferramenta de previsão. 7
Diálise de equilíbrio é considerado como o método padrão de ouro para estudos de ligação de proteína de plasma. O dispositivo rápido equilíbrio de diálise (VERMELHO) proporciona um sistema rápido, fácil de usar e fiáveis para a realização de tais ensaios. 8 O dispositivo é constituído por dois componentes: de utilização única, descartáveis que consistem inserções de 2 câmaras separadas por um cilindro vertical de membrana semi-permeável; e placas de base reutilizáveis que pode armazenar até 48 inserções de cada vez. A membrana de diise tem um 8 kDa de peso molecular de corte (MWCO) que é ideal para estudos de ligação a drogas macromolécula. A razão de área para volume elevada superfície do compartimento da membrana de diálise permite uma rápida e equilibração. Ambos os insertos e a placa de base foram validados para o mínimo de ligação não específica. A combinação do dispositivo VERMELHO com técnicas bioanalíticas fornece estimativas precisas sobre as fracções não ligadas de medicamentos em pLasma 8 , 9
Embora originalmente concebido para medir a ligação às proteínas plasmáticas, o dispositivo RED foi utilizado em vários estudos de ligação de tecidos utilizando homogeneizados. 10 , 11 Neste protocolo, medimos a ligação do fármaco ao caseu, os detritos necróticos excisados das lesões necróticas e cavidades de coelhos infectados com tuberculose. A natureza acelular e não vascular do material caseoso facilita a homogeneização numa suspensão homogénea que é compatível com o ensaio.
Dado que o caseu é tedioso para produzir e difícil de encontrar, o protocolo também foi validado para uso com uma matriz substituta que é preparada a partir de macrófagos espumosos. Os macrófagos derivados de monócitos THP-1 são induzidos com ácido oleico para acumular múltiplos corpos lipídicos que lhes conferem a sua aparência "espumosa". Estas células carregadas de lípidos são colhidas eProcessado para produzir uma matriz que usamos como um substituto de caseu. Este estudo mostrou que a ligação do fármaco a esta matriz substituta se correlaciona bem com a ligação ao caseu, imitando eficazmente o processo in vivo que impede a penetração do fármaco no núcleo caseoso de granulomas e cavidades.
Protocolo
Todos os estudos com animais foram realizados de acordo com o Guia para o Cuidado e Uso de Animais de Laboratório dos Institutos Nacionais de Saúde com a aprovação do Comitê Institucional animal Cuidado e Uso do NIAID (NIH), Bethesda, MD. Todos os estudos envolvendo o M. tuberculosis foram realizados num laboratório com nível de segurança biológica de contenção 3 (BSL-3).
Modelo Infecção 1. Coelho e Coleção caseum
- Infect de coelhos Nova Zelândia brancos com M. tuberculosis usando um sistema de exposição de aerossóis só de nariz, como descrito anteriormente. 12, 13 permitir que a infecção progride para 12-16 semanas. Sedar os coelhos com 35 mg / kg de cetamina e 5 mg / kg de xilazina por via intramuscular, sacrificar os coelhos, com 0,22 ml / kg de pentobarbital de sódio por via intravenosa e a fenitoína de sódio e prosseguir com as necropsias.
- Usando pinças e um bisturi, remove pulmões do ca peitoVidade. A partir de cada lobo pulmonar, dissecar cavidades individuais e grandes granulomas necróticos usando um bisturi. Cuidadosamente raspar fora caseu da cavidade e granuloma paredes. Pesar, gravar e armazenar amostras em tubos de 2 mL com tampa roscada a -20 ° C até que esteja pronto para uso.
- Irradia-se as amostras de caseu infecciosas a 3 MegaRad em gelo seco para torná-las não infecciosas e seguras para utilização num laboratório BSL-2.
2. Geração In Vitro de Substituto Caseum de células THP-1
- Crescer monócitos THP-1 em meio RPMI 1640 (L-glutamina 2 mM e soro fetal bovino a 10%) em frascos de cultura de células T175 (80 mL / balão). Incubar os frascos numa atmosfera de CO2 a 5% a 37 ° C durante 3-4 dias.
- Centrifugar a cultura de um balão T175 em dois tubos cônicos de 50 mL a 150 xg por 5 min. Descartar o sobrenadante e suspender o sedimento em 10 mL de meio RPMI 1640.
- Pipetar 5 μL desta cultura em um tubo de 1,5 mL contendo 45 μL de tazul rypan. Mistura-se cuidadosamente por pipetagem. Transferir 10 uL para um hemocitómetro e contar o número de monócitos THP-1 viáveis (sem corante), utilizando um microscópio óptico (ampliação de 10X). Calcular o número de células viáveis por ml de cultura. Diluir com meio RPMI para a densidade final de 1,25 x 10 6 culas / mL.
- Carregar 40 ml da cultura em uma placa de cultura de células grandes (50 x 10 6 culas / placa). Adicionar 40 uL de 100 uM de PMA (forbol 12-myristate13-etilo preparado em etanol) e permitir que as células a aderir durante a noite na incubadora.
NOTA: A concentração final de PMA é de 100 nm. - Dilui-se o ácido puro oleico (OA) (0,89 g / mL) em etanol para a concentração de 0,1 M (ou seja 31,7 mL de OA em 968,3 mL de etanol). Dilui-se esta solução em meio fresco RPMI pré-aquecido a uma concentração de 10 mM. Dilui-se esta suspensão de OA a 0,4 mM (concentração final de trabalho), em meio RPMI pré-aquecido a 37 ° C.
- Remova a mídia e não existentesDas células de cultura de células e adicionar suavemente 40 mL de OA 0,4 mM aos macrófagos THP-1 (THP-M). Incubar a 37 ° C na incubadora durante a noite.
- Use um microscópio de luz com uma ampliação de 40x para confirmar visualmente a presença de numerosas inclusões de corpo lipídico em cada THP-M. Remover todo o meio RPMI das placas de cultura de células e lavar cuidadosamente as células aderentes duas vezes com solução salina tamponada com fosfato (PBS) utilizando uma pipeta serológica de 50 mL.
NOTA: Os corpos lipídicos aparecem como estruturas esféricas pequenas e claras no citoplasma do THP-M. - Adicionar 40 mL de ácido etilenodiaminotetraacético 5 mM (EDTA) em PBS a cada placa. Incubar durante 15 min a 37 ° C.
- Desmonte os macrófagos espumosos (FM) pipetando repetidamente para cima e para baixo sobre a superfície da placa inteira usando uma pipeta serológica de 10 mL. Transferir a suspensão celular para um tubo cônico de 50 mL e girar para baixo a 150 xg por 5 min.
- Ressuspender o sedimento celular em 10 mL de PBS (terceira lavagem com PBS) aNd de transferência para um pré-pesados 15 mL mL tubos cônicos. Girar novamente para 150 xg durante 5 min. Aspirar cuidadosamente o sobrenadante utilizando uma pipeta serológica e descartar.
- Submeter as pastilhas de FM a 3 ciclos de congelamento-descongelamento para lisar as células e incubá-las a 75 ° C durante 20-30 min para desnaturar as proteínas na matriz. Armazenar os grânulos a -20 ° C até estar pronto para uso.
3. Ensaio de Diálise de Equilíbrio Rápido (RED)
- Preparar soluções-mãe 10 mM de todos os compostos de teste em dimetilsulfóxido (DMSO). Diluir a soluções de trabalho de 500 μM em DMSO antes de cada ensaio.
- Pesar o tubo contendo a pastilha substituta de caseu. Subtrair o peso do tubo vazio para derivar o peso do grânulo sozinho. Adicionar 2-3 esferas metálicas por tubo e, utilizando um homogeneizador de tecidos a 1200 golpes / minuto durante 1 minuto, interromper o caseu ou a matriz substituta em PBS (1: 9 p / v) para se obter a suspensão diluída 10x de cada matriz.
- Spike 6,5 μL dos 500ΜM do composto de teste em 643,5 μL de homogeneizado para se obter a concentração final de 5 μM (≤ 1% de DMSO) e vórtex.
- Coloque as inserções VERMELHAS na placa de base. Adicionar 200 μL da matriz droga-cravada na câmara doadora (anel vermelho) de cada inserto VERMELHO e 350 μL de PBS em cada câmara receptora. Preparar 3 insertos para cada composto de teste (amostras em triplicado). Selar a placa com um vedante de placa adesiva e incubar a 37 ° C no termomixador a 200 rpm (1 xg) durante 4 h.
- Após a incubação, misturar suavemente o conteúdo das câmaras doador e receptor por pipetagem para cima e para baixo 2-3 vezes. Pipetar para fora alíquotas de 20 μL de homogeneizado das câmaras de dador e adicionar 20 μL de PBS limpo num tubo de 1,5 mL (1: 1). Do mesmo modo, pipetar para fora alíquotas de 20 μL de amostras de PBS das câmaras receptoras e adicionar 20 μL de homogeneizado limpo (correspondência de matriz). 8
NOTA: A correspondência de matriz elimina aEd para 2 curvas de calibração separadas (em homogeneizado e PBS) a serem feitas para análise quantitativa. O conteúdo da câmara doadora pode sedimentar ao longo do tempo. Misture suavemente o conteúdo por pipetagem antes de remover as alíquotas.
4. Quantificação de LC-MS e Análise de Dados
- Adicionar 160 μL de metanol: acetonitrilo 1: 1 contendo diclofenac 500 ng / mL ou verapamil 10 ng / mL (padrão interno) a cada tubo e vortex para precipitar as proteínas. Centrifugar a 10 000 xg durante 5 min para sedimentar o precipitado e transferir os sobrenadantes para placas de poço profundo de 96 poços para análise de cromatografia líquida-espectrometria de massa (LCMS). 7
- Construir curvas de calibração de 1-1000 nM para cada composto de teste, mantendo a mesma composição de matriz que as amostras acima. Quantificar a concentração do composto de teste em amostras das câmaras doadora e receptora utilizando um método LC-MS.
- Calcular a fracção não ligada ( f u ) oF o fármaco em matriz diluída usando a equação 1. Calcule o f u em matriz não diluída usando a equação 2 ( D = fator de diluição de 10). 14
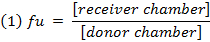
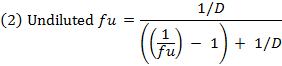
- Verificar a recuperação (balanço de massa) de cada composto utilizando a equação 3 para identificar compostos com estabilidade / metabolismo / questões de ligação não específicas.
NOTA: Recuperação normalmente cai entre 70% e 130%. 15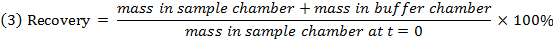
Resultados
Usando este protocolo, testámos centenas de compostos de desenvolvimento de tuberculose para a sua eficiência previsto no penetrante caseum. A Figura 1 visualiza os conceitos básicos do ensaio VERMELHO. A membrana de diálise das inserções VERMELHOS permite para pequenas moléculas não ligadas a difundir a partir do dador bem ao receptor bem como, finalmente, atingir um equilíbrio entre os dois compartimentos. As pequenas moléculas que são ligadas a macromolécu...
Discussão
Lesões necróticas pulmonares e cavidades em pacientes infectados com tuberculose contêm subpopulações de bactérias que são recalcitrantes ao tratamento medicamentoso. Os núcleos caseosos destas estruturas são particularmente responsáveis por abrigar estes persisters em um ambiente extracelular. Acredita-se que uma distribuição favorável de agentes anti-bacterianos nestes locais remotos seja um determinante importante da eficácia do fármaco contra a tuberculose. Antes da validação deste protocolo, ...
Divulgações
Não existem interesses financeiros concorrentes.
Agradecimentos
Desejamos agradecer à Johnson & Johnson, à TB Alliance, à Astra Zeneca, à Rib-X e à Trius Therapeutics pela prestação de bedaquilina, PA-824 (pré-tonsanida), AZD5847, radezolid e tedizolid, respectivamente. Brendan Prideaux, Matthew Zimmerman, Stephen Juzwin, Emma Rey-Jurado, Nancy Ruel, Leyan Li e Danielle Weiner forneceram suporte com análise MALDI, métodos bioanalíticos, preparação do substituto caseu, síntese química e isolamento de caseum de coelho. Este trabalho foi realizado com financiamento da Fundação Bill e Melinda Gates, o prêmio # OPP1044966 e OPP1024050 para V. Dartois, NIH Shared Instrumentation Grant S10OD018072, bem como o financiamento conjunto da Fundação Bill e Melinda Gates e Wellcome Trust para um Centro de Excelência Para Lead Optimization para Doenças do Mundo em Desenvolvimento a P. Wyatt.
Materiais
| Name | Company | Catalog Number | Comments |
| New Zealand White Rabbits | Covance | - | |
| HN878 Mycobacterium tuberculosis | BEI Resources | NR-13647 | |
| Ketathesia (Ketamine) 100 mg/mL C3N | Henry Schein Animal Health | 56344 | |
| Anased (Xylazine) 100 mg/mL | Henry Schein Animal Health | 33198 | |
| Euthasol (pentobarbital sodium and phenytoin sodium) Solution | Virbac | 710101 | |
| THP-1 monocytic cell line | ATCC | ATCC TIB-202 | |
| 175 cm² TC-Treated Flask (T175) | Fisher Scientific | T-3400-175 | |
| RPMI 1640 media w/o glutamine | Fisher Scientific | MT-15-040-CV | |
| Hyclone Fetal Bovine Serum, Gamma irradiated | Fisher Scientific | SH3091003IR | |
| Hyclone L-glutamine, 200 mM | Fisher Scientific | SH3003401 | |
| Cellstar TC dish, 145 mm x 20 mm, vented | Fisher Scientific | T-2881-1 | |
| Phorbol 12-myristate 13-acetate (PMA) | Fisher Scientific | BP685-1 | |
| Ethylenediaminetetraacetic acid | Sigma | E6758 | |
| Oleic acid | Fisher Scientific | ICN15178101 | |
| Pierce RED Device Reusable Base Plate | Fisher Scientific | PI-89811 | |
| Pierce RED Device Inserts, 50/box | Fisher Scientific | PI-89809 | |
| Pierce RED insert removal tool | Fisher Scientific | 89812 | |
| Adhesive plate seal | Fisher Scientific | 08-408-240 | |
| PBS, pH 7.4, 10x 500 mL (Gibco) | Life Technologies | 10010-049 | |
| DMSO | Sigma | 472301 | |
| Acetonitrile | Sigma | 34998 | |
| Methanol | Sigma | 34860 | |
| Verapamil hydrochloride | Sigma | V4629 | |
| Diclofenac sodium salt | Sigma | 93484 | |
| Trypan Blue Solution, 0.4% | Fisher Scientific | 15-250-061 | |
| Ethanol, 200 proof | Fisher Scientific | 04-355-451 | |
| 2010 Geno/Grinder | SPEX SamplePrep | 2010 | |
| Bead Mill Homogenizer Accessory, Metal Bulk Beads | Fisher Scientific | 15-340-158 | |
| 484R Cobalt 60 Irradiator | JL Shepard | 7810-484-1 | |
| INCYTO C-Chip Disposable Hemacytometers | Fisher Scientific | 22-600-100 | |
| Upright Light Microscope | Leica | DM1000 | |
| Binary Liquid Chromatography system | Agilent | 1260 | Multi-compenent |
| Mass spectrometer | AB Sciex | 4000 |
Referências
- Sacchettini, J. C., Rubin, E. J., Freundlich, J. S. Drugs versus bugs: in pursuit of the persistent predator Mycobacterium tuberculosis. Nat Rev Microbiol. 6 (1), 41-52 (2008).
- Zhang, Y. Persistent and dormant tubercle bacilli and latent tuberculosis. Front Biosci. 1 (9), 1136-1156 (2004).
- Aber, V. R., Nunn, A. J. Short term chemotherapy of tuberculosis. Factors affecting relapse following short term chemotherapy. Bull Int Union Tuberc. 53 (4), 276-280 (1978).
- Chang, K. C., Leung, C. C., Yew, W. W., Ho, S. C., Tam, C. M. A nested case-control study on treatment-related risk factors for early relapse of tuberculosis. Am J Respir Crit Care Med. 170 (10), 1124-1130 (2004).
- Dartois, V. The path of anti-tuberculosis drugs: from blood to lesions to mycobacterial cells. Nature Rev Microbiol. 12 (3), 159-167 (2014).
- Prideaux, B., et al. The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med. 21 (10), 1223-1227 (2015).
- Sarathy, J. P., et al. Prediction of Drug Penetration in Tuberculosis Lesions. ACS Infect Dis. 2 (8), 552-563 (2016).
- Waters, N. J., Jones, R., Williams, G., Sohal, B. Validation of a rapid equilibrium dialysis approach for the measurement of plasma protein binding. J Pharm Sci. 97 (10), 4586-4595 (2008).
- Singh, J. K., Solanki, A., Maniyar, R. C., Banerjee, D., Shirsath, V. S. Rapid Equilibrium Dialysis (RED): an In-vitro High-Throughput Screening Technique for Plasma Protein Binding using Human and Rat Plasma. J Bioequiv Availab. 14, 1-4 (2012).
- Liu, X., et al. Unbound drug concentration in brain homogenate and cerebral spinal fluid at steady state as a surrogate for unbound concentration in brain interstitial fluid. Drug Metab Dispos. 37 (4), 787-793 (2009).
- Able, S. L., et al. Receptor localization, native tissue binding and ex vivo occupancy for centrally penetrant P2X7 antagonists in the rat. Br J Pharmacol. 162 (2), 405-414 (2011).
- Subbian, S., et al. Chronic pulmonary cavitary tuberculosis in rabbits: a failed host immune response. Open Biol. 1 (4), 1-14 (2011).
- Via, L. E., et al. Tuberculous Granulomas are Hypoxic in Guinea pigs, Rabbits, and Non-Human Primates. Infect Immun. 76 (6), 2333-2340 (2008).
- Kalvass, J. C., Maurer, T. S. Influence of nonspecific brain and plasma binding on CNS exposure: implications for rational drug discovery. Biopharm Drug Dispos. 23 (8), 327-338 (2002).
- Di, L., Umland, J. P., Trapa, P. E., Maurer, T. S. Impact of recovery on fraction unbound using equilibrium dialysis. J Pharm Sci. 101 (3), 1327-1335 (2012).
- Lenaerts, A. J., et al. Location of persisting mycobacteria in a Guinea pig model of tuberculosis revealed by r207910. Antimicrob Agents Chemother. 51 (9), 3338-3345 (2007).
- Prideaux, B., et al. High-sensitivity MALDI-MRM-MS imaging of moxifloxacin distribution in tuberculosis-infected rabbit lungs and granulomatous lesions. Anal Chem. 83 (6), 2112-2118 (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados