Method Article
Método eletrofisiológico para gravações de tensão de célula inteira de
Neste Artigo
Resumo
As gravações de células inteiras dos fotorreceptores Drosophila melanogaster permitem a medição de solavancos escuros espontâneos, colisões quânticas, respostas macroscópicas à luz e relações tensão-tensão em várias condições. Em combinação com as ferramentas de manipulação genética de D. melanogaster , este método permite o estudo da via de sinalização inositol-lipídico ubíqua e seu alvo, o canal TRP.
Resumo
As gravações de tensão de tensão de células inteiras dos fotorreceptores de Drosophila melanogaster revolucionaram o campo da transdução visual de invertebrados, possibilitando o uso da genética molecular de D. melanogaster para estudar sinalização de inositol-lipídico e canais de Potencial de Receptor Transiente (TRP) no nível de molécula única. Um punhado de laboratórios dominou essa poderosa técnica, que permite a análise das respostas fisiológicas à luz sob condições altamente controladas. Esta técnica permite o controle sobre a mídia intracelular e extracelular; A tensão da membrana; E a rápida aplicação de compostos farmacológicos, como uma variedade de indicadores iônicos ou de pH, aos meios intra e extracelulares. Com uma relação sinal / ruído excepcionalmente alta, este método permite a medição de correntes unitárias espontâneas espirais e induzidas pela luz ( ou seja, colapsos espontâneos e quânticos) e correntes macroscópicas induzidas pela luz (LIC) do pecadoGle D. Melanogaster photoreceptors. Este protocolo descreve, com grande detalhe, todas as etapas-chave necessárias para executar esta técnica, que inclui tanto as gravações eletrofisiológicas quanto as gravações ópticas. O procedimento de dissecção da retina da mosca para a obtenção de ommatidia isolada in vivo e viável ex vivo na câmara do banho é descrito. O equipamento necessário para realizar medições de imagens de células inteiras e fluorescências também é detalhado. Finalmente, são explicadas as dificuldades em usar esta delicada preparação durante experimentos prolongados.
Introdução
Estudos genéticos extensivos da mosca da fruta, Drosophila melanogaster ( D. melanogaster) , iniciados há mais de 100 anos, estabeleceram a mosca D. melanogaster como um modelo experimental extremamente útil para a dissecação genética de processos biológicos complexos. A metodologia descrita abaixo combina o poder acumulado da genética molecular de D. melanogaster com a alta relação sinal-ruído das gravações de grampos de patch de células inteiras. Esta combinação permite o estudo da fototransdução de D. melanogaster como modelo de sinalização de inositol-lipídico e regulação e ativação do canal TRP, tanto no ambiente nativo como na maior resolução de moléculas únicas.
A aplicação do método de gravação de células inteiras para fotoreceptores de D. melanogaster revolucionou o estudo da fototransdução de invertebrados. Este método foi desenvolvido por Hardie 1 e indepFinalmente, por Ranganathan e colegas 2 ~ 26 anos atrás e foi projetado para explorar as extensas ferramentas de manipulação genética de D. melanogaster e usá-los para descobrir mecanismos de fototransdução e sinalização de inositol-lipídico. No início, esta técnica sofreu uma rápida redução da sensibilidade à luz e um baixo rendimento de ommatidia durante o processo de dissecação, o que impediu estudos quantitativos detalhados. Mais tarde, a adição de ATP e NAD à pipeta do remendo aumentou dramaticamente a adequação da preparação para gravações quantitativas prolongadas. Posteriormente, realizou-se uma caracterização extensiva do mecanismo de transdução de sinal ao nível molecular.
Atualmente, a fototransdução de D. melanogaster é um dos poucos sistemas nos quais a sinalização de fosfoinositido e os canais de TRP podem ser estudados ex vivo na resolução de uma única molécula. Isso faz a fototransdução de D. melanogaster e o euA teologia desenvolvida para estudar este mecanismo é um sistema modelo altamente sensível. Este protocolo descreve como dissecar a retina de D. melanogaster e separar mecanicamente a ommatidia isolada das células do pigmento circundante (glia). Isso permite a formação de um giga-seal e um grampo de patch de células inteiras nos corpos celulares do fotorreceptor. Felizmente, a maioria das proteínas de sinalização são confinadas ao rabdom e não se difundem. Além disso, existe um tampão imóvel de Ca 2 + chamado calfotina, localizado entre o compartimento de sinalização e o corpo celular 3 , 4 , e um alto nível de expressão do permutador de Na + / Ca 2+ (CalX) no microvilli 5 . Juntos, o confinamento de proteínas ao rabdomé, o tampão de calofotina ea alta expressão do CalX permitem gravações de células inteiras relativamente prolongadas ( ou seja, até 20 min) sem a perda de componentes essenciaisDo processo fototranscisão e mantendo alta sensibilidade à luz. O seguinte protocolo descreve como obter uma ommatidia isolada e realizar gravações de células inteiras que parecem preservar as propriedades nativas da cascata de fototranscisão. Os experimentos de grampos de parcelas de células inteiras em barricas dissociadas ( Periplaneta americana ) 6 e grilo ( Gryllus bimaculatus ) 7 ommatidia foram realizados de forma semelhante à descrita para D. melanogaster . Além disso, os experimentos de grampos de patch em fotorreceptores dissociados do clam de arquivo ( Lima Scabra ) e Scallop ( Pecten irradians ) foram realizados de maneira ligeiramente diferente daquela realizada em D. melanogaster , permitindo a medição de células inteiras 8 e de canal único 9 . Aqui, as principais realizações obtidas em D. melanogaster usando esta técnica são descritas. A discussão iInclui a descrição de algumas armadilhas e limitações desta técnica.
Protocolo
1. Preparação do reagente
NOTA: Prepare todas as soluções de acordo com as instruções nas Tabelas 1-4 .
- Encha uma seringa de 10 ml com solução extracelular (ES ou ES-0Ca 2+ , conforme necessário, veja a Tabela 1 ) e mantenha-a no gelo.
- Prepare um frasco de solução de trituração (TS, veja a Tabela 2 , ou seja ES ou ES-0Ca 2+ + FBS e sacarose) e mantenha isso no gelo.
- Prepare ES suficiente para o experimento e mantenha isso no gelo até que seja necessário.
NOTA: A perfusão contínua do banho não é necessária, portanto, o volume de ES não precisa ser superior a algumas dúzias de mL. - Usando um filtro PVDF de 22 μm, carregue a solução intracelular (ver Tabela 3 ou Tabela 4 ) em uma seringa de 1 mL com uma ponta alongada de enchimento de eletrodo. Mantenha isso no gelo.
2. Configuração geral das ferramentas de dissecação
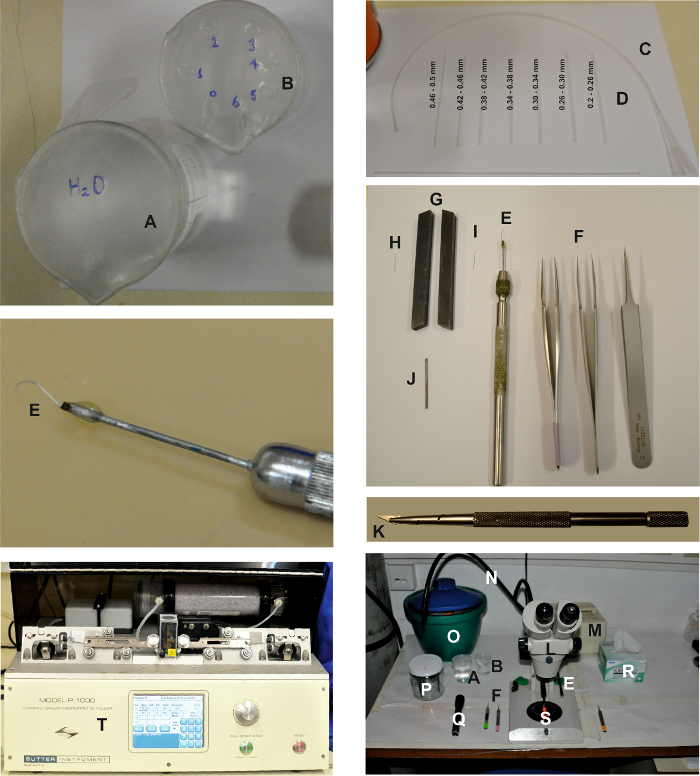
Figura 1: Ferramentas e dispositivos necessários para fazer a preparação da Ommatidia isolada. As imagens mostram os vários dispositivos necessários para criar a preparação ommatidia isolada, conforme descrito no protocolo detalhado acima. Duas taças, uma cheia de água ( A ) e a outra cheia com etanol ( B ) para limpar as pipetas de trituração ( D ), que estão conectadas à tubulação ( C ). As ferramentas de dissecação são: 2 pares de finos e 1 par de pinças grossas ( F ) e uma scooper retina ( E ). Para preparar a scooper de retina, uma agulha de micro-dissecção ( H ) é pressionada entre duas ferramentas de torno que atuam como um vira ( G ) para achatar a parte superior da agulha ( I ). Então está conectado a um pi alongado Ece de metal usando cola ( J ) e montado sobre um suporte de agulha ( E ). Pedaço de lâmina de barbear e suporte: quebre e monte um pequeno chip triangular de uma lâmina de barbear usando um suporte de lâmina de barbear ( K ). A área de trabalho de dissecção é composta por uma binocular ( L ) e uma fonte de luz vermelha fresca (( M) ) com duas guias de luz ( N ). As ferramentas de dissecção, incluindo as pinças ( F ), a retina scooper ( E ), as taças ( A e B ), uma lanterna com um filtro vermelho ( Q ) e delicados limpadores ( R ) são colocados em ambos os lados do binóculo. Um balde de gelo com o ES, o FBS-ES, as seringas de solução intracelular, a placa de Petri de 60 mm ( S ) e o suporte do eletrodo ( P ) também são colocados na mesa. Os eletrodos de gravação são puxados usando um extrator horizontal ( T ).E.com/files/ftp_upload/55627/55627fig1large.jpg "target =" _ blank "> Clique aqui para ver uma versão maior desta figura.
- Construa uma scooper retina para isolar a retina.
- Insira o ponto (1-4 mm) de uma agulha de micro-dissecção (agulha entomológica, 12 mm de comprimento, 0,1 mm de diâmetro) entre as duas mandíbulas do torno e aplique-a batendo com um pequeno martelo.
- Monte a agulha achatada em um suporte de agulha micro-dissecante (veja a Tabela de Materiais ).
- Usando um par de pinças, curve a extremidade achatada da agulha para formar um gancho com uma curvatura de ~ 2,5 mm.
- Crie pipetas de trituração para a separação ommatidia.
- Coloque um capilar de vidro de 1,2 x 0,68 mm (OD x ID) sobre uma chama aberta e espreite-o para reduzir a abertura.
- Medir o tamanho da abertura capilar no microscópio. Classifique as pipetas de trituração ommatidial criadas em seveN grupos de acordo com o tamanho das suas aberturas ( ou seja, 0,2-0,5 mm). Armazene-os em recipientes separados e adequados ( por exemplo , tubos de ensaio).
- Preencha um copo pequeno com água duplamente destilada (DDW) e outro copo pequeno com etanol a 70%. Cubra cada copo com uma folha de parafina.
- Perfure um pequeno orifício na folha de parafina que cobre o copo DDW (veja a Figura 1A ).
- Perfure sete pequenos orifícios na folha de parafina que cobre o vaso de etanol e identifique os furos de 0 a 6 (veja a Figura 1B ).
- Coloque uma pipeta de trituração ommatidial de cada grupo de tamanhos em cada furo de parafina, de modo que a pipeta com a maior abertura esteja localizada no orifício 0 e a pipeta com a menor abertura esteja localizada no orifício 6.
- Conecte uma ponta de pipeta plástica de 200 μL a uma peça de tubo de polietileno de 35 cm de comprimento, 1,57 x 1,14 mm (OD x ID). ConexãoT a outra extremidade da tubulação para uma das pipetas de trituração ommatidial com a maior abertura ( ou seja, 0,46 - 0,5 mm), garantindo que a ponta da pipeta de trituração não esteja voltada para dentro da tubulação.
- Prepare pipetas de gravação de células inteiras puxando pipetas de grampos de patch de um filamento de borosilicato de 1 x 0,58 mm (OD x ID) contendo capilares de vidro.
NOTA: A resistência das pipetas deve ser de 8-15 MΩ quando se utiliza a solução intracelular à base de gluconato de potássio (IS1). Qualquer extrator de pipeta apropriado pode ser usado (por exemplo, veja a Tabela de Materiais ). Não é necessário polir fogo. - Prepare uma câmara de gravação (veja a Figura 2 ), fixando uma lamínula (veja a Tabela de Materiais ) na parte inferior da câmara do banho usando uma parafina derretida ou uma graxa de silicone de alto vácuo. Use qualquer câmara caseira ou comercial adequada que permita o acesso e a perfusão de eletrodos.
- Monte o banho no palco de um microscópio invertido. Coloque o tubo do sistema de perfusão, o sistema de sucção e o solo ( ou seja , fio / aglomerado Ag-AgCl) no banho (ver Tabela de Materiais e Figura 2 ).
- Coloque dois pares de pinças # 5 finas ( Figura 1 ) na superfície de trabalho para uso durante a dissecção da retina e as etapas de isolamento de ommatidia.
3. D. melanogaster Criando
- Raise D. Melanogaster voa com baixa densidade populacional ( ou seja, ~ 20 moscas em uma garrafa de 6 onças) em garrafas contendo alimento de farinha de milho padrão a 19-24 ° C.
NOTA: é preferível trabalhar em moscas adaptadas ao escuro. Para manter a alta sensibilidade à luz, reduza a diversidade e evite a degeneração da retina em moscas mutantes. - Atrás das moscas no escuro por pelo menos 24 h antes da experiência.
NOTA: as moscas usadas para as experiências devem ser receGeralmente fechado (<2 h) e ainda suave, pálido e exibe o mecônio. Ommatidia também pode ser prontamente preparado a partir de pupas, embora sua sensibilidade à luz seja então fortemente dependente dos 10 anos.
4. Dissecção Retina e Isolamento Ommatidia: Opção 1
NOTA: Execute todas as seguintes etapas no microscópio de zoom estereoscópico usando uma amplificação adequada para visualizar corretamente a preparação (ver Figura 1 ).
- Coloque quatro gotas de ES-0Ca 2+ e uma gota de solução de TS em uma placa de Petri de 60 mm que foi virada.
- Usando pinças ásperas, pegue um recém-eclosed (<2 h depois da eclosão) voando pelas asas ou pelo corpo. A partir deste ponto, execute todos os procedimentos rapidamente e sob iluminação vermelha fraca a 20 ± 1 ° C.
- Enquanto ainda agarra a mosca com as pinças ásperas, use o primeiro par de pinças finas para separar a cabeça da mosca do corpo. SubmeRGE a cabeça na primeira queda ES-0Ca 2+ .
- Disseca a cabeça pela metade ao longo do plano sagital usando o segundo par de pinças finas. Certifique-se de que, no final desta etapa, ambos os olhos ainda estão intactos.
- Transfira uma metade da cabeça para a segunda gota ES-0Ca 2+ e a outra metade para a terceira queda ES-0Ca 2+ .
- Usando a pinça fina, remova a maior parte do tecido que envolve o olho possível e assegure-se de que nenhum dano seja causado à retina.
- Aperte firmemente a borda de uma córnea com as pinças finas e coloque a retina usando a scooper.
NOTA: Após a conclusão deste passo, a córnea será deixada vazia e intacta, separada de uma retina intacta. - Enxaguar a pipeta de trituração conectada à tubulação com DDW e preencher a pipeta com uma pequena quantidade de ES-0Ca 2+ a partir da quarta gota.
NOTA: Esta etapa deve ser realizada sempre que uma nova pipeta de separação ommatidia é usada e removidaM o copo de etanol (a solução que enche a pipeta deve combinar a solução na qual a retina está submersa). - Suavemente aspirar pela boca para desenhar a retina isolada na pipeta. Tenha extremo cuidado de não aspirar bolhas de ar na pipeta.
- Transfira a retina isolada para a queda de TS. Execute as etapas 4.6-4.10 no segundo olho também.
- Limpe as gotas de ES-0Ca 2+ usando toalhetes delicados, deixando apenas a gota de TS contendo ambos retina na placa de Petri. Adicione mais seis gotas de TS ao topo da placa de Petri. Transfira ambas as retinas para uma das outras gotas TS.
- Substitua a pipeta de trituração por uma pipeta de abertura de menor diâmetro. Enxágüe como descrito no passo 4.8, usando TS como solução para preencher a pipeta.
- Rápido e repetidamente, aspira e expira ambos retina na solução para iniciar a separação de ommatidia isolada despojada de células de pigmento de toda a retina.
NOTA: O omma isoladoTidia está visível na queda TS, e à medida que o processo de isolamento avança, a queda TS fica menos translúcida. - Transfira a retina restante para a próxima queda TS. Preencha a pipeta com toda a gota TS anterior (contendo a ommatidia isolada) e expira a queda na câmara do banho.
- Repita as etapas 4.12-4.14 para obter uma ommatidia isolada máxima. Aguarde aproximadamente 1 minuto para permitir que a ommatidia isolada afunda e se une ao fundo da câmara de banho.
- Usando o sistema de perfusão, comece o fluxo de ES-0Ca 2+ com 1,5 mM de Ca 2+ na câmara do banho. Certifique-se de que a câmara está completamente cheia com a solução, de baixo para cima, e que o solo está completamente submerso na solução. Continue a lavar o banho 4-5x.
5. Dissecção Retina e Isolamento Ommatidia: Opção 2
Nota: execute todas as seguintes etapas no microscópio de zoom estereoscópico, usando um ampliAdequada para visualizar adequadamente a preparação (ver Figura 1 ).
- Prepare uma lâmina de lâmina e suporte. Retire e monte um pequeno chip triangular de uma lâmina de barbear usando um suporte de lâmina de barbear ( Figura 1 ).
- Prepare um prato / bloco de dissecação de silicone de acordo com as instruções do fabricante (veja a Tabela de Materiais ).
- Para a dissecção, crie uma grande gota (<0,5 mL) de solução ES no bloco de dissecção de silicone. Adicione duas gotas de "reservatório" (~ 50 μL a cada) de solução de TS a uma placa de Petri de 60 mm
- Imobilize uma nova eclosed (<2 h post-eclosion) voe em um tubo de vidro no gelo e pegue-a pelas asas usando uma pinça. A partir deste ponto, execute todos os procedimentos rapidamente e sob iluminação vermelha fraca a 20 ± 1 ° C.
- Segurando a mosca com pinças, corte a cabeça da mosca usando uma lâmina de lâmina de barbear montada em um suporte. Pegue um alfinete de inseto (12 mm de comprimento,0,1 mm de diâmetro) com a pinça e perfurar a cabeça entre os olhos.
- Submergir brevemente a cabeça em etanol a 70%; Isso evita que bolhas de ar se formem na superfície da cabeça / olho. Coloque a cabeça sob a gota ES no prato de dissecção de silicone.
- Corte os dois olhos usando a lâmina da lâmina de barbear usando um movimento de serrar ao longo da linha da margem frontal do olho.
- Aperte firmemente a borda de uma córnea com as pinças finas.
- Retire a retina usando o scooper.
NOTA: Após a conclusão deste passo, a córnea será deixada vazia e intacta, separada de uma retina intacta. - Sem danificar a retina, use as pinças e scooper para retirar suavemente os sacos de ar aderentes e excesso de tecido cerebral.
NOTA: A preparação de retina isolada também é útil para análises de Western blot de proteínas de retina não específicas 11 , histologia de montagem total e imagem de retina inteira. As gravações de patch clamp também podem ser realizadas em phOtoreceptores de toda a retina 12 . - Pegue a pipeta de trituração com o maior diâmetro, conecte-a à tubulação e preencha a pipeta com uma pequena quantidade de TS de uma das gotas do reservatório na placa de Petri por sucção suave ( ou seja, pela boca). Execute este passo sempre que uma nova pipeta de trituração de Ommatidia for usada.
- Tire suavemente o TS sobre os dois retina pela boca e, em seguida, desenhe a retina isolada na pipeta usando uma sucção suave. Tenha cuidado para garantir que não haja bolhas de ar na pipeta.
- Transfira a retina isolada para a placa de Petri, formando uma pequena gota (~ 20 μL) e lave-os uma ou duas vezes com TS de uma das gotas do reservatório.
- Incube a retina no escuro por 20-25 minutos.
- Substitua a pipeta de trituração de ommatidia por uma pipeta com uma abertura de menor diâmetro (usando TS fresco de uma das gotas do reservatório como no passo 4.6 para preencher a pipeta).
- RapidamenteAspirar e expirar os retinos em uma pequena gota (~ 20 μL) para iniciar a separação da ommatidia isolada.
NOTA: Na primeira etapa, a glia pigmentada circundante deve se desintegrar, deixando pequenos detritos visíveis na solução. - Depois de acumulados pequenos detritos substanciais, mas antes de se separarem muitas ommatidias, use TS fresco de uma das gotas do reservatório e transfira a retina para uma nova gota pequena.
- Selecione uma pipeta de trituração de menor diâmetro, preenchimento e continue triturando.
NOTA: Como o ommatidia agora começa a se separar, suas formas alongadas devem ser claramente visíveis sob o alto poder do estereomicroscópio. Se necessário, continue mudando as pipetas de trituração para diâmetros menores até que um bom rendimento de ommatidia seja visível - Uma vez que um rendimento razoável de ommatidia é visível e a queda não é mais translúcida, preencha a pipeta com toda a gota contendo a ommatidia isolada e expira a gota gentilmente naParte inferior da câmara de banho pré-preenchida com ES.
- Aguarde aproximadamente 1 minuto para permitir que a ommatidia isolada se afaste e se assente no fundo da câmara do banho.
- Usando o sistema de perfusão, comece o fluxo de ES na câmara de banho. Certifique-se de que a câmara está completamente cheia da solução, de baixo para cima, e que o solo está totalmente submerso na solução. Continue a lavar o banho 4-5x.
NOTA: Depois disso, a perfusão contínua não é necessária, embora o banho seja lavado brevemente antes de introduzir uma nova pipeta de remendo.
6. Gravação de células inteiras

Figura 2: Visão geral da Configuração eletrofisiológica e óptica. A instalação contém uma gaiola Faraday de ferro, pintada de preto ( F ). O lado da frente é coberto usando uma cortina preta com malha de cobre dentro. Esta configuraçãoA uração permite que a preparação seja completamente isolada de qualquer luz dispersa e é adequada para registrar batimentos espontâneos escuros. O microscópio de fluorescência invertido ( A ) é fixado em uma tabela anti-vibração ( E ). O aparelho de gravação de fotorreceptores consiste em uma câmara caseira de banho de vidro acrílico ( O ) com entrada de perfusão ( Q ), uma pipeta de sucção ( S ) e um solo de prata-cloreto de prata ( P ). A câmara do banho é montada no palco do microscópio ( T ) com um adaptador caseiro. A pipeta de gravação é conectada através de um fio de cloreto de prata e prata a um suporte de vidro acrílico, que está conectado ao estágio da cabeça do amplificador ( C ). O estágio da cabeça é então montado em um micromanipulador grosso que é montado em um micromanipulador mecânico XYZ fino ( B ). O sistema de perfusão ( D ) é composto por um conjunto de seringas, enquanto o fluxo de líquidoD é controlado por válvulas de pressão ( H ). O rack está conectado eletricamente ao mesmo chão central ao qual todo o equipamento dentro da gaiola de Faraday está conectado e consiste em um amplificador de grampos de correção ( N ), um osciloscópio ( J ), um gerador de pulso / função ( K ), um A para Conversor D ( L ), um controlador de perfusão ( I ) e uma roda de filtro e controlador de obturador ( M ). Para experiências de imagem, uma câmera CCD arrefecida (-110 ° C, veja a Tabela de Materiais ) é conectada através de uma porta lateral ( G ). Clique aqui para ver uma versão maior desta figura.
NOTA: Durante todas as etapas a seguir, use apenas iluminação de luz vermelha fraca e assegure-se de que a exposição da ommatidia à luz seja mínima ( ou seja, trabalhe rapidamente eDesligue a fonte de luz de dissecação e a iluminação vermelha da câmara usadas para visualizar o ommatidia ao executar tarefas que não exigem a visualização do ommatidium). Além disso, execute todas as seguintes etapas de acordo com o protocolo eletrofisiológico padrão.
- Sob um microscópio invertido (objetivo 40X), inspecione cuidadosamente todas as ommatidias no banho e escolha um ommatidium adequado para a experiência.
- Certifique-se de que a membrana externa do ommatidium é lisa e intacta, que o eixo longo está aproximadamente em ângulo reto em relação à direção de aproximação do eletrodo (como visto na Figura 3A ) e que a seção distal do ommatidium não está rodeada por nenhum Excesso de tecido. Coloque o ommatidio escolhido no eixo óptico da lente de objetivo (no centro do campo de visão) para garantir uma iluminação uniforme.
- Preencha uma pipeta com solução intracelular (IS1 ou IS2).
NOTA: Para mimCertifique-se de resposta de intensidade e análise de colisão, use IS1. Para medir o potencial de reversão dos canais sensíveis à luz, use IS2. - Monte a pipeta do remendo no suporte do eletrodo.
- Mexa na pipeta pela boca, através do tubo conectado ao suporte do eletrodo, fazendo com que ele se encha com pressão positiva. Feche a válvula do tubo para manter a pressão.
- Usando o micromanipulador, insira o eletrodo na câmara do banho.
- Guie o eletrodo perto da seção distal do ommatidium, de modo que não haja contato entre o eletrodo e o ommatidium, até que uma pequena covinha (devido à pressão positiva na pipeta do remendo) possa ser observada no ommatidium.
- Abra o software de gravação (consulte a Tabela de Materiais ). Abra o "módulo de teste de membrana" para aplicar pulsos de tensão quadrada contínua de 2 mV a uma taxa de 100 Hz.
- Defina o potencial de junção para "zero", ajustando o kno apropriadoB no amplificador de grampo de patch para definir a base do pulso quadrado para a corrente "zero"
NOTA: A configuração eletrofisiológica inclui um estágio principal ( ou seja , amplificação no primeiro estágio) conectado a um amplificador ( ou seja , amplificação em segundo estágio). O sinal analógico amplificado é convertido em um sinal digital usando o conversor A / D, que é controlado pelo software instalado em um computador PC. - Solte a pressão positiva na pipeta, abrindo a válvula do tubo conectado ao suporte do eletrodo. Crie suavemente pressão negativa na pipeta, sugando o tubo, levando à associação da pipeta com a membrana celular. Feche a válvula do tubo para manter a pressão.
- Certifique-se de que a resistência do eletrodo vista na tela do computador seja elevada a 100 - 150 MΩ. Solte a pressão negativa na pipeta abrindo manualmente a válvula do tubo conectado ao suporte do eletrodo.
- Certifique-se de que oA resistência ao ectrodo é elevada a pelo menos 1-2 GΩ.
NOTA: Neste ponto, foi formada uma vedação entre o eletrodo e o fotorreceptor. - Deslize as correntes capacitivas da pipeta, ajustando o botão apropriado no amplificador de grampo de patch.
- Crie ataques rápidos, curtos e vigorosos de pressão negativa no eletrodo, sugando pela boca fora do tubo conectado ao suporte do eletrodo para "quebrar" na membrana do fotorreceptor e criar uma configuração de células inteiras. Alternativamente, use o "botão Zap" para aplicar pulsos elétricos curtos e retangulares, começando com uma duração de "0,1 ms" ou aplique uma combinação de ambos os métodos.
NOTA: A geração da configuração de células inteiras é revelada por um aumento súbito na capacitância da pipeta (tipicamente ~ 60 pF para um fotoreceptor R1-6 de tipo selvagem; uma capacitância de apenas ~ 20 pF indica uma gravação de um fotorreceptor R7; uma capacitância acima ~ 90 pF indica uma gravação de doisFotorreceptores). - Defina o potencial de retenção do fotorreceptor para a tensão necessária (geralmente, -70 mV), manualmente, usando o botão apropriado no amplificador do grampo do patch.
NOTA: É possível realizar este passo após a obtenção de um selo (etapa 6.11) e antes da configuração da célula inteira ter sido alcançada. - Deslocamento das correntes capacitivas e da resistência em série (um valor de resistência da série medido superior a 25 MΩ indica que a pipeta do eletrodo foi entupida) e, se necessário ( ou seja, para correntes maiores), aplique uma compensação de resistência série usando os botões apropriados no amplificador de grampos .
- Feche a cortina dianteira preta da gaiola de Faraday para obter escuridão máxima e isolamento elétrico.
- Comece o processo de gravação usando o software e administre estímulos leves e / ou substâncias farmacológicas de acordo com o procedimento experimental desejado.
7. Wh simultâneaGravações de células ole e imagens de Ca 2 +
- Para indicadores de Ca 2+ codificados geneticamente, isolar a ommatidia conforme descrito acima usando moscas de D. melanogaster expressando GCaMP6f 13 . Use uma câmera CCD (veja a Tabela de Materiais ) para a medição de fluorescência e assegure-se de que o microscópio esteja equipado com filtros apropriados de excitação e emissão e um espelho dicroico (ver Tabela de Materiais ) 4 .
- Para o uso de indicador de Ca 2+ exógeno ( Figura 4 , veja a Tabela de Materiais ), isole a ommatidia conforme descrito acima. Além disso, assegure-se de que a solução de pipeta inclua um indicador de cálcio de 20-100 μM.
- Use o software de imagem (veja a Tabela de Materiais ) para adquirir imagens a uma taxa de 40 Hz. Execute a aquisição da imagem durante um período escuro de 10 s seguido por uma luz forte de 2 sMultiplicação.
- Use o software de imagem e defina uma Região de Interesse (ROI). Meça a intensidade de florescência no ROI. Média a fluorescência escura (F D ) e subtrai-la das gravações de fluorescência durante a estimulação da luz (F L ) (F L -F D ). Normalize estas medidas de acordo com a intensidade de fluorescência no início da estimulação de luz (F L 0 ).
Resultados
O método descrito permitiu a gravação precisa das correntes unitárias fundamentais que geram solavancos quânticos espontâneos e evocados pela luz, que somem para produzir a resposta macroscópica à luz, em condições definidas. Também permitiu a comparação entre moscas selvagens e mutantes que apresentam defeitos nas moléculas críticas de sinalização ( Figuras 3 e 5 ) 14 , 15 , 16 , 17 , 18 . Além disso, a capacidade de medir o potencial de reversão sob condições bi-iónicas revelou propriedades biofísicas fundamentais dos canais TRP e TRP (TRPL) 18 , 19 . Também permitiu a medição dos efeitos das substituições de aminoácidos na região de poros da TRP que modificou o seu Ca 2+Permeabilidade 20 .
A resposta de luz obtida por gravações de grampos completos depende de uma intensidade luminosa de pelo menos 4 ordens de grandeza. Isso não pôde ser resolvido usando métodos de gravação ERG e intracelular. Conseqüentemente, uma série de respostas a breves flashes de intensidade crescente e um gráfico da função de resposta de intensidade revelaram uma linearidade estrita da resposta instantânea com o aumento da intensidade da luz. A linearidade estrita detém até pelo menos várias centenas de pA, mas é discutível se, a partir daí, é linearidade ou controle de grampo que se desintegra ( Figura 6 ). Estes resultados sugerem que as respostas macroscópicas à luz são uma soma linear das respostas unitárias à luz ( ou seja, quoturas quânticas).
Foi bem estabelecido usando gravações de tensão que diminuem a estimulação de luz indPossui flutuações de tensão discretas ( ou seja, quoturas quânticas) na maioria das espécies de invertebrados. Os derrames quânticos de D. melanogaster resultam da abertura concertada de ~ 15 canais TRP e ~ 2 canais TRPL no pico da colisão 18 . Cada colisão é gerada pela absorção de um único fóton, enquanto a resposta macroscópica a luzes mais intensas é o somatório dessas respostas elementares 14 , 21 . Os solavancos variam significativamente em latência, tempo e amplitude, mesmo quando as condições de estímulo são idênticas. A geração de colisões é um processo estocástico descrito pelas estatísticas de Poisson, pelo qual cada fóton efetivamente absorvido provoca apenas uma colisão. A relação single-photon-single-bump exige que cada passo na cascata inclua não apenas um mecanismo eficiente de "ativação", mas também um mecanismo de "desligamento" igualmente eficaz. A vantagem funcional é a produção de umContador de fótons muito sensível com uma resposta transitória rápida muito adequada à sensibilidade e à resolução temporal requerida pelo sistema visual. O requisito de um mecanismo de desligamento eficiente é revelado quando o fotopigmento ativo ( ou seja , metarododina, M) ou seu alvo, o G q α, não consegue inativar e leva à produção contínua de solavancos muito tempo depois que a luz é desligada ( Figura 3 ) 15 , 22 , 23 , 24 .
A colisão representa a atividade cooperativa dos canais TRP / TRPL em um microvillus. Como tal, qualquer hipótese de ativação do canal também deve explicar a ativação do canal cooperativo. Recentemente, Hardie e colegas demonstraram que a luz evoca as rápidas contrações dos fotorreceptores, sugerindo que o sensível à luzOs canais e (TRP / TRPL) podem ser fechados mecanicamente 25 . Esta ativação mecânica, juntamente com os prótons observados liberados pela hidrólise PIP 2 mediada por PLC, promove a abertura dos canais TRP / TRPL e explica a natureza cooperativa da produção de colisão 26 . Atualmente, os fotorreceptores de D. melanogaster são um dos poucos sistemas em que a sinalização de fosfoinositidos e os canais de TRP podem ser estudados in vivo , tornando a fototransdução de D. melanogaster ea metodologia desenvolvida para estudar este mecanismo, um sistema modelo altamente valioso.
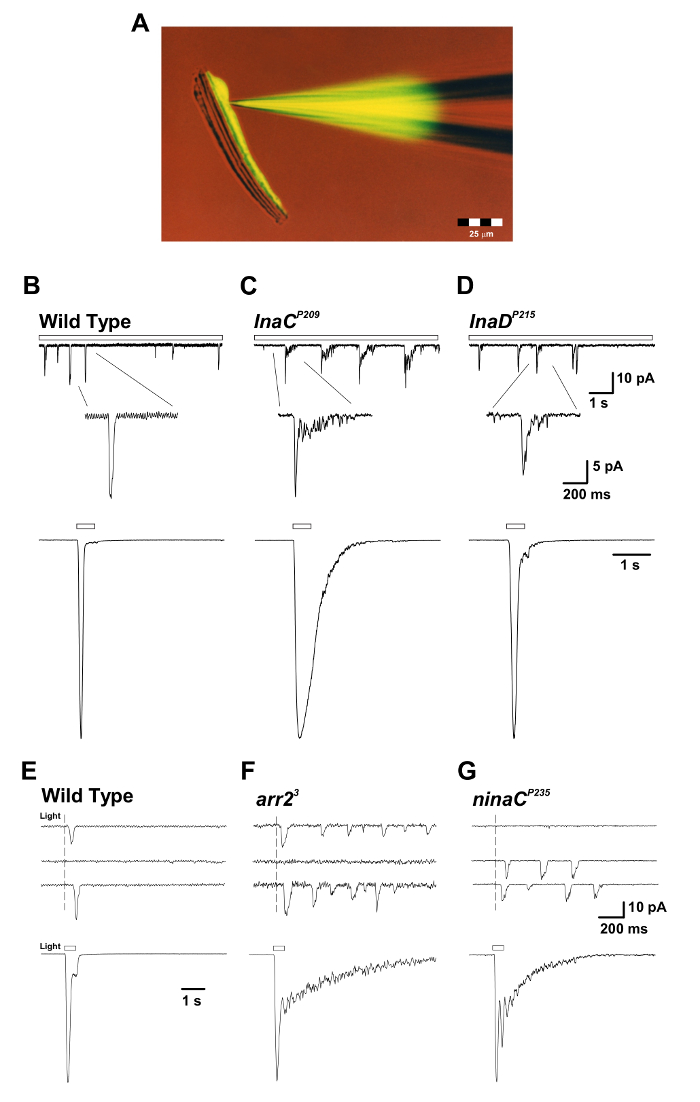
Figura 3: Os mutantes InaC P209 e InaD P215 revelam a rescisão da resposta lenta da resposta macroscópica à luz e dos solavancos únicos de quantum. ( A ) O ommatidium prepa isoladoA ração com uma pipeta de remendo preenchida com corante fluorescente Lucifer Yellow CH (excitação: 430 nm; emissão: 540 nm) é apresentada durante uma gravação de células inteiras. Note-se que o corante fluorescente difundiu e rotulou um único corpo de célula fotorreceptora e que os corpos celulares do fotorreceptor são destacados de seus axônios alongados, mas ainda mantêm a viabilidade. Esta preparação é adequada para gravações simultâneas de células inteiras e experiências de imagem. ( BD ) Painéis superiores: as respostas de colisão quântica de tensão de célula inteira à luz fraca contínua (barra aberta) nas moscas mutantes WT, inaC P209 e inaD P215 . Uma terminação lenta das protuberâncias é observada nos mutantes ina P209 e inaD P215 em relação às moscas WT. A inserção abaixo exibe a forma ampliada de solavancos simples. Painéis inferiores: respostas macroscópicas normalizadas de células inteiras para um pulso de luz de 500 ms (1,5 x 10 5 fótons por s) do tipo selvagem acima E as moscas mutantes. (EG) Painéis superiores: as respostas de colisão quântica de tensão de célula inteira a uma resposta breve (1 ms), luz fraca, induzindo respostas de fóton único em moscas mutantes Wildtype , arr2 3 e NinaC P235 . Observe o trem de solavancos observados nas moscas mutantes arr2 3 e ninaC P235 em resposta a uma única absorção de fótons. Painéis inferiores: a tensão de célula inteira pressionou as respostas normalizadas a um pulso de luz de 500 ms (1,5 x 10 4 fótons / s) nos mutantes correspondentes. Observe o término lento das respostas macroscópicas observadas no arr2 3 E ninaC P235 mutante voa em relação ao WT. Clique aqui para ver uma versão maior desta figura.
D / 55627 / 55627fig4.jpg "/>
Figura 4: A dinâmica do Ca 2+ celular após o fluxo de Ca 2+ induzido por sinal é afetada pela calfotina. Uma série temporal de imagens fotorreceptoras de tipo selvagem e Cpn 1% voa mostrando a fluorescência do indicador de Ca 2+ durante a estimulação de luz. As imagens de intensidade bruta são plotadas usando codificação de falso cor (barra = 10 μm; cabeças de seta indicam a pipeta). Figura reimpressa com permissão de Weiss et al. 4 . Clique aqui para ver uma versão maior desta figura.
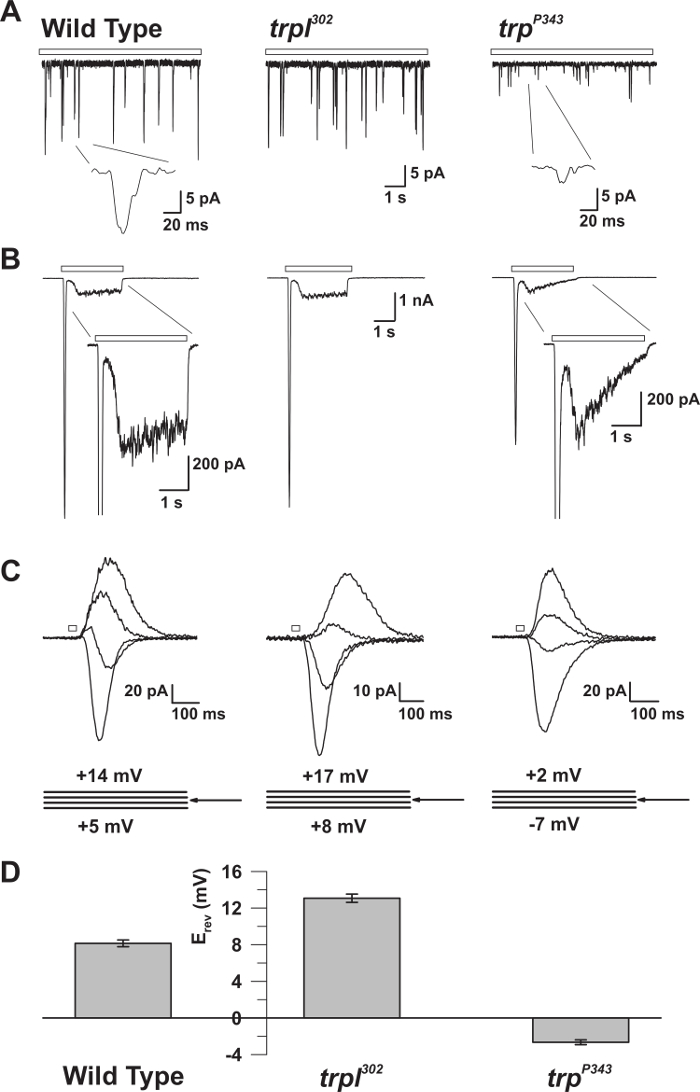
Figura 5: Propriedades eletrofisiológicas dos mutantes WT, trp e trpl. ( A ) Reconhecimento da braçadeira de tensão da célula inteiraRações de solavancos quânticos em resposta à luz fraca contínua (barra aberta) em moscas nulas mutantes WT, trpl 302 e trp P343 . Amplitudes altamente reduzidas de trp P34 3 batidas são observadas. Inserção: são mostradas as colisões quânticas únicas ampliadas de moscas silvestres nulas de wildtype e trp P343 . ( B ) Gravações de tensão de tensão de célula inteira em resposta a um pulso de luz de 3 s de tipo selvagem e os mutantes correspondentes. A resposta transitória do estado estacionário do mutante trp P343 é observada. Inserção: são mostradas respostas de luz ampliadas de mutantes WT e trp P343 . ( C ) Uma família de correntes induzidas pela luz sobrepostas das estirpes da mosca acima mencionadas, provocada em resposta a um pulso de luz de 20 ms, em passos de tensão de 3 mV, medidos em torno do potencial de reversão (E rev ). ( D ) Um histograma que traça o E rev médio do tipo selvagem e os vários mutanTs. As barras de erro são o SEM O potencial de reversão (E rev ) de WT está entre o E rev positivo de trpl 302 , que expressa apenas o TRP, e o E rev do mutante nulo trp P343 , que expressa apenas TRPL. Clique aqui para ver uma versão maior desta figura.
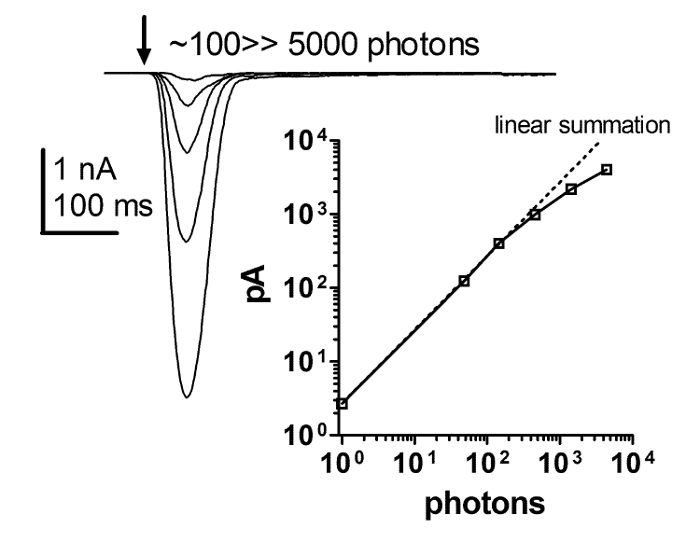
Figura 6: A Resposta do Flash é Estritamente Linear com Aumento da Intensidade da Luz.
Uma série de respostas atuais para breves flashes de intensidade de luz crescente e uma parcela da dependência da amplitude de pico da resposta de luz na intensidade crescente de flashes de luz breves. Esta relação revela uma linearidade estrita entre a resposta instantânea e o aumento da intensidade da luz. Essa linearidade estritaMantém até pelo menos várias centenas de pA, com intensidade de luz que abrange mais de 4 ordens de grandeza, enquanto é discutível se é linearidade ou controle de fixação que se rompe depois disso. Clique aqui para ver uma versão maior desta figura.
| PH | 7,15 (ajustar com NaOH) |
| Reagente | Concentração (mM) |
| NaCl | 120 |
| KCl | 5 |
| MgCl 2 | 4 |
| TES | 10 |
| Proline | 25 |
| Alanina | 5 |
| Armazenar a -20 ° C. | |
| Nota: Esta solução é nominalmente Ca 2 + livre, mas não tem tampões de Ca 2+ adicionados e, portanto, terá aproximadamente 5 a 10 μM de traço Ca 2+ . Solução extracelular (ES) = ES-0Ca 2+ com 1,5 mM de CaCl2, preparada por adição de CaCl2 a partir de uma solução de reserva de 0,5 ou 1 M para ES-0Ca 2+ . | |
Tabela 1: Solução extracelular livre de Ca +2 (ES). Descrição química e as quantidades específicas necessárias para produzir ES livre de Ca +2 .
| Reagente | Montante |
| FBS | 15 mL |
| Sacarose | 1,5 g |
| Divida em alíquotas de 150 μL em frascos de 1,5 mL e armazene a -20 76; C. | |
| Solução de triagem (TS) | Preencha 1 frasco para injectáveis de 150 mL da solução de reserva com 1.350 mL ES ou ES-0Ca 2+ , para combinar a solução utilizada durante a dissecção. |
Tabela 2: Sérum Bovino Fetal (FBS) + Sacarose - Solução de estoque. Descrição química e as quantidades específicas necessárias para a produção de soro fetal bovino fetal (FBS) + sacarose.
| PH | 7,15 (ajustar com KOH) |
| Reagente | Concentração (mM) |
| Gluconato de potássio (Kglu) | 140 |
| MgCl 2 | 2 |
| TES | 10 |
| ATP sal de magnésio (MgATP) | 4 |
| GTP sal de sódio (Na 2 GTP) | 0,4 |
| Hidrato de dinucleótido de adenina de β-nicotinamida (NAD) | 1 |
| Armazenar a -20 ° C. |
Tabela 3: Solução intracelular (IS1). Descrição química e as quantidades específicas necessárias para a produção de IS1, que é principalmente usado para medidas de resposta de intensidade e colisão quântica.
| PH | 7.15 (ajustar com CsOH) |
| Reagente | Concentração (mM) |
| CsCl | 120 |
| MgCl 2 | 2 |
| TES | 10 |
| ATP sal de magnésio (MgATP) | 4 |
| GTP sal de sódio (Na 2 GTP) | 0,4 |
| Hidrato de dinucleótido de adenina de β-nicotinamida (NAD) | 1 |
| Cloreto de tetra-etil-amónio (TAE) | 15 |
| Armazenar a -20 ° C. |
Tabela 4: Solução intracelular (IS2). Descrição química e as quantidades específicas necessárias para a produção de solução intracelular IS2, que é principalmente utilizada para medidas de potencial de reversão da corrente induzida pela luz.
Discussão
A aplicação de gravações de células inteiras para fotorreceptores D. melanogaster permitiu a descoberta e a elucidação funcional de novas proteínas de sinalização, como os canais TRP 27 , 28 , 29 e as proteínas de andaimes INAD 30 , 31 , 32 . Desde a introdução inicial desta técnica, permitiu a resolução de questões básicas a longo prazo relativas ao mecanismo iónico e à dependência de tensão da resposta da luz. Isso ocorreu devido à capacidade conferida para controlar com precisão a tensão da membrana e a composição iónica extracelular e intracelular 19 , 28 .
Um obstáculo importante da técnica de aperto de parches em D. melanogaster tem sido a fragilidade da prepa isolada de ommatidiaração. Estudos detalhados revelaram que a integridade da máquina de fototranscisão depende criticamente do fornecimento contínuo de ATP, especialmente durante a exposição à luz, o que leva a um grande consumo de ATP. Infelizmente, as bandagens mecânicas das células de pigmento ( isto é, glia), necessárias para alcançar a membrana do fotorreceptor com a pipeta do remendo, eliminam a principal fonte de metabolitos necessários para a produção de ATP 33 . A aplicação de ATP exógeno na pipeta de gravação apenas cumpre parcialmente o requisito de grandes quantidades de ATP. Um curto suprimento de ATP leva à ativação espontânea dos canais TRP e à dissociação da máquina de fototranscisão dos canais ativados por luz, causando um grande aumento no Ca 2+ celular e a abolição da resposta normal à luz 34 , 35 . Esta seqüência de eventos não se deve ao dano doFotorreceptores pelo procedimento de dissecação, mas sim pela depleção celular da ATP. Para evitar que esta sequência de eventos ocorra e para manter respostas de luz normais, os fotorreceptores não devem ser expostos a luzes intensas, que consomem grandes quantidades de ATP. Além disso, NAD deve ser incluído na pipeta de gravação, presumivelmente para facilitar a produção de ATP nas mitocôndrias 18 , 36 . Para as medidas de solavancos espontâneos e quânticos, a dificuldade acima é mínima porque apenas as luzes fracas são usadas. Na prática, uma gravação estável de células inteiras pode ser mantida por ~ 20-25 min, embora haja uma tendência para a cinética de resposta a abrandar durante esse período. Uma única preparação de ommatidia dissociada pode permanecer viável até 2 h.
Uma falta adicional da preparação de ommatidia isolada é a inacessibilidade do microvilli, o que se traduz na inacessibilidade do TRP eTRPL para a pipeta de gravação, evitando gravações de canal único. Usando um método que eles desenvolveram, Bacigalupo e colegas conseguiram gravar diretamente a atividade de canal único do rabdom 37 . No entanto, esta actividade de canal difere da dos canais TRPL expressos heterologicamente em células de cultura de tecidos 38 e da actividade de canal TRP derivada da análise de ruído de tiro obtida a partir de ommatidia 34 isolada. Presumivelmente, o procedimento de dissecação danificou muito as células fotorreceptoras ao usar este método.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
A parte experimental desta pesquisa foi apoiada por subsídios da Fundação de Ciências Nacionais US-Israel Bi (BM e IL), a Fundação de Ciência de Israel (ISF), a Cooperação Deutsch-Israelische Projektko (DIP) (e BM) e a Biotecnologia E Conselho de Pesquisa em Ciências Biológicas (BBSRC números de bolsa: BB / M007006 / 1 e BB / D007585 / 1) para RCH
Materiais
| Name | Company | Catalog Number | Comments |
| 10 mL syringe | |||
| 5 mL syringe | |||
| 1 mL syringe with elongated tip | |||
| Petri dish | 60 mm | ||
| Syringe filters | Millex | 22 µm PVDF filter | |
| Capillaries (for omatidia separation) | Glass, 1.2 x 0.68 mm (~7.5 cm each) | ||
| Polyethylene Tubing | Becton Dickinson | 1.57 x 1.14 mm (35 cm) | |
| 2 small beakers | 50 mL or less | ||
| 2 paraffin film sheets | Parafilm M | ~5 x 5 cm | |
| Bath chamber | home-made | ||
| Cover slips | 22 x 22 mm No. 0 | ||
| Paraplast Plus | Sigma | Paraffin – polyisobutylene mixture | To glue the coverslip onto the bottom of the bath chamber |
| Ground | Warner Instruments | 64-1288 | Hybrid Assembly Ag-AgCl Wire Assembly |
| Headless micro dissection needle | Entomology, 12 mm | ||
| Micro dissecting needle holder | |||
| Vise | |||
| 2 fine tweezers + 1 rough tweezers | Dumont #5, Biology | 0.05 x 0.02 mm, length 110 mm, Inox | |
| Stereoscopic zoom Microscope | Nikon | SMZ-2B | |
| Cold light source | Schott | KL1500 LCD | |
| Filter (Color) for cold light source | Schott | RG620 | |
| Delicate wipers | Kimtech | Kimwipes | |
| Electrode holder | Warner Instruments | QSW-T10P | Q series Holders compatible with Axon amplifiers, straight body style |
| Silver Wire | Warner Instruments | 0.25 mm diameter, needs to be chloridized | |
| Micromanipulator | Sutter Instruments | MP 85 | Huxley-Wall Style Micromanipulator |
| Faraday cage | home made | Electromagnetic noise shielding and black front curtain | |
| Anti-vibration Table | Newport | VW-3036-OPT-01 | |
| Osilloscope | GW | GOS-622G | |
| Perfusion system | Warner Instruments | VC-8P | Pinch valve control system |
| Perfusion valve controller | Scientific instruments | BPS-8 | |
| Suction system | |||
| Amplifier | Molecular Device | Axopatch-1D | |
| Head-stage | Molecular Device | CV - 4 | Gain: x 1/100 |
| A/D converter | Molecular Device | Digidata 1440A | |
| Clampex | Molecular Device | 10 | software |
| pCLAMP | Molecular Device | 10 | software |
| Light source (Xenon Arc lamp) | Sutter Instruments | Lambda LS | |
| Light detector | home made | phototransistor | |
| Filter wheel and shutter controller | Sutter Instruments | Lambda 10-2 with a Uniblitz shutter | |
| Filters (Natural density filter) | Chroma | 6,5,4,3,2,1,0.5,0.3 | |
| Filter (Color) | Schott | OG590, Edge filter | |
| Xenon Flash Lamp system | Dr. Rapp OptoElecftronic | JML-C2 | |
| Light guide | Quartz | ||
| Pulse generator | AMPI | Master 8 | |
| Microscope | Olympus | IX71, Inverted | |
| Red illumination filter (Microscope) | RG630 / RG645 ø45mm | ||
| Microscope objective | Olympus | X60/0.9 UplanFL N air or X60/1.25 UplanFI oil | |
| CCD Camera | Andor | iXon DU885K | |
| NIS Element | Nikon | AR | software |
| Ca+2 indicator | Invitrogen | Calcium green 5N | |
| Excitation & emission filters and dichroic mirror | Chroma | 19002 - AT - GFP/FITC Longpass set | |
| Vertical pipette puller | Narishige | Model PP83 | Use either vertical or horizontal puller, as preferred. |
| Horizontal pipette puller | Sutter Instrument | Model P-1000 Flaming/Brown Micropipette Puller | |
| Filament | Sutter Instrument | 3 mm trough or square box | |
| Capillaries | Harvard Apparatus | borosilicate glass capillaries | 1 x 0.58 mm |
Referências
- Hardie, R. C. Whole-cell recordings of the light induced current in dissociated Drosophila photoreceptors: evidence for feedback by calcium permeating the light-sensitive channels. Proc. R. Soc. Lond. B. 245, 203-210 (1991).
- Ranganathan, R., Harris, G. L., Stevens, C. F., Zuker, C. S. A Drosophila mutant defective in extracellular calcium- dependent photoreceptor deactivation and rapid desensitization. Nature. 354, 230-232 (1991).
- Martin, J. H., Benzer, S., Rudnicka, M., Miller, C. A. Calphotin: a Drosophila photoreceptor cell calcium-binding protein. Proc. Natl. Acad. Sci. U.S.A. 90 (4), 1531-1535 (1993).
- Weiss, S., et al. Compartmentalization and Ca2+ buffering are essential for prevention of light-induced retinal degeneration. J Neurosci. 32 (42), 14696-14708 (2012).
- Wang, T., et al. Light activation, adaptation, and cell survival functions of the Na + /Ca 2+ exchanger CalX. Neuron. 45 (3), 367-378 (2005).
- Weckstrom, M., Hardie, R. C., Laughlin, S. B. Voltage-activated potassium channels in blowfly photoreceptors and their role in light adaptation. J. Physiol. Lond. 440, (1991).
- Frolov, R. V., Immonen, E. V., Weckström, M. Performance of blue- and green-sensitive photoreceptors of the cricket Gryllus bimaculatus. J Comp Physiol A Neuroethol Sens Neural Behav Physiol. 200 (3), 209-219 (2014).
- Nasi, E. Whole-cell clamp of dissociated photoreceptors from the eye of Lima scabra. J Gen Physiol. 97 (1), 35-54 (1991).
- Nasi, E., Gomez, M. P. Light-activated ion channels in solitary photoreceptors of the scallop Pecten irradians. J. Gen. Physiol. 99, 747-769 (1992).
- Hardie, R. C., Peretz, A., Pollock, J. A., Minke, B. Ca 2+ limits the development of the light response in Drosophila photoreceptors. Proc. R. Soc. Lond. B. Biol. Sci. 252, 223-229 (1993).
- Kohn, E., et al. Functional Cooperation between the IP3 Receptor and Phospholipase C Secures the High Sensitivity to Light of Drosophila Photoreceptors In Vivo. J Neurosci. 35 (6), 2530-2546 (2015).
- Hevers, W., Hardie, R. C. Serotonin modulates the voltage dependence of delayed rectifier and Shaker potassium channels in Drosophila photoreceptors. Neuron. 14 (4), 845-856 (1995).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Henderson, S. R., Reuss, H., Hardie, R. C. Single photon responses in Drosophila photoreceptors and their regulation by Ca 2. J. Physiol. Lond. 524 (Pt 1), 179-194 (2000).
- Scott, K., Zuker, C. S. Assembly of the Drosophila phototransduction cascade into a signalling complex shapes elementary responses. Nature. 395 (6704), 805-808 (1998).
- Elia, N., Frechter, S., Gedi, Y., Minke, B., Selinger, Z. Excess of G betae over G qalphae in vivo prevents dark, spontaneous activity of Drosophila photoreceptors. J. Cell Biol. 171 (3), 517-526 (2005).
- Katz, B., Minke, B. Phospholipase C-Mediated Suppression of Dark Noise Enables Single-Photon Detection in Drosophila Photoreceptors. J. Neurosci. 32 (8), 2722-2733 (2012).
- Hardie, R. C., et al. Molecular basis of amplification in Drosophila phototransduction. Roles for G protein, phospholipase C, and diacylglycerol kinase. Neuron. 36 (4), 689-701 (2002).
- Reuss, H., Mojet, M. H., Chyb, S., Hardie, R. C. In vivo analysis of the Drosophila light-sensitive channels, TRP and TRPL. Neuron. 19, 1249-1259 (1997).
- Liu, C. H., et al. In vivo identification and manipulation of the Ca 2+ selectivity filter in the Drosophila transient receptor potential channel. J. Neurosci. 27 (3), 604-615 (2007).
- Ahmad, S. T., Natochin, M., Barren, B., Artemyev, N. O., O'Tousa, J. E. Heterologous expression of bovine rhodopsin in Drosophila photoreceptor cells. Invest Ophthalmol Vis Sci. 47 (9), 3722-3728 (2006).
- Scott, K., Sun, Y., Beckingham, K., Zuker, C. S. Calmodulin regulation of Drosophila light-activated channels and receptor function mediates termination of the light response in vivo. Cell. 91 (3), 375-383 (1997).
- Liu, C. H., et al. Ca 2+ -dependent metarhodopsin inactivation mediated by calmodulin and NINAC myosin III. Neuron. 59 (5), 778-789 (2008).
- Cook, B., et al. Phospholipase C and termination of G-protein-mediated signalling in vivo. Nat. Cell Biol. 2 (5), 296-301 (2000).
- Hardie, R. C., Franze, K. Photomechanical responses in Drosophila photoreceptors. Science. 338 (6104), 260-263 (2012).
- Huang, J., et al. Activation of TRP channels by protons and phosphoinositide depletion in Drosophila photoreceptors. Curr. Biol. 20 (3), 189-197 (2010).
- Minke, B., Wu, C. F., Pak, W. L. Isolation of light-induce response of the central retinular cells from the electroretinogram of Drosophila. J. Comp. Physiol. 98, 345-355 (1975).
- Hardie, R. C., Minke, B. The trp gene is essential for a light-activated Ca2+ channel in Drosophila photoreceptors. Neuron. 8, 643-651 (1992).
- Niemeyer, B. A., Suzuki, E., Scott, K., Jalink, K., Zuker, C. S. The Drosophila light-activated conductance is composed of the two channels TRP and TRPL. Cell. 85 (5), 651-659 (1996).
- Huber, A., et al. The transient receptor potential protein (Trp), a putative store- operated Ca 2+ channel essential for phosphoinositide-mediated photoreception, forms a signaling complex with NorpA, InaC and InaD. EMBO J. 15 (24), 7036-7045 (1996).
- Shieh, B. H., Niemeyer, B. A novel protein encoded by the InaD gene regulates recovery of visual transduction in Drosophila. Neuron. 14 (1), 201-210 (1995).
- Tsunoda, S., et al. A multivalent PDZ-domain protein assembles signalling complexes in a G-protein-coupled cascade. Nature. 388 (6639), 243-249 (1997).
- Tsacopoulos, M., Veuthey, A. L., Saravelos, S. G., Perrottet, P., Tsoupras, G. Glial cells transform glucose to alanine, which fuels the neurons in the honeybee retina. J. Neurosci. 14 (3 Pt 1), 1339-1351 (1994).
- Hardie, R. C., Minke, B. Spontaneous activation of light-sensitive channels in Drosophila photoreceptors. J. Gen. Physiol. 103, 389-407 (1994).
- Agam, K., et al. Metabolic stress reversibly activates the Drosophila light-sensitive channels TRP and TRPL in vivo. J Neurosci. 20 (15), 5748-5755 (2000).
- Agam, K., Frechter, S., Minke, B. Activation of the Drosophila TRP and TRPL channels requires both Ca2+ and protein dephosphorylation. Cell Calcium. 35 (2), 87-105 (2004).
- Delgado, R., Muñoz, Y., Peña-Cortés, H., Giavalisco, P., Bacigalupo, J. Diacylglycerol activates the light-dependent channel TRP in the photosensitive microvilli of Drosophila melanogaster photoreceptors. J Neurosci. 34 (19), 6679-6686 (2014).
- Parnas, M., Katz, B., Minke, B. Open channel block by Ca2+ underlies the voltage dependence of Drosophila TRPL channel. J. Gen. Physiol. 129 (1), 17-28 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados