É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
PH intracelular de quantificação de óptica em Drosophila melanogaster túbulo de Malpighi epitélios com um indicador de pH fluorescente geneticamente codificado
Neste Artigo
Resumo
Transporte de iões celular muitas vezes pode ser avaliado pelo monitoramento pH intracelular (pHeu). Geneticamente codificado-indicadores de pH (GEpHIs) fornecem óptica quantificação do pH intracelular em células intactas. Este protocolo detalha a quantificação do pH intracelular através de celular ex vivo ao vivo-imagens de túbulos de Malpighi de Drosophila melanogaster com pHerry, um pseudo-ratiometric geneticamente codificado indicador de pH.
Resumo
Transporte de íons epitelial é vital para a homeostase do íon sistêmica, bem como a manutenção dos gradientes eletroquímicos celulares essenciais. PH intracelular (pHeu) é influenciado por muitos transportadores de íons e assim monitoramento de pH, é uma ferramenta útil para avaliar a atividade de transporte. Moderna geneticamente codificado-indicadores de pH (GEpHIs) fornecem óptica quantificação de pH em células intactas na escala celular e subcellular. Este protocolo descreve em tempo real quantificação do pH celulareu regulamento em túbulos de Malpighi (MTs) de Drosophila melanogaster através de ex vivo ao vivo-imagem latente de pHerry, um pseudo-ratiometric GEpHI com pKum adequado para controlar as alterações do pH no citosol. Extraído de mosca adulta MTs são compostos de seções morfologicamente e funcionalmente distintas de epitélios de célula única camada e podem servir como um modelo acessível e geneticamente tractable para investigação de transporte epitelial. GEpHIs oferecem diversas vantagens sobre os convencionais sensíveis ao pH de corantes fluorescentes e eletrodos íon-seletivos. GEpHIs pode rotular populações de células distintas, desde elementos promotor apropriados estão disponíveis. Esse rótulo é particularmente útil em ex vivo, in vivoe em situ preparações, que são inerentemente heterogêneas. GEpHIs também permitem quantificação de pHi em tecidos intactos ao longo do tempo, sem necessidade de exteriorização de tratamento ou tecido de tintura repetidas. A principal desvantagem de GEpHIs atual é a tendência de agregar no citosol inclusões em resposta ao dano tecidual e sobre-expressão de construir. Estas deficiências, suas soluções e as vantagens inerentes de GEpHIs são demonstradas neste protocolo através de avaliação do transporte de protões (H+) basolateral nas células principais e estreladas funcionalmente distintas de mosca extraída MTs. As técnicas e a análise descrita são facilmente adaptáveis a uma grande variedade de preparações de vertebrados e invertebradas, e a sofisticação do ensaio pode ser dimensionada de ensino labs para intrincados determinação do fluxo de iões através de transportadores específicos.
Introdução
O objetivo do presente protocolo é descrever a quantificação do pH intracelular (pHi) usando um geneticamente codificado-indicador de pH (GEpHI) e demonstrar como esse método pode ser usado para avaliar o transporte de H+ basolateral em um inseto modelo d (. melanogaster) estrutura renal, túbulos de Malpighi (MT). MTs servem como órgãos excretores da mosca da fruta e são funcionalmente semelhantes aos mamíferos néfron em vários aspectos chave1. MTs são arranjados como 2 pares de túbulos (anteriores e posteriores) no tórax e abdômen de uma mosca. O tubo de única célula epitelial de cada MT é composto por metabolicamente ativas células principais com distintas apicais (luminal) e polaridade basolateral (hemocoel), bem como células estreladas intercaladas. MTs anteriores são compostas de 3 morfologicamente, funcionalmente, e mentalmente distintos segmentos, nomeadamente a inicial dilatadas segmento, segmento de transição e secretora segmento principal, que se junta ao ureter2. Na escala celular transporte trans-epitelial íons no lúmen é realizado por uma membrana plasmática apical V-ATPase3 e um cambista do alcaloide-metal/H+ , bem como um basolateral at+-+K-ATPase4, aperfeiçoamento activo-retificador K+ canais5, at+-conduzido Cl−/HCO3− cambista (NDAE1)6e Na+-K+-2 Cl− cotransporter (NKCC; Ncc69)7, enquanto células estreladas mediam Cl– e transporte de água8,9. Este sistema fisiológico complexo mas acessível oferece excelentes oportunidades para a investigação de mecanismos de transporte de íon endógena quando combinado com diversos fatores genéticos e comportamentais conjuntos de ferramentas de Drosophila.
A justificativa para este protocolo foi descrever um sistema geneticamente maleável para estudar o transporte de íons epitelial com potencial para a integração do celular para o comportamento e exportação de ferramentas para outros sistemas de modelo. Expressão de pHerry10, uma GEpHI derivada de uma fusão de verdes sensíveis ao pH super eclíptica pHluorin11,12 (SEpH) e vermelho mCherry diferenciação de pH13, em MTs permite a quantificação de transporte H+ , em células únicas MT através da alta K+/nigericin calibração técnica14. Como muitos transportadores de iões mover equivalentes de H+ , quantificação de pH intracelular serve como uma representação funcional do movimento de iões através de uma variedade de transportadores. O modelo de sistema de Drosophila MT também oferece ferramentas poderosas de genéticas em tecido-específica do transgene15 e RNA interferência (RNAi)16 expressão, que pode ser combinado com o celular imagens e ensaios todo-órgão17 , 18 , 19 da função do túbulo para criar um conjunto de ferramentas robusto com integração vertical das moléculas de comportamento. Isto contrasta com muitos outros protocolos para avaliação biologia epitelial, como historicamente, tais medidas têm confiado na intrincada e assustadora micro-dissecção, sofisticado eletrodos íon-seletivos20,21, e sensíveis ao pH caro tinge22 com requisitos de carga restritiva e pobre especificidade celular em tecidos heterogêneos. GEpHIs têm sido utilizados para medir o pHeu em uma variedade de tipos de célula23extensivamente. Primeiros trabalhos exploraram a pH-sensibilidade inerente de proteína fluorescente verde (GFP) para monitorar o pHeu em culturas de células epiteliais24 mas nas duas últimas décadas viram GEpHIs usado em neurônios25, glia26, fungos27 , e células de plantas28. A combinação do potencial de segmentação celular de construções genéticas através da expressão de GAL4/UAS sistema15 e a acessibilidade fisiológica de MT a drosófila isto fazer uma preparação ideal para investigações de pHeu regulamento e transporte de íon epitelial.
pHeu regulamento tem sido estudado há décadas e é vital para a vida. A preparação de MT oferece um modelo robusto de ensinar fisiologia do Regulamento pHeu mas também realizar sofisticadas investigações de pHi Regulamento ex vivo e in vivo. Este protocolo descreve a quantificação do movimento H+ através da membrana basolateral das células epiteliais da drosófila MT usando o NH4Cl ácido de pulso técnica21a carregar, mas como o indicador de pH é geneticamente codificado, esses métodos e o seu enquadramento teórico podem ser aplicados a qualquer preparação passível de transgênese e geração de imagens ao vivo.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Todas as etapas neste protocolo estar em conformidade com as diretrizes de uso de animais da clínica Mayo (Rochester, MN).
1. criação de voar
- Aumento voa e conjunto cruza de acordo com o padrão de criação29.
Nota: A expressão fluorescente repórter pelo sistema GAL4/UAS é proporcional à temperatura e, portanto, a criação da temperatura pode ser ajustada para alterar o nível de expressão. Enquanto os níveis de alta expressão muitas vezes levam a uma melhor relação sinal-ruído esta condição também é associada com aumento citosólico e organellar agregados quando usando as boas práticas agrícolas para fusão de proteína fluorescente vermelha (RFP) constrói como pHerry10, 30,31. Se a agregação é inevitável, quantificação ainda é possível através da realização de calibrações no ponto em cada experimento e normalização de dados tais que uma proporção de fluorescência de 1.0 corresponde ao pHeu 7.0 (ver passo 7.4 nota na calibração abaixo). - Conjunto de cruzes de homozigotos capaR-GAL432 machos homozigotos UAS-pHerry10 fêmeas virgens e homozigotos c724-GAL42 machos às fêmeas virgens de homozigotos UAS-pHerry para permitir imagens de pH em células principais e células estreladas de MT, respectivamente. Lugar 6 UAS-pHerry fêmeas com 3 machos GAL4 dentro dos frascos de frescos de comida e deixar de acasalar a 28 ° C.
Nota: As larvas devem ser evidentes dentro de 4D e adultos começará a eclose próximo dia 10. - Colete femininas moscas em cima de eclosão e reserve a idade para d 10 a 28 ° C.
Nota: O tempo de experimentação pode ser ajustado para corresponder à qualquer restritivos ensaios comportamentais (como o Ramsay secreção ensaio17,19) que vão ser correlacionados a imagem latente do pH intracelular de ao vivo. Moscas masculinas podem ser usadas mas túbulos das fêmeas são geralmente maiores e mais robusta.
2. preparação de lâminas de poli-L-lisina.
- Desenhar uma borda de 40 x 20 mm com uma caneta PAP hidrofóbica ao redor do topo de slides padrão 75 x 25 mm e Reserve secar durante 15 min em lamelas de grande uso de RT. se as lâminas não são compatíveis com imagem latente ótica.
- 2 ml da solução de poli-L-lisina (PLL) de 0,01% das ações para cada slide e reserve por 1h no RT
- Remova o excesso PLL com uma pipeta. Salve a solução em um frasco de 50 mL cônica para uso futuro. Loja a 4 ° C.
- Aspire qualquer solução restante com uma linha de vácuo. Execute a linha de vácuo sobre a superfície inteira do slide para que permaneça sem solução nos slides.
- Defina os slides lado por 1h adicional à antes da RT para usar. Armazene os slides seca em RT até 1 mês em um livro de slide padrão.
3. preparação do prato e hastes de vidro de dissecação
- Adicione 0,5 mL de agente de cura de elastômero de 4,5 mL de elastômero base em poliestireno um 35 x 10 mm placa de Petri em RT para produzir uma profundidade de 5 mm. misture com a ponta da pipeta descartável. Permitir que o elastômero curar O/N em RT
Nota: Elastômero deve ser clara e livre de bolhas. Clareira de bolhas pode ser facilitada pela manter placas de elastômero em um frasco de vácuo para 10-15 min depois de derramar. - Segure uma vareta de vidro de diâmetro de 5 mm entre as mãos e derreta o centro da haste em um bico de Bunsen aceso enquanto puxa as extremidades separados. Como o vidro derrete puxa mais rapidamente para produzir um fino (0,1 mm) e o eixo cônico (Figura 1).
Nota: Um ângulo de 45 ° na haste da é frequentemente útil no tratamento de túbulos. Isto pode ser conseguido através de uma redução de uma mão como a haste é puxada (ver Figura 1). - Quebre a haste fina no meio com o lado sem corte de uma lâmina de aço carbono com arestas único. Inspecione a extremidade fina da haste em um escopo de dissecação para garantir que o tempo está limpo.
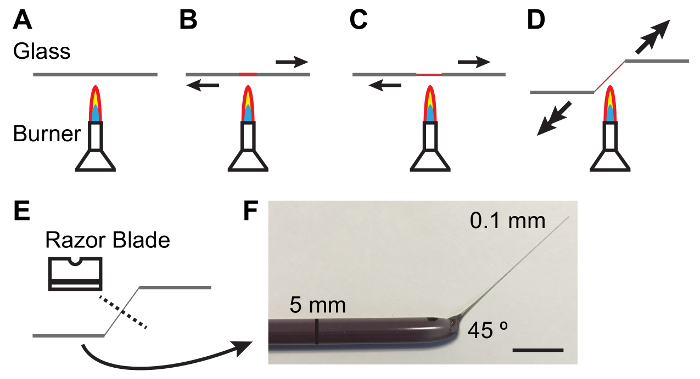
Figura 1: Fabricação de hastes de vidro para a manipulação de túbulos de Malpighi.
A - E. Processo de aquecimento e puxando uma vareta de vidro para produzir um atarraxamento e ângulo adequado para manipulação mts. setas indicam direção e magnitude da força a ser aplicada. F. fotografia de uma ferramenta de vidro fabricada adequadamente. Barra de escala = 10 mm. clique aqui para ver uma versão maior desta figura.
4. preparação de soluções e sistema de perfusão
Nota: Sistemas de perfusão diferem pelo fabricante. Este protocolo é baseado em torno de um reservatório aberto 8 canais de gravidade-alimentado com um regulador de taxa de fluxo de entrada e uma saída controlado por vácuo, mas o método de montagem que MTS conforme descrito aqui podem ser adaptados para funcionar com qualquer sistema de perfusão.
-
Prepare as seguintes soluções:
- Do alíquota Schneider médio (40 mL dentro dos frascos de Erlenmeyer de 50 mL) e em 4 ° C.
- Preparar soluções (ou seja, o inseto Phosphate-Buffered salina (iPBS) e iPBS com NH4Cl) em RT conforme necessário de acordo com a tabela 1). Soluções warm para RT antes de usar no dia do experimento.
Nota: iPBS e iPBS com 40mm NH4Cl pode ser preparado em grandes volumes (1 L ou mais) e armazenadas a 4 ° C. - Preparar 8 soluções de calibração em volumes de 500 mL pH = 5.0, 6.0, 6.5, 7.0, 7.3, 7.6, 8.0 e 9.0, conforme indicado na tabela 1 e em 4 ° C. Ajuste o pH de cada solução por titulação com N-metil-D-glucamine (NMDG) e HCl.
- No dia de experimentos, aquecer alíquotas de 5 mL das soluções de calibração para RT e adicionar solução de nigericin de estoque (20 mM em dimetilsulfóxido (DMSO)) para produzir uma concentração final de 10 µM.
Atenção: Lidar com nigericin com luvas. Trate todos os equipamentos que entra em contato com nigericin como descartável. Nigericin permanece em vidro e plástico e comprometam preparações biológicas se o equipamento está sendo reutilizado.
-
Sistema de perfusão:
- Encha o sistema de perfusão através do preenchimento de todos os reservatórios com O ddH2(Figura 2). Abra os canais, um de cada vez para permitir que todas as linhas proximal para o regulador de taxa de fluxo para preencher.
Nota: Pode ser necessário limpar o ar nas linhas abrindo o canal paralisado e usando um êmbolo ao fluxo de movimentação do reservatório. - Abra 2 canais e permitir o ddH2O drenar. Uma vez que os reservatórios estão quase vazios, encha o reservatório de primeiro com iPBS e o segundo reservatório com NH4Cl-pulsada iPBS. Definir a taxa de fluxo ao máximo com o regulador de taxa de fluxo e permitir que cada solução a fluir por 1 min preencher as linhas distais e, em seguida, interromper o fluxo (Figura 2).
- Posição 2 conjuntos de solda grampos "dando uma mãozinha" na cena de imagem do microscópio. Coloque um grampo em cada lado da plataforma de imagem.
- Aquecer cuidadosamente as 0,5 polegadas distais de um pedaço de vidro capilar (diâmetro interno de 1.5 mm, diâmetro externo 0,86 mm, comprimento 100mm) sobre um bico de Bunsen. Crie uma curva de 45 °, permitindo que a extremidade distal dobrar pela gravidade e remover o vidro da chama, uma vez atingido o ângulo desejado. Repita este processo com um segundo pedaço de vidro capilar.
- Inserir os capilares de vidro vergado no fluxo em linha e linha de saída conectado a vácuo, respectivamente e montá-los nas mãos de"ajudar" para alinhá-los com o estágio de imagem do microscópio (Figura 3).
- Encha o sistema de perfusão através do preenchimento de todos os reservatórios com O ddH2(Figura 2). Abra os canais, um de cada vez para permitir que todas as linhas proximal para o regulador de taxa de fluxo para preencher.

Figura 2: Sistema de perfusão e configuração de imagem.
Componentes necessários para a avaliação fisiológica da função de transporte MT basolateral através de simultânea ao vivo troca de solução de imagem e rápida de fluorescência. Linhas de gás mostradas são opcionais e permitam a expansão de experiências para a avaliação do transporte HCO3– . Clique aqui para ver uma versão maior desta figura.
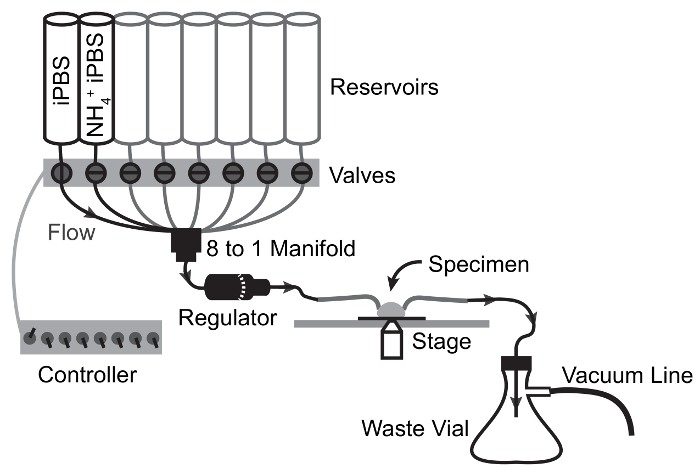
Figura 3: Diagrama esquemático do fluxo de perfusão aparelhos para NH4Cl pulso experimentos.
As setas mostram caminho de fluxo e válvula de comutação pontos. Solução se move do reservatório a amostra por fluxo de gravidade e é desenhada da câmara de amostra para o balão de resíduos por sucção à vácuo. Por favor clique aqui para ver uma versão maior desta figura.
5. dissecação de túbulos de Malpighi Anterior adulto drosófila .
- Recolher o prato de dissecação e puxei a vareta de vidro da seção 3, um slide PLL-revestido da secção 2, um adesivo divisor de perfusão-bem, vácuo graxa, uma 4 x 2" tira de filme de selagem, 2 pares de #5 finas fórceps e alíquotas de 40 mL do gelado Schneider médio e RT iPBS.
- Espalhe a graxa vácuo na fita da selagem e pressione o adesivo divisor de perfusão-bem para a fita para revestir o fundo com graxa. Descole o adesivo divisor de perfusão-bem e coloque graxa-lado-para baixo em cima de um slide revestido de PLL. Retire o divisor de perfusão-bem para deixar cada amostra poços traçados a graxa hidrofóbica.
- Lugar 200 µ l de iPBS de RT na graxa-cercado bem no slide revestido PLL e deslocar o carro sob o estereoscópio.
- Moscas UAS-pHerry/capaR-GAL4 lugar em um vazio voar frasco e anestesia no gelo por 10 min.
Nota: Este método de anestesia, ao contrário de CO2, assegura que as moscas não desidratar. - Despeje o prato de dissecação médio do Schneider gelada e use pinça fina para transferir uma única mosca feminina anestesiada para a placa sob um estereoscópio dissecação.
- Segure a mosca pelo tórax com um conjunto de pinças e usar o outro para segurar suavemente a parte posterior do abdômen. Abra a parte posterior da mosca usando a pinça, em suma, moções deliberadas. Uma vez que o intestino grosso é visível, segure a extremidade distal e libertar o intestino e MTs os subjacentes tracheoles puxando o intestino posterior, longe do corpo através de rebocadores repetitivos, breves.
Nota: Os anteriores e posteriores MTs será visível onde se encontram com a junção do intestino grosso através do ureter e intestino. O primeiro par de MTs para ser livre arbítrio provável ser túbulos posteriores como eles cercam o intestino grosso. Estes podem ser ignorados (Figura 4A). - Beliscar fora os anteriores MTs no ureter com pinça fina uma vez que o segundo conjunto de MTs é livre do abdômen. Isto irá separar os MTs anteriores do intestino e fechar o ureter.
- Pega os MTs livre anteriores com a vareta de vidro puxado deslizando a haste sob o ureter, tal que os túbulos cair para o outro lado. Levante os MTs em linha reta fora da solução.
- Transformar a vareta de vidro, tal que o MTs e ureter são respeitados na parte inferior da haste e descer o ureter diretamente para o slide. Apor o ureter e selar as extremidades distais dos MTs pressionando o ureter baixo a lâmina de vidro (Figura 4B). Não manipule os MTs mais que o necessário. As MTs devem ser flutuar na solução com o ureter ancorado no slide.
- Use bem final da haste de vidro para varrer suavemente cada túbulo através da superfície do slide. Segure a vara contra o slide para evitar o esmagamento do túbulo e deslize a haste no topo do túbulo, movendo-se distal para proximal, para anexar o comprimento total de cada túbulo à superfície do slide PLL-revestido (Figura 4).
- Coloque o adesivo divisor de perfusão-bem novamente no slide para formar um pequeno cheio de líquido ao longo do túbulo montado.
- Coloque a amostra no palco microscópio. Posicione o influxo e capilares de saída sobre a entrada e a abertura de saída da perfusão bem, respectivamente.
Nota: O divisor bem pode ser deixado se uma câmara aberta perfusão é desejada. Neste caso, os capilares de entrada e saída podem ser alinhados para lados opostos de uma imagem bem.
6. validação de imagem protocolo e túbulo saúde
Nota: Este protocolo é realizado em um microscópio de epifluorescente invertido de campo amplo com GFP (SEpH) e conjuntos de filtros RFP (mCherry) (excitação de 470/40 nm (ex), emissão de longpass 515 nm (em), 500 nm nm dicroicas e 546/10 ex em de longpass 590 nm, 565 nm dicroicas), um 10 X / 0.45 ar objetivo, uma câmera monocromática para captura de imagem ao vivo e software de imagem. O protocolo pode ser adaptado para qualquer posição vertical ou microscópio invertido com filtro automático comutação entre as boas práticas agrícolas e RFP óptica e imagem software de aquisição, embora as parâmetros, intensidade de luz e tempos de exposição ideal variará. Em todas as análises, a intensidade de fluorescência deve ser analisada como a intensidade do pixel média na região de interesse (ROI), após subtração do fundo em cada canal usando um ROI com não contém nenhuma fluorescência adjacente ao sinal ROI.
- Ligue o microscópio, fonte de luz e sistema de imagem.
- Software aberto de imagem associado.
- Olhe através da ocular e ajustar o foco manualmente até o lúmen do MT é claramente visível sob luz transmitida.
- Clique na opção "Aquisição" no software de análise de imagem e selecione "2 x 2" no menu suspenso "Binning" na seção "Modo de aquisição".
- Inserir um filtro de densidade neutra de 5% para o caminho de luz para reduzir a luz de iluminação e minimizar fotobranqueamento.
- Clique no canal GFP (SEpH) no menu "Canais" e, em seguida, clique em "Live" para observar o sinal fluorescente através da câmera.
- Ajuste o controle deslizante "Tempo" para definir o tempo de exposição, tais que os valores de pixel mais brilhantes no histograma intensidade são cerca de 40% do valor máximo e, em seguida, clique em "Stop" para parar a iluminação.
- Repita etapas 6.6-6,7 no RFP (mCherry) canal e confirmam a presença do segmento inicial dilatada de MT a anterior e a ausência de mCherry citosólica agrega (indicativa de dano tecidual ou superexpressão) (Figura 4).
Nota: O segmento dilatado deve ser evidente, como é o segmento mais proximal do túbulo e o diâmetro do lúmen interno deste segmento é maior do que a do segmento adjacente transitório de ~ 20 µm. 2 x 2 pixel binning, muitas vezes é suficiente, mas pode ser aumentado para reduzir a intensidade de iluminação exigida. Tempos de exposição típicas são entre 150 e 800 ms/canal. Use como pouca luz possível para minimizar o fotobranqueamento. Minimizar o fotobranqueamento é vital para a utilização de indicadores de dual-fluoróforo como pHerry como os dois fluorophores pode descorar independentemente, invalidando assim qualquer calibração de relação. - Habilite um lapso de tempo protocolo de imagem clicando na caixa de seleção "Séries temporais".
- Ajuste a "duração" no menu suspenso na seção "Séries temporais" para 10 min e o slider de "Intervalo" de 0 para definir o tempo de captura total com uma taxa de aquisição de imagem máxima. Uma taxa de aquisição total de 0,2 Hz é muitas vezes suficiente.
- Verifique a GFP (SEpH) e caixas RFP (mCherry) na seção de "Canais".
- Abra a linha de iPBS do sistema de perfusão ativando o controlador de válvula apropriada e iniciar o protocolo de imagem clicando em "Iniciar experiência." Depois de 1 min, alterne para NH4Cl solução de pulso por 20 s abrindo a válvula apropriada e fechando a linha iPBS, em seguida, retornar para iPBS fechando o NH4Cl linha e reabrindo a válvula iPBS. Permitir que o protocolo de imagem completo completar antes de interromper o sistema de perfusão.
Nota: Análise de lapso de tempo deve revelar um sinal mCherry estável e um sinal de SEpH que aumenta na presença de NH4Cl, sacia com esmaecimento e recupera gradualmente. - Realize uma calibração de 2 pontos.
- Retire o divisor bem descascando-lo longe do slide subjacente e retire a imagem bem os grampos e capilares de perfusão.
- Aplica a imagem bem com uma pipeta de 200 µ l 200 µ l calibração iPBS (pH 7,4, 10 µM nigericin). Remover a solução da imagem bem com a pipeta e, em seguida, substitua por outro 200 µ l de solução de calibração. Repita este processo 4 vezes para garantir a troca da solução completa.
- Incube a preparação em solução de calibração para 30 min antes de imagem. Repito o protocolo de imagem usando os mesmos parâmetros determinados nas etapas 6.6-6.11, com a modificação de apenas 1 min da imagem de captura.
Nota: O sistema de perfusão e capilares não são necessários nesta etapa e não deve ser ligados à imagem bem para evitar expor os capilares para nigericin. - Adicione 200 µ l calibração iPBS (pH 9.0, 10 nigericin µM) para a imagem bem com uma pipeta de 200 µ l. Remover a solução da imagem bem com a pipeta e, em seguida, substitua por outro 200 µ l de solução de calibração. Repita este processo 4 vezes para garantir a troca da solução completa.
- Incube a preparação da solução de calibração segundo por 10 min antes de imagem. Repeti o protocolo de imagem como na etapa 6.13.3.
- Examine a pilha de imagem capturada em software de análise de imagem para confirmar que nenhum pixel em qualquer canal é saturada clicando em "Significa ROI" e rolagem embora a pilha de imagem com o controle deslizante "Frame", observando que não há valores relatados no histograma intensidade atingir o valor máximo detectável. Se quaisquer quadros contêm pixels que atingem a intensidade máxima detectável, reduza a intensidade de tempo ou iluminação de exposição e repetição seção 6.
Nota: Uma vez estabelecida não altere parâmetros de imagem entre experiências ou calibração a menos ponto calibrações devem ser usados em cada preparação (ver passo 8.3).
- Analise a pilha de imagem para plotar a intensidade fluorescente e relação de fluorescência (SEpH/mCherry) em função do tempo.
- Clique em "Quer dizer ROI" e selecione a ferramenta de forma livre. Segure o botão esquerdo do mouse para rastrear um ~ 50 µm Comprimento do Mt. Clique com o botão direito para terminar o ROI de desenho e, em seguida, repita em uma área adjacente a MT para definir um fundo ROI (Figura 5A).
- Clique em "Intensidade significa" sob "Medições". Criar uma tabela de valores de intensidade, clicando em "Exportar > tabela de dados > criar."
- Clique no ícone de roda dentada de configuração e desmarcar todos os parâmetros, exceto o "Tempo" e "Significa intensidade." Guia para a tabela de dados recém-criado com o botão direito, selecione "Salvar como" e exportar os dados como um arquivo. csv.
Nota: As medições semelhantes também podem ser feitas usando o software livre como o ImageJ. - Abrir uma tabela de planilha e importar a tabela de dados selecionando a aba "Dados" seguida por "De texto".
- Use funções na planilha para subtrair a intensidade de fundo SEpH de intensidade de sinal o SEpH em cada ponto de tempo. Repita este processo para o sinal de mCherry.
- Plotar cada intensidade do canal em função do tempo, selecionando as colunas contendo o tempo e dados de intensidade de correção de fundo e em seguida, clicando em "Inserir > Scatter (gráficos) > dispersão com linhas retas" (Figura 5B).
- Use funções de planilha para calcular a proporção de fluorescência SEpH/mCherry em cada ponto de tempo.
- Relação de fluorescência trama em função do tempo, selecionando as colunas que contêm os dados de tempo e proporção e em seguida, clicando em "Inserir > Scatter (gráficos) > dispersão com linhas retas" (Figura 5).
7. completa calibração de pHerry em túbulos de Malpighi Ex Vivo.
- Dissecar e montar um novo conjunto de MTs anteriores, conforme descrito na seção 5.
- Trocar iPBS para calibração iPBS (pH 7,4, nigericin de 10 µM), conforme descrito na etapa 6.13.2. Incube durante 30 min.
- Localize os MTs e coletar os pares de imagens SEpH/mCherry conforme descrito nas etapas 6.1-6.11. Substitua a solução com outro estoque de calibração iPBS conforme descrito na etapa 6.13.4, esperar 10 min e a imagem novamente. Repita este processo até que a proporção de SEpH/mCherry tem sido fotografada em todas as soluções. Obter pH 9,0 imagens última como o espécime raramente se recupera de pH elevado.
- Plotar rácio de fluorescência de SEpH para mCherry de calibrações em oito amostras em função do pH impostaeu conforme descrito na etapa 6.14.9. Ajuste os dados de calibração com uma curva de Boltzmann para obter a função de calibração completa de acordo com a equação 1 (Figura 5). Se dados são inconsistentes, plotar conjuntos de calibração de cada amostra normalizada de tal forma que uma relação de fluorescência de 1.0 corresponde ao pHi 7.0 e re-analisar (Figura 5E).
Nota: Se o último processo é necessário experiências individuais terá seu próprio ponto interno calibrações33 (ver procedimento de quantificação abaixo (etapa 8.3)). -
Equação 1
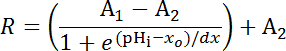
Onde R = relação SEpH/mCherry e um1,2, xóe dx é curva encaixe parâmetros que representam a proporção mínima de fluorescência, fluorescência máxima relação, pKume largura da função respectivamente. xo = aparente pKum de pHerry, que pode variar entre 7.1 e 7.4 dependendo do tipo de célula e as condições de calibração exata.
8. quantificação de ácido Basolateral extrusão do epitélio do túbulo de Malpighi Ex Vivo .
- Células estreladas pHerry-expressando de imagem e diretor pHerry-expressando células simultaneamente.
- Dissecar MTs anteriores de uma mosca UAS-pHerry/capaR-GAL4 , conforme descrito na seção 5, mas não a transferência MTs de meio a dissecação Schneider para a geração de imagens bem.
- Disse MTs anteriores de uma mosca UAS-pHerry/c724-GAL4 no mesmo prato dissecação usando o procedimento descrito na seção 5.
- Transferi os 2 conjuntos de MTs para a mesma imagem bem como descrito nos passos 5.8-5.11.
Nota: Quando varrendo os braços das MTs até o slide, coloque os MTs da UAS-pHerry/c724-GAL4 e túbulos UAS-pHerry/capaR-GAL4 perto uns dos outros por células estreladas e principais pHerry-expressando podem ser visualizadas no mesmo campo ( Figura 6A).
- Aplica o NH4Cl prepulse conforme descrito na etapa 6.12.
Nota: Se não será possível calibração consistente (Figura 4B), realizar uma calibração de ponto definindo pHi para 7,0 ao final de cada experimento com calibração iPBS (pH 7.0, 10 µM nigericin, incubação de 30 min) após o adesivo divisor de perfusão-bem e o equipamento de perfusão foram removidos. - Calibrar os traços de células estreladas e principais dos diferentes segmentos de MT (usando a proporção absoluta ou normalizada conforme apropriado) com a equação 2 e analisar a fase de recuperação depois de NH4Cl retirada aplicando as funções de decaimento exponencial usando software de análise estatística e salientando a constante de decaimento (τ) (Figura 6B).
Equação 2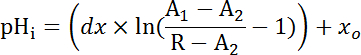
Onde R = relação SEpH/mCherry e um1,2, xóe dx é curva encaixe parâmetros determinados pela calibração na etapa 7.4 (equação 1).- Calcule a taxa de ácido extrusão (JH +, ver equação 3) em função do pHeu para dar conta das variações de pHeu e ácido carregando entre preparações34a descansar. Use as funções exponenciais derivadas na etapa 8.3 para calcular a derivada de pHeu em relação ao tempo em cada intervalo de tempo.
Equação 3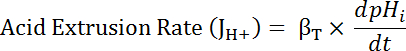
- Calcular a capacidade intrínseca de buffer (βi; Equação 4) do citosol para o pH, desde o início de cada intervalo na etapa 8.3.1 baseada na literatura anterior (ver equação 4).
Nota: Em Drosophila, a mais completa caracterização de β, vem do nervo motor larval terminais35 e estes dados podem-se supor para segurar por células de MT na ausência de outros dados disponíveis.
Equação 4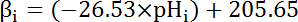
- Calcule o produto de βT (da etapa 8.3.2)e dpHeu/DT. (da etapa 8.3.1) para determinar JH + (equação 3).
Nota: Em soluções de bicarbonato nominalmente livre como os descritos no presente protocolo, capacidade tampão bicarbonato-derivado (βb) presume-se ser ~ 0 mM. Capacidade (βT) tampão de total é a soma de βeu eβbe, portanto, βeu = βT na ausência de HCO3–/CO236. - Plot JH + em função do pH no início de cada intervalo de tempo, conforme descrito na etapa 6.14.9.
- Aplica funções de decaimento exponencial para a parte de todos os conjuntos de dados que se sobrepõem no pHeu usando software de análise estatística. Compare taxas de alteração das funções resultantes para comparar taxas de extrusão ácido entre células e segmentos MT (Figura 6).
Nota: A função mais adequada utilizada para o encaixe de curva não pode sempre ser um único exponencial. Outras funções podem ser substituídas se elas melhoram a bondade de ajuste. - Calcular o ácido flux (ver equação 5), em função do pHeu para dar conta das variações de forma e tamanho da célula.
Equação 5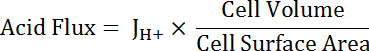
Nota: Dimensões da célula podem ser medidos diretamente em imagens ou aproximados. Células principais podem ser representadas como as metades de um tubo oco, com as seguintes dimensões: diâmetro interno 24 µm; diâmetro exterior 48 µm; altura 50 µm. transitório células estreladas são variáveis, mas podem ser representadas aproximadamente como cilindros com diâmetros de 10 µm e alturas de 50 µm. Ver o parágrafo final do Representante resultados abaixo. - Aplica funções de decaimento exponencial para a parte de todos os conjuntos de dados que se sobrepõem no pHeu usando software de análise estatística. Compare taxas de alteração das funções resultantes para comparar ácidos fluxos entre células e segmentos MT (Figura 6).
- Calcule a taxa de ácido extrusão (JH +, ver equação 3) em função do pHeu para dar conta das variações de pHeu e ácido carregando entre preparações34a descansar. Use as funções exponenciais derivadas na etapa 8.3 para calcular a derivada de pHeu em relação ao tempo em cada intervalo de tempo.
Access restricted. Please log in or start a trial to view this content.
Resultados
Tecidos saudáveis e identificação adequada de MTs anteriores são vitais para o sucesso do presente protocolo. Durante a dissecção, deve ter cuidado para não diretamente toque os MTs e identificador único-los pelo ureter como segurando os MTs diretamente conduzirá à quebra (Figura 4A– B). Quando MTs são varridos plana para o slide, túbulos devem ser tocados o mínimo possível e movimento em excesso evitado como...
Access restricted. Please log in or start a trial to view this content.
Discussão
O sucesso da quantificação de pH em Drosophila MTs depende inteiramente da saúde de MTs extraídos e a qualidade da montagem e dissecação (Figura A – C). Assim, o tratamento cuidadoso do tecido como descrito é imperativo. Slides recém revestidos em PLL substancialmente ajuda MT montagem como eles tendem a ser muito mais adesivo do que os slides que anteriormente foram expostos a solução. Cuidado montagem também ajudarão na identificaç?...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi financiado pelo NIH DK092408 e DK100227 de Mfr. AJR foi apoiado por T32-DK007013. Os autores desejam agradecer Dr. Julian A.T. Dow de CapaR-GAL4 e c724-GAL4 estoques de Drosophila . Agradecemos também o Jacob B. Anderson para obter assistência manutenção cruzamentos experimentais de voar.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Poly-L-Lysine (PLL) Solution | Sigma-Aldrich | P4832 | Store at 4 °C, can be reused. |
| Nigericin Sodium Salt | Sigma-Aldrich | N7143 | CAUTION: Handle with gloves. Store as aliquots of 20 mM stock solution in DMSO at 4 °C. |
| Adhesive Perfusion Chamber Covers, adhesive size 1 mm, chamber diameter × thickness 9 mm × 0.9 mm, ports diameter 1.5 mm | Sigma-Aldrich | GBL622105 | Can be substituted as needed to match perfusion system. |
| Sylgard 184 Silicone Elastomer Kit | Ellsworth Adhesives | 184 SIL ELAST KIT 0.5KG | Available from multiple vendors. |
| Helping Hands Soldering Stands | Harbor Freight Tools | 60501 | Available from multiple vendors. |
| Open Gravity-fed Perfusion System with Valve Controller, 8 to 1 Manifold and Reserviors | Bioscience Tools | PS-8S | Any comparable perfusion system can be used. |
| Flow Regulator | Warner Instruments | 64-0221 | Can be substituted as needed to match perfusion system. |
| Schneider's Medium | Fisher Scientific | 21720024 | Store at 4 °C in sterile aliquots. |
| #5 Inox Steel Forceps | Fine Science Tools | 11252-20 | Can be substituted based on experimenter comfort. |
| 35 x 10 mm polystyrene Petri dish | Corning Life Sciences | Fisher Scientific 08-757-100A | Exact brand and size are unimportant. |
| 75 x 25 mm Microscope Slides | Corning Life Sciences | 2949-75X25 | Exact brand and size can vary as long as perfusion wells are compatible. |
| Filimented Borosilicate Capillary Glass, ID 1.5 mm, OD 0.86 mm, thickness 0.32 mm | Warner Instruments | 64-0796 | Filiment not necessary, glass can be substituted to match perfusion tubing and perfusion wells. |
| Tygon Tubing, ID 1/16", OD 1/8", thickness 1/32" | Fisher Scientific | 14-171-129 | Available from multiple vendors, can be substituted to match perfusion system. |
| Vacuum Silicone Grease | Sigma-Aldrich | Z273554 | Available from multiple vendors. |
| Plastic Flow Control Clamp | Fisher Scientific | 05-869 | Available from multiple vendors, sterility not required |
| Glass rods, 5 mm diameter | delphiglass.com | 9198 | Exact size is personal preference, multiple vendors available |
| PAP Hydrophobic Pen | Sigma-Aldrich | Z377821 | Available from multiple vendors. |
| Sealing Film | Sigma-Aldrich | P7668 | Available from multiple vendors. |
| 15 mL Falcon tube | BD Falcon | 352096 | Available from multiple vendors. |
| 50 mL Falcon tube | BD Falcon | 352070 | Available from multiple vendors. |
| HEPES; 4-(2-Hydroxyethyl)piperazine-1-ethanesulfonic acid | Sigma-Aldrich | H3375 | Available from multiple vendors. |
| MES; 4-Morpholineethanesulfonic acid monohydrate | Sigma-Aldrich | 69892 | Available from multiple vendors. |
| TAPS; N-[Tris(hydroxymethyl)methyl]-3-aminopropanesulfonic acid | Sigma-Aldrich | T5130 | Available from multiple vendors. |
| 10X/0.45 Air Objective | Zeiss | 000000-1063-139 | Comparable objectives can be substituted. 40X objectives can be used for single cell imaging. |
| Dissecting Stereoscope | Zeiss | Discovery.V8 | Any dissecting stereoscope can be used. |
| UAS-pHerry transgenic Drosophila melagnogaster | Available from Romero Lab | First published: Citation 10 | |
| capaR-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 32 | |
| c724-GAL4 driver line Drosophila melagnogaster | Available from Romero Lab | First published: Citation 2 | |
| Monochromatic High Sensitivity Digital Camera | Zeiss | Axiocam 506 mono | Exact brand and model can vary, can be replaced with any monochromatic high-sensitivity camera suited to live cellular imaging. |
| GFP/FITC filter set, 470/40 nm ex., 515 nm longpass em., 500 nm dichroic | Chroma | CZ909 | Any GFP/FITC filer set can be substituted. |
| RFP/TRITC filter set, 546/10 nm ex., 590 nm longpass em., 565 nm dichroic | Chroma | CZ915 | Any GFP/FITC filer set can be substituted. |
| Inverted Epifluoescent Microscope | Zeiss | Axio Observer Z.1 | Any comparable microscope with motorized filter switching can be used. Upright microscopes can be used with open perfusion baths and water-immersion objectives. |
| Statistical Analysis Software | Microcal | Origin 6.0 | Any software with comparable functionality can be substituted |
| Image Analysis Software | National Institutes of Health | ImageJ 1.50i | Any software with comparable functionality can be substituted |
| Image Acquisition Software | Zeiss | Zen 1.1.2.0 | Any software with comparable functionality can be substituted |
| Single-edged Carbon Steel Razor Blade | Electron Microscopy Sciences | 71960 | Available from multiple vendors. |
| Microscopy Slide Folder | Fisher Scientific | 16-04 | Available from multiple vendors. |
| Bunsen Burner | Fisher Scientific | 50-110-1231 | Available from multiple vendors. |
| Polystrene Drosophila Rearing Vials with Flugs | Genesee Scientific | 32-109BF | Comparable items can be substituted. |
| 2.5 L Laboratory Ice Bucket | Fisher Scientific | 07-210-129 | Available from multiple vendors. |
| NMDG; N-Methyl-D-glucamine | Sigma-Aldrich | M2004 | Available from multiple vendors. |
| 200 uL barrier pipette tips | MidSci | AV200 | Available from multiple vendors. |
| 200 μL variable volume pipette | Gilson Incorporated | PIPETMAN P200 | Available from multiple vendors. |
Referências
- Dow, J. A. T., Romero, M. F. Drosophila provides rapid modeling of renal development, function, and disease. Am J Physiol Renal Physiol. 299 (6), F1237-F1244 (2010).
- Sozen, M. A., Armstrong, J. D., Yang, M., Kaiser, K., Dow, J. A. Functional domains are specified to single-cell resolution in a Drosophila epithelium. P Natl Acad Sci USA. 94 (10), 5207-5212 (1997).
- Davies, S. A., et al. Analysis and inactivation of vha55, the gene encoding the vacuolar ATPase B-subunit in Drosophila melanogaster reveals a larval lethal phenotype. J Biol Chem. 271 (48), 30677-30684 (1996).
- Torrie, L. S., et al. Resolution of the insect ouabain paradox. P Natl Acad Sci USA. 101 (37), 13689-13693 (2004).
- Evans, J. M., Allan, A. K., Davies, S. A., Dow, J. A. Sulphonylurea sensitivity and enriched expression implicate inward rectifier K+ channels in Drosophila melanogaster renal function. J Exp Biol. 208 (Pt 19), 3771-3783 (2005).
- Sciortino, C. M., Shrode, L. D., Fletcher, B. R., Harte, P. J., Romero, M. F. Localization of endogenous and recombinant Na(+)-driven anion exchanger protein NDAE1 from Drosophila melanogaster. Am J Physiol Cell Physiol. 281 (2), C449-C463 (2001).
- Ianowski, J. P., O'Donnell, M. J. Basolateral ion transport mechanisms during fluid secretion by Drosophila Malpighian tubules: Na+ recycling, Na+:K+:2Cl- cotransport and Cl- conductance. J Exp Biol. 207 (Pt 15), 2599-2609 (2004).
- O'Donnell, M. J., et al. Hormonally controlled chloride movement across Drosophila tubules is via ion channels in stellate cells. Am J Physiol. 274 (4 Pt 2), R1039-R1049 (1998).
- Cabrero, P., et al. Chloride channels in stellate cells are essential for uniquely high secretion rates in neuropeptide-stimulated Drosophila diuresis. P Natl Acad Sci USA. 111 (39), 14301-14306 (2014).
- Rossano, A. J., Kato, A., Minard, K. I., Romero, M. F., Macleod, G. T. Na+ /H+ -exchange via the Drosophila vesicular glutamate transporter (DVGLUT) mediates activity-induced acid efflux from presynaptic terminals. J Physiol. 595 (3), 805-824 (2017).
- Sankaranarayanan, S., De Angelis, D., Rothman, J. E., Ryan, T. A. The use of pHluorins for optical measurements of presynaptic activity. Biophys J. 79 (4), 2199-2208 (2000).
- Miesenbock, G., De Angelis, D. A., Rothman, J. E. Visualizing secretion and synaptic transmission with pH-sensitive green fluorescent proteins. Nature. 394 (6689), 192-195 (1998).
- Shaner, N. C., et al. Improved monomeric red, orange and yellow fluorescent proteins derived from Discosoma sp. red fluorescent protein. Nat biotechnol. 22 (12), 1567-1572 (2004).
- Thomas, J. A., Buchsbaum, R. N., Zimniak, A., Racker, E. Intracellular pH measurements in Ehrlich ascites tumor cells utilizing spectroscopic probes generated in situ. Biochemistry. 18 (11), 2210-2218 (1979).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Dietzl, G., et al. A genome-wide transgenic RNAi library for conditional gene inactivation in Drosophila. Nature. 448 (7150), 151(2007).
- Dow, J. A., et al. The malpighian tubules of Drosophila melanogaster: a novel phenotype for studies of fluid secretion and its control. J Exp Biol. 197, 421-428 (1994).
- Hirata, T., et al. In vivo Drosophilia genetic model for calcium oxalate nephrolithiasis. Am J Physiol Renal Physiol. 303 (11), F1555-F1562 (2012).
- Schellinger, J. N., Rodan, A. R. Use of the Ramsay Assay to Measure Fluid Secretion and Ion Flux Rates in the Drosophila melanogaster Malpighian Tubule. J Vis Exp. (105), (2015).
- Caldwell, P. C. An investigation of the intracellular pH of crab muscle fibres by means of micro-glass and micro-tungsten electrodes. J Physiol. 126 (1), 169-180 (1954).
- Boron, W. F., De Weer, P. Intracellular pH transients in squid giant axons caused by CO2, NH3, and metabolic inhibitors. J Gen Physiol. 67 (1), 91-112 (1976).
- Rink, T. J., Tsien, R. Y., Pozzan, T. Cytoplasmic pH and free Mg2+ in lymphocytes. J Cell Biol. 95 (1), 189-196 (1982).
- Bizzarri, R., Serresi, M., Luin, S., Beltram, F. Green fluorescent protein based pH indicators for in vivo use: a review. Anal Bioanal Chem. 393 (4), 1107-1122 (2009).
- Kneen, M., Farinas, J., Li, Y., Verkman, A. S. Green fluorescent protein as a noninvasive intracellular pH indicator. Biophys J. 74 (3), 1591-1599 (1998).
- Raimondo, J. V., Irkle, A., Wefelmeyer, W., Newey, S. E., Akerman, C. J. Genetically encoded proton sensors reveal activity-dependent pH changes in neurons. Front Mol Neurosci. 5, 68(2012).
- Raimondo, J. V., et al. Tight Coupling of Astrocyte pH Dynamics to Epileptiform Activity Revealed by Genetically Encoded pH Sensors. J Neurosci. 36 (26), 7002-7013 (2016).
- Bagar, T., Altenbach, K., Read, N. D., Bencina, M. Live-Cell imaging and measurement of intracellular pH in filamentous fungi using a genetically encoded ratiometric probe. Eukaryot Cell. 8 (5), 703-712 (2009).
- Gjetting, K. S., Ytting, C. K., Schulz, A., Fuglsang, A. T. Live imaging of intra- and extracellular pH in plants using pHusion, a novel genetically encoded biosensor. J Exp Bot. 63 (8), 3207-3218 (2012).
- Greenspan, R. J. Fly pushing: the theory and practice of Drosophila genetics. , 2nd ed, Cold Spring Harbor Laboratory Press. (2004).
- Raimondo, J. V., et al. A genetically-encoded chloride and pH sensor for dissociating ion dynamics in the nervous system. Front Cell Neurosci. 7, 202(2013).
- Koivusalo, M., et al. Amiloride inhibits macropinocytosis by lowering submembranous pH and preventing Rac1 and Cdc42 signaling. J Cell Biol. 188 (4), 547-563 (2010).
- Terhzaz, S., et al. Mechanism and function of Drosophila capa GPCR: a desiccation stress-responsive receptor with functional homology to human neuromedinU receptor. PloS one. 7 (1), e29897(2012).
- Boyarsky, G., Ganz, M. B., Sterzel, R. B., Boron, W. F. pH regulation in single glomerular mesangial cells. I. Acid extrusion in absence and presence of HCO3. Am J Physiol. 255 (6 Pt 1), C844-C856 (1988).
- Chesler, M. The regulation and modulation of pH in the nervous system. Prog Neurobiol. 34 (5), 401-427 (1990).
- Rossano, A. J., Chouhan, A. K., Macleod, G. T. Genetically encoded pH-indicators reveal activity-dependent cytosolic acidification of Drosophila motor nerve termini in vivo. J Physiol. 591 (7), 1691-1706 (2013).
- Roos, A., Boron, W. F. Intracellular pH. Physiol Rev. 61 (2), 296-434 (1981).
- Vaughan-Jones, R. D., Wu, M. L. pH dependence of intrinsic H+ buffering power in the sheep cardiac Purkinje fibre. J Physiol. 425, 429-448 (1990).
- Buckler, K. J., Vaughan-Jones, R. D., Peers, C., Nye, P. C. Intracellular pH and its regulation in isolated type I carotid body cells of the neonatal rat. J Physiol. 436, 107-129 (1991).
- Bevensee, M. O., Schwiening, C. J., Boron, W. F. Use of BCECF and propidium iodide to assess membrane integrity of acutely isolated CA1 neurons from rat hippocampus. J Neurosci Methods. 58 (1-2), 61-75 (1995).
- Arosio, D., et al. Simultaneous intracellular chloride and pH measurements using a GFP-based sensor. Nat Methods. 7 (7), 516-518 (2010).
- Wu, Y., Baum, M., Huang, C. L., Rodan, A. R. Two inwardly rectifying potassium channels, Irk1 and Irk2, play redundant roles in Drosophila renal tubule function. Am J Physiol Regul Integr Comp Physiol. 309 (7), R747-R756 (2015).
- Schulte, A., Lorenzen, I., Bottcher, M., Plieth, C. A novel fluorescent pH probe for expression in plants. Plant Methods. 2, 7(2006).
- Shen, Y., Rosendale, M., Campbell, R. E., Perrais, D. pHuji, a pH-sensitive red fluorescent protein for imaging of exo- and endocytosis. J Cell Biol. 207 (3), 419-432 (2014).
- Johnson, D. E., et al. Red fluorescent protein pH biosensor to detect concentrative nucleoside transport. J Biol Chem. 284 (31), 20499-20511 (2009).
- Mahon, M. J. pHluorin2: an enhanced, ratiometric, pH-sensitive green florescent protein. Adv Biosci Biotechnol. 2 (3), 132-137 (2011).
- Li, Y., Tsien, R. W. pHTomato, a red, genetically encoded indicator that enables multiplex interrogation of synaptic activity. Nat Neurosci. 15 (7), 1047-1053 (2012).
- Tantama, M., Hung, Y. P., Yellen, G. Imaging intracellular pH in live cells with a genetically encoded red fluorescent protein sensor. J Am Chem Soc. 133 (26), 10034-10037 (2011).
- Matlashov, M. E., et al. Fluorescent ratiometric pH indicator SypHer2: Applications in neuroscience and regenerative biology. Biochimica et biophysica acta. 1850 (11), 2318-2328 (2015).
- Kogure, T., et al. A fluorescent variant of a protein from the stony coral Montipora facilitates dual-color single-laser fluorescence cross-correlation spectroscopy. Nat biotechnol. 24 (5), 577-581 (2006).
- Llopis, J., McCaffery, J. M., Miyawaki, A., Farquhar, M. G., Tsien, R. Y. Measurement of cytosolic, mitochondrial, and Golgi pH in single living cells with green fluorescent proteins. P Natl Acad Sci USA. 95 (12), 6803-6808 (1998).
- Poburko, D., Santo-Domingo, J., Demaurex, N. Dynamic regulation of the mitochondrial proton gradient during cytosolic calcium elevations. J Biol Chem. 286 (13), 11672-11684 (2011).
- Stornaiuolo, M., et al. KDEL and KKXX retrieval signals appended to the same reporter protein determine different trafficking between endoplasmic reticulum, intermediate compartment, and Golgi complex. Mol Biol Cell. 14 (3), 889-902 (2003).
- Makkerh, J. P., Dingwall, C., Laskey, R. A. Comparative mutagenesis of nuclear localization signals reveals the importance of neutral and acidic amino acids. Curr Biol. 6 (8), 1025-1027 (1996).
- Zacharias, D. A., Violin, J. D., Newton, A. C., Tsien, R. Y. Partitioning of lipid-modified monomeric GFPs into membrane microdomains of live cells. Science. 296 (5569), 913-916 (2002).
- McGuire, R. M., Silberg, J. J., Pereira, F. A., Raphael, R. M. Selective cell-surface labeling of the molecular motor protein prestin. Biochem Biophys Res Comm. 410 (1), 134-139 (2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados