É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Medição da captação de glicose e resposta à estimulação de insulina em miotubos primários humanos cultivados in vitro
Neste Artigo
Resumo
Neste método, as células musculares primárias humanas são cultivadas in vitro para obter miotubos diferenciados e as taxas de absorção de glicose são medidas. Nós fornecemos um protocolo detalhado para quantificar taxas em estados basais e estimulados por insulina usando [ 3 H] 2-desoxi-D-Glucose radiomarcado.
Resumo
O músculo esquelético é o maior depósito de glicose em mamíferos e contribui em grande parte para a homeostase da glicose. A avaliação da sensibilidade à insulina das células musculares é de grande relevância para todos os estudos dedicados a explorar o metabolismo da glicose muscular e caracterizar alterações metabólicas. Nas células musculares, as proteínas do transportador de glicose 4 (GLUT4) translocam para a membrana plasmática em resposta à insulina, permitindo assim a entrada maciça de glicose na célula. A capacidade das células musculares para responder à insulina, aumentando a taxa de captação de glicose é uma das leituras padrão para quantificar a sensibilidade das células musculares à insulina. Os miotubos primários humanos são um modelo in vitro adequado, uma vez que as células mantêm muitas características do fenótipo do doador, incluindo a sensibilidade à insulina. Este modelo in vitro também é adequado para o teste de quaisquer compostos que possam impactar a capacidade de resposta da insulina. As medições da taxa de absorção de glicose em miotubos diferenciados refletemSensibilidade à insulina.
Neste método, as células musculares primárias humanas são cultivadas in vitro para obter miotubos diferenciados, e as taxas de absorção de glicose com e sem estimulação com insulina são medidas. Nós fornecemos um protocolo detalhado para quantificar as taxas de transporte de glicose passiva e ativa usando [ 3 H] 2-desoxi-D-Glucose radiomarcado ([3H] 2dG). Os métodos de cálculo são fornecidos para quantificar as taxas basais e estimuladas por insulina, bem como a dobra de estimulação.
Introdução
O músculo esquelético é o maior depósito de glicose em mamíferos e contribui em grande parte para a homeostase da glicose. Este tecido responsivo à insulina é o principal local de captação de glicose que é desencadeado pela estimulação de insulina 1 .
Na diabetes tipo 2, a resistência à insulina é observada em vários tecidos, incluindo o músculo esquelético, e conduz à concentração de glicose no sangue acima do normal. Assim, é de grande relevância para determinar o nível de sensibilidade à insulina deste tecido e suas células, quer seja para caracterizar um defeito em um sujeito, quer para avaliar a eficiência de um tratamento com o objetivo de melhorá-lo. Em indivíduos humanos ou animais, a técnica de padrão-ouro para avaliar a sensibilidade à insulina é o grampo hiperinsulinêmico-euglicêmico. Introduzido por DeFronzo em 1979 2 e modificado desde 3 , 4 então, o método permite quantificar todo o corpo aNd tecidos de resposta de insulina medida como a taxa de glicose a ser perfundida sob estimulação de insulina para manter a concentração normal de glicose no sangue.
A exploração da sensibilidade à insulina também pode ser realizada no nível celular usando modelos musculares in vitro e a medição das taxas de absorção de glicose continua sendo uma ferramenta eficiente e confiável para quantificar a resposta biológica da célula à estimulação de insulina 5 , 6 , 7 . De fato, a medida da absorção de glicose quantifica a resposta biológica celular à estimulação de insulina, desde a ligação da insulina ao seu receptor até a translocação de vesículas enriquecidas com GLUT4 e incluindo sinalização intracelular e cascatas de fosforilação 8 .
Isso é de grande interesse com amostras humanas, pois os miotubos diferenciados mantêm muitas características do fenótipo do doador, incluindo propriedades metabólicasIes e distúrbios observados no paciente 9 , 10 , 11 , 12 . Os miotubos apresentam semelhanças estruturais, metabólicas e fenotípicas com o músculo esquelético 13 , 14 , incluindo a expressão de transportadores de glicose 15 e a maquinaria de sinalização de insulina celular 16 . Assim, a medição da absorção de glicose em miotubos primários é relevante para caracterizar o fenótipo muscular de um doador, ou investigar o efeito de uma intervenção (medicamento, nutrição ou atividade física) na sensibilidade à insulina na célula muscular.
A medida da absorção de glicose em miotubos cultivados também é uma ferramenta confiável ao realizar experimentos que modificam a sensibilidade à insulina 17 , 18 . O in vitro modelo é adequado para o teste de quaisquer compostos que possam melhorar a capacidade de resposta da insulina, ou poderia prevenir ou reverter a resistência à insulina adquirida ou induzida 19 , 20 , 21 , 22 , 23 .
Aqui descrevemos um protocolo detalhado para a cultura e diferenciamos os miotubos humanos e medimos as taxas de absorção de glicose celular. O método é aplicável a qualquer fonte de células precursoras de músculo humano, sejam eles provenientes de preparações em laboratório, colaboração ou fornecedores comercialmente disponíveis. As linhas celulares musculares imortalizadas, como C2C12 e L6, respectivamente, de origem de rato e rato, também podem ser usadas para medição de absorção de glicose com este protocolo 7 .
Nós fornecemos um protocolo detalhado para quantificar as taxas em estados basais e estimulados por insulina usando [3H] 2dG radiomarcado. TO uso de um análogo de glicose rotulado permite uma determinação precisa da entrada de glicose com material de partida reduzido, uma condição comum ao trabalhar com células primárias. A molécula de glicose modificada é incapaz de entrar em caminhos metabólicos e, assim, se acumula dentro da célula, permitindo quantificação confiável através da radioatividade celular total. As condições experimentais incluem o uso de um inibidor do transporte de glicose (citocalasina B), e as medidas são realizadas com e sem insulina. Esta combinação permite a determinação das taxas de entrada ativa da glicose, bem como o cálculo da variação da dobra para o índice de resposta à insulina. O método é apresentado com uma dose de insulina durante um único tempo de incubação, mas o protocolo pode ser facilmente modificado para experiências de resposta a dose ou tempo 12 .
Protocolo
1. Preparação de meios e soluções de cultura de células
- Preparação de meios de cultura
- Prepare o meio de proliferação (PM), completando o meio F-10 de Ham com glutamina (2 mM), penicilina / estreptomicina (5 μg / mL final), 2% de soro de vitelo fetal (FCS) e 2% de suero.
- Prepare o meio de diferenciação (DM), completando o meio de Eagle modificado por Dulbecco (DMEM) com glutamina (2 mM), penicilina / estreptomicina (5 μg / mL final) e FCS a 2%.
- Preparação de soluções de absorção de glicose
Cuidado: o manuseio de material radioativo só é permitido em uma área restrita e controlada por pessoal autorizado. Os materiais e os resíduos devem ser manuseados de acordo com os procedimentos adequados, diretrizes e legislação local.- Para preparar a solução salina tamponada com fosfato de X-Dulbecco (X-DPBS), faça uma solução de DPBS contendo 0,2% (p / v) (concentração final) de soro bovino albUmin (BSA). Filtra a solução através de um filtro de 0,2 μm. Armazenar a 4 ° C.
- Para preparar a solução fria de 2-desoxi-D-glicose (2dG), pesa 16,4 mg de 2dG e solubiliza-se em 10 mL de água destilada para se obter uma solução 10 mM. Armazenar a 4 ° C.
- Adicione 600 μL de 2dG frio e 6 μL de [3H] 2dG radiomarcado a 5400 μL de X-DPBS para obter a solução 2dG (2dG *) radiomarcada.
NOTA: A concentração final é 1 mM 2dG e rotulagem é 1 μCi / mL.- Coloque uma alíquota de 20 μL (TC20) de uma solução 2dG * radiomarcada.
- Preparação de misturas de incubação
- Para a mistura de citocalasina B, adicione 2 μL de citocalasina B 20 mM a 2 mL de solução 2dG * radiomarcada.
NOTA: A solução de reserva de citocalasina B é de 10 mg / mL em sulfóxido de dimetilo (DMSO). - Para a mistura DMSO, adicione 4 μL de DMSO aos restantes 4 mL de solução 2dG * radiomarcada.
- Para a mistura de citocalasina B, adicione 2 μL de citocalasina B 20 mM a 2 mL de solução 2dG * radiomarcada.
2. Cultura das células musculares primárias humanas
- Semeadura de placas de 6 poços com células de células musculares humanas
NOTA: Use in-house (veja a referência 24 para detalhes) ou células de satélite musculares disponíveis comercialmente a partir de um frasco congelado (contendo 250,000 células). O seguinte procedimento é dado para 250.000 células, de modo a obter uma placa de 6 poços necessária para a medição da absorção de glicose em uma única condição.- Descongelar rapidamente os frascos congelados de 24 ou as preparações comerciais de células satélites de músculo humano em água pré-aquecida (37 ° C) até que apenas um pequeno bloco de gelo permaneça no frasco.
- Despeje diretamente em um tubo de plástico de 50 mL contendo 10 mL de pré-aquecido (37 ° C) PM.
- Centrifugar durante 5 min a 500 xg e descartar o sobrenadante.
- Ressuspenda gentilmente o sedimento celular com 18 mL de PM pré-aquecido (para obter 42.000 células por3 mL de meio). Distribua 3 mL em cada poço de uma placa de 6 poços (9,6 cm 2 ).
NOTA: Os seis poços individuais de uma placa são necessários para realizar uma medida duplicada da absorção de glicose nas seguintes condições: inibição do transporte passivo (poços 1 e 2), taxa basal (poços 3 e 4) e taxa estimulada pela insulina (poços 5 e 6). Repita tantas placas de seis poços como tratamentos distintos são necessários. - Incubar em condições de cultura padrão (37 ° C, 5% de CO 2 ) até as células atingir 90% de confluência.
NOTA: Esta etapa leva entre 48 e 72 h, dependendo do lote celular. Não mude o meio durante esta etapa.
- Diferenciação de células musculares
- Remova o PM (após 48-72 h) e substitua-o por DM pré-aquecido (3 mL por poço). Incubar a 37 ° C, 5% de CO 2 .
NOTA: A diferenciação leva cinco dias para alcançar um estado estável onde as células estão alinhadas e polinucleadas. Normalmente, o primárioOs miotubos são cultivados em um meio de glicose de 1 g / L. Portanto, para evitar a depleção de glicose durante a cultura, preencha a placa com 3 mL de meio para garantir que o substrato suficiente de glicose esteja disponível para as células em todos os momentos. - Substitua o DM médio a cada dois dias.
NOTA: A partir deste ponto, os miotubos são estáveis por até 7 dias sem alteração significativa e a medição da absorção de glicose pode ser realizada a qualquer momento.
- Remova o PM (após 48-72 h) e substitua-o por DM pré-aquecido (3 mL por poço). Incubar a 37 ° C, 5% de CO 2 .
- Tratamento de células musculares (opcional)
NOTA: Os miotubos primários podem ser tratados por vários dias para induzir modificação (teste de drogas, inibidores / ativadores da via de sinalização, etc. ) antes da estimulação de insulina e medidas de absorção de glicose. As células musculares podem ser submetidas a qualquer tratamento que possa ter um impacto na sensibilidade à insulina, e a medida da absorção de glicose irá quantificar esse impacto. Por exemplo, a incubação de células musculares com o palmitato de ácidos graxos saturados promove a resistência à insulina e as células apresentam redução de iNsulin estimulou a absorção de glicose.- Prepare 12 mL de DM suplementado com 10% de BSA (sem ácidos graxos) e palmitato de 0,5 mL (PALM). Prepare 12 mL de DM suplementado apenas com 10% de BSA (sem ácidos graxos).
- Prepare duas placas de 6 poços com miotubos primários humanos e cultive-os conforme descrito nas seções 2.1 e 2.2 (com 5 dias de diferenciação).
- No dia 5, lave cada poço com 2 mL de PBS. Em um prato, adicione 2 mL de DM contendo PALM. Para a outra placa, adicione 2 mL de BSA contendo apenas DM.
- Incubar durante 48 h a 37 ° C, 5% de CO 2 .
3. Estimulação da insulina
- Lavar as células musculares diferenciadas duas vezes com 2 mL de PBS.
- Remova PBS cuidadosamente e incuba com 3 mL de MS sem FCS durante 3 h (37 ° C, 5% de CO 2 ) para a depleção de soro.
- Substitua a mídia em todos os poços por 3 mL de DM sem FCS. Adicione insulina 100 nM aos poços 5 e 6.
- Incubar cultura de miotubos humanos para1 h (37 ° C, 5% de CO 2 ).
4. Captação de glicose
- Após 1 h de estimulação com insulina, lave os poços duas vezes com X-DPBS (1 mL por lavagem).
- Adicione 1 mL de mistura de citocalasina B aos poços 1 e 2 e 1 mL de mistura de DMSO aos poços 3 a 6. Incube durante 15 minutos (37 ° C, 5% de CO 2 ). No final da incubação, coloque imediatamente a placa no gelo.
5. Lise celular
- Lavar as células duas vezes com 1 mL de PBS gelado.
- Lyse as células em cada poço com 600 μL de 50 mM de NaOH. Incube no gelo durante 5 min e misture suavemente com rotação orbital lenta.
NOTA: Se o lisado for muito viscoso, diluir com 1,5 mL de NaOH. - Usando uma pipeta, ressuspenda e coleciona o lisado celular.
6. Determinação da glicose radiomarada
- Coloque 400 μL de cada lisado celular num frasco de contagem de cintilação líquida. Prepare um frasco de controle negativo com 400ΜL de NaOH 50 mM e um frasco de controlo positivo com 20 μL de TC20 (a partir do passo 1.2.3.1).
- Adicione 4 mL de solução de cintilação líquida a cada frasco para injectáveis. Feche a tampa e misture cada frasco completamente (1-2 s).
- Insira cada frasco em um contador de cintilação líquida e mida a radioatividade de acordo com as instruções do fabricante. Contagem de registros por minuto (CPM) para cada frasco de cintilação por 10 min.
NOTA: CPM = "desintegrações por minuto" x "eficiência de contagem".
7. Taxa de captação de glicose
- Use o restante lisado (200 μL, a partir do passo 5.2) para medir a concentração de proteína. Determine a concentração de proteína de cada lisado celular utilizando Bradford 25 ou um método equivalente. Calcule a quantidade total de proteína (Q) em mg para cada poço.
- Para obter TC1 (o valor para 1 μL de 2dG radiomarcado *), divida o valor de CPM de TC20 em 20.
- Para cada frasco, calcule tA taxa de absorção de glicose é a seguinte:
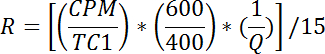
NOTA: R é medido em pmol / mg / min. A média de R para os poços 1 a 2 dá taxa de transporte passivo, R p . A média de R para poços 3-4 dá taxa de transporte total basal, R bt . A média de R para os poços 5-6 dá taxa de transporte total estimulada pela insulina, R it .- Calcule a taxa de transporte ativo basal (R ba ) da seguinte maneira:
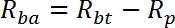
- Calcule a taxa de transporte ativa estimulada pela insulina (R ia ) da seguinte maneira:
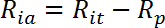
NOTA: Em células responsivas a insulina como miotubos, as taxas de absorção de glicose são geralmente representadas por três valores: R ba , R ia e a estimulação da dobra de insulina como R ia / R ba .
- Calcule a taxa de transporte ativo basal (R ba ) da seguinte maneira:
Resultados
No dia 3, os mioblastos alcançam a confluência ( Figura 1A ). Os mioblastos nesta fase são tipicamente mononucleados. O meio foi alterado e no dia 8, a diferenciação foi completada ( Figura 1B ) (seção de protocolo 2). Após 5 dias de diferenciação, os miotubos são alinhados e tipicamente polinucleados. Os miotubos primários humanos foram submetidos a um tratamento com palmitato ou apenas com BSA antes da medição da...
Discussão
A absorção de glicose é uma medida biológica fundamental para testar ativadores ou inibidores na cultura celular e como eles afetam o uso de glicose e a capacidade da célula de responder à insulina. O método descrito aqui mostrou-se rápido e confiável e tem sido amplamente utilizado em muitos estudos usando miotubos primários de indivíduos saudáveis e / ou pacientes metabólicamente afetados 6 , 7 , 10 ,<...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores reconhecem Anne Charrié no serviço de Radiobiologia (hospital Lyon-Sud) e Fond National Suisse (FNS) pelo apoio financeiro.
Materiais
| Name | Company | Catalog Number | Comments |
| Human primary muscle cell | In house preparation from human skeletal muscle biopsies | In house preparation from human skeletal muscle biopsies | If not available, use commercial source |
| Human primary muscle cell | Promocell | C-12530 | Should be cultured with associated media C23060 and C23061 |
| 6-well plate | Corning | 356400 | BioCoat Collagen I Multiwell Plates |
| Ham's F10 | Dutscher | L0145-500 | 1 g/L glucose |
| Glutamine | Dutscher | X0551-100 | |
| penicilin/streptomycin 100x | Thermo fisher scientific | 15140122 | |
| Serum substitute UltroserG | Pall France | 15950.017 | serum substitute in text |
| DMEM low glucose | Dutscher | L0064-500 | 1 g/L glucose |
| Fetal Calf Serum | Eurobio | CVFSVF00-01 | |
| Dulbecco's Phosphate-Buffered Saline | Dutscher | L0625-500 | Contains Mg2+ (0.5 mM) and Ca2+ (0.9 mM) |
| Insulin solution human | Sigma-Aldrich | I9278 | |
| 2-deoxy-D-glucose | Sigma-Aldrich | D6134 | |
| Albumin bovine | euromedex | 04-100-812-E | |
| fatty acid-free BSA | Roche | 10,775,835,001 | |
| palmitate | Sigma-Aldrich | P0500 | |
| Deoxy-D-glucose, 2-[1,2-3H (N)] | PerkinElmer | NET328A001MC | Specific Activity: 5 - 10 Ci (185-370GBq)/mmol, 1 mCi (37MBq |
| Cytochalasin B | Sigma-Aldrich | c2743 | |
| PICO PRIAS VIAL 6 mL | PerkinElmer | 6000192 | |
| ultima gold MW CA | PerkinElmer | 6013159 | scintillation liquid |
| bêta counter | PerkinElmer | 2900TR |
Referências
- Stump, C. S., Henriksen, E. J., Wei, Y., Sowers, J. R. The metabolic syndrome: role of skeletal muscle metabolism. Ann Med. 38 (6), 389-402 (2006).
- DeFronzo, R. A., Tobin, J. D., Andres, R. Glucose clamp technique: a method for quantifying insulin secretion and resistance. Am J Physiol. 237 (3), E214-E223 (1979).
- Fossum, E., Hoieggen, A., Moan, A., Nordby, G., Kjeldsen, S. E. Insulin sensitivity relates to other cardiovascular risk factors in young men: validation of some modifications of the hyperinsulinaemic, isoglycaemic glucose clamp technique. Blood Press Suppl. 2, 113-119 (1997).
- Heise, T., et al. Euglycaemic glucose clamp: what it can and cannot do, and how to do it. Diabetes Obes Metab. 18 (10), 962-972 (2016).
- Sell, H., Jensen, J., Eckel, J. Measurement of insulin sensitivity in skeletal muscle in vitro. Methods Mol Biol. 933, 255-263 (2012).
- Sarabia, V., Lam, L., Burdett, E., Leiter, L. A., Klip, A. Glucose transport in human skeletal muscle cells in culture. Stimulation by insulin and metformin. J Clin Invest. 90 (4), 1386-1395 (1992).
- Sarabia, V., Ramlal, T., Klip, A. Glucose uptake in human and animal muscle cells in culture. Biochem Cell Biol. 68 (2), 536-542 (1990).
- Richter, E. A., Hargreaves, M. Exercise, GLUT4, and skeletal muscle glucose uptake. Physiol Rev. 93 (3), 993-1017 (2013).
- Gaster, M., Kristensen, S. R., Beck-Nielsen, H., Schroder, H. D. A cellular model system of differentiated human myotubes. Apmis. 109 (11), 735-744 (2001).
- Bouzakri, K., et al. Reduced activation of phosphatidylinositol-3 kinase and increased serine 636 phosphorylation of insulin receptor substrate-1 in primary culture of skeletal muscle cells from patients with type 2 diabetes. Diabetes. 52 (6), 1319-1325 (2003).
- Scheele, C., et al. Satellite cells derived from obese humans with type 2 diabetes and differentiated into myocytes in vitro exhibit abnormal response to IL-6. PLoS One. 7 (6), e39657 (2012).
- Jackson, S., et al. Decreased insulin responsiveness of glucose uptake in cultured human skeletal muscle cells from insulin-resistant nondiabetic relatives of type 2 diabetic families. Diabetes. 49 (7), 1169-1177 (2000).
- Aas, V., et al. Are cultured human myotubes far from home?. Cell Tissue Res. 354 (3), 671-682 (2013).
- Bakke, S. S., et al. Myotubes from severely obese type 2 diabetic subjects accumulate less lipids and show higher lipolytic rate than myotubes from severely obese non-diabetic subjects. PLoS One. 10 (3), e0119556 (2015).
- Stuart, C. A., et al. Hexose transporter mRNAs for GLUT4, GLUT5, and GLUT12 predominate in human muscle. Am J Physiol Endocrinol Metab. 291 (5), E1067-E1073 (2006).
- Al-Khalili, L., et al. Insulin action in cultured human skeletal muscle cells during differentiation: assessment of cell surface GLUT4 and GLUT1 content. Cell Mol Life Sci. 60 (5), 991-998 (2003).
- Tsuka, S., et al. Promotion of insulin-induced glucose uptake in C2C12 myotubes by osteocalcin. Biochem Biophys Res Commun. 459 (3), 437-442 (2015).
- Gorbunov, E. A., Nicoll, J., Myslivets, A. A., Kachaeva, E. V., Tarasov, S. A. Subetta Enhances Sensitivity of Human Muscle Cells to Insulin. Bull Exp Biol Med. 159 (4), 463-465 (2015).
- Breen, D. M., Sanli, T., Giacca, A., Tsiani, E. Stimulation of muscle cell glucose uptake by resveratrol through sirtuins and AMPK. Biochem Biophys Res Commun. 374 (1), 117-122 (2008).
- Pinnamaneni, S. K., Southgate, R. J., Febbraio, M. A., Watt, M. J. Stearoyl CoA desaturase 1 is elevated in obesity but protects against fatty acid-induced skeletal muscle insulin resistance in vitro. Diabetologia. 49 (12), 3027-3037 (2006).
- Gastebois, C., et al. Transition from physical activity to inactivity increases skeletal muscle miR-148b content and triggers insulin resistance. Physiol Rep. 4 (17), (2016).
- Naimi, M., Tsakiridis, T., Stamatatos, T. C., Alexandropoulos, D. I., Tsiani, E. Increased skeletal muscle glucose uptake by rosemary extract through AMPK activation. Appl Physiol Nutr Metab. 40 (4), 407-413 (2015).
- Feng, Y. Z., et al. PPARdelta activation in human myotubes increases mitochondrial fatty acid oxidative capacity and reduces glucose utilization by a switch in substrate preference. Arch Physiol Biochem. 120 (1), 12-21 (2014).
- Perrin, L., et al. Human skeletal myotubes display a cell-autonomous circadian clock implicated in basal myokine secretion. Mol Metab. 4 (11), 834-845 (2015).
- Bradford, M. M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72, 248-254 (1976).
- Bouzakri, K., et al. Malonyl CoenzymeA decarboxylase regulates lipid and glucose metabolism in human skeletal muscle. Diabetes. 57 (6), 1508-1516 (2008).
- Shemyakin, A., et al. Endothelin-1 reduces glucose uptake in human skeletal muscle in vivo and in vitro. Diabetes. 60 (8), 2061-2067 (2011).
- Alkhateeb, H., Chabowski, A., Glatz, J. F., Luiken, J. F., Bonen, A. Two phases of palmitate-induced insulin resistance in skeletal muscle: impaired GLUT4 translocation is followed by a reduced GLUT4 intrinsic activity. Am J Physiol Endocrinol Metab. 293 (3), E783-E793 (2007).
- Coll, T., et al. Oleate reverses palmitate-induced insulin resistance and inflammation in skeletal muscle cells. J Biol Chem. 283 (17), 11107-11116 (2008).
- Gaster, M., Rustan, A. C., Beck-Nielsen, H. Differential utilization of saturated palmitate and unsaturated oleate: evidence from cultured myotubes. Diabetes. 54 (3), 648-656 (2005).
- Hage Hassan, R., et al. Endoplasmic reticulum stress does not mediate palmitate-induced insulin resistance in mouse and human muscle cells. Diabetologia. 55 (1), 204-214 (2012).
- Haghani, K., Pashaei, S., Vakili, S., Taheripak, G., Bakhtiyari, S. TNF-alpha knockdown alleviates palmitate-induced insulin resistance in C2C12 skeletal muscle cells. Biochem Biophys Res Commun. 460 (4), 977-982 (2015).
- Hommelberg, P. P., et al. Palmitate-induced skeletal muscle insulin resistance does not require NF-kappaB activation. Cell Mol Life Sci. 68 (7), 1215-1225 (2011).
- Yang, M., et al. Saturated fatty acid palmitate-induced insulin resistance is accompanied with myotube loss and the impaired expression of health benefit myokine genes in C2C12 myotubes. Lipids Health Dis. 12, 104 (2013).
- Peng, G., et al. Oleate blocks palmitate-induced abnormal lipid distribution, endoplasmic reticulum expansion and stress, and insulin resistance in skeletal muscle. Endocrinology. 152 (6), 2206-2218 (2011).
- Lambernd, S., et al. Contractile activity of human skeletal muscle cells prevents insulin resistance by inhibiting pro-inflammatory signalling pathways. Diabetologia. 55 (4), 1128-1139 (2012).
- Nikolic, N., et al. Electrical pulse stimulation of cultured human skeletal muscle cells as an in vitro model of exercise. PLoS One. 7 (3), e33203 (2012).
- Hsu, F. L., et al. Antidiabetic effects of pterosin A, a small-molecular-weight natural product, on diabetic mouse models. Diabetes. 62 (2), 628-638 (2013).
- Zou, C., Wang, Y., Shen, Z. 2-NBDG as a fluorescent indicator for direct glucose uptake measurement. J Biochem Biophys Methods. 64 (3), 207-215 (2005).
- Catalano, K. J., et al. Insulin resistance induced by hyperinsulinemia coincides with a persistent alteration at the insulin receptor tyrosine kinase domain. PLoS One. 9 (9), e108693 (2014).
- Liu, H. Y., et al. Insulin is a stronger inducer of insulin resistance than hyperglycemia in mice with type 1 diabetes mellitus (T1DM). J Biol Chem. 284 (40), 27090-27100 (2009).
- Renstrom, F., Buren, J., Svensson, M., Eriksson, J. W. Insulin resistance induced by high glucose and high insulin precedes insulin receptor substrate 1 protein depletion in human adipocytes. Metabolism. 56 (2), 190-198 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados