É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliação In Vivo das Propriedades Mecanicas e Viscoelásticas da Língua do Rato
Neste Artigo
Resumo
Descrevemos um procedimento cirúrgico em um modelo de rato anestesiado para determinar o tônus muscular e as propriedades viscoelásticas da língua. O procedimento envolve estimulação específica dos nervos hipoglosos e aplicação de curvas de força / deformação Lissajous passivas ao músculo.
Resumo
A língua é um hidróstato muscular altamente inervado e vascularizado no chão da boca da maioria dos vertebrados. Suas principais funções incluem o apoio à mastigação e deglutição, bem como sensação ao gosto e fonética. Conseqüentemente, a força e o volume da língua podem afetar a habilidade dos vertebrados para realizar atividades básicas, como alimentação, comunicação e respiração. Pacientes humanos com apneia do sono têm linguas alargadas, caracterizadas por redução do tônus muscular e aumento da gordura intramuscular que pode ser visualizada e quantificada por ressonância magnética (MRI). As habilidades para medir a geração da força e as propriedades viscoelásticas da língua constituem ferramentas importantes para a obtenção de informação funcional para correlacionar os dados de imagem. Aqui, apresentamos técnicas para medir a produção da força da língua em ratos Zucker anestesiados através da estimulação elétrica dos nervos hipoglosos e para a determinação das propriedades viscoelásticas oF na língua aplicando curvas de força / deformação Lissajous passivas.
Introdução
A língua fornece suporte essencial para mastigação, deglutição, sensação ao gosto e fala. A presença de musculatura extrínseca e intrínseca, com inervação e anatomia / função distintas, explica a singularidade desse hydrostat muscular. Os avanços recentes em técnicas de imagem forneceram uma visão mais detalhada de sua anatomia complexa 1 . A diminuição da funcionalidade da língua, a atrofia da língua, disfagia e impedimentos de fala também são manifestações comuns de doenças miopáticas como Parkinson 2 , esclerose lateral amiotrófica (ALS) 3 , distrofia miotônica (MD) 4 e outras miopatias.
Alterações na composição muscular associadas a estados de doença comuns afetam as propriedades mecânicas e viscoelásticas da língua. Por exemplo, a análise funcional da força da língua revelou mudanças nas propriedades contráteis associadas ao envelhecimentoSs = "xref"> 5 , 6 , hipoxia 7 , 8 e obesidade 9 , 10 . No caso da distrofia muscular, o aumento da fibrose leva à maior rigidez muscular, o que se traduz em uma menor adesão à deformação quando se aplica um protocolo de deformação Lissajous 11 . Por outro lado, as mudanças no teor de gordura muscular, como as documentadas em pacientes obesos, alteram as propriedades metabólicas 12 e mecânicas do músculo esquelético 13 , 14 e prevêem aumentar a adesão muscular à deformação. O aumento da gordura da língua também se correlaciona com o desenvolvimento da apneia obstrutiva do sono (OSA) em seres humanos 17 aumentando o volume da língua para o ponto de oclusão parcial das vias aéreas superiores (apneia) 15 , 16 . SimPor sua vez, a infiltração de gordura na língua foi documentada em ratos obesos Zucker 10 , sugerindo que este modelo é uma ferramenta valiosa para estudar os efeitos da infiltração de gordura na fisiologia da língua.
A força da língua de medição requer técnicas cirúrgicas delicadas para isolar e estimular bilateralmente os nervos hipoglosos 17 , 18 . Tais técnicas foram descritas anteriormente em ratos 5 , 17 , 19 , 20 , coelhos 21 e humanos 22 , 23 , ainda com auxílios visuais limitados para o investigador. Devido à sua natureza altamente técnica, a disponibilidade de um protocolo detalhado melhoraria significativamente a acessibilidade e a reprodutibilidade dessa técnica. O objetivo do nosso paradigma experimental é o doenteEstabelecer uma técnica válida e confiável para medir a força e as propriedades viscoelásticas da língua em um modelo de rato. Para realizar isso, o rato é anestesiado, os nervos hipoglosos são expostos e a traquéia é canulada para garantir o acesso gratuito à língua do animal. Um loop de sutura então conecta a ponta da língua a um transdutor de força, capaz de controlar força e comprimento, enquanto dois eletrodos de gancho bipolar estimulam os nervos hipoglosos a induzir a contração da língua. Após a conclusão da medida da força, as capacidades de controle de comprimento do transdutor de força são usadas para alterar rapidamente o comprimento da língua, de acordo com um protocolo de onda senoidal com amplitude fixa (curvas Lissajous), duração e freqüência, permitindo derivar Suas propriedades viscoelásticas 11 , 24 . O protocolo orientará o investigador através das etapas de dissecção, o posicionamento do animal no platfo experimentalRm, colocação de eletrodos e, finalmente, para a aquisição e análise dos dados de força e viscoelasticidade.
Protocolo
Todos os procedimentos, incluindo assuntos de animais, foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) da Universidade da Pensilvânia (Protocolo número 805822). O procedimento descrito é terminal e não requer a utilização de condições assépticas ou produtos de grau farmacêutico.
1. Procedimentos cirúrgicos
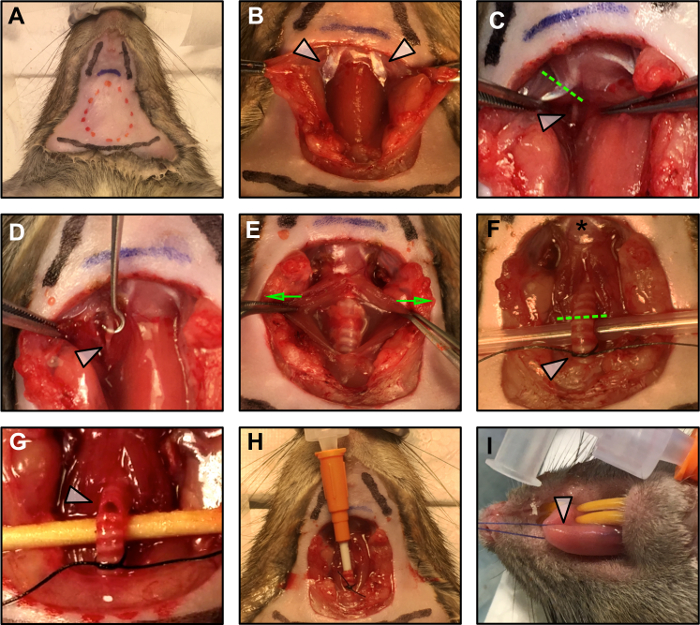
Figura 1: Procedimentos cirúrgicos.
(A) Demarcação do plano cirúrgico. A linha tracejada vermelha indica a área da incisão. Duas linhas pretas indicam a posição do maxilar, enquanto a linha inferior preta marca a posição do tórax. A linha azul indica o osso hióide. (B) Exposição da barriga posterior do músculo digástrico (setas) após a dissecação sem corte do tecido adiposo, a sublingual e submaxill Glândulas ary. (C) Resecção da barriga posterior do músculo digástrico (linha verde tracejada) para expor o nervo hipoglosso (flecha branca). (D) O nervo hipoglosso (seta branca) é removido da fáscia circundante. (E) A traquéia é exposta puxando suavemente o músculo liso ao redor dele (as setas verdes indicam a direção da força aplicada) e levantaram (F) para se preparar para a intubação. A estrela indica a inserção da língua no osso hióide. A linha tracejada verde marca o ponto de incisão para a intubação. A flecha branca indica o nó solto preparado para proteger a cânula no lugar, uma vez inserido. (G) Incisão da traquéia para a canulação. (H) A cânula traqueal é inserida e segura no lugar com um nó quadrado. (I) Aplicação da sutura à língua.Target = "_ blank"> Clique aqui para ver uma versão maior desta figura.
- Anestesia e preparação para cirurgia
- Coloque o rato na câmara de indução com 4% de anestesia com isoflurano.
- Coloque o animal em decúbito dorsal sobre uma fonte de calor e mantenha a anestesia com 1 a 3% de isoflurano a partir de uma nosecone, garantindo uma taxa respiratória de pelo menos 70 respirações por minuto.
- Raspe a área do pescoço com um creme de depilação e depilação. Ao usar o creme de depilação, espalhe o creme com um aplicador com ponta de algodão até que a pele seja removida. A exposição prolongada ao creme de depilação pode causar irritação da pele.
- Limpe o campo cirúrgico com 70% de álcool ( Figura 1A ).
- Verifique o padrão respiratório e os reflexos do animal (falta de reflexo de pinça) antes de continuar com a incisão inicial. O monitoramento contínuo e avaliação da profundidade da anestesia é essencial (reTaxa respiratória do cordão e falta de reflexos a cada 10 min); O animal precisa estar debaixo de um plano cirúrgico profundo da anestesia durante todo o procedimento.
- Identificação de Nervos Hipoglosos
- Abra o campo cirúrgico com um par de tesouras operando ressecando e removendo a pele como indicado pela linha pontilhada vermelha na Figura 1A .
- Dissecção brusca através de qualquer tecido adiposo, glândulas sublinguais e submaxilares e a camada muscular que envolve a traqueia.
NOTA: Seja conservador durante a dissecção. Use a dissecação sem corte sempre que possível e tenha cuidado para não danificar os vasos sanguíneos do pescoço. - Identificar a barriga posterior do músculo digástrico (PD) lateral à traquéia ( Figura 1B - setas brancas). O nervo hipoglosso corre sob este músculo ( Figura 1C - seta branca). Com o electrocauterismo, reseca o PD proxImediatamente no osso hióide ( Figura 1C - linha tracejada).
NOTA: Não deixe o nervo ou o tecido em torno dele se tornarem secos. Adicione uma gota de óleo mineral no nervo para protegê-lo. Para evitar a contração muscular devido à propagação de campo do estímulo dos eletrodos, cauterize cuidadosamente o tecido muscular nos possíveis locais de contato ao redor do nervo. - Usando um par de pinças finas, dissecar o nervo hipoglosso da fáscia circundante. Com a ajuda de um gancho, certifique-se de que pelo menos 3 mm do nervo estejam disponíveis para a conexão do eletrodo bipolar ( Figura 1D ).
- Usando pinças micro-hemostáticas, esmagam o nervo hipoglosso como distalmente do osso hióide ( Figura 1D - seta branca) quanto possível para evitar a propagação retrógrada do estímulo. Esmague o nervo aplicando pressão sobre ele com a pinça micro-hemostática por 5 s. Quando o hemostático agarra o nervo, um breve tA bruxa na base da língua deve ser visível.
- Repita o procedimento para o outro lado.
- Intubação traqueal
- Exponha a traquéia separando suavemente os músculos lisos circundantes por dissecação sem corte ( Figura 1E - como indicado pelas setas verdes).
NOTA: Seja conservador e use dissecção preferencialmente contundente. Compare o diâmetro da cânula com o da traquéia. A cânula deve caber corretamente na traquéia e deve permanecer inserida de forma estável depois de ser suturada como descrito nos passos 1.3.2 a 1.3.5. - Levante levemente a traquéia usando um par de fórceps de amarração de sutura e passe uma sutura 4-0 debaixo dela, perto do tórax. Amarre um nó solto inicial entre o 6º eo 7º anel da laringe ( Figura 1F - seta branca). Este nó será fechado uma vez que a cânula seja inserida para mantê-la no lugar.
- Deslize o tronco de umTransfira a pipeta (lubrifique a pipeta com óleo mineral para facilitar a inserção) sob a traquéia para levantar e facilitar a inserção da cânula (IV 14 gx 3,25 "cânula).
- Corte uma pequena incisão entre os 4º e 5º anéis da laringe ( Figura 1G - seta branca). Após a primeira incisão, a abertura tenderá a se espalhar, portanto, seja conservadora ao fazer o corte inicial para evitar a ressecção completa da traquéia.
NOTA: Antes de realizar a incisão da traquéia, verifique se a cânula está pronta e a entrega da anestesia está ativada. - Comece a administração da anestesia através da cânula e insira-a suavemente na incisão, avançando suavemente dentro da traquéia com o comprimento de aproximadamente 5 anéis. Fixe a cânula no lugar com a sutura, para criar uma vedação hermética ( Figura 1 ).
NOTA: Certifique-se de que nenhum fluido entra na traquéia cortada para evitar o sufixoOcação. Uma vez que a traquéia é incisada, o animal estará respirando o ar da sala. Portanto, é importante inserir rapidamente a cânula para que a entrega da anestesia seja mantida. Quando / se mover o animal, monitore a posição correta da cânula na traquéia. - Remova gentilmente o animal da nosecone.
NOTA: O uso de anestésicos injectáveis em vez de isoflurano pode simplificar o procedimento, eliminando a necessidade de intubação traqueal e eliminando o espaço de trabalho experimental do excesso de tubulação.
- Exponha a traquéia separando suavemente os músculos lisos circundantes por dissecação sem corte ( Figura 1E - como indicado pelas setas verdes).
- Sutura de língua
- Empurre um pedaço de sémen 5/0 de 20 cm de comprimento (sugerimos Seda, trançado preto) em PBS.
- Enquanto mantém aberta a boca do rato, segure suavemente a ponta da língua com a pinça que liga a sutura.
- Passe a sutura medialmente através da ponta da língua ( Figura 1I - seta branca) com atenção para manter a língua úmida com solução salina para evitar possíveis tecidosdanificar.
- Amarre um laço com aproximadamente 4 cm de largura (o diâmetro pode mudar com base na distância entre o animal e o transdutor de força).
NOTA: Certifique-se de que a sutura e a língua estejam molhadas para facilitar a inserção e evitar lesões desnecessárias do tecido.
2. Configuração Experimental
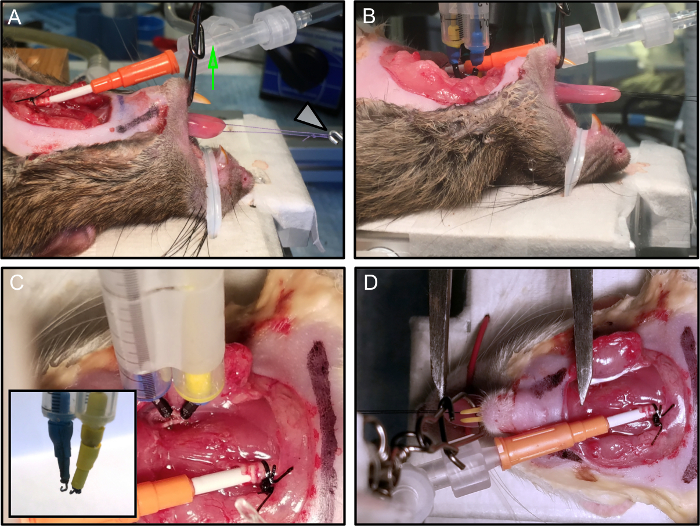
Figura 2: posicionando e protegendo o animal.
(A) O mouse está posicionado na plataforma experimental. A mandíbula está segura e a boca mantida aberta pela aplicação de tensão vertical (seta verde). O loop de sutura é conectado ao transdutor de força (seta branca). (B) Os eletrodos estão conectados. (C) Cada eletrodo, montado em um micromanipulador, está conectado de forma estável ao nervo. A incrustação mostra o término de tEle ganha eletrodo. (D) O comprimento ideal da língua é medido com uma pinça Vernier, desde a inserção ao nível do osso hióide até a ponta da língua. Nesta imagem, os eletrodos foram removidos por clareza. Clique aqui para ver uma versão maior dessa figura.
Nota: Posicione o animal em decúbito dorsal na bandeja aquecida do aparelho, usando as seguintes medidas de segurança para evitar o movimento durante o experimento.
- Fixe o nariz do rato à bandeja com uma torção metálica revestida de plástico diretamente conectada à plataforma aquecida ( Figura 2A , 2B ).
- Mantenha a boca do rato aberta aplicando tensão vertical (use uma linha de monofilamento de teste de 3 viragens com fita adesiva de 9 kg e segure no lugar com um stick de câmera) ( Figura 2A - seta verde).
NOTA: Uma abordagem alternativa para estabilizar o rato é usar uma mordaça de boca de roedor ou uma modificação personalizada dele. É essencial que a boca seja mantida aberta e estável para evitar movimentos do pescoço que possam afetar a qualidade das medidas. - Conecte o loop de sutura ao transdutor de força ( Figura 2A - seta branca).
- Usando fita cirúrgica, imobilizam os membros e o abdômen do rato para limitar os movimentos durante os estímulos.
- Aplique os dois eléctrodos bipolares de gancho estimulante aos nervos hipoglosos dissecados, proximalmente ao local de esmagamento ( Figura 2C ).
- Use eletrodos bipolares estimulantes feitos a partir de um par de eletrodos de agulha de calibre 29 de aço de grau cirúrgico, mantidos juntos a uma distância de 2 mm uns dos outros usando um suporte de plástico (aqui, utilizamos duas pipetas sorológicas de 1 mL gravadas).
- Dobre as pontas dos eletrodos da agulha até uma forma de ganchoPequeno o suficiente para formar um contato estável com o nervo (~ 1 mm de diâmetro) ( Figura 2C - inlay).
- Conecte os dois fios de cada eletrodo a um empate empilhável de ligação dupla com conector banana jack x BNC e, em seguida, conecte-se ao módulo estimulador de um sistema de teste de músculo in situ (Tabela 3) usando um divisor BNC.
NOTA: Certifique-se de que o animal é estável e que o pescoço e a língua estão alinhados com a alavanca do transdutor de força. Continue monitorando a freqüência respiratória e assegure-se de que as restrições não interferem com a respiração.
3. Comprimento ótimo (L 0 ) e determinação de força isométrica máxima
- Ajuste o comprimento da língua gradualmente e aplique estímulos de contração isométrica até obter uma força máxima.
- Defina L 0 como o comprimento em que a força de contração isométrica ( Tabela 1 ) é máxima e registre para a posterior normalização deAs medidas de força, como muda para cada animal. Usando uma pinça Vernier, mida o comprimento da língua da inserção ao nível do osso hióide ( Figura 2D ) até a ponta da língua.
NOTA: O posicionamento correto dos eletrodos é essencial para garantir um contato ótimo com os nervos. O posicionamento ótimo deve exercer forças similares e aditivas ao estimular um dos dois nervos ou ambos, respectivamente.
- Defina L 0 como o comprimento em que a força de contração isométrica ( Tabela 1 ) é máxima e registre para a posterior normalização deAs medidas de força, como muda para cada animal. Usando uma pinça Vernier, mida o comprimento da língua da inserção ao nível do osso hióide ( Figura 2D ) até a ponta da língua.
- Antes de iniciar o experimento, conecte ambos os eletrodos ao estimulador e administre um teste de estimulação tetânica ( Tabela 1 ). Durante esta contração, monitore o animal para garantir que a posição seja estável e verifique se há contrações visíveis indesejadas dos músculos do pescoço.
- Medir a força isométrica aplicando uma contração seguida de 20 s por uma estimulação tetânica. Repita as estimulações 3 vezes, permitindo uma recuperação de 4 min entre os ciclos de estimulação (um ciclo inclui uma contração e umaE estimulação tetânica), e registrar as forças máximas de contração e tetânica.
- Manter a língua molhada em todos os momentos, aplicando algumas gotas de PBS entre as contracções.
NOTA: Se os músculos do pescoço se contraírem, altere cuidadosamente o posicionamento dos eletrodos para que eles não toquem nenhum tecido muscular circundante e, se necessário, cauterize o tecido em contato com os eletrodos.
4. Determinação das propriedades viscoelásticas (Curvas Lissajous)
- Deixe a língua descansar por 3 a 5 minutos após a determinação da força isométrica. Execute as curvas Lissajous começando em L 0 , portanto, a posição do animal e do transdutor de força nunca deve ser alterada.
- Sem estimular os nervos hipoglosos, aplique ciclos de estiramentos passivos ( Tabela 2 ) com aumento do deslocamento (d) ou seja , 5, 10, 15, 20, 25, 30, 35, 40, 50% de L 0 (amplitudes maiores podem exigir um duplo Controlador de modo com higheR valores de excursão do que o 305C-LR). Por exemplo, uma amplitude de 40% L 0 causará a deformação da língua de + 20% L 0 a -20% L 0 .
- Use uma freqüência senoidal fixa de 2 Hz com 10 repetições em cada ciclo, para uma duração total de 5 s em cada ciclo. Alterações da freqüência do seno têm sido usadas no passado com tecidos como o diafragma 24 e podem ser adotadas para modificar o protocolo experimental.
- Aguarde 30 s entre cada ciclo e assegure que a língua esteja molhada durante todo o procedimento.
NOTA: Mantenha a língua molhada durante o procedimento, adicionando algumas gotas de PBS. Certifique-se de que o restrição que contém a mandíbula permaneça estável durante os trechos, particularmente quando o deslocamento atinge 40% ou mais.
- Imediatamente após a conclusão do experimento, enquanto o animal ainda está sob um plano cirúrgico profundo da anestesia, eutanasia o animal de acordo com o protótipo animal IACUC aprovadoOcol. Disseca a língua para processamento posterior (por exemplo, seccionamento ou armazenamento congelado para análises bioquímicas).
Resultados
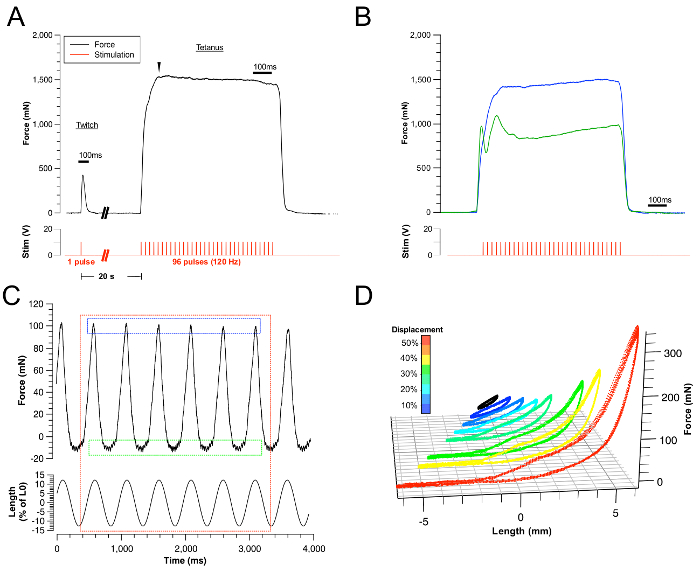
Figura 3: Resultados representativos.
(A) Exemplos de traços de força de tontão e tontânica bem sucedidos. A estimulação correspondente é representada pelo traço vermelho. (B) Exemplo de contracções tetanicas de língua mal sucedidas devido a contração submáxima (traço azul) e estimulação indireta dos músculos do pescoço. Amba...
Discussão
Alterações no metabolismo e / ou composição da língua, por exemplo , infiltração de gordura na língua como conseqüência da obesidade, prevêem alterações quantificáveis dos parâmetros avaliados pelo nosso protocolo. A quantificação da força da língua é de grande interesse uma vez que um desequilíbrio entre a atividade protrusiva e retrusiva ou enfraquecimento geral da língua pode resultar na oclusão da via aérea superior 15 . As técnicas de exercício com o ...
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Esta investigação foi apoiada por dois Institutos Nacionais de Subsídios de Saúde: HL089447 ("Obesidade e OSA: Compreender a Importância da Língua Fat & Metabolic Function") e HL094307 ("Compreensão da Relação entre Obesidade e Língua Fat")
Materiais
| Name | Company | Catalog Number | Comments |
| SurgiSuite (heated Surgical tray) | Kent Scientific | SurgiSuite-LG | Includes heated platform |
| LED Lighting and Magnification Kit | Kent Scientific | SURGI- 5003 | |
| RC2 Rodent Circuit Controller | VetEquip | 922100 | |
| Isoflurane | Butler Schein Animal Health Supply | 29405 | |
| Alcohol Prep | Webcol | 6818 | |
| Cotton-tipped applicators | MediChoice | WOD1002 | |
| Hair clipper | Conair | ||
| Hair remover lotion | Nair | ||
| Medical tape | Transpore | 3M | |
| D-PBS | Corning | 21-030-CM | |
| Operating Scissors | World Precision Instruments | 503717-12 | |
| Hemostatic Forceps | Merit | 97-458 | Any tissue forceps can be used instead |
| Microdissecting Forceps, Angled, Serrated, 10.2 cm, SS | World Precision Instruments | 504479 | |
| Suture Tying Forceps | Fine Science Tools | 18025-10 | |
| Blunt Micro Hook | Fine Science Tools | 10062-12 | |
| Microhemostat | Fine Science Tools | 12075-14 | |
| Thermal cautery | WPI | 501292 | Disposable cauteries are available at lower cost |
| IV 14g x 3.25" cannula | BD | B-D382268H | For tracheal cannulation |
| Braided silk non-absorbable suture size 4-0 | Harvard Apparatus | SP104 | For stabilization of the tracheal cannula |
| Braided non-absorbable silk 5/0 suture | Surgik LC, USA | ESILRC15387550 | For suturing the tongue |
| Plastic-coated metal twist-tie (or electrical wire) | For securing the rat's nose to the platform | ||
| Camera stick | |||
| 3 way-swivel and Trilene 9 Kg test monofilament line | Berkley | For securing the jaw and maintaining the mouth open | |
| Camera stick with adjustable angle | For supporting the 3 way-swivel and maintaining the mouth open. | ||
| in situ Muscle Test System | Aurora Scientific | 809C | This system is designed for mice and was modified by extending the platform. Alternatively the rat-specific 806D system can be used. |
| Dual-Mode Muscle lever (force transducer) | Aurora Scientific | 305C-LR | 309C offers higher excursion capabilities than 305C-LR. Link for more information and specifications: http://aurorascientific.com/products/muscle-physiology/dual-mode-muscle-levers/ |
| Needle Electrodes (surgical steel, 29 gauge) | AD Instruments | MLA1204 | 300C is recommended for use in mice. |
| Magnetic Stands | World Precision Instruments | M10 | Used for making the bipolar stimulating hook electrodes |
| Kite Manual Micromanipulator | World Precision Instruments | KITE-R and KITE-L | Require a steel plate |
| Stackable Double Binding Post with Banana Jack x BNC Jack | McMaster Carr | 6704K13 | |
| Carbon fiber composites digital caliper | VWR | 36934-152 |
Referências
- Sanders, I., Mu, L. A three-dimensional atlas of human tongue muscles. Anat Rec (Hoboken). 296 (7), 1102-1114 (2013).
- Ciucci, M. R., et al. Tongue force and timing deficits in a rat model of Parkinson disease. Behav Brain Res. 222 (2), 315-320 (2011).
- Easterling, C., Antinoja, J., Cashin, S., Barkhaus, P. E. Changes in tongue pressure, pulmonary function, and salivary flow in patients with amyotrophic lateral sclerosis. Dysphagia. 28 (2), 217-225 (2013).
- Wang, Z. J., Huang, X. S. Images in clinical medicine. Myotonia of the tongue. N Engl J Med. 365 (15), e32 (2011).
- Ota, F., Connor, N. P., Konopacki, R. Alterations in contractile properties of tongue muscles in old rats. Ann Otol Rhinol Laryngol. 114 (10), 799-803 (2005).
- Schwarz, E. C., Thompson, J. M., Connor, N. P., Behan, M. The Effects of Aging on Hypoglossal Motoneurons in Rats. Dysphagia. 24 (1), 40 (2008).
- Pae, E. -. K., Wu, J., Nguyen, D., Monti, R., Harper, R. M. Geniohyoid muscle properties and myosin heavy chain composition are altered after short-term intermittent hypoxic exposure. J Appl Physiol. 98 (3), 889-894 (2005).
- Fuller, D. D., Fregosi, R. F. Fatiguing contractions of tongue protrudor and retractor muscles: influence of systemic hypoxia. J Appl Physiol. 88 (6), 2123-2130 (2000).
- Ray, A. D., Farkas, G. A., Pendergast, D. R. In-situ mechanical characteristics of the tongue are not altered in the obese Zucker rat. Sleep. 32 (7), 957 (2009).
- Brennick, M. J., et al. Tongue fat infiltration in obese versus lean Zucker rats. Sleep. 37 (6), 1095-1102 (2014).
- Stedman, H. H., Sweeney, H. L., Shrager, J. B., Maguire, H. C., Panettieri, R. A., Petrof, B., Narusawa, M., Leferovich, J. M., Sladky, J. T., Kelly, A. M. The mdx mouse diaphragm reproduces the degenerative changes of Duchenne muscular dystrophy. Nature. 352 (6335), 536-539 (1991).
- Goodpaster, B. H., Wolf, D. Skeletal muscle lipid accumulation in obesity, insulin resistance, and type 2 diabetes. Pediatr Diabetes. 5 (4), 219-226 (2004).
- Loro, E., et al. IL-15Rα is a determinant of muscle fuel utilization, and its loss protects against obesity. Am J Physiol Regul Integr Comp Physiol. 309 (8), R835-R844 (2015).
- Rahemi, H., Nigam, N., Wakeling, J. M. The effect of intramuscular fat on skeletal muscle mechanics: implications for the elderly and obese. J R Soc Interface. 12 (109), 20150365 (2015).
- Kim, A. M., et al. Tongue fat and its relationship to obstructive sleep apnea. Sleep. 37 (10), 1639-1648 (2014).
- Kim, A. M., et al. Metabolic activity of the tongue in obstructive sleep apnea. A novel application of FDG positron emission tomography imaging. Am J Respir Crit Care Med. 189 (11), 1416-1425 (2014).
- Gilliam, E. E., Goldberg, S. J. Contractile properties of the tongue muscles: effects of hypoglossal nerve and extracellular motoneuron stimulation in rat. J Neurophysiol. 74 (2), 547-555 (1995).
- Sokoloff, A. J. Localization and contractile properties of intrinsic longitudinal motor units of the rat tongue. J Neurophysiol. 84 (2), 827-835 (2000).
- Becker, B. J., Russell, J. A., Connor, N. P. Effects of aging on evoked retrusive tongue actions. Arch Oral Biol. 60 (6), 966-971 (2015).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle Nerve. 47 (2), 230-240 (2013).
- Seo, J., et al. Nerve cuff electrode using embedded magnets and its application to hypoglossal nerve stimulation. J Neural Eng. 13 (6), 066014 (2016).
- Friedman, M., et al. Targeted hypoglossal nerve stimulation for the treatment of obstructive sleep apnea: Six-month results. Laryngoscope. 126 (11), 2618-2623 (2016).
- Heiser, C., Maurer, J. T., Steffen, A. Functional outcome of tongue motions with selective hypoglossal nerve stimulation in patients with obstructive sleep apnea. Sleep Breath. 20 (2), 553-560 (2016).
- Syme, D. A. Passive viscoelastic work of isolated rat, Rattus norvegicus, diaphragm muscle. J Physiol. 424, 301-315 (1990).
- Connor, N. P., et al. Effect of tongue exercise on protrusive force and muscle fiber area in aging rats. J Speech Lang Hear Res. 52 (3), 732-744 (2009).
- Schaser, A. J., Stang, K., Connor, N. P., Behan, M. The effect of age and tongue exercise on BDNF and TrkB in the hypoglossal nucleus of rats. Behav Brain Res. 226 (1), 235-241 (2012).
- Puhan, M. A., et al. Didgeridoo playing as alternative treatment for obstructive sleep apnea syndrome: randomised controlled trial. BMJ. 332 (7536), 266-270 (2006).
- Guimarães, K. C., Drager, L. F., Genta, P. R., Marcondes, B. F., Lorenzi-Filho, G. Effects of oropharyngeal exercises on patients with moderate obstructive sleep apnea syndrome. Am J Respir Crit Care Med. 179 (10), 962-966 (2009).
- Ueda, H., Almeida, F. R., Chen, H., Lowe, A. A. Effect of 2 jaw exercises on occlusal function in patients with obstructive sleep apnea during oral appliance therapy: a randomized controlled trial. Am J Orthod Dentofacial Orthop. 135 (4), 430 (2009).
- Strollo, P. J., et al. Upper-airway stimulation for obstructive sleep apnea. N Engl J Med. 370 (2), 139-149 (2014).
- Perrier, P., Payan, Y., Zandipour, M., Perkell, J. Influences of tongue biomechanics on speech movements during the production of velar stop consonants: A modeling study. J Acoust Soc Am. 114 (3), 1582-1599 (2003).
- Connor, N. P., et al. Tongue muscle plasticity following hypoglossal nerve stimulation in aged rats. Muscle & nerve. 47 (2), 230-240 (2013).
- Brady, J. P., et al. AlphaB-crystallin in lens development and muscle integrity: a gene knockout approach. Invest Ophthalmol Vis Sci. 42 (12), 2924-2934 (2001).
- Spassov, A., et al. Differential expression of myosin heavy chain isoforms in the masticatory muscles of dystrophin-deficient mice. Eur J Orthod. , ciq113 (2010).
- Lever, T. E., et al. Videofluoroscopic Validation of a Translational Murine Model of Presbyphagia. Dysphagia. 30 (3), 328-342 (2015).
- Gantois, I., et al. Ablation of D1 dopamine receptor-expressing cells generates mice with seizures, dystonia, hyperactivity, and impaired oral behavior. Proc Natl Acad Sci. 104 (10), 4182-4187 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados