Method Article
Microscopia episcopática de alta resolução (HREM) - Protocolos simples e robustos para processamento e visualização de materiais orgânicos
Neste Artigo
Resumo
Nós fornecemos protocolos simples e robustos para o processamento de materiais de biópsia de várias espécies, embriões de organismos modelo biomédico e amostras de outros tecidos orgânicos para permitir a geração de dados de volume digital com o método de microscopia episcópica de alta resolução.
Resumo
Nós fornecemos protocolos simples para gerar dados de volume digital com o método de microscopia episcópica de alta resolução (HREM). O HREM é capaz de imaginar materiais orgânicos com volumes até 5 x 5 x 7 mm 3 em resoluções numéricas típicas entre 1 x 1 x 1 e 5 x 5 x 5 μm 3 . Os espécimes são incorporados em resina de metacrilato e seccionados em um microtomo. Após cada seção, uma imagem da superfície do bloco é capturada com uma câmera de vídeo digital que fica no fototubo conectado à cabeça do microscópio composto. O eixo óptico passa através de um cubo de filtro de proteína fluorescente verde (GFP) e está alinhado com uma posição, na qual o braço do suporte da bomba fica em repouso após cada seção. Desta forma, são produzidas uma série de imagens digitais inerentemente alinhadas, que exibem superfícies de bloco subsequentes. Carregar tal série de imagens em software de visualização tridimensional (3D) facilita a conversão imediata para dados de volume digital, o que permite virtual sEm vários planos ortogonais e oblíquos e a criação de modelos computacionais de volume e superfície. Apresentamos três protocolos simples e específicos para o tecido para o processamento de vários grupos de espécimes orgânicos, incluindo embriões de peixes de rato, pintos, codornas e zebras, material de biópsia humana, papel não revestido e material de substituição da pele.
Introdução
A análise estrutural de materiais orgânicos e anorganicos é o primeiro passo para entender suas propriedades e funções físicas. A base para essa análise é, muitas vezes, a informação bidimensional (2D) obtida por observação cuidadosa de seções histológicas, com uma variedade de métodos de imagem simples e sofisticados que extraem detalhes de arquitetura de tecido, morfologia celular e topologia, composição molecular e propriedades biomecânicas 1 , 2 , 3 . No entanto, a informação em 2D não é adequada para pesquisar arranjos espacialmente complexos. Assim, um número crescente de métodos in vivo e ex vivo que permitem a geração de dados de volume digital foram estabelecidos nas últimas décadas 4 e muitos mais estão em desenvolvimento.
O princípio metódico da maioria dos métodos de geração de dados de volume é a geração de pilhas virtuaisDe imagens digitais que exibem seções obtidas por trechos físicos ou virtuais de um objeto. Se as imagens da seção estiverem alinhadas corretamente, isso cria um volume, que pode ser re-seccionado em planos de seção virtual, ou usado para criar modelos 3D de superfície e volume renderizados. As técnicas populares para visualizar seres humanos e espécimes biológicos maiores são a tomografia por ressonância magnética (MRT), tomografia computadorizada (TC), tomografia por emissão de pósitrons (PET) e tomografia computadorizada de emissão de fóton único (SPECT). Os espécimes pequenos são geralmente visualizados usando imagens de ressonância micro-magnética (μMRI), tomografia de projeção óptica (OPT), tomografia de coerência óptica (OCT), tomografia fotoacústica (PAT), métodos baseados em secções histológicas, microscopia confocal e tomografia eletrónica 5 , 6 7 , 8 , 9 , 10 11 , 12 , 13 , 14 , 15 , 16 , 17 .
Uma técnica de geração de dados de volume relativamente nova, que produz dados digitais de pequenos espécimes e amostras de tecido histológico, é o método HREM, que foi desenvolvido em estreita cooperação com Tim Mohun 18 , 19 . É uma técnica baseada em microscópio simples, que gera dados de volume digital de material incorporado em resina que é seccionado em um microtomo. Os dados facilitam a análise detalhada da arquitetura dos tecidos e das distribuições celulares, bem como a análise métrica de pequenos recursos em um nível microscópico microscópico intermediário.
HREM produz pilhas de imagens digitais inerentemente alinhadas que aparecem como se fossem capturadas de eSeções histológicas manchadas com osina. O contraste de tecido e a resolução de dados em relação ao campo de visão excedem os dados produzidos com μCT, μMRI e OPT, mas são inferiores aos alcançáveis com microscopia confocal, de chapa leve e eletrônica 20 . No entanto, em contraste com o último, o HREM é capaz de visualizar espécimes com volumes relativamente grandes de até 5 x 5 x 7 mm 3 em qualidade histológica. Uma série de estudos recentes fornecem caracterizações detalhadas e comparações de vantagens e desvantagens das técnicas de imagem única e, por uma questão de objetividade, nos referimos a informações adicionais sobre suas limitações e campos potenciais de aplicações 4 , 21 , 22 , 23 , 24 .
Este estudo enfoca o método de imagem HREM e visa fornecerProtocolos muito simples para gerar dados HREM de um amplo espectro de materiais orgânicos, bem como exemplos de sua aplicação. O fluxo de trabalho para criar dados HREM é simples e aplica-se a todos os materiais que podem ser incorporados em resina de metacrilato ( Figura 1 ). No entanto, existem diferenças específicas de tecidos na preparação da amostra, que precisam ser consideradas. Fornecemos, portanto, três protocolos padrão para a preparação de várias amostras. As etapas de incorporação e protocolo de geração de dados são idênticas para todos eles.
Protocolo
Todos os procedimentos foram realizados de acordo com diretrizes éticas na Universidade Médica de Viena.
1. Preparação da amostra
- Preparando embriões e tecidos embrionários (até 5 x 5 x 5 mm 3 )
- Corrija os embriões ou partes dos embriões em 4% de PFA / PBS ou fixador de Bouin a 4 ° C durante pelo menos 16 a 24 h sob balanço constante.
NOTA: podem ser utilizados embriões de várias espécies e de vários estádios de desenvolvimento, como peixe-zebra de 48 h, pintainho e codorna de 19 h, e também embriões de rato pré-natal, que foram utilizados aqui (ver resultados representativos ). Os espécimes foram colhidos e transferidos para PBS à temperatura ambiente para estadiamento, antes de serem colocados em fixador. Se necessário, corte os espécimes com micro-tesoura ou bisturis antes da fixação para encaixar nos moldes de encaixe. - Remova o fixador e lave o tecido embrionário em PBS a 4 ° C sob rocha constanteG por 24 h (2-3 mudanças).
- Desidratar as amostras em 70%, 80%, 90%, 96% de etanol a 4 ° C durante 2 a 3 h cada. Coloque tubos contendo as amostras em um rotador.
NOTA: Para pequenas amostras (<2 x 2 x 2 mm 3 ), o tempo que uma amostra repousa em cada etanol pode ser reduzido para 60 min. Para grandes amostras (> 5 x 5 x 5 mm 3 ), pode ser estendido para 4 h. - Execute as seguintes etapas de infiltração sob uma chaminé com luvas de proteção.
- Prepare a solução de infiltração adicionando 1,25 g de peróxido de benzoílo (catalisador plastificado) e 0,4 g de eosina a 100 mL de solução A (para mais detalhes, ver Tabela de Materiais ). Mexa-o num copo numa placa de agitação magnética a 4 ° C até que a eosina e o catalisador estejam completamente dissolvidos (2 a 3 h).
- Coloque as amostras durante 12 a 24 h na solução de infiltração. Mantenha-o a 4 ° C sob balanço contínuo ou rotação. Substitua a solução de infiltração com solução fresca após 3 e 12H.
NOTA: Estenda o tempo de infiltração para 48 h para grandes embriões (> 1 cm de coroa / comprimento de nádega).
- Corrija os embriões ou partes dos embriões em 4% de PFA / PBS ou fixador de Bouin a 4 ° C durante pelo menos 16 a 24 h sob balanço constante.
- Preparando amostras de tecidos adultos (até 5 x 5 x 7 mm 3 )
- Corrigir os tecidos em 2% de PFA / PBS contendo 4% de ácido carbólico a 4 ° C durante pelo menos 3 dias.
NOTA: A amostra de tecido proveniente de pele, fígado, pâncreas, rim, tireóide, coração, músculo estriado, cérebro, nervos e modelos tumorais de vários humanos, roedores, porcos, moscas da fruta e peixes neonatais e adultos podem ser consertados nesta solução E depois processados para imagens HREM (demonstramos a fixação das amostras, ver resultados representativos ). Esqueça as amostras de tecido com bisturis, tesouras ou socos de biópsia e transfira-os diretamente para o fixador. Para fixação de tecido nervoso, 4% de PFA / PBS. - Remova o fixador e lave o tecido sob a água da torneira durante 3-6 h.
- Desidratar as amostras posteriormenteEm 70%, 80%, 90%, 96% de etanol, misturado com 0,4 g de eosina por 100 mL (2 a 3 h cada). Mantenha as soluções com amostras a 4 ° C sob balanço constante ou em um rotador.
NOTA: Para pequenas amostras (<2 x 2 x 2 mm 3 ), o tempo que uma amostra repousa em cada etanol pode ser reduzido para 60 min. Para grandes amostras (> 5 x 5 x 5 mm 3 ), pode ser prolongado para 4-8 h. - Execute todas as seguintes etapas de infiltração sob uma chaminé com luvas de proteção.
- Prepare a solução de infiltração adicionando 1,25 g de peróxido de benzoílo (catalisador plastificado) e 0,4 g de eosina a 100 mL de Solução A (para mais detalhes, ver Tabela de Materiais ). Agitar um copo numa placa de agitação magnética a 4 ° C até a eosina e o catalisador serem totalmente dissolvidos (2 a 3 h).
- Coloque as amostras na solução de infiltração durante 24 a 36 h. Mantenha-o a 4 ° C sob balanço contínuo ou rotação. Substitua a solução de infiltração por solução fresca após 3 e12 h.
NOTA: Para grandes amostras (> 5 x 5 x 5 mm 3 ), estenda o tempo de infiltração até 48 h.
- Corrigir os tecidos em 2% de PFA / PBS contendo 4% de ácido carbólico a 4 ° C durante pelo menos 3 dias.
- Preparando outro material orgânico
NOTA: Corte os substitutos da pele e o papel com o tamanho desejado com uma tesoura comum. Não é necessária nenhuma fixação.- Passo de fixação, lavagem e desidratação.
- Execute todas as seguintes etapas de infiltração sob uma chaminé com luvas de proteção.
- Prepare a solução de infiltração adicionando 1,25 g de peróxido de benzoílo (catalisador plastificado) e 0,4 g de eosina a 100 mL de Solução A (para mais detalhes, ver Tabela de Materiais ). Acrescente uma taça a 4 ° C numa placa de agitação magnética até que a eosina e o catalisador estejam totalmente dissolvidos (2 a 3 h).
- Coloque amostras em solução de infiltração por 3-12 h. Mantenha-o a 4 ° C sob balanço contínuo ou rotação. Substitua a solução de infiltração com solução fresca após 1 e 2 - 4 h.
2. Incorporação
NOTA: Execute todas as etapas sob uma chaminé com luvas de proteção.
- Prepare a solução de infiltração fresca conforme descrito acima (etapa 1.1.4.1). Adicione 4 mL de Solução B (para detalhes, veja Tabela de Materiais ) a 100 mL de solução de infiltração para preparar a solução de incorporação.
NOTA: Se for necessária uma orientação precisa da amostra nos moldes de incorporação e permitir a incorporação de várias amostras em paralelo, diminua a polimerização da solução de reserva colocando o copo em um banho de gelo. - Use moldes para copos (para detalhes, veja Tabela de Materiais ) com moldes com um volume de rotina de 6 x 8 x 5 mm 3 ou 13 x 19 x 5 mm 3 , ou moldes personalizados com volumes de até 8 x 10 x 15 mm 3 ( Figura 2 ).
- Encha os moldes com solução de encaixe e transfira a amostra para o molde usandouma colher. Durante a transferência assegure-se de que a amostra esteja totalmente coberta com solução de encaixe para evitar a captura de ar.
NOTA: Isso pode ser feito a temperatura ambiente, se iniciado imediatamente após a coleta das amostras e a solução de encaixe da geladeira.- Oriente a amostra dentro do molde usando agulhas ou fórceps.
- Assim que a solução de incorporação começar a tornar-se viscosa, coloque um suporte de bloco (veja Tabela de Materiais ) em cima do molde e adicione solução de encaixe através do furo central do suporte do bloco até a base do suporte do bloco ser coberta com 1 - 2 Mm de solução de encaixe.
- Selar a bandeja do copo de moldagem, cobri-la com parafina líquida e aguardar até que ela se endureça. Alternativamente, coloque uma segunda bandeja de copo de moldagem de cabeça para baixo na bandeja do copo de moldagem com amostras e selá-la com fita adesiva para a prova de ar.
- Permita que os blocos terminem a polimerização armazenando as bandejas de copos de moldagem seladas para 1 -2 dias à temperatura ambiente.
- Para o processamento pós-polimerização, coloque as bandejas dos copos de moldagem com os blocos polimerizados em um forno de laboratório padrão e asse em 70 a 80 ° C por um período mínimo de 1 a 2 dias até ficar vermelho escuro. Colete as bandejas do forno e remova os blocos do molde.
NOTA: O cozimento pode ser feito em condições ambientais normais. A bandeja de copos de moldagem de cobertura, que garante a vedação a prova de ar na primeira fase após a incorporação, pode ser removida para permitir a verificação da cor da resina após 10 h. Imediatamente após o cozimento, a resina é macia e os blocos podem ser facilmente removidos da bandeja do copo de moldagem. Dentro de 2 a 3 horas são difíceis e podem ser armazenados à temperatura ambiente por vários meses.
3. Geração de dados
NOTA: O protótipo HREM 18 , 25 usado aqui compreende os seguintes itens: (i) Microtome rotativo com um suporte de blocoQue pára após cada corte em seu ponto de viragem superior. (Ii) Faca de micrótomo padrão não descartavel, metal duro, perfil D (para detalhes, veja Tabela de Materiais ). (Iii) Cabeça de microscópio composto de fluorescência com revólver de objetivo e um cubo de filtro GFP (excitação 470/40; filtro de emissão 525/50) em seu eixo óptico. O eixo óptico é organizado perpendicularmente à superfície recém-cortada de um bloco montado no microtomo e é mantido por um dispositivo que permite movimento ascendente e descendente. (Iv) Mesa cruzada motorizada que transporta o microtome. A tabela pode ser deslocada na direção do eixo óptico e lateralmente. (V) Câmera de vídeo digital anexada ao microscópio composto fluorescente. (Vi) Fonte de luz monocromática (470 nm). (Vii) Computador conectado à câmera, com software de geração de dados (para detalhes, veja Tabela de Materiais ).
- Procedimento
- Indique a região de interesse.
- Use o laboratório padrão liGht source (veja Tabela de Materiais ) para dirigir a luz branca obliquamente para a superfície do bloco.
- Identifique os contornos do material incorporado à medida que ele se projeta na superfície do bloco. Indique a região de interesse e posterior campo de visão na superfície do bloco usando uma caneta ou lâmina de barbear.
NOTA: Esta etapa é obrigatória para definir a extensão do campo de visão antes da seção.
- Defina o campo de visão.
- Monte o bloco de resina com amostra no microtomo.
- Mova o suporte do bloco para sua posição de parada (ponto de rotação superior da excursão do suporte do bloco).
- Inicie a câmera digital e o software de geração de dados, e adquira uma imagem ao vivo.
- Escolha uma lente objetiva, com uma ampliação adequada para cobrir a região de interesse indicada na superfície do bloco.
NOTA: Objetivos com ampliação 2.5X, 5X, 10X, 20X e aberturas numéricas entre 0,07 e 0,40 são comumente usados. - Mova a óptica para cima e para baixo e o micrótomo lateralmente usando a mesa cruzada motorizada até a região de interesse corresponder ao campo de exibição exibido na tela do computador.
- Foco.
- Execute a seção manual passo a passo até que as primeiras estruturas da amostra se tornem visíveis.
- Organize a superfície do bloco no plano de foco da óptica, movendo o microtome na direção do eixo óptico.
- Escolha a espessura da seção; Recomenda-se espessuras de seção de 0,5 a 5 μm.
- Indique a região de interesse.
- Geração e processamento de dados
- Inicie a rotina de software que orquestra a seção e a captura de imagens. Siga as instruções documentadas do software de captura de imagens.
- Pare a rotina do software e coloque um slide de escala na frente da superfície do bloco assim que a amostra estiver completamente seccionada.
- Capture uma imagem de forma interativa para calibração posteriorÇão.
NOTA: Isso deve ser feito sempre que um objetivo é usado em uma configuração recentemente organizada. - Converta a série de imagens para imagens de escala de cinza de 8 bits no formato .jpg.
- Carregue séries de imagens no software de visualização 3D e ajuste os contrastes.
NOTA: A conversão de imagens e a visualização 3D podem ser feitas com vários pacotes de software padrão comercial ou livremente disponíveis, seguindo as instruções do respectivo software.
Resultados
HREM gera séries de imagens digitais inerentemente alinhadas com contrastes semelhantes às imagens de seções histológicas manchadas de hematoxilina / eosina. Ao contrário das imagens de seção 2D, pilhas de imagens HREM permitem a visualização e análise da arquitetura de tecido, morfologia e topologia de uma ampla variedade de materiais orgânicos em 3D. O alto contraste muitas vezes facilita a visualização 3D rápida e simples de modelos computacionais volumosos e descobertas semiautomáticas do contorno para a geração de modelos renderizados de superfície.
O tamanho dos dados HREM varia de acordo com o tamanho do alvo da câmera, o modo de captura de imagem (8, 12, 16 bits, escala de cinza, cor) eo número de imagens de face de bloco único. Conjuntos de dados menores de 1.000 imagens de escala de cinza de 8 bits.jpg de 2.048 pixels x 2.048 pixels têm um tamanho de cerca de 900 MB. Conjuntos de dados maiores de 3.000 imagens de escala de cinza de 8 bits.jpg de 4.096 pIxel x 4,096 pixels tem volumes de aproximadamente 20 GB.
Os protocolos fornecidos são simples e robustos, e durante a última década, eles foram empregados para gerar dados HREM de diferentes espécimes. A seção de protocolo 1.1 foi otimizada para o processamento de embriões inteiros de organismos modelo biomédicos com um comprimento de até 1 cm e amostras de tecido embrionário com uma dimensão de até 5 x 5 x 5 mm 3 ; Usamos esse método para produzir dados HREM de embriões das seguintes espécies: mouse ( Mus musculus) , pintinho ( Gallus gallus ), peixe zebra ( Danio rerio ), codorna ( Coturnix coturnix) , sapo africano com garras ( Xenopus laevis ), cavalo ( Equus ferus caballus ), bug de amido de amendoa ( Oncopeltus fasciatus ), crocodilo ( Crocodylia ) e polvo ( Octopus vulgaris ). Os dados de todas as espécies foram de excelente qualidade ( por exemplo , Figura 3 )
A seção de protocolo 1.2 foi otimizada para o processamento de amostras de tecido juvenil e adulto com dimensões até 5 x 5 x 7 mm 3 e empregada para visualizar amostras de tecido do Pele, fígado, pâncreas, rim, tireóide, coração, músculo estriado, cérebro, nervos e modelos tumorais colhidos de humanos ( Homo sapiens ), camundongos ( Mus musculus ), ratos ( Rattus norvegicus ), porcos ( Sus scrofa domestica ) furão ( Mustela Furo ), mosca da fruta ( Drosophila melanogaster ) e peixe zebra ( Danio rerio ). Enquanto os resultados foram excelentes com a maioria dos espécimes ( por exemplo , Figura 4 , Animação 1 ), as partes muito centrais da pele (com epiderme) e espécimes cerebrais maiores que 3 x 3 x 3 mm 3, muitas vezes permanecem não mantidas devido à penetração insuficiente de eosina através Esses tecidos.
Protocolo sA eção 1.3 foi otimizada para o processamento de material orgânico fibroso e empregada para visualizar a arquitetura de fibra de papel revestido, papel não revestido, material substitutivo dérmico nativo e material substituto dermico semeado de células-tronco. Essas amostras foram fáceis e rápidas de processar. Os dados do papel não revestido e a maioria dos substitutos da pele foram de boa qualidade ( Figura 5 , Animação 2 ). Ocorreram problemas no processamento do papel revestido, quando o material anorganico dificultou a penetração da eosina. Outra questão ocorreu ao processar os substitutos da pele com base em ágar porque eles foram parcialmente digeridos pela solução de infiltração.
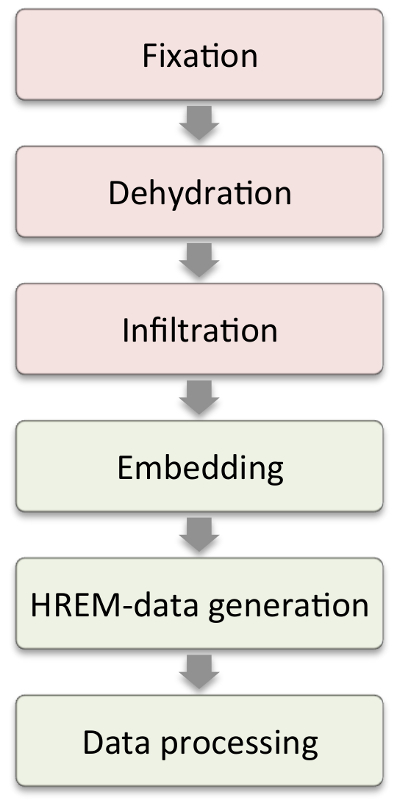
Figura 1: fluxo de trabalho. Os passos mostrados nas caixas vermelhas exigem modificações de acordo com as características da amostra. Passos nas caixas verdes são aqueles queSão semelhantes em todas as amostras. Clique aqui para ver uma versão maior dessa figura.

Figura 2: Moldes personalizados. Os moldes podem ser adaptados cortando um furo no molde original, inserindo a lâmpada de uma pipeta Pasteur e selando-a com material de modelagem. Clique aqui para ver uma versão maior dessa figura.
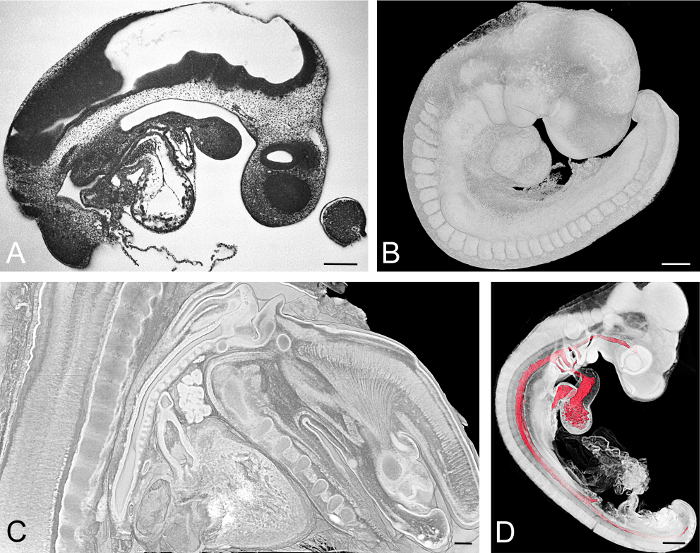
Figura 3: Embriões exemplificativamente visualizados. (A, B) Embrião de rato colhido no dia embrionário, E = 9,5. A imagem da seção HREM é mostrada em (A) . O modelo 3D representado por volume mostrando a superfície é mostrado em (B) . (C) Secção sagital virtual através de um modelo volumétrico do pescoço de um embrião de rato E15.5. (D) Embrião de pintinho no estádio de desenvolvimento Hamburger Hamilton (HH) 18. Modelo de superfície da lumina dos componentes cardiovasculares combinado com renderização de volume de todos os tecidos embrionários. Barras de escala = 200 μm. Clique aqui para ver uma versão maior dessa figura.
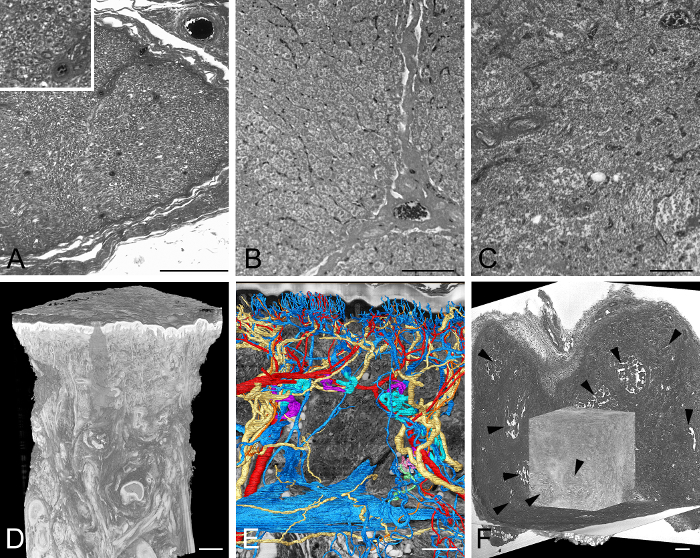
Figura 4: Amostras de tecido adulto exemplificativamente visualizadas. (A) Parte de uma imagem da seção HREM através de um nervo humano. Inlay mostra uma seção da imagem com mais detalhes. (B) Parte de uma imagem da seção HREM através do fígado porcino. Observe o nUclei. (C) Parte de uma imagem da seção HREM de tecido linfático humano. (D, E) Pele grossa de um polegar humano. O modelo 3D em volume da biópsia completa. (D) A superfície produziu modelos de artérias, veias e nervos na frente de uma ressecção virtual através de dados HREM (E) . (F) Tumor experimental em tecido de rato adulto. Modelo voltado para o volume 3D em frente a três seções virtuais através de dados HREM. Observe as partes necróticas (pontas de seta). Barras de escala = 200 μm. Clique aqui para ver uma versão maior dessa figura.

Figura 5: material fibroso exemplificado. (A, B) Imagem da seção HREM de papel marrom não revestido. (B) mostra uma seção de (A) . Observe as fibras e o seu lúmen. (C) seção HREM de papel revestido. Observe que as fibras permanecem impuras. (D) Modelo reduzido de volume de material substituto dérmico nativo. Observe o calibre diferente e a forma das fibras. Barras de escala = 100 μm. Clique aqui para ver uma versão maior dessa figura.
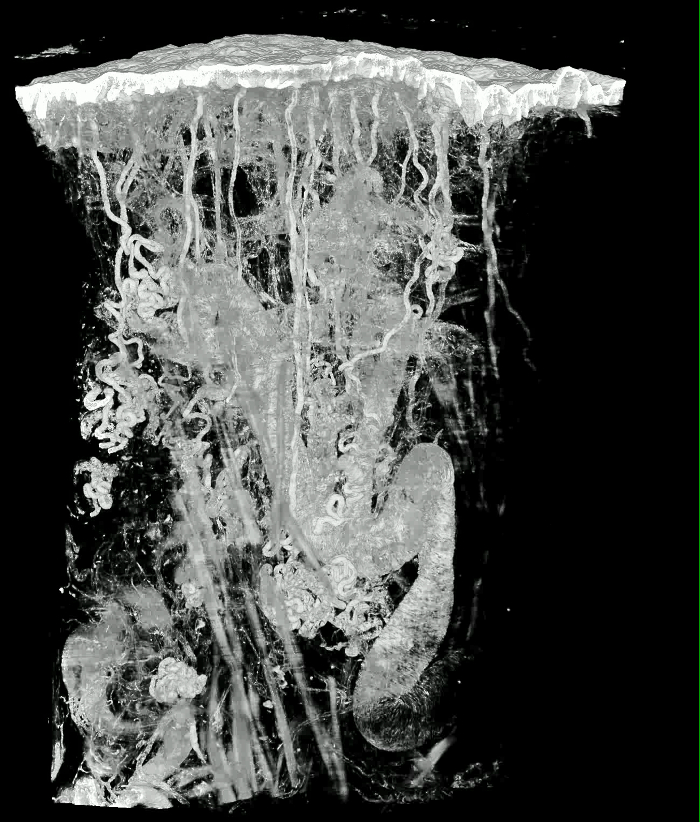
Animação 1: Modelo Renderizado por Volume da Pele Grosso de uma Almofada Humana Humana. O tamanho do bloco de tecido é aproximadamente 4,2 x 2,7 x 2,7 mm 3 . O tamanho do Voxel é 1,07 x 1,07 x 2 μm 3 . Clique aqui para ver este vídeo. (Clique com o botão direito do mouse para baixar.)
Animação 2: Modelo Renderizado de Volume do Material Substituto Dermico nativo. O tamanho da amostra é de aproximadamente 1,2 x 0,85 x 0,4 mm 3 . O tamanho do Voxel é de 0,54 x 0,54 x 2 μm 3 . Clique aqui para ver este vídeo. (Clique com o botão direito do mouse para baixar.)
Discussão
HREM é um método microscópico altamente robusto que é ideal para visualizar um amplo espectro de materiais orgânicos utilizados em biomedicina e indústria 18 , 21 , 26 , 27 , 28 , 29 , 30 , 31 , 32 , 33 , 34 , 35 , 36 , 37. 38 , 39 , 40 . Pode ser empregado como uma modalidade de imagem exclusiva, como atualmente usado pelo programa Mecanismos de Distúrbios do Desenvolvimento (DMDD) 41 , 42 , 43 , 44 , ou como uma parte integrativa de pipelines de imagens multimodais 45 .
Um aparelho de geração de dados HREM totalmente operacional pode ser montado a partir de componentes de laboratório convencionais e compreende um micrótomo motorizado, microscópio, mesa cruzada motorizada e um computador com software apropriado 25 . É fundamental usar um microtomo equipado com um suporte de bloco que pára de forma reprodutiva após cada seção em uma posição definida e cubos de filtro GFP dentro da via óptica. No entanto, soluções integrantes totalmente abrangentes podem ser compradas em empresas como a Indigo Scientific.
HREM enfrenta as mesmas limitações que todas as técnicas histológicas, exceto que nenhum artefato é introduzido durante a seção ou a montagem da seção. No entanto, existem limitações, que resultam da necessidade de manchar amostras antes da seção eDas características do material de incorporação. A penetração de eosina através de todo o espécime é necessária para obter contrastes de tecido suficientes; Material muito denso, tecidos adiposos e substâncias anorganicas efetivamente impedem a penetração de eosina e isso resulta em tecidos não corados no centro dos objetos. O uso de fixadores especiais ajuda a manchar os espécimes da pele, mas ainda não existe um método adequado para superar o problema. Outra limitação é que as resinas que bloqueiam mais de 2 cm tendem a quebrar durante a seção. Isso pode ser parcialmente evitado cortando os espécimes e processando partes separadamente.
O posicionamento correto de pequenas amostras ou amostras com superfícies irregulares nos moldes durante a incorporação é muitas vezes problemático. Cobrindo as amostras com agarose e processando os blocos de agarose, conforme descrito no protocolo, geralmente resolve essa questão 19 . Uma abordagem alternativa, que também ajuda a bloquear os blocos durante o sectioLigando, é remover o bloco já endurecido de seu suporte e incorporá-lo de novo, seguindo o procedimento de encadernação descrito.
Um conjunto de dados HREM típico compreende 500 a 3.000 imagens individuais. Sua resolução numérica é determinada pela distância entre as imagens sucessivas ( ou seja , por espessura de seção), a característica do alvo da câmera e as propriedades da óptica utilizada. Utilizamos espessuras de seção entre 1 μm e 5 μm e conseguimos bons resultados, embora os protocolos apresentados não elimine completamente o brilho dos artefatos 20 , 46 . Esses artefatos são causados por tecidos intensamente corados localizados profundamente dentro do bloco, resultando em desfocagem de informações de tecido sobre as superfícies do bloco.
As câmeras tinham dimensões alvo de 2,560 x 1,920 pixels 2 , 2,048 x 2,048 pixels 2 e 4,096 x 4,096 pixels 2 e eram combiNed com lentes objetivas de 1.25X, 2.5X, 5X, 10X e 20X. Isso resultou em tamanhos de pixels numéricos entre 0,18 x 0,18 μm 2 e 5,92 x 5,92 μm 2 , o que se mostrou suficiente para a análise em 3D da arquitetura de tecido e formas de células, e mesmo para visualização de núcleos. Dada a alta resolução numérica, outras organelas celulares também devem ser visíveis. Os contrastes insuficientes devido à coloração simples de eosina e as propriedades ópticas dos objetivos reduzem dramaticamente a possibilidade de discriminar estruturas. A máxima resolução espacial máxima dos dados HREM, que leva em consideração a abertura numérica, é de aproximadamente 1 x 1 x 1 μm 3 e, portanto, só permite a discriminação efetiva de estruturas maiores do que aproximadamente 3 x 3 x 3 μm 3 .
Um problema comum para todas as técnicas de imagem digital é a compensação entre o tamanho do campo de visão, que define a parte do espécime que pode ser exibidaD no alvo da câmera e a resolução numérica da imagem. Quanto maior o campo de visão, menor a resolução numérica máxima máxima 46 . A configuração HREM usada aqui permite a geração de dados HREM com um campo de visão entre 0,74 x 0,74 mm 2 (objetivo 20X) exibido em uma resolução numérica de 0,18 x 0,18 μm 2 e 12,12 x 12,12 mm 2 (objetivo de 1,25X) exibido em Uma resolução numérica de 2,96 x 2,96 μm 2 . As configurações alternativas e comercializadas podem fornecer campos maiores de visualizações, mas ao custo da resolução verdadeira. No entanto, eles fornecem excelentes resultados, como é óbvio a partir dos dados exibidos na página inicial do programa DMDD 47 .
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
Os autores agradecem Tim Mohun por suas contribuições invalubale no desenvolvimento de HREM e Petra Heffeter para fornecer amostras.
Materiais
| Name | Company | Catalog Number | Comments |
| JB-4 Plus Embedding Kit | Polysciences Europe GmbH | 18570-1 | includes Benzoyl Peroxide, Plasticized (Catalyst) and Solution A+B |
| Polyethylene Molding Cup Trays, 6 x 8 x 5 mm hexagon (9 cavities) | Polysciences Europe GmbH | 17177A-3 | |
| Polyethylene Molding Cup Trays, 13 x 19 x 5 mm (9 cavities) | Polysciences Europe GmbH | 17177C-3 | |
| JB-4 Plastic Block Holders | Polysciences Europe GmbH | 15899-50 | |
| Eosin | Waldeck GmbH & Co. KG, Division Chroma | 1A-196 | |
| Microtec CUT 4060E | rotary microtome | ||
| Leica DM LM, fluorescence compound microscope | Leica Mikrosysteme Handelges.m.b.H | ||
| GFP filter set | Leica Mikrosysteme Handelges.m.b.H | 11090937180000 | |
| Motorised cross table | Walter Uhl, technische Mikroskopie GmbH & CO. KG | KT5-LSMA | |
| Digital video camera SPOT-FLEX | Visitron Systems GmbH. | ||
| precisExcite High-Power LED | Visitron Systems GmbH. | light source | |
| VisiView 2.1.4 | Visitron Systems GmbH. | Image capturing software | |
| Hard metal knife (tungsten carbide), profile D | Leica Mikrosysteme Handelges.m.b.H | ||
| KL 2500 LCD | Schott AG | light source |
Referências
- Murray, K. K., Seneviratne, C. A., Ghorai, S. High resolution laser mass spectrometry bioimaging. Methods. 104, 118-126 (2016).
- Holzlechner, M., et al. In Situ Characterization of Tissue-Resident Immune Cells by MALDI Mass Spectrometry Imaging. J Proteome Res. 16 (1), 65-76 (2017).
- Elsayad, K., et al. Spectrally coded optical nanosectioning (SpecON) with biocompatible metal-dielectric-coated substrates. Proc Natl Acad Sci U S A. 110 (50), 20069-20074 (2013).
- Norris, F. C., et al. A coming of age: advanced imaging technologies for characterising the developing mouse. Trends Genet. 29 (12), 700-711 (2013).
- Schneider, J. E., et al. High-resolution imaging of normal anatomy, and neural and adrenal malformations in mouse embryos using magnetic resonance microscopy. J Anat. 202 (2), 239-247 (2003).
- Sharpe, J. Optical projection tomography as a new tool for studying embryo anatomy. J Anat. 202 (2), 175-181 (2003).
- Metscher, B. D. MicroCT for developmental biology: A versatile tool for high-contrast 3D imaging at histological resolutions. Dev Dyn. 238 (3), 632-640 (2009).
- Syed, S. H., Larin, K. V., Dickinson, M. E., Larina, I. V. Optical coherence tomography for high-resolution imaging of mouse development in utero. J Biomed Opt. 16 (4), 046004 (2011).
- Zhang, E. Z., et al. Multimodal photoacoustic and optical coherence tomography scanner using an all optical detection scheme for 3D morphological skin imaging. Biomed Opt Express. 2 (8), 2202-2215 (2011).
- Singh, M., et al. Applicability, usability, and limitations of murine embryonic imaging with optical coherence tomography and optical projection tomography. Biomed Opt Express. 7 (6), 2295-2310 (2016).
- Weninger, W. J., Meng, S., Streicher, J., Müller, G. B. A new episcopic method for rapid 3-D reconstruction: applications in anatomy and embryology. Anat Embryol (Berl). 197 (5), 341-348 (1998).
- Weninger, W. J., Mohun, T. Phenotyping transgenic embryos: a rapid 3-D screening method based on episcopic fluorescence image capturing. Nat Genet. 30 (1), 59-65 (2002).
- Khairy, K., Keller, P. J. Reconstructing embryonic development. Genesis. 49 (7), 488-513 (2011).
- Medalia, O., et al. Macromolecular architecture in eukaryotic cells visualized by cryoelectron tomography. Science. 298 (5596), 1209-1213 (2002).
- Berrios-Otero, C. A., Wadghiri, Y. Z., Nieman, B. J., Joyner, A. L., Turnbull, D. H. Three-dimensional micro-MRI analysis of cerebral artery development in mouse embryos. Magn Reson Med. 62 (6), 1431-1439 (2009).
- Liu, M., et al. Dual modality optical coherence and whole-body photoacoustic tomography imaging of chick embryos in multiple development stages. Biomed Opt Express. 5 (9), 3150-3159 (2014).
- Mohun, T. J., Leong, L. M., Weninger, W. J., Sparrow, D. B. The morphology of heart development in Xenopus laevis. Dev Biol. 218 (1), 74-88 (2000).
- Weninger, W. J., et al. High-resolution episcopic microscopy: a rapid technique for high detailed 3D analysis of gene activity in the context of tissue architecture and morphology. Anat Embryol. 211 (3), 213-221 (2006).
- Mohun, T. J., Weninger, W. J. Embedding Embryos for High-Resolution Episcopic Microscopy (HREM). Cold Spring Harb Protoc. 2012 (6), 678-680 (2012).
- Geyer, S. H., Mohun, T. J., Weninger, W. J. Visualizing vertebrate embryos with episcopic 3D imaging techniques. ScientificWorldJournal. 9, 1423-1437 (2009).
- Bruneel, B., et al. Imaging the zebrafish dentition: from traditional approaches to emerging technologies. Zebrafish. 12 (1), 1-10 (2015).
- Adams, D., et al. Bloomsbury report on mouse embryo phenotyping: recommendations from the IMPC workshop on embryonic lethal screening. Dis Model Mech. 6 (3), 571-579 (2013).
- Heddleston, J. M., Chew, T. L. Light sheet microscopes: Novel imaging toolbox for visualizing life's processes. Int J Biochem Cell Biol. 80, 119-123 (2016).
- Powell, K. A., Wilson, D. 3-dimensional imaging modalities for phenotyping genetically engineered mice. Vet Pathol. 49 (1), 106-115 (2012).
- Geyer, S. H., Mohun, T. J., Kamolz, L. P., Weninger, W. J. High resolution episcopic microscopy - current applications. Current Biotechnology. 1 (4), 281-286 (2012).
- Weninger, W. J., Maurer, B., Zendron, B., Dorfmeister, K., Geyer, S. H. Measurements of the diameters of the great arteries and semi-lunar valves of chick and mouse embryos. J Microsc. 234 (2), 173-190 (2009).
- Geyer, S. H., Maurer, B., Dirnbacher, K., Weninger, W. J. Dimensions of the great intrathoracic arteries of early mouse fetuses of the C57BL/6J strain. The Open Anatomy Journal. 4 (1), 1-6 (2012).
- Geyer, S. H., Maurer, B., Pötz, L., Singh, J., Weninger, W. J. High-Resolution Episcopic Microscopy Data-Based Measurements of the Arteries of Mouse Embryos: Evaluation of Significance and Reproducibility under Routine Conditions. Cells Tissues Organs. 195 (6), 524-534 (2012).
- Geyer, S. H., Weninger, W. J. Some Mice Feature 5th Pharyngeal Arch Arteries and Double-Lumen Aortic Arch Malformations. Cells Tissues Organs. 196 (1), 90-98 (2012).
- Kee, H. J., et al. Ret finger protein inhibits muscle differentiation by modulating serum response factor and enhancer of polycomb1. Cell Death Differ. 19 (1), 121-131 (2012).
- Geyer, S. H., Nohammer, M. M., Tinhofer, I. E., Weninger, W. J. The dermal arteries of the human thumb pad. J Anat. 223 (6), 603-609 (2013).
- Geyer, S. H., Weninger, W. J. Metric characterization of the aortic arch of early mouse fetuses and of a fetus featuring a double lumen aortic arch malformation. Ann Anat. 195 (2), 175-182 (2013).
- Maurer, B., Geyer, S. H., Weninger, W. J. A Chick Embryo With a yet Unclassified Type of Cephalothoracopagus Malformation and a Hypothesis for Explaining its Genesis. Anat Histol Embryol. 42 (3), 191-200 (2013).
- Geyer, S. H., et al. High-Resolution Episcopic Microscopy (HREM): A Tool for Visualizing Skin Biopsies. Microsc Microanal. 20 (5), 1356-1364 (2014).
- Weninger, W. J., et al. Phenotyping structural abnormalities in mouse embryos using high-resolution episcopic microscopy. Dis Model Mech. 7 (10), 1143-1152 (2014).
- Geyer, S. H., et al. High-resolution episcopic microscopy (HREM): A useful technique for research in wound care. Ann Anat. 197, 3-10 (2015).
- Captur, G., et al. Morphogenesis of myocardial trabeculae in the mouse embryo. J Anat. 229 (2), 314-325 (2016).
- Wong, R., Geyer, S., Weninger, W., Guimberteau, J. C., Wong, J. K. The dynamic anatomy and patterning of skin. Exp Dermatol. 25 (2), 92-98 (2016).
- Jenner, F., et al. The embryogenesis of the equine femorotibial joint: The equine interzone. Equine Vet J. 47 (5), 620-622 (2015).
- Wiedner, M., et al. Simultaneous dermal matrix and autologous split-thickness skin graft transplantation in a porcine wound model: a three-dimensional histological analysis of revascularization. Wound Repair Regen. 22 (6), 749-754 (2014).
- Mohun, T., et al. Deciphering the Mechanisms of Developmental Disorders (DMDD): a new programme for phenotyping embryonic lethal mice. Dis Model Mech. 6 (3), 562-566 (2013).
- Wilson, R., et al. Highly variable penetrance of abnormal phenotypes in embryonic lethal knockout mice. Wellcome Open Res. 1, 1 (2016).
- Wilson, R., McGuire, C., Mohun, T. Deciphering the mechanisms of developmental disorders: phenotype analysis of embryos from mutant mouse lines. Nucleic Acids Res. 44 (D1), D855-D861 (2016).
- Dickinson, M. E., et al. High-throughput discovery of novel developmental phenotypes. Nature. 537 (7621), 508-514 (2016).
- Pieles, G., et al. microMRI-HREM pipeline for high-throughput, high-resolution phenotyping of murine embryos. J Anat. 211 (1), 132-137 (2007).
- Weninger, W. J., Geyer, S. H. Episcopic 3D Imaging Methods: Tools for Researching Gene Function. Curr Genomics. 9, 282-289 (2008).
- . Deciphering the Mechanisms of Developmental Disorders: DMDD Available from: https://dmdd.org.uk/ (2017)
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados