É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Extração de amostra e quantificação cromatográfica simultânea de doxorrubicina e mitomicina C após entrega de combinação de drogas em nanopartículas para ratos de Tumor-rolamento
Neste Artigo
Resumo
Este protocolo descreve um processo analítico eficiente e conveniente de extração de amostra e determinação simultânea de múltiplas drogas, doxorrubicina (DOX), mitomicina C (MMC) e um metabólito tóxico cardio DOX, doxorubicinol (DOXol), no biológico amostras de um modelo de tumor de mama pré-clínico tratadocom com formulações de nanopartículas de combinação sinérgica de drogas.
Resumo
Quimioterapia de combinação é frequentemente usada na clínica para tratamento de câncer; no entanto, os efeitos adversos associados ao tecido normal podem limitar seu benefício terapêutico. Combinação de drogas baseados em nanopartículas foi mostrada para atenuar os problemas encontrados pela terapia de combinação livre de drogas. Nossos estudos anteriores têm demonstrado que a combinação de duas drogas anticâncer, doxorrubicina (DOX) e mitomicina C (MMC), produziu um efeito sinérgico contra ambos murino e células de câncer de mama humano em vitro. Nanopartículas de híbrido de polímero carregado co-lipídico DOX e MMC (DMPLN) através de várias bombas de transportador de efluxo que conferem multirresistência e demonstrada eficácia reforçada em modelos de tumor de mama. Em comparação com formas de solução convencional, tal eficácia superior de DMPLN foi atribuída à farmacocinética sincronizada de DOX e MMC e biodisponibilidade de aumento intracelular de drogas dentro de células de tumor habilitado pelo nanocarreador PLN.
Para avaliar a farmacocinética e bio-distribuição de co administrado DOX e MMC em solução livre e formas de nanopartículas, um método de análise de múltiplas drogas simples e eficiente usando reverso-fase de alto desempenho foi de cromatografia líquida (HPLC) desenvolvido. Em contraste com os métodos anteriormente relatados que analisaram DOX ou MMC individualmente no plasma, esse novo método HPLC é capaz de dosar simultaneamente DOX, MMC e um metabolito principal de DOX cardio-tóxico, doxorubicinol (DOXol), em diferentes matrizes biológicas ( por exemplo, sangue total, tumor de mama e coração). Uma dupla sonda fluorescente e ultravioleta de absorvente 4-methylumbelliferone (4-MU) foi usado como um padrão interno (I.S.) para a deteção de uma etapa de análise de drogas múltiplas com comprimentos de onda diferentes da deteção. Este método foi aplicado com sucesso para determinar as concentrações de DOX e MMC entregado por abordagens tanto nanopartículas e solução no sangue e vários tecidos em modelo murino de tumor de mama um ortotópico. O método analítico apresentado é uma ferramenta útil para a análise pré-clínico de entrega baseados em nanopartículas de combinações de drogas.
Introdução
A quimioterapia é uma modalidade de tratamento primário para muitos tipos de câncer ainda é frequentemente associado com efeitos adversos graves e eficácia limitada devido a resistência às drogas e outros fatores1,2,3. Regimes de combinação de drogas para melhorar o resultado da quimioterapia, foram aplicados na clínica com base em considerações como toxicidades não-sobreposição, diferentes mecanismos de ação de drogas e drogas não-cruz resistência4,5 , 6. em ensaios clínicos, uma melhor taxa de resposta do tumor foi muitas vezes observada usando simultaneamente administrados combinações de drogas, em comparação com um regime de drogas sequencial entrega7,8. No entanto, devido à sub-ótimo bio-distribuição de formulários de droga livre, injeção simultânea de múltiplas drogas pode causar toxicidade proeminentes tecido normal que supera o efeito terapêutico9,10,11. Entrega de drogas baseadas em nanocarreador foi mostrada para alterar a farmacocinética e bio-distribuição de medicamentos encapsulados, aumentando a acumulação de tumor-alvo12,13,14. Como comentado em nossos artigos recentes, nanopartículas co carregadas com combinações sinérgicas de drogas têm demonstrado a capacidade de atenuar os problemas enfrentados por combinações de drogas livre, devido a sua controlada entrega co temporal e espacial de várias drogas ao tecido do tumor, permitir efeitos sinérgicos droga contra o câncer células4,15,16. Como resultado, superior eficácia terapêutica e baixa toxicidade foram demonstradas em ambos os estudos pré-clínicos e clínicos4,17,18.
Nossos anterior em vitro estudos encontraram que a combinação de duas drogas anticâncer, doxorrubicina (DOX) e mitomicina C (MMC), produziu um efeito sinérgico contra várias linhas de células de câncer de mama e, além disso, co carregando DOX e MMC dentro nanopartículas de lipídios-polímero híbrido (DMPLN) superaram vários resistente a múltiplas drogas associado efluxo bombas (por exemplo, P-glicoproteína e proteína resistente ao cancro da mama)19,20,21. In vivo, DMPLN habilitado entrega co espaço-temporal de DOX e MMC para localizações tumorais e maior biodisponibilidade de drogas dentro de células de câncer, conforme indicado pela moderação da formação do metabólito DOX doxorubicinol (DOXol)22. Como resultado, o DMPLN reforçada a apoptose de células do tumor, inibição de crescimento do tumor e sobrevivência de acolhimento prolongado em comparação a livre combinação de DOX e MMC ou um lipossomal DOX formulação22,23,24, 25.
Analisando a quantidade real de drogas fornecido em parceria pela nanocarreador é fundamental para a concepção de formulações de nanopartículas eficaz. Muitos métodos foram desenvolvidos para analisar o nível plasmático de único doses DOX ou MMC usando alta cromatografia líquida (HPLC) sozinha ou em combinação com a espectrometria de massa (MS)26,,27,28 , 29 , 30 , 31 , 32 , 33 , 34. no entanto, estes métodos são muitas vezes demorado e impraticável para a terapia de combinação como um grande número de amostras biológicas precisa ser preparados separadamente para análise de múltiplas drogas (às vezes incluindo metabolitos de drogas). Além da ligação às proteínas plasmáticas forte de DOX e MMC, glóbulos vermelhos também têm uma grande capacidade de vincular e concentrar muitas drogas anticâncer35,36. Assim, a análise de plasma para DOX ou MMC pode ofuscar concentrações de droga de sangue real. O presente trabalho (Figura 1) descreve uma maneira simples e robusto método de análise de drogas múltiplas usando fase reversa HPLC para extrair simultaneamente e dosar DOX, MMC e o DOX metabólito doxorubicinol (DOXol) de sangue total e diversos tecidos ( por exemplo, tumores). Foi aplicado com sucesso para determinar a farmacocinética e bio-distribuição de DOX e MMC, bem como a formação de DOXol após a entrega da droga através de soluções livres ou formas de nanopartículas (i.e., DMPLN e DOX lipossomal) em um orthotopically implantou o modelo de rato da mama-tumor murino após a intravenosa (i.v.) injeção22.
Protocolo
todos os experimentos com animais foram aprovados pelo Animal conta Comissão de University Health Network no Ontario Cancer Institute e conduzidos de acordo com o Conselho canadense sobre as orientações de cuidado Animal.
1. preparação da amostra biológica
- coletar o sangue total, os principais órgãos e tumor de mama nos pontos de tempo predeterminados após administração intravenosa (IV) de contendo fármaco formulações (por exemplo, DMPLN, DOX lipossomal)
- injetar um peito tumor-rolamento do mouse IV com uma formulação contendo fármaco preparada.
- Anestesiar o mouse nos pontos tempo designados (por exemplo, 15 min), dando inalável isoflurano de 2% em uma câmara selada.
- Colocar o mouse anestesiado em suas costas e colocar seu nariz através de um inalador nasal que constantemente fornece 2% isoflurano.
Nota: Para garantir que o mouse passa por anestesia profunda, suavemente belisca os membros dianteiros do mouse e procure qualquer movimento contrair. - Limpe muito bem os peito e abdome regiões usando etanol a 70% e, em seguida, executar um procedimento terminal da punção cardíaca os ratos anestesiados profundos, usando uma seringa heparinizada 1 mL e uma agulha 23G. Heparina
- coletar o sangue total em um rotulado de sódio pulverizado tubo plástico e agite suavemente o tubo para garantir coletado sangue entra em contato com a heparina revestida da parede do tubo. Recolha um mínimo de 50 µ l de sangue total. Mantenha sempre as amostras no gelo
- Fita todos os quatro membros do rato para fixá-lo e abrir a cavidade abdominal e torácica do mouse usando um par de tesouras e pinças. Deslocar o intestino para o lado e empurre o fígado para cima para expor suficientemente a veia porta. Cortar a veia porta para a drenagem de sangue.
- Perfundir o corpo todo rato com 50 mL de soro fisiológico 0,9% gelado através do coração utilizando uma seringa de 10 mL com uma agulha de 25 G.
Nota: Dobrar a agulha a 90° para guiar a seringa na veia portal. - Órgãos de impostos especiais de consumo no seguinte ordem: coração, pulmão, fígado, baço, rins. Em seguida, separe o tumor de mama os tecidos conectivos circundantes, usando um par de tesouras de incisão para a almofada de gordura mamária direita do mouse. Coletar todos os órgãos individualmente em tubos de polipropileno de 1,5 mL e rapidamente congelá-los em azoto líquido.
Nota: separar a vesícula do fígado. - Armazenar o sangue de toda a 4 ° C e tecidos extirpados em congelador a-80 ° C até posterior análise HPLC.
- Extrair DOX, MMC e DOXol de matrizes biológicas.
- Pesar todos os tecidos dissecados congelados rapidamente e transferi-los para um tubo cônico de fundo arredondado de 13 mL. Para evitar o metabolismo das drogas possível ou degradação, manter as amostras no gelo
- Adicionar 15 mL de tampão de lise celular gelada no tubo.
Nota: O volume de reserva para usar depende do peso de tecido com base na relação tecido-tampão de 1 g: 5 mL (p/v); para pequenos órgãos, tais como o coração e o baço, a proporção é de 1 g: 2 mL. - Usar um movimento cima-baixo curso para homogeneizar as amostras no gelo à velocidade de 18.000 rpm usando um homogeneizador de mão elétrico.
Nota: Homogeneização completa requer cerca de 3 a 5 iterações de um processo de homogeneização curta de menos de 15 s, seguido de resfriamento com gelo entre cada curta homogeneização de tecidos. - Lavar a sonda de gerador dente de serra 10 mm do homogenizador com água destilada deionizada (DDI) H 2 O etanol a 70% e em seguida DDI H 2 O entre cada amostra de tecido para evitar a contaminação cruzada.
- Transferir 50 µ l de homogeneizado de tecido ou sangue total em um tubo de centrífuga micro polipropileno 1,5 mL e spike com 5 µ l de uma interna padrão (I.S.) 4-methylumbelliferone (4-MU) (2000 ng/mL) no tubo.
Nota: solução de 4-MU foi preparada em metanol aqui. - Adicionar 250 µ l de um solvente de extração gelada no tubo contendo sangue ou tecido homogeneizado.
Nota: O solvente de extração consiste em 60% acetonitrila (ACN) e acetato de amônio 40% (5 mM) com pH ajustado para pH = 3.5 usando 0,05% de ácido fórmico. Use uma amostra de (v/v) de 1:5: solvente de extração para relação volume. - Vigorosamente a mistura por 2 min, centrifugar 3.000 x g força no 4 o C por 10 min e pipetar 200 µ l sobrenadante para outro tubo de microcentrífuga fresco pre-refrigerado de vórtice.
- Sobrenadante de evaporar a 60 ° C, sob uma corrente lenta de gás nitrogênio com proteção contra luz.
- Reconstituir o resíduo seco com 100 µ l de metanol gelado, vórtice vigorosamente por 30 s e centrifugar a 3000 x g a 4 ° C, mais 5 min.
- Transferir o sobrenadante para uma inserção do frasco HPLC e colocar os frascos de amostra em uma bandeja de mostruário para injeção.
2. HPLC Instrumentação e parâmetros de operação
- preparar HPLC fase móvel com reprodutibilidade consistente
- medir de HPLC-classe H 2 O usando um cilindro graduado de 500 mL.
- Medir 500 mL de acetonitrila grau CLAE (ACN) usando um cilindro graduado separado.
- , Cuidadosamente, adicionar 0,5 mL de ácido trifluoroacético (TFA) (cuidado) em cada um dos 500 mL de H 2 O e ACN para obter a fase móvel de H 2 O e ACN contendo 0,1% TFA, respectivamente.
Nota: O TFA é corrosivo e tóxico e deve ser tratado sob uma coifa de laboratório. Todas as misturas de solventes são preparadas à temperatura ambiente. - Filtro fases móveis através de um filtro de membrana de nylon com um 0,45 µm reduz o tamanho dos poros e transferi-lo para limpas garrafas de reservatório HPLC.
- Instrumentação de HPLC de set-up para a deteção simultânea de DOX, MMC e DOXol e I.S. 4-MU.
- Ligue a bomba de gradiente, de gasser, auto-sampler, detetor de fotodiodo matriz e multi detector de fluorescência λ.
- Entrada as condições iniciais da composição da fase móvel para 16,5% H 2 O (0,1% TFA) e 83,5% ACN (0,1% TFA) (v/v).
- Definir o detector UV em dois canais, um em 310 nm para 4-MU (I.S.) e o outro a 360 nm para MMC.
- Definir o detector de fluorescência em dois canais, um de cada λ ex / λ em = 365/445 nm para 4-MU e o outro no λ ex / λ em = 480 nm/560 nm para DOX e DOXol, respectivamente.
- Definir uma taxa de fluxo de isocrática de 1,0 mL/min.
- Equilibrar uma coluna de 18 fase reversa pré-instalado C (4,6 mm x 250 mm, 5 µm) em temperatura ambiente por 10 min. para o estabelecimento da linha de base.
- Separar drogas (DOX, MMC, DOXol e 4-MU) usando condição gradiente de fase móvel.
- Injetar 15 µ l de amostras re-concentradas e extraídas usando o auto-sampler.
- Gradualmente mudar a condição inicial da fase móvel (consulte a etapa protocolo 2.2.2) para 100% ACN (0,1% TFA) mais 18 min usando a bomba gradiente automatizada.
Nota: Durante o processo de separação, quatro canais (dois absorventes UV e duas fluorescentes) aparecem simultaneamente com cada canal exibindo um medicamento composto (consulte a etapa de protocolo 2.2.3 e 2.2.4). - Manter 100% de ACN (0,1% TFA) por 1 min e em seguida, retornar à condição inicial fase móvel dentro de 1 min.
- Re-condicionar a coluna com a fase móvel inicial com caudal de 1,5 mL/min durante 4 min para a próxima injeção de amostra.
3. Validação de HPLC
- preparar normas de trabalho de DOX, MMC e DOXol e 4-MU (I.S.).
- Pesar separadamente 1 mg de pó de drogas DOX e MMC (cuidado) e 4-MU em uma nova pesagem pequeno papel (3 x 3 polegadas 2).
Observe que todas as drogas anticâncer são consideradas um perigo para a saúde que pode causar mutagenicidade de toxicidade e células germinativas aguda na inalação ou ingestão. Devem ser manuseadas com cuidado com luvas e máscaras. - Transferir o pesado DOX, MMC e 4-MU em Nova individual 1,5 mL polipropileno microtubo de centrífuga.
- Adicionar 1 mL de metanfetaminaadilia e vórtice brevemente para obter a concentração de 1 mg/mL de DOX e MMC.
- Adicionar 1 mL de metanol em um frasco contendo pré-pesados 1 mg de DOXol (cuidado) e vórtice brevemente para obter a concentração de 1 mg/mL de DOXol.
Nota: DOXol é um metabólito tóxico cardio e deve ser manuseado com cuidado. - Pipeta 20 µ l de soluções estoque preparadas de DOX, MMC, DOXol e 4-MU em um novo separar o tubo de microcentrífuga polipropileno de 1,5 mL e adicionar 980 µ l de metanol para obter um padrão de trabalho de 20 µ g/mL de cada medicamento.
- Diluir 20 µ g/mL de DOX, MMC e DOXol usando metanol para obter as normas de trabalho de 50 ng - 20 µ g /mL para DOX, MMC e DOXol e 2000 ng/mL para I.S. 4-MU.
- Fechar a tampa do tubo de soluções de trabalho com um estreito pedaço de película coberta de parafina para evitar a evaporação do metanol, enrole o tubo inteiro com papel de alumínio para evitar a exposição à luz direta e loja em -20 ° C.
- Pesar separadamente 1 mg de pó de drogas DOX e MMC (cuidado) e 4-MU em uma nova pesagem pequeno papel (3 x 3 polegadas 2).
- Determinar a linearidade, precisão e exatidão de DOX, MMC e DOXol em matrizes biológicas (ou seja, o sangue total e tumor homogenate).
- Simultaneamente espigão 5 µ l de normas de trabalho de DOX e DOXol (50 ng/mL - 20 µ g/mL), MMC (1.000 ng/mL - 16 µ g/mL) e 4-MU (2 µ g/mL) em 50 µ l de sangue em branco ou tecido homogeneizado em polipropileno tubos de centrífuga de micro obter a curva padrão de concentração que variam de 5-2000 ng/mL para compostos de drogas e 200 ng/mL para o 4-MU (I.S.).
- Realizar o ensaio de extração de drogas descrito no protocolo 1.2.
- Usar concentrações baixas, média e altas de DOX e DOXol (50, 500 e 2.000 ng/mL) e MMC (100, 1000, 2.000 ng/mL) para precisão intra e inter dia.
Nota: Preparar concentrações padrão frescas no dia da análise.
- Análise de amostras
- injetar 15 µ l de amostra usando o auto-sampler.
- Gradualmente mudar a fase móvel mais de 0 a 18 min, aumentando a composição do Grupo ACN no intervalo.
- Depois de 18 min, segure a condição de fase móvel de 1 min.
- Retornar à condição inicial sobre a próxima 2 min e, em seguida, re-equilibrar para 4 min antes da próxima injeção.
- Após cada amostra executar, note que os picos de compostos de drogas com o seu tempo de retenção são mostrados como segue: MMC, DOXol, 4-MU (I.S.) e DOX.
- Integrar a área do pico sob a curva (AUC) de compostos de drogas usando HPLC software.
- Calcular a relação AUC entre compostos individuais sobre drogas e I.S. (equação 1) e use as curvas padrão elaboradas sob os mesmos procedimentos de extração para determinar as concentrações de droga de DOX, MMC e DOXol na formulação de DMPLN.
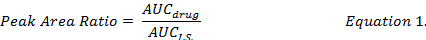
- calcular a percentagem de recuperação de drogas (equação 2), comparando as concentrações de droga reconstituídas utilizando metanol de extractos de amostras biológicas cravados àquele da norma (" pura ") solução em metanol de drogas.
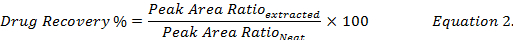
Resultados
Duas drogas anticâncer, DOX e MMC, bem como o metabólito DOX, DOXol, foram detectado simultaneamente sem qualquer interferência biológica sob a condição HPLC aplicada mesma gradiente usando 4-MU como o I.S. para os detectores de UV e fluorescência. DOX, MMC, DOXol e 4-MU foram bem separados uns dos outros com tempos de retenção de 5,7 min para MMC, 10,4 min para DOXol, 10,9 min para 4-MU e 11,1 min para DOX (Figura 2). Cada fármaco no sangue e vári...
Discussão
Em comparação com outros métodos cromatográficos que permitem a detecção de uma espécie única droga de cada vez, o presente protocolo HPLC é capaz de dosar simultaneamente três compostos de drogas (DOX, MMC e DOXol) na mesma matriz biológica sem a necessidade de mudar a fase móvel. Esse método de preparação e análise tem sido aplicado com sucesso para determinar a farmacocinética e bio-distribuição de dois sistemas de entrega de drogas baseados em nanopartículas (i.e., lipossomal DOX e DMPLN)...
Divulgações
Os autores não têm interesses financeiros concorrentes e conflitos de interesse.
Agradecimentos
Os autores reconhecem com gratidão a concessão de equipamentos da ciência Natural e pesquisa de engenharia (NSERC) Conselho de Canadá para HPLC, a subvenção de funcionamento do Instituto canadense de pesquisa de saúde (CIHR) e pesquisa de câncer de mama canadense (CBCR) Aliança para X.Y. Wu e a bolsa da Universidade de Toronto para R.X. Zhang e T. Zhang.
Materiais
| Name | Company | Catalog Number | Comments |
| Doxorubicin | Polymed Theraeutics | 111023 | Anticancer drug |
| Mitomycin C | Polymed Theraeutics | 060814 | Anticancer drug |
| Doxorubicinol (DOXol) | Toronto Research Chemicals | D558020 | Metabolite of DOX |
| 4-Methylumbelliferone sodium salt | Sigma-Aldrich | M1508 | Internal standard |
| Myristic Acid | Sigma-Aldrich | 544-63-8 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (100) Stearate | Spectrum | M1402 | Materials for poly-lipid hybrid nanoparticles |
| Polyoxyethylene (40) Stearate | Sigma-Aldrich | P3440 | Materials for poly-lipid hybrid nanoparticles |
| Pluronic F68 (PF68) | BASF Corp. | 9003-11-6 | Materials for poly-lipid hybrid nanoparticles |
| Ultrasonication (UP100H) | Hielscher, Ultrasound Technology | NA | Nanoparticle preparation |
| Water Bath (ISOTEMP 3016HS) | Fisher Scientific | NA | Nanoparticle preparation |
| Liposomal Doxorubicin (Caelyx) | Janssen | Purchased from the pharmacy Princess Margaret Hospital | Clinically-approved nanoparticle formulation |
| HPLC-graded Methanol | Caledon Chemicals | 6701-7-40 | HPLC mobile phase composition |
| HPLC-graded H2O | Caledon Chemicals | 8801-7-40 | HPLC mobile phase composition |
| HPLC-graded Acetonitrile | Caledon Chemicals | 1401-7-40 | HPLC mobile phase composition |
| Trifluoroacetic Acid | Sigma-Aldrich | 302031 | HPLC mobile phase composition |
| 0.45 μm Nylon Membrane Filter Paper | Whatman | WHA7404004 | HPLC mobile phase preparation |
| 1cc Plastic Syringes | Becton, Dickinson and Company | 2606-309659 | Treatment injection |
| 5cc Plastic Syringes | Becton, Dickinson and Company | 2608-309646 | Tissue collections |
| 30G 1/2 Needles | Becton, Dickinson and Company | 305106 | Treatment injection |
| 25G 5/8 Needles | Becton, Dickinson and Company | 305122 | Tissue collections |
| Sterile 0.9% Saline | Univeristy of Toronto House Brand | 1011 | Tissue perfusion |
| 13 ml Rounded-bottom conical tube | SARSTEDT | 62.515.006 | Prolyprolene, tissue homogenization |
| Alpha Minimum Essential Medium (MEM) | Gibco | 12571063 | Cell medium |
| 1 x Phosphate Buffer Saline | Gibco | 10010023 | Tissue homogenization |
| Triton X-100 | Sigma-Aldrich | X100-100 ML | Tissue homogenization |
| Formic acid | Caledon Chemicals | 1/5/3840 | Adjust pH for extraction solvent |
| Sodium heparin sprayed plastic tubes | Becton, Dickinson and Company | 367878 | Blood collection |
| Analytical Weigh Balance | Sartorius | CPA225D | NA |
| pH meters | Fisher Scientific | 13-637-671 | accumet BASIC |
| Vortex Mixter | Fisher Scientific | 02-215-365 | Vortexing samples at desired speed |
| 1.5 ml Microcentrifuge Tube | Fisherbrand | 2043-05408129 | Prolyprolene |
| Model 1000 homogenizer | Fisher Scientific | 08-451-672 | Tissue homogenization |
| Centrifuge 5702R | Eppendorf | 5702R | Extraction preparation |
| Heated Evaporator System | Glas-Col | NA | Sample reconstitution |
| HPLC Screw Thread Vials | DIKMA | 5320 | HPLC sample injection |
| HPLC Screw Caps with PTFE White Silicone Septa | DIKMA | 5325 | HPLC sample injection |
| HPLC Polypropylene Insert | Agilent Technologies | 5182-0549 | Maximum volume 250 μl, HPLC sample injection |
| Xbridge C18 Column | Waters Corporation | 186003117 | Drug analysis |
| Gradient pump | Waters Corporation | W600 | Drug analysis |
| Auto-sampler | Waters Corporation | W2707 | Drug analysis |
| Photodiode array detector | Waters Corporation | W2998 | Drug analysis |
| Multi λ fluoresence detector | Waters Corporation | W2475 | Drug analysis |
| EMPOWER 2 | Waters Corporation | NA | Data analysis software |
| Scientist | Micromath | NA | Pharmacokinetic analysis |
| Female Balb/c Mice | Jackson Laboratory | 001026 | In vivo |
| EMT6/WT Breast Cancer Cells | Provided by Dr. Ian Tannock; Ontario Cancer Institute | NA | In vivo |
Referências
- Holohan, C., Van Schaeybroeck, S., Longley, D. B., Johnston, P. G. Cancer Drug Resistance: An Evolving Paradigm. Nat. Rev. Cancer. 13 (10), 714-726 (2013).
- Szakacs, G., Paterson, J. K., Ludwig, J. A., Booth-Genthe, C., Gottesman, M. M. Targeting Multidrug Resistance in Cancer. Nat Rev Drug Discov. 5 (3), 219-234 (2006).
- Kong, A. -. N. T., Kong, A. .. N. .. T. .. ,. . Inflammation, Oxidative Stress, and Cancer: Dietary Approaches for Cancer Prevention. , (2013).
- Zhang, R. X., Wong, H. L., Xue, H. Y., Eoh, J. Y., Wu, X. Y. Nanomedicine of Synergistic Drug Combinations for Cancer Therapy - Strategies and Perspectives. J Control Release. 240, 489-503 (2016).
- Webster, R. M. Combination Therapies in Oncology. Nat. Rev. Drug. Discov. 15 (2), 81-82 (2016).
- Waterhouse, D. N., Gelmon, K. A., Klasa, R., Chi, K., Huntsman, D., Ramsay, E., Wasan, E., Edwards, L., Tucker, C., Zastre, J., Wang, Y. Z., Yapp, D., Dragowska, W., Dunn, S., Dedhar, S., Bally, M. B. Development and Assessment of Conventional and Targeted Drug Combinations for Use in the Treatment of Aggressive Breast Cancers. Curr Cancer Drug Targets. 6 (6), 455-489 (2006).
- Cancello, G., Bagnardi, V., Sangalli, C., Montagna, E., Dellapasqua, S., Sporchia, A., Iorfida, M., Viale, G., Barberis, M., Veronesi, P., Luini, A., Intra, M., Goldhirsch, A., Colleoni, M. Phase Ii Study with Epirubicin, Cisplatin, and Infusional Fluorouracil Followed by Weekly Paclitaxel with Metronomic Cyclophosphamide as a Preoperative Treatment of Triple-Negative Breast Cancer. Clin Breast Cancer. 15 (4), 259-265 (2015).
- Masuda, N., Higaki, K., Takano, T., Matsunami, N., Morimoto, T., Ohtani, S., Mizutani, M., Miyamoto, T., Kuroi, K., Ohno, S., Morita, S., Toi, M. A Phase Ii Study of Metronomic Paclitaxel/Cyclophosphamide/Capecitabine Followed by 5-Fluorouracil/Epirubicin/Cyclophosphamide as Preoperative Chemotherapy for Triple-Negative or Low Hormone Receptor Expressing/Her2-Negative Primary Breast Cancer. Cancer Chemother Pharmacol. 74 (2), 229-238 (2014).
- Carrick, S., Parker, S., Thornton, C. E., Ghersi, D., Simes, J., Wilcken, N. Single Agent Versus Combination Chemotherapy for Metastatic Breast Cancer. Cochrane Database Syst Rev. 15 (2), 003372 (2009).
- Cardoso, F., Bedard, P. L., Winer, E. P., Pagani, O., Senkus-Konefka, E., Fallowfield, L. J., Kyriakides, S., Costa, A., Cufer, T., Albain, K. S., Force, E. -. M. T. International Guidelines for Management of Metastatic Breast Cancer: Combination Vs Sequential Single-Agent Chemotherapy. J Natl Cancer Inst. 101 (17), 1174-1181 (2009).
- Alba, E., Martin, M., Ramos, M., Adrover, E., Balil, A., Jara, C., Barnadas, A., Fernandez-Aramburo, A., Sanchez-Rovira, P., Amenedo, M., Casado, A. Multicenter Randomized Trial Comparing Sequential with Concomitant Administration of Doxorubicin and Docetaxel as First-Line Treatment of Metastatic Breast Cancer: A Spanish Breast Cancer Research Group (Geicam-9903) Phase Iii. J Clinn Oncol. 22 (13), 2587-2593 (2004).
- Sadat, S. M., Saeidnia, S., Nazarali, A. J., Haddadi, A. Nano-Pharmaceutical Formulations for Targeted Drug Delivery against Her2 in Breast Cancer. Curr. Cancer Drug Targets. 15 (1), 71-86 (2015).
- Devadasu, V. R., Wadsworth, R. M., Ravi Kumar, M. N. V. Tissue Localization of Nanoparticles Is Altered Due to Hypoxia Resulting in Poor Efficacy of Curcumin Nanoparticles in Pulmonary Hypertension. Eur. J. Pharm. Biopharm. 80 (3), 578-584 (2012).
- Li, S. D., Huang, L. Pharmacokinetics and Biodistribution of Nanoparticles. Mol. Pharm. 5 (4), 496-504 (2008).
- Zhang, R. X., Ahmed, T., Li, L. Y., Li, J., Abbasi, A. Z., Wu, X. Y. Design of Nanocarriers for Nanoscale Drug Delivery to Enhance Cancer Treatment Using Hybrid Polymer and Lipid Building Blocks. Nanoscale. 9 (4), 1334-1355 (2017).
- Wang, X., Li, S., Shi, Y., Chuan, X., Li, J., Zhong, T., Zhang, H., Dai, W., He, B., Zhang, Q. The Development of Site-Specific Drug Delivery Nanocarriers Based on Receptor Mediation. J. Control. Release. 193, 139-153 (2014).
- Batist, G., Gelmon, K. A., Chi, K. N., Miller, W. H., Chia, S. K., Mayer, L. D., Swenson, C. E., Janoff, A. S., Louie, A. C. Safety, Pharmacokinetics, and Efficacy of Cpx-1 Liposome Injection in Patients with Advanced Solid Tumors. Clin Cancer Res. 15 (2), 692-700 (2009).
- Mayer, L. D., Harasym, T. O., Tardi, P. G., Harasym, N. L., Shew, C. R., Johnstone, S. A., Ramsay, E. C., Bally, M. B., Janoff, A. S. Ratiometric Dosing of Anticancer Drug Combinations: Controlling Drug Ratios after Systemic Administration Regulates Therapeutic Activity in Tumor-Bearing Mice. Mol. Cancer Ther. 5 (7), 1854-1863 (2006).
- Prasad, P., Cheng, J., Shuhendler, A., Rauth, A. M., Wu, X. Y. A Novel Nanoparticle Formulation Overcomes Multiple Types of Membrane Efflux Pumps in Human Breast Cancer Cells. Drug Deliv Transl Res. 2 (2), 95-105 (2012).
- Shuhendler, A. J., Cheung, R. Y., Manias, J., Connor, A., Rauth, A. M., Wu, X. Y. A Novel Doxorubicin-Mitomycin C Co-Encapsulated Nanoparticle Formulation Exhibits Anti-Cancer Synergy in Multidrug Resistant Human Breast Cancer Cells. Breast Cancer Res Treat. 119 (2), 255-269 (2010).
- Shuhendler, A. J., O'Brien, P. J., Rauth, A. M., Wu, X. Y. On the Synergistic Effect of Doxorubicin and Mitomycin C against Breast Cancer Cells. Drug Metabol. Drug Interact. 22 (4), 201-233 (2007).
- Zhang, R. X., Cai, P., Zhang, T., Chen, K., Li, J., Cheng, J., Pang, K. S., Adissu, H. A., Rauth, A. M., Wu, X. Y. Polymer-Lipid Hybrid Nanoparticles Synchronize Pharmacokinetics of Co-Encapsulated Doxorubicin-Mitomycin C and Enable Their Spatiotemporal Co-Delivery and Local Bioavailability in Breast Tumor. Nanomedicine. 12 (5), 1279-1290 (2016).
- Zhang, T., Prasad, P., Cai, P., He, C., Shan, D., Rauth, A. M., Wu, X. Y. Dual-Targeted Hybrid Nanoparticles of Synergistic Drugs for Treating Lung Metastases of Triple Negative Breast Cancer in Mice. Acta Pharmacol Sin. , 1-13 (2017).
- Shuhendler, A. J., Prasad, P., Zhang, R. X., Amini, M. A., Sun, M., Liu, P. P., Bristow, R. G., Rauth, A. M., Wu, X. Y. Synergistic Nanoparticulate Drug Combination Overcomes Multidrug Resistance, Increases Efficacy, and Reduces Cardiotoxicity in a Nonimmunocompromised Breast Tumor Model. Mol Pharm. 11 (8), 2659-2674 (2014).
- Prasad, P., Shuhendler, A., Cai, P., Rauth, A. M., Wu, X. Y. Doxorubicin and Mitomycin C Co-Loaded Polymer-Lipid Hybrid Nanoparticles Inhibit Growth of Sensitive and Multidrug Resistant Human Mammary Tumor Xenografts. Cancer Lett. 334 (2), 263-273 (2013).
- Rafiei, P., Michel, D., Haddadi, A. Application of a Rapid Esi-Ms/Ms Method for Quantitative Analysis of Docetaxel in Polymeric Matrices of Plga and Plga-Peg Nanoparticles through Direct Injection to Mass Spectrometer. Am. J. Anal. Chem. 6 (2), 164-175 (2015).
- Daeihamed, M., Haeri, A., Dadashzadeh, S. A Simple and Sensitive Hplc Method for Fluorescence Quantitation of Doxorubicin in Micro-Volume Plasma: Applications to Pharmacokinetic Studies in Rats. Iran. J. Pharm. Res. 14, 33-42 (2015).
- Alhareth, K., Vauthier, C., Gueutin, C., Ponchel, G., Moussa, F. Hplc Quantification of Doxorubicin in Plasma and Tissues of Rats Treated with Doxorubicin Loaded Poly(Alkylcyanoacrylate) Nanoparticles. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci. 887-888, 128-132 (2012).
- Al-Abd, A. M., Kim, N. H., Song, S. C., Lee, S. J., Kuh, H. J. A Simple Hplc Method for Doxorubicin in Plasma and Tissues of Nude Mice. Arch Pharm Res. 32 (4), 605-611 (2009).
- Loadman, P. M., Calabrese, C. R. Separation Methods for Anthraquinone Related Anti-Cancer Drugs. J. Chromatogr. B Biomed. Sci. Appl. 764 (1-2), 193-206 (2001).
- Zhang, Z. D., Guetens, G., De Boeck, G., Van Cauwenberghe, K., Maes, R. A., Ardiet, C., van Oosterom, A. T., Highley, M., de Bruijn, E. A., Tjaden, U. R. Simultaneous Determination of the Peptide-Mitomycin Kw-2149 and Its Metabolites in Plasma by High-Performance Liquid Chromatography. J. Chromatogr. B Biomed. Sci. Appl. 739 (2), 281-289 (2000).
- Alvarez-Cedron, L., Sayalero, M. L., Lanao, J. M. High-Performance Liquid Chromatographic Validated Assay of Doxorubicin in Rat Plasma and Tissues. J. Chromatogr. B Biomed. Sci. Appl. 721 (2), 271-278 (1999).
- Paroni, R., Arcelloni, C., De Vecchi, E., Fermo, I., Mauri, D., Colombo, R. Plasma Mitomycin C Concentrations Determined by Hplc Coupled to Solid-Phase Extraction. Clin. Chem. 43 (4), 615-618 (1997).
- Song, D., Au, J. L. Direct Injection Isocratic High-Performance Liquid Chromatographic Analysis of Mitomycin C in Plasma. J Chromatogr B Biomed Appl. 676 (1), 165-168 (1996).
- Schrijvers, D. Role of Red Blood Cells in Pharmacokinetics of Chemotherapeutic Agents. Clin. Pharmacokinet. 42 (9), 779-791 (2003).
- Colombo, T., Broggini, M., Garattini, S., Donelli, M. G. Differential Adriamycin Distribution to Blood Components. Eur. J. Drug Metab. Pharmacokinet. 6 (2), 115-122 (1981).
- Maeda, H., Nakamura, H., Fang, J. The Epr Effect for Macromolecular Drug Delivery to Solid Tumors: Improvement of Tumor Uptake, Lowering of Systemic Toxicity, and Distinct Tumor Imaging in Vivo. Adv. Drug Deliv. Rev. 65 (1), 71-79 (2013).
- Gustafson, D. L., Rastatter, J. C., Colombo, T., Long, M. E. Doxorubicin Pharmacokinetics: Macromolecule Binding, Metabolism, and Excretion in the Context of a Physiologic Model. J. Pharm. Sci. 91 (6), 1488-1501 (2002).
- Gabizon, A., Shiota, R., Papahadjopoulos, D. Pharmacokinetics and Tissue Distribution of Doxorubicin Encapsulated in Stable Liposomes with Long Circulation Times. J. Natl. Cancer Inst. 81 (19), 1484-1488 (1989).
- Motlagh, N. S., Parvin, P., Ghasemi, F., Atyabi, F. Fluorescence Properties of Several Chemotherapy Drugs: Doxorubicin, Paclitaxel and Bleomycin. Biomed Opt Express. 7 (6), 2400-2406 (2016).
- Mohan, P., Rapoport, N. Doxorubicin as a Molecular Nanotheranostic Agent: Effect of Doxorubicin Encapsulation in Micelles or Nanoemulsions on the Ultrasound-Mediated Intracellular Delivery and Nuclear Trafficking. Mol Pharm. 7 (6), 1959-1973 (2010).
- Cielecka-Piontek, J., Jelińska, A., Zając, M., Sobczak, M., Bartold, A., Oszczapowicz, I. A Comparison of the Stability of Doxorubicin and Daunorubicin in Solid State. J. Pharm. Biomed Anal. 50 (4), 576-579 (2009).
- Gilbert, C. M., McGeary, R. P., Filippich, L. J., Norris, R. L. G., Charles, B. G. Simultaneous Liquid Chromatographic Determination of Doxorubicin and Its Major Metabolite Doxorubicinol in Parrot Plasma. J. chromatogr. B Analyt. Technol. Biomed. Life sci. 826 (1-2), 273-276 (2005).
- Liu, Z. S., Li, Y. M., Jiang, S. X., Chen, L. R. Direct Injection Analysis of Mitomycin C in Biological Fluids by Multidemension High Performance Liquid Chromatography with a Micellar Mobile Phase. J. Liq. Chromatogr. Relat. Technol. 19 (8), 1255-1265 (1996).
- Zhou, Y., He, C., Chen, K., Ni, J., Cai, Y., Guo, X., Wu, X. Y. A New Method for Evaluating Actual Drug Release Kinetics of Nanoparticles inside Dialysis Devices Via Numerical Deconvolution. J. Control. Release. 243, 11-20 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados