É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Na Vivo Avaliação de EPR de pH, pO2, Status Redox e as concentrações de fosfato e glutationa no microambiente do Tumor
Neste Artigo
Resumo
Baixo-campo (L-band, 1.2 GHz) ressonância paramagnética electrónica utilizando sondas de nitroxyl e trityl solúveis é demonstrada para avaliação dos parâmetros fisiologicamente importantes no microambiente do tumor em modelos do rato do cancro da mama.
Resumo
Este protocolo demonstra a capacidade do baixo-campo de ressonância paramagnética electrónica (EPR)-com base em técnicas em combinação com sondas paramagnéticos funcionais para fornecer informações quantitativas sobre o microambiente do tumor química (TME), incluindo p Ó2, status de redox, pH, concentrações de fosfato inorgânico intersticial (Pi) e intracelular glutationa (GSH). Em particular, um aplicativo de uma sonda recentemente desenvolvidos solúvel trityl multifuncional fornece inigualável oportunidade para in vivo medições simultâneas de pH, pO2 e Pi em E espaço de xtracellular (sonda de esperança). As medições de três parâmetros, usando um único teste permitem suas análises de correlação independentes de distribuição sonda e hora das medições.
Introdução
Um papel fundamental do TME na progressão do câncer e terapia é cada vez mais apreciada1. Entre os parâmetros fisiológicos importantes do TME em tumores sólidos de hipóxia do tecido2, acidose3,4, alta redução de capacidade5, concentrações elevadas de intracelular GSH6,7, e intersticial Pi8 estão bem documentados. Não-invasiva em vivo pO2, pH, Pi, GSH e redox avaliações proporcionam exclusivos insights sobre os processos biológicos em TME e ferramentas de avanço para o rastreio pré-clínico de drogas anti-câncer e estratégias terapêuticas TME-alvo. Uma radiofrequência razoável profundidade de penetração nos tecidos por ressonância magnética (MRI) e técnicas de baixo-campo baseadas em EPR torna as abordagens mais adequadas para avaliação não invasiva destes parâmetros de TME. MRI baseia-se em grande medida na imagem prótons da água e é amplamente utilizado em ambientes clínicos para fornecer resolução anatômica, mas carece de resolução funcional. As medições de ressonância magnética nuclear de fósforo-31 (31P-NMR) de extracelular Pi concentração e pH com base em um sinal de fosfato endógeno são potencialmente atraentes para caracterização de TME, mas normalmente são mascaradas por várias vezes maior intracelular Pi concentrações9,10. Em contraste com isso, medições de EPR dependem de espectroscopia e imagem latente de especialmente projetado paramagnéticos sondas para fornecer resolução funcional. Note que sondas EPR exógenas têm uma vantagem sobre exógena NMR sondas devido a sensibilidade intrínseca muito superior de EPR e ausência de sinais EPR de fundo endógena. O desenvolvimento recente de uma dupla função de pH e redox nitroxyl probe11 e multifuncional trityl sonda12 fornece oportunidades inigualáveis para in vivo medições simultâneas de vários parâmetros do TME e seus análises de correlação independentes na distribuição de sonda e o tempo de medição. A nosso conhecimento, não há nenhum outros métodos disponíveis para avaliar simultaneamente na vivo fisiologicamente importantes parâmetros TME químicos em indivíduos vivos, tais como pO2, pHe, Pi, redox e GSH.
Sondas para Na Vivo Medições funcionais:
A Figura 1 mostra as estruturas químicas das sondas paramagnéticos usadas para acessar parâmetros TME, que incluem sondas solúveis e partículas. Alta sensibilidade funcional, estabilidade em tecidos vivos e toxicidade mínima são alguns benefícios que fazem partículas sondas preferidas sobre sondas solúveis para oximetria de EPR na vivo . Por exemplo, sondas partículas aumentaram tempos de retenção no local de implante de tecido, em comparação com sondas solúveis, permitindo a medição longitudinal de tecido pO2 por várias semanas. Por outro lado, sondas solúveis superam sondas partículas fornecendo medições espaciais-resolvido usando EPR com base em técnicas de imagem, bem como permitindo análises concomitantes de múltiplas funcionalidades (pO2, pH, Pi, redox, e GSH).

Figura 1. Estruturas químicas das sondas paramagnéticos que montam o ensaio de avaliação de TME. Isso inclui a partículas pO2 sonda, LiNc-BuO (R = - O (CH2)3CH3) e sondas solúveis: sonda de pH e redox de dupla função, NR; Sonda de GSH-sensíveis, RSSR; e multifuncional pO2, pH e sonda de Pi do microambiente extracelular, a sonda de esperança. A síntese de tais sondas tem sido descrita nas referências fornecidas 11,12. Clique aqui para ver uma versão maior desta figura.
Protocolo
Todo trabalho de animais foi realizado em conformidade com o protocolo WVU IACUC aprovado.
1. síntese e calibração da sonda
- Partículas pO2-sonda de LiNc-BuO sensível
Nota: LiNc-BuO microcristais são sintetizados e preparados conforme descrito na referência13. Eles são muito estáveis e podem ser mantidos em temperatura ambiente por anos. O linewidth EPR da sonda partículas LiNc-BuO é uma pO2-parâmetro sensível. LiNc-BuO microcristais demonstram ideal dependência linear do linewidth na concentração de oxigênio na faixa de condições anóxica até 760 mmHg de pressão parcial pO2 13, com os valores da linewidth intrínseco na ausência de oxigênio e a inclinação da dependência de oxigênio (medida em mG/mmHg) ligeiramente diferentes para diferentes lotes da preparação microcrystal. Portanto, a calibração é necessária para cada lote particular.- Pese 60 mg de microcristais de LiNc-BuO.
- Para a calibração da sensibilidade de oxigênio, suspender microcristais em 3 mL de meio de mídia de Eagle modificado (DMEM) de Dulbecco (em uma concentração de 20 mg/mL) e proceda à sonicação por 5 min no gelo com um sonicador de sonda a 20 kHz usando 7 W de poder em um tubo de fundo redondo de vidro de 5 mL.
- Coloque 1 mL dos microcristais lisados num copo tubo no ressonador de bobina de superfície do espectrómetro EPR L-band (1.2 GHz) e adquirir os espectros EPR de ondas contínuas (CW) na temperatura fisiológica de 37 ° C e oxigênio concentrações de 0, 1, 2, 4, 8 e 20,9%. Mantenha a concentração de oxigênio por borbulhamento a solução com a mistura de gases, entregada a partir de um controlador de gás e a temperatura utilizando um banho de água ligado a um termostato. Use os seguintes parâmetros de aquisição de espectrômetro EPR: amplitude de modulação, 100 mG; frequência de modulação, 100 kHz; largura de varredura, 5g; varrer a tempo, 60 s.
- Para obter uma melhor relação sinal-ruído (SNR), utilize um valor de amplitude de modulação de 60% do linewidth (por exemplo, usar uma amplitude de modulação 0,6 G para o linewidth de 1 G).
- Alternativa simplificado o procedimento de calibração: gravar os espectros EPR em soluções anóxica e borbulhar ar14. Neste último caso, manter a anóxia nas amostras através da adição de glicose 10 mM e 100 U/mL glicose oxidase para soluções de sonda 1 mL de acordo com a referência14.
- Encaixe os espectros EPR, com a função Lorentzian encontrar a largura da linha, LW. Avaliar a sensibilidade de microcristais de pO2 como uma inclinação da dependência de LW pO2, ou seja, como um valor de (LWar−LWanóxia) /pO2air, onde LWar e LWanóxia são espectros linewidth em condições de ar e anóxia, respectivamente; p Ó2air = 152 mmHg.
- Sonda de pH e redox de dupla função, NR
Nota: A sonda NR é sintetizada conforme descrito na referência11. É estável à temperatura ambiente como um sólido e em soluções aquosas. A sonda NR sintetizada é mantida a 4 ° C. O nitrogênio hyperfine dividindo umNe a taxa de decaimento de amplitude do sinal são os parâmetros espectrais da sonda NR que são sensíveis ao pH (sonda pKum = 6,6 a 37 ° C, gama de sensibilidade de pH de 5,6 7,6) e à capacidade de redução da sonda microambiente, respectivamente.- Retire o NR do freezer e deixe o recipiente aquecer a temperatura ambiente (10-15 min). Pesar 6,34 mg do NR, dissolvê-lo em 1 mL de solução salina e ajustar o pH para 7.2 com pequenas alíquotas de HCl ou NaOH, usando um medidor de pH. Use a solução preparada de NR (10 mM) como uma solução.
- Execute a calibração de pH da sonda NR como segue (ver referência11). Em primeiro lugar, adicione 0,1 mL da solução-mãe NR para 0,9 mL de tampão de at-fosfato de 2 mM, 150 mM de NaCl. Titule a solução obtidos 1 mM NR com alíquotas de HCl ou NaOH ao pH exigido usando um medidor de pH. Controle a temperatura usando um banho de água ligado a um termostato.
- Grave os espectros EPR das amostras em tubos de 1,5 mL microcentrifuga usando o espectrômetro EPR L-band. Use os seguintes parâmetros de aquisição de espectrômetro EPR: amplitude de modulação, 2,5 G; frequência de modulação, 100 kHz; largura de varredura, 60 G; varrer o tempo, 20 s.
- Medir o hyperfine divisão constante (N) como metade da distância entre os componentes de baixa e alta-campo dos espectros de EPR e desenhar versus pH, para fornecer a curva de calibração para medições de EPR L-faixa de pH.
- Sonda RSSR GSH-sensível
Nota: A sonda RSSR é sintetizada conforme descrito na referência15. Armazenar a sonda NR sintetizada a 4 ° C. O biradical de bissulfeto RSSR lipofílico composto difunde-se facilmente através da membrana celular para reagir com GSH intracelular e fornecer uma abordagem confiável para determinar GSH na vivo usando EPR16,17. Este método baseia-se nas taxas de reação da piscina de tióis GSH intracelular predominante com a sonda RSSR. A reação da biradical RSSR com divisões GSH dissulfeto de seu vínculo (ver esquema 1) resultando no cancelamento da troca de rotação entre os dois fragmentos de radicais e manifestando-se em uma diminuição dos componentes espectrais biradical e correspondente aumento dos componentes monoradical. Para a sonda RSSR biradical, a taxa do aumento da amplitude do componente monoradical é proporcional à concentração de GSH e é um parâmetro espectral conveniente de EPR GSH-sensíveis. Para avaliar a concentração de GSH das medições de EPR na vivo , a calibração anterior da taxa da reação RSSR com GSH na temperatura e pH correspondente tem de ser realizada da seguinte forma.- Retire o RSSR do freezer e deixe o recipiente aquecer a temperatura ambiente (10-15 min). Pesar 4,05 mg do NR e dissolvê-lo em 1 mL de solução de DMSO. Use a solução preparada de RSSR (10 mM) como uma solução.
- Determine o valor da taxa constante, kobs, da reação de RSSR com GSH no pH e temperatura desejável como segue.
- Em primeiro lugar, adicionar 20 µ l de solução-mãe RSSR (10 mM) para 0,98 mL de tampão de 1 mM nd-fosfato, pH 7.2, 150 mM de NaCl, para obter um 0,2 mM RSSR sonda solução.
- Prepare soluções de concentrações de 1, 2 e 5 mM de GSH no buffer de at-fosfato 0,1 M em pH 7,2. Para avaliar com precisão a concentração de GSH nas células do órgão alvo de medições na vivo , a calibração em vitro tem de ser realizada em um pH próximo do valor do pH intracelular.
- Misturar volumes iguais de solução RSSR de 0,2 mM e uma das soluções preparadas na etapa 1.3.4 GSH. para uma concentração final da sonda em 0,1 mM e de GSH em 0,5, 1 ou 2, 5mm.
- Imediatamente após a solução RSSR e GSH mistura, coloque a amostra no ressonador EPR e gravar os espectros EPR em 12 segundos por 10 minutos. Em seguida, calcule a cinética do aumento da amplitude espectral monoradical. Use os seguintes parâmetros de aquisição de espectrômetro EPR: amplitude de modulação, 1 G; frequência de modulação, 100 kHz; largura de varredura, 60 G; tempo de varredura, 10-60 s.
- Caber a cinética EPR medida para o monoexponents e calcular a constante de tempo da cinética exponencial, τ. A regressão linear (1/τ = kobs × [GSH]) fornece o valor da constante da reação entre GSH e RSSR taxa observada (por exemplo, a 34 ° C e pH 7,2, kobs = 2,8 ± 0,2 M-1s-1)11.
- Sonda de esperança multifuncional para pO2, pH e avaliação de Pi
Nota: O trityl de monophosphonated esperança sonda é sintetizada conforme descrito na referência12 e é mantido a 4 ° C. Os espectros de EPR CW de esperança no pH << pKpor (A - ácido formulário) e pH >> pKpor (B - forma básica) são representados pelas parelhas devido ao fósforo hyperfine dividindo, umP. Os ajustes do instrumento típico são os seguintes: amplitude de modulação, 37,5 mG; frequência de modulação, 100 kHz; largura de varredura, 0,9 G; tempo de varredura, 20-60 s. A pH intermediário (5 < pH < 8) o espectro EPR de esperança sonda é caracterizado por um quarteto quando A e B Estados estão presentes. O linewidth EPR individual da esperança é um marcador de2 pO (exatidão, ≈ 1 mmHg; p O2 intervalo, 1-100 mmHg). A fração de protonados esperança (uma forma) é um marcador de pH na faixa de 6 a 8.0 (exatidão, ± 0,05). O valor da taxa de câmbio próton (expressado em mG) com Pi extraído por simulação de espectros é um marcador de Pi (exatidão, ± 0,1 mM, gama, 0.1-20mm). Procedimentos de calibração são executados na temperatura fisiológica (37 ° C), força iônica da solução (NaCl, 150mm) e concentração de sonda esperança de 0,2 mM, conforme descrito anteriormente na referências12,18e detalhada abaixo.- Retire a sonda de esperança do freezer e deixe o recipiente aquecer a temperatura ambiente (10-15 min).
- Pesar 10,7 mg da sonda esperança, dissolvê-lo em 1 mL de solução salina e ajustar o pH para 7,4. Adicionar 20 µ l da solução preparada da esperança (10 mM) para 0,98 mL de solução salina para obter uma esperança de 0.2 mM sonda solução.
- Para calibração da sonda de pH, titule 0,2 mM da solução sonda esperança pela adição de um pequeno volume de NaOH ou HCl, com a diluição final da amostra, menos de 1%. Medir o pH com um eletrodo de pH calibrado a 37 ° C, usando os valores de pH para a solução de referência recomendada pelo Bureau Nacional de padrões (EUA). Use um copo de reação encamisadas anexado a um circulador para manter a temperatura das soluções tituladas e referência cuidadosamente durante as medições de pH. Manter condições anóxica pela adição de glicose 10 mM e 100 U/mL glicose oxidase para as soluções sonda.
- Adquira os espectros EPR dos formulários A e B ≤ pH 5 e pH ≥ 8, respectivamente, em condições anóxica na ausência de fosfato.
- Use os espectros correspondentes para obter parâmetros espectrais intrínsecos. Ou seja, simule a linha espectral como a convolução da função Lorentzian com a função gaussiana que se aproxima a estrutura hiperfina super não resolvida da sonda esperança. O encaixe dos espectros de EPR calculados para os espectros experimentais produz os valores deP e Lorentzian linewidth (ΔLpp), determinados pela taxa de relaxação transversal, 1/T2 (onde 1/T2 = pp (√3/2) L para a medida derivada da linha de absorção de RF em CW EPR) e o linewidth de distribuição gaussiana, G.
Nota: A seguir estão os parâmetros obtidos a partir dos espectros medidos em condições especificadas na etapa 1.4.2:P(A) = 3,63 G,P(B) = 3,37 G; 1/T2(A) = 23,6 mG; 1/T2(B) = 9 mG; G(A) = 40 mG; G(B) = 45 mG (ver referência8). - Adquirir os espectros EPR da esperança a pH intermediário (5 < pH < 8). Simule o componente de alta-arquivado dos espectros de EPR adquiridos usando a teoria da troca entre vários sites em sistemas frouxamente acoplados ou não acoplado, adaptados de referência19 , como descrito anteriormente,18. Uso os parâmetros intrínsecos obtidos para o A e B Estados (consulte a etapa 1.4.5) para diminuir o número de variáveis. Encaixar os espectros calculados para os experimentais para encontrar os valores de fração de um (pA) e traçar a dependência dovalor p pH. Use a dependência do pA pH em outros estudos como uma curva de calibração de pH.
Nota: Encaixe a dependência do pH do pA com uma curva de titulação padrão fornece o valor da dissociação constante, pKuma (esperança) = 6.98. Em estudos em vivo , adquirir os espectros EPR completo da sonda esperança é impraticável devido o tempo adicional necessário para adquirir a lacuna entre os componentes de alta e baixa --campo do fósforo hyperfine divisão no espectro de EPR. Portanto, em estudos exemplificados apenas o componente de alta-Arquivado do espectro EPR foi medido e analisado. - Para a calibração da sonda de pO2, adquira espectros EPR da sonda esperança em diferentes concentrações de oxigênio.
- Controle a pO2 valores das soluções por borbulhamento com a mistura de gás entregues a partir de um controlador de gás. Controle a temperatura da solução (37 ° C) utilizando um banho de água ligado a um termostato.
- Simular os espectros EPR e encaixá-los com os experimentais, conforme descrito na etapa 1.4.6 para determinar os valores das taxas de relaxamento induzido por oxigênio.
Nota: Os valores das taxas de relaxamento induzido por oxigênio foram 0,49 mG/mmHg ambos para um e formulários B da esperança sonda como medida a 37 ° C8. - Para a calibração da sonda de [Pi], adquira espectros EPR da sonda esperança em várias concentrações de fosfato. Use a solução radical de esperança com um valor de pH perto pKum (pKum = 6,9 a 37 ° C)18 e titula-se com diferentes concentrações de fosfato. Manter a temperatura e o gás composição conforme descrito nos passos acima.
- Simular os espectros EPR e encaixá-los com os experimentais, conforme descrito na etapa 1.4.6 para determinar os valores da taxa de câmbio induzida por Pi.
Nota: A dependência da taxa de câmbio induzida por Pi [Pi] é usada como calibração em outros estudos.
2. Mouse modelos de câncer de mama
- Modelo de tumor espontânea WINGLESS-PyMT
- Use 4-8 semana-velho amigo vírus tipo B susceptibilidade/NIH (FVB/N) rato tumor mamário vírus promotor (WINGLESS) polyoma médio-T antígeno (PyMT +) ratos fêmeas com tumores mamários formados espontaneamente para estudos de EPR na vivo .
- Para comparação do microambiente do tecido normal de glândulas mamárias e tumores, use as fêmeas idade-combinadas littermate deficientes no PyMT oncogene (PyMT−, "wild type")20.
- Sujeitar os ratos a espectroscopia EPR L-banda uma vez por semana durante quatro semanas durante a anestesia de isoflurano (veja sonda entrega abaixo).
- Anestesiar o mouse usando uma mistura de ar-isoflurano (3% de isoflurano) e coloque o mouse sobre uma mesa ajustável numa posição lateral direita com o tumor (glândulas mamárias), perto do ressonador de bobina de superfície.
- Após a colocação do rato, administrar a sonda pela injeção de intratissual (t.i.), ajustar o espectrómetro EPR e adquirir os espectros EPR para 5-10 min.
- Medida 2-3 tumores mamários (do WINGLESS-PyMT + ratos) ou não-tumoral rolamento glândulas mamárias (a partir de ratos PyMT−) durante a mesma sessão EPR.
- Modelo de tumor ortotópico MET-1
- Desenvolvem-se células de câncer de mama murino FVB/N fundo Met-1 em 37 ° C, umidade relativa de 95% em DMEM contendo 10% de soro fetal bovino (FBS), 10 µ g/mL insulina, rhEGF 5 ng/mL e 1% e 5% CO2PSA (penicilina G de sódio, sulfato de estreptomicina e anfotericina B) para ~ confluência de 80% em um balão de T175.
- Aspire a mídia e enxágue as células aderentes com 10 mL de PBS (1,54 mM KH2PO4, 155 mM NaCl e 2,71 mM Na2HPO4-7 H2O sem cloreto de cálcio ou cloreto de magnésio, pH = 7,4).
- Separe as células, adicionando 5 mL de solução de EDTA-tripsina 0,25% e balançando o balão. Quando as células são desanexadas, adicionar 10 mL DMEM contendo 10% FBS no balão e recolher as células.
- Centrifugar a suspensão de eritrócitos a 132 x g durante 10 minutos a 4 ° C. Contar as células usando um hemocytometer e ressuspender a 1 x 106 células por µ l 100 DMEM mínima.
- Usando uma seringa de insulina (agulha de 29 1/2), lentamente injete 100 µ l de suspensão de células de tumor as almofadas de gordura mamária número 4 de ratos fêmeas do tipo selvagem FVB/N 8 semanas de idade.
- Monitorar a iniciação do tumor pela palpação (aparecem após aproximadamente 2-3 semanas), crescimento (visual) e o rato heath (visual) todos os dias.
- Medir as dimensões do tumor uma vez por semana usando pinças e determinar o volume do tumor através da equação:
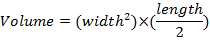
3. sonda entrega para as medições In Vivo funcional
- Sonda de LiNc-BuO partículas uso (protocolo I) para medições de2 pO em modelos de tumor ortotópico implantando células tumorais com LiNc-BuO interiorizado microcristais como anteriormente descrito de14,21 em detalhada abaixo.
- No caso do modelo de tumor MET-1, para a internalização de microcristais de LiNc-BuO em células MET-1, suspender os microcristais de LiNc-BuO em DMEM em uma concentração de 20 mg/mL e proceda à sonicação com um sonicador de sonda a 20 kHz usando 7 W de poder em um tubo de fundo redondo de vidro 5 mL por 5 min no gelo.
- Adicione 100 µ l (2 mg de LiNc-BuO) da suspensão para um balão de T75 com 10 mL meio de cultura contendo células MET-1 (aproximadamente 30% de confluencia). Todos os procedimentos ocorrem em um gabinete de biossegurança e a mídia contém penicilina e estreptomicina para minimizar o potencial de infecção.
- Incube as celulas a 37 ° C por 72 h ou até atingirem ~ confluência de 80%.
- Aspire os meios de comunicação. Lave as células cinco vezes com 10 mL de PBS. Separe as células com 5ml do trypsin-EDTA. Colete as células. Centrífuga, conforme descrito acima na etapa 2.2.4. Manche uma amostra de células com tintura de exclusão para determinar a quantidade e viabilidade celular.
- Suspender as células em uma concentração de 1 x 106 por 100 µ l DMEM mínima.
- Utilizando uma seringa de insulina, lentamente injete 100 µ l de suspensão de células que contém os microcristais de LiNc-BuO internalizados nas almofadas de gordura mamária número 4 de 8 semanas de idade fêmea FVB/N tipo selvagem os ratos como descrito na etapa 2.2.5.
- Monitorar a iniciação do tumor e crescimento, conforme descrito nas etapas 2.2.6 e 2.2.7.
- Sonda de LiNc-BuO partículas uso (Protocolo II) em qualquer espontânea ou modelos ortotópico. Injete LiNc-OBu microcristais no local de interesse, por exemplo, normais glândulas mamárias ou tumores mamários, utilizando uma seringa de insulina.
- Sondas solúveis
- Anestesiar os ratos por inalação de uma mistura de ar-isoflurano (entrega de 1,0 L/min e 2-3% de isoflurano) usando uma anestesia da máquina e coloque-os na abertura do espectrómetro EPR.
- Afine o instrumento e, em seguida, injetar o NR (10-30 µ l, 10 mM), sonda de esperança (10−30 µ l, 0.5-2 mM) em solução salina, pH 7.2 ou sonda RSSR em soluções de DMSO (10 µ l, 10 mM) (t.i.).
4. as medições in Vivo funcional
- Para medições espectroscópicas EPR, anestesia os ratos por inalação de ar-isoflurano mistura usando uma máquina de anestesia conforme descrito na etapa 3.3.1.
- Realize medições funcionais usando o espectrômetro de EPR L-band (1.2 GHz) como segue.
- Coloque o ressonador de bobina de superfície em uma glândula mamária normal ou um tumor mamário e sintonizar o espectrômetro.
- Adquira os espectros EPR da sonda partículas implantado para min 5−10 por várias semanas após o implante. No caso de sondas solúveis, adquira os espectros EPR imediatamente após a injeção de sonda por 5-10 min.
- Analise os espectros EPR da sonda para encontrar o hyperfine dividindo, umNe a amplitude do sinal, I(t) NR. Converta o valor de umN para o valor de pH utilizando a curva de calibração obtida na etapa 1.2.4. Analisar a taxa de decaimento da amplitude sinal I(t) como mudança relativa da amplitude inicial, I(t = 0), calculada em unidades arbitrárias por segundo (s-1).
- Ajuste o aumento do componente monoradical do espectro da sonda RSSR GSH-sensíveis para o monoexponents para obter a constante de tempo da cinética exponencial para calcular a concentração de GSH EPR.
- Encaixe os espectros EPR de componente de alta-campo da sonda multifuncional esperança àqueles experimentais como descrito em (etapa 1.4.5) para produzir os valores de pH, pO2 e Pi.
5. análise estatística
- Execute o processamento de dados e análises estatísticas. Use o teste de correlação de Pearson, um r (para conjuntos de dados normalmente distribuídos) e a correlação de ordem Rank do Spearman (para datasets com normalidade rejeitada da distribuição de dados) para análises de correlação.
Resultados
Tecido p O 2 Sondas de avaliação usando o LiNc-BuO:
Usando o procedimento descrito no passo 1.1, realizamos a calibração da suspensão de microcristais de LiNc-BuO preparado na hora. A Figura 2 mostra a dependência de oxigênio típico do linewidth da sonda o LiNc-BuO, bem como seus espectro...
Discussão
Os métodos apresentados permitem avaliação não-invasiva em vivo dos parâmetros críticos da TME a química, ou seja pO2, pH, redox status e concentrações de GSH intracelular e intersticial Pi. Técnicas de ressonância magnética, como MRI e baixo-campo EPR, são os métodos de escolha para não-invasiva na vivo perfis desses parâmetros de TME. MRI visualiza estruturas anatômicas, mas carece de sensibilidade funcional. Em contraste com MRI, técnicas EPR fornecem sensibilida...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este trabalho foi parcialmente financiado pelo NIH concede CA194013, CA192064 e U54GM104942. O WVCTSI é reconhecida pela start-up para VVK, AB e TDE. Os autores Obrigado Dr. M. Gencheva e K. Steinberger para a assistência com os experimentos ilustrativos. O conteúdo é exclusivamente da responsabilidade dos autores e não representa necessariamente a opinião oficial do NIH.
Materiais
| Name | Company | Catalog Number | Comments |
| L-band EPR spectrometer | Magnettech, Germany | L-band (1.2 GHz) electron paramagnetic resonance (EPR) spectrometer for collection in vitro and in vivo spectra of paramagnetic molecules | |
| Temperature & Gas Controller | Noxygen, Germany | Temperature & Gas Controller designed to control and adjust the temperature and gas composition | |
| Sonicator | Fisher Scientific | ||
| GSH (L-Glutathione reduced) | Sigma-Aldrich | G4251 | |
| MMTV-PyMT mice | In house | ||
| DMEM | Thermo Fisher Scientific | 11995065 | |
| Met-1 murine breast cancer cells | In house | ||
| C57Bl/6 wild type mice | Jackson Laboratory | ||
| Trypsin | Thermo Fisher Scientific | 25200056 | |
| Trypan Blue Exclusion Dye | Thermo Fisher Scientific | T10282 | |
| Ohmeda Fluotec 3 | |||
| Isoflurane (IsoFlo) | Abbott Laboratories | ||
| Sodium phosphate dibasic | Sigma-Aldrich | S9763 | |
| Sodium phosphate monobasic | sigma-Aldrich | S07051 | |
| Sodium Chloride | sigma-Aldrich | S7653 | |
| Hydrochloric acid | sigma-Aldrich | 320331 | |
| Sodium Hydroxide | sigma-Aldrich | S8045 | |
| Glucose | sigma-Aldrich | ||
| Glucose oxydase | sigma-Aldrich | ||
| Lauda Circulator E100 | Lauda-Brikmann | ||
| pH meter Orion | Thermo Scientific | ||
| LiNc-BuO probe | In house | The Octa-n-Butoxy-Naphthalocyanine probe was synthesizided according to ref 13 | |
| NR probe | In house | The Nitroxide probe was synthesizided according to ref 11 | |
| RSSR probe | In house | The di-Nitroxide probe was synthesizided according to ref 15 | |
| HOPE probe | In house | The monophoshonated Triarylmethyl probe was synthesizided according to ref 12 |
Referências
- Siemann, D. W. . Tumor Microenvironment. , (2011).
- Tatum, J. L., et al. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82 (10), 699-757 (2006).
- Brahimi-Horn, M. C., Chiche, J., Pouyssegur, J. Hypoxia signalling controls metabolic demand. Curr Opin Cell Biol. 19 (2), 223-229 (2007).
- Haulica, A., Ababei, L. Comparative study of glycolytic activity in the erythrocytes of animals with chronic experimental hypoxia and with tumours. Neoplasma. 21 (1), 29-35 (1974).
- Matsumoto, K., et al. High-resolution mapping of tumor redox status by magnetic resonance imaging using nitroxides as redox-sensitive contrast agents. Clin Cancer Res. 12 (8), 2455-2462 (2006).
- Estrela, J. M., Ortega, A., Obrador, E. Glutathione in cancer biology and therapy. Crit Rev Clin Lab Sci. 43 (2), 143-181 (2006).
- Voegtlin, C., Thompson, J. W. Glutathione content of tumor animals. J. Biol. Chem. 70, 801-806 (1926).
- Bobko, A. A., et al. Interstitial Inorganic Phosphate as a Tumor Microenvironment Marker for Tumor Progression. Sci Rep. 7, 41233 (2017).
- Gillies, R. J., Raghunand, N., Garcia-Martin, M. L., Gatenby, R. A. pH imaging. A review of pH measurement methods and applications in cancers. IEEE Eng Med Biol Mag. 23 (5), 57-64 (2004).
- Gade, T. P., et al. Imaging intratumoral convection: pressure-dependent enhancement in chemotherapeutic delivery to solid tumors. Clin Cancer Res. 15 (1), 247-255 (2009).
- Bobko, A. A., et al. In vivo monitoring of pH, redox status, and glutathione using L-band EPR for assessment of therapeutic effectiveness in solid tumors. Magn Reson Med. 67, 1827-1836 (2012).
- Dhimitruka, I., Bobko, A. A., Eubank, T. D., Komarov, D. A., Khramtsov, V. V. Phosphonated Trityl Probe for Concurrent In Vivo Tissue Oxygen and pH Monitoring Using EPR-based Techniques. JACS. 135, 5904-5910 (2013).
- Pandian, R. P., Parinandi, N. L., Ilangovan, G., Zweier, J. L., Kuppusamy, P. Novel particulate spin probe for targeted determination of oxygen in cells and tissues. Free Radic Biol Med. 35 (9), 1138-1148 (2003).
- Bobko, A. A., Evans, J., Denko, N. C., Khramtsov, V. V. Concurrent Longitudinal EPR Monitoring of Tissue Oxygenation, Acidosis, and Reducing Capacity in Mouse Xenograft Tumor Models. Cell Biochem Biophys. 75, 247-253 (2017).
- Khramtsov, V. V., Yelinova, V. I., Glazachev Yu, I., Reznikov, V. A., Zimmer, G. Quantitative determination and reversible modification of thiols using imidazolidine biradical disulfide label. J Biochem Biophys Methods. 35 (2), 115-128 (1997).
- Roshchupkina, G. I., et al. In vivo EPR measurement of glutathione in tumor-bearing mice using improved disulfide biradical probe. Free Rad. Biol. Med. 45, 312-320 (2008).
- Khramtsov, V. V., Zweier, J. L., Hicks, R. . Stable Radicals: Fundamentals and Applied Aspects of Odd-Electron Compounds. , 537-566 (2010).
- Bobko, A. A., Dhimitruka, I., Zweier, J. L., Khramtsov, V. V. Fourier Transform EPR of Trityl Radicals for Multifunctional Assessment of Chemical Microenvironment). Angew. Chem. Int. Edit. 53, 2735-2738 (2014).
- Martin, M. L., Martin, G. J., Delpuech, J. J. . Practical NMR spectroscopy. , (1980).
- Lin, E. Y., et al. Progression to malignancy in the polyoma middle T oncoprotein mouse breast cancer model provides a reliable model for human diseases. Am J Pathol. 163 (5), 2113-2126 (2003).
- Eubank, T. D., et al. Granulocyte macrophage colony-stimulating factor inhibits breast cancer growth and metastasis by invoking an anti-angiogenic program in tumor-educated macrophages. Cancer Res. 69 (5), 2133-2140 (2009).
- Khramtsov, V. V., et al. Quantitative determination of SH groups in low- and high-molecular-weight compounds by an electron spin resonance method. Anal Biochem. 182 (1), 58-63 (1989).
- Komarov, D. A., et al. Electron paramagnetic resonance monitoring of ischemia-induced myocardial oxygen depletion and acidosis in isolated rat hearts using soluble paramagnetic probes. Magnetic Resonance in Medicine. 68 (2), 649-655 (2012).
- Song, Y. G., Liu, Y. P., Liu, W. B., Villamena, F. A., Zweier, J. L. Characterization of the binding of the Finland trityl radical with bovine serum albumin. Rsc Advances. 4 (88), 47649-47656 (2014).
- Khramtsov, V. V., Bobko, A. A., Tseytlin, M., Driesschaert, B. Exchange Phenomena in the Electron Paramagnetic Resonance Spectra of the Nitroxyl and Trityl Radicals: Multifunctional Spectroscopy and Imaging of Local Chemical Microenvironment. Analyt. Chem. 89 (9), 4758-4771 (2017).
- Samouilov, A., et al. In Vivo Proton-Electron Double-Resonance Imaging of Extracellular Tumor pH Using an Advanced Nitroxide Probe. Analyt. Chem. 86 (2), 1045-1052 (2014).
- Goodwin, J., et al. In vivo tumour extracellular pH monitoring using electron paramagnetic resonance: the effect of X-ray irradiation. NMR Biomed. 27 (4), 453-458 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados