Method Article
Simples geração de uma cultura de alto rendimento de neurônios induzidas de fibroblastos de pele humana adulta
Neste Artigo
Resumo
Reprogramação neuronal direta gera neurônios que mantêm a idade da célula somática inicial. Aqui, descrevemos um método baseado em vetor único para gerar neurônios induzidos de fibroblastos dérmicos obtidos de doadores humanos adultos.
Resumo
Neurônios induzidos (iNs), o produto das células somáticas convertidos diretamente para os neurônios, são uma maneira de obter os neurônios paciente-derivado de tecido que é facilmente acessível. Através desta rota, neurônios maduros podem ser obtidos em questão de poucas semanas. Aqui, descrevemos um protocolo em uma etapa simples e rápida para obter iNs de fibroblastos dérmicos, obtidos através de amostras de biópsia de doadores humanos adultos. Vamos explicar cada passo do processo, incluindo a manutenção de fibroblastos dérmicos, o procedimento de congelamento para construir um estoque da linha celular, semeadura de células para reprogramação, bem como as condições de cultura durante o processo de conversão. Além disso, descrevemos a preparação de lamelas de vidro para gravações eletrofisiológicas, condições de revestimento a longo prazo e célula de fluorescência ativada classificação (FACS). Também ilustramos exemplos dos resultados esperado. O protocolo descrito aqui é fácil de executar e podem ser aplicada ao ser humano de fibroblastos derivados de biópsias de pele humana de pacientes com vários diagnósticos diferentes e idades. Este protocolo gera uma quantidade suficiente de iNs que pode ser usado para uma ampla gama de aplicações biomédicas, incluindo modelagem de doença, triagem de drogas e validação do alvo.
Introdução
Desenvolvimento de tratamentos eficazes para doenças neurológicas foram dificultados pelo acesso limitado para as células do cérebro humano vivas para realizar estudos mecanicistas e ensaios funcionais. Há cerca de uma década, esta situação mudou radicalmente com o desenvolvimento de pluripotentes induzidas (iPSCs) da pilha de haste tecnologia1,2. Isto, combinado com uma melhor compreensão dos mecanismos de diferenciação neural ocorrendo durante o desenvolvimento humano normal, tem permitido a geração de definidos e diversos subtipos neuronais do material específico de paciente e doença. Com tal material, agora é possível estudar mecanismos intracelulares subjacentes doenças neurológicas e o potencial de diferentes compostos para aliviar essas características patológicas3.
Enquanto iPSCs foram revolucionárias para o campo da neurociência, uma grande desvantagem destas células é que sua assinatura de envelhecimento é apagada durante o processo de reprogramação de tal forma que o neurônio rejuvenescido não retém a vulnerabilidade associada 4,5,6do envelhecimento. Esta característica particular dos neurônios que são produzidos pode acabar sendo crítico para sintetizando muitos aspectos da cascata patogénico intracelular, particularmente no caso das doenças para as quais a velhice é um importante fator de risco.
Direto reprogramação neural é uma tecnologia onde uma célula somática é diretamente convertida em um em sem passar por um pluripotentes intermediário estágio. Isto permite a rápida geração de neurônios humanos em vitro que pode ser paciente e doença específica. Uma característica notável de reprogramação direta é que a idade inicial da célula doadora é mantida, e com isso, sua vulnerabilidade a envelhecimento processos tais como aumento da produção de estresse oxidativo4,7. Como resultado, iNs de pacientes com doenças neurológicas associadas ao envelhecimento, tais como a doença de Alzheimer e doença de Parkinson, são adequados para uma ampla gama de aplicações biomédicas, incluindo doença de modelagem, ensaios e estudos de toxicologia de despistagem de drogas .
A principal ressalva que impediu o iNs de pacientes com doenças neurodegenerativas sendo amplamente utilizadas é que eles não são fáceis reprogramar, e isso se torna ainda mais difícil com a expansão dos fibroblastos. Como resultado, a geração de células em quantidades necessárias para esses tipos de aplicativos não foi alcançada até recentemente apenas8. Agora, nós desenvolvemos um método simples para reprogramar os fibroblastos de doadores de qualquer idade de forma muito eficiente. Esse método combina a expressão forçada dos fatores de transcrição neuronal, Ascl1 e Brn2 com um nocaute do repressor proteína RE1-silenciar transcrição fator (resto) usando um único vetor. Aqui, descrevemos as etapas diferentes, levando à geração de iNs convertido a partir de fibroblastos da pele biopsiados de doadores idosos.
Protocolo
Fibroblastos dérmicos adultos foram obtidos a partir da investigação da doença de Parkinson e a doença de Huntington clínicas no centro John van Geest para reparação do cérebro (Cambridge, UK) e usados sob aprovação ética local (REC 09/H0311/88). Para obter detalhes sobre o procedimento de amostragem de biópsia de pele, consulte referência8.
1. preparação dos fibroblastos da pele para reprogramação
- Usando uma célula automatizada de descongelar o sistema ou banho maria a 37 ° C, descongelar os fibroblastos dérmicos humanos adultos (aHDFs) e 200.000 por balão T75 (contagem com um contador automatizado de células) em 10 mL de meio de fibroblasto da placa (ver tabela 1) a 37 ° C em 5% CO2.
- Realizar uma mudança completa de médio com médio de fibroblasto no dia seguinte.
- Altere o meio de fibroblasto cada 3-4 dias até as células atinjam a confluência de 95%.
Nota: Um frasco confluente conterá cerca de 1.000.000 de células. O aHDFs pode ser congelado para construir um estoque da linha celular (secção 2) ou directamente re-chapeado pronto para reprogramação (secção 3).
2. congelamento dos fibroblastos da pele
- Coloque um recipiente de congelamento taxa controlada em uma caixa com gelo ou em geladeira a 4 ° C.
- Dissocia as células com tripsina 0,05% (1,5 mL por frasco T75) a 37 ° C por 3 – 5 min.
- Adicione meio de fibroblasto (contendo soro fetal bovino (FBS)), para neutralizar a tripsina (3ml por descarga por balão T75) e coletar as células isoladas em um tubo de 15 mL, nivelando para fora das células no frasco duas vezes.
- Contar as células usando o contador de célula automatizada; congelamento (recomendado) aproximadamente 500.000 aHDFs por frasco.
- Gire para baixo as células a 400 x g por 5 min.
- Ressuspender as células em 1 mL de meio de congelação (ver tabela 1) e a transferência para o tubo criogênico. Coloque os tubos directamente dentro do recipiente de congelamento controlado-taxa.
- Armazene a taxa controlada congelando aparelhos a-80 ° C durante a noite. No dia seguinte, os tubos de transferência para um freezer de-140 º C e armazenar até ser necessário.
3. chapeamento para reprogramação (1 dia)
Nota: É recomendável usar um revestimento de gelatina para experimentos de curto prazo (até 30 dias); Como alternativa, para experimentos de longo prazo é aconselhável começar em um poli-L-ornitina, fibronectina e laminina (PFL) revestimento.
- 60 min antes do chapeamento do aHDFs para reprogramação, revestir uma placa de 24 com 0.1% de gelatina (250 µ l/poço) e incubar a 37 ° C.
- Aspire o meio de fibroblasto sobre o aHDFs. Lave uma vez com DPBS. Dissocia as células com tripsina 0,05% (1,5 mL por frasco T75) a 37 ° C por 3 – 5 min.
- Adicione meio de fibroblasto para neutralizar a tripsina (3ml por descarga por balão T75) e coletar as células isoladas em um tubo de 15 mL, nivelando para fora das células no frasco duas vezes.
- Gire para baixo as células a 400 x g por 5 min. Discard sobrenadante e ressuspender as células em 1 mL de meio de fibroblasto.
- Conte as células usando um contador de célula automatizada (para garantir uma boa qualidade conversão Verifique a viabilidade celular é superior a 90% com trypan azul coloração).
- Para uma placa de 24 completa, prepare uma suspensão de 1.320.000 células em 13,2 mL do meio de fibroblasto para conseguir uma suspensão de 100.000 células/mL de meio (ou 55.000 células/poço em 550 µ l de meio de fibroblasto, multiplicado pelo número de poços necessários).
- Aspirar a gelatina do prato e lavar duas vezes com DPBS. Adicionar 500 µ l de suspensão de células a cada poço e incubar durante uma noite a 37 ° C em 5% CO2.
4. viral transdução (dia 0)
Nota: Trabalhar com particulas de Lentivirus requer equipamento de categoria 2 e o uso de um agente para neutralizar o vírus. Usar dois pares de luvas é também altamente recomendável.
- Aquecer a 13,2 mL do meio de fibroblasto 37 ° c.
- Descongele um vetor de Lentivirus contendo os fatores de transcrição, Ascl1 e Brn2 com grampo de cabelo curto dois RNAs (shRNA) visando o resto à temperatura ambiente.
Nota: Consulte para fazer referência a8; a construção está disponível em um repositório do plasmídeo. Para obter detalhes sobre o procedimento para produzir lentivírus consulte referência9. - Adicione o volume necessário de lentivirus para infectar o aHDFs na multiplicidade de infecção (MOI) 20 ao meio sem qualquer potenciadores de transdução.
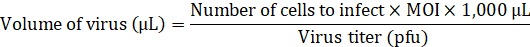
- Substituir a medium em 24 a placa com meio de fibroblasto contendo o vetor de Lentivirus (500 µ l/poço) e incubar durante uma noite a 37 ° C em 5% CO2.
- No dia seguinte, substitua o medium em poços com meio de fibroblasto fresco sem o vetor de Lentivirus.
Nota: O meio é considerado infeccioso por 7 dias e como tal, uma protecção adequada e procedimentos de manipulação devem ser usados durante a primeira semana após transdução viral.
5. manutenção das células de conversão
Nota: Uma vez que a conversão começa células são suscetíveis a elevação; Cuide-se a ponta da placa e usar uma pipeta µ l 1.000 quando remover mídia para evitar células desanexação.
- No dia 3, remover o meio de fibroblasto e adicione 500 µ l de meio neuronal conversão inicial (ver tabela 1).
- Duas a três vezes por semana, tire 225 µ l de meio velho do poço e adicionar-em 250 µ l de meio fresco de conversão neuronal precoce.
- No dia 18, remover todo o meio de cada poço e substituir com 500 µ l de meio atrasado de conversão neuronal (ver tabela 1).
- Continue a mudar metade do meio como acima com atraso médio de conversão neuronal cada 2-3 dias até o dia 25 ou ponto de extremidade do experimento (figura 1A).
Nota: Se as células não são banhadas em cada poço para o experimento, encha poços vazios com PBS ou água para evitar a evaporação evidente do meio e minimizar a variação entre poços.
| Concentração das ações | Trabalho de concentração | |
| Médio de fibroblasto | ||
| Meio basal | N/A | N/A |
| Penicilina/estreptomicina | 10.000 U/mL | 100 mg/mL |
| FBS | N/A | 10% |
| Meio de congelação | ||
| Médio de fibroblasto | N/A | 45% |
| FBS | N/A | 45% |
| DMSO | N/A | 10% |
| Meio de conversão neuronal inicial (ENM) | ||
| Meio de diferenciação neural | N/A | N/A |
| Penicilina/estreptomicina | 10.000 U/mL | 100 mg/mL |
| CHIR99021 | 10 mM | 2 ΜM |
| SB-431542 | 20 mM | 10 ΜM |
| Cabeça | 100 µ g/mL | 0,5 µ g/mL |
| LDN-1931189 | 10 mM | 0,5 ΜM |
| VPA | 1 M | 1 mM |
| LM-22A4 | 20 mM | 2 ΜM |
| GDNF | 20 µ g/mL | 2 ng/mL |
| NT3 | 10 µ g/mL | 10 ng / µ l |
| DB-cAMP | 50 mM | 0.5 mM |
| Atraso médio de conversão neuronal (MNL) | ||
| Meio de diferenciação neural | N/A | N/A |
| Penicilina/estreptomicina | 10.000 U/mL | 100 mg/mL |
| LM-22A4 | 20 mM | 2 ΜM |
| GDNF | 20 µ g/mL | 2 ng/mL |
| NT3 | 10 µ g/mL | 10 ng / µ l |
| DB-cAMP | 50 mM | 0.5 mM |
| Buffer de FACS | ||
| HBSS 1 x [- cálcio, magnésio, - vermelho de fenol] | N/A | N/A |
| BSA | N/A | 1% |
| DNAase | N/A | 0,05% |
Tabela 1: composição dos diferentes meios de comunicação utilizados. Descrição completa da composição para todas as mídias necessárias no presente protocolo, incluindo meio de fibroblasto, congelando a meio, meio neuronal conversão inicial, atraso médio de conversão neuronal e buffer de FACS.
6. vidro lamelas para gravações eletrofisiológicas
Nota: Recomenda-se usar um jaleco, óculos de proteção, luvas o dobro e concluir todo o trabalho em uma coifa. Este protocolo é adaptado a partir de 10.
- Coloque as lamelas de vidro no fundo de um prato de vidro sem sobreposição.
- Adicione o laboratório geral limpeza detergente para submergir todas as lamelas sem arriscar estouro durante a agitação (aproximadamente 30 mL). Coloque em um agitador orbital em velocidade lenta por 2 h.
- Lave seis vezes (30 min cada) com água destilada esterilizada.
- Adicione etanol a 95% por 2 h.
- Remover o etanol e esperar até que as lamelas são secas.
- Uma vez seco, transferir as lamelas para um copo de vidro e adicionar ácido nítrico 70% até as lamelas são submergidas.
- Coloca o copo de vidro em um banho do sonicador por 60 min.
- Remover o ácido nítrico e lavar três vezes com água destilada esterilizada.
Cuidado: Sempre adicione ácido à água, nunca o contrário como isto pode levar a uma reação violenta. - Retire o copo possível tanta água e adicione ácido clorídrico concentrado (HCI), até que as lamelas são submersos; Agite o recipiente e cubra com filme de parafina.
- Proceda à sonicação durante 60 min (50 – 60 Hz, 30 W).
- Remova tanto HCI de lamelas quanto possível e o lugar em um caixote do lixo apropriado. Enxágue com água deionizada esterilizada duas vezes.
- Pegue as lamelas fora do bairro e enxaguar 20 vezes (ou mais) com água destilada esterilizada, até que todos o HCI é removido.
- Uma vez seco, coloque as lamelas em placas de 24 poços estéril.
- Coloca as placas sob radiação ultravioleta (UV) luz durante a noite. No dia seguinte, as lamelas são prontas para usar.
Nota: Se as lamelas de vidro estão sendo usadas, é recomendável usar o revestimento do PFL. Simplesmente coloque uma lamela em cada poço de uma placa de 24 (usando pinça estéril) e a seguir o protocolo como abaixo.
7. PFL revestimento para cultura de longo prazo
- Revestir a placa de 24 com poli-L-ornitina (500 µ l/poço) e deixar durante a noite a 37 ° C em 5% CO2.
- Aspirar o poli-L-ornitina e esperar até que esteja seco o suficiente a forma gotas por cima.
- Faça uma gota (cerca de 60 µ l) de laminina, no centro de cada bem e espalhar para cobrir toda a superfície da lamela. Deixe por 2 h 45 min a 37 ° C em 5% de CO2.
- Lavar três vezes com DPBS.
- Adicionar fibronectina (500 µ l/poço) e deixar durante a noite a 37 ° C em 5% CO2.
- Lave uma vez com DPBS antes de adicionar as células.
Nota: O revestimento do PFL pode ser usado para longo prazo culturas de iNs (mais de 100 dias), embora a morte celular progressiva é de se esperar de dia 30.
8. FACS
Nota: Para re-placa das células após FACS classificação preparar uma placa PFL-revestida 48 h com antecedência. As células podem ser classificadas usando um anticorpo de molécula (NCAM) de adesão de célula neural do dia 20 em diante após transdução.
- Remova a mídia com uma pipeta de 1.000 µ l (não lavar para evitar a desanexação de células).
- Adicionar células dissociando agente (250 µ l/poço), deixar por 10-20 min até o elevador de células e flutuam como células únicas.
- Durante este tempo prepare o buffer de FACS.
- Triture suavemente com uma pipeta de 1.000 µ l. Se permanecerem alguns aglomerados, incube um pouco mais.
- Uma vez obtida uma suspensão de célula única, removê-lo do poço e colocar em um tubo de 1,5 mL.
- Expulsar o bem duas vezes com atraso médio de conversão neuronal e coloque no tubo de 1,5 mL mesmo.
- Spin para baixo a 400 x g por 5 min e descartar o sobrenadante.
- Ressuspender as células em 200 µ l de tampão de FACS.
- Gire para baixo as células a 400 x g por 5 min e descartar o sobrenadante.
- Repita os passos de 8,8 e 8,9 duas vezes.
- Ressuspender as células em 50 µ l de tampão de FACS contendo anticorpo humano de CD56 (NCAM) em uma concentração de 01:50 por 15 min no gelo. Protege da luz.
- Gire para baixo as células a 400 x g por 5 min.
- Resuspenda em buffer de FACS 200 µ l de lavar e spin para baixo as células a 400 x g por 5 min.
- Repita a etapa 8.13.
- Resuspenda em 200 µ l de tampão de FACS contendo iodeto de propidium (PI; 10 µ g/mL). Classificar o NCAM positivo (iNs) e PI negativo (ao vivo) as células usando FACS pelo gating baseia-se o nível de intensidade de fluorescência das amostras de controle que não foram coradas com o anticorpo NCAM ou PI.
- Colete as células positivas NCAM em um tubo contendo meio tarde de conversão neuronal.
- Conte as células usando um contador de célula automatizada e re-placa, as células em uma densidade elevada (50.000 células/cm2) em meio de conversão neuronal atrasado em um prato PFL revestido.
- Continue a mudar metade do meio de 2 – 3 vezes por semana com atraso médio de conversão neuronal até o ponto de extremidade do experimento (figura 1A).
Resultados
Uma clara mudança na morfologia da célula deve ser visível a partir do dia 5 em diante (figura 1B). Alguma morte celular é de se esperar depois de transdução viral, embora não abertamente. De cada poço em uma placa de 24 um rendimento total de célula de 20.000-40.000 células deve ser esperado por dia 25, dos quais cerca de metade deveria ter se tornado os neurônios. É importante notar que o rendimento e pureza podem variar em toda linha de celular, bem como com lotes de vírus e estado de doença.
Células irão expressar marcadores neuronais mais padrão, incluindo MAP2 e TAU (Figura 1) no dia 25, além de expor uma morfologia neuronal madura. É possível conseguir um puro na população fazendo FACS baseia o marcador NCAM (ver referências8,,11). Células podem posteriormente ser também re-chapeadas no revestimento triplo PFL (ver referência10) ou directamente congelado para análises biomoleculares.
Se as células não são classificadas, imunofluorescência rotulagem com MAP2 ou TAU deve ser realizada para identificar as células convertidas com êxito e co rotulado com a proteína de interesse.

Figura 1: evolução da conversão ao longo do tempo. (A) linha do tempo do experimento e mapa da construção empacotado em um lentivirus usado para reprogramar os fibroblastos dérmicos humanos adultos. Cada seta preta representa uma mudança de média. (B) imagens de contraste de fase representativa representando as mudanças na morfologia das células durante o processo de conversão entre 0 de dia para dia 22 (conforme indicado no canto superior direito de cada painel). Imagens foram tiradas em um microscópio de contraste de fase com o objetivo de X 10. (C) imagem de imunofluorescência de um TAU e MAP2 dupla coloração na transdução pós dia 35. As células foram fixadas em paraformaldeído 4% e permeabilizadas com 0,1% Triton em DPBS por 10 min. células foram bloqueados por 30 min em uma solução de 5% de soro em DPBS. Os anticorpos foram diluídos em solução de bloqueio e aplicados durante a noite a 4 ° C. Anticorpos secundarios conjugados fluoróforo foram diluídos em solução de bloqueio e aplicados por 2 h. células foram counterstained com DAPI por 15 min, seguido de 3 lavagens com DPBS. Imagens foram tiradas em um microscópio de fluorescência invertido usando o objectivo X 20. Barras de escala = 100 µm (B, C). Abreviaturas: ENM: meio neuronal inicial; LNM: atraso médio neuronal. Clique aqui para ver uma versão maior desta figura.
Discussão
Esse vetor de one-step/uma reprogramação método fornece uma maneira eficiente para obter iNs de fibroblastos humanos adultos. Fibroblastos humanos adultos são normalmente muito mais difícil de secretas que fibroblastos fetais, com estudos limitados anteriormente relatando as eficiências de aproximadamente 5-10%12,13. No entanto, com este novo protocolo é possível alcançar um rendimento neuronal (medido como células MAP2 +) de aproximadamente 50%8. Além disso, nosso protocolo pode ser usado em fibroblastos dérmicos que têm sido passados várias vezes sem perder a eficiência de conversão. Até agora temos usado células passadas até 14 vezes sem detectar qualquer diminuição na eficiência de conversão. Além disso, não há nenhuma diferença em eficiência em nossas mãos com fibroblastos de doadores de idade entre 52 e 87 de reprogramação. Para obter mais detalhes sobre a idade e a doença de outras linhas celulares testados com essa construção consulte referência8. Outros estudos não relataram também nenhuma diferença na eficiência de conversão usando um protocolo Lentivirus baseado e pequeno molécula aprimorado com doadores entre 0 e 89 anos4. Além disso, a aplicabilidade consistente com reprogramação neuronal miRNA-baseado tem sido relatada em fibroblastos de todas as idades, com doadores entre 0 e 86 anos7. Através desta rota, neurônios maduros podem ser obtidos em aproximadamente 12 a 15 semanas em vitro ou aproximadamente 8 semanas após o transplante no vivo8. Isto é vantajoso porque dá acesso ao paciente e doença específica iNs humana de tecido que é facilmente acessível. Embora este protocolo é eficiente, não produzirá um rendimento de 100% neuronal, e como tal, é necessária uma etapa de purificação usando FACS por exemplo.
O passo mais crítico no âmbito do presente protocolo é transdução viral (protocolo seção 4). É crucial que o título do vírus é preciso, além de ter banhado um número exato de aHDFs para a conversão. O título recomendado para uso com este protocolo é entre 4 x 108 e 4 x 109. Usar um título de qualquer coisa abaixo de 1 x 108 não ia ser recomendado como uma adição de grandes volumes de vírus será tóxicos para as células. Além disso, como os fibroblastos começam a secreta para iNs se tornarão mais frágeis e suscetíveis a elevação. É essencial para ser suave quando se muda a mídia para não perturbar as células demais. Isso pode ser feito removendo o líquido lentamente com uma pipeta de 1.000 µ l. Finalmente, quando o chapeamento para reprogramação (protocolo seção 3) é importante garantir uma população saudável de fibroblastos antes de iniciar um experimento; Isto é indicado por uma viabilidade celular de mais de 90%, com coloração azul trypan. O aHDFs deve sempre ser passado antes de chegar a confluência de 95%.
Se há morte celular perceptível antes de transdução viral, não iniciar a conversão: Verifique que a viabilidade celular é acima de 90% e que não houve problemas com o revestimento da placa. Espera-se que tem uma pequena quantidade de morte celular após transdução viral, no entanto, isto não deve ser significativo. Neste caso, confirmar a semeadura precisa de 50.000 aHDFs/poço e verificar a concentração de vírus. Se houver inconsistência perceptível entre poços durante a conversão, primeiro verifique que cada poço contém uma quantidade igual de mídia e evaporação evidente não está ocorrendo nas bordas (se necessário mídia extra pode ser adicionada aos poços de borda). Como alternativa, verifique passo 4.4 e certifique-se de uma mistura apropriada para uma suspensão homogênea quando transducing. É crucial adicionar o lentivirus ao meio primeiro, antes de adicionar esta nos poços. Diretamente, adicionando lentivirus nos poços irá aumentar a variabilidade de bem de bem e também é provável que seja tóxico para as células. Por último, verifique sempre que o meio é aquecido a 37 ° C antes de adicionar as células.
Este protocolo inclui seções opcionais para condições de revestimento de longo termo cultura do iNs e FACS classificação para aumentar a pureza neuronal. Para experimentos que pretendem investigar a caracterização funcional de iNs, um protocolo para a preparação de lamelas de vidro para eletrofisiologia também foi incluído. O protocolo de conversão aqui está configurado para uso com uma placa de 24; se desejado, isto pode ser modificado para um 6, 12, 48-, placa de 96 poços ou frascos. Neste caso, por favor, ajuste todos os volumes para a área da superfície da placa ou do balão utilizado.
Este protocolo utiliza a expressão forçada de Ascl1 e Brn2 em combinação com um nocaute de resto todos embalados em um único vetor8 para gerar iNs de um fenótipo pan-neuronal. A geração de qualquer subtipos gliais com este método, no entanto, não foi avaliado. Esse método, portanto, precisa ser modificado para uso com outros fatores de reprogramação para obter subtipo específicos neurônios. A reprogramação direta tem mostrado anteriormente a possibilidade de gerar neurônios, neurônios sensoriais, fotorreceptores, neurônios de Proechimys médio striatal e de10,de neurônios dopaminérgicos14. Isto será benéfico na investigação de doenças neurológicas em qual subtipo específico neuronal são preferencialmente afetados, por exemplo a doença de Parkinson e neurônios dopaminérgicos.
Até muito recentemente, tecnologia de reprogramação neural direta não possibilitava a produção de iNs de forma padronizada e eficiente — a um nível que é exigido para a toxicologia e ensaios em grande escala de despistagem de drogas. Este novo método é muito eficiente e pode ser usado em fibroblastos que têm sido passados muitas vezes, tal que agora remove essas restrições e abre-se para uma vasta gama de estudos, não só em um sistema neural humano, mas também em um sistema que pode ser paciente específico. A simplicidade desta abordagem processa a tecnologia em acessível para todos os grupos querendo realizar estudos semelhantes em casa e pode ser facilmente usada não somente para aplicações biomédicas em larga escala, tais como o rastreio de drogas e ensaios de toxicologia, mas também para apoiar dados derivados de modelos animais e amostras de tecido humano post-mortem .
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Agradecemos a Marie Persson Vejgården para obter assistência técnica. A pesquisa que conduz a estes resultados recebeu financiamento da Fundação de células-tronco de Nova York, o Conselho Europeu de investigação no âmbito do sétimo programa-quadro da União Europeia: reparação de células-tronco Neuro FP/2007-2013 (n º 602278) e a Convenção de subvenção ERC não. 30971, o Conselho Sueco de pesquisa (conceder acordo 5624-521-2012, 2016-00873 e 70862601 / Bagadilico), Fundação de Parkinson sueco (Parkinsonfonden) e da área de investigação estratégica na Universidade de Lund Multipark (pesquisa multidisciplinar em Doença de Parkinson). Janelle Drouin-Ouellet é apoiado por uma bolsa de institutos canadenses da pesquisa saúde (CIHR) (#358492), e Roger Barker é suportado por uma bolsa de NIHR centro de investigação biomédica para a Universidade de Cambridge/Neuropsychologist do Hospital. Malin Parmar é um investigador de Robertson de fundação de células-tronco de Nova York. Shelby Shrigley é financiado pelo programa da União Europeia 2020 de horizonte (H2020-ACEM-ITN-2015) sob a rede de formação inovadora Marie Skłodowska-Curie e Grant acordo n. º 676408.
Materiais
| Name | Company | Catalog Number | Comments |
| Cell Lines | |||
| Adult human dermal fibroblasts | [C2 passage #7] Donor was a 67 year old female. Cells obtained from the Parkinson’s Disease Research and Huntington’s disease clinics at the John van Geest Centre for Brain Repair (Cambridge, UK). | ||
| Reagents for Fibroblast Culture, Transduction and Conversion | |||
| Dulbecco's phosphate-buffered saline (DPBS) [-CaCl2, -MgCl2] | Gibco | 14190094 | |
| Trypsin-EDTA [0.5%] | Gibco | 15400-054 | Dilute to 0.05% in DPBS. |
| Virkon (agent used to neutralize virus) | Viroderm | 7511 | Dilute to 1% solution with warm water. |
| Milli-Q Water | Millipore | ||
| Basal medium - Dulbecco’s Modified Eagle Medium (DMEM) + GlutaMax | Gibco | 61965059 | |
| Penicillin/Streptomycin [10,000 U/mL] | Gibco | 15140-122 | |
| Fetal Bovine Serum (FBS) | Gibco | 10270-106 | |
| CryoMACS® dimethyl sulfoxide (DMSO) 10 | Miltenyi | 170-076-303 | |
| Neural differentiation medium - NDiff 227 | Takara-Clontech | Y40002 | |
| LM-22A4 | Tocris | 4607 | Dilute 10 mg in 1450 µL DMSO. Stock concentration: 20 mM. |
| Glial cell line-derived neurotrophic factor (GDNF) [recombinant human] | R&D systems | 212-GD-010 | Dilute 10 ug in 500 µL 0,1% BSA in DPBS. Stock concentration: 20 µg/mL. |
| NT3 [recombinant human] | R&D systems | 267-N3-025 | Dilute 25 µg in 2,5 mL 0,1% BSA in DPBS. Stock concentration: 10 µg/mL. |
| db-cAMP | Sigma Aldrich | D0627 | Dilute 1 g in 40,7 mL Milli-Q water. Filter and make 500 µL aliquots or stock tubes of 10 mL. Stock concentration: 50 mM. |
| CHIR99021 | Axon | 1386 | Dilute 2 µg in 429,8 µL DMSO. Stock concentration: 10 mM. |
| SB-431542 | Axon | 1661 | Dilute 5 mg in 595 µL DMSO. Stock concentration: 20 mM. |
| Noggin [recombinant human] | Miltenyi | 130-103-456 | Dilute 100 µg in 100 µL of Milli-Q water + 900 µL 0,1% BSA in DPBS. Stock concentration: 100 µg/mL. |
| LDN-193189 | Axon | 1509 | Dilute 2 mg in 360 µL DMSO. Stock concentration: 10 mM. |
| Valproic acid sodium salt (VPA) | Merck Millipore | 676380 | Dilute 5 g in Milli-Q water to acheive a stock concentration of 1 M. CAUTION: Avoid ingestion, contact with skin, and breathing dust formation. |
| Reagents for Coatings | |||
| Gelatin | Sigma Aldrich | G2500 | Dilute to 0.1% in Milli-Q water. |
| Poly-L-ornithine | Sigma Aldrich | P3655 | Dissolve in Milli-Q water. Use at 15µg/mL. |
| Fibronectin | ThermoFisher Scientific | 33010-018 | 2 mL of Milli-Q water + 70 µL 0,25 M NaOH. Use at 5 µg/mL. |
| Laminin | ThermoFisher Scientific | 23017-015 | Store at -80°C. Thaw on ice, keep cool and aliquot 30 µL. Use at 5 µg/mL. |
| Reagents for Fluorescence Activated Cell Sorting | |||
| Cell dissociation agent - Accutase (Stem Pro) | ThermoFisher Scientific | A1110501 | |
| Hanks' Balanced Salt Solution (HBSS) 1X [-calcium, -magnesium, - phenol red] | ThermoFisher Scientific | 14175-046 | |
| Bovine Serum Albumin (BSA) | Sigma Aldrich | A2153 | Use at 1% concentration for Anti-Human CD56 (NCAM). |
| DNAase | Sigma Aldrich | DN-25 | Use at 0.05% concentration. |
| Anti-Human CD56 (NCAM) Antibody [Mouse] | BD Pharmingen | 555518 | Use at 1 : 50. |
| Propidium iodide | Sigma Aldrich | P4170 | Dilute to 1mg/mL in PBS and keep sterile. Use at 1:1000 to achieve a concentration of 10µg/mL. |
| Reagents for Glass Coverslips | |||
| Autoclaved deionized water | |||
| Alconox detergent | Sigma Aldrich | Z273228 | |
| Ethanol 95% | |||
| Nitric Acid | Sigma Aldrich | 438073-M | CAUTION: Concentrated nitric acid is highly corrosive, and its vapours are potentially harmful. |
| Concentrated hydrochloric acid (HCI) | CAUTION: Concentrated hydrochloric acid is highly corrosive, and its vapours are potentially harmful. | ||
| Reagents for Immunocytochemistry | |||
| Paraformaldehyde (PFA) | Merck Millipore | 1040051000 | Use at a concentration of 4%. CAUTION: PFA is a potent fixative. Avoid ingestion and contact with skin |
| Triton X-100 | Fisher Scientific | 10254640 | Use at a concentration of 0.1%. |
| Serum [Donkey] | Merck Millipore | S30-100ML | |
| Anti-MAP2 Antibody [Chicken] | Abcam | ab5392 | Use at a concentration of 1 : 5,000. |
| Tau HT7 Monoclonal Antibody [Mouse] | ThermoFisher Scientific | MN1000 | Use at a concentration of 1 : 500. |
| Cy3 Anti-Chicken Antibody [Donkey] | Jackson ImmunoResearch | 703-165-155 | Use at a concentration of 1 : 400. |
| Alexa Fluor488 Anti-Mouse Antibody [Donkey] | Jackson ImmunoResearch | 715-545-150 | Use at a concentration of 1 : 400. |
| 4′,6-Diamidine-2′-phenylindole dihydrochloride (DAPI) | Sigma Aldrich | D9542 | Reconstitute the powder in Milli-Q water to 1 mg/mL. Aliquot and store at -20°C, light sensitive. Use at a concentration of 1 : 500. |
| Equipment | |||
| T75 flask [Nunclon Delta Surface] | ThermoFisher Scientific | 156499 | |
| 24-well plate [Nunc] | ThermoFisher Scientific | 142485 | |
| 1.5 mL polypropylene tube | Sigma Aldrich | Z336769 | |
| 15 mL falcon tube | Sarstedt | 62.554.502 | |
| 50 mL falcon tube | Sarstedt | 62.547.254 | |
| CryoPure tube 1.6 mL | Sarstedt | 72.380 | |
| Pippette controller | For pipetting volumes 1-25 mL. | ||
| Sterile serological pipettes: 5, 10 and 25 mL | Sarstedt | 86.1253.001, 86.1254.001, 86.1685.001 | |
| Adjustable volume pipettors: 5, 20, 200, and 1,000 µL | |||
| Sterile pipette tips | For pipetting volumes of 0.5 - 1,000 µL. | ||
| Glass coverslips | NeuVitro | GG-12-1.5-oz | #1.5 thickness, 12mm diameter, 0.5oz, CE certified, fit 24 well plates. |
| Glass dish | Approximately 150mm diameter. | ||
| Glass beaker | Make sure to have an appropriate size beaker for the sonicator bath available. Water from the sonicator bath should not overflow into the glass beaker. | ||
| Parafilm M | VWR | ||
| ThawSTAR Automated Cell Thawing System | BioCision | BCS-601 | |
| Countess II Automated Cell Counter | ThermoFisher Scientific | AMQAX1000 | |
| Cell counting chambers [50 slides] and trypan blue [0.4%] | ThermoFisher Scientific | C10228 | For use with Countess II Automated Cell Counter. |
| CoolCell Cell LX Controlled-rate Freezing Container | Biocision | BCS-405 | |
| Laminar flow hood | |||
| Humidified 5% CO2 37 °C incubator | |||
| Centrifuge | Suitable for 1,5, 15 and 50 mL tubes. | ||
| Orbital shaker | |||
| Sonicator - Bransonic Model B200 cleaner | Sigma Aldrich | Z305359 | Frequency = 50-60Hz, Amplitude = 30 Watts |
| FACS Aria III cell sorter | BD Pharmingen | ||
| Phase contrast microscope | Olympus | CKX31 | |
| Inverted fluorescence microscope | Leica | DMI6000 B |
Referências
- Takahashi, K., Yamanaka, S. Induction of pluripotent stem cells from mouse embryonic and adult fibroblast cultures by defined factors. Cell. 126, 663-676 (2006).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131, 861-872 (2007).
- Avior, Y., Sagi, I., Benvenisty, N. Pluripotent stem cells in disease modelling and drug discovery. Nat Rev Mol Cell Biol. 17, 170-182 (2016).
- Mertens, J., et al. Directly Reprogrammed Human Neurons Retain Aging-Associated Transcriptomic Signatures and Reveal Age-Related Nucleocytoplasmic Defects. Cell Stem Cell. 17, 705-718 (2015).
- Hashizume, O., et al. Epigenetic regulation of the nuclear-coded GCAT and SHMT2 genes confers human age-associated mitochondrial respiration defects. Sci Rep. 5, 10434 (2015).
- Lapasset, L., et al. Rejuvenating senescent and centenarian human cells by reprogramming through the pluripotent state. Genes Dev. 25, 2248-2253 (2011).
- Huh, C. J., et al. Maintenance of age in human neurons generated by microRNA-based neuronal conversion of fibroblasts. Elife. 5, (2016).
- Drouin-Ouellet, J., et al. REST suppression mediates neural conversion of adult human fibroblasts via microRNA-dependent and -independent pathways. EMBO Mol Med. , (2017).
- Tiscornia, G., Singer, O., Verma, I. M. Production and purification of lentiviral vectors. Nat Protoc. 1, 241-245 (2006).
- Richner, M., Victor, M. B., Liu, Y., Abernathy, D., Yoo, A. S. MicroRNA-based conversion of human fibroblasts into striatal medium spiny neurons. Nat Protoc. 10, 1543-1555 (2015).
- Lau, S., Rylander Ottosson, D., Jakobsson, J., Parmar, M. Direct neural conversion from human fibroblasts using self-regulating and nonintegrating viral vectors. Cell Rep. 9, 1673-1680 (2014).
- Pfisterer, U., Wood, J., Nihlberg, K., Hallgren, O., Bjermer, L., Westergren -Thorsson, G., Lindvall, O., Parmar, M. Efficient induction of functional neurons from adult human fibroblasts. Cell Cycle. 10, 3311-3316 (2011).
- Caiazzo, M., Dell'Anno, M. T., Dvoretskova, E., Lazarevic, D., Taverna, S., Leo, D., Sotnikova, T. D., Menegon, A., Roncaglia, P., Colciago, G., Russo, G., Carninci, P., Pezzoli, G., Gainetdinov, R. R., Gustincich, S., Dityatev, A., Broccoli, V. Direct generation of functional dopaminergic neurons from mouse and human fibroblasts. Nature. 476, 224-227 (2011).
- Masserdotti, G., Gascón, S., Götz, M. Direct neuronal reprogramming: learning from and for development. Development. 143, 2494-2510 (2016).
- Pereira, M., Pfisterer, U., Rylander, D., Torper, O., Lau, S., Lundblad, M., Grealish, S., Parmar, M. Highly efficient generation of induced neurons from human fibroblasts that transplantation into the adult rat brain. Sci Rep. 4, 6330 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados