É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Protocolo experimental para o uso de drosófila como um sistema modelo invertebrados para testes de toxicidade em laboratório
Neste Artigo
Resumo
Neste trabalho, nós fornecemos um protocolo detalhado para expor a espécie do género Drosophila aos poluentes com o objetivo de estudar o impacto da exposição sobre uma gama de saídas fenotípicas em diferentes estádios de desenvolvimento e para mais de uma geração.
Resumo
Propriedades emergentes e fatores externos (população-ecossistema-nível e interações, em particular) desempenham um papel importante na mediação ecologicamente importantes pontos de extremidade, embora raramente são considerados em estudos toxicológicos. D. melanogaster está emergindo como um modelo de toxicologia para os impactos comportamentais, neurológicos e genéticos das substâncias tóxicas, para citar alguns. Mais importante, a espécie do género Drosophila pode ser utilizado como um sistema modelo para uma abordagem integrativa quadro para incorporar propriedades emergentes e responder perguntas ecologicamente relevantes na pesquisa de toxicologia. O objetivo deste trabalho é fornecer um protocolo para expor espécies do género Drosophila aos poluentes para ser usado como um sistema modelo para uma gama de saídas fenotípicas e perguntas ecologicamente relevantes. Mais especificamente, este protocolo pode ser usado para 1) link vários níveis biológicos de organização e compreender o impacto de substâncias tóxicas em ambos adequação do nível de indivíduo e população; 2) testar o impacto de substâncias tóxicas em diferentes estágios de desenvolvimento, exposição; 3) implicações de várias gerações e evolutiva teste de poluentes; e 4) testar vários contaminantes e estressores simultaneamente.
Introdução
Todos os anos, aproximadamente 1.000 novas substâncias químicas são introduzidas pela indústria química1,2; no entanto, os impactos ambientais de apenas uma pequena percentagem destes produtos químicos são testados antes de distribuição2,3. Apesar de catástrofes em grande escala são incomuns, exposição crônica e subletais de uma grande variedade de poluentes são difundidos em seres humanos e animais selvagens4,5. O foco histórico de Ecotoxicologia e toxicologia ambiental foi testar a letalidade, única exposição química, exposição aguda e os efeitos fisiológicos da exposição, como um meio de medir o impacto de poluentes na sobrevivência6, 7 , 8 , 9 , 10. embora não haja uma mudança no sentido éticas e não-invasiva de abordagens à experimentação animal, as abordagens atuais estão limitando por causa do papel esse desenvolvimento, propriedades emergentes e fatores externos (tais como o nível de população e interações do ecossistema-nível) jogam na mediação ecologicamente importantes pontos de extremidade8. Portanto, há uma necessidade de métodos que incorporem uma abordagem mais holística, sem sacrificar a vida selvagem e/ou vertebrados no laboratório.
Sistemas modelo de invertebrados, como Drosophila melanogaster, são uma alternativa atraente para abordar a necessidade de uma abordagem mais holística para testes de toxicidade. D. melanogaster, foi originalmente desenvolvido como um sistema modelo invertebrados para pesquisas genéticas relacionadas a humanos há um século atrás11. D. melanogaster agora é proeminentemente usada como uma alternativa de modelo de vertebrados por vários motivos: 1) a conservação de genes e vias entre d. melanogaster e humanos; 2) tempo de geração curto em relação aos modelos de vertebrados; 3) barato custo de manutenção; 4) facilidade na geração de tamanhos de amostra grande; e 5) pletora de fenotípica e ecologicamente-relevantes pontos de extremidade disponíveis para testes11,12,13,14,15,16,17 .
Vários laboratórios11,15,16,17,18,19,20,21,22, 23 , 24 , 25 estão usando d. melanogaster como uma alternativa de vertebrados modelo para testes de toxicidade para compreender os impactos da poluição sobre os seres humanos. Espécies selvagens locais de Drosophila podem ser utilizadas, também, como modelos de toxicidade para a vida selvagem (e humanos) responder ecologicamente-, comportamentalmente-e evolutivamente relevantes perguntas em vários níveis biológicos de organização. Utilizando espécies do género Drosophila como modelo, vários pontos de extremidade mensuráveis são possíveis11,15,16,18,19,20 ,21,22,23,24,25. In addition, usando o modelo de Drosophila , toxicologistas podem: 1) eticamente vincular os efeitos em vários níveis biológicos da organização; 2) incorporar o papel de fatores emergentes e desenvolvimento; 3) estudo ecologicamente importantes pontos de extremidade (além de medicamente importantes pontos de extremidade); 4) testar vários estressores simultaneamente; 5) e teste a longo prazo várias gerações (por exemplo, evolutiva e transgeracional) implicações de estressores. Portanto, usar drosófila como um sistema de modelo permite que uma multiplicidade de abordagens, que não se limitando a estudar abordagens mecanicistas com linhagens puras de d. melanogaster no laboratório.
Neste trabalho, apresentamos os métodos para criação e coletando drosófila para responder a várias questões toxicológicas. Mais especificamente, descrevemos a metodologia para 1) criação de Drosophila em meio misturado com um ou mais poluentes; 2) coletando Drosophila durante todo o desenvolvimento (por exemplo, vagando larvas de terceiro instar, casos pupal, recém-eclosed adultos e adultos); e 3) criação de Drosophila a médio contaminado teste intergeracional e transmissão transgeracional, bem como as implicações evolutivas de exposição tóxica a longo prazo. Usando este protocolo, anterior autores18,19,20,21,22,23,24,25 relataram diferentes efeitos fisiológicos, genéticos e comportamentais do desenvolvimento chumbo (Pb2 +) exposição. Este protocolo permite toxicologistas usar uma abordagem mais holística e toxicológica, que é essencial para a compreensão de como os poluentes são fatores de risco para os seres humanos e animais selvagens em um ambiente cada vez mais poluído.
Access restricted. Please log in or start a trial to view this content.
Protocolo
O seguinte é um protocolo experimental usado para trás espécies do gênero Drosophila no meio contaminado quando a ingestão oral de uma toxina é apropriada; outras formas de exposição são possíveis usando a drosófila modelo11,15,16,26. Os métodos descritos neste protocolo têm sido descritos anteriormente por Hirsch et al . 19 e Peterson et al . 23 , 24 , 25.
1. configurar ações populações de Drosophila em laboratório de pesquisa
- Configurar uma incubadora do ambiente controlado (ou pequena sala) para as populações de estoque de casa de Drosophila , definindo as incubadoras para uma temperatura constante, ciclo de luz: escuro e umidade, dependendo das preferências das espécies teste.
Nota: Condições ambientais preferenciais variará consoante a ecologia nativa da espécie escolhida para o estudo. Por exemplo, d. melanogaster é nativo de África subsahariana27 e é normalmente mantida em 25 ° C, ciclo de luz: escuro 12:12 e aproximadamente 60% umidade16,18,19,20 , 21 , 22 , 23 , 24 , 25 , 28 , 29 , 30. por outro lado, d. montana gama estende-se durante a maior parte do Canadá e E.U.A. centro-oeste, uma região muito mais fria; Portanto, d. montana é normalmente mantida em 19 – 20 ° C e, por vezes, um regime de 24 h de luz para simular condições durante a temporada de acasalamento31. Para uma descrição mais detalhada das escalas geográficas de diversas espécies de Drosophila, consulte os padrões de especiação de Drosophila site32. -
Obter uma espécie de drosófila preferida e/ou linha pura ou um centro de estoque (ver tabela de materiais), outro laboratório de pesquisa em cima do pedido, ou coletar selvagens, populações geneticamente variáveis do campo.
Nota: As etapas a seguir explicam os métodos para coletar as populações selvagens, geneticamente variáveis de drosófila para manter no laboratório de pesquisa. Esses métodos foram modificados de Markow e o ' Grady33 e Werner e Jaenike34 para recolher a maior diversidade de espécies de uma só vez, ao invés de espécies-alvo específico com uma fonte de isca.- Congelar a meia dúzia dezenas bananas maduras no congelador durante a noite e descongelar antes de definir a isca de armadilhas.
- Prepare vários L 1 – 2 garrafas plásticas cortando uma fenda em forma de u na parte da frente da garrafa para permitir moscas ser capturado na isca de garrafa e não escape. Cap as garrafas de plástico com suas tampas de garrafa, para que as moscas não escapar através de tampas.
- Adicione a banana descongelada para o fundo das garrafas para que o fundo das garrafas contém aproximadamente uma polegada de banana. Coloque uma fatia de tomate maduro na garrafa. Adicione uma pasta de levedura (fermento sobra do procedimento de fabricação de cerveja) para a banana no fundo da garrafa para que a banana fica de molho no chorume fermento.
- Varas de madeira (na posição vertical vertical) adicione ao frasco para que as moscas têm um substrato limpo a pisar longe do chorume de fermento e banana.
A Figura 1 ilustra o produto final desses métodos. - Pendurar a isca garrafas em árvores durante a noite e verificar que cada aspiração de boca de 24 h. voa de garrafas e coloque individualmente fêmeas em frascos com meio para criar linhas de iso-fêmea.
Nota: Multi femininas linhas podem ser criadas, no entanto, somente se as fêmeas de cada espécie podem ser claramente identificadas. Além disso, moscas do gênero Drosophila ocupam diferentes nichos ecológicos e terão diferentes necessidades dietéticas dependendo desses nichos (Werner e Jaenike34); Ver Werner e Jaenike34 para recomendações de dieta e receitas de comida. - Examine a prole de1 F adulta sob o microscópio de dissecação para identificar a espécie do coletados drosófila (ver Markow e o ' Grady33 e Werner e Jaenike34 para assistência na identificação de várias espécies ).

Figura 1 : Representação pictórica de armadilhas e isco usado para coletar as populações selvagens de Drosophila no domínio. (A) mosca armadilhas conjunto em um local do campo local no Colorado. (B) uma visão mais próxima da mosca armadilhas conjunto neste site de campo. Clique aqui para ver uma versão maior desta figura.
- Manter a iso-fêmea ou as linhas multi femininas em uma incubadora do ambiente controlado ou quarto com temperatura constante, ciclo de luz: escuro e umidade. Para fazer isso, casa voa em frascos ou garrafas no preferido médio e permitir que as fêmeas gravid para pôr ovos no meio. Monitore os frascos para a presença de larvas e pupas.
Nota: Moscas do gênero Drosophila ocupam nichos ecológicos diferentes e terão diferentes necessidades dietéticas e ambientais abióticas preferências dependendo desses nichos33,34. Preferências ambientais e recomendações dietéticas (e novas instruções sobre criação de voar) podem ser encontrados em Elgin e Miller28, Shaffer et al. 29, stocker e Gallant30, Markow e o ' Grady33e Werner e Jaenike34. Se usando espécies selvagens capturados, condições ambientais locais podem ser simuladas nas incubadoras até que as espécies podem ser identificadas. - Transferir ações frequentemente para meio fresco, descartando antigos frascos, para manter as linhas saudáveis e evitar a infecção de ácaros.
Nota: A frequência da transferência dependerá do ciclo de vida das espécies. Por exemplo, transferi Drosophila melanogaster a cada duas semanas para o meio fresco. Para mais informações sobre manutenção de linhas em laboratório, ver Rand et al. 16, Elgin e Miller28, Shaffer et al. 29, stocker e Gallant30, Greenspan35e educação científica36do banco de dados.
2. traseira drosófila no meio contaminado
Nota: Se testando drosófila em laboratório pela primeira vez ou com uma nova contaminant(s), identificar a dose letal (ver Castaneda et al 37 e Massie et al 38 para métodos) e a DL50 (ver Castaneda et al. 37 e Akins et al. 39 para métodos) primeiro. Em seguida, executar uma curva de dose-resposta para identificar concentrações biologicamente relevantes para a saída fenotípica desejada; Ver Hirsch et al. 19 e Zhou et al. 40 para métodos.
- Prepare Soluções conservadas em estoque do meio contaminado nas concentrações desejadas, dependendo da química do contaminante.
Nota: por exemplo, para preparar soluções estoque de PbAc: Preparar soluções estoque de meio de acetato de chumbo (PbAc) adicionando contaminante a água destilada (dH20) até meio feito com água de contaminante atinge concentração desejada. Por exemplo, uma solução stock de 1.000 µM PbAc, pode ser preparado pela adição de PbAc para dH20 até atingir 1.000 µM PbAc. Além disso, diluir a solução estoque (por exemplo, os 1.000 µM PbAc solução) para a concentração desejada (tais como 500 µM PbAc) e manter essas soluções como estoque também. - Prepare o suporte, as orientações do fabricante seguir para servir como meio de controle. Preparar meio adicional, as orientações do fabricante seguintes; no entanto, suplemento contaminante solução preparada para dH20.
Nota: por exemplo, se usando um instante médio de Drosophila , adicione aproximadamente uma colher de chá instantâneo médio para um frasco plástico. Adicione aproximadamente 5 – 5.5 mL dH20 ao meio. Espalhe alguns grãos de fermento padeiro ao vivo para preparar meio de controle. Para preparar meio experimental, complementam a solução-mãe (como 500 µM PbAc) para dH20. -
Transferi reprodutivamente viáveis maduros machos e fêmeas de populações de ações para o controle e o meio experimental.
Nota: A pós-eclosão de tempo a maturidade reprodutiva é diferente entre as espécies de Drosophila 41.- Bata levemente o frasco de estoque moscas para baixo com a mão dominante. Certifique-se de que as moscas se mover automaticamente para o fundo do frasco. Com a outra mão, retire a tampa do frasco enquanto grampeia o frasco e coloque um frasco fresco de controle ou o contaminada médio na parte superior do frasco com as moscas. Manter os frascos juntos e flip-los, batendo suavemente, para que as moscas automaticamente são transferidas para o frasco fresco de controle ou meio contaminado. Enquanto ainda batendo o frasco com as moscas, tampa do frasco.
- Repita com mais ampolas, certificando-se de padronizar o número de moscas em cada frasco.
Nota: O número total de adultos transferidos através de simples transferência ou anestesia vai depender do tamanho dos frascos usados para evitar a superlotação. - Incubar a adultos em uma condição ambiental padrão (ou seja, uma incubadora) e permitir que os adultos acasalar e botar ovos no suporte 24-96 h.
- Depois de 24-96 h, descartar adultos em um necrotério (um frasco enchido com óleo mineral e tampado com um funil apertadas) deixando para trás fertilizado ovos (que mais tarde se tornará os sujeitos experimentais) para amadurecer-se para o teste. Coloca os frascos na incubadora para permitir que os ovos desenvolver.
- Monitore os frascos para larvas de ínstar vagando à procura de larvas que estão emergindo do meio.
3. coletar assuntos Experimental em vários estágios do desenvolvimento
Nota: Disciplinas experimentais podem ser coletadas em qualquer fase do desenvolvimento, colocados nos cegos codificados 15 mL tubos cónicos e testado por acumulação. Métodos para testar o acúmulo de contaminantes dependerá o contaminante que está sendo estudado. Por exemplo, acúmulo de PbAc pode ser testado usando espectrometria de massa Inductively-Coupled Plasma (ICP-MS)42. Além disso, disciplinas experimentais podem ser coletadas em qualquer fase do desenvolvimento a ser testado para uma variedade de efeitos fenotípicos de contaminantes. A Figura 2 ilustra o ciclo de vida de Drosophila 43. A Figura 3 ilustra o protocolo experimental para a exposição e os diferentes estádios de desenvolvimento de coleção.
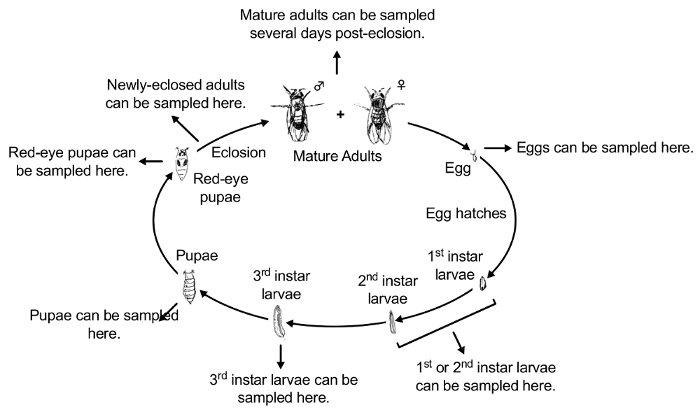
Figura 2 : Visão geral conceitual de ciclo de vida de d. melanogaster (o sistema mais comumente utilizado modelo Drosophila ). Os estágios do ciclo de vida de drosófila são: 1) ovo 2) primeiro ínstar-larva, larva 3) segundo-ínstar, 4) terceiro instar-larva, 5) vagando larva de terceiro ínstar, 6) Lophozosterops pupa, pupa 7) olhos vermelhos, adulto 8) recém-eclosed e 9) adulto. Clique aqui para ver uma versão maior desta figura.
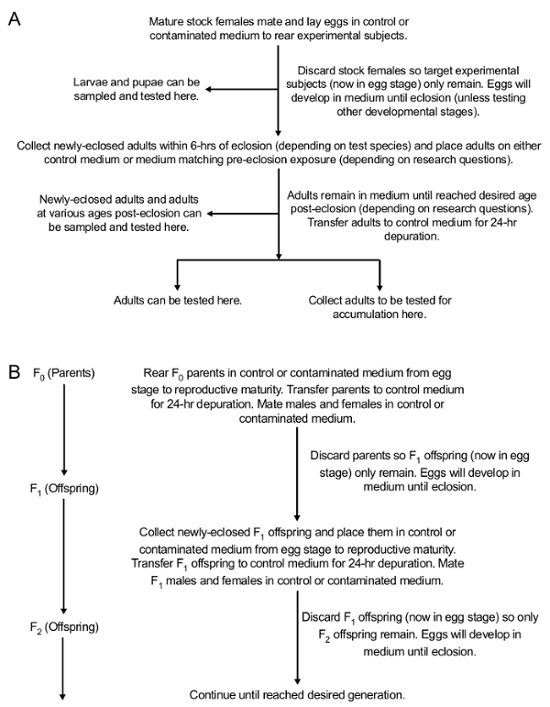
Figura 3 : Visão geral conceitual dos métodos expor oralmente drosófila para médio contaminado em ambos os parentais (F0) e as gerações subsequentes (F-1 e para a frente). (A) métodos para exposição oral durante o desenvolvimento da geração exposta. (B) métodos para testar a transferência de contaminantes a prole (F1 para a geração desejada). Esta figura foi modificada de Peterson et al . 24 Clique aqui para ver uma versão maior desta figura.
-
Coletar larvas vagando-terceiro ínstar
- Começa a monitorar os frascos quando ligar luzes na incubadora, como larvas vão surgir do meio e mova para cima no lado do frasco dentro de um h depois luzes ligar na incubadora. Dentro deste h, retire as larvas vagando-terceiro instar os lados do frasco com cuidado, usando uma vara de madeira ou uma pinça.
Nota: O número de larvas disponíveis para coleta dependerá do número de ovos postos em "2.3.4". - Para remover o excesso de meio de larvas, coloque as larvas em um copo pequeno com dH2O. Pour a dH2O fora o copo e coloque as larvas em um limpador de tarefa delicada. Usando um limpador de tarefa delicada, remova cuidadosamente o excesso de dH2O de larvas.
- Manter as populações experimentais na incubadora do ambiente controlado.
- Começa a monitorar os frascos quando ligar luzes na incubadora, como larvas vão surgir do meio e mova para cima no lado do frasco dentro de um h depois luzes ligar na incubadora. Dentro deste h, retire as larvas vagando-terceiro instar os lados do frasco com cuidado, usando uma vara de madeira ou uma pinça.
-
Coletar os adultos recém-eclosed
- Frascos de monitor para eclosão, observando a coloração das pupas ao longo dos lados dos frascos.
Nota: Pupas vão escurecer durante o desenvolvimento. Tempo de desenvolvimento, particularmente pre-eclosão, depende da espécie testada. - Quando os primeiros adultos começam a eclose, despejar e descarte destes adultos dentro de um necrotério contendo óleo mineral.
- Quando as luzes se ligar na incubadora na manhã seguinte, despejar e descartar qualquer adultos de idade desconhecida (ou virgindade) que podem ter eclosed durante a noite ou durante as luzes de peça sobre.
- Aproximadamente 4 h depois, anestesiar qualquer adultos surgido como adultos recém-eclosed com uma arma de2 CO em frascos. Coloque adultos num prato de2 CO sob um microscópio de dissecação. Sexo adultos procurando por pentes de sexo sobre os forelimbs de machos e ovipositors nas fêmeas.
Nota: D. melanogaster devem ser recolhidos dentro de 6 h de eclosão para evitar o acasalamento, mas outras espécies podem ter mais desenvolvimento vezes (e, portanto, não precisam ser coletados dentro deste prazo). - Adultos separados na placa CO2 , usando uma vara de madeira. Transfira delicadamente adultos em grupos específicos de sexo usando uma vara de madeira para a média correspondente história pré-existente.
- Frascos de monitor para eclosão, observando a coloração das pupas ao longo dos lados dos frascos.
-
Coletar os adultos maduros pós eclosão
- Permitir que adultos permaneçam no média correspondente pré-eclosão exposição do estágio de ovo para a eclosão de pós idade desejada em uma incubadora do ambiente controlado.
- Transferi individualmente adultos para o meio de controle para 24h antes do teste para permitir que os adultos aparar o excesso de meio contaminado fora de seus corpos.
4. traseira disciplinas experimentais para testar os efeitos de várias gerações ou exposição transgeracional.
- Para a traseira da geração parental (aka o P0 ou gerações de0 F), transferir adultos de populações das ações de controle e o experimental médio seguindo as etapas em "2.1" para "2.3" e "3.1" para "3.3".
- Quando os adultos estão reprodutivamente maduros (ver Pitnick et al. 41), a uma transferência (como indicado em 2.3.1), um frasco de machos para um frasco novo de controle ou meio experimental. Isoladamente, transferi um frasco de fêmeas ao frasco fresco que agora contém os machos. Permitir a adultos para companheiro e colocam ovos no meio de 24-96 h.. despejo e descartar a adultos em um necrotério contendo óleo mineral e re-incubar frascos para permitir que a prole desenvolver.
- Repita as etapas 4.1 através de 4.2 dependendo o número desejado de gerações.
Access restricted. Please log in or start a trial to view this content.
Resultados
Ao expor oralmente drosófila para uma contaminant(s) durante todo o desenvolvimento, várias questões toxicológicas podem ser testados, expondo a drosófila em diferentes níveis de organização biológica. Esta seção apresenta resultados representativos obtidos usando este protocolo em artigos publicados anteriormente23,24. Em particular, este protocolo foi usado anteriormente para avaliar a acumulação, ...
Access restricted. Please log in or start a trial to view this content.
Discussão
Drosophila melanogaster foi estabelecido como um poderoso modelo para uma variedade de processos biológicos devido a extensa conservação de genes e vias entre d. melanogaster e humanos13,14. Pelas mesmas razões que é um poderoso modelo para a ciência médica, Drosophila tem emergido como um sistema de modelo adequado para estudar o impacto da poluição antropogênica sobre uma série de parâmetros toxicológicos. Vários laborat...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Esta publicação foi apoiada por uma concessão do Ministério da educação (PR prêmio #P031C160025-17, o título do projecto: 84,031 C) para as comunidades de Colorado State University-Pueblo (CSU-Pueblo) para construir tronco ativo engajamento (C-BASE). Agradecemos a atual zoologia e Elsevier para fornecer os direitos para usar os resultados representativos publicado em papéis anteriores, bem como os editores de JoVE por nos oferecer a oportunidade de publicar este protocolo. Gostaríamos também de agradecer o programa C-BASE, Dr. Brian Vanden Heuvel (C-BASE e departamento de biologia, CSU-Pueblo), departamento de biologia da CSU-Pueblo, Thomas Graziano, Dr. Bernard Possidente (departamento de biologia, Skidmore College) e Dr. Claire Varian Ramos (Departamento de biologia, Universidade do estado do Colorado-Pueblo) pelo apoio e assistência.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Carolina Biological Instant Drosophila Medium Formula 4-24 | Carolina Biological | 173204 | |
| Drosophila vials, Narrow (PS), Polystyrene, Superbulk, 1000 vials/unit | Genessee Scientific | 32-116SB | Used to store flies |
| Flugs Closures for vials and bottles, Narrow plastic vials | Genessee Scientific | 49-102 | Used to store flies |
| Cardboard trays, trays only, narrow | Genessee Scientific | 32-124 | Used to organize populations of flies |
| Cardboard trays, dividers only, narrow | Genessee Scientific | 32-126 | Used to organize populations of flies |
| Thermo Scientific Nalgene Square Wide-Mouth HDPE Bottles with Closure | Fischer Scientific | 03-312D | Useful for storage of contaminants |
| Thermo Scientific Nalgene Color-Coded LDPE Wash Bottles | Fischer Scientific | 03-409-17C | Useful for storage of contaminants |
| Eppendorf Repeater M4 Manual Handheld Pipette Dispenser | Fischer Scientific | 14-287-150 | Used to prepare medium |
| Combitips Advanced Pipetter Tips - Standard, Eppendorf Quality Tips | Fischer Scientific | 13-683-708 | Used to prepare medium |
| Flypad, Standard Size (8.1 X 11.6cm) | Genessee Scientific | 59-114 | Used to anesthetize flies |
| Flystuff foot valve | Genessee Scientific | 59-121 | Used to anesthetize flies |
| Tubing, green (1 continguous foot/unit) | Genessee Scientific | 59-124G | Used to anesthetize flies |
| Mineral Oil, Light, White, High Purity Grade, 500 mL HDPE Bottle | VWR | 97064-130 | Used to make a morgue |
| Glass Erlenmeyer Flask Set - 3 Sizes - 50, 150 and 250ml, Karter Scientific 214U2 | Walmart | Not applicable | Used to make a morgue |
| BGSET5 Glass Beaker Set Of 5 | Walmart | ||
| Inbred or wildtype line of Drosophila | Bloomington Drosophila Stock Center at Indiana University | https://bdsc.indiana.edu | |
| Wild popultions of Drosophila | UC San Diego Drosophila Stock Center | https://stockcenter.ucsd.edu/info/welcome.php |
Referências
- Postel, S. Defusing the Toxics Threat: Controlling Pesticides and Industrial Waste. , Worldwatch Institute. Washington, DC. (1987).
- Vitousek, P. M., Mooney, H. A., Lubchenco, J., Melillo, J. M. Human domination of earth's ecosystems. Science. 277, 494-499 (1997).
- United Nations Environment Program (UNEP). Saving Our Planet: Challenges and Hopes. , UNEP. Nairobi. (1992).
- Hansen, L. J., Johnson, M. L. Conservation and toxicology: Integrating the disciplines. Conservation Biology. 13, 1225-1227 (1999).
- Johnston, E. L., Mayer-Pinto, M., Crowe, T. P. REVIEW: Chemical contaminant effects on marine ecosystem functioning. Journal of Applied Ecology. 52, 140-149 (2015).
- Dell'Omo, G. Behavioral ecotoxicology. , John Wiley & Sons, LTD. West. Sussex, UK. (2002).
- Clotfelter, E. D., Bell, A. M., Levering, K. R. The role of animal behaviour in the study of endocrine-disrupting chemicals. Animal Behaviour. 68, 665-676 (2004).
- Peterson, E. K., Buchwalter, D. B., Kerby, J. L., LeFauve, M. K., Varian-Ramos, C. W., Swaddle, J. P. Integrative behavioral ecotoxicology: bringing together fields to establish new insight to behavioral ecology, toxicology, and conservation. Current Zoology. 63, 185-194 (2017).
- Scott, G. R., Sloman, K. A. The effects of environmental pollutants on complex fish behaviour: Integrating behavioural and physiological indicators of toxicity. Aquatic Toxicology. 68, 369-392 (2004).
- Zala, S. M., Penn, D. J. Abnormal behaviors induced by chemical pollution: A review of the evidence and new challenges. Animal Behaviour. 68, 649-664 (2004).
- Abolaji, A. O., Kamdem, J. P., Farombi, E. O., Rocha, J. B. T. Drosophila melanogaster as a promising model organism in toxicological studies. Archives of Basic & Applied Medicine. 1, 33-38 (2013).
- Jennings, B. H. Drosophila-a versatile model in biology and medicine. Materials Today. 14, 190-195 (2011).
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacology Reviews. 63, 411-436 (2011).
- Rubin, G. M., et al. Comparative genomics of the eukaryotes. Science. 287, 2204-2215 (2000).
- Rand, M. D. Drosophotoxicology: The growing potential for Drosophila in neurotoxicology. Neurotoxicol Teratol. 32, 74(2010).
- Rand, M. D., Montgomery, S. L., Prince, L., Vorojeikina, D. Developmental toxicity assays using the Drosophila model. Current Protocols in Toxicology. 59, 1.12.1-1.12.20 (2015).
- Burke, M. K., Rose, M. R. Experimental evolution with Drosophila. American Journal of Physiology: Regulatory, Integrative and Comparative Physiology. 296, R1847-R1854 (2009).
- He, T., Hirsch, H. V. B., Ruden, D. M., Lnenicka, G. A. Chronic lead exposure alters presynaptic calcium regulation and synaptic facilitation in Drosophila larvae. NeuroToxicology. 30, 777-784 (2009).
- Hirsch, H. V., et al. Behavioral effects of chronic exposure to low levels of lead in Drosophila melanogaster. NeuroToxicology. 24, 435-442 (2003).
- Hirsch, H. V. B., et al. Variations at a quantitative trait locus (QTL) affect development of behavior in lead-exposed Drosophila melanogaster. NeuroToxicology. 30, 305-311 (2009).
- Morley, E. J., Hirsch, H. V. B., Hollocher, K., Lnenicka, G. A. Effects of chronic lead exposure on the neuromuscular junction in Drosophila larvae. NeuroToxicology. 24, 35-41 (2003).
- Ruden, D. M., et al. Genetical toxicologenomics in Drosophila identifies master- modulatory loci that are regulated by developmental exposure to lead. NeuroToxicology. 30, 898-914 (2009).
- Peterson, E. K., et al. Accumulation, elimination, sequestration, and genetic variation of lead (Pb2+) loads within and between generations of Drosophila melanogaster. Chemosphere. 181, 368-375 (2017).
- Peterson, E. K., et al. Asymmetrical positive assortative mating induced by developmental lead (Pb2+) exposure in a model system, Drosophila melanogaster. Current Zoology. 63, 195-203 (2017).
- Peterson, E. K. Consequences of developmental lead (Pb2+) exposure on reproductive strategies in Drosophila. , University at Albany-State University of New York. Dissertation (2016).
- Chifiriuc, M. C., Ratiu, A. C., Popa, M., Ecovolu, A. A. Drosophotoxicology: An emerging research area for assessing nanoparticles interaction with living organisms. International Journal of Molecular Sciences. 17, 36(2016).
- Lachaise, D., Cariou, M. L., David, J. R., Lemeunier, F., Tsacas, L., Ashburner, M. Historical biogeography of the Drosophila melanogaster species subgroup. Evolutionary Biology. 22, 159-225 (1988).
- Elgin, C. R., Miller, D. W. Mass rearing of flies and mass production and harvesting of embryos. The Genetics and Biology of Drosophila. Ashburner, M., Wright, T. R. F. 2a, 112-121 (1978).
- Shaffer, C. D., Wuller, J. M., Elgin, C. R. Chapter 5: Raising large quantities of Drosophila for biochemical experiments. Methods in Cell Biology. 44, 99-108 (1994).
- Stocker, H., Gallant, P. Getting started: an overview on raising and handling Drosophila. Methods in Molecular Biology. 420, 27-44 (2008).
- Jennings, J. H., Etges, W. J., Schmitt, T., Hoikkala, A. Cuticular hydrocarbons of Drosophila montana: geographic variation, sexual dimorphism and potential roles as pheromones. Journal of Insect Physiology. 61, 16-24 (2014).
- Drosophila Speciation Patterns. , http://www.drosophila-speciation-patterns.com/rangemaps.html. (2018).
- Markow, T. A., O'Grady, P. M. Drosophila: A Guide to Species Identification and Use. , Academic Press. London. (2005).
- Werner, T., Jaenike, J. Drosopholids of the midwest and northeast. , River Campus Libraries, University of Rochester. Rochester NY. (2017).
- Greenspan, R. J. The basics of doing a cross. Fly Pushing: The theory and practice of Drosophila genetics. , 2nd, Cold Spring Harbor Laboratory Press, Cold Spring Harbor. New York. 3-24 (1997).
- JoVE Science Education Database. . Biology I: yeast, Drosophila and C. elegans. Drosophila Maintenance. , JoVE. Cambridge, MA. (2018).
- Castañeda, P. L., Muñoz, G. L. E., Durán, D. A., Heres, P. M. E., Dueñas, G. I. E. LD50 in Drosophila melanogaster. fed on lead nitrate and lead acetate. Drosophila Information Service. 84, 44-48 (2001).
- Massie, H. R., Aiello, V. R., Whitney, S. J. P. Lead accumulation during aging of Drosophila and effect of dietary lead on life span. Age. 15, 47-49 (1992).
- Akins, J. M., Schroeder, J. A., Brower, D. L., Aposhian, H. V. Evaluation of Drosophila melanogaster as an alternative animal for studying the neurotoxicity of heavy metals. BioMetals. 5, 111-120 (1992).
- Zhou, S., et al. The genetic basis for variation in sensitivity to lead toxicity in Drosophila melanogaster. Environmental Health Perspectives. 124, 1062-1070 (2016).
- Pitnick, S., Markow, T. A., Spicer, G. S. Delayed male maturity is a cost of producing large sperm in Drosophila. Proceedings of National Academy of Sciences USA. 92, 10614-10618 (1995).
- Beauchemin, D. Inductively Coupled Plasma Mass Spectrometry. Analytical Chemistry. 82, 4786-4810 (2010).
- Tyler, M. S. Development of the fruit fly Drosophila melanogaster. Developmental Biology, a Guide for Experimental Study. Tyler, M. S. , 2nd, Sinauer Associates Inc. Sunderland, MA, USA. 8-27 (2000).
- Ortiz, J. G., Opoka, R., Kane, D., Cartwright, I. L. Investigating arsenic susceptibility from a genetic perspective in Drosophila reveals a key role for glutathione synthetase. Toxicological Sciences. 107, 416-426 (2009).
- Bonilla, E., Contreras, R., Medina-Leendertz, S., Mora, M., Villalobos, V., Bravo, Y. Minocycline increases the life span and motor activity and decreases lipid peroxidation in manganese treated Drosophila melanogaster. Toxicology. 294, 50-53 (2012).
- Guarnieri, D. J., Heberlein, U. Drosophila melanogaster, a genetic model system for alcohol research. International Review of Neurobiology. 54, 199-228 (2003).
- Posgai, R., Cipolla-McCulloch, C. B., Murphy, K. R., Hussain, S. M., Rowe, J. J., Nielsen, M. G. Differential toxicity of silver and titanium dioxide nanoparticles on Drosophila melanogaster development, reproductive effort, and viability: size, coatings and antioxidants matter. Chemosphere. 85, 34-42 (2011).
- Gupta, S. C., et al. Adverse effect of organophosphate compounds, dichlorvos and chlorpyrifos in the reproductive tissues of transgenic Drosophila melanogaster: 70kDa heat shock protein as a marker of cellular damage. Toxicology. 238, 1-14 (2007).
- Wasserkort, R., Koller, T. Screening toxic effects of volatile organic compounds using Drosophila melanogaster. Journal of Applied Toxicology. 17, 119-125 (1997).
- Markow, T. A., O'Grady, P. O. Reproductive ecology of Drosophila. Functional Ecology. 22, 747-759 (2008).
- Dev, K., Chahal, J., Parkash, R. Seasonal variations in the mating-related traits of Drosophila melanogaster. Journal of Ethology. 31, 165-174 (2013).
- Salminen, T. S., Vesala, L., Laiho, A., Merisalo, M., Hoikkala, A., Kankare, M. Seasonal gene expression kinetics between diapause phases in Drosophila virilus group species and overwintering differences between diapausing and non-diapausing females. Nature Scientific Reports. 5, 11197(2015).
- Miller, R. S., Thomas, J. L. The effects of larval crowding and body size on the longevity of adult Drosophila melanogaster. Ecology. 39, 118-125 (1958).
- Peterson, E. K., Ghiradella, H., Possidente, B., Hirsch, H. Transgenerational epigenetic effects of lead exposure on behavior in Drosophila melanogaster. Abstracts of the IBANGS Genes, Brain and Behavior Meeting, May 16-19, 2012, Boulder, CO, 11, Genes, Brain & Behavior 492-493 (2012).
- Soares, J. J., et al. Continuous liquid feeding: New method to study pesticides toxicity in Drosophila melanogaster. Analytical Biochemistry. 537, 60-62 (2017).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados