É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Förster homogênea de tempo-resolvido ressonância energia baseada em transferência ensaio para detecção de secreção de insulina
Neste Artigo
Resumo
Aqui, apresentamos homogênea tempo resolvido FRET (HTRF) como um método eficiente para detecção rápida de insulina secretada de células.
Resumo
A detecção de secreção de insulina é fundamental para elucidar os mecanismos de secreção regulamentado, bem como em estudos de metabolismo. Apesar de inúmeros ensaios de insulina já existem há décadas, o recente advento da tecnologia de Förster ressonância energia de transferência (HTRF) de tempo-resolvido homogênea simplificou significativamente estas medições. Isto é um ensaio óptico rápido, econômico, reprodutível e robusto depende dos anticorpos conjugados a brilhante fluorophores com emissão de longa duração, que facilita o tempo-resolvido Förster ressonância transferir energia. Além disso, a detecção de insulina HTRF é favorável para o desenvolvimento de ensaios de rastreio com throughput alto. Aqui usamos o HTRF para detectar a secreção de insulina em células INS-1E, uma linha de celular insulinoma-derivado de rato. Isso nos permite estimar os níveis basais de insulina e suas mudanças em resposta à estimulação de glicose. Além disso, nós usamos este sistema de deteção de insulina para confirmar o papel da dopamina como um regulador negativo da secreção de insulina glicose-estimulada (GSIS). De forma semelhante, outros de dopamina D2-como agonistas dos receptores, quinpirole e bromocriptina, reduzem GSIS de forma concentração-dependente. Nossos resultados destacam o utilitário do formato HTRF insulina ensaio para determinar o papel de numerosas drogas em GSIS e seus perfis farmacológicos.
Introdução
A regulação do metabolismo energético é aperfeiçoá-lo por um importante hormônio anabólico, a insulina. Insulina é sintetizada e liberada por células-beta do pâncreas em resposta aos níveis de glicose extracelular aumentado. A insulina liberada provoca a absorção de glicose pelos tecidos sensíveis à insulina1,2. Fisiologicamente, isto está ligado à elevação da concentração de glicose após uma refeição, seguida de secreção de insulina para regular a absorção de glicose. Perturbações na homeostase de glicose levam a deficiências metabólicas, culminando na resistência à insulina e, finalmente, no início da43,2,do diabetes tipo 2.
Embora a secreção de insulina tem sido extensivamente estudada, seus mecanismos regulatórios permanecem mal compreendidos. Uma área crítica de investigação tem sido a identificação de novos moduladores de secreção de insulina em células beta5,6,7,8. Estes estudos requerem uma melhor compreensão da relação de acoplamento entre a estimulação de glicose e a secreção de insulina. Portanto, a capacidade de precisão de monitorar e quantificar os níveis de secreção de insulina glicose-estimulada (GSIS) tem sido essencial. Até à data, no entanto, apenas um número limitado de métodos estava disponível para permitir a quantificação de GSIS usando linhas de células secretoras de insulina e/ou de ilhotas pancreáticas. Um é o radioimunoensaio (RIA), que utiliza anticorpos e insulina radioisótopo-tag. As principais limitações desta abordagem incluem questões de segurança devido à manipulação e eliminação de materiais radioactivos. Além disso, este método é trabalhoso, envolvendo múltiplos lavagem longa e etapas de incubação. Ensaio imunoenzimático (ELISA) é outra abordagem dispendiosa e trabalhosa que utiliza anticorpos para a deteção de insulina. Variação em afinidades de anticorpo e da eficiência de reconhecer a insulina estão limitando fatores desse método e pode afetar a reprodutibilidade dos resultados. ELISA, nem RIA foi projetado para experimentos de alta produtividade. AlphaScreen é um ensaio homogêneo usado para detectar e medir os níveis de secreção de insulina. AlphaScreen tecnologia baseia-se na conversão de oxigênio ambiente em um estado singlete oxigênio excitado que pode reagir com espécies quimioluminescente, resultando na geração de quimioluminescência. Porque o ensaio é homogêneo, muitas das etapas lavagem associadas a RIA e ELISA são eliminadas. No entanto, a instabilidade do sinal devido à natureza da reação é um fator limitante que possam afectar a leitura do ensaio. (TR-pinça, desenvolvido pela Heyduk e colegas9, é outra abordagem homogénea para medição de insulina com base na ligação de dois anticorpos separados para diferentes epitopos na molécula de insulina. Os anticorpos são cada DNA encalhado quimicamente ligado à dupla com curto complementares único encalhado DNA saliências. Ligação dos anticorpos à insulina reúne-os e leva a um duplex de DNA encalhado dobro. Cada anticorpo também está associado com um fluoróforo dador ou aceitador respectivo, e a associação do duplex de DNA reúne estes fluorophores para gerar a transferência de energia de ressonância de Förster (FRET). Uma limitação potencial de TR-pinça, baseia-se no entanto, com o traste em si. A incapacidade de dissipar rapidamente fluorescência de fundo durante a reação de FRET pode levar a níveis relativamente elevados de fluorescência de fundo e um baixo sinal à relação de ruído dentro do ensaio. Portanto, ainda existe uma necessidade para um ensaio confiável, robusto e econômico para quantificar GSIS em uma maneira de alta produtividade.
Avanços recentes em Biofísica culminaram no desenvolvimento de um ensaio de transferência (HTRF) com base de ressonância de energia homogênea fluorescência tempo-resolvido. Especificamente, enquanto a energia de transferência dentro o ensaio pode ser descrito como baseado no traste, mais precisamente, HTRF depende da luminescência energia ressonância transferência (LRET)10 que é non-radiative transferência de energia entre o doador e o aceptor espécie de11,12,13. Esta distinção é importante, desde o momento de uma fluorescência ou têmpera interação com base de FRET é muito diferente do que é para LRET, embora os mesmos tipos de retenção podem ser usados para FRET e LRET. Além disso, o uso de terras raras lantanídeos cryptate compostos tais como o európio ou térbio cryptate em HTRF produz fluorescência longa meia-vida de12,14. Isto oferece a vantagem exclusiva da introdução de um atraso de tempo (microssegundos por) entre a excitação do doador e a medição das emissões do aceitador (isto é, tempo-resolvido do ensaio). Este atraso do tempo permite tempo suficiente para que a fluorescência de fundo a dissipar-se antes da medição de fluorescência de emissão aceitador. Consequentemente, a leitura é livre de fluorescência não-específica e assim, uma alta relação sinal-ruído é alcançada (Figura 1). Além disso, a natureza homogênea de HTRF elimina a necessidade de etapas de lavagem para lavar a espécie desacoplada, fazendo o ensaio muito mais rápido do que os métodos baseados em RIA ou ELISA.
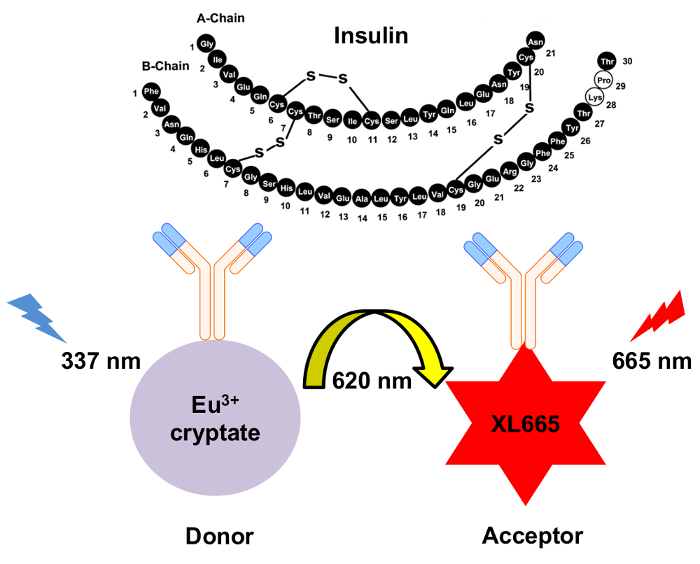
Figura 1: esquemático do mecanismo para a deteção de insulina HTRF. Dois anticorpos monoclonais independentemente gerados especificamente reconhece e vincule a insulina em locais separados. Estes anticorpos são conjugados para o doador de cryptate de európio ou o aceitador de XL665. Excitação do doador em 337 resultados de nm em emissão a 620 nm. A transferência de energia resultante faz com que XL665 emitir um comprimento de onda mais longos, 665 nm. Clique aqui para ver uma versão maior desta figura.
Aqui, nós fornecemos um protocolo detalhado para usar uma abordagem baseada em HTRF para determinar os níveis de GSIS de células INS-1E, uma bem estabelecida insulina secretoras derivado de células beta rato insulinoma célula linha15. Além disso, este ensaio pode ser utilizado para identificar o perfil farmacológico de reguladores moleculares da secreção de insulina. Aplicamos este ensaio de insulina com base em HTRF para examinar a dopamina D2-como o Regulamento do receptor de GSIS. Cada vez mais estudos têm revelado que o neurotransmissor dopamina é um importante regulador do GSIS8,16,17,18,19,20, 21 , 22. dopamina afeta GSIS de maneira autócrina/parácrina negativa através de ações sobre a dopamina D2-como os receptores (D2, D3, receptores de4 D) expressados na superfície de células pancreáticas beta8 , 16 , 19. usando este ensaio, confirmar o papel da dopamina como um regulador negativo de GSIS e demonstrar que a dopamina D2-como receptor agonistas bromocriptina e quinpirole também reduzem GSIS.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. INS-1E células: manutenção e chapeamento
- Manter células INS-1E numa incubadora de2 ˚C/5% CO 37 umidificado e culta com meio RPMI 1640 suplementado com 5% (v/v) inactivadas pelo calor fetal soro bovino, 2 mM L-glutamina, 10 mM HEPES, piruvato de sódio de 1 mM, 100 U/mL penicilina/estreptomicina solução de 50 µM de β-Mercaptoetanol. Cultura de células em meio RPMI 1640 completo de 10 mL (por placa), até atingirem a confluência de 80-90%, quando podem ser trypsinized e passadas ou usados para o ensaio de secreção de insulina.
- Dia 1: Aspirar a mídia e lavar as células uma vez com 5 mL de PBS pré-aquecido. Adicione 0,5 mL de tripsina (0.025%) diluído 1:1 em 0,5 mL de PBS trypsinize as células e incubar durante 3-4 minutos a 37 ˚ c. Desactive a tripsina adicionando mídia completa 9 mL e a transferência de células para um tubo de centrífuga de 15 mL por pipetagem.
- Células de pelotas por centrifugação e ressuspender o centrifugado em aproximadamente 5 mL fresco meios de comunicação.
- Pegue 10 µ l de células re-suspensas e misture com 10 µ l corante vital de Trypan azul para verificar a viabilidade celular. Contar as células vivas e mortas em 10 µ l desta mistura usando um hemocytometer. Nível de viabilidade deve ser acima de 90%. Dilua as células re-suspensas em mídia fresca para 1 milhão de células por mL.
- Células de INS-1E de 0,5 mL de semente por bem em um poli-L-Lysine pré-revestido placa de 24, com uma densidade de 500.000 células/poço.
- Dia 2: Remova a mídia 18-24h depois de chapeamento e adicionar 500 µ l/poço de mídia de RPMI 1640 fresco. Incube as células para outro 24h permitir que as células para se recuperar totalmente da etapa passaging prévia. Esse tempo adicional permite que as células a se espalhar na placa de cultura de tecidos.
2. insulina secreção ensaio (dia 3)
- Preparar o tampão KRB: 132,2 mM NaCl, 3,6 mM KCl, 5mm NaHCO3, 0.5 mM NaH2PO4, 0.5 mM MgCl2, 1,5 mM CaCl2e 0,001 g/mL albumina de soro bovino (BSA), pH 7,4.
- Aspire os meios de comunicação de células e lave duas vezes com PBS pré-aquecido.
- Para a etapa de fome de glicose, adicione 450 µ l/poço KRB (contendo BSA) sem glicose para 1h 37 ˚C/5% CO2.
- Durante a etapa de fome de glicose, preparar diluições em série da droga (s) em KRB contendo 200 mM glicose (10 x concentração).
- Prepare a droga em 10 x a concentração final em KRB suplementado com glicose 200 mM (também 10 x a concentração final de glicose). Se o estoque de drogas (e mais o adicionado 10 x glicose) é em DMSO, certifique-se de percentual de DMSO é mantido consistente durante todo o ensaio (idealmente final percentual inferior a 0,1% DMSO).
- Para tratamentos de dopamina e quinpirole, usar um intervalo de concentração de drogas de ensaio final de 100 µM a 100 pM (do maior para menor concentração), com o último ponto da resposta dose não contendo nenhuma droga. Para bromocriptina, use um intervalo de concentração de ensaio final de 10 µM para 22:00, com o último ponto da resposta dose sendo o controle de drogas.
- Depois da fome de glicose, adicione diluições em série drogas para o ensaio para produzir uma resposta de dose.
- Adicione 50 µ l/poço de cada diluição serial nos poços correspondentes (ensaio total volume 500 µ l).
- Para a etapa de estimulação de glicose, incubar as células com as diluições de série respectivas drogas (na presença de glicose de 20 mM) durante 90 minutos a 37 ˚C/5% CO2. Incluem um conjunto de poços de controle: (1) estimulação com glicose 20mm sozinho na ausência de qualquer droga adicional e (2) células que nem são estimuladas com drogas nem glicose (que fornece uma taxa basal de secreção).
- Após a etapa de estimulação, remova com cuidado os sobrenadantes (uso diretamente ou loja no 4 ˚ c).
Nota: Um passo de centrifugação suave adicional 5 min (600 g de x, 1 min) pode ser introduzido neste momento para remover quaisquer células remanescentes nos sobrenadantes de ensaio.
3. HTRF a secreção de insulina medida
- Dilua o ensaio sobrenadantes 01:10 em KRB (sem BSA), de preferência em placas de 96 poços claros.
- Prepare a curva padrão de insulina para o ensaio de insulina HTRF (tabela 1).
| Solução-padrão estoque 500 ng/ml | Diluições em série | Trabalhando [insulina] ng/ml |
| STD 7 | 30 µ l estoque + 140 µ l KRB | 150 |
| STD 6 | 30 µ l STD 7 + 45 µ l KRB | 60 |
| STD 5 | 30 µ l STD 6 + 45 µ l KRB | 24 |
| STD 4 | 30 µ l STD 5 + 45 µ l KRB | 9.6 |
| DST 3 | 30 µ l STD 4 + 45 µ l KRB | 3,84 |
| STD 2 | 30 µ l STD 3 + 45 µ l KRB | 1,54 |
| STD 1 | 30 µ l STD 2 + 45 µ l KRB | 0,61 |
| STD 0 | µ l 45 KRB | 0 |
| Nota: Estoque STD é 500 ng/ml | ||
Tabela 1. Diluições em série para fazer a curva padrão de insulina.
- Adicione as amostras de curva padrão e os sobrenadantes de ensaio diluída para a placa HTRF. A medição de insulina secretada por HTRF pode efectuar-se em um poço-96 ou um formato de placa 384, mantendo em mente que o volume de ensaio deve ser re-ajustado. Uso 10 µ l/poço amostra em brancas 96 poços meia-área chapas ou 5 µ l/poço em uma placa de baixo volume, fundo redondo 384-poço branco (consulte Tabela de materiais).
- Preparar a mistura de anticorpo no buffer de deteção (ver Tabela de materiais) em um doador de 1:2 (cryptate) / relação do aceitador (XL-665).
Nota: Mais detalhes específicos sobre o ensaio HTRF estão disponíveis do fabricante. - Adicione a mistura de anticorpos para o ensaio em 30 µ l/poço (para um formato de 96-placa de ensaio) ou 15 µ l/poço (para um formato de ensaio de placa 384).
- Selar a placa e incubar à temperatura ambiente.
- Ler a placa depois de 2h, 4h, e/ou incubação durante a noite com anticorpos usando o leitor e o módulo de óptica de HTRF apropriado (337 665 620 nm) (ver Tabela de materiais e as instruções do fabricante). Definir o início da integração em 60 µs e o tempo de integração em 400 µs. uso 200 pisca por bem.
Nota: Estes parâmetros foram baseados na utilização de nosso leitor específico. A leitura a 620 nm e 665 nm pode variar entre diferentes instrumentos. Esta é uma das razões que sugerimos usar a relação de 665/620. No cálculo deste rácio, quaisquer diferenças de potencial de leitor para leitor vão ser normalizadas em fornecem valores consistentes independentemente do instrumento utilizado para medir a HTRF.
4. normalização e análise de dados
- Calcular as concentrações de insulina dos poços de ensaio através de extrapolação de ratiometric leituras de fluorescência (665 nm/620 nm) para uma segunda ordem polinomial curva quadrática (Figura 2).

Figura 2 : Curva padrão insulina. Estoque de insulina humana de concentrações conhecidas foi usado para gerar a curva padrão de insulina. Os rácios HTRF resultantes (665 nm / 620 nm) foram plotados contra as concentrações de insulina. Os dados foram o melhor ajuste para uma segunda curva polinomial quadrático de ordem (R2 = 0.99996). Esta é uma curva padrão representativa. Barras de erro = SEM. , por favor clique aqui para ver uma versão maior desta figura.
- Com os dados extrapolados como ng/mL de insulina secretada, normalize (insulina secretada em resposta ao aumento da concentração de ligante) para o valor médio de poços de teste a % máxima de insulina secreção (condição sozinho de glicose 20 mM).
- Use o ajuste de curva (R2) de uma única experiência para calcular a variação de intraplate. Dentro do experimento, derivado dos valores individuais de2 R as duplicatas intra experimentais, permitindo o cálculo do erro padrão da média para a curva de ajuste.
- Para determinar a variação interplate, use os dados de pelo menos três experimentos individuais para calcular o erro padrão da média para o valor de2 R da curva coletiva.
Access restricted. Please log in or start a trial to view this content.
Resultados
Nós validado o nosso ensaio HTRF de insulina, gerando uma curva padrão de insulina, usando insulina humana purificada padrões predefinidos concentrações (Figura 2). Geração da curva padrão nos permitiu extrapolar as leituras de fluorescência ratiometric e, portanto, para determinar os níveis de insulina secretada em resposta aos tratamentos de drogas (Figura 2). Intraplate variação para o encaixe de curva foi mínima ...
Access restricted. Please log in or start a trial to view this content.
Discussão
O ensaio de insulina HTRF descrito aqui oferece um sistema rápido e eficiente para medir a secreção de insulina de um sistema de baseados em células cultivada. Entre suas vantagens mais importantes, neste ensaio oferece um sinal baixo fundo devido a alta relação sinal-ruído. Além disso, confirmamos que o sinal HTRF é estável durante longos períodos de tempo (> 24 h)7. No entanto, desde que os anticorpos monoclonais de ligação de insulina rapidamente chegar a saturação de ligação a...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Agradecemos Nicolas Pierre (Cisbio bioensaios) para conselhos úteis e Dr. Pierre Maechler (Universidade de Genebra) generosamente, fornecendo células INS-1E. Este trabalho foi apoiado pelo financiamento do departamento de defesa (grant PR141292 a Z.F.) e John F. e Nancy A. Emmerling fundo da Fundação de Pittsburgh (a Z.F.).
Agradecimentos
Os autores não têm nada para divulgar.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 96-well white half area plate | Greiner Bio-One | 82050-042 | |
| 384-well white low-volume, round-bottom plate | Corning | 15100157 | |
| Insulin High Range Kit | Cisbio Bioassays | 62IN1PEH | 10,000 test HTRF-based insulin assay kit |
| PHERAstar FSX plate reader | BMG Labtech | FSX | Plate reader adapted for HTRF-based assay readings |
| Plate sealers | Fisher Scientific | DY992 | To seal plate while antibodies incubate |
| Hemocytometer | Hausser Scientific | 3100 | |
| RPMI Medium 1640 (1x) | Gibco | 11875-093 | [+] L-glutamine |
| Trypsin 0.05% | Corning | 25-052-CI | 0.53 mM EDTA, (-) sodium bicarbonate |
| DPBS (Dulbecco's phosphate buffered saline) | Corning | 21-031-CV | Without calcium and magnesium |
| Fetal Bovine Serum | Corning | 35-010-CV | |
| HEPES | Gibco | 156-30-080 | |
| Sodium pyruvate | Gibco | 11360070 | |
| Penicillin/Streptomycin solution 100x | Corning | 30-002 CT | |
| 2-mercaptoethanol | Sigma | M1348 | |
| Trypan Blue Stain (0.4%) | Gibco | 15250-061 | |
| Dopamine hydrochloride | Sigma | 8502 | |
| Bromocriptine mesylate | Tocris | 427 | |
| (-)-Quinpirole hydrochloride | Tocris | 1061 | |
| Bovine Serum Albumin | Calbiochem | 12659 | |
| Poly-L-Lysine | Sigma | P4832 | |
| Glucose | Sigma | G7021 | |
| DMSO (Dimethyl sulfoxide) | Sigma | 276855 |
Referências
- Taniguchi, C. M., Emanuelli, B., Kahn, C. R. Critical nodes in signalling pathways: Insights into insulin action. Nat Rev Mol Cell Biol. 7 (2), 85-96 (2006).
- Vetere, A., Choudhary, A., Burns, S. M., Wagner, B. K. Targeting the pancreatic beta-cell to treat diabetes. Nat Rev Drug Discov. 13 (4), 278-289 (2014).
- Despres, J. P., Lemieux, I. Abdominal obesity and metabolic syndrome. Nature. 444 (7121), 881-887 (2006).
- Kahn, S. E., Hull, R. L., Utzschneider, K. M. Mechanisms linking obesity to insulin resistance and type 2 diabetes. Nature. 444 (7121), 840-846 (2006).
- Barg, S. Mechanisms of exocytosis in insulin-secreting B-cells and glucagon-secreting A-cells. Pharmacol Toxicol. 92 (1), 3-13 (2003).
- Braun, M., Ramracheya, R., Rorsman, P. Autocrine regulation of insulin secretion. Diabetes Obes Metab. 14 Suppl 3, 143-151 (2012).
- Farino, Z. J., et al. Development of a rapid insulin assay by homogenous time-resolved fluorescence. PLoS One. 11 (2), e0148684(2016).
- Simpson, N., et al. Dopamine-mediated autocrine inhibitory circuit regulating human insulin secretion in vitro. Mol Endocrinol. 26 (10), 1757-1772 (2012).
- Heyduk, E., Moxley, M. M., Salvatori, A., Corbett, J. A., Heyduk, T. Homogeneous insulin and C-Peptide sensors for rapid assessment of insulin and C-peptide secretion by the islets. Diabetes. 59 (10), 2360-2365 (2010).
- Heyduk, T. Measuring protein conformational changes by FRET/LRET. Curr Opin Biotechnol. 13 (4), 292-296 (2002).
- Degorce, F. HTRF((R)): Pioneering technology for high-throughput screening. Expert Opin Drug Discov. 1 (7), 753-764 (2006).
- Degorce, F., et al. HTRF: A technology tailored for drug discovery - a review of theoretical aspects and recent applications. Curr Chem Genomics. 3, 22-32 (2009).
- Mathis, G. HTRF(R) Technology. J Biomol Screen. 4 (6), 309-314 (1999).
- Daijo, J. E., Sportsman, J. R. A time-resolved fluorescence immunoassay for insulin in rodent plasma. J Pharm Biomed Anal. 19 (3-4), 335-342 (1999).
- Merglen, A., et al. Glucose sensitivity and metabolism-secretion coupling studied during two-year continuous culture in INS-1E insulinoma cells. Endocrinology. 145 (2), 667-678 (2004).
- Ustione, A., Piston, D. W. Dopamine synthesis and D3 receptor activation in pancreatic beta-cells regulates insulin secretion and intracellular [Ca(2+)] oscillations. Mol Endocrinol. 26 (11), 1928-1940 (2012).
- Ustione, A., Piston, D. W. A simple introduction to multiphoton microscopy. J Microsc. 243 (3), 221-226 (2011).
- Ustione, A., Piston, D. W., Harris, P. E. Minireview: Dopaminergic regulation of insulin secretion from the pancreatic islet. Mol Endocrinol. 27 (8), 1198-1207 (2013).
- Rubi, B., et al. Dopamine D2-like receptors are expressed in pancreatic beta cells and mediate inhibition of insulin secretion. J Biol Chem. 280 (44), 36824-36832 (2005).
- Garcia-Tornadu, I., et al. Disruption of the dopamine d2 receptor impairs insulin secretion and causes glucose intolerance. Endocrinology. 151 (4), 1441-1450 (2010).
- Garcia-Tornadu, I., et al. New insights into the endocrine and metabolic roles of dopamine D2 receptors gained from the Drd2 mouse. Neuroendocrinology. 92 (4), 207-214 (2010).
- Lopez Vicchi, F., et al. Dopaminergic drugs in type 2 diabetes and glucose homeostasis. Pharmacol Res. 109, 74-80 (2016).
- Kalra, S., Kalra, B., Agrawal, N., Kumar, S. Dopamine: The forgotten felon in type 2 diabetes. Recent Pat Endocr Metab Immune Drug Discov. 5 (1), 61-65 (2011).
- Mahajan, R. Bromocriptine mesylate: FDA-approved novel treatment for type-2 diabetes. Indian J Pharmacol. 41 (4), 197-198 (2009).
- Caicedo, A. Paracrine and autocrine interactions in the human islet: more than meets the eye. Semin Cell Dev Biol. 24 (1), 11-21 (2013).
- Ballon, J. S., Pajvani, U., Freyberg, Z., Leibel, R. L., Lieberman, J. A. Molecular pathophysiology of metabolic effects of antipsychotic medications. Trends Endocrinol Metab. , (2014).
- Freyberg, Z., Aslanoglou, D., Shah, R., Ballon, J. S. Intrinsic and antipsychotic drug-induced metabolic dysfunction in schizophrenia. Front Neurosci. 11, 432(2017).
- de Leeuw van Weenen, E. J., et al. The dopamine receptor D2 agonist bromocriptine inhibits glucose-stimulated insulin secretion by direct activation of the alpha2-adrenergic receptors in beta cells. Biochem Pharmacol. 79 (12), 1827-1836 (2010).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados