Method Article
Isolamento, caracterização e alto Throughput análise de fluxo extracelular de Mouse primária Renal Tubular as células epiteliais
Neste Artigo
Resumo
Este protocolo fornece uma abordagem econômica para isolar e caracterizar pilhas do rato primária renal tubular que podem posteriormente ser sub cultivadas para avaliar funções biológicas renal ex vivo, incluindo bioenergética mitocondrial.
Resumo
A disfunção mitocondrial nas células epiteliais tubulares renais (TECs) pode levar a fibrose renal, das principais causas de doença renal crônica (DRC). Portanto, avaliar a função mitocondrial em TECs primárias pode fornecer insights valiosos sobre o status de bioenergético das células, fornecendo insights sobre a fisiopatologia da DRC. Enquanto há um número de protocolos complexos disponíveis para o isolamento e purificação de túbulos proximais em espécies diferentes, o campo não possui um método de baixo custo otimizado para isolamento de célula tubular sem a necessidade de purificação. Aqui, nós fornecemos um protocolo de isolamento que permite estudos enfocando tanto primária mouse TECs renais proximais e distais. Além de reagentes de baixo custo e mínimos animal os procedimentos exigidos no presente protocolo, as células isoladas mantêm altos níveis de energia após isolamento e podem ser sub cultivadas até quatro passagens, permitindo estudos contínuos. Além disso, usando um analisador de fluxo extracelular alto throughput, avaliamos a respiração mitocondrial diretamente nos TECs isolados em uma placa de 96 poços, para que nós fornecer recomendações para a otimização da densidade celular e a concentração de compostos. Estas observações sugerem que este protocolo pode ser usado para estudos tubular renal ex vivo , com uma produção consistente, bem padronizada de TECs renais. Este protocolo pode ter aplicações futuras mais amplas para estudar a disfunção mitocondrial associada com doenças renais, para fins de caracterização de drogas ou fármacos.
Introdução
Função de células epiteliais tubulares renais (TEC) é fortemente associada com a condição de saúde geral do rim. Sinalização patológica no rim provoca o quê de TECs, que desempenha um papel importante na fibrose renal e renal crônica (DRC) de doença1,2. Como um órgão altamente energético, o rim está perdendo apenas para o coração no consumo de oxigênio, principalmente através a fosforilação oxidativa mitocondrial3. Estudos de microscopia eletrônica revelaram uma correlação positiva de alterações morfológicas mitocondriais de eventos patológicos nos túbulos renais4. Disfunção mitocondrial em TECs causa fibrose renal através de transição epitelial de mesenquimais5 e defeituoso ácido graxo oxidação6. A fibrose é uma patologia renal progressiva que resulta em CKD. Portanto, compreender o status energético de TECs renais é uma necessidade para desvendar a fisiopatologia da DRC.
Existem tipos de célula > 20 no rim adulto7. Para estudar a função de TECs, uma cultura primária de células epiteliais renais é necessária como uma plataforma para aplicações de biologia molecular como tratamentos químicos e manipulações genéticas. Importante, manipulações genéticas podem ser feitas na vivo em camundongos via transgênese ou usando AAV gene entrega técnicas8 para que as células primárias isoladas já fosse manipuladas geneticamente. O isolamento de primários células tubulares renais de ratos9,10, ratos11,12,13, caninos14, coelhos15,16e os humanos17 ,18 tem sido relatado com etapas de purificação para produzir células tubulares proximais puras. Nestes protocolos anteriormente publicados que focam o isolamento das células tubulares proximais, centrifugação gradiente e classificando as experiências foram realizadas para fins de purificação19. Enquanto estes protocolos são valiosos para o estudo de túbulos proximais, eles não são suficientes, quando túbulos proximais e distais são necessários para ser estudado. Por exemplo, nosso estudo sobre a síndrome de Alport revelou que túbulos renais proximais e distais desempenham um papel importante na progressão de doença20, e, portanto, ambos os tipos de túbulos renais devem ser investigados em cultura. Um estudo recente sobre toxicidade renal flúor também mostrou que as alterações patológicas teve lugar em ambos os túbulos proximal e distal21. Portanto, este protocolo de isolamento é projetado e otimizado para as células tubulares proximais e distais de rins de rato com um custo mínimo de reagentes e procedimentos simples. Alternativamente, investigadores ainda podem seguir o protocolo até o passo 3.1 e adicionar etapas de purificação9 desse ponto em diante para o isolamento de células tubulares proximais puros.
As células isoladas apresentam altos níveis energéticos e mantêm as características epiteliais renais após as sub-culturas de 4 passagens. Usando um analisador de fluxo extracelular alto throughput, avaliamos a respiração mitocondrial diretamente nos TECs isolados em uma placa de 96 poços, o que leva a novas perspectivas na otimização de densidade celular. Estas observações sugerem que este protocolo pode ser aplicado a estudos de tubular renal ex vivo , com uma produção consistente, bem padronizada de TECs renais. Um significado adicional do presente protocolo é seu possível uso como uma ferramenta de alto rendimento para a caracterização de ex vivo de bioenergética mitocondrial em células de tubulares renais proximais e distais. Portanto, ele pode servir como uma plataforma para fins de caracterização de drogas de doenças renais ou descoberta da droga.
Protocolo
Todos os experimentos envolvendo animais foram aprovados pelo Comitê de uso da Universidade de Miami, em conformidade com as diretrizes do NIH e institucional Cuidado Animal.
1. placa de revestimento e preparação dos reagentes
- Prepare o revestimento de colágeno:
- Adicione 35 μL de colágeno I 2 mL de uma solução de ácido acético pré-filtrada 20 mM em um único prato de Petri-60mm. -Incubar à temperatura ambiente durante 1 h, secá-lo e expô-lo aos raios UV.
- Lave o revestimento 3x com PBS para remover qualquer resíduo de ácido e salvá-lo em um de 37 ° C CO2-incubadora de cultura de célula livre até que as células estão prontas para semeadura. A concentração final do revestimento colágeno é 5 μg/cm2.
- Preparar o tampão de perfusão: Adicionar 300 μL de penicilina-estreptomicina (P/S) para 30 mL de PBS e aquecer a mistura em banho maria a 37 ° C até que o isolamento começa.
- Preparar o tampão de digestão: dissolver 3,9 mg de colagenase tipo 2 em 30 mL de PBS, filtrar a solução através de um filtro de garrafa-top de 0,2 μm e aquecer em banho-maria a 37 ° C até que o isolamento começa.
- Prepare meios de cultura de células:
- Trazer os suplementos à temperatura ambiente. Sem filtragem, adicionar o suplemento (0,05 mL de soro fetal bezerro, 10 ng/mL de fator de crescimento epidérmico, 5 μg/mL de insulina, 0.5 μg/mL de epinefrina, 36 ng/mL de hidrocortisona e 5 μg/mL de transferrina 4 pg/mL de triiodo-L-Tironina) para os 500 mL de renal célula epitelial crescimento meio de base 2.
- Aquecer a mídia em um banho de água de 37 ° C até que esteja pronto para usar.
- Preparar compostos: preparar 50mm Compararia, rotenona de 10 mM, 10 mM oligomicina, 10mm antimycin A, 50mm, L-carnitina e 50mm etomoxir estocam soluções em DMSO, alíquota e armazenam os compostos a-20 ° C.
- Palmitato de sódio 2,5 mM em 220 mL de uma solução de NaCl 150 mM de preparar e aquecer a solução em um banho de água de 75 ° C até que o palmitato é totalmente dissolvido.
- Preparar a albumina de soro bovino (BSA): preparar 0,34 mM sem gordura BSA em 250 mL de 150 mM de NaCl. O controle BSA serve como um controle negativo para a solução de palma-BSA que pode ser preparado por seguindo passo 1.8.
- Conjuga o palmitato de BSA (Palm-BSA):
- Adicione a solução de palmitato gradualmente para a solução de BSA enquanto ainda está quente. Em seguida, ajustar o pH para 7,4 e misturá-los a 37 ° C, durante pelo menos 1 h completar a conjugação.
- Quando a conjugação está concluída, adicionar 150 mL de 150 mM de NaCl à solução, misture bem e salvar as alíquotas a-20 ° C. A solução final contém 1 mM de sódio palmitato e 0,17 mM BSA e será usada como um substrato de ácidos graxos para as células em um ensaio de fluxo extracelular à base de ácido graxo.
- Prepare a mídia basal do fluxo extracelular do ensaio:
- Adicionar 1 saco de pó DMEM e 20 mL de 200 mM L-glutamina (final de 4 mM) para 1 L de autoclavado dH2O e misture-os delicadamente.
- No dia do experimento bioenergética, adicione piruvato de sódio 100 µM para a mídia basal preparada para as preparações subsequentes de mídia de fluxo extracelular do ensaio deve ser usado em um ensaio de glicose ou ácidos graxos - respiração com base.
- Prepare a mídia baseada em glicose:
- Para medir a capacidade de respiração celular através da glicólise, adicione o pó de glicose de 17,5 mM, 100 µM controle BSA (como descrito na etapa 1.7) e 20 µM etomoxir (para inibir a oxidação de ácidos graxos) para a mídia basal acima descrita na etapa 1.9.
- Aquecer a mídia a 37 ° C, ajustar o pH para 7,4 e mantê-lo em banho-maria a 37 ° C, até que ele é usado em um ensaio de fluxo extracelular.
- Prepare a mídia com base em ácidos graxos:
- Para medir a capacidade de respiração celular através da oxidação de ácidos graxos, adicionar o pó de 10 milímetros 2D-glicose (glicose analógico para inibir a glicólise), 100 µM Palm-BSA (como descrito no passo 1.8) e 100 µM para a mídia basal da L-carnitina descrito acima na etapa 1.9.
- Aquecer a mídia a 37 ° C, ajustar o pH para 7,4 e mantê-lo em banho-maria a 37 ° C, até que ele é usado no ensaio de fluxo extracelular.
2. perfusão, digestão e colheita de rins de camundongos
- Anestesiar o mouse com um fluxo de isoflurano e corrigi-lo em uma posição supina. Certifique-se que o isolamento começa somente depois que o animal perde seus braço endireitante os reflexos e a profundidade anestésica é monitorizada por avaliações pitada utilizando Pinças atraumáticas, antes e durante o procedimento de22.
- Retire a pele, usando um creme depilatório, do peito do rato à sua área abdominal, desinfetar com iodo e limpa o resíduo de iodo.
- Fazer uma incisão no peito, cortar a pele para abrir a área toda abdominal e expor o coração e os rins.
- Configurar uma bomba de perfusão em 32 mL/min e remover quaisquer bolhas no tubo antes de iniciar a perfusão.
- Inserir uma agulha 27-G para o ventrículo esquerdo através do ápice do coração, assim como o buffer enche o coração e picar a aurícula direita para criar uma saída para que o buffer de perfusão circula como o coração bombeia e eventualmente for removido da saída da aurícula direita.
- Após a perfusão, mude a velocidade da bomba para 30 mL/min para a digestão.
- Depois de 20 mL de tampão de digestão é perfundido através do ápice, Remova ambos os rins para o isolamento da célula tubular.
3. tecido processamento e primária Tubular células isolamento
- Remover as cápsulas renais e medula, picar os dois rins em pedaços pequenos e incube-os em 10 mL de um tampão de digestão em um forno de 37 ° C com rotação suave por 5 min.
- Remova quaisquer tecidos renais não digerida, passando a reserva através de um filtro de 70 μm. Adicione 10 mL de meio de cultura para parar a digestão.
- Para coletar as células tubulares, centrifugar a suspensão de células filtrada a 50 x g por 5 min coletar a primeira pelota. Transferir o sobrenadante para um tubo novo e adicionar 5 mL de meios de cultura, centrífuga em 50 x g por 5 min assegurar todas as células tubulares são colecionados na segunda pelota.
A centrifugação é a uma velocidade inferior a pelota principalmente pesados túbulos. Mais tarde, depois que as células se recuperar do isolamento, a pura cultura tubular é centrifugada a uma velocidade maior durante as sub-culturas. - Ressuspender o primeiro em 20 mL de meio de cultura e centrifuga-lo a 50 x g por 5 min coletar a Terceira Pelotização.
- Resuspenda as pelotas de segunda e terceiros em 1 mL de meio de cultura. Mix 10 µ l da suspensão celular com 10 µ l de azul de Tripan, carregar a mistura na câmara A uma contagem slide e registro a viabilidade celular de automático da pilha contador (ver Tabela de materiais).
- Semente até 107 células (uma população heterogénea) em um único prato 60mm pré-revestido com colágeno e deixa que as células tubulares anexar durante a noite.
4. primário Tubular células sub-cultura e caracterização
- No dia 1 após o isolamento, recolher meios de cultura e centrifugue a 50 x g por 5 min qualquer flutuantes túbulos de Pelotas. Remover o sobrenadante e ressuspender as células em 4 mL de meio de cultura fresco e placa de volta para o mesmo prato de cultura.
- No dia 4, após o isolamento, remova a mídia de cultura antiga e adicionar mídia fresca.
- No dia 7 após o isolamento, separe as células por eles a incubar a 37 ° C em 2 mL de 0,25% do trypsin-EDTA por 5 min. Adicione 3 mL de meio de cultura para parar a reação e coletar as células por centrifugação a 250 x g durante 5 min.
- Para subcultura e caracterizar células da P0 P1, 5.000 células de sementes por alvéolo em uma placa de 24 Poços revestidos com colágeno eu conforme descrito acima.
- 24 h após a etapa 4.4, consertar as células no P1 com 4% PFA para 10 min, permeabilize-los com 0,2% Triton X-100 por 3 min e bloqueá-los com 10% de soro de burro (DS) por 1h à temperatura ambiente.
- Diluir, a 1: 100 em 10% DS, cada uma das seguintes proteínas: o angiotensinogen marcadores tubular proximal (AGT) e aquaporina 1 (AQP1); o marcador tubular distal E-caderina; o marcador mesangial CD90/Thy1; e o macrófago marcadores EGF-como módulo contendo mucina-como hormônio receptor-como cluster de diferenciação 68 (CD68) e 1 (F4/80) e incube-os com células durante a noite a 4 ° C.
- No dia seguinte, detectar qualquer coloração usando 1: 200-anticoelho, anti-rato ou anti-rato o anticorpos secundários fluorescente por 45 min. Com imagens sob microscopia confocal para confirmar a expressão dos marcadores, como mostrado na Figura 2A.
- No dia 3, após a sub-cultura de P1, separe as células para uma sub-cultura e caracterização em P2 por uma coloração dos marcadores tubulares, mesangiais e macrófago descritos na etapa 4.5. Imagem a coloração sob microscopia confocal para confirmar a expressão dos marcadores, como mostrado na Figura 2A.
- No dia 3, após a sub-cultura de P2, separe as células para uma sub-cultura e caracterização no P3 por uma coloração dos marcadores tubulares, mesangiais e macrófago descritos na etapa 4.5. Imagem a coloração sob microscopia confocal para confirmar a expressão dos marcadores, como mostrado na Figura 2A.
- Prepare a coloração do tecido:
- Secar ao ar livre selvagem-tipo congelado e Col4a3- / - slides de rim por 1h à temperatura ambiente e corrigi-los com 4% PFA durante 10 min. Permeabilize-los com 0,2% Triton X-100 por 10 min e bloqueá-los com 10% de soro de burro (DS) por 1h à temperatura ambiente. Acrescente os anticorpos contra as proteínas marcador descritos na fase 4.5 a 1: 200 e incube-os a 4 ° C durante a noite.
- No dia seguinte, detecta qualquer coloração com 1: 200-anticoelho, anti-rato ou anti-rato o anticorpos secundários fluorescente por 45 min. Com imagens sob um microscópio confocal para confirmar a expressão dos marcadores, como mostrado nas figuras 2B e 2C.
5. mitocôndria bioenergética ensaio
- Células tubulares de semente P1 em 20.000, 30.000 ou 40.000 células por poço em 100 μL de meios de cultura em uma microplaca de 96 poços pré-revestido com colágeno de2 μg/cm 5 eu no dia anterior os ensaios de fluxo extracelular.
- Para a hidratação do refil do sensor, levante o cartucho de sensor e encha cada um bem da placa com 200 µ l de uma solução de calibração. Cuidadosamente, carregar o cartucho volta para submergir os sensores da solução de calibração. Coloque o cartucho em um forno de 37 ° C sem CO2 pelo menos 7 h antes da utilização.
Para os melhores resultados, recomenda-se a hidratação de cartucho durante a noite. - Preparar os compostos: preparar 8 µM oligomicina 9 µM Compararia e mistura de rotenona/antimycin A 20 µM em glicose (descrito na etapa 1.10) e ácido graxo (descrito no passo 1.11) meios de ensaio de fluxo extracelular.
- Alterar os meios de comunicação: Aspire o meio de cultura celular, Adicionar 175 µ l dos meios de ensaio de glicose ou ácidos graxos (dependente o composto que está sendo trabalhado, consulte a etapa 5.3) e incube-os por 1h em uma de 37 ° C CO2-incubadora livre.
- Carregar os portos de cartucho com 25 µ l dos seguintes compostos: 8 μM oligomicina para Porto A atingir uma concentração final de 1 µM (Nota: como cada um bem irá conter µ l 175 de mídia, o composto terá diluído 8 x), 9 μM Compararia no Porto B a obter uma concentração final de 1 µM (Nota: como cada um bem irá conter µ l 175 de mídia e 25 µ l da solução injetada do Porto A mais, o composto terá 9 diluídos x) e 20 µM rotenona/antimycin A no porto C a obter uma concentração final de 2 µM para cada composto (Nota : como cada um bem irá conter µ l 175 de mídia além de 50 µ l da solução injetada de portos A e B, o composto terá diluído 10 x).
- Adicione água para todos os poços na porta D e todas as outras portas de poços de fundo (sem pilhas). Incubar a 37 ° C CO2o cartucho-incubadora grátis por 10 min.
- Liga o analisador de fluxo extracelular e o controlador.
- Abra o Software Analyzer e o seguinte protocolo de entrada:
- Escolha o ensaio padrão. Pressione Assistente de ensaio. Usando a guia de compostos , atribuir o layout composto e use a guia grupos e rótulos para rotular os grupos experimentais. Lembre-se de atribuir os poços vazios (sem células) como pano de fundo.
- Na guia protocolo , defina os seguintes ciclos de mix e medida utilizando os comandos disponíveis, como indicado na tabela 1: calibrar, mistura por 2 min, espere por 2 min e medida por 3 min (repetir este ciclo x 2-3); injetar o porto A, mistura por 2 min, aguarde 2 min, medida por 3 min (repetir este ciclo x 2-3); injetar o Porto B, misturar por 2 min, esperar por 2 min, medida por 3 min (repetir este ciclo x 2-3); injetar a porta C, misture por 2min, esperar por 2 min, medida por 3 min (repetir este ciclo x 2-3). Pressione End assistente. Também é possível salvar o modelo atual para uso futuro.
- Pressione Iniciar para iniciar a calibração. O analisador então automaticamente ejeta o suporte da placa e pede o prato de cartucho para ser inserido.
- Quando a etapa de calibração é feita (normalmente em 20-25 min), pressione o comando prompt para mudar a placa do cartucho para a placa de células e continuar a execução.
- Quando a execução é concluída, os dados de transferência e retire a placa de 96 poços. Adicionar Hoechst (1:1, 000) para cada um dos poços de ensaio e incube-os por 5 min a 37 ° C. Normalize os dados OCR para contagem de células por uma medida da fluorescência Hoechst lendo uma excitação 355 nm e uma emissão de 460 nm.
Resultados
Digestão e perfusão renal rendimento altamente viáveis células epiteliais tubulares:
Células epiteliais tubulares renais de mouse foram isoladas seguindo as etapas descritas nas seções 1-3 do protocolo descrito acima.
Após as digestões, uma população heterogênea de células de rim túbulos incompletamente digeridos e outros restos de tecido que é menor do que 70 µm foram chapeados para o prato de cultura no dia de isolamento. Alterações do dia 0 ao dia 1, depois o isolamento geralmente são esperados para ser visto apenas no anexo de célula em vez do crescimento da célula. Olhando através da população heterogênea flutuante, apenas algumas células tubulares foram afixadas no dia 1 (figura 1A). Uma re-coleção de células no dia 1, uma centrifugação e uma re-chapeamento ajudou para remover detritos leves e liquidar as peças pequenas do túbulo para o lançamento da célula tubular. Do dia 1 a dia 3, as alterações eram esperadas não só em um acessório de celular a melhor, mas também em uma taxa de crescimento de célula notavelmente melhorada que observou-se com uma densidade celular triplicou em comparação com o dia 1 (figura 1A). Na fase inicial de crescimento, as células formaram diversas colônias em povoada em torno das colônias. A partir daí, as células isoladas foram totalmente recuperadas e exibidos uma proliferação saudável. Dia 5, as células estavam em uma confluência de 80-90% em um prato de Petri-60mm com alguns espaços entre uma célula para outra e a colônia de Colônia (figura 1A).
Sub-cultura e caracterização das células tubulares isoladas:
As células epiteliais tubulares renais isoladas foram cultivadas sub para um seguinte caracterização os passos descritos na secção 4 do protocolo descrita acima.
Do dia 5, as células totalmente recuperaram do isolamento e começaram a proliferar vigorosamente. Uma semana após o isolamento, as células cresceram a confluência em uma placa de Petri 60mm. Após 1 semana em uma cultura em passagem 0, as células estavam prontas para ser sub cultivadas a passagem 1 e, posteriormente, para 2 passagens mais. Padrões de crescimento semelhantes foram observados na passagem 1 e 2 de passagem. Geralmente, leva menos de uma semana para as células na passagem 1 e 2 para crescer a confluência de outras sub-culturas (figura 1B). A cultura contínua da confluentes de passagem 0 ao status de passagem 2 mostrou uma cúpula extensa formação23,24 (figura 1B), sugerindo que as células isoladas mantenham uma saudável onde eles excretada líquidos similares para um status in vivo . Isto causou a monocamada de células para levantar a placa, mas permanecer conectado via junções apertadas.
Para caracterizar as células em cultura, realizamos coloração imunofluorescente nas culturas de células de passagem 1 passagem 4, bem como em um controle celular humano-linha proximal renal HK-2 células epiteliais. Marcadores tubulares proximais, aquaporina 1 (AQP1)25 e angiotensinogen (AGT)9, o marcador tubular distal E-caderina25, o marcador epitelial músculo liso actina (SMA)26,,27,28, macrófago marcadores F4/8029 e CD6830e o antígeno de diferenciação de timócitos mesangial marcador 1 (Thy1/CD90)9 foram usados para os estudos de caracterização. Ambas as proteínas tubulares proximais AQP1 e AGT foram consistentemente altamente expressos nas células tubulares isoladas de passagem 1 a passagem 4, bem como as controlo positivo HK-2 proximais células epiteliais (Figura 2A). A proteína tubular distal E-caderina foi expressa nas células tubulares isoladas através de passagem 4 e também foi observada nas células HK-2 (Figura 2A). SMA foi expresso abundantemente nas células tubulares isoladas e nas células controle HK-2, consistentes com relatórios publicados26,27. Por outro lado, as proteínas mesangiais Thy1 e proteína macrófago F4/80 estavam ausentes em ambas as células tubulares isoladas e as células de controle HK-2 (Figura 2A). CD68 mostrou uma expressão mínima nas células HK-2 e nas células tubulares isoladas na passagem 1 e 2 de passagem e então sua expressão se tornou indetectável de 3 passagem passagem 4 (Figura 2A). Os resultados sugerem que as células isoladas seguindo este protocolo são uma mistura de células tubulares proximais e distais. Para comparar as expressões destes marcador proteínas na vivo, realizamos a coloração em tecidos congelados nos rins. Marcadores tubulares, incluindo proteína AQP1, AGT e E-caderina e mesangiais Thy1 foram encontrados altamente expresso em rins colhidos de um rato saudável do selvagem-tipo (Figura 2B). Baixas expressões de F4/80 e CD68 foram observados no selvagem-tipo rins mas amplamente expresso em rins de um rato Col4a3- / - que desenvolveu insuficiência renal com um macrófago infiltração20,31 ( colhidos Figura 2).
Ensaio de bioenergética mitocondrial nas células tubulares primárias isoladas:
As etapas de ensaio de respiração mitocondrial são descritas na secção 5 do protocolo descrito acima.
A respiração mitocondrial das células tubulares primárias isoladas é medida por uma análise de fluxo extracelular da taxa de consumo de oxigênio (OCR) no chapeamento de diferentes densidades. Para dosear a densidade de chapeamento, 20.000, 30.000 e 40.000 TECs primárias por alvéolo foram semeadas em uma microplaca de XF96 de 96 poços no dia anterior (aproximadamente 20 h antes) o ensaio de fluxo extracelular (Figura 3A). Após a análise de fluxo extracelular, as medições de OCR em seguida foram normalizadas para a contagem de células por uma quantificação da Hoechst coloração. Chapeamento do TECs de 20.000, 30.000 ou 40.000 células/poço resultou em um OCR basal média de 25, 45 ou 50 pmol/min, respectivamente (Figura 3A). Além disso, imagens microscópicas das células chapeadas revelaram que 40.000 células/poço coberto toda a superfície do fundo dos poços de microplacas melhores que as outras densidades de chapeamento (Figura 3B). Mesmo que o OCR máximo não aumentar usando 40.000 células em comparação com a densidade de 30.000 células, recomendamos uma densidade de células de cerca de 40.000 células/poço para ideais interações entre células e compostos.
Além disso, em nossos experimentos, a concentração ideal dos compostos inibitórios/desacoplador foi mostrada para ser 1 oligomicina µM e 1 µM Compararia 2 µM rotenona/antimycin-A (protocolos de ensaio de fluxo extracelular e as injeções de porta são listados em tabela 1 ; os experimentos de otimização não são mostrados). No entanto, é aconselhável para todos os usuários executar um teste preliminar com várias concentrações desses compostos, idealmente inferiores e superiores aos valores publicados, garante os melhores resultados.
Um ensaio de fluxo extracelular produz um número de parâmetros importantes para a avaliação da bioenergética de TECs renais. Por exemplo, como oxidação de ácidos graxos é mostrada para ser especificamente defeituoso em TECs, o uso de mídia contendo substrato de ácido graxo (palmitato) juntamente com o inibidor da glicólise (2 DG) pode servir como uma ferramenta útil para avaliar diretamente a oxidação de ácidos graxos em TECs em passagens 1 e 2 (Figura 3). No caso de fibrose renal, a capacidade de respiração geral das células é esperada para ser menor do que um rim saudável, mesmo que a mídia baseada em glicose não pode revelar quaisquer diferenças.
Tomados em conjunto, o ensaio de fluxo extracelular, especialmente para avaliar a capacidade de oxidação de ácidos graxos, pode ser utilizado como uma medida informativa para avaliar o estado energético de TECs renais na quais as alterações patológicas que afectam a peça de perfil bioenergética um papel importante na fibrose renal e a progressão para insuficiência renal.
| Passos | Tempo (min) |
| Calibrar | |
| Equilibrar: | 00:12:00 |
| Medida 1 | 3 loops |
| Mix | 00:02:00 |
| Espere | 00:02:00 |
| Medida | 00:03:00 |
| Mix | 00:02:00 |
| Espere | 00:02:00 |
| Medida | 00:03:00 |
| Mix | 00:02:00 |
| Espere | 00:02:00 |
| Medida | 00:03:00 |
| Injetar uma (1 μM oligomicina) da porta | 2 loops de |
| Mix | 00:02:00 |
| Espere | 00:02:00 |
| Medida | 00:03:00 |
| Mix | 00:02:00 |
| Espere | 00:02:00 |
| Medida | 00:03:00 |
| Injetar o Porto B (FCCP 1 μM) | 2 loops de |
| Mix | 00:02:00 |
| Espere | 00:02:00 |
| Medida | 00:03:00 |
| Mix | 00:02:00 |
| Espere | 00:02:00 |
| Medida | 00:03:00 |
| Injetar C Porto (Rotenon/Antimycin 2 μM) | 2 loops de |
| Mix | 00:02:00 |
| Espere | 00:02:00 |
| Medida | 00:03:00 |
| Mix | 00:02:00 |
| Espere | 00:02:00 |
| Medida | 00:03:00 |
Tabela 1. Padronizados de análise de fluxo extracelular executando o protocolo para medições de OCR ideais nas células tubulares primárias.
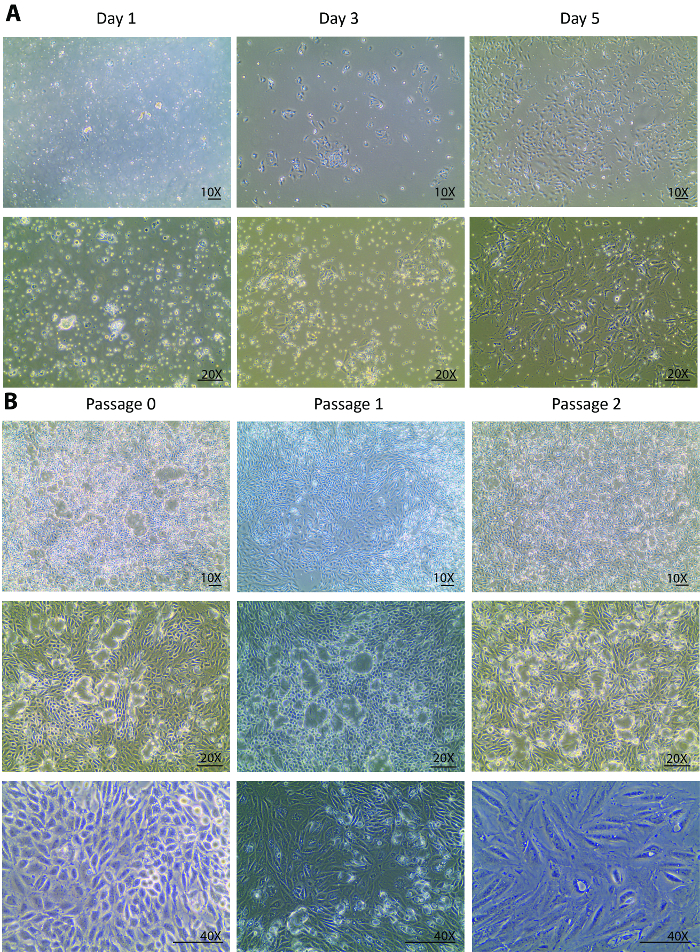
Figura 1. Células de cultura de células tubulares primárias isoladas. (A) as células tubulares primárias isoladas anexar mais cedo no dia 1 e crescer robustamente de dia 3 a dia 5. As imagens são tiradas sob 10x e 20 X de objectivos. (B), este painel mostra uma subcultura de células tubulares isoladas primárias de passagem 0 a passagem 3. As imagens são tiradas sob 10x e 20 X objetivos, as visões das cúpulas da célula e sob um objetivo X 40 para uma visão das alterações morfológicas através das passagens. O scalebar = 100 µm. clique aqui para ver uma versão maior desta figura.
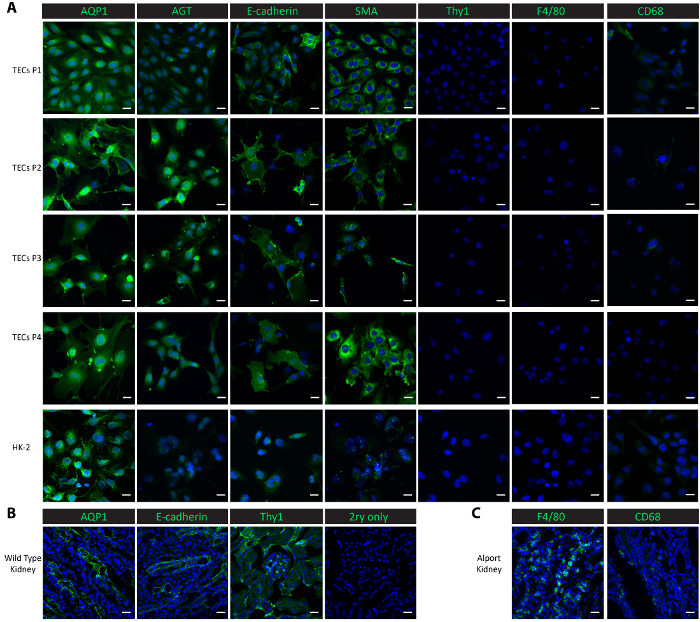
Figura 2. Caracterização de células isoladas de tubulares primárias. (A) imunocoloração com anticorpos contra proteínas tubulares proximais (AQP1, AGT), uma proteína tubular distal (E-caderina), uma proteína epitelial (SMA), uma proteína mesangial (Thy1) e proteínas de macrófagos (F4/80, CD68) mostram que o principal isolado células tubulares e sub-culturas subsequentes são puras células tubulares proximais e distais. (B) este painel mostra uma coloração do túbulo proximal, túbulo distal e mesangiais proteínas nos tecidos renais de um rato selvagem-tipo saudável como um controle positivo e um controle negativo não primário. (C) este painel mostra uma coloração das proteínas macrófago F4/80 e CD68 no tecido renal, coletados de um rato Col4a3- / - como um controle positivo. Scalebar = 20 µm. A DAPI é mostrado em azul. As proteínas de marcador são mostradas em verde. Clique aqui para ver uma versão maior desta figura.
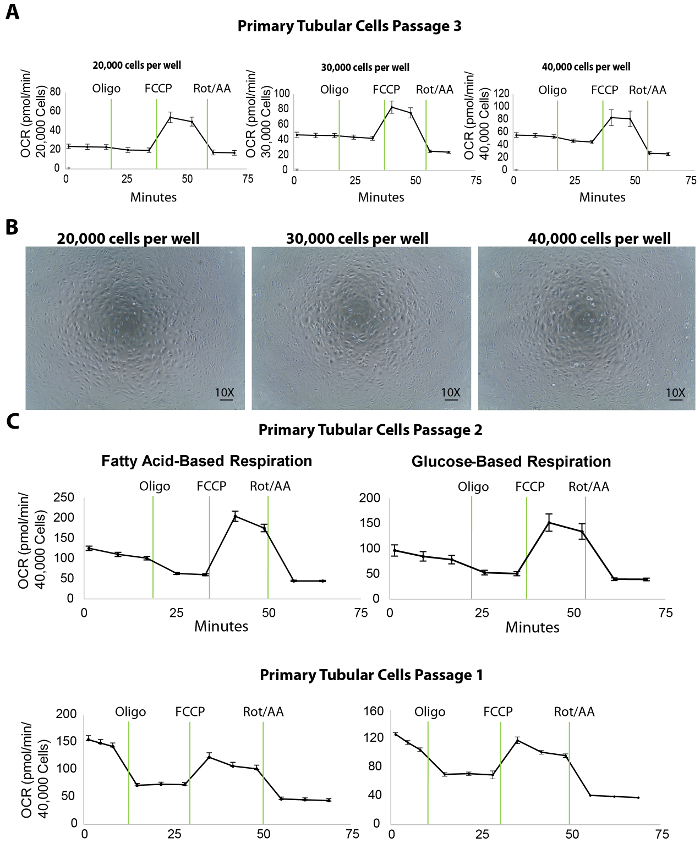
Figura 3. Ensaio de fluxo extracelular em células tubulares primárias isoladas no chapeamento de diferentes densidades. (A) aumento celular chapeamento densidade aumenta os níveis de respiração basal nas células tubulares primárias, testado no passage 3. (B) este painel mostra imagens microscópicas de células tubulares primárias cultivadas em uma microplaca de XF96 semeada em 20.000, 30.000 e 40.000 células/poço densidades. Scalebar = 100 µm. (C), este painel mostra um ensaio de fluxo extracelular baseados em glicose ou ácidos graxos nas células tubulares primárias em passagens 2 e 1. Os dados são média ± SEM. clique aqui para ver uma versão maior desta figura.
Discussão
Nós otimizado um protocolo que permite o isolamento eficiente de rato renal tubular células epiteliais (TECs) e mostrou que as células podem ser cultivadas sub para uma análise de fluxo extracelular avaliar a respiração mitocondrial na presença de ácidos graxos- e/ou substratos baseado em glicose. Este protocolo destina-se a estudos enfocando as células tubulares proximais e distais e serve como um quadro para a criação de experiências mais complexas para o entendimento de Nefropatias associadas a patologia TEC. Comparado com protocolos previamente publicados9,10,19, este método não requer gradientes separações com longos tempos de centrifugação ou uso de um anticorpo amplo para classificação e, portanto, oferece uma forma mais guia eficiente e otimizado para pesquisadores que trabalham no campo metabólico tubular renal. Existem vários passos críticos no presente protocolo, incluindo a digestão, re-coleção e densidade de chapeamento e otimização composta para o ensaio de fluxo extracelular.
Escolher o tipo correto de colagenase e a concentração ideal é a chave para uma bem sucedida digestão e dissociação das células tubulares de tecidos renais. Comparado a outros tipos de colagenases, colagenase tipo 2 contém níveis relativamente mais elevados de atividade de protease, capaz de desassociar estruturas compactas renais. Para minimizar as chances de contaminação como resultado de uma perfusão prolongada e tempo de digestão, colagenase tipo 2 de 0,013% foi perfundido a 30 mL/min. A cápsula renal só foi removida depois de ambos os rins foram colhidos a partir do animal e transferidos para uma capa de cultura celular esterilizado. Os rins foram picados em pedaços pequenos e continuaram sua incubação com 10 mL de um tampão de digestão para mais 5 minutos para uma digestão completa e liberação máxima das células tubulares.
Embora, após a digestão, a suspensão de tecido é passada através de um filtro de 70 µm para remover pedaços de tecido muito grande, haverá ainda não digeridos túbulos que passam através do filtro e ficar dentro da suspensão celular e obter chapeados para o prato de cultura. Demora mais tempo do que o normal para esses túbulos liberar células tubulares e fixar firmemente a placa de cultura. Portanto, é importante coletar a suspensão de eritrócitos e centrifugar para pelotas os túbulos desanexados e células no segundo dia após o chapeamento de célula. Esta etapa de baixa velocidade de centrifugação mais remove outros tipos de células que são mais leves que as células tubulares e permite túbulos desanexados e células tubulares para resolver.
A identificação de densidade celular adequada é o primeiro e fundamental passo para um ensaio de sucesso fluxo extracelular. Os resultados mostraram que 40.000 células por poço em uma microplaca de XF96 é ideal para células tubulares primárias em um ácido graxo e um ensaio de respiração baseado em glicose (Figura 3). Neste protocolo, células tubulares isoladas foram utilizadas para o ensaio de fluxo extracelular em passagens 1 e 2. As células cultivadas sub para passagem 3, embora mantiveram uma expressão de marcadores de tubular (Figura 2) e um desempenho decente em ensaios a bioenergética (Figura 3A) e eles mostraram níveis de diminuição da respiração basal em comparação com passagem 2 (mostrado por comparar a OCR nos painéis mais à direita da Figura 3A , a Figura 3). Esta diminuição não pode afetar substancialmente saudáveis células tubulares (por exemplo, aqueles isolados de ratos jovens do selvagem-tipo). No entanto, para estudos em células isoladas de modelos CKD do mouse que já tem uma respiração mitocondrial diminuída, passagens superiores das células podem causar uma nova diminuição da respiração basal que afetaria os resultados do ensaio do fluxo extracelular. Nos estudos realizaram aqui, as células de passagem 1 e passagem 2 mostrou alto níveis de respiração basal. Portanto, seguindo este protocolo, recomendamos o uso destas duas passagens antecipadas para estudos de respiração mitocondrial com células isoladas de animais saudáveis e doentes. As células de passagem 2 ainda devem ser tida em conta se a sub-cultura de passagem 1 não produz células suficientes para o ensaio de fluxo. Além de estudos de bioenergética, nossa pesquisa anterior mostra que TECs primários na passagem 3 podem ser extremamente útil para tratamentos com compostos seguidos de proteína e RNA estudos (dados não mostrados). Sendo assim, sugerimos que os investigadores usando esse protocolo para isolar as células tubulares devem escolher cuidadosamente a passagem ideal para aplicações de pesquisa diferente.
O princípio de funcionamento da análise de fluxo extracelular baseia-se sobre as interações entre os compostos injetados e os complexos de cadeia de respiração e o efeito do desacoplador. Oligomicina é um inibidor do complexo V (ATP sintase) e é usada para distinguir o consumo de oxigênio vinculados ao ATP e o consumo de oxigênio que é necessário para superar o vazamento de próton regular através de uma membrana interna mitocondrial32. Compararia desacopla o consumo de oxigênio, desde a produção de ATP por perturbar o potencial de membrana mitocondrial. Assim, ele fornece uma medida da capacidade máxima da respiração como ele contorna a capacidade limitada de efluxo de iões um próton pela ATP sintase, permitindo que um transporte de protões através da membrana. Antimycin-A, um inibidor do complexo III e a rotenona, um complexo bloqueador, são usados em combinação para desligar a respiração mitocondrial inteira, permitindo uma diferenciação entre o mitocondrial vs o consumo de oxigênio não-mitocondrial em as células. Estes compostos sempre deverá ser titulados por um tipo de célula específica antes do ensaio de fluxo extracelular determinar as concentrações ideais que geram as curvas ideais de OCR. Aqui, nós recomendamos 1 µM de oligomicina, 1 µM de FCCP e 2 µM de rotenona/antimycin A para o ensaio de fluxo extracelular na TECs primários.
Em conclusão, este protocolo fornece uma maneira simples e econômica para isolar renais primárias proximais e distais tubulares células epiteliais que podem ser usadas para avaliar bioenergética mitocondrial ex vivo. Enquanto este protocolo pode ser útil em uma ampla gama de estudos de biologia molecular, explorando a função biológica das células epiteliais tubulares renais, reconhecemos suas limitações quando aplicá-lo aos estudos, precisando de puros túbulos proximais ou distais. Por exemplo, estudos sobre a síndrome de Lowe, uma disfunção tubular proximal seletivo33ou estudos sobre acidose tubular renal distal, uma disfunção tubular distal34, exigiria um protocolo mais sofisticado para isolamento de célula e purificação. No entanto, para a maioria dos estudos que comparam os túbulos vs glomérulos e para estudos para potenciais reguladores da respiração mitocondrial nas células tubulares de tela em geral, o protocolo prevê uma abordagem viável alto throughput. Portanto, este protocolo pode ter amplas aplicações para estudar a disfunção mitocondrial associada com doenças renais, para fins de validação de descoberta ou alvo de drogas.
Divulgações
Os autores não têm nada a declarar.
Agradecimentos
Este trabalho foi apoiado pelas seguintes subvenções para Lina A. Shehadeh: o Instituto Nacional de saúde (R56HL132209 e 1R01HL140468) e Instituto de pesquisa do centro de Miami.
Materiais
| Name | Company | Catalog Number | Comments |
| Collagen I Rat Protein, Tail | ThermoFisher Scientific | A1048301 | |
| Acetic Acid | J.T.Baker | 9508 | |
| Collagenase Type II | Worthington | LS004176 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Renal Epithelial Cell Growth Medium 2 Kit | PromoCell | C-26130 | |
| 2-Deoxy glucose | Sigma | D6134 | |
| Glucose | Sigma | G8270 | |
| L-Carnitine | Sigma | C0283 | |
| Etomoxir | Sigma | E-1905 | |
| Oligomycin | Sigma | 75351 | |
| Carbonyl cyanide 4-(trifluoromethoxy) phenylhydrazone (FCCP) | Sigma | C2920 | |
| Rotenone | Sigma | R8875 | |
| Antimycin-A | Sigma | A8674 | |
| Bovine Serum Albumin (BSA) | Sigma | A7030 | |
| Sodium palmitate | Sigma | P9767 | |
| NaCl | Sigma | S7653 | |
| Sodium pyruvate | Sigma | P5280 | |
| L-Glutamine 200mM solution | Sigma | G7513 | |
| DMEM powder | Sigma | D5030-1L | |
| Hoechst 33342 | LifeTechnologies | H3570 | |
| Trypan Blue Staining (0.4%) | LifeTechnologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Micro Dissecting Forceps | Roboz | RS-5101 | |
| TC10 automated cell counter | Bio-Rad | 506BR2119 | |
| MINIPULS 3 Peristaltic Pump | Gilson Inc. | GM3P | |
| Seahorse XFe96 Analyzer | Seahorse Bioscience | S7800A | |
| Seahorse XFe96 FluxPack (includes sensor cartridges, microplates, and calibrant) | Seahorse Bioscience | 10260-100 |
Referências
- Bielesz, B., et al. Epithelial notch signaling regulates interstitial fibrosis development in the kidneys of mice and humans. Journal of Clinical Investigation. 120 (11), 4040-4054 (2010).
- Fabian, S. L., et al. Hedgehog-Gli pathway activation during kidney fibrosis. American Journal of Pathology. 180 (4), 1441-1453 (2012).
- Forbes, J. M. Mitochondria-power players in kidney function. Trends in Endocrinology & Metabolism. 27 (7), 441-442 (2016).
- Suzuki, T., Furusato, M., Takasaki, S., Ishikawa, E. Giant mitochondria in the epithelial cells of the proximal convoluted tubules of diseased human kidneys. Laboratory Investigation. 33 (6), 578-590 (1975).
- Yuan, Y., et al. Mitochondrial dysfunction accounts for aldosterone-induced epithelial-to-mesenchymal transition of renal proximal tubular epithelial cells. Free Radical Biology & Medicine. 53 (1), 30-43 (2012).
- Kang, H. M., et al. Defective fatty acid oxidation in renal tubular epithelial cells has a key role in kidney fibrosis development. Nature Medicine. 21 (1), 37-46 (2015).
- Al-Awqati, Q., Oliver, J. A. Stem cells in the kidney. Kidney International. 61 (2), 387-395 (2002).
- Rocca, C. J., Ur, S. N., Harrison, F., Cherqui, S. rAAV9 combined with renal vein injection is optimal for kidney-targeted gene delivery: conclusion of a comparative study. Gene Therapy. 21 (6), 618-628 (2014).
- Kamiyama, M., Garner, M. K., Farragut, K. M., Kobori, H. The establishment of a primary culture system of proximal tubule segments using specific markers from normal mouse kidneys. International Journal of Molecular Sciences. 13 (4), 5098-5111 (2012).
- Terryn, S., et al. A primary culture of mouse proximal tubular cells, established on collagen-coated membranes. American Journal of Physiology-Renal Physiology. 293 (2), F476-F485 (2007).
- Tang, M. J., Suresh, K. R., Tannen, R. L. Carbohydrate metabolism by primary cultures of rabbit proximal tubules. American Journal of Physiology. 256, C532-C539 (1989).
- Gesek, F. A., Wolff, D. W., Strandhoy, J. W. Improved separation method for rat proximal and distal renal tubules. American Journal of Physiology. 253, F358-F365 (1987).
- Vinay, P., Gougoux, A., Lemieux, G. Isolation of a pure suspension of rat proximal tubules. American Journal of Physiology. 241 (4), F403-F411 (1981).
- Taub, M., Chuman, L., Saier, M. H., Sato, G. Growth of Madin-Darby canine kidney epithelial cell (MDCK) line in hormone-supplemented, serum-free medium. Proceedings of the National Academy of Sciences of the United States of America. 76 (7), 3338-3342 (1979).
- Chung, S. D., Alavi, N., Livingston, D., Hiller, S., Taub, M. Characterization of primary rabbit kidney cultures that express proximal tubule functions in a hormonally defined medium. Journal of Cell Biology. 95 (1), 118-126 (1982).
- Rubera, I., et al. Chloride currents in primary cultures of rabbit proximal and distal convoluted tubules. American Journal of Physiology. 275, F651-F663 (1998).
- Inoue, C. N., et al. Use of cultured tubular cells isolated from human urine for investigation of renal transporter. Clinical Nephrology. 53 (2), 90-98 (2000).
- Van der Hauwaert, C., et al. Isolation and characterization of a primary proximal tubular epithelial cell model from human kidney by CD10/CD13 double labeling. PLoS One. 8 (6), e66750 (2013).
- Helbert, M. J., Dauwe, S. E., Van der Biest, I., Nouwen, E. J., De Broe, M. E. Immunodissection of the human proximal nephron: flow sorting of S1S2S3, S1S2 and S3 proximal tubular cells. Kidney International. 52 (2), 414-428 (1997).
- Wen Ding, K. Y., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Quadri, J. A., et al. Fluoride-associated ultrastructural changes and apoptosis in human renal tubule: a pilot study. Human & Experimental Toxicology. , (2018).
- Kawai, S., Takagi, Y., Kaneko, S., Kurosawa, T. Effect of three types of mixed anesthetic agents alternate to ketamine in mice. Experimental Animals. 60 (5), 481-487 (2011).
- Condorelli, L., et al. Effect of fluid shear stress on tubular kidney epithelial cell structure. World Congress on Medical Physics and Biomedical Engineering. 25 (10), 50-52 (2009).
- Aschauer, L., et al. Delineation of the key aspects in the regulation of epithelial monolayer formation. Molecular and Cellular Biology. 33 (13), 2535-2550 (2013).
- George, S. K., et al. Potential use of autologous renal cells from diseased kidneys for the treatment of renal failure. PLoS One. 11 (10), e0164997 (2016).
- Elberg, G., et al. MKL1 mediates TGF-beta1-induced alpha-smooth muscle actin expression in human renal epithelial cells. American Journal of Physiology-Renal Physiology. 294 (5), F1116-F1128 (2008).
- Elberg, G., Guruswamy, S., Logan, C. J., Chen, L., Turman, M. A. Plasticity of epithelial cells derived from human normal and ADPKD kidneys in primary cultures. Cell and Tissue Research. 331 (2), 495-508 (2008).
- Cai, Q., et al. Toxicity of acetaminophen, salicylic acid, and caffeine for first-passage rat renal inner medullary collecting duct cells. Journal of Pharmacology and Experimental Therapeutics. 306 (1), 35-42 (2003).
- Zhao, Y., et al. Isolation and epithelial co-culture of mouse renal peritubular endothelial cells. BMC Cell Biology. 15, 40 (2014).
- Barros, M. H., Hauck, F., Dreyer, J. H., Kempkes, B., Niedobitek, G. Macrophage polarisation: An immunohistochemical approach for identifying M1 and M2 macrophages. PLoS One. 8 (11), e80908 (2013).
- Kim, M., et al. Progression of Alport kidney disease in Col4a3 knock out mice is independent of sex or macrophage depletion by clodronate treatment. PLoS One. 10 (11), e0141231 (2015).
- Linnett, P. E., Beechey, R. B. Inhibitors of the ATP synthethase system. Methods in Enzymology. 55, 472-518 (1979).
- Bockenhauer, D., et al. Renal phenotype in Lowe Syndrome: a selective proximal tubular dysfunction. Clinical Journal of the American Society of Nephrology. 3 (5), 1430-1436 (2008).
- Ranawaka, R., Dayasiri, K., Gamage, M. A child with distal (type 1) renal tubular acidosis presenting with progressive gross motor developmental regression and acute paralysis. BMC Research Notes. 10 (1), 618 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados