Method Article
Análise da função de células Beta utilizando imagens de cálcio de célula única resolução em ilhotas de Zebrafish
Neste Artigo
Resumo
Funcionalidade de células beta é importante para a homeostase de glicose sanguínea, que é avaliada em célula única resolução usando um repórter geneticamente codificado para o influxo de cálcio.
Resumo
As células-beta do pâncreas respondem ao aumento das concentrações de glicose do sangue através da secreção da hormona insulina. A disfunção das células beta leva a hiperglicemia e consequências graves, com risco de vida. Compreensão de como as células-beta operam sob condições fisiológicas e que fatores genéticos e ambientais podem causar sua disfunção pode levar a melhores opções de tratamento para pacientes diabéticos. A capacidade de medir os níveis de cálcio em células-beta serve como um importante indicador da função de células beta, como o fluxo de liberação de insulina de gatilhos de íons de cálcio. Aqui descrevemos um protocolo para monitorar o influxo de cálcio glicose-estimulada em células-beta do zebrafish usando GCaMP6s, um sensor geneticamente codificado de cálcio. O método permite o monitoramento da dinâmica de cálcio intracelular com resolução de célula única em ex vivo montado ilhotas. A glicose-capacidade de resposta das células-beta dentro da mesma ilha pode ser capturado simultaneamente sob concentrações diferentes de glicose, que sugere a presença de heterogeneidade funcional entre as células-beta do zebrafish. Além disso, a técnica fornece a alta resolução temporal e espacial, que revela a natureza oscilatória o influxo de cálcio após estimulação de glicose. Nossa abordagem abre as portas para usar o zebrafish como um modelo para investigar a contribuição de fatores genéticos e ambientais para a função de células beta e disfunção.
Introdução
Nossa glicose no sangue é mantida em uma estreita faixa, em grande parte devido a função do pâncreas endócrino. A função endócrina do pâncreas é executada por ilhotas de Langerhans, que contêm células secretoras de hormônio. As beta-células secretoras de insulina são responsáveis pela redução dos níveis de glicose sanguínea após uma refeição contendo carboidratos. A secreção de insulina inadequada de células beta pode resultar em diabetes1, que é caracterizada por glicemia alta sustentada. Tipo 1 e Diabetes tipo 2, que atualmente atinge mais de 400 milhões de pessoas no mundo, leva a morbidade e mortalidade2. Investigando os fatores moleculares e ambientais que contribuem para a disfunção da célula beta, entenderemos melhor como diabetes tipo 2 começa e progride. Além disso, a capacidade de diferenciar células estaminais humanas em células-beta funcional em vitro pode fornecer uma fonte de novas células-beta das terapias de reposição celular no Diabetes tipo 1. Para este fim, é importante estudar a função da célula beta e maturação em organismos-modelo genético a fim de obter o conhecimento necessário para fazer as células-beta funcionais em um prato.
Funcionalidade de células beta pode ser monitorada no nível de conjunto-ilhéu por quantificar a quantidade total de insulina secretada em resposta à glicose-estimulação. Esta abordagem cumulativa estuda o ilhéu como um único grupo de células sem diferenciação individual Propriedades da célula. No entanto, a análise das respostas de glicose de beta-células individuais revelou uma diversidade nas propriedades funcionais das células beta e a presença de heterogeneidade3. Para avaliar a função das células beta-individuais, é possível monitorar as alterações intracelulares que levam à secreção de insulina4. A secreção de insulina é precedida por uma entrada de glicose para as células-beta. A glicose que entra nas células-beta é rapidamente metabolizada a ATP. Altas concentrações de ATP intracelulares diminuem a probabilidade aberta de canais de íons de potássio sensíveis ao ATP levando a despolarização da célula beta. Despolarização abre os canais iônicos de cálcio voltagem-sensíveis e aumenta cálcio intracelular. Por sua vez, cálcio desencadeia a exocitose de insulina, que é liberada na circulação e reduz os níveis de glicose através da promoção da utilização de glicose5,6,7.
Várias estratégias foram aplicadas para investigar a função das células beta, incluindo monitoramento do potencial de membrana8, visualização directa de insulina-vesículas de exocitose9e quantificação de intracelular Ca2 + afluxo como um proxy para glicose-resposta10. Entre eles, imagem latente de intracelular Ca2 + fornece a vantagem da extrapolação da análise de várias células individuais dentro da mesma ilhéu11,12, permitindo a comparação direta da glicose-resposta entre beta-células individuais. Concentração de Ca2 + intracelular pode ser monitorada usando corantes fluorescentes sensíveis ao cálcio13 ou cálcio geneticamente codificado indicadores (GECIs)14. Considerando que o cálcio-indicador corantes falta especificidade de tipo de célula, GECIs pode ser expressa em um tipo específico de célula pelos promotores específicos. Além disso, a nova geração do GECIs, tais como GCaMP6, fornece a melhor relação sinal-ruído juntamente com mais rápido temporal dinâmica15. Aqui descrevemos o utilitário da novo-geração do GECIs, em particular GCaMP6s, Visualizar o cálcio em células-beta em resolução de célula única. Podemos aplicar esse método para o ilhéu primário zebrafish como nosso modelo de escolha. Durante o desenvolvimento embrionário, células-beta no Ilhéu do primário originam a dorsal e ventral do pâncreas botões16. A ilha principal está localizada em uma posição anatômica estereotipada dentro do pâncreas zebrafish, permitindo a sua fácil identificação e isolamento. Células-beta no Ilhéu do primário são necessárias para glicose-regulamento, conforme sua genética ablação leva à hiperglicemia17,18. Além disso, estas células-beta se tornar glicose responsivo durante o início do zebrafish desenvolvimento19. Este protocolo pode ser também aplicado a imagem latente as ilhotas secundárias, que se formam durante as fases pós-embrionárias. O protocolo permite a imagem beta-células ex vivo, em fases posteriores de desenvolvimento e sob as concentrações de glucose definidos.
Protocolo
Todos os procedimentos, incluindo assuntos animais foram aprovados pelo acto de bem-estar Animal e com a permissão do Landesdirektion Sachsen, Alemanha (AZ 24 – 9168.11 / 1/2013 / 14, T12/2016).
1. preparação
Nota: Este protocolo é para ex vivo por imagens do zebrafish ilhéu primário de duplo Tg transgénicos (ins:nls-Renilla-mKO2; cryaa:CFP); TG (ins:GCaMP6s; cryaa:mCherry) 19 zebrafish. Nesta linha de transgênicos, o promotor de insulina (ins) conduz a expressão específica de células beta de dois transgenes: nls-Renilla-mKO2, que marca o núcleo das células-beta com monomérico Kusabira laranja 2 (mKO2) fluorescência; e GCaMP6s15, que emite fluorescência verde em resposta ao aumento nos níveis de cálcio intracelular. A expressão de beta-pilha-específico de GCaMP6s permite estudar a glicose-capacidade de resposta das células-beta sem a interferência de alterações de cálcio em torno de tipos de células.
- Preparar o estoque fresco fibrinogênio (10 mg/mL) dissolvendo-se 10 mg de fibrinogênio bovino em 1 mL de Ca2 +/ mg2 +-que contém a solução de sal balanceada de Hanks (HBSS) num tubo de centrífuga 1,5 mL. Vórtice vigorosamente até que o pó de fibrinogênio se dissolve completamente. Manter a solução em temperatura ambiente por mais pelo menos de 15 min.
Nota: O estoque pode ser mantido em temperatura ambiente por 2 – 3 h.. descarte o estoque se a solução começa a polimerizar-se e torna-se viscoso. - Prepare a solução de trabalho de fibrinogênio (3,3 mg/mL) diluindo o estoque de fibrinogênio HBSS em triplo. Por exemplo, misture 300 µ l de caldo de fibrinogênio em 600 µ l de HBSS preparar 900 µ l da solução de trabalho de fibrinogênio.
- Preparar a solução de trombina (10 U/mL) dissolvendo-se 10 unidades de trombina em 1 mL de HBSS ou fosfato tampão salino (PBS).
Nota: Esta solução pode ser preparada com antecedência, aliquotada em 50 partes µ l e congelada a-20 ° C. - Prepare 200 mM D-glucosa dissolvendo 1,8 g de D-glicose em 50 mL de água. Manter em 4 ° C para armazenamento a longo prazo.
- Prepare 300 mM solução KCl dissolvendo-se 1,1 g de KCl em 50 mL de água. Manter em 4 ° C para armazenamento a longo prazo.
- Adquirir 35mm pratos de vidro-fundo de diâmetro para a montagem dos ilhéus.
- Para dissecação e fixar o ilhéu, usar um microscópio estéreo equipado com lâmpada de fluorescência e cubo filtro vermelho (TRITC: excitação: 554 – 532 nm, emissão: 613 – 570 nm; ou Texas-vermelho: excitação: 540 – 580 nm, emissão: 592-667 nm).
- Para o influxo de cálcio em células-beta, uso um microscópio confocal invertido (Zeiss LSM 780 ou similar) com 20 X (0,8 NA) objetivo do ar e equipado com um suporte de placa para os pratos de vidro-fundo de diâmetro 35mm de imagem.
- Prepare uma solução de 200 mg/L de sulfonato de metano metanosulfonato (MS222) para eutanásia o zebrafish.
- Requisitar pratos de Petri de 90 mm para a dissecação do zebrafish.
2. Zebrafish primária ilhéu dissecação e montagem
- Eutanásia em um peixe usando incubação prolongada em MS222. Para isso, delicadamente Retire o peixe do aquário usando uma rede de pesca e incube-lo em uma placa de Petri contendo a solução MS222 até que o animal não mostra nenhum movimento de odontódios (brânquias); Normalmente, este leva 5 min. transferência o peixe para um prato de Petri contendo a solução HBSS com Ca2 +/ mg2 +.
-
Sob um microscópio estéreo equipado com uma lâmpada da fluorescência e cubo filtro vermelho, disse a pele que cobre o lado direito do abdômen do animal para isolar o pâncreas.
- Para isso, corte a pele do zebrafish da boca a nadadeira anal usando Pinças afiadas. Descascar a pele cortada para expor o abdome; Este recorte expõe os órgãos internos. Usando a fluorescência vermelha de mKO2 expressão em células-beta, verificar a localização dos ilhéus através de exame visual, sob o microscópio. Se necessário, remova os lóbulos do fígado, como eles poderiam cobrir o ilhéu, tornando difícil de encontrar.
Nota: O Ilhéu primário está localizado perto da região anterior do abdômen, geralmente no lado direito.
- Para isso, corte a pele do zebrafish da boca a nadadeira anal usando Pinças afiadas. Descascar a pele cortada para expor o abdome; Este recorte expõe os órgãos internos. Usando a fluorescência vermelha de mKO2 expressão em células-beta, verificar a localização dos ilhéus através de exame visual, sob o microscópio. Se necessário, remova os lóbulos do fígado, como eles poderiam cobrir o ilhéu, tornando difícil de encontrar.
- Limpe o ilhéu primário removendo cuidadosamente o tecido circundante como fígado e adipócitos. Tomar precauções para não ferir ou picar o ilhéu; Depois de limpar o tecido circundante, as células individuais na superfície do Ilhéu tornam-se perceptíveis.
- Pipete uma gota de 30 µ l de HBSS no centro de um prato fundo de vidro. Transferi o ilhéu dissecado para essa queda.
- Lave cuidadosamente o ilhéu, uma vez com HBSS e uma vez com 30 µ l da solução de trabalho de fibrinogênio (3,3 mg/mL). Certifique-se de evitar a secagem do Ilhéu durante as etapas de lavagem, pois se assim resulta na morte celular.
- Lenta e suavemente, adicione 10 µ l da solução de trombina (10 U/mL). O ilhéu e o prato deixe intocado por 15 – 20 min, observar que a gota de fibrinogênio-trombina se torne viscoso e ligeiramente opaco neste momento.
3. Ex Vivo ao vivo-imagem latente da intensidade de fluorescência GCaMP em ilhotas de Zebrafish primária
- Adicionar 200 µ l de HBSS em cima do molde e coloque o prato com cuidado sobre o suporte da placa do microscópio confocal. Use um objectivo de ar X, at 0.8, 20 para a imagem latente confocal. Localize o ilhéu usando a opção brightfield.
- Usando o filtro para fluorescência vermelha para visualizar a fluorescência nuclear mKO2 em células-beta, o foco na ilhota. Núcleos individuais devem ser claramente visíveis.
- Localize um avião claro imagem alterando manualmente o plano focal do microscópio confocal a fim de mover-se através da espessura da ilhota ao longo de seu eixo z. Certifique-se de que o avião de imagem contém um número suficiente (50-100) de células-beta para a imagem latente, e o brilho da fluorescência nuclear mKO2 é uniforme, especialmente no centro da ilha.
- Configurar uma aquisição sequencial para GCaMP6s e mKO2 de fluorescência usando as seguintes configurações no "Menu Setup inteligente": GCaMP6s, excitação: 488 nm, emissão: 500 – 555 nm, falsa-cor: verde (selecione "GFP"); mKO2, excitação: 561 nm (mCherry), de emissão: 570 – 630 nm, falsa-cor: vermelho (selecione "mCherry").
Nota: Com esta configuração, o canal vermelho irá gravar a posição dos núcleos de células beta, enquanto o canal verde irá gravar a intensidade de fluorescência de GCaMP. - No modo de"aquisição" definir a resolução da imagem a 1.024 x 1.024 pixels, a velocidade em 10 e em média em 1. Iniciar uma contínua gravação selecionando a opção para "Séries temporais", e definindo a "duração" para 500 ciclos, com tempo de aquisição de s aproximadamente 2 por quadro.
Nota: Os primeiros 50 quadros do tempo-série correspondem a atividade das células-beta na concentração de glicose de 5 mM. Esta é a resposta de linha de base. Uma resposta beta-célula mostrará depilação e diminuindo a intensidade de fluorescência verde com o tempo. Temos observado que alguns (1 – 5%) das células-beta oscilar em glicose de 5 mM. -
Fique de olho no ciclo de imagem. Após os primeiros 50 quadros, aumente a concentração de glicose da solução circundante de 10 mM sem parar a gravação.
- Sem distorçer a aquisição de imagens, gentilmente Pipete 5 µ l da solução de D-glicose em cima do gel segurando o ilhéu de 200 mM. Adquira 150 quadros na glicose 10 mM.
Nota: O aumento da concentração de glicose aumentará o número de células-beta passando por GCaMP fluorescentes oscilações no canal verde. - Certifique-se de que os núcleos das células permanecem estáveis durante o processo. Se o Ilhéu está tremendo extensivamente durante a aquisição e os núcleos estão se movendo fora do plano focal, descarte a amostra (se necessário).
- Espere um período suficiente para permitir a polimerização do molde de fibrinogênio-trombina para garantir a estabilidade das amostras subsequentes.
- Sem distorçer a aquisição de imagens, gentilmente Pipete 5 µ l da solução de D-glicose em cima do gel segurando o ilhéu de 200 mM. Adquira 150 quadros na glicose 10 mM.
- A 200 quadros, aumente ainda mais a concentração da solução de 20mm suavemente pipetando 10 µ l de 200 milímetros solução de D-glicose. Adquira 150 quadros para a concentração de 20 mM.
- Após 350 quadros, despolarizar o ilhéu com 30 mM de KCl. Para isso, adicione 20 µ l da 300 mM solução KCl. Nesta fase, observe que as oscilações de fluorescência GCaMP6s irão parar e consertar em uma alta intensidade; células-beta que não respondeu a glicose também podem exibir um aumento na intensidade de fluorescência verde sobre adição de KCL.
4. quantificação do traço de fluorescência GCaMP Beta-células individuais
Nota: Para localizar e quantificar as respostas das células-beta individuais para diferentes níveis de glicose, quantificar a intensidade de fluorescência GCaMP durante todo o período de imagem. Quantificação é realizada no celular resolução. Para isso, use FIJI20 para extrair os valores de intensidade de fluorescência GCaMP das imagens (etapas 4.1 – 4.6) e software de planilha ou R21 para realizar a análise (etapas 4.8 – 4,9).
- Abra o arquivo de imagem em FIJI, usando a caixa de ferramentas"LSM". Para isso, selecione "Plugin | Caixa de ferramentas LSM | Mostre a caixa de ferramentas LSM". No "Toolbox LSM", clique em "Open LSM" e selecione o arquivo de imagem.
Nota: Para formatos não suportados pelo LSM "Toolbox", convertê-los primeiro para tiff para análise. - Extrair as respostas das células usando a ferramenta de região de interesse (ROI) em FIJI. Abra o "Gerenciador de ROI" no menu "Analisar" em "Ferramentas". Desenhe manualmente o ROI usando a ferramenta de seleção"polígono" localizada na barra de ferramentas.
- Desenhe o ROI no canal vermelho em que os núcleos de células beta são visíveis. Selecione o ROI tal que cobre uma área que é maior do que o núcleo da célula, a fim de incluir alguns do citoplasma da célula. Certifique-se de que a posição de ROI é consistente entre quadros e ajustar a posição, se necessário.
- Adicione o ROIs selecionado para o "Gerenciador de ROI", clicando no botão "Adicionar [t]". Selecionar e adicionar ROIs múltiplos para o ROI para a obtenção de dados em várias células.
- Em seguida, no menu "Analisar", selecione "Definir medidas". Selecione "Densidade integrada" para especificar a extração da intensidade de fluorescência total dentro da área.
- Mudar para o canal verde, contendo a fluorescência GCaMP e selecione "Multi medida" no "Gerenciador de ROI".
Nota: Isto irá fornecer as medições de intensidade para as células em toda a série de tempo. - No caso da posição de ROI precisa ser ajustada devido ao movimento de ilhota, compile manualmente as medições de intensidade em diferentes quadros. Copiar e colar os valores para uma planilha separada.
- Obter os carimbos de hora dos quadros da imagem da caixa de ferramentas"LSM". Uso "aplicar selos | Aplicar selos t | Nome do arquivo | Despejar a textfile"para obter os carimbos de hora. Salvar os carimbos de hora usando a opção "Salvar como", ou copiá-los para a planilha.
- Após compilar os valores de intensidade para todas as células, realize a análise uma célula de cada vez ou automaticamente (por exemplo, usando fórmulas do Excel ou R).
-
Analise as células individuais em duas etapas.
- Na primeira etapa, calcule a intensidade de fluorescência acima da linha de base. Para este fim, calcule a intensidade fluorescente de base (F0) como a média das intensidades de fluorescência para os primeiros 50 quadros (glicose de 5 mM). Subtrair a linha de base (F0) toda a série de tempo (F – F0).
Nota: algumas células podem mostrar clara GCaMP oscilações sob glicose basal, que normalmente continuam após estimulação com concentrações mais elevadas. Para tais células, somente é possível estimar F0 , tendo a intensidade média dos quadros iniciais no qual as células mostraram uma gota em fluorescência. - Na segunda etapa da análise, obter a intensidade de fluorescência GCaMP final normalizando a intensidade de fluorescência.
Nota: Esta é realizada para remover as diferenças entre ilhotas de animais diferentes. Ilhéus individuais exibem diferentes níveis de emissão de fluorescência após estimulação de glicose. - Normalize a intensidade da fluorescência, dividindo-o com o valor mais alto de intensidade. Para isso, calcular a intensidade de pico (Fmáx – F0) e dividir os valores basais subtraído pelo pico de intensidade para produzir a final GCaMP a intensidade de fluorescência (F – F0) / (Fmáx – F0).
- Na primeira etapa, calcule a intensidade de fluorescência acima da linha de base. Para este fim, calcule a intensidade fluorescente de base (F0) como a média das intensidades de fluorescência para os primeiros 50 quadros (glicose de 5 mM). Subtrair a linha de base (F0) toda a série de tempo (F – F0).
- Descarte as células que não apresentam uma alteração na intensidade após estimulação de KCl, como eles podem ser insalubre ou danificados.
- Para realizar a análise (medidas 4.9 – 4.10) em R, use o script de R (plotcelltrace. R) fornecido com este manuscrito.
Resultados
Usando o protocolo descrito acima, foram analisadas as respostas de glicose das células-beta em um ilhéu de um zebrafish pós fertilização (dpf) de 45 dias. Para isso, a ilhota principal foi dissecada de um animal euthanized e montada no molde trombina fibrinogênio em um prato fundo de vidro. O ilhéu foi imerso em HBSS contendo glicose de 5 mM. A concentração de glicose foi aumentada de forma faseada de 10 mM e 20 mM. As respostas das células-beta para o aumento das concentrações de glicose foram gravadas. Finalmente, as células-beta foram despolarizadas usando 30 mM KCl (Figura 1). A despolarização usando KCl induz a entrada de cálcio nas células-beta saudáveis.
Usando a FIJI e um software de análise de dados, a intensidade de fluorescência GCaMP6s de beta-células individuais é extraída e normalizado (Figura 2). Como visto o rastreamento da intensidade de fluorescência, beta-células individuais exibem oscilações na GCaMP6s de fluorescência após estimulação de glicose, que para após estimulação de KCl. A técnica fornece uma resolução de celular de glicose-capacidade de resposta da célula beta- e uma janela em sua funcionalidade.
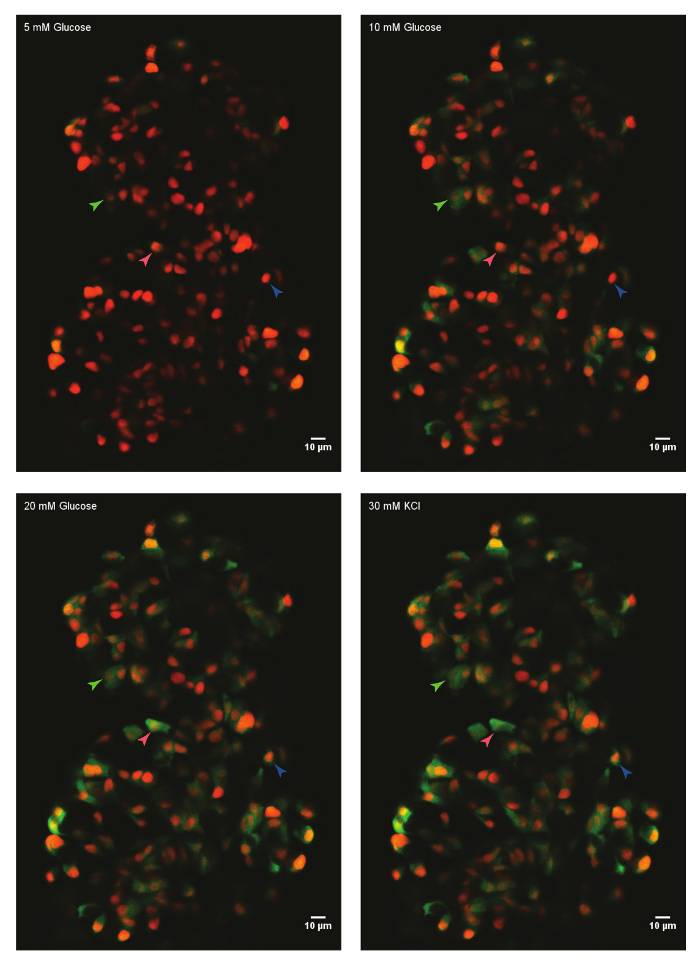
Figura 1: Ex vivo ao vivo-imagem latente do influxo de cálcio usando GCaMP6s em células-beta do zebrafish. Uma ilhota primária de Tg(ins:nls-Renilla-mKO2); TG(ins:GCaMP6s) zebrafish (45 dpf) foi montado no molde de fibrinogênio-trombina e incubada com glicose de 5 mM (basal). Células-beta foram rotuladas com um marcador vermelho nuclear, enquanto a fluorescência de GCaMP6s está presente no canal verde. O ilhéu foi estimulado com uma glicose-rampa consistindo de incubação sequencial com 10 mM e 20 mM D-glicose e despolarizada através da adição de 30 mM que KCl. setas marcam beta-células individuais, cuja actividade foi analisada. Clique aqui para ver uma versão maior desta figura.
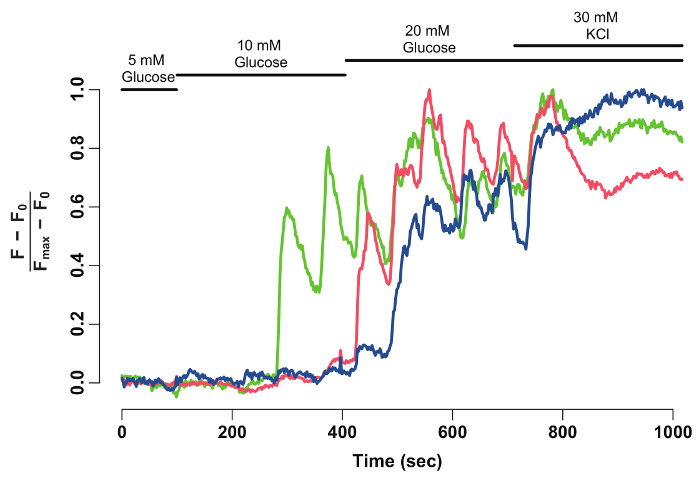
Figura 2: normalizado GCaMP6s intensidade de fluorescência-traço beta-células individuais. Normalizado GCaMP6s fluorescência intensidade-rastreamento para as células-beta marcado com setas na Figura 1. O eixo x indica o tempo em segundos. No topo, barras mostram a concentração de glicose e de KCl no meio HBSS. O eixo y denota a intensidade de fluorescência normalizado durante a série de tempo. Por isso, intensidade da linha de base (F0) é calculada como a média intensidade durante incubação em glicose de 5 mM. Isto é subtraído os todo série de tempo dados (F - F0). A intensidade de linha de base é normalizada pela intensidade máxima exibida pela célula (F - F0) / (Fmáx- F0). O registo normalizado mostra uma resposta oscilatória das células beta à glicose, que estabiliza quando as células são despolarizadas com 30 mM KCl. clique aqui para ver uma versão maior desta figura.
Discussão
Aqui vamos demonstrar uma técnica para a quantificação de células beta glicose capacidade de resposta na resolução de célula única. Isto é possibilitado pela concentração de cálcio intracelular, utilizando um indicador de cálcio geneticamente codificado, GCaMP6s de monitoramento. A atividade de células beta é capturado ex vivo montando o Ilhéu em um molde de fibrinogênio-trombina. Uma etapa crítica do protocolo é a estabilidade do molde. Tempo suficiente deve ser dada para o fibrinogênio dissolver na solução HBSS. Sem isso, o molde não polimerizar-se suficientemente para fornecer estabilidade durante a sessão de imagens. Um ilhéu montado no molde de fibrinogênio-trombina e imersos em meios de cultura celular pode permanecer viável pelo menos uma semana (dados não mostrados). Alternativas para o molde de fibrinogênio-trombina, como agarose de baixo ponto de fusão, podem ser utilizadas para montar o ilhéu22. Outro parâmetro crítico é a dissecção da ilhota. Durante esta etapa, o tecido circundante a ilhota precisa ser removido sem ferir ou picar o ilhéu. Uma dissecação hábil vem com prática.
Uma limitação do protocolo de imagem é a restrição a um avião confocal de ilhota. Isso é feito para capturar a dinâmica do influxo de cálcio dentro beta-células individuais. Um Z-pilha através de toda espessura da ilhota leva à baixa de imagem velocidades e perda de sinal oscilatório de células individuais. Esta limitação pode ser melhorada usando meios mais rápidos de confocal de imagem tais como a microscopia de disco giratório, para permitir a captura a dinâmica de cálcio em 3 dimensões. Outra fronteira seria na vivo cálcio imagem12. A natureza transparente do zebrafish embrião ou o uso de cepas de pigmento-menos de zebrafish adultos23 poderia abrir a possibilidade para na vivo de imagens no futuro.
A imagem da atividade de células beta em alta resolução espacial e temporal permite investigar a heterogeneidade funcional entre beta-células individuais. Esta abordagem pode ajudar a lançar luz sobre a existência de sub-populações de células beta. Recentemente, vários estudos têm demonstrado a existência de sub-populações em células-beta nominalmente homogênea24,25,26. Ex vivo de imagem pode ser combinada com repórteres genéticos para caracterizar da resposta do subpopulação de glicose. Além disso, combinando a configuração de imagem com estimulação farmacológica pode permitir para rastreio de compostos que poderiam melhorar a funcionalidade de células beta.
Em resumo, a técnica aqui apresentada permite a quantificação e comparação entre a capacidade de resposta de glicose para beta-células individuais. Ele fornece uma janela direta para funções de células beta, um parâmetro importante no desenvolvimento do diabetes.
Divulgações
Os autores declaram não concorrentes interesses financeiros.
Agradecimentos
Agradecemos a membros do laboratório Ninov para comentários sobre o manuscrito, membros do centro para instalações de peixe e microscopia de Dresden de terapias regenerativas (poucos) para obter assistência técnica. N.N. é suportado pelo financiamento da DFG-poucos, Cluster de excelência no TU-Dresden, Fundação de pesquisa alemã (DFG) e o centro alemão para Diabetes pesquisa (DZD).
Materiais
| Name | Company | Catalog Number | Comments |
| Transgenic Zebrafish line: Tg(ins:nls-Renilla-mKO2; cryaa:CFP); Tg(ins:GCaMP6s; cryaa:mCherry) | By request from authors | ||
| Stereo microscope | ZEISS | 495015-0001-000 | SteREO Discovery.V8 |
| Fluorescence lamp | ZEISS | 423013-9010-000 | Illuminator HXP 120 V |
| Red Filter Cube | ZEISS | 000000-1114-462 | Filter set 45 HQ TexasRed |
| Confocal Microscope | ZEISS | LSM 780 | |
| Bovine fibrinogen | Sigma | F8630 | |
| HBSS (Hanks' Balanced Salt solution) | ThermoFisher | 14025092 | |
| Thrombin | Sigma | T4648 | |
| D-Glucose | Sigma | G8270 | |
| KCl | Sigma | P9333 | |
| 35 mm diameter glass-bottom dishes | ThermoFisher | 150680 | |
| tricaine methane sulfonate | Sigma | E10521 | |
| Fine Forceps | Fine Science Tools | 11445-12 | |
| FIJI, using ImageJ Version: 2.0.0-rc-43/1.50e | https://fiji.sc/ | ||
| R, version 3.2.4 | https://www.r-project.org/ | ||
| RStudio | https://www.rstudio.com/ | ||
| plotcelltrace.R | A custom script provided with the manuscript |
Referências
- Kahn, S. E. The relative contributions of insulin resistance and beta-cell dysfunction to the pathophysiology of Type 2 diabetes. Diabetologia. 46 (1), 3-19 (2003).
- Ogurtsova, K., et al. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040. Diabetes Res Clin Pract. 128, 40-50 (2017).
- Pipeleers, D. G. Heterogeneity in pancreatic beta-cell population. Diabetes. 41 (7), 777-781 (1992).
- MacDonald, P. E., Joseph, J. W., Rorsman, P. Glucose-sensing mechanisms in pancreatic beta-cells. Philos Trans R Soc Lond B Biol Sci. 360 (1464), 2211-2225 (2005).
- Hellman, B., et al. Glucose induces oscillatory Ca2+ signalling and insulin release in human pancreatic beta cells. Diabetologia. 37, S11-S20 (1994).
- Bergsten, P., Grapengiesser, E., Gylfe, E., Tengholm, A., Hellman, B. Synchronous oscillations of cytoplasmic Ca2+ and insulin release in glucose-stimulated pancreatic islets. J Biol Chem. 269 (12), 8749-8753 (1994).
- Wollheim, C. B., Pozzan, T. Correlation between cytosolic free Ca2+ and insulin release in an insulin-secreting cell line. J Biol Chem. 259 (4), 2262-2267 (1984).
- Pace, C. S., Price, S. Electrical responses of pancreatic islet cells to secretory stimuli. Biochem Biophys Res Commun. 46 (4), 1557-1563 (1972).
- Ohara-Imaizumi, M., Nakamichi, Y., Tanaka, T., Ishida, H., Nagamatsu, S. Imaging exocytosis of single insulin secretory granules with evanescent wave microscopy: distinct behavior of granule motion in biphasic insulin release. J Biol Chem. 277 (6), 3805-3808 (2002).
- Soria, B., Martin, F. Cytosolic calcium oscillations and insulin release in pancreatic islets of Langerhans. Diabetes Metab. 24 (1), 37-40 (1998).
- Kenty, J. H. R., Melton, D. A. Testing pancreatic islet function at the single cell level by calcium influx with associated marker expression. PLoS One. 10 (4), e0122044 (2015).
- Speier, S., et al. Noninvasive in vivo imaging of pancreatic islet cell biology. Nat Med. 14 (5), 574-578 (2008).
- Bootman, M. D., Rietdorf, K., Collins, T., Walker, S., Sanderson, M. Ca2+-sensitive fluorescent dyes and intracellular Ca2+ imaging. Cold Spring Harb Protoc. 2013 (2), 83-99 (2013).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Chen, T. W., et al. Ultrasensitive fluorescent proteins for imaging neuronal activity. Nature. 499 (7458), 295-300 (2013).
- Hesselson, D., Anderson, R. M., Beinat, M., Stainier, D. Y. R. Distinct populations of quiescent and proliferative pancreatic beta-cells identified by HOTcre mediated labeling. Proc Natl Acad Sci U S A. 106 (35), 14896-14901 (2009).
- Pisharath, H., Rhee, J. M., Swanson, M. A., Leach, S. D., Parsons, M. J. Targeted ablation of beta cells in the embryonic zebrafish pancreas using E. coli nitroreductase. Mech Dev. 124 (3), 218-229 (2007).
- Curado, S., Stainier, D. Y. R., Anderson, R. M. Nitroreductase-mediated cell/tissue ablation in zebrafish: a spatially and temporally controlled ablation method with applications in developmental and regeneration studies. Nat Protoc. 3 (6), 948-954 (2008).
- Singh, S. P., et al. Different developmental histories of beta-cells generate functional and proliferative heterogeneity during islet growth. Nat Commun. 8 (1), 664 (2017).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nat Methods. 9 (7), 676 (2012).
- R Core Team. . R: A Language and Environment for Statistical Computing. , (2016).
- Friedman, R. S., et al. An evolving autoimmune microenvironment regulates the quality of effector T cell restimulation and function. Proc Natl Acad Sci. 111 (25), 9223-9228 (2014).
- White, R. M., et al. Transparent adult zebrafish as a tool for in vivo transplantation analysis. Cell Stem Cell. 2 (2), 183-189 (2008).
- Bader, E., et al. Identification of proliferative and mature β-cells in the islets of Langerhans. Nature. 535 (7612), 430-434 (2016).
- Dorrell, C., et al. Human islets contain four distinct subtypes of β cells. Nat Commun. 7, 11756 (2016).
- Johnston, N. R., et al. Beta Cell Hubs Dictate Pancreatic Islet Responses to Glucose. Cell Metab. 24 (3), 389-401 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados