É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
In Vitro Criação de abelhas solitárias: uma ferramenta para avaliar os fatores de risco Larval
Neste Artigo
Resumo
Sprays de fungicida em plantas de floração podem expor abelhas solitárias para altas concentrações de resíduos do fungicida transmitidas pelo pólen. Usando experimentos baseados em laboratório, envolvendo-se em vitro-larvas de abelha criados, este estudo investiga os efeitos interativos de consumir pólen tratada com fungicida derivado de host e host não plantas.
Resumo
Embora as abelhas solitárias fornecem serviços de polinização crucial para culturas selvagens e gerenciados, este grupo de ricos em espécies foi negligenciado em grande parte em estudos de regulamento de pesticidas. O risco de exposição a resíduos do fungicida é provável que seja especialmente elevado se o spray ocorre em ou perto de plantas hospedeiras, enquanto as abelhas estão coletando pólen para provisionar seus ninhos. Para espécies de Osmia que consomem pólen de um seleto grupo de plantas (oligolecty), a incapacidade de usar o pólen de plantas não-hospedeiras pode aumentar seu fator de risco para toxicidade relacionadas com fungicida. Este manuscrito descreve protocolos usados com sucesso criar abelhas oligolectic mason Osmia ribifloris sensu lato, do ovo à fase prepupal em placas de cultura de células em condições laboratoriais padronizados. O em vitro-abelhas criadas posteriormente são usadas para investigar os efeitos da fonte de exposição e pólen de fungicida na aptidão de abelha. Baseado em um experimento fatorial 2 x 2 totalmente atravessado, o experimento examina os efeitos principais e interativos da fonte de exposição e pólen de fungicida na aptidão larval, quantificada por biomassa prepupal, tempo de desenvolvimento larval e sobrevivência. Uma grande vantagem desta técnica é que usando em vitro-abelhas criadas reduz a variabilidade natural de fundo e permite a manipulação simultânea de vários parâmetros experimentais. O protocolo descrito apresenta uma ferramenta versátil para hipóteses testes envolvendo o conjunto de fatores que afetam a saúde das abelhas. Para os esforços de conservação a ser cumprido com sucesso significativo e duradouro, tais insights sobre a complexa interação de fatores fisiológicos e ambientais que levam a abelha declínios provarão para ser crítico.
Introdução
Dado o seu papel como o grupo dominante de insetos polinizadores1, a perda global em populações de abelhas é uma ameaça para a segurança alimentar e o ecossistema estabilidade2,3,4,5,6 ,7. As tendências em declínio em ambas as populações de abelhas gerenciado e selvagens têm sido atribuídas a vários factores de risco compartilhados, incluindo fragmentação de habitat, emergentes, parasitas e agentes patogénicos, perda de diversidade genética e a introdução de espécies invasoras3 ,,4,7,8,9,10,11,12. Em particular, o aumento dramático no uso de pesticidas, (por exemplo, neonicotinoides) tem sido diretamente associado a efeitos prejudiciais entre abelhas13,14,15. Vários estudos têm mostrado que o sinergismo entre neonicotinoides e fungicidas de (EBI) inibindo a biossíntese de ergosterol pode levar a alta mortalidade entre múltiplos abelha espécie16,17,18 , 19 , 20 , 21 , 22. não obstante, fungicidas, consideradas por muito tempo para ser 'abelha-safe', continuam a ser pulverizado nas culturas no-flor sem muito controlo23. As abelhas operárias foram documentadas para rotineiramente trazer cargas de pólen contaminadas com resíduos de fungicida24,25,26. O consumo de tal fungicida-ladenpollen pode causar alta mortalidade larval abelhas27,28,29,30e um conjunto de efeitos sub-letais entre abelhas adultas16 , 31 , 32 , 33 , 34. um estudo recente sugere que fungicidas podem causar perdas de abelha, alterando a comunidade microbiana na colmeia-armazenado o pólen, rompendo assim, a crítica simbiose entre abelhas e pólen transmitidas por micróbios35.
Embora as abelhas solitárias são vitais para a polinização de diversas plantas silvestres e agrícolas36,37,38, este grupo diverso de polinizadores tem recebido muito menos atenção em estudos de monitoramento de pesticidas. O ninho de uma fêmea solitária adulta contém câmaras ninhadas seladas de 5-10, cada abastecida com uma massa finita de maternalmente coleta de pólen e néctar e um único ovo39. Após a eclosão, as larvas dependem da prestação de pólen alocado e a microbiota associada transmitidas por pólen para obter uma nutrição adequada40,41. Porque eles não possuem os benefícios de um estilo de vida social, as abelhas solitárias podem ser mais vulneráveis à exposição de pesticidas42. Por exemplo, enquanto os défices em abelhas sociais seguindo um spray podem ser compensados para estendem a alguns trabalhadores e novos emergentes, ninhada, a morte de uma única fêmea solitária adulta termina todas as atividade reprodutiva43. Tais diferenças de susceptibilidade destacam a necessidade de incorporar táxons de abelha diversificada em estudos ecotoxicológicos para garantir proteção adequada para as abelhas selvagens e gerenciadas parecidas. No entanto, além de um punhado de estudos, investigações sobre os efeitos da exposição de fungicida tem focado principalmente nas abelhas sociais18,23,32,44,45 ,46,,47,,48,49.
Abelhas solitárias, pertencentes ao gênero Osmia (Figura 1) têm sido utilizadas no mundo inteiro como polinizadores eficientes de vários frutos importantes e porca culturas39,50,,51,53, 53. como com outros polinizadores gerenciado grupos24,54,55,56,57,58, abelhas adultas Osmia são rotineiramente expostos aos fungicidas pulverizadas sobre as culturas em-flor44. Fêmeas adultas forrageamento em culturas recentemente pulverizadas podem coletar e estocar seus aposentos ninhados com fungicida-carregado de pólen, que posteriormente forma a dieta exclusiva para as larvas em desenvolvimento. Consumir as disposições de pólen contaminados posteriormente pode expor as larvas de fungicida resíduos42. O risco de exposição pode ser maior entre espécies de oligolectic que forragem somente em alguns anfitrião estreitamente relacionadas plantas59,60,61. Certos megachilid de abelhas, por exemplo, parecem preferencialmente forragem para o pólen de Asteraceae de baixa qualidade, como um meio de reduzir o parasitismo62. No entanto, a extensão a que fungicidas impacto larval adequação entre abelhas solitárias oligolectic não foi empiricamente quantificada. O objetivo deste estudo é desenvolver um protocolo para testar as principais e efeitos interativos da fonte de exposição e pólen de fungicida na aptidão do in vitro criadas abelhas solitárias. Para investigar, ovos de ribifloris o. sensu lato (s.l.) podem ser obtidos comercialmente (tabela de materiais). Esta população é ideal por causa de sua importância como um polinizadores nativos e sua forte predileção para o néctar rico Mahonia aquifolium (uva de Oregon) encontrado dentro da região53,63,64 (Figura 2).

Figura 1. Uma foto de alta resolução de um adulto Osmia ribifloris. Foto de crédito Dr. Jim Cane, pesquisa entomologista, USDA-ARS , por favor clique aqui para ver uma versão maior desta figura.

Figura 2. Aninhamento de palhetas de Osmia ribifloris (s.l.) com uma fêmea de nidificação em primeiro plano,. de Phragmite Partições de câmara e buchas terminais para as palhetas são construídas a partir de folhas mastigadas. Foto crédito Sr. Kimball Clark, NativeBees.com , por favor clique aqui para ver uma versão maior desta figura.
O primeiro objectivo deste estudo é avaliar o efeito de consumir pólen tratada com fungicida na aptidão larval (medido em termos de tempo de desenvolvimento e biomassa de prepupal). Enquanto a exposição para o propiconazol fungicida comumente aplicada tem sido associada ao aumento da mortalidade entre abelhas adultas através de várias espécies de 23,24,32,44,45, 54,55,56,57,58,65,,66,67, seu impacto sobre as abelhas larvas é menor conhecido. O segundo objectivo deste estudo é avaliar os efeitos de consumir pólen não-host na aptidão larval. Estudos anteriores indicam que as larvas de abelhas oligolectic não conseguem desenvolver quando forçado a consumir pólen host não68. Tais resultados podem ser atribuídos às variações na fisiologia de abelha69, pólen bioquímica70e o benéfico microbiome associado com pólen natural disposições71. O terceiro objectivo deste estudo é avaliar os efeitos interativos de tratamento fungicida e pólen dietético na aptidão larval.
Numerosos traços biológicos, incluindo o tamanho do corpo materno, provisionamento de taxa, estratégia de forrageamento e pólen quantidade72,73,,74,75 são conhecidos por afetar a aptidão larval entre abelhas solitárias. Esses fatores podem introduzir variabilidade significativa entre juncos, que constitui um desafio no desenvolvimento de projetos experimentais defensáveis quando avaliação saúde larval. Além disso, dado que desenvolvimento larval ocorre dentro de juncos aninhamento selados, os efeitos de tal variabilidade na progenitura são difíceis de Visualizar e quantificados sem o uso de técnicas não-letais (Figura 3). Para superar este desafio, todas as hipóteses dentro deste estudo são testados usando larvas criadas fora suas linguetas de aninhamento. O delineamento experimental representa um totalmente cruzados 2 × 2 fatorial set-ups, com cada fator, consistindo em 2 níveis; Fator 1: Exposição fungicida (fungicida; Nenhum fungicida); Fator 2: Fonte de pólen (Host pólen, pólen de Non-host). As abelhas são disparadas do ovo à fase prepupal placas de cultura de célula do multiwell estéril sob condições controladas de laboratório. Cada um bem individualmente é abastecido com uma quantidade padronizada de um único ovo e disposições de pólen. Após a eclosão, a larva alimenta-se o pólen alocado dentro do poço, conclui desenvolvimento larval e inicia a pupa. Após estudos têm mostrado que inexplicáveis de mortalidade é menor entre abelhas levantadas dentro deste ambiente de criação artificial do que o encontrado no selvagem49,,76. O uso do in vitro-abelhas criadas tem diversas vantagens sobre os estudos de campo baseada: 1) minimiza os efeitos de confundimento de variabilidade natural e descontrolados fatores associados tipicamente com os estudos de campo baseada; 2) permite que vários níveis de manipulação para cada factor de interesse a serem testadas simultaneamente em grupos de tratamento; 3) o número de repetições pode ser predeterminado, e fatores experimentais para cada replicar podem ser manipulados individualmente; 4) variáveis resposta larval podem ser facilmente visualizadas e gravadas independentemente sem perturbadoras larvas adjacentes; 5) o protocolo pode ser modificado para acomodar mais complexos desenhos experimentais envolvendo múltiplos fatores e variáveis de resposta.

Figura 3. Conteúdo dentro de uma palheta de nidificação natural de Osmia ribifloris (s.l.). Perto da (A) um reed dissecado mostrando câmaras individuais, disposições de pólen e as partições e (B) recém colhidas disposições de pólen e os ovos associados (indicados com um círculo preto). Clique aqui para ver uma versão maior desta figura.
Protocolo
1. prepare soluções propiconazol para experimentos de exposição de fungicida
- Prepare 0,1 x solução fungicida dissolvendo volumes adequados de propiconazol adquiridos comercialmente 14,3% em água estéril no dia do experimento. Certifique-se de que a única solução recentemente preparada de fungicida é usada para todos os tratamentos.
- Adicione 23 µ l de 0,1 x solução fungicida por grama de provisão de pólen para obter a concentração máxima de propiconazol anteriormente relatado de pólen de abelha-coletados24 (0,361 PPM ou µ g de ingrediente ativo g-1 de pólen).
2. colher ovos e disposições de pólen Host de Osmia juncos
- Usando um bisturi esterilizado, disse recém ligado aninhando canas de Osmia, dividi-la em duas partes ao longo do comprimento da cana para expor as câmaras individuais.
Nota: Cada ninho pode conter entre 8 a 14 câmaras e um ovo dentro de uma câmara. - Inspecione os juncos visualmente para identificar as câmaras contendo ovos masculinos com base em diretrizes previamente publicados77. Uso uma agulha esterilizada dobrada para remover cada disposição de pólen juntamente com o ovo associado o nidificação reed e coloque em um ambiente limpo pesar o barco.
- Suavemente separa a prestação usando um pincel limpo bem o ovo e gravar o peso fresco de uma prestação pólen e utilizando uma balança de laboratório padrão do ovo. Calcule o peso médio das disposições pólen masculino.
- Execute as etapas subsequentes com prazo mínimo para reduzir as chances de danos para o ovo da exposição à temperatura excessiva e desidratação.
3. prepare a disposições de pólen de plantas de Host
- Inspecione visualmente o pólen planta hospedeira maternalmente coletados escavado das câmaras de nidificação para não garantir que nenhum parasitas presentes78. A fim de reduzir qualquer potencial viés materna, combinar as disposições de pólen em uma massa única em uma placa de Petri estéril e misture bem, usando uma agulha esterilizada.
- Divida a massa combinada em novas disposições de pólen, garantindo que o peso de cada prestação reconstituído é aproximadamente igual ao peso médio de uma disposição masculina naturalmente alocada (média ± SE, 0,35 ± 0,01 g, N = 42).
Nota: Porque Osmia sp. aloca menores disposições de pólen para a prole masculina, isso resulta em menor peso corporal das larvas masculinas comparadas de fêmeas77. Para evitar qualquer tal preconceito resultantes de diferenças específicas do sexo, apenas use ovos masculinos nos experimentos.
4. prepare a planta hospedeira não provisão de pólen
- Pulverizamos adquiridos comercialmente mel abelha coleta pólen a um pó fino, usando um padrão de laboratório com moinho de esfera.
- Com base no teor de umidade disposições de pólen coletado maternalmente anfitrião (~ 20%), hidrate o pó de pólen usando volumes adequados de solução de açúcar de 40% esterilizado79 e misture cuidadosamente para formar uma consistência de massa.
- Divida em massas de pólen individuais, cada um pesando aproximadamente o mesmo que o peso médio de uma disposição masculino naturalmente alocado.
Nota: De humidade do pólen de anfitrião maternalmente coletados disposições podem ser padronizadas em antes comparando o peso fresco e seco, de disposições de pólen de 30 câmaras masculino selecionado aleatoriamente80. Para obter o peso seco, disposições de pólen devem ser liofilizadas em um Liofilizador (1,5 Pa para 72 h).
5. preparar placas de cultura de células do Multiwell
- Poços individuais de linha da placa de cultura de 48-bem estéril com copos de estanho autoclavados (5 × 9 cm). Usando a pinça estéril, toque suavemente para fora da borda superior da cápsula para que ele pode acomodar a provisão de pólen.
- Coloque uma massa única de host ou o host não prestação de pólen dentro do copo lata usando ferramentas estéril com base no grupo de tratamento.
Nota: Para evitar contaminação cruzada, use chapas separadas por grupos tratamento e controle.
6. Adicione fungicidas
- Faça uma depressão centralmente posicionada dentro da massa de pólen usando uma vara de madeira estéril. Use um stick para cada prestação de pólen.
- Adicione volumes adequados de solução fungicida (para tratamento), ou água esterilizada (para controles) para a depressão. Beliscar a abertura da depressão usando Pinças esterilizadas para minimizar o contato entre o fungicida de superfície / estéril água e o ovo.
- Certifique-se de que a afinação fatorial do design experimental alinha com isso retratado na representação esquemática (Figura 4).
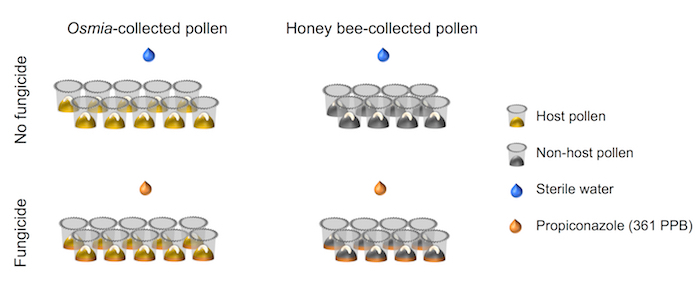
Figura 4. Representação esquemática da instalação experimental. O experimento representa um totalmente cruzada 2 × 2 fatorial configurações. Fator 1 representa a exposição do fungicida e consiste em 2 níveis: (i) nenhum fungicida (N = 10) e (ii) fungicida (N = 10). Fator 2 representa a fonte de pólen e consiste em 2 níveis: pólen (i) Host (N = 8) e (ii) não-acolhimento de pólen (N = 8). Clique aqui para ver uma versão maior desta figura.
7. traseira e observar larvas
- Coloque um ovo masculino selecionado aleatoriamente na superfície superior da prestação pólen utilizando um pincel limpo bem. Uma vez que os ovos foram colocados em todas as disposições, substitua a tampa da placa de cultura de célula, fixando-a com fita nas esquinas de rotulagem.
- Coloque as placas bem em uma bandeja limpa e cubra com um pano escuro para obstruir o contato com luz direta. Lugar um poço 6 placa contendo 30 mL de água estéril dentro da bandeja para evitar a dessecação. Bandejas de incubação deixe intacta dentro de uma incubadora à temperatura ambiente.
- Observe bem placas diariamente sob um microscópio dissecação sem retirar a tampa das placas bem. Certifique-se de que as larvas estão vivas, verificando para o movimento. Se nenhum movimento for detectado, descarte a caneca contendo as larvas mortas e a restante oferta de pólen. Permitir que todas as larvas sobreviventes desenvolver imperturbado dentro as placas bem até que eles atinjam o estágio de prepupal.
- Remova a larva do copo de estanho quando atinge o estágio prepupal41. Usar uma escova para limpar os defecar no casulo de seda. Cuidadosamente corte através do casulo de seda usando um microscópio de dissecação e extrair o prepupa com pinça de borracha.
- Manipule o prepupa suavemente para garantir que as ferramentas não perfurar o corpo mole. Registro do peso fresco do prepupa (prepupal biomassa) e o tempo do desenvolvimento do ovo à fase prepupal (tempo do desenvolvimento larval).
Nota: Qualquer larva morta deve ser descartado imediatamente para evitar o crescimento microbiano indesejável sobre o cadáver e disposição de restos de pólen. Isso reduz o risco de infecção para as restantes larvas saudáveis.
Resultados
Aptidão larval foi quantificada utilizando três métricas (i) larval tempo do desenvolvimento, (ii) prepupal biomassa e sobrevivência (iii) por cento. Uma ANOVA de duas vias foi realizada utilizando exposição fungicida (dois níveis: nenhum fungicida, fungicida) e fonte de pólen (dois níveis: Host pólen, pólen de Non-host) como variáveis independentes e tempo de desenvolvimento larval como variável dependente. O principal efeito para exposição de fungicida (F1,2...
Discussão
Criação de abelhas do lado de fora seus juncos de nidificação naturais, sob condições de laboratório, permite o teste de múltiplas hipóteses relativas à aptidão larval. Na medida em que fatores não identificados continuam a causar mortalidade das abelhas, os estudos de avaliação de risco usando em vitro experiências podem ajudar a identificar ameaças potenciais e informar as práticas de gestão para este grupo de ricos em espécies de polinizadores selvagens 12 ,
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores agradecer Kimball Clark e Tim Krogh para fornecer Osmia aninhamento juncos, Meredith Nesbitt e Molly Bidwell para assistência em laboratório, os Drs Cameron Currie, Christelle Guédot, Terry Griswold, Michael Branstetter e três revisores anônimos para seus comentários úteis que melhorou o manuscrito. Este trabalho foi financiado por fundos de USDA-Agricultural Research Service, que se apropriou (atual Research Information System #3655-21220-001), Wisconsin, Ministério da agricultura, do comércio e defesa do consumidor (#197199), National Science Foundation (sob N º de Grant Deb-1442148), o centro de pesquisa de bioenergia do DOE grandes lagos (DOE escritório de ciência BER DE-FC02-07ER64494).
Materiais
| Name | Company | Catalog Number | Comments |
| eggs of O. ribifloris sensu lato (s.l.) | Kaysville, Davis County, Utah, USA | ||
| Osmia reeds | Nativebees.com | NA | Freshly plugged reeds |
| Dissection set | VWR | 89259-964 | Sterilize before use |
| Long Nose Pliers | Husky | 1006 | |
| 6 well culture plates | VWR | 10062-892 | Sterile sealed |
| 48 well culture plates | VWR | 10062-898 | Sterile sealed |
| Petri dishes | VWR | 25373100 | Sterile sealed |
| Square Weighing Boats | VWR | 10770-448 | |
| Camel Hair Brush | Bioquip | 1153A | |
| Tin capsules | EA Consumables | D1021 | Sterilize before use |
| Sucrose | VWR | 470302-808 | |
| Propiconazole 14.3 | Quali-Ppro | 60207-90-1 | Propiconazole 14.3% |
| Honey bee pollen | Bee energised | 897098001244 | Untreated, natural, raw pollen |
| Microbalance | VWR | 10204-990 | |
| Pulverisette | LAB SYNERGY INC. | 30334913 | |
| Wooden sticks | VWR | 470146908 | Sterilize before use |
| Sealing tape | VWR | 89097-912 | |
| Microscope | VWR | 89403-384 | |
| Planting tray | VWR | 470150-632 | |
| Ethanol | VWR | BDH1158-4LP | |
| Centrifuge tube | VWR | 21008936 | |
| Microsyringe | Cole-Palmer | UX-07940-07 | |
| Rubber tweezer | Amazon | B0135HWPN4 | |
| Syringe needles | VWR | 89219-334 | |
| Freeze drier | Labcono | LFZ-1L | |
| Statistical software | SPSS | Version 21.0 |
Referências
- Klein, A. -. M., et al. Importance of pollinators in changing landscapes for world crops. P Roy Soc Lond B Bio. 274 (1608), 303-313 (2007).
- Biesmeijer, J. C. J., et al. Parallel declines in pollinators and insect-pollinated plants in Britain and the Netherlands. Science. 313 (5785), 351-354 (2006).
- Potts, S. G., Biesmeijer, J. C., Kremen, C., Neumann, P., Schweiger, O., Kunin, W. E. Global pollinator declines: Trends, impacts and drivers. Trends Ecol Evol. 25 (6), 345-353 (2010).
- Cameron, S. A., et al. Patterns of widespread decline in North American bumble bees. P Natl Acad Sci USA. 108 (2), 662-667 (2011).
- Gallai, N., Salles, J. M., Settele, J., Vaissière, B. E. Economic valuation of the vunerability of world agriculture confronted with pollinator decline. Ecol Econ. 68 (3), 810-821 (2009).
- Fontaine, C., Dajoz, I., Meriguet, J., Loreau, M. Functional diversity of plant-pollinator interaction webs enhances the persistence of plant communities. Plos Biol. 4 (1), 0129-0135 (2006).
- Kluser, S., Peduzzi, P. . Global pollinator decline: a literature review. , (2007).
- Brown, M. J. F., Paxton, R. J. The conservation of bees: a global perspective. Apidologie. 40 (3), (2009).
- Lebuhn, G., et al. Detecting insect pollinator declines on regional and global scales. Conserv Biol. 27 (1), (2013).
- Vanengelsdorp, D., Meixner, M. D. A historical review of managed honey bee populations in Europe and the United States and the factors that may affect them. J Invertebr Pathol. , S80-S95 (2010).
- Pettis, J. S., Delaplane, K. S. Coordinated responses to honey bee decline in the USA. Apidologie. 41 (3), 256-263 (2010).
- Sandrock, C., Tanadini, L. G., Pettis, J. S., Biesmeijer, J. C., Potts, S. G., Neumann, P. Sublethal neonicotinoid insecticide exposure reduces solitary bee reproductive success. Agr Forest Entomol. 16 (2), (2014).
- Van der Sluijs, J. P., Simon-Delso, N., Goulson, D., Maxim, L., Bonmatin, J. M., Belzunces, L. P. Neonicotinoids, bee disorders and the sustainability of pollinator services. Curr Opin Env Sust. 5 (3), (2013).
- Goulson, D., Nicholls, E., Botías, C., Rotheray, E. L. Bee declines driven by combined stress from parasites, pesticides, and lack of flowers. Science. 347 (6229), (2015).
- Johnson, R. M., Ellis, M. D., Mullin, C. A., Frazier, M. Pesticides and honey bee toxicity - USA. Apidologie. 41 (3), (2010).
- Iwasa, T., Motoyama, N., Ambrose, J. T., Roe, R. M. Mechanism for the differential toxicity of neonicotinoid insecticides in the honey bee, Apis mellifera. Crop Protection. 23 (5), 371-378 (2004).
- Glavan, G., Bozic, J. The synergy of xenobiotics in honey bee Apis mellifera: mechanisms and effects. Acta Biol. Slov. 56, 11-27 (2013).
- Biddinger, D. J., et al. Comparative toxicities and synergism of apple orchard pesticides to Apis mellifera (L.) and Osmia cornifrons (Radoszkowski). PLoS ONE. 8 (9), e72587 (2013).
- Thompson, H. M., Fryday, S. L., Harkin, S., Milner, S. Potential impacts of synergism in honeybees (Apis mellifera) of exposure to neonicotinoids and sprayed fungicides in crops. Apidologie. 45 (5), 545-553 (2014).
- Jansen, J. -. P., Lauvaux, S., Gruntowy, J., Denayer, J. Possible synergistic effects of fungicide-insecticide mixtures on beneficial arthropods. IOBC-WPRS Bulletin. 125, 28-35 (2017).
- Robinson, A., Hesketh, H., et al. Comparing bee species responses to chemical mixtures: Common response patterns?. PLoS ONE. 12 (6), (2017).
- Sgolastra, F., Medrzycki, P., et al. Synergistic mortality between a neonicotinoid insecticide and an ergosterol-biosynthesis-inhibiting fungicide in three bee species. Pest Management Science. 73 (6), 1236-1243 (2017).
- Ladurner, E., Bosch, J., Kemp, W. P., Maini, S. Assessing delayed and acute toxicity of five formulated fungicides to Osmia lignaria and Apis mellifera. Apidologie. 36 (3), 449-460 (2005).
- Mullin, C. A., et al. High levels of miticides and agrochemicals in North American apiaries: implications for honey bee health. PloS one. 5 (3), e9754 (2010).
- Pettis, J. S., Lichtenberg, E. M., Andree, M., Stitzinger, J., Rose, R., Vanengelsdorp, D. Crop pollination exposes honey bees to pesticides which alters their susceptibility to the gut pathogen Nosema ceranae. PloS one. 8 (7), e70182 (2013).
- David, A., et al. Widespread contamination of wildflower and bee-collected pollen with complex mixtures of neonicotinoids and fungicides commonly applied to crops. Environ Int. 88, 169-178 (2016).
- Zhu, W., Schmehl, D. R., Mullin, C. A., Frazier, J. L. Four common pesticides, their mixtures and a formulation solvent in the hive environment have high oral toxicity to honey bee larvae. PloS one. 9 (1), e77547 (2014).
- Simon-Delso, N., Martin, G. S., Bruneau, E., Minsart, L. A., Mouret, C., Hautier, L. Honeybee colony disorder in crop areas: The role of pesticides and viruses. PLoS ONE. 9 (7), (2014).
- Park, M. G., Blitzer, E. J., Gibbs, J., Losey, J. E., Danforth, B. N. Negative effects of pesticides on wild bee communities can be buffered by landscape context. P Roy Soc B-Biol Sci. 282 (1809), 20150299-20150299 (2015).
- Bernauer, O. M., Gaines-Day, H. R., Steffan, S. A. Colonies of bumble bees (Bombus impatiens) produce fewer workers, less bee biomass, and have smaller mother queens following fungicide exposure. Insects. 6 (2), 478-488 (2015).
- Williamson, S. M., Wright, G. A. Exposure to multiple cholinergic pesticides impairs olfactory learning and memory in honeybees. J Exp Biol. 216 (10), 1799-1807 (2013).
- Artz, D. R., Pitts-Singer, T. L. Effects of fungicide and adjuvant sprays on nesting behavior in two managed solitary bees, Osmia lignaria and Megachile rotundata. PLoS ONE. 10 (8), e0135688 (2015).
- Pilling, E. D., Bromleychallenor, K. A. C., Walker, C. H., Jepson, P. C. Mechanism of synergism between the pyrethroid insecticide lambda-cyhalothrin and the imidazole fungicide prochloraz, in the honeybee (Apis mellifera L). Pestic Biochem Phys. 51 (1), 1-11 (1995).
- Johnson, R. M., Wen, Z., Schuler, M. A., Berenbaum, M. R. Mediation of pyrethroid insecticide toxicity to honey bees (Hymenoptera: Apidae) by cytochrome P450 monooxygenases. J. Econ. Entomol. 99 (4), 1046-1050 (2006).
- Steffan, S. A., Dharampal, P. S., Diaz-Garcia, L. A., Currie, C. R., Zalapa, J. E., Hittinger, C. T. Empirical, metagenomic, and computational techniques illuminate the mechanisms by which fungicides compromise bee health. JoVE. (128), e54631 (2017).
- Batra, S. W. T. Solitary bees. Sci Am. 250 (2), 120-127 (1984).
- Linsley, E. G. The ecology of solitary bees. Hilgardia. 27 (19), 543-599 (1958).
- Garibaldi, L. A., et al. Wild Pollinators Enhance Fruit Set of Crops Regardless of Honey Bee Abundance. Science. 339 (6127), 1608-1611 (2013).
- Bosch, J., Kemp, W. P. . How to manage the blue orchard bee. , (2001).
- Keller, A., Grimmer, G., Steffan-Dewenter, I. Diverse microbiota identified in whole intact nest chambers of the red mason bee Osmia bicornis (Linnaeus 1758). PLoS ONE. 8 (10), e78296 (2013).
- Bosch, J., Kemp, W. P. Development and Emergence of the Orchard Pollinator Osmia lignaria (Hymenoptera: Megachilidae). Environmental Entomology. 29 (1), 8-13 (2000).
- Brittain, C., Potts, S. G. The potential impacts of insecticides on the life-history traits of bees and the consequences for pollination. Basic and Applied Ecology. 12 (4), 321-331 (2011).
- Arena, M., Sgolastra, F. A meta-analysis comparing the sensitivity of bees to pesticides. Ecotoxicology. 23 (3), 324-334 (2014).
- Ladurner, E., Bosch, J., Kemp, W. P., Maini, S. Foraging and nesting behavior of Osmia lignaria (Hymenoptera: Megachilidae) in the presence of fungicides: cage studies. J Econ Entomol. 101 (3), 647-653 (2008).
- Huntzinger, A. C. I., James, R. R., Bosch, J., Kemp, W. P. Fungicide tests on adult alfalfa leafcutting bees (Hymenoptera: Megachilidae). J Econ Entomol. 101 (4), 1088-1094 (2008).
- Tsvetkov, N., et al. Chronic exposure to neonicotinoids reduces honey bee health near corn crops. Science. 356 (6345), 1395-1397 (2017).
- Mao, W., Schuler, M. A., Berenbaum, M. R. Disruption of quercetin metabolism by fungicide affects energy production in honey bees (Apis mellifera). P Natl Acad Sci. 114 (10), 2538-2543 (2017).
- Blacquière, T., Smagghe, G., Van Gestel, C. A. M., Mommaerts, V. Neonicotinoids in bees: A review on concentrations, side-effects and risk assessment. Ecotoxicology. 21 (4), 973-992 (2012).
- Sgolastra, F., Tosi, S., Medrzycki, P., Porrini, C., Burgio, G. Toxicity of spirotetramat on solitary bee larvae, Osmia cornuta (Hymenoptera: Megachilidae), in laboratory conditions. Journal of Apicultural Science. 59 (2), 73-83 (2015).
- Mader, E., Spivak, M., Evans, E. . Managing Alternative Pollinators. , (2010).
- Bosch, J., Kemp, W. P. Developing and establishing bee species as crop pollinators: the example of Osmia spp.(Hymenoptera: Megachilidae) and fruit trees. B Entomol Res. 92 (1), 3-16 (2002).
- Sampson, B. J., Rinehart, T. A., Kirker, G. T., Stringer, S. J., Werle, C. T. Phenotypic variation in fitness traits of a managed solitary bee, Osmia ribifloris (Hymenoptera: Megachilidae). J Econ Entomol. 108 (6), 2589-2598 (2015).
- Sampson, B. J., Cane, J. H., Kirker, G. T., Stringer, S. J., Spiers, J. M. Biology and management potential for three orchard bee species (Hymenoptera: Megachilidae): Osmia ribifloris Cockerell, O. lignaria (Say) and O.chalybea Smith with emphasis on the former. Acta Hort. 810, 549-555 (2009).
- Hladik, M. L., Vandever, M., Smalling, K. L. Exposure of native bees foraging in an agricultural landscape to current-use pesticides. Sci Total Environ. 542, 469-477 (2016).
- Long, E. Y., Krupke, C. H. Non-cultivated plants present a season-long route of pesticide exposure for honey bees. Nat Commun. 7, (2016).
- Krupke, C. H., Hunt, G. J., Eitzer, B. D., Andino, G., Given, K. Multiple routes of pesticide exposure for honey bees living near agricultural fields. PLoS ONE. 7 (1), e29268 (2012).
- Stoner, K. A., Eitzer, B. D. Using a hazard quotient to evaluate pesticide residues detected in pollen trapped from honey bees (Apis mellifera) in Connecticut. PLoS ONE. 8 (10), e77550 (2013).
- Sánchez-Bayo, F., Goulson, D., Pennacchio, F., Nazzi, F., Goka, K., Desneux, N. Are bee diseases linked to pesticides? - A brief review. Environ Int. 89, 7-11 (2016).
- Steffan-Dewenter, I., Klein, A. -. M., Gaebele, V., Alfert, T., Tscharntke, T. Bee diversity and plant-pollinator interactions in fragmented landscapes. Specialization and generalization in plant-pollinator interactions. , 387-410 (2006).
- Kremen, C., Ricketts, T. Global perspectives on pollination disruptions. Conserv Biol. 14 (5), 1226-1228 (2000).
- Memmott, J., Waser, N. M., Price, M. V. Tolerance of pollination networks to species extinctions. P Roy Soc B-Biol Sci. 271 (1557), 2605-2611 (2004).
- Spear, D. M., Silverman, S., Forrest, J. R. K. Asteraceae pollen provisions protect Osmia mason bees (Hymenoptera: Megachilidae) from brood parasitism. The American Naturalist. 187 (6), 797-803 (2016).
- Rust, R. W. Biology of Osmia (Osmia) ribifloris Cockerell (Hymenoptera: Megachilidae). J Kansas Entomol Soc. 59, 89-94 (1986).
- Torchio, P. F. Osmia ribifloris, a native bee species developed as a commercially managed pollinator of highbush blueberry (Hymenoptera: Megachilidae). J Kansas Entomol Soc. 63 (633), 427-436 (1990).
- Sanchez-Bayo, F., Goka, K. Pesticide residues and bees - A risk assessment. PLoS ONE. 9 (4), e94482 (2014).
- Kasiotis, K. M., Anagnostopoulos, C., Anastasiadou, P., Machera, K. Pesticide residues in honeybees, honey and bee pollen by LC-MS/MS screening: Reported death incidents in honeybees. Sci Total Environ. 485 (1), 633-642 (2014).
- Stanley, J., Sah, K., Jain, S. K., Bhatt, J. C., Sushil, S. N. Evaluation of pesticide toxicity at their field recommended doses to honeybees, Apis cerana and A. mellifera through laboratory, semi-field and field studies. Chemosphere. 119, 668-674 (2015).
- Praz, C. J., Müller, A., Dorn, S. Specialized bees fail to develop on non-host pollen: Do plants chemically protect their pollen?. Ecology. 89 (3), 795-804 (2008).
- Sedivy, C., Müller, A., Dorn, S. Closely related pollen generalist bees differ in their ability to develop on the same pollen diet: Evidence for physiological adaptations to digest pollen. Funct Ecol. 25 (3), 718-725 (2011).
- Williams, N. M. Use of novel pollen species by specialist and generalist solitary bees (Hymenoptera: Megachilidae). Oecologia. 134, (2003).
- Graystock, P., Rehan, S. M., McFrederick, Q. S. Hunting for healthy microbiomes: determining the core microbiomes of Ceratina, Megalopta, and Apis bees and how they associate with microbes in bee collected pollen. Conserv Genet. 18 (3), 1-11 (2017).
- Bosch, J., Vicens, N. Relationship between body size, provisioning rate, longevity and reproductive success in females of the solitary bee Osmia cornuta. Behav Ecol Sociobiol. 60 (1), 26-33 (2006).
- Bosch, J., Vicens, N. Body size as an estimator of production costs in a solitary bee. Ecol Entomol. 27 (2), 129-137 (2002).
- Radmacher, S., Strohm, E. Factors affecting offspring body size in the solitary bee Osmia bicornis (Hymenoptera, Megachilidae). Apidologie. 41 (2), 169-177 (2010).
- Seidelmann, K. Open-cell parasitism shapes maternal investment patterns in the Red Mason bee Osmia rufa. Behav Ecol. 17 (5), (2006).
- Becker, M. C., Keller, A. Laboratory rearing of solitary bees and wasps. Insect Science. 23 (6), 918-923 (2016).
- Bosch, J. The nesting behaviour of the mason bee Osmia cornuta (Latr) with special reference to its pollinating potential (Hymenoptera, Megachilidae). Apidologie. 25, 84-93 (1994).
- Krunić, M., Stanisavljević, L., Pinzauti, M., Felicioli, A. The accompanying fauna of Osmia cornuta and Osmia rufa and effective measures of protection. B Insectol. 58 (2), 141-152 (2005).
- Elliott, S. E., Irwin, R. E., Adler, L. S., Williams, N. M. The nectar alkaloid, gelsemine, does not affect offspring performance of a native solitary bee, Osmia lignaria (Megachilidae). Ecol Entomol. 33 (2), 298-304 (2008).
- Hendriksma, H. P., Härtel, S., Steffan-Dewenter, I. Honey bee risk assessment: New approaches for in vitro larvae rearing and data analyses. Methods Ecol and Evol. 2 (5), 509-517 (2011).
- Aupinel, P., et al. Improvement of artificial feeding in a standard in vitro method for rearing Apis mellifera larvae. B Insectol. 58 (2), 107-111 (2005).
- Beekman, M., Ratnieks, F. L. W. Long-range foraging by the honey-bee, Apis mellifera L. Funct Ecol. 14 (4), 490-496 (2000).
- Gathmann, A., Tscharntke, T. Foraging ranges of solitary bees. J Anim Ecol. 71 (5), 757-764 (2002).
- Greenleaf, S. S., Williams, N. M., Winfree, R., Kremen, C. Bee foraging ranges and their relationship to body size. Oecologia. 153 (3), 589-596 (2007).
- . Bee Pollen Supplement - Bee Rescued Available from: https://beerescued.com/product/bee-rescued-bee-pollen-supplement/ (2018)
- Cane, J. H., Griswold, T., Parker, F. D. Substrates and Materials Used for Nesting by North American Osmia Bees (Hymenoptera: Apiformes: Megachilidae). Annals of the Entomological Society of America. 100 (3), 350-358 (2007).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados