Method Article
Uma abordagem In Vitro para terapia fotodinâmica
Neste Artigo
Resumo
A terapia fotodinâmica (PDT) é um procedimento médico que envolve a incubação de uma forma exógena aplicada fotossensibilizador (PS) seguido de fotoativação de luz visível para induzir apoptose. Apresentamos um protocolo em vitro PDT projetado para simular o PDT que pode ser usado para estudar as diferenças em incubação de PS e parâmetros de tratamento com luz.
Resumo
A terapia fotodinâmica (PDT) é um procedimento médico que envolve a incubação de um fotossensibilizador exogenamente aplicada (PS), seguida de fotoativação de luz visível para induzir apoptose celular. O Federal Drug Administration aprovou o PDT para o tratamento de ceratose actínica e diretrizes clínicas recomendam o PDT como um tratamento para certos tipos de câncer de pele não-melanoma e acne vulgar. PDT é uma modalidade terapêutica vantajosa como é de baixo custo, não invasivo e associado com efeitos adversos mínimos e assustando. Na primeira etapa do PDT, um PS é aplicado e permitido acumular intracelular. Irradiação de luz subsequente induz a formação de espécies reativas de oxigênio, que em última análise, pode levar à apoptose celular, ruptura de membrana, dano mitocondrial, imunomodulação, proliferação de queratinócitos e volume de negócios de colágeno. Neste documento, apresentamos um método em vitro para estudo PDT em uma linhagem de células aderentes. Este protocolo de tratamento é projetado para simular o PDT e pode ser ajustado para estudar o uso do PDT com várias linhas celulares, fotossensibilizadores, temperaturas de incubação ou photoactivation comprimentos de onda. Células de carcinoma de células escamosas foram incubadas com 0, 0,5, 1,0 e 2 mM de ácido 5-aminolevulínico (5-ALA) por 30 min e fotoativados com 417 luz azul nm para 1.000 s. A medida de desfecho primário foi apoptose e necrose, como medido por citometria de fluxo D-anexina V e 7-aminoactinomycin. Houve um aumento dose-dependente na apoptose celular, após trinta minutos incubação de 5-ala Para alcançar alta validade inter teste, é importante manter a incubação consistente e luz parâmetros ao realizar experimentos em vitro PDT. PDT é que uma investigação clínica útil em procedimento e in vitro pode permitir o desenvolvimento do romance PSs, otimização de protocolos e novas indicações para o PDT.
Introdução
A terapia fotodinâmica (PDT) é um procedimento médico que envolve a incubação de um fotossensibilizador exogenamente aplicada (PS), seguida de fotoativação de luz visível para induzir apoptose celular. O Federal Drug Administration (FDA) aprovou o PDT para o tratamento de ceratose actínica (AK) e diretrizes clínicas recomendam o PDT como um tratamento para certos tipos de câncer de pele não-melanoma e acne vulgaris1,2. Usos não-dermatológico emergentes para PDT incluem o tratamento de cânceres ginecológicos, gastrointestinais e próstata3. PDT é uma modalidade terapêutica vantajosa como é associado com efeitos adversos mínimos e cicatrizes2, baixo custo e não-invasiva.
Na primeira etapa do PDT, um PS é aplicado e permitido acumular intracelular2. Nos Estados Unidos, ácido 5-aminolevulínico tópica (5-ALA) é comumente usado para tratar a AKs. Durante a incubação, fase, 5-ALA é convertido em protoporfirina IX (PP-IX), através da via de biossíntese do hemo em células incorporado3. Células de câncer e pré-câncer diminuíram a atividade ferroquelatase, que converte a protoporfirina IX (PP-IX), o produto final, hemo. Como resultado, as células do câncer se acumulam PP-IX em comparação com células normais4,5. Esta acumulação de PP-IX em câncer e pré-câncer células em relação ao tecido circundante permite PDT ser uma abordagem orientada com mínimos efeitos adversos. Irradiação de luz leva à geração de (ROS) de espécies reativas de oxigênio quando o oxigênio aceita elétrons excitados do PP-IX. PP-IX tem uma absorção de pico no espectro ultravioleta com picos menores em todo o espectro visível da luz, incluindo luz azul e vermelha2. Formação de ROS em última análise, pode levar a apoptose celular, ruptura de membrana, dano mitocondrial, imunomodulação, proliferação de queratinócitos e colágeno volume6,7,8,9 , 10.
PDT foi desenvolvido na década de 1970 e é uma evolução da modalidade terapêutica3. O protocolo aprovado pelo FDA para o tratamento de AKs recomenda incubação de 5-ALA pele de 14 – 18 h, mas incubação do 1 a 2 h é comumente usadas na prática clínica2. In vitro e mostramos que mais curta incubação do 5-ALA de 15 min pode aumentar apoptose celular de fibroblasto comparado com fibroblastos não tratados11,12. Além disso, romance chlorin, ftalocianina e PSs baseados em nanopartículas estão sendo estudados para melhorar a eficácia de PDT3. Neste documento, apresentamos um método em vitro para estudo PDT em um carcinoma de células escamosas aderente as células. Neste protocolo, SCC-13 células são incubadas com 0, 0,5, 1,0 e 2 mM 5-ALA por 30 min e fotoativados com 417 luz azul nm para 1.000 s. A medida de resultado primário é a apoptose e necrose, como medido por citometria de fluxo-anexina V e 7-aminoactinomycin D (7-AAD). Este protocolo de tratamento é projetado para simular o PDT e pode ser ajustado para estudar o uso do PDT com outras linhas celulares, fotossensibilizadores, temperaturas de incubação ou photoactivation comprimentos de onda. Preparação de grupos de controle adicionais pode ser necessária, incluindo o fluoróforo imaculado, único manchado, controles negativos e positivos por citometria de fluxo. Uma revisão abrangente da teoria, protocolos, delineamento experimental e gating para apoptose/necrose citometria de fluxo pode ser encontrada em outro lugar13.
Protocolo
1. preparação das células
- Células de placa 20.000 em 2 mL de meio de cultura em cada poço de uma placa de 6 utilizando uma técnica estéril em uma armário de biossegurança.
- Coloque placas 6-poços em uma incubadora umidificada (37 ° C, 5% CO2) para 24 h permitir que as células para aderir às placas.
2. preparação do fotossensibilizador para tratamento de células
- Prepare soluções de 0,5, 1 e 2 mM 5-ALA em meio de cultura. Se o soro fetal bovino (FBS) é um ingrediente do meio de cultura, preparar e tratar as células com 5-ALA na solução de meio de cultura com 0,1% FBS para incubação do. 11 , 12 neste caso, as células de SCC-13 não exigem FBS, então 5-ALA foi adicionado diretamente ao queratinócito soro livre médio, suplementado com extrato de pituitária bovina e fator de crescimento epidérmico.
- Aspire o meio de cultura e lavar as células pelo menos 2 mL de soro de tampão fosfato (PBS).
- Aspire PBS e adicionar 2 mL de soluções de 5-ALA 0, 0,5, 1 ou 2 mM em chapas separadas ou poços.
- Incube as celulas com 0, 0,5, 1 ou 2 mM 5-ALA em um 36 a 37 ° C, bloco de 30 min. de aquecimento protegem as células da exposição à luz durante a incubação, usando papel alumínio.
- As soluções de 5-ALA 0, 0,5, 1 e 2 mM, Aspire e lavar as células com 2 mL de PBS.
- Aspire PBS e adicionar 2 mL de meio de cultura para a irradiação de luz azul.
3. azul fototerapia Light
- Antes de irradiar as células, ligue o aparelho de luz azul (por exemplo, diodo emissor de luz, lâmpadas fluorescentes ou luz halógena) e correr para um ciclo (1.000 s) para aquecer o dispositivo. O dispositivo de luz azul deve ter um comprimento de onda de saída de 417 + /-5 nm. Permitindo que o dispositivo executar um ciclo antes dos tratamentos garante que o comprimento de onda de luz azul e irradiância consistentes em toda a fase de fotoativação.
- Use um fotômetro para medir irradiância na superfície da célula. A irradiação de luz azul na superfície da célula deve ser de 10 mW/cm2. A distância entre a luz e as células pode precisar ser ajustada para atingir uma irradiância de 10 mW/cm2 , dependendo da intensidade da fonte luminosa.
- Coloque grupos de tratamento de ALA 0, 0,5, 1 e 2 mM sobre uma superfície preta sob a fonte de luz azul. Irradiar as células com luz azul para 1.000 s (16 min e 40 s) para uma total fluência de 10 J/cm2. Após a fotoativação de luz azul, as células estão prontas para análise.
4. coleta e coloração
- Prepare o buffer de fluxo de acordo com as orientações do fabricante (ver Tabela de materiais).
- Aspire o meio de cultura e as células de lavagem com 2 mL de PBS.
- Adicione 1 mL de 0,25% do trypsin-EDTA e permitir que as células desanexar por aproximadamente 3 a 5 min. As células podem ser examinadas ao microscópio para confirmar o desprendimento de células.
- Adicione 1 mL de meio de cultura (ou PBS) com 10% de soro bovino fetal para desactivar a tripsina.
- Colete suspensão de células em tubos de fluxo 5ml rotulada.
- Gire o tubo de fluxo de 5 mL em uma centrífuga a 201 x g por 5 min. aspirado de solução sem remover centrifugado.
- Adicione 200 µ l de buffer de fluxo com conjugado anticorpo anexina-V (1 µ l de anexina-v por 39 µ l de buffer de fluxo) para cada amostra.
- Ressuspender as células e colocar na incubadora (37 ° C, 5% CO2) por 20 min permitir a ligação de anexina-V.
- Adicione 3 µ l de 7-AAD para cada amostra. Incube durante 5 min à temperatura ambiente.
5. fluxo Cytometric Analysis
- Siga as orientações de fabricante de citômetro de fluxo para set-up (ver Tabela de materiais).
- Coletar e analisar amostras com citometria de fluxo. 13
- Realize comparação estatística entre grupos tratamento e controle usando a análise de variância (ANOVA)14. Compare os meios dos grupos de tratamento para a média do controle com o teste de Dunnett, uma análise post hoc .
Resultados
Depois de SCC-13 células foram incubadas por 30 min com 0, 0,5, 1 e 2 mM 5-ALA e irradiadas com 1.000 s de azul claro, houve um aumento dose-dependente em apoptose celular. Apoptose total (média ± erro padrão da média) foi de 3,94 ± 0,34, 7,90 ± 0,52, 23,86 ± 0,52 e 38.33 ± 1,81 após 30 min de incubação com 0, 0,5, 1 e 2 mM 5-ALA, respectivamente e 1000 segundos de azul leves (Figura 1). Comparamos a porcentagem média da célula apoptótica entre 0, 0,5, 1 e 2 mM 5-ALA grupos incubados usando ANOVA. As células tratadas com 1 e 2 mM 5-ALA tinham um aumento significativo na apoptose celular, comparado a 0 mM 5-ALA células tratadas. Figura 2A mostra representativo fluxo cytometric gating de dispersão para a frente (FSC) versus dispersão lateral (SSC) para SCC-13 células incubadas com 0, 0,5, 1 e 2 mM 5-Alabama O círculo de gating inclui população celular SCC-13. Para este experimento, 7500 eventos foram coletados e o portão de população SCC-13 célula capturada pelo menos 90% dos eventos. Figura 2B mostra uma parcela representativa do 7-AAD no eixo x e anexina-V no eixo y. As populações de célula são bloqueadas em quatro quadrantes (Q1 a Q4) para discriminar células apoptóticas. Q1 (alta anexina-v, baixa 7-AAD) representa as células em fase precoce apoptose. Q2 (alta anexina-v de alta 7-AAD) representam as células em fase final apoptose ou necrose. Q3 (baixa anexina-v de alta 7-AAD) representa as células em fase de necrose. Representa a Q4 (baixa anexina-v, baixa 7-AAD) células não submetidos à apoptose ou necrose. Para calcular a porcentagem de células em apoptose, adicionamos a percentagem de células no Q1 e Q2. Inconsistência na duração do período de incubação de 5-ALA, temperatura de incubação ou dose de irradiação photoactivation pode alterar a eficácia do PDT. A Figura 3 demonstra um representante anexina-V e 7-AAD trama fluxo cytometric quando a temperatura de incubação é variada (i.e., 27, 36 ou 42 ° C). Houve um aumento de temperatura dependente na apoptose.
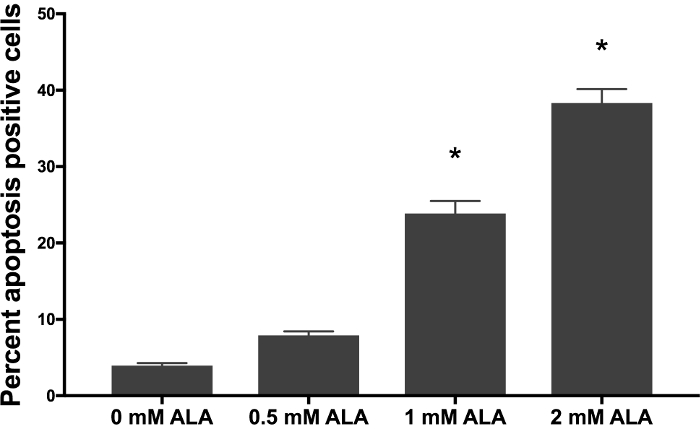
Figura 1: aumento Dose-dependente na apoptose após trinta minutos de incubação de 5-ala 5-ALA incubadas a 36 ° C durante trinta minutos, seguidos de 1.000 s de luz azul nas células SCC-13. Barras representam a médias positivas anexina-V células por cento em cada tratamento e grupo controle. Foram realizados experimentos em triplicado técnico. Significância estatística foi determinada por ANOVA, com p < 0.05 indicado por um asterisco (*). Barras de erro representam média ± erro padrão da média. Clique aqui para ver uma versão maior desta figura.
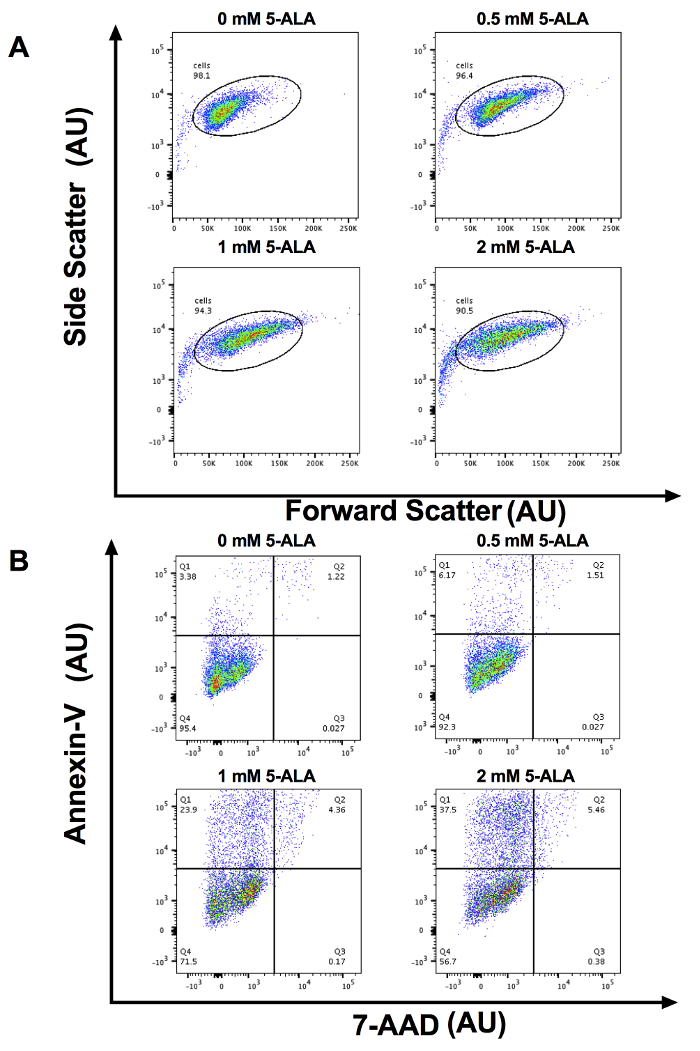
Figura 2: representante fluxo Cytometry plota. (A) representativo frente vs lado dispersão cytometry dispersão em unidades arbitrárias (AU) para x - e eixo y para 0, 0,5, 1 e 2 mM 5-ALA células incubadas. Para este experimento, 7500 eventos foram coletados e o portão de população celular SCC-13 capturado 90% dos eventos. (B) de citometria de fluxo representativo anexina-V vs. 7-AAD terrenos em AU para x - e eixo y para 0, 0,5, 1 e 2 mM 5-ALA células incubadas. Q1: início apoptotic células, Q2: tarde células apoptóticas/necrótico, Q3: células necróticas e Q4: células viáveis. Clique aqui para ver uma versão maior desta figura.
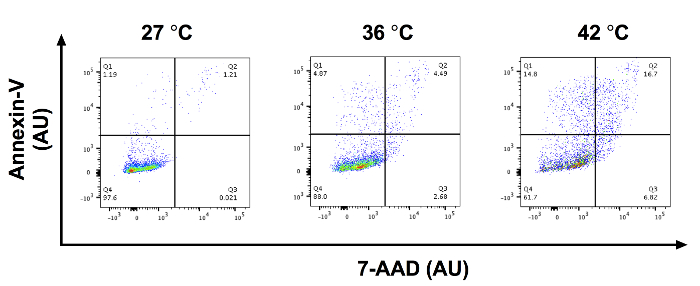
Figura 3: incubação de 5-ALA em temperaturas diferentes pode alterar a eficácia de PDT. Terrenos de citometria de fluxo representativo anexina-V vs. 7-AAD em AU para x - e y - axis para SCC-13 células incubadas com 0,5 mM 5-ALA em 27, 36 e 42 ° C. Q1: início apoptotic células, Q2: tarde células apoptóticas/necrótico, Q3: células necróticas e Q4: células viáveis. Clique aqui para ver uma versão maior desta figura.
Discussão
Houve um aumento significativo na apoptose SCC-13 após incubação do 30 min de 0,5, 1 e 2 mM 5-ALA seguido por 1.000 s da luz azul. Estes resultados são consistentes com nossa pesquisa publicada anteriormente, demonstrando que a incubação do 5-ALA de 30 min, seguido por ativação de luz azul leva a um aumento da percentagem de células de fibroblastos submetidos à apoptose12, dose-dependente 14.
Esta abordagem experimental para estudar PDT tem vantagens e limitações. Os métodos descritos em conformidade com a prática clínica como um PS comercialmente disponível e fonte de luz foram usados. Pesquisadores podem personalizar os métodos com diferentes tipos de células, PSs, fontes de luz e parâmetros de irradiação. No entanto, existem limitações dessa abordagem como este protocolo é projetado para células aderentes cultivadas em uma monocamada. Na prática clínica, as diferenças na patologia tecido arquitetura ou doença (ou seja, hiperqueratose ou fibrose) podem diminuir a absorção de PS ou penetração15de luz. Como resultado, as doses de tratamento e conclusões experimentais podem não corresponder diretamente à prática clínica. Modelos de tumor esferoide e microfluidic chip têm sido estudados como métodos para replicar mais estreitamente tumor microambiente16,17,18. Esferoides têm nichos celulares internos e externas que podem incorporar os fotossensibilizadores diferencialmente e representam a arquitetura do tumor heterogêneo. Outros pesquisadores usaram microfluidic chips para condições de tratamento de tela e entrega vascular de fotossensibilizadores. No entanto, microfluidic fichas podem ser caro para desenvolver ou difíceis de implementar para os investigadores não estão familiarizados com a técnica. Além disso, esferoides e microfluidic chips podem não refletir o tratamento clínico de cancros da pele em que fotossensibilizadores são aplicados diretamente para a superfície do tumor sem disseminação vascular. Pesquisadores podem ser necessário avaliar os prós e contras de cultura monocamada e modelos de tumor esferoide microfluidic fichas para estudar PDT em sistemas diferentes de doença. Como não existem células imunes ou matriz extracelular, não é possível determinar como PDT afeta as interações célula-célula complexas. Pesquisadores podem precisar confirmar em vitro resultados experimentais usando modelos animais e ensaios clínicos. Para alcançar alta validade inter teste, é importante manter a incubação consistente e luz parâmetros ao realizar experimentos em vitro PDT.
Temperatura é conhecida por alterar a eficácia do PDT19. Um estudo demonstrou que a morte celular, absorção de 5-ALA, PP-IX formação e liberação de citocinas podem ser melhoradas incubando-se células com 5-ALA em temperaturas acima de 44 ° C19. Temperaturas de incubação acima de 44 ° C podem levar à morte celular induzida térmica e temperaturas de incubação abaixo de 20 ° C não podem levar à absorção de 5-ALA significativa e acumulação19. Recomendamos que os investigadores realizar incubação do PS em um bloco de aquecimento temperatura ajustável a uma temperatura constante de Controlarar para confundir potencialmente efeitos térmicos. Além disso, é importante Incubar o fotossensibilizador para uma quantidade suficiente de tempo para permitir a conversão de 5-ALA em PP-IX. Neste protocolo, SCC-13 células foram incubadas com 5-ALA por 30 min, que com sucesso induziu a apoptose celular. Demonstramos anteriormente que uma incubação de 10 min de 5-ALA não aumentou significativamente apoptose em fibroblasto em relação ao controle não tratados fibroblastos11,14. PP-IX começa a acumular-se na pele de rato depois de 5-ALA está incubando durante seis minutos a 37 ° C. Portanto, após dez minutos de incubação de 5-ALA, pode não haver suficiente acumulação de PP-IX para induzir a apoptose de células20. Recomendamos um período de incubação mínimo de 20 a 30 min para 5-ALA baseado em nossos anteriores estudos11,14. Pesquisadores podem ser necessário otimizar o período de incubação, com base no laboratório de configuração, fotossensibilizador de interesse, tipo de célula e indicação clínica. Experimentos de otimização e titulação de anticorpos podem ser realizados para obter melhores resultados usando as orientações de fabricantes. Outros ensaios de interesse podem ser realizados seguindo o photoactivation luz azul, incluindo dihydroethidium quantificação fluxo cytometric ROS. 14
Variação na quantidade de luz entregues por unidade de superfície (ou seja, irradiância) e dose de irradiação total (ou seja, fluência) durante a fase de fotoativação pode afetar a formação de ROS e de apoptose celular21. A relação entre tempo, irradiância e fluência pode ser descrita pela seguinte equação:
Fluência (J/cm2) = irradiância (W/cm2) x tempo (s)
Como fluência é dependente do tempo, aumentando ou reduzindo as photoactivation fases pode mudar eficácia do tratamento. A irradiância é proporcional à distância ao quadrado entre a fonte luminosa e o tecido-alvo. Como resultado, se a luz for muito longe, pode não haver energia suficiente luz, entregada para o tecido-alvo para excitar o PS. Alternativamente, a irradiação pode ser aumentada pela luz refletindo as superfícies circundantes. Portanto, recomendamos realizar irradiações de luz com as placas de cultura de células colocadas sobre uma superfície preta para evitar a reflexão da luz. Pesquisadores podem adquirir comercialmente disponíveis ou aprovado pela FDA azuis diodos emissores de luz e dispositivos fluorescentes para uso nas experiências do PDT, mas estes dispositivos podem ter diferentes potências e uniformidade de campo claro. Um fotômetro de comprimento de onda específico deve ser usado para medir a radiação na superfície da célula e uniformidade do campo de luz antes de cada experimento para resultados consistentes. Um difusor comercialmente disponível pode ser usado para melhorar a uniformidade do campo, se necessário.
Em resumo, descrevemos uma abordagem in vitro para investigar PDT por detalhando a teoria, métodos experimentais, limitações, possíveis armadilhas e recomendações para a otimização. PDT é que uma investigação clínica útil em procedimento e in vitro pode permitir o desenvolvimento do romance PSs, otimização de protocolos e novas indicações para o PDT.
Divulgações
DUSA/Sun farmacêutica desde 5-ALA e o dispositivo de luz BLU-U. Este manuscrito foi apoiado pelo residual do Dr. Jagdeo financiamento. O conteúdo não representam a opinião do departamento dos EUA de assuntos de veteranos ou o governo dos Estados Unidos.
Agradecimentos
Os autores têm sem agradecimentos.
Materiais
| Name | Company | Catalog Number | Comments |
| Keratinocyte serum free medium | Thermofisher | 17005042 | Culture medium for SSC-13 cells |
| DMEM low glucose glutamax | Thermofisher | 10567022 | Possible culture medium for other cell types |
| 6-well culture plates | Thermofisher | 720083 | |
| PBS | Thermofisher | 14190250 | |
| 0.25% Trypsin-EDTA | Thermofisher | 25200056 | |
| Trypan Blue Solution, 0.4% | Thermofisher | 15250061 | For cell counting and plating |
| BLU-U light | DUSA | Request from manufacturer | Other blue LED, flourescent, or halogen lights may used |
| 5-ALA | DUSA | Request from manufacturer | |
| FBS | Atlanta Biologicals | C17032 | |
| FlowCellect Annexin Red Kit | Millipore Sigma | FCCH100108 | Propidium iodide may replace 7-AAD. Comes with annexin-V, 7-AAD, and flow buffer |
| FACSCanto II | BD | Request from manufacturer | Any flow cytometer may be used |
| Counting Chamber | Hausser | 3120 | For cell counting and plating |
| FlowJo | FlowJo | Request from manufacturer | Flow cytometry analysis software |
Referências
- Morton, C., et al. European Dermatology Forum guidelines on topical photodynamic therapy. European Journal of Dermatology. 25 (4), 296-311 (2015).
- Ozog, D. M., et al. Photodynamic therapy: A clinical consensus guide. Dermatologic Surgery: Official Publication for American Society for Dermatologic Surgery. 42 (7), 804-827 (2016).
- Abrahamse, H., Hamblin, M. R. New photosensitizers for photodynamic therapy. Biochemical Journal. 473 (4), 347-364 (2016).
- Josefsen, L. B., Boyle, R. W. Photodynamic therapy and the development of metal-based photosensitisers. Metal-Based Drugs. 2008, 276109 (2008).
- Ohgari, Y., et al. Mechanisms involved in δ-aminolevulinic acid (ALA)-induced photosensitivity of tumor cells: Relation of ferrochelatase and uptake of ALA to the accumulation of protoporphyrin. Biochemical pharmacology. 71 (1-2), 42-49 (2005).
- Kessel, D., Luo, Y. Mitochondrial photodamage and PDT-induced apoptosis. Journal of Photochemistry and Photobiology B: Biology. 42 (2), 89-95 (1998).
- Goldberg, D. J. Photodynamic therapy in skin rejuvenation. Clinics in Dermatology. 26 (6), 608-613 (2008).
- Sakamoto, F. H., Lopes, J. D., Anderson, R. R. Photodynamic therapy for acne vulgaris: A critical review from basics to clinical practice: Part I. Acne vulgaris: When and why consider photodynamic therapy. Journal of the American Academy of Dermatology. 63 (2), 183-193 (2010).
- Boen, M., Brownell, J., Patel, P., Tsoukas, M. M. The role of photodynamic therapy in acne: An evidence-based review. American Journal of Clinical Dermatology. 18 (3), 311-321 (2017).
- Allison, R. R., Moghissi, K. Oncologic photodynamic therapy: Clinical strategies that modulate mechanisms of action. Photodiagnosis and Photodynamic Therapy. 10 (4), 331-341 (2013).
- Koo, E., Austin, E., Mamalis, A., Jagdeo, J., et al. Thermal ultra short photodynamic therapy: heating fibroblasts during sub-30-minute incubation of 5-aminolevulinic acid increases photodynamic therapy-induced cell death. Dermatologic Surgery: Official Publication for American Society for Dermatologic Surgery. , (2017).
- Koo, E., Austin, E., Mamalis, A., Jagdeo, J. Efficacy of ultra short sub-30 minute incubation of 5-aminolevulinic acid photodynamic therapy in vitro. Lasers in Surgery and Medicine. 49 (6), 592-598 (2017).
- JoVE Science Education Database. Cell Biology. Annexin V and Propidium Iodide Labeling. JoVE. , (2018).
- Mamalis, A., Koo, E., Sckisel, G., Siegel, D., Jagdeo, J. Temperature-dependent impact of thermal aminolaevulinic acid photodynamic therapy on apoptosis and reactive oxygen species generation in human dermal fibroblasts. British Journal of Dermatology. 175 (3), 512-519 (2016).
- Gilaberte, Y., et al. Cellular intrinsic factors involved in the resistance of squamous cell carcinoma to photodynamic therapy. Journal of Investigative Dermatology. 134 (9), 2428-2437 (2014).
- Yoon, H. K., et al. Nanophotosensitizers engineered to generate a tunable mix of reactive oxygen species, for optimizing photodynamic therapy, using a microfluidic device. Chemistry of Materials. 26 (4), 1592-1600 (2014).
- Chen, Y. -. C., Lou, X., Zhang, Z., Ingram, P., Yoon, E. High-throughput cancer cell sphere formation for characterizing the efficacy of photo dynamic therapy in 3D cell cultures. Scientific Reports. 5, 12175 (2015).
- Campos, C., Inada, N., Kurachi, C. Low-dose PDT on breast cancer spheroids. Optical Methods for Tumor Treatment and Detection: Mechanisms and Techniques in Photodynamic Therapy XXVII. , (2018).
- Yang, J., et al. The influence of temperature on 5-aminolevulinic acid-based photodynamic reaction in keratinocytes in vitro. Photodermatology, Photoimmunology & Photomedicine. 26 (2), 83-88 (2010).
- Juzeniene, A., Juzenas, P., Kaalhus, O., Iani, V., Moan, J. Temperature effect on Accumulation of protoporphyrin IX after topical application of 5-aminolevulinic acid and its methylester and hexylester derivatives in normal mouse skin. Photochemistry and Photobiology. 76 (4), 452-456 (2002).
- Novak, B., Heesen, L., Schary, N., Lubbert, H. The influence of different illumination parameters on protoporphyrin IX induced cell death in squamous cell carcinoma cells. Photodiagnosis and Photodynamic Therapy. 21, 385-392 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados