É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Fabricando um rim córtex Extracellular Matrix-derivado hidrogel
Neste Artigo
Resumo
Aqui nós apresentamos um protocolo para fabricar um rim córtex extracelulares matriz-derivado hidrogel para manter a composição de estruturais e bioquímicos de matriz extracelular (ECM) do rim nativo. O processo de fabricação e suas aplicações são descritas. Finalmente, uma perspectiva sobre como usar este hidrogel para apoiar a bioengenharia e a regeneração celular e tecido de rim-específicas é discutida.
Resumo
Matriz extracelular (ECM) fornece importantes pistas biofísicas e bioquímicas para manter a homeostase do tecido. Hidrogel sintético atual oferece suporte mecânico robusto em vitro cultura de células, mas falta a composição de proteínas e ligante necessária para eliciar comportamentos fisiológicos das células. Este manuscrito descreve um método de fabricação para um hidrogel de ECM-derivado de córtex renal com robustez mecânica adequada e apoia composição bioquímica. O hidrogel é fabricada por mecanicamente, homogeneizando e solubilizing córtex renal humana decellularized ECM. A matriz preserva rácios de proteína nativa renal córtex ECM, permitindo também a criação de gelificação para stiffnesses mecânicas fisiológicas. O hidrogel serve como substrato ao qual nos rins córtex-derivado de células podem ser mantidas sob condições fisiológicas. Além disso, a composição de hidrogel pode ser manipulada para modelar um ambiente de doente que permite o estudo futuro das doenças renais.
Introdução
Matriz extracelular (ECM) fornece importantes pistas biofísicas e bioquímicas para manter a homeostase do tecido. A composição molecular complexa regula propriedades estruturais e funcionais do tecido. Proteínas estruturais fornecem células com consciência espacial e permitam a migração e adesão1. Ligantes acoplados interagem com receptores de superfície celular para controlar o comportamento de célula2. Rim ECM contém uma infinidade de moléculas cuja composição e estrutura varia dependendo da localização anatômica, grau de desenvolvimento e doença estado3,4. Recapitulando a complexidade do ECM é um aspecto fundamental no estudo de células de rim-derivado em vitro.
Tentativas anteriores de replicar o microambiente ECM focaram-se decellularizing todo tecido para criar andaimes capaz de recellularization. Decellularization tem sido realizado com detergentes químicos tais como sulfato dodecyl de sódio (SDS) ou detergentes não-iônicos, e utiliza qualquer órgão inteiro perfusão ou imersão e agitação métodos5,6,7 ,8,9,10,11,12,13. Os andaimes aqui apresentados preservar as pistas estruturais e bioquímicas encontradas no tecido nativo ECM; Além disso, recellularization com células específicas do doador tem relevância clínica em cirurgia reconstrutiva14,15,16,17,18, 19. no entanto, estes andaimes falta flexibilidade estrutural e, portanto, são incompatíveis com muitos dispositivos atuais usados para estudos em vitro . Para contornar essa limitação, muitos grupos têm ulteriormente decellularized ECM em hidrogel20,21,22,23,24. Estes hidrogel é compatíveis com bioink e moldagem por injeção e contornar micrômetro escala espacial restrições que decellularized lugar de andaimes nas células. Além disso, a composição molecular e rácios encontrados em ECM nativo são preservados3,25. Aqui vamos demonstrar um método para fabricar um hidrogel derivado de córtex renal ECM (kECM).
O propósito do presente protocolo é produzir um hidrogel que Replica o microambiente da região cortical do rim. Tecido de córtex renal é decellularized em uma solução de SDS 1% sob agitação constante para remover a matéria celular. SDS é comumente usado para decellularize de tecido devido à sua capacidade de remover rapidamente o material celular imunológica6,7,9,26. O kECM é então sujeito a homogeneização mecânica e liofilização5,6,9,11,26. Solubilização de um ácido forte com pepsina resulta em uma solução de hidrogel final20,27. KECM nativo de proteínas que são importantes para estrutural suportam e sinal de transdução estão preservados3,25. O hidrogel pode também ser gelificada para dentro de uma ordem de magnitude de rim humano nativo córtex28,29,30. Esta matriz fornece um ambiente fisiológico que tem sido usado para manter a quiescência de células específicas do rim em comparação com hidrogel de outras proteínas da matriz. Além disso, composição da matriz pode ser manipulada, por exemplo, através da adição de colágeno-I, ambientes de doença de modelo para o estudo de fibrose renal e outras doenças de rim31,32.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Rins humanos foram isolados por LifeCenter noroeste seguindo as diretrizes éticas, definidas pela Associação de organizações de contratos órgão. Este protocolo segue animais cuidados e célula cultura diretrizes delineadas pela Universidade de Washington.
1. preparação do tecido do rim humano
- Preparação da solução de decellularization
- Esterilize um copo de 5000 mL e uma barra de agitação de 70 x 10mm.
- Misture 1: 1000 (peso: volume) Dodecil sulfato de sódio (SDS) em água desionizada esterilizada no copo. Deixe a solução em uma placa de agitação em aproximadamente 200 rpm para 24h ou até o SDS é completamente dissolvido.
Nota: Normalmente, 2500 mL de solução de SDS 1% é suficiente para decellularize um único rim humano. - Transferir a solução para um filtro de vácuo estéril 500 mL e filtrar em recipientes sealable esterilizados.
- Processamento de tecido renal
- Lavagem e da autoclave um par de pinças, pinça hemostática dois grampos, um par de tesouras de serviço geral série, duas alças de lâmina de bisturi, uma proveta de 1000 mL coberta com folha de alumínio e uma barra de agitação de 36 x 9 mm.
- Linha um capuz de cultura de tecidos com underpad. Coloque o copo, um prato de cultura de tecido estéril (150 x 25 mm) e o órgão de rim no capô. Encha o pote com 500 mL de solução de SDS 1%.
Nota: Os rins humanos foram recebidos no gelo do LifeCenter noroeste. - Coloque o rim a placa de cultura de tecido estéril (figura 1A). Retire toda a gordura perirrenal cortando levemente ao redor da cápsula renal com um bisturi (figura 1B).
- Faça uma incisão superficial 8-10 cm com o bisturi, fundo o suficiente para abrir a cápsula renal sem danificar o tecido do córtex subjacente, em toda a extremidade superior do rim. Remova a cápsula renal por peeling-lo longe do tecido do córtex com duas pinças pinça hemostática (Figura 1).
- Bissetriz do rim ao longo do plano coronal, usando o bisturi ao longo do lado lateral do rim (Figura 1). Isolar o tecido do córtex de ambas as partes por esculpir a região medular com o bisturi (Figura 1E) e cortar o tecido do córtex em pedaços de 0,5 cm3 (Figura 1F). Remova qualquer grandes vasos visíveis.
- Isolamento de matriz extracelular
- Em uma capa de cultura de tecidos, encha uma proveta de 1000 mL com 500 mL de solução de SDS 1%. Coloque a barra de tecido e mexa de córtex em cubos no copo contendo solução de SDS. Cubra o copo com folha de alumínio esterilizado e coloque-o em um prato misture a aproximadamente 400 rpm fora a capa de cultura de tecidos.
- Depois que o tecido do córtex tem sido na placa de agitação por 24 h, trazer o copo em uma capa de cultura de tecidos e adicionar um filtro de célula estéril de 40 µm feito com malha de nylon. Encha um copo separado 1000 mL com 200 mL de água sanitária e coloque dentro do capô de cultura de tecidos.
- Pipetar a solução de SDS através do filtro de célula para o béquer contendo água sanitária. Pipetar toda solução de SDS até apenas tecido decellularized e o filtro célula permanecem no copo.
Nota: O filtro célula deve evitar qualquer tecido removido durante a aspiração da solução. - Deixe o filtro célula copo e encha com 500 mL de solução de SDS fresca. Cubra o copo com a mesma folha de alumínio e coloque em uma placa de agitação na mesma velocidade que antes.
- Repita etapas 1.3.1-1.3.3 cada 24 horas com solução de SDS fresca para um total de cinco dias.
- Lave o tecido decellularized com água esterilizada cada 24h para total de 3 dias, seguindo a técnica descrita em etapas 1.3.1-1.3.3.
- Lave o tecido decellularized com água de grau de cultura de célula cada 24h para total de 2 dias, seguindo a técnica descrita em etapas 1.3.1-1.3.3.
- Repita as etapas 1.3.1-1.3.2. Transferir o tecido decellularized (referido como kECM deste ponto na) em um 30ml self permanente tubo cônico e preenchê-lo com água de grau de cultura de célula até que todo o tecido está submersa.
2. fabricação da solução estoque de hidrogel
- Processamento mecânico do tecido decellularized
- Em uma capa de cultura de tecidos, homogeneizar mecanicamente o kECM no interior do tubo cônico com um homogeneizador por 2 min.
Nota: KECM homogeneizado deve assemelhar-se uma solução opaca com nenhum fragmentos visíveis de ECM. - Mergulhe o tubo cônico contendo a kECM em nitrogênio líquido até ebulição em torno do tubo não mais persiste. Armazene o kECM em-4 ˚ c durante a noite.
- Em uma capa de cultura de tecidos, homogeneizar mecanicamente o kECM no interior do tubo cônico com um homogeneizador por 2 min.
- Liofilização de tecidos decellularized congelados
- Ligeiramente Afrouxe a tampa do tubo cônico para permitir a troca gasosa e colocar o tubo em uma máquina de liofilização. Lyophilize o kECM por três dias ou até que se assemelha a um pó branco fino. Loja-4 ˚ c.
- Digestão química e solubilização de gel
- Autoclave, um frasco de cintilação de 20 mL e cap, uma barra de agitação de 15,9 x 7,9 mm e um par de pinças de ponta fina.
- Pesar o liofilizado kECM e calcular o volume de HCl e massa de pepsina necessária para solubilizar o kECM para uma solução de 3% (30 mg/mL), usando as seguintes equações, onde mpepsina é a massa de pepsina, mtecido é a massa do tecido liofilizado e VHCl é o volume de 0,01 N HCl:
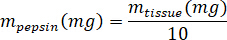
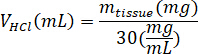
- Em uma capa de cultura de tecidos, adicionar barra de agitação, 0,01 N HCl e pepsina gástrica suínos para o frasco de cintilação e deixá-lo em um prato misture a aproximadamente 500 rpm até dissolver toda a pepsina. Transferir o kECM liofilizado para o frasco de cintilação e deixar a solução em uma placa de agitação em aproximadamente 500 rpm durante três dias.
3. hidrogel gelificação
- Preparação do hidrogel rim ECM
- O hidrogel do gel misturando a solução-mãe de hidrogel kECM com 1 N NaOH, 10 x mídia suplemento (M199) e meios de cultura de células. Mantenha todas as soluções no gelo.
Nota: Concentrações de gel de Final de 7,5 mg/mL foram usadas para cultura de células. 1 mL de gel de kECM era suficiente para experimentos de cultura celular apresentados. - Determinar o volume do gel de kECM funcional produzido e volume de estoque kECM hydrogel necessário usando a seguinte equação, onde final V é o volume do gel criado, VkECM estoque é o volume de hidrogel de kECM das ações necessária, CkECM de estoque é a concentração de hidrogel o estoque kECM, e Cfinal é a concentração do gel final:
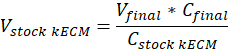
- Determinar o volume de neutralizar os reagentes necessários usando as seguintes equações, onde VNaOH é o volume de 1 N de NaOH, V10 X é o volume de M199 completar 10 mídia X e V1 X é o volume de meios de cultura de células:
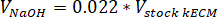
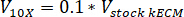
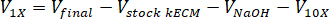
- Em uma capa de cultura de tecidos, pipete os reagentes neutralizantes (NaOH, M199 e meios de cultura de células) para um estéril 30ml self permanente tubo cônico. Misture a solução de reagente a neutralização com um microspatula.
- Use uma seringa de 1ml estéril para transferir o volume apropriado de hidrogel de kECM ações para a solução neutralizante do reagente. Use um microspatula para misturar delicadamente a solução até obter uma homogênea em solução de hidrogel de cor.
Nota: Evite a introdução de bolhas de ar agitando lentamente e suavemente. - Para incorporar o hidrogel de kECM células, subtrai os cálculos de volume de solução neutralizante na etapa 3.1.1.3 em 10 µ l de meios de cultura celular (V1. X).
- Suspenda as células em 10 µ l de meios de cultura de células. Determine o número de células a ser suspenso usando a seguinte equação, onde #células implica o número de células para suspender efinal V é o volume do gel criado:
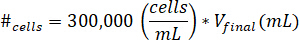
Nota: 300.000 células/mL é a concentração de células utilizadas no gel kECM. - Pipete a 10 µ l de solução de célula suspensa para o gel de kECM final após a solução estoque de kECM foi misturada com solução de reagente de neutralização. Mexa a solução com um microspatula até as células são distribuídas uniformemente.
- Suspenda as células em 10 µ l de meios de cultura de células. Determine o número de células a ser suspenso usando a seguinte equação, onde #células implica o número de células para suspender efinal V é o volume do gel criado:
- O hidrogel do gel misturando a solução-mãe de hidrogel kECM com 1 N NaOH, 10 x mídia suplemento (M199) e meios de cultura de células. Mantenha todas as soluções no gelo.
- Use uma seringa de 1 mL para preencher um dispositivo de cultura de célula desejado com o hidrogel de kECM.
- Permitir que o gel definir em 37 ˚ c por 1h antes de transferir ou chapear pilhas.
Access restricted. Please log in or start a trial to view this content.
Resultados
O hidrogel de kECM fornece uma matriz para cultura de células de rim com composição química similar como o microambiente de rim nativo. Para fabricar o hidrogel, tecido de córtex renal é mecanicamente isolado de um órgão de rim e cubos (Figura 1). Decellularization com um detergente químico (Figura 2AA..1-3), seguido de lavagens com água para remover partículas de detergente (Figur...
Access restricted. Please log in or start a trial to view this content.
Discussão
Matrizes fornecem importantes dicas mecânicas e químicas que regem o comportamento da célula. Hidrogel sintético é capazes de apoiar a padronização 3-dimensional complexa mas não apresentar as diversas pistas extracelulares encontradas no microambiente matriz fisiológica. Hidrogel derivado de ECM nativo é materiais ideais para estudos tanto in vivo e in vitro . Estudos anteriores usaram decellularized ECM hidrogel para revestir biomateriais sintéticos para evitar33
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores gostaria de reconhecer a Lynn e Mike Garvey Imaging laboratório do Instituto de células-tronco e medicina regenerativa e LifeCenter noroeste. Eles também gostaria de agradecer o apoio financeiro da National Institutes of Health subvenções, UH2/UH3 TR000504 (de J.H.) e DP2DK102258 (para Y.Z.), NIH T32 formação grant DK0007467 (R.J.N.) e um presente sem restrições os centros de rim do noroeste para o Instituto de pesquisa do rim.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| Preparation of Kidney Tissue | |||
| 5000 mL Beaker | Sigma-Aldrich | Z740589 | |
| Sodium Dodecyl Sulfate (SDS) | Sigma-Aldrich | 436143 | |
| Sterile H2O | Autoclaved DI H2O | ||
| Stir Bar (70 x 10 mm) | Fisher Science | 14-512-128 | |
| 500 mL Vacuum Filter | VWR | 97066-202 | |
| Stir Plate | Sigma-Aldrich | CLS6795420D | |
| 1000 mL Beaker | Sigma-Aldrich | CLS10031L | |
| Forceps | Sigma-Aldrich | F4642 | Any similar forceps may be used |
| Scissor-Handle Hemostat Clamp | Sigma-Aldrich | Z168866 | |
| Dissecting Scissors | Sigma-Aldrich | Z265977 | |
| Scalpel Handle, No. 4 | VWR | 25859-000 | Any similar scalpel handle may be used |
| Scalpel Blade, No. 20 | VWR | 25860-020 | Any similar scalpel blade may be used |
| Stir Bar (38.1 x 9.5 mm) | Fisher Science | 14-513-52 | |
| Absorbent Underpad | VWR | 82020-845 | |
| Petri Dish (150 x 25 mm) | Corning | 430597 | |
| Autoclavable Biohazard Bag | VWR | 14220-026 | |
| Sterile Cell Strainer (40 um) | Fisher Science | 22-363-547 | |
| Cell Culture Grade Water | HyClone | SH30529.03 | |
| 30 mL Freestanding Tube | VWR | 89012-778 | |
| Fabrication of ECM Gel | |||
| Tissue Homogenizer Machine | Polytron | PCU-20110 | |
| Freeze Dryer | Labconco | 7670520 | |
| 20 mL Glass Scintillation Vials and Cap | Sigma-Aldrich | V7130 | |
| Stir Bar (15.9 x 8 mm) | Fisher Science | 14-513-62 | |
| Pepsin from Porcine Gastric Mucosa | Sigma-Aldrich | P7012 | |
| 0.01 N HCl | Sigma-Aldrich | 320331 | Dilute to 0.01 N HCl with cell culuture water |
| Kidney ECM Gelation | |||
| 1 N NaOH (Sterile) | Sigma-Aldrich | 415413 | Dilute to 1 N in cell culture grade water |
| Medium 199 | Sigma-Aldrich | M4530 | |
| 15 mL Conical Tube | ThermoFisher | 339651 | |
| Cell Culture Media | ThermoFisher | 11330.032 | Dulbecco's Modified Eagle Medium: Nutrient Mixture F-12 (DMEM/F12) |
| Fetal Bovine Serum (FBS) | Gibco | 10082147 | |
| Antibiotic-Antimycotic 100X | Life Technologies | 15240-062 | |
| Insulin, Transferrin, Selenium, Sodium Pyruvate Solution (ITS-A) 100X | Life Technologies | 51300-044 | |
| 1 mL Syringe | Sigma-Aldrich | Z192325 | |
| Microspatula | Sigma-Aldrich | Z193208 |
Referências
- Lelongt, B., Ronco, P. Role of extracellular matrix in kidney development and repair. Pediatric Nephrology. 18 (8), 731-742 (2003).
- Yue, B. Biology of the Extracellular Matrix: An Overview. Journal of Glaucoma. 23, S20-S23 (2014).
- Miner, J. H. Renal basement membrane components. Kidney International. 56 (6), 2016-2024 (1999).
- Petrosyan, A., et al. Decellularized Renal Matrix and Regenerative Medicine of the Kidney: A Different Point of View. Tissue Engineering Part B. 22 (3), 183-192 (2016).
- Caralt, M., et al. Optimization and Critical Evaluation of Decellularization Strategies to Develop Renal Extracellular Matrix Scaffolds as Biological Templates for Organ Engineering and Transplantation. American Journal of Transplantation. 15 (1), 64-75 (2015).
- Nakayama, K. H., Batchelder, C. A., Lee, C. I., Tarantal, A. F. Decellularized rhesus monkey kidney as a three-dimensional scaffold for renal tissue engineering. Tissue Engineering Part A. 16 (7), 2207-2216 (2010).
- Nakayama, K. H., Lee, C. C. I., Batchelder, C. A., Tarantal, A. F. Tissue Specificity of Decellularized Rhesus Monkey Kidney and Lung Scaffolds. Public Library of Science ONE. 8 (5), (2013).
- Orlando, G., et al. Production and implantation of renal extracellular matrix scaffolds from porcine kidneys as a platform for renal bioengineering investigations. Annals of Surgery. 256 (2), 363-370 (2012).
- Sullivan, D. C., et al. Decellularization methods of porcine kidneys for whole organ engineering using a high-throughput system. Biomaterials. 33 (31), 7756-7764 (2012).
- Choi, S. H., et al. Development of a porcine renal extracellular matrix scaffold as a platform for kidney regeneration. Journal of Biomedical Materials Research Part A. 103 (4), 1391-1403 (2015).
- Ross, E. A., et al. Mouse stem cells seeded into decellularized rat kidney scaffolds endothelialize and remodel basement membranes. Organogenesis. 8 (2), 49-55 (2012).
- Nagao, R. J., et al. Decellularized Human Kidney Cortex Hydrogels Enhance Kidney Microvascular Endothelial Cell Maturation and Quiescence. Tissue Engineering Part A. 22 (19-20), 1140-1150 (2016).
- Gupta, S. K., Mishra, N. C., Dhasmana, A. Decellularization Methods for Scaffold Fabrication. Methods in Molecular Biology. , 1-10 (2017).
- Hudson, T., et al. Optimized Acellular Nerve Graft is Immunologically Tolerated and Supports Regeneration. Tissue Engineering. 10 (11), 1641-1651 (2004).
- Atala, A., Bauer, S. B., Soker, S., Yoo, J. J., Retik, A. B. Tissue-engineered autologous bladders for patients needing cystoplasty. Lancet. 367 (9518), 1241-1246 (2006).
- Ott, H. C., et al. Perfusion-decellularized matrix: using nature's platform to engineer a bioartificial heart. Nature Medicine. 14 (2), 213-221 (2008).
- Uygun, B., et al. Organ reengineering through development of a transplantable recellularied liver graft using decellularized liver matrix. Nature Medicine. 16 (7), 814-820 (2010).
- Nagao, R. J., et al. Preservation of Capillary-beds in Rat Lung Tissue Using Optimized Chemical Decellularization. Journal of Materials Chemistry B. 1 (37), 4801-4808 (2013).
- Song, J. J., et al. Regeneration and experimental orthotopic transplantation of a bioengineered kidney. Nature Medicine. 19 (5), 646-651 (2013).
- Freytes, D. O., Martin, J., Velankar, S. S., Lee, A. S., Badylak, S. F. Preparation and rheological characterization of a gel form of the porcine urinary bladder matrix. Biomaterials. 29 (11), 1630-1637 (2008).
- Wolf, M. T., et al. A hydrogel derived from decellularized dermal extracellular matrix. Biomaterials. 33 (29), 7028-7038 (2012).
- Fisher, M. B., et al. Potential of healing a transected anterior cruciate ligament with genetically modified extracellular matrix bioscaffolds in a goat model. Knee Surgery, Sports Traumatology, Arthroscopy. 20 (7), 1357-1365 (2012).
- Ghuman, H., et al. ECM hydrogel for the treatment of stroke: Characterization of the host cell infiltrate. Biomaterials. 91, 166-181 (2016).
- Rijal, G. The decellularized extracellular matrix in regenerative medicine. Regenerative Medicine. 12 (5), 475-477 (2017).
- Lennon, R., et al. Global Analysis Reveals the Complexity of the Human Glomerular Extracellular Matrix. Journal of the American Society of Nephrology. 25 (5), 939-951 (2014).
- Bonandrini, B., et al. Recellularization of Well-Preserved Acellular Kidney Scaffold Using Embryonic Stem Cells. Tissue Engineering Part A. 20 (9-10), 1486-1498 (2014).
- O'Neill, J. D., Freytes, D. O., Anandappa, A. J., Oliver, J. A., Vunjak-Novakovic, G. V. The regulation of growth and metabolism of kidney stem cells with regional specificity using extracellular matrix derived from kidney. Biomaterials. 34 (38), 9830-9841 (2013).
- Streitberger, K. -J., et al. High-resolution mechanical imaging of the kidney. Journal of Biomechanics. 47 (3), 639-644 (2014).
- Bensamoun, S. F., et al. Stiffness imaging of the kidney and adjacent abdominal tissues measured simultaneously using magnetic resonance elastography. Clinical Imaging. 35 (4), 284-287 (2011).
- Moon, S. K., et al. Quantification of Kidney Fibrosis Using Ultrasonic Shear Wave Elastography. Journal of Ultrasound in Medicine. 34, 869-877 (2015).
- Genovese, F., Manresa, A. A., Leeming, D. J., Karsdal, M. A., Boor, P. The extracellular matrix in the kidney: a source of novel non-invasive biomarkers of kidney fibrosis? Fibrogenesis & Tissue Repair. 7 (1), (2014).
- Hewitson, T. D. Fibrosis in the kidney: is a problem shared a problem halved? Fibrogenes & Tissue Repair. 5 (1), S14(2012).
- Wolf, M. T., et al. Polypropylene surgical mesh coated with extracellular matrix mitigates the host foreign body response. Journal of Biomedical Materials Research Part A. 102 (1), 234-246 (2014).
- Faulk, D. M., et al. ECM hydrogel coating mitigates the chronic inflammatory response to polypropylene mesh. Biomaterials. 35 (30), 8585-8595 (2014).
- Jeffords, M. E., Wu, J., Shah, M., Hong, Y., Zhang, G. Tailoring Material Properties of Cardiac Matrix Hydrogels To Induce Endothelial Differentiation of Human Mesenchymal Stem Cells. ACS Applied Materials & Interfaces. 7 (20), 11053-11061 (2015).
- Kim, M. -S., et al. Differential Expression of Extracellular Matrix and Adhesion Molecules in Fetal-Origin Amniotic Epithelial Cells of Preeclamptic Pregnancy. Public Library of Science ONE. 11 (5), e0156038(2016).
- Paduano, F., Marrelli, M., White, L. J., Shakesheff, K. M., Tatullo, M. Odontogenic Differentiation of Human Dental Pulp Stem Cells on Hydrogel Scaffolds Derived from Decellularized Bone Extracellular Matrix and Collagen Type I. Public Library of Science ONE. 11 (2), e0148225(2016).
- Viswanath, A., et al. Extracellular matrix-derived hydrogels for dental stem cell delivery. Journal of Biomedical Materials Research Part A. 105 (1), 319-328 (2017).
- Uriel, S., et al. Extraction and Assembly of Tissue-Derived Gels for Cell Culture and Tissue Engineering. Tissue Engineering Part C Methods. 15 (3), 309-321 (2009).
- Saldin, L. T., Cramer, M. C., Velankar, S. S., White, L. J., Badylak, S. F. Extracellular matrix hydrogels from decellularized tissues: Structure and function. Acta Biomaterialia. 49, 1-15 (2017).
- Faust, A., et al. Urinary bladder extracellular matrix hydrogels and matrix-bound vesicles differentially regulate central nervous system neuron viability and axon growth and branching. Journal of Biomaterials Applications. 31 (9), 1277-1295 (2017).
- Pouliot, R. A., et al. Development and characterization of a naturally derived lung extracellular matrix hydrogel. Journal of Biomedical Materials Research Part A. 104 (8), 1922-1935 (2016).
- Pati, F., et al. Printing three-dimensional tissue analogues with decellularized extracellular matrix bioink. Nature Communications. 5, 3935(2014).
- Pati, F., et al. Biomimetic 3D tissue printing for soft tissue regeneration. Biomaterials. 62, 164-175 (2015).
- Wang, R. M., Christman, K. L. Decellularized myocardial matrix hydrogels: In basic research and preclinical studies. Advanced Drug Delivery Reviews. 96, 77-82 (2016).
- Jang, J., et al. 3D printed complex tissue construct using stem cell-laden decellularized extracellular matrix bioinks for cardiac repair. Biomaterials. 112, 264-274 (2017).
- Frantz, C., Stewart, K. M., Weaver, V. M. The extracellular matrix at a glance. Journal of Cell Science. 123 (Pt 24), 4195-4200 (2010).
- Mouw, J. K., Ou, G., Weaver, V. M. Extracellular matrix assembly: a multiscale deconstruction. Nature Reviews Molecular Cell Biology. 15 (12), 771-785 (2014).
- Bonnans, C., Chou, J., Werb, Z. Remodelling the extracellular matrix in development and disease. Nature Reviews Molecular Cell Biology. 15 (12), 786-801 (2014).
- Hinderer, S., Layland, S. L., Schenke-Layland, K. ECM and ECM-like materials - Biomaterials for applications in regenerative medicine and cancer therapy. Advanced Drug Delivery Reviews. 97, 260-269 (2016).
- Uriel, S., et al. The role of adipose protein derived hydrogels in adipogenesis. Biomaterials. 29 (27), 3712-3719 (2008).
- Singelyn, J. M., et al. Naturally derived myocardial matrix as an injectable scaffold for cardiac tissue engineering. Biomaterials. 30 (29), 5409-5416 (2009).
- Medberry, C. J., et al. Hydrogels derived from central nervous system extracellular matrix. Biomaterials. 34 (4), 1033-1040 (2013).
- Loneker, A. E., Faulk, D. M., Hussey, G. S., D'Amore, A., Badylak, S. F. Solubilized liver extracellular matrix maintains primary rat hepatocyte phenotype in-vitro. Journal of Biomedical Materials Research Part A. 104 (4), 957-965 (2016).
- Hill, R. C., Calle, E. A., Dzieciatkowska, M., Niklason, L. E., Hansen, K. C. Quantification of extracellular matrix proteins from a rat lung scaffold to provide a molecular readout for tissue engineering. Molecular & Cellular Proteomics. 14 (4), 961-973 (2015).
- Li, Q., et al. Proteomic analysis of naturally-sourced biological scaffolds. Biomaterials. 75, 37-46 (2016).
- Tanaka, T., Yada, R. Y. N-terminal portion acts as an initiator of the inactivation of pepsin at neutral pH. Protein Engineering. 14 (9), 669-674 (2001).
- Ligresti, G., et al. A Novel Three-Dimensional Human Peritubular Microvascular System. Journal of the American Society of Nephrology. 27 (8), 2370-2381 (2016).
- Mozes, M. M., Böttinger, E. P., Jacot, T. A., Kopp, J. B. Renal expression of fibrotic matrix proteins and of transforming growth factor-beta (TGF-beta) isoforms in TGF-beta transgenic mice. Journal of the American Society of Nephrology. 10 (2), 271-280 (1999).
- Romanowicz, L., Galewska, Z. Extracellular matrix remodeling of the umbilical cord in pre-eclampsia as a risk factor for fetal hypertension. Journal of Pregnancy. 2011, 542695(2011).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados