Method Article
Visualizando o nó e placa Notochordal em Gastrulating embriões de rato usando microscopia eletrônica e imunofluorescência de montagem inteira
Neste Artigo
Resumo
O nó e placa notochordal são transitórios de organizadores no desenvolvimento de embriões de rato que podem ser visualizados usando várias técnicas de sinalização. Aqui, descrevemos em detalhes como realizar duas das técnicas para estudar sua estrutura e morfogênese: 1) microscopia eletrônica (SEM); e 2) monte todo imunofluorescência (WMIF).
Resumo
O embrião após a implantação do mouse sofre alterações de grande forma após o início da gastrulação e morfogênese. Uma marca registrada da morfogênese é a formação dos organizadores transitórias, o nó e placa notochordal, de células que passaram a raia primitiva. A formação adequada destes centros de sinalização é essencial para o desenvolvimento do plano do corpo e técnicas para visualizá-las são de grande interesse para os biólogos do desenvolvimento do mouse. O nó e placa notochordal deite-se na superfície ventral de embriões de rato gastrulating próximo dia embrionário (E) 7.5 de desenvolvimento. O nó é uma estrutura em forma de taça, cujas células possuem um único Delgado cílio cada. A correcta Localização subcellular e rotação dos cílios no poço nó determina assimetria esquerda-direita. As células de notochordal placa também possuem cílios simples embora mais curto do que aqueles das células nó. A placa notochordal forma a notocorda, que age como um importante organizador de sinalização para somitogenesis e padronização neural. Porque as células do nó e placa notochordal são transitoriamente presentes na superfície e possuem cílios, eles podem ser visualizados usando microscopia eletrônica de varredura (MEV). Entre outras técnicas usadas para visualizar estas estruturas a nível celular é toda montagem imunofluorescência (WMIF) usando os anticorpos contra as proteínas que são altamente expressa no nó e placa notochordal. Neste relatório, descrevemos nossos protocolos otimizados para executar SEM e WMIF do nó e placa notochordal no desenvolvimento de embriões de rato para ajudar na avaliação da organização celular em selvagem-tipo e forma de tecido e embriões mutantes gastrulação.
Introdução
Gastrulação e os movimentos de acompanhamento morfogenéticas são cruciais para moldar o embrião de rato1. As mudanças na forma celular e a organização durante a morfogênese ditam informações posicionais para regular o destino da célula e também permitir que as vias de sinalização que se seguiu precisamente realizar suas funções para diversificar o recém-formado camadas germinativas1. A formação de organizar estruturas transientes e sinalização de centros como o nó e a notocorda é essencial para a execução do programa do desenvolvimento2. Biólogos do desenvolvimento têm usado uma variedade de técnicas para estudar a morfogênese destas estruturas, mais notável dos quais é o uso de celulares repórteres e ao vivo ex vivo de imagem para acompanhar a dinâmica no comportamento celular e subcellular2 ,3,4. Neste relatório, focalizamos descrevendo os detalhes de nossos protocolos otimizados para duas dessas técnicas: varredura, microscopia eletrônica de varredura (MEV) e toda montagem imunofluorescência (WMIF), que foram e são ainda instrumental em estudar a morfogênese do nó e a placa de notochordal, o precursor da notocorda.
O nó embrionário de rato é uma taça em forma de lágrima de células que situa-se na superfície ventral do embrião em torno do início do mouse para estágios finais de dois assaltos durante a gastrulação e morfogênese (dia embrionário, E7.5-E8)2,5, 6,7. A placa notochordal morfologicamente emana anteriormente o nó3. Cada célula no nó e placa notochordal é caracterizada por um único cílio que se projeta para o exterior, que é mais longo nas células do nó mas cujo comprimento varia de acordo com o grau de desenvolvimento2. A rotação dos cílios no poço nó tem demonstrada ser importante para sinalização que determina a assimetria esquerda-direita4. A placa notochordal é o precursor da notocorda, o centro de sinalização que é importante para a padronização das somitas adjacentes e o tubo neural sobrejacente3.
Por causa dos atributos de localização (superfície), forma (Copa) e possuindo estruturas celulares externas distintas (cílios), SEM tem sido tradicionalmente usada para visualizar o nó e placa notochordal e estudar sua formação e estrutura de2, 7. SEM também é usada para estudar as mudanças na estrutura do próprio nó ou os cílios em suas células em mutações que afetam a gastrulação, morfogênese, bem como a formação de cílios8,9,10. SEM é uma técnica que utiliza um feixe focalizado de elétrons para interrogar a ultraestrutura topológica da superfície exterior de materiais tais como espécimes biológicos11. A amostra é normalmente fixa, seco e em seguida por pulverização catódica revestidos com metais para observação sob um microscópio eletrônico de varredura como descrevemos na etapa 1.
WMIF é uma técnica de coloração para visualizar produtos de genes, tais como proteínas, em três dimensões (3D). WMIF de tecidos, órgãos ou organismos nem todo fornece informação espacial sobre a distribuição do sinal e a forma da estrutura resultante em 3D. A técnica é baseada na fixação da amostra manchando-o com o cojugado fluorescente. Embriões de rato ~ E7.5 são pequenas e transparentes e, portanto, ideal para protocolos WMIF Visualizar o nó e placa notochordal. Por exemplo, o fator de transcrição Barchyury (T) é expressa no núcleo do nó e placa notochordal e em menor medida na raia primitiva, em torno do desenvolvimento embrionário e bom trabalho anticorpos contra T por WMIF da E7.5-E8 são comercialmente disponível e possibilitar o processo de coloração. As células do nó e placa notochordal também são caracterizadas por superfícies apicais constringidas, que enfrentam o exterior e, portanto, podem ser manchadas com fluorescência-conjugados faloidina marca F-Actina nas constrições apicais. Usando estes reagentes como exemplos, a combinação de T e F-Actina coloração por WMIF fornece uma representação do nó e placa notochordal em 3D em embriões de rato gastrulating como demonstramos na etapa 2 de 8. No entanto, marcadores de cílios, como ARL13B ou tubulina acetilada, bem como outros marcadores do nó e placa notochordal, como FOXA2, também podem ser usados para executar o WMIF no desenvolvimento do mouse embriões3,4.
Mostramos que a proteína striatin-interagindo 1 (STRIP1) é essencial para gastrulação normal e morfogênese do embrião de rato8. STRIP1 é um componente do núcleo do striatin-interagindo fosfatases e complexos de quinases (STRIPAK), que nós e os outros têm implicado na actina citoesqueleto organização8,12. Um defeito considerável em embriões mutantes Strip1 é a formação da mesoderme axial (nó e placa notochordal) e extensão do eixo antero-posterior corpo. Usamos SEM e WMIF para analisar o nó e notochordal placa de tipo selvagem (WT) e Strip1 mutantes embriões, como mostramos na Representante resultados e números correspondentes.
Protocolo
Todos os experimentos envolvendo experimentos com animais foram aprovados pelas autoridades responsáveis no Norte-Vestefália Rhein (LANUV-NRW).
1. microscopia eletrônica do nó embrionário de rato
- Sacrificar o rato fêmea grávido no ~ E7.5 (2-4 fase somite) por deslocamento cervical. Uma explicação detalhada com diagramas de passos 1.1 - 1.7 está disponível no embrião de rato laboratório manuais13.
- Abrir o abdômen através da pele e mesenteries e remover o útero usando uma tesoura e pinça fina.
- Lavar o útero brevemente em água destilada e colocá-lo em um pequeno prato de Petri limpo (6 cm) contendo 1 x tampão fosfato salino (PBS).
- Sob um microscópio de dissecção e usando pinça fina, remova a musculatura uterina para liberar os deciduae individuais ou locais de implantação.
- Segure cada decídua com um par de pinças e usar o outro par tornar-se uma incisão longitudinal da cheio-espessura entre a parte vermelha (futura placenta) e a parte branca (onde o embrião está localizado). Fazer perfurações superficiais verticalmente ao longo da parte branca da decidua contíguo com a incisão. Separe a decidua horizontalmente em duas metades e cuidadosamente Retire o embrião na parte branca da decídua.
- Transferi o embrião para uma nova placa de Petri (35 mm) com PBS estéril filtrada fresca. Repita para todos os deciduae/embriões.
- Remover a membrana do Reichert, uma relativamente opaca membrana que envolve o embrião, de cada embrião por provocando afastado como uma meia, começando com o cone de ectoplacental (local de implante avermelhada). Para a genotipagem, pegue um pedaço pequeno (~ 0,1 mm2) do saco vitelino nesta fase.
- Sob uma capa de química e usar proteção adequada (luvas), transferi os embriões para EM grau fixador composto por glutaraldeído 2,5% em PBS estéril filtrada em um tubo de microcentrifugadora (1,5 mL) à temperatura ambiente. Fixar os embriões durante a noite a 4 ° C.
- Cuidadosamente remova o tubo sem tocar os embriões o fixador de glutaraldeído e descarte em um recipiente de recolha apropriado. Lave os embriões três vezes em PBS estéril filtrada, durante 15 minutos à temperatura ambiente.
- Desidrata-se os embriões em uma série de etanol por 5 min cada: 50%, 70%, 85% e três vezes em 100% ou etanol absoluto. Armazenar os embriões −20 ° C em etanol ou proceder diretamente para a próxima etapa.
- Transferi os embriões em etanol para cestas para ponto crítico (CPD) de secagem na máquina do secador ponto crítico. Encha a câmara com etanol para cobrir as cestas completamente.
- Trocar o etanol irrigando cuidadosamente com líquido de CO2 por dez vezes a 10 ° C. Escorra líquido CO2 após o último passo até que a câmara está meio cheia. Aquece até 40 ° C até que a pressão atinge 80 bares (o ponto crítico) e o líquido de CO2 muda para gás. Espere por 10 min, em seguida, lentamente passar o gás aproximadamente 45 min.
- Como uma alternativa mais fácil para CPD para secar, adicione hexamethyldisilazane (HMDS) na proporção de 1:1 para os embriões em etanol por 30 min. Em seguida, transferir os embriões para HMDS puro durante 30 min. Retire os embriões sem o líquido usando uma pipeta e deixá-los secar durante 30 min.
Nota: Os dois métodos de secagem funcionaram igualmente bem em nossas mãos. - Use um pincel fino para montar os embriões secados com o lado ventral (nó) em um esboço SEM com fita dupla face.
- Inserir os stubs com os embriões em uma máquina de revestimento por pulverização catódica para revestimento de partículas de ouro, que é o preferido para cobrar os cílios longas e finos. Aplique uma camada de 120-150 Å; o tempo é dependente da corrente, que irá variar com cada amostra.
- Coloque os stubs revestidos com embriões em um microscópio SEM, aplicar vácuo e observar o nó embrionário e a placa notochordal células com cílios em ampliações que variam de 1000 X-15, 000 X.
2. toda montagem imunofluorescência do Mouse nó e placa Notochordal
- Usando o PBS gelado com 0,05% Tween 20 (PBSTw), siga os passos acima de 1,1-1,7 para remover os embriões no E7.75 e colocá-los em PBSTw em um prato de Petri no gelo de 35mm.
- Sob uma capa de química e usar proteção adequada (luvas), transferi os embriões para uma fixador solução de paraformaldeído 4% em PBS em um tubo de microcentrifugadora. Fixar os embriões durante a noite a 4 ° C.
- Cuidadosamente remova o tubo sem tocar os embriões o fixador de paraformaldeído e descarte em um recipiente de recolha apropriado. Lave os embriões três vezes com PBS contendo 0,2% Triton X-100 (PBSTr) por 5 min à temperatura ambiente. Execute todas as lavagem e próximas etapas de incubação num agitador de oscilador.
- Remover a última lavagem e adicionar solução de bloqueio contendo PBSTr com 10% de soro inativado por calor (a partir de espécies de hospedeiros do anticorpo secundário). Bloco de 2 h para durante a noite (ou mais) em um nutator a 4 ° C.
- Remover o bloqueio e adicionar ~ 1 mL do anticorpo primário diluído em solução, por exemplo, um anticorpo anti-T na diluição de 1: 500 de bloqueio. Incubar durante a noite (ou mais) em um nutator a 4 ° C.
- Remover o anticorpo primário e salvá-lo para uso posterior, adicionando a azida de sódio a uma concentração final de 0,02% (1 µ l de caldo de 20% para 1 mL de solução de anticorpo). O anticorpo pode ser reutilizado ~ 10 vezes. Lave os embriões duas vezes com PBSTr e em seguida lavá-los três vezes por 30 min em um nutator a 4 ° C.
- Substituir a lavagem com um anticorpo secundário conjugado de fluorescência, contra as espécies de hospedeiros de anticorpo primário, diluídos em ~ 1: 1000 durante a noite (ou mais) em um nutator a 4 ° C.
- Remova o anticorpo secundário e lave duas vezes com PBSTr e, em seguida, lavar três vezes por 30 min com PBSTr.
- Substitua a última lavagem com PBSTr contendo 1: 500 conjugados a fluorescência faloidina, para manchar a F-Actina e 1: 1000 DAPI, para manchar os núcleos, por 1h à temperatura ambiente.
- Lave duas vezes em PBSTr e lave uma vez com PBSTr por 30 min à temperatura ambiente.
- Substituir PBSTr com PBS e deixar os embriões no gelo. Prepare slides limpa-carregadas positivamente (24 x 60 mm) e lamelas (24 x 24 mm) e mídia de montagem aquoso baseado em glicerol, por exemplo, 90% de glicerol em 1xPBS e um reagente antidesgaste, montar os embriões.
- Coloque dois pedaços de fita desobstruída a uma distância de ~ 15 mm do outro na parte clara do slide. Isto irá criar espaço suficiente 3D (na dimensão Z) que permitiria aplainar os embriões, mas não completamente, esmagando-os.
- Sob um microscópio de dissecação, cuidadosamente mover os embriões com uma pipeta de P200 a corte (para permitir espaço suficiente para o embrião ser transferido e não danificada), para o slide.
- Usando a pinça fina, fazer dois cortes completo nos lados laterais do saco vitelino para desdobrar o embrião. Coloque o embrião com o lado ventral (nó e placa notochordal) acima (dorsal do tubo neural em baixo do slide).
- Adicione 50 µ l de mídia de montagem sobre o embrião. Coloque 4-5 embriões por slide. Adicione um pouco de mídia para o lado da lamela que primeiro tocar o slide (lado superior ou inferior), então coloque-o entre os dois pedaços de fita e abaixá-lo lentamente para os embriões usando pinça fina ou uma agulha fina dobrada, evitando criar bolhas de ar de montagem.
- Limpe a mídia excesso montagem usando uma compressa absorvente. Tenha cuidado para não mover a lamela no processo.
- Usando uma quantidade generosa de esmalte, sele os lados da lamela sem movê-lo.
- Observe sob um microscópio confocal.
Resultados
A fim de examinar a formação do nó em embriões mutantes WT e Strip1 em ~ E7.5, usamos SEM como descrito na etapa 1 e mostrado na Figura 18. Os detalhes ultraestrutural da topologia exterior usando SEM foram bastante informativos e ficou imediatamente claro que ao contrário do nó em forma de poço em embriões WT, os embriões mutantes tinham um nó achatado e irregular. Maior ampliação dos embriões mostrou os cílios característicos nas células do nó que identificaram-os de forma inequívoca. A menor densidade aparente de cílios no mutante pode ser imputável à perda da estrutura do poço de nó e curvatura ou um número menor de células do nó. A placa notochordal que aparece emanando do nó também foi irregular nos embriões mutantes. Eles eram identificáveis com seus cílios mais curtos. Por conseguinte, SEM foi importante para revelar os defeitos de morfogênese nó na Strip1 mutantes8. Também usamos SEM em estudos anteriores para comprovar a ausência de cílios no nó embrionário de mutantes que faltava centríolos, que preveem o modelo cílios9.
Para estudar os defeitos de formação do mesoderma axial em Strip1 embriões mutantes a nível celular, usamos WMIF como descrito na etapa 2 e mostrado na Figura 2. Usando esta técnica, o nó e placa notochordal eram facilmente identificadas pelo F-Actina e coloração de T. Nó WT e placa notochordal células têm constrição apicais domínios onde F-Actina foi enriquecido, e coloração nuclear de T era evidente. A placa notochordal prorrogado rostral no WT, mas foi curto e irregular no mutante. Os dados mostraram que a organização da F-Actina é anormal nas camadas germinativas diferentes dos embriões mutantes incluindo o mesoderma axial8. Assim, o WMIF foi fundamental para estudar os defeitos no nó e a formação de placa notochordal em embriões mutantes Strip1 .
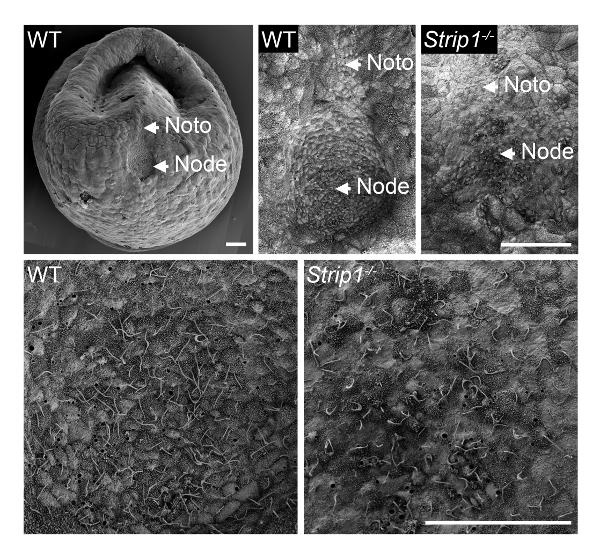
Figura 1 . Microscópio eletrônico de varredura revela os defeitos na morfogênese nó em embriões de rato mutante Strip1 . (Topo) Análises de SEM de WT e Strip1 nós embrionárias ventrais mutantes e placas notochordal (Noto)8. Um exemplo de uma imagem de baixa ampliação de um embrião WT é mostrado à esquerda. (Parte inferior) Ampliações do centro de nós mostrado no topo, revelando a longo monocilia projetando a partir das células do nó. Anterior está em todos os painéis. Barras de escala: 30 µm. clique aqui para ver uma versão maior desta figura.
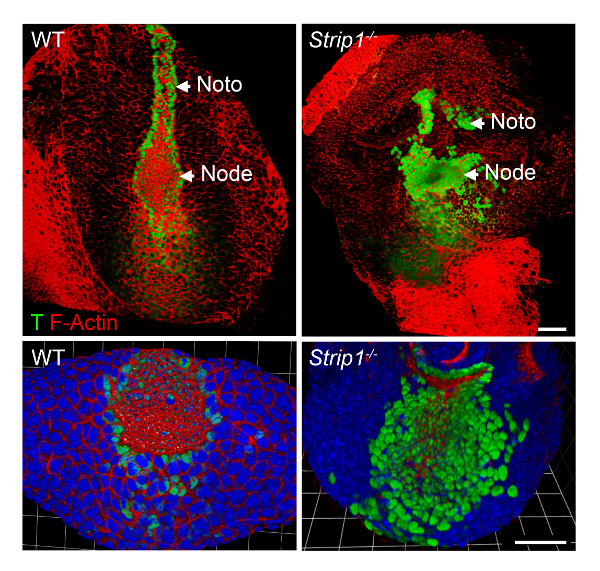
Figura 2 . Toda montagem imunofluorescência mostra o nó anormal e notochordal placa a nível celular em embriões mutantes Strip1 . (Topo) Ventral renderização 3D (software de Volocity) de WMIF em embriões mutantes WT e Strip1 , usando uma combinação de faloidina conjugada com fluorescência (F-Actina, vermelho) e T mancha do anticorpo (verde). (Parte inferior) Mais exemplos da coloração mostrado acima focando o nó com zoom maior e incluindo DAPI. Anterior está em todos os painéis. Barras de escala: 30 µm. clique aqui para ver uma versão maior desta figura.
Discussão
Neste trabalho, demonstramos como executar SEM e WMIF para visualizar o nó embrionário de rato e placa notochordal. O tamanho pequeno de embriões de rato gastrulating ~ E7.5 e a presença destas estruturas na superfície de torná-los ideal para estudar usando as técnicas descritas2,7,8. A disponibilidade de anticorpos boas, como marcadores de T e cílios, dá excelentes informações 3D usando WMIF sobre a estrutura, organização e formação destes organizadores embrionários essencial8.
Porque o desenvolvimento embrionário de rato prossegue a um ritmo muito rápido e o nó e placa notochordal são apenas transitoriamente presentes na superfície do embrião, timing é essencial para o sucesso destes experimentos2,3. Por exemplo, 2-4 embriões de somite são bons para análise SEM de um poço de nó maduro com cílios longos. Em embriões muito anteriores ou posteriores (por exemplo, 12 h antes ou depois), o nó pode não estar presente na superfície. WMIF é um pouco mais flexível neste aspecto, mas as estruturas se também são transientes durante o desenvolvimento e o sincronismo neste caso depende do interesse dos pesquisadores.
A pureza dos reagentes também é essencial para o sucesso destas técnicas, especialmente a ultraestrutura de probing Tiny SEM. impurezas que furam os embriões geralmente resulta em artefatos enormes.
Nós testamos dois diferentes métodos de fixação do embrião para SEM uma usando o fixador do meia Karnovsky (glutaraldeído 2,5%, 2% paraformaldeído e 0,1 M cacodylate buffer) e um mais simples glutaraldeído 2,5% em PBS 1x. Nós preferimos usar o glutaraldeído e fixador de PBS, conforme descrito na etapa 1, no entanto, nós e os outros também usaram fixador do Karnovsky a metade com êxito para SEM.
Temos também comparou dois métodos de secagem os embriões para SEM e não encontrado nenhuma diferença na qualidade da amostra usando um secador de ponto crítico ou HMDS, conforme descrito na etapa 1 e relatado em outro lugar14.
Para a etapa 2, testamos incorporando os embriões após as etapas de lavagem final em 1% de agarose derretimento baixo montagem sobre um prato de vidro-fundo de 35 mm e em seguida topping-lo com ~ 10 µ l de meio de montagem. Este método de encastre funciona e preserva a estrutura 3D original do embrião e estruturas associadas; no entanto, um microscópio do multiphoton é necessário para a amostra de imagem porque um microscópio confocal regular não pode chegar tão profunda em embriões intactos (~ 1mm).
Acreditamos que usando estas duas técnicas dá informações complementares sobre a estrutura de nó e a placa de notochordal durante o desenvolvimento normal e em mutantes que apresentam defeitos na formação dessas estruturas.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
M.P. é suportado pelo financiamento de inicialização da faculdade de medicina e SFB829 da Universidade de Colónia. C.X. é suportado pelo DFG conceder BA 5810/1-1. Gostaríamos de agradecer o Imaging instalações no centro de pesquisa CECAD e Memorial Sloan Kettering Cancer Center (Nova Iorque, EUA). Agradecemos sua percepção sobre os embriões de montagem para WMIF-Joaquín Grego-Bessa (espanhol centro nacional de investigação Cardiovascular, Madrid, Espanha).
Materiais
| Name | Company | Catalog Number | Comments |
| 1,1,1,3,3,3 Hexamethyldisilazane (HMDS) | Carl Roth | 3840 | |
| Anti-T antibody | R&D Systems | AF2058 | |
| Critical Point Dryer | Blazers Union | CPD 020 | |
| DAPI | AppliChem | A4099,0005 | |
| Glutardialdehyde solution 25% | Merck | 1042390250 | |
| Triton X-100 | Sigma Aldrich | X100-100ML | |
| Tween 20 | AppliChem | A4974,0500 | |
| SEM coating unit PS3 | Agar Aids for Electron Microscopy | PS3 | |
| SEM microscope Quantum FEG 250 | ThermoFisher Scientific (FEI) | Quantum FEG 250 |
Referências
- Rivera-Pérez, J. A., Hadjantonakis, A. K. The dynamics of morphogenesis in the early mouse embryo. Cold Spring Harbor Perspectives in Biology. , (2015).
- Lee, J. D., Anderson, K. V. Morphogenesis of the node and notochord: The cellular basis for the establishment and maintenance of left-right asymmetry in the mouse. Developmental Dynamics. 237 (12), 3464-3476 (2008).
- Balmer, S., Nowotschin, S., Hadjantonakis, A. K. Notochord morphogenesis in mice: Current understanding and open questions. Developmental Dynamics. 245 (5), 547-557 (2016).
- Yoshiba, S., et al. Cilia at the node of mouse embryos sense fluid flow for left-right determination via Pkd2. Science. , (2012).
- Jurand, A. Some aspects of the development of the notochord in mouse embryos. Journal of Embryology and Experimental Morpholog. 32 (1), 1-33 (1974).
- Poelmann, R. E. The head-process and the formation of the definitive endoderm in the mouse embryo. Anatomy and Embryology (Berl). , 41-49 (1981).
- Sulik, K., et al. Morphogenesis of the murine node and notochordal plate. Developmental Dynamics. 201 (3), 260-278 (1994).
- Bazzi, H., Soroka, E., Alcorn, H. L., Anderson, K. V. STRIP1, a core component of STRIPAK complexes, is essential for normal mesoderm migration in the mouse embryo. Proceedings of the National Academy of Sciences of the United States of America. 114 (51), 10928-10936 (2017).
- Bazzi, H., Anderson, K. V. Acentriolar mitosis activates a p53-dependent apoptosis pathway in the mouse embryo. Proceedings of the National Academy of Sciences of the United States of America. 111 (15), 1491-1500 (2014).
- Huangfu, D., Liu, A., Rakeman, A. S., Murcia, N. S., Niswander, L., Anderson, K. V. Hedgehog signalling in the mouse requires intraflagellar transport proteins. Nature. 426 (6962), 83-87 (2003).
- McMullan, D. Scanning electron microscopy 1928-1965. Scanning. 17 (3), 175-185 (2006).
- Bai, S. W., et al. Identification and characterization of a set of conserved and new regulators of cytoskeletal organization, cell morphology and migration. BMC Biology. 9, (2011).
- Behringer, R., Gertsenstein, M., Vintersen Nagy, K., Nagy, A. Manipulating the Mouse Embryo: A Laboratory Manual, Fourth Edition. Cold Harb Lab Press. , (2014).
- Braet, F., De Zanger, R., Wisse, E. Drying cells for SEM, AFM and TEM by hexamethyldisilazane: a study on hepatic endothelial cells. Journal of Microscopy. 186, 84-87 (1997).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados