Method Article
Automação de um protocolo de síntese Positron emission Tomography (PET) Radiotracer para produção clínica
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Positron-emissão tomografia computadorizada (PET) de imagens locais que são envolvidos em múltiplas tentativas iniciais de pesquisa clínica precisam de recursos de fabricação radiotracer robusto e versátil. Usando o radiotracer [18F] Clofarabine como um exemplo, ilustramos como automatizar a síntese de um radiotracer usando um radiosynthesizer flexível, baseada em fita e validar a síntese para uso clínico.
Resumo
O desenvolvimento de novos marcadores de tomografia computadorizada (PET) emissão de pósitrons é permitir que pesquisadores e clínicos para a imagem de um cada vez mais vasto leque de alvos biológicos e processos. No entanto, o aumento do número dos diferentes marcadores cria desafios para a sua produção em radiopharmacies. Enquanto que historicamente tem sido prática de dedicar um radiosynthesizer configurados e célula quente para a produção repetida de cada marcador individual, torna-se necessário alterar esse fluxo de trabalho. Radiosynthesizers comerciais recentes, baseados em fitas/kits descartáveis para cada tracer simplificar a produção de vários marcadores com um conjunto de equipamento, eliminando a necessidade de modificações personalizadas específicas do traçador. Além disso, alguns destes radiosynthesizers permitem ao operador desenvolver e otimizar seus próprios protocolos de síntese, além de comprar kits de comercialmente disponíveis. Neste protocolo, descrevemos o procedimento geral para como a síntese manual de um novo localizador de PET pode ser automatizada em um destes radiosynthesizers e validado para a produção de marcadores clínicos da série. Como exemplo, usamos a radiosynthesizer ELIXYS, uma ferramenta de radioquímica baseada em fita flexível que pode apoiar os esforços de desenvolvimento do traçador de PET, bem como fabricação de rotina clínica sonda no mesmo sistema, para produzir [18F] Clofarabine ([ 18 F] CFA), um marcador de PET para medida da atividade enzimática na vivo Desoxicitidina quinase (dCK). Traduzir uma manual síntese envolve quebrando o protocolo sintético em processos de radioquímica básicas que são traduzidos em química intuitiva "operações unitárias" suportadas pelo software sintetizador. Essas operações podem rapidamente ser então convertidas em um programa de síntese automatizado por montá-los usando a interface de arrastar e soltar. Após o teste básico, o procedimento de síntese e purificação pode exigir otimização para atingir o rendimento desejado e pureza. Uma vez que o desempenho desejado é alcançado, uma validação da síntese é realizada para determinar sua adequação para a produção do radiotracer para uso clínico.
Introdução
Uma crescente variedade de alvos biológicos pode ser visualizada dinamicamente em vida submete através da modalidade de imagem molecular animal de estimação. PET fornece na vivo ensaios de processos biológicos, bioquímicos e farmacológicos específicos usando radiotracers específicas (moléculas rotuladas com radionuclídeos emissores de pósitrons) que são injetadas o assunto antes da imagem1. O aumento da utilização de PET para estudar uma grande variedade destes processos em ciência básica e pesquisa clínica2,3,4e na descoberta, desenvolvimento e uso clínico de drogas no tratamento do paciente5, 6, está levando a uma crescente demanda por diversas radiotracers7,8. Para evitar a exposição à radiação para o também e para garantir uma produção reprodutível destes marcadores de curta duração, geralmente são fabricados usando um radiosynthesizer automatizado operando dentro de uma célula"quente". Radiosynthesizers recentes usam uma arquitetura descartável-gaveta/kit para simplificar a tarefa de conformidade com a fabricação de grau clínico, proporcionando também a flexibilidade para preparar vários tipos de radiotracers simplesmente por trocar fitas9 . No entanto, em estágios clínicos iniciais, existem normalmente sem fitas/kits comercialmente disponíveis para executar o radiosynthesis automatizada; Consequentemente, as instalações de produção de drogas PET lutam para personalizar sistemas para implementar recursos de produção de traçador cGMP-grau dentro de um prazo adequado e a um custo razoável. Assim, radiosynthesizers foram desenvolvidos que combinam a arquitetura de gaveta/kit com recursos para facilitar o desenvolvimento e otimização dos marcadores.
O FLEX/CHEM ELIXYS (ELIXYS) é um exemplo de uma radiosynthesizer baseada em fita flexível com uma grande reação, solvente e reagente temperatura compatibilidade10. Tem três vasos de reação e usa um mecanismo robótico para configurar dinamicamente o caminho fluido conforme exigido por qualquer protocolo de síntese particular11. O software sintetizador permite a criação de programas de síntese (sequências) para marcadores diferentes, arrastando e soltando As operações unitárias como Armadilha isótopo Isótopo eluir, Adicionar o reagente, reagir, e evaporar12. Cada operação de unidade tem uma variedade de parâmetros programáveis disponíveis ao operador, como duração, temperaturaou pressão (pressão) de condução de gás inerte. Compreendendo a natureza de cada operação de unidade, uma síntese manual pode ser facilmente traduzida em uma sequência de operações unitárias e então ser modificada durante a otimização do protocolo13. Em combinação com o módulo ELIXYS PURE/forma, o sistema integrado também pode realizar uma purificação automatizada e formulação do traçador PET. Usando este radiosynthesizer, anteriormente informamos a síntese automatizada de 24 diferentes 18F-rotulado traçadores e grupos prostético11,14,15,16, como bem como o radiofluorination enzimático automatizado de biomoléculas17, simplesmente alterando os reagentes e não a configuração do sistema. Outros têm mostrado a síntese automatizada de [18F] RO6958948 para o tratamento de imagens de tau tangles emaranhados18, a síntese automatizada do grupo prostético [18F] F-Py-TFP com uma rotulagem subsequentes de peptídeos19 e a síntese automatizada de [18F] AM580 para o tratamento de imagens de fosfodiesterase 10a (PDE10A)20. Além disso, vários grupos têm mostrado a produção dos marcadores apropriados para uso clínico, incluindo 4-[18F] Fluorobenzyl-triphenylphosphonium ([18F] FBnTP) para a imagem latente da membrana mitocondrial potencial21, [ 18 F] DCFPyL para o tratamento de imagens de membrana específico da próstata antígeno (PSMA)22e [18F] para a imagem latente de tau23da THK-5351.
Neste trabalho, utilizamos a nossa experiência com [18F] CFA para ilustrar como um procedimento de Radiosintéticos manual pode ser direta e rapidamente traduzido em uma síntese automatizada adequada para a produção de rotina seguindo diretrizes de cGMP. O tracer [18F] CFA foi projetado para a geração de imagens de atividade dCK. O manual radiosynthesis de [18F] CFA foi originalmente descrita por Shu et al . 24 como um procedimento usando dois navios de reação, purificação de cartucho intermediário de sílica e uma purificação final de HPLC passo (veja Material suplementar, secção 1 para obter detalhes). Recentes em vitro e estudos pré-clínicos têm demonstrado a especificidade excepcional deste tracer para dCK, e primeiro-em-humano estudos mostraram-se favoráveis biodistribuição25. Há um interesse imediato em estudos clínicos de maior escala para confirmar a sensibilidade do [18F] CFA PET às variações na atividade dCK e um interesse de longo prazo em potenciais aplicações clínicas deste marcador26. Pode ser útil biomarcador para terapias que desencadear a ativação de células T, induzem os danos do DNA ou contar com exemplos análogo nucleosídeo dCK-dependente. Em particular, [18F] CFA pode permitir a estratificação dos pacientes para um potencial resposta ao tratamento com Clofarabine. [18-F] CFA também pode facilitar o estudo e desenvolvimento de inibidores de dCK que estão avançando em direção a ensaios clínicos. Desde que este marcador tradicionalmente tem sido sintetizado manualmente, avançar todos estes estudos requer uma síntese confiável, automatizada de [18F] CFA adequado para uso clínico.
Embora nós relatamos anteriormente uma síntese automatizada de [18F] CFA para estudos pré-clínicos16, este protocolo baseia-se mais adiante esses esforços e descreve adicionais modificações necessárias para a produção de clínica deste marcador, incluindo a integração de purificação totalmente automatizada e formulação, protocolo de validação e testes de controle de qualidade. Os procedimentos gerais descritos aqui não estão limitados a desenvolver uma síntese automatizada e clinicamente apropriado [18F] CFA mas pode ser generalizada de uma maneira simples para desenvolver sínteses automatizados adequados para uso clínico do outro radiotracers marcados com flúor-18.
Protocolo
1. procedimento geral para a automação e a validação de um protocolo de Radiosynthesis para a fabricação de clínica
-
Analisar a elegibilidade do regime de síntese manual clínico fabricação
- Realizar análise de risco de contaminação do produto com quaisquer químicos residuais indesejadas.
- Evite classe 1 solventes tais como benzina e substituí-los por solventes alternativos adequados (classe 2 ou classe 3).
- Evite produtos químicos que seriam difíceis de detectar na formulação final como potenciais impurezas residuais.
- Escolha apenas os produtos químicos que são comercialmente disponíveis em grau de pureza elevado (a USP ou Ph.Eur. grau desejado) e são fornecidos com um certificado de análise.
- Refine o esquema de síntese se quaisquer produtos químicos indesejáveis ou solventes são detectados pela análise de risco e repita seção 1.1 até nenhum permanecem.
- Realizar análise de risco de contaminação do produto com quaisquer químicos residuais indesejadas.
-
Automatizar o protocolo de síntese
- Se um protocolo automatizado para o tracer usando o mesmo sintetizador já foi criado e carregado para um repositório on-line, Baixe uma cópia do programa de síntese.
- Se um programa automatizado síntese já não existir, crie um.
- Usando papel e caneta, divida a síntese manual em etapas de alto nível (por exemplo, secagem/ativando [18F] flúor, aquecimento para facilitar uma reação radioquímica, realizando uma etapa de purificação, etc.). Ainda mais se dividem as etapas de alto nível em discretas, processos básicos que são necessários. Como exemplo, o esquema de síntese de [18F] CFA é mostrado na Figura 1, a identificação das etapas de alto nível é mostrada na Figura 2A, e a discriminação em processos é mostrada na Figura 2B.
- Usando papel e caneta, mapear cada processo para as operações da unidade individual fornecidas pelo software sintetizador. Como exemplo, uma análise do mapeamento de processos básicos na síntese de [18F] CFA para operações de unidade apropriada no software sintetizador13 é mostrada na Figura 2.
- Usando a interface de programação de radiosynthesizer, criar um programa em branco e cada uma das operações identificadas unidade acrescentar na sequência clicando no botão de Menu (canto superior esquerdo) e seleção de sequências, e clicando o novo Sequência botão. Para cada operação de unidade identificada na etapa 1.2.2.2, arraste a operação de unidade entre as operações disponíveis para a vista de película de filme e clique ou tipo de preencher o valor desejado de cada parâmetro de funcionamento da unidade. A Figura 3 mostra um exemplo da interface quando todas as operações para sintetizar [18F] CFA tenha sido preenchido, e o usuário tiver selecionado a primeira operação de unidade reagir para editar os valores de parâmetro. O programa de síntese final para [18F] CFA é descrito no Material complementar, Tabelas S1 e S2.
- Verifique se o programa de síntese.
- Execute um teste. Configurar e executar o programa como em passos 2.1-2.3, usando todos os reagentes e solventes que não sejam o radionuclídeo (por exemplo, fluoreto [18F]) para verificar o comportamento esperado.
- Se necessário, ajuste os valores de parâmetro de operação de unidade no programa (por exemplo, o tempo ou condução de pressão para transferir completamente um reagente, o tempo/temperatura para evaporar o solvente para o nível desejado, etc.) e teste novamente. Para ajustar os valores de parâmetro, primeiro, retornar para o modo de Editar , escolhendo sequências do menu principal (canto superior esquerdo) e selecione o programa recém-criado. Em seguida, clique sobre o funcionamento da unidade desejada na exibição de película fotográfica (parte inferior da tela), navegue para o parâmetro desejado e selecione ou digite o novo valor.
- Execute um teste de baixa atividade (< 370 MBq) para avaliar o programa.
- Otimize a síntese automatizada, ajustando os valores de parâmetro para melhorar o rendimento, tempo de síntese, repetibilidade e qualquer outro desejado resultado mensurável.
-
Desenvolver procedimentos de teste de controle de qualidade (QC)
- Usando uma referência não-radioativo do produto final e amostras de impurezas químicas potenciais, desenvolver uma rádio-HPLC analítica e/ou rádio-fino método de cromatografia (rádio-TLC) camada com suficiente separação de espécies para a determinação da química, atividade molar, pureza radioquímica, identidade e pureza radioquímica. Validar o método ou métodos analítico para repetibilidade e linearidade e determinar os limites de deteção e quantificação.
- Da mesma forma, desenvolver e validar um método de cromatografia gasosa para analisar as impurezas voláteis (por exemplo, valores residuais de solventes que são usados durante a síntese).
- Desenvolver e validar ensaios analíticos que permitem a detecção e quantificação de outras impurezas potenciais (por exemplo, criptante 222 através o teste de mancha de cor padrão).
- Use os procedimentos padrão para a determinação da esterilidade, pH, radionucleica identidade, pureza radionucleica, concentração de radioatividade, volume do produto e níveis de endotoxinas.
-
Executar a validação de síntese
- Estabelecer procedimentos habituais de funcionamento (PHF) para a síntese e QC, procedimentos de teste e integrar um materiais e sistema de rastreamento de equipamentos em conformidade com a atual boa fabricação requisitos prática (cGMP).
- Valide os procedimentos de síntese através de três produção independente e consecutiva é executado nos mesmos níveis de radioactividade como destinados à fabricação clínica seguindo os PHF. Documente o desempenho de síntese e resultados dos testes de QC.
- Todas as execuções de validação consecutivos devem passar dos limites previamente definidos de QC. Se uma validação falhar, repita o processo de validação toda abordar adequadamente a causa raiz da falha.
2. exemplo: Automated síntese do CFA [18F] para uso clínico
- Preparar o radiosynthesizer
- Poder sobre o radiosynthesizer.
- Garantir o fornecimento de gás inerte é ativado com uma pressão suficiente e que as válvulas necessárias estão abertas para que o radiosynthesizer está ligado ao fornecimento de gás.
- Instalar novas fitas descartáveis no reator #1 e #2 posições e inserir os vasos de reação contendo barras de agitação magnética. Certifique-se de que cada tubo de mergulho de transferência de gaveta é apontado direto para baixo.
- Preparar frascos de reagente e instalá-los nas fitas de acordo com o diagrama na Figura 4.
- Instalar um vazio [18O] frasco de recuperação H2O na posição W1 da gaveta #1.
- Ativar um cartucho de methylammonium quaternários (QMA), primeiro passando 12 mL de solução 1 M KHCO3 , seguido por 12 mL de água desionizada. Condição de um cartucho de sílica Sep-Pak, passando de 5 mL de acetato de etila através dele.
- Conectar os cartuchos e fazer todas as conexões de tubulação de gaveta, como indicado na Figura 5A. Verificar que nenhum tubo de gaveta (incluindo tubulação não utilizada) trava no interior, onde pode interferir com os movimentos robóticos.
- Conecte a linha de fonte de flúor [18F] partir o ciclotron para a linha de entrada de flúor [18F] na gaveta #1.
- Certifique-se que o recipiente de resíduos está vazio. Lugar linhas resíduos do subsistema de purificação/formulação para o recipiente de resíduos (ou seja, linha de circuito 1 amostra de resíduos, HPLC subsistema resíduos linha e a linha de resíduos de bomba de seringa).
- Conecte as linhas de entrada de HPLC. Fase móvel para HPLC lugar de entrada de linha "A" em um recipiente de acetato de amônio 25 mM e HPLC fase móvel entrada linha "B" em um recipiente de EtOH.
- Equilibrar o subsistema de purificação/formulação e coluna HPLC.
- Abra a página de controle para o módulo de purificação/formulação no software selecionando HPLC do menu principal (canto superior esquerdo). Por padrão, a guia de purificação já ser selecionada. (Esta página é mostrada na Figura 6).
- Definir a taxa de fluxo de 5,0 mL/min para a composição de solvente definida e escolher qual posição de coluna da coluna de purificação está instalada no. Ligue a bomba HPLC no modo isocrática pelo menos 10 min.
- Enxague a linha de produtos e todas as linhas de coleção de fração com a fase móvel, cada uma por 1 min.
- Lave cada loop de amostra HPLC e transferência de laço de amostra HPLC tubo com 10 mL da fase móvel, utilizando uma seringa.
- Conecte as linhas entrada bomba de seringa purificação/formulação subsistema. Utilização concentrada de cloreto de sódio (90 mg/mL) para a linha Elute e solução salina 0,9% para a linha de reconstituir .
- Prime o subsistema de formulação.
- Navegue até a guia de formulação da página de controle da purificação/formulação.
- Para prime o cloreto de sódio concentrado (90 mg/mL), selecione a guia Elute imprensa inicializar inicializar a bomba de seringa. Dispense 5ml.
- Para prime o soro fisiológico a 0,9%, selecione a reconstituir Tab dispensar 5 mL.
- Conecte as linhas de produto e o produto Final da parte frontal do subsistema de purificação/formulação em um T-conexão. Conecte a saída da T-conexão a um filtro estéril (0,22 µm), que, por sua vez, é conectado ao frasco estéril de produto final. Inserir uma agulha de ventilação com um filtro estéril o headspace do frasco do produto final. Uma fotografia de confi guração do sistema final é mostrada na Figura 5B.
- Adicione gelo seco e EtOH ou MeOH à armadilha fria.
- Execute o programa de síntese
- Navegue até a lista de programas, selecionando o botão de menu principal (canto superior esquerdo) sequências . Selecione o programa CFA [18F] e iniciar o programa, premindo o botão executar .
- Cuidadosamente atravessar cada item na lista de verificação pré-execução e verificá-los como eles são concluídos. Parte da tela a lista de verificação pré-execução é mostrado na Figura 7.
- Clique em continuar para confirmar que a configuração está concluída e causar a síntese automatizada começar.
- Se desejado, monitorar a síntese em tempo real via feedback visual (câmeras de reactor), leituras do sensor (por exemplo, temperatura, pressão, vácuo, radiação, etc.) e cronômetros de contagem regressiva. Uma imagem representativa é mostrada na Figura 8.
- Durante a operação de unidade de purificação , selecione o produto quando o pico de produto tem começado a aparecer no cromatograma do detector de radiação. Uma imagem representativa durante esta operação de unidade (contendo um cromatograma de UV e o detector de radiação de saída) é mostrado na Figura 9.
- Uma vez que o pico de cromatograma do detector de radiação voltou-se para a linha de base, selecione a desperdiçar a desviar do caminho do fluxo do subsistema HPLC para o recipiente de resíduos.
- Configurar e executar o programa de formulação
- Na lista de programas (sequência de tela), abra o [18F] CFA formulação programa.
- Ajuste os parâmetros da operação de unidade de formulação.
- Calcule o volume da fração produto coletado (Vfração) com base na taxa de fluxo da bomba de HPLC e a duração da coleção de fração.
- Calcule o volume de cloreto de sódio adicional (90 mg/mL) necessário para alcançar isotonicity e calcular a quantidade de solução salina adicional necessária para diluir a concentração de EtOH abaixo de 10%.
- Modifica o programa com esses valores. O volume de cloreto de sódio (90 mg/mL) é inserido para a etapa de Elute e o volume de solução salina é inserido para a etapa de reconstituir . (Os cálculos são descritos no Material complementar, Figura S2).
- Salve o programa.
- Execute o programa. O sistema irá diluir a fração de produto purificado coletados com cloreto de sódio e soro fisiológico para garantir a isotonicity da formulação e entregá-lo através de um filtro esterilizante dentro do frasco do produto estéril.
- Coletar formulado [18F] CFA para controle de qualidade e expedição
- Remova o produto CFA formulado [18F] a célula quente.
- Usando técnicas de trabalho estéreis, retire duas amostras (300 µ l) para realizar testes de controle de qualidade.
- Use a primeira amostra para testar a esterilidade da formulação final, inocular mídia fluido de tioglicolato e caldo tryptic soy para 14 d sem observar qualquer crescimento.
- Use a segunda amostra para realizar o controle de qualidade de acordo com os procedimentos desenvolvidos na etapa 1.3. Os procedimentos estabelecidos na UCLA Ahmanson biomédica ciclotron instalação em conformidade com a Farmacopeia dos EUA são descritos abaixo.
- Avalie a aparência por inspeção visual.
- Avalie o pH com um papel indicador.
- Avalie o conteúdo de endotoxinas bacterianas usando um cinético cromogênico bacteriana endotoxina teste (aposta).
- Avalie radioquímica identidade com rádio-HPLC analítica verificando a eluição co da amostra radioativa e uma composto de referência não-radioativo.
- Avalie a pureza radioquímica com rádio-HPLC analítica, comparando a área sob a curva (AUC) de impurezas radioativas no cromatograma gama-detector com o AUC correspondente ao produto desejado.
- Avalie a pureza química com HPLC analítica determinando a AUC no cromatograma UV-detector de todas as impurezas de UV-ativo.
- Avalie a atividade molar e a massa de transportadora com rádio-HPLC analítica determinando o AUC correspondente ao produto desejado no cromatograma detector de UV.
- Avalie o Half-Life da sonda medindo sua atividade em dois momentos diferentes e montagem de uma curva de decaimento.
- Avalie o conteúdo de solvente residual da formulação por cromatografia em fase gasosa.
- Avalie a energia do radionuclídeo usando um espectrômetro gama.
- Avalie o conteúdo de criptante 222 usando um teste local baseado no TLC.
- Se todos os testes passarem, liberar a formulação de sonda para envio ao site da clínico de imagem.
- Pós execução e sistema de desligamento
- Lave a coluna de purificação de HPLC e toda tubulação usada para coleta de produto com 70% (v/v) EtOH na água. Isso deve ser feito com a página de pura/FORM controle, semelhante ao passo 2.1.12.
- Desliga o radiosynthesizer através do botão liga/desliga no software. Uma janela pop-up irá indicar quando a energia para o sistema pode ser desligada.
- Desligue o fornecimento de ar comprimido e gás inerte, fechando as válvulas de corte apropriado.
- Prazo para radioatividade residual na célula quente a decadência (normalmente durante a noite).
- Limpar o radiosynthesizer
- Remova e elimine todas as fitas, cartuchos, frascos de reator e frascos de reagente utilizados durante a síntese.
- Esvazie o conteúdo da armadilha fria.
- Limpe os caminhos de fluido de subsistema de purificação.
- Abra um programa de limpeza existente ou criar um novo programa que contém uma única operação de unidade de purificação no modo de limpeza (ou seja, com a caixa de seleção limpar seleccionada). Consulte o Material complementar, Figura S9 para obter um exemplo.
- Na página configuração de parâmetro, selecione a coluna que foi utilizada para a purificação e a linha de entrada de fase móvel de HPLC que está conectada a um frasco contendo 70% EtOH na água. Programar um caudal de 2 mL/min, a duração de lavagem para cada loop de injeção de 5 min e uma duração de lavagem para cada saída de produto e fração de 30 s. Selecione Linhas seco e programar uma duração de 30 s.
- Coloque todas as saídas de linha da fração em um grande recipiente de resíduos.
- Execute o programa.
- Após a conclusão, esvazie o recipiente de resíduos.
- Limpe os caminhos de fluido de subsistema de formulação.
- Abrir um programa existente ou criar um novo programa que contém uma única operação de unidade de formulação no modo de limpeza (ou seja, com a caixa de seleção limpar selecionada na guia Clean ). Consulte o Material complementar, Figura S10 , por exemplo.
- Encha um reservatório de diluição limpo (na frente do subsistema de purificação/formulação) com 100 mL de EtOH.
- Coloque o subsistema de purificação/formulação Elute linha de entrada em um reservatório de EtOH (contendo > 50ml de EtOH).
- Coloca as linhas de entrada enxaguar e reconstituir em um recipiente de resíduos juntamente com a linha de saída do produto final.
- Execute o programa.
- Após a conclusão, esvazie o recipiente de resíduos.
Resultados
Um método para automatizar a produção de [18F] CFA foi desenvolvida e três lotes de validação foram sintetizados. Síntese, purificação e formulação de [18F] CFA foi conseguida em 90 ± 5 min (n = 3) e o rendimento de radioquímica decaimento não-corrigida 8,0 ± 1,4% (n = 3). Os rendimentos da actividade das três pistas foram 3.24 GBq, 2.83 GBq e GBq 3.12, a partir de 34,3 GBq, 41,8 GBq e 41,1 GBq, respectivamente. As formulações de CFA obtidos [18F] passaram todos os testes de controle de qualidade (tabela 1). O protocolo automatizado atualmente está sendo usado para a produção de grau clínico [18F] CFA para suportar os ensaios clínicos.
| Dados de controle de qualidade | Validação executar 1 | Validação executar 2 | Validação executar 3 |
| [exigência para "Passar"] | |||
| Aparência | Passar | Passar | Passar |
| [desobstruído, incolor, livre de partículas] | |||
| Concentração de radioatividade em EOS | 213 MBq/mL | 210 MBq/mL | MBq/mL 180 |
| [≤ 740 MBq/mL @ EOS] | |||
| pH | 6 | 5.8 | 6 |
| [5.0-8.0] | |||
| Half-Life | 115 min | 108 min | 112 min |
| [105-115 min] | |||
| Pureza radioquímica | 99% | 99% | 99% |
| [> 95%] | |||
| Radioquímica identidade pelo tempo de retenção relativo (RRT) | 1.01 | 1.01 | 1.01 |
| [1,00 < RRT < 1.10] | |||
| Atividade molar | 314 GBq/µmol | > 370 GBq/µmol | > 370 GBq/µmol |
| [≥ 3,7 GBq/µmol] | |||
| Massa total transportadora no produto final | 3.1 µ g | < 1 µ g | < 1 µ g |
| [≤ 50 µ g/dose] | |||
| Massa total de impureza no produto final | ND | ND | ND |
| [≤ 1 µ g / dose] | |||
| Volume máximo admissível de injeção com base no total transportadora massa ≤ 50 µ g/dose e impureza total massa ≤ 1 µ g/dose | Lote inteiro | Lote inteiro | Lote inteiro |
| Conteúdo residual de EtOH por GC | 8,90% | 9,50% | 9,60% |
| [≤ 10%] | |||
| Conteúdo residual de AcOEt por GC | < 1 ppm | < 1 ppm | < 1 ppm |
| [≤ 5000 ppm] | |||
| Conteúdo residual de MeCN por GC | < 1 ppm | < 1 ppm | < 1 ppm |
| [≤ 410 ppm] | |||
| K222 residual por teste de cores spot | Passar | Passar | Passar |
| [< 50 µ g/mL] | |||
| Teste de integridade de membrana de filtro | Passar | Passar | Passar |
| [bolha ponto 50PSI ≥] | |||
| Endotoxinas bacterianas | Passar | Passar | Passar |
| [≤ 175 EU/lote] | |||
| Radionucleica pureza por espectroscopia gama | Passar | Passar | Passar |
| [> 99,5%] | |||
| Esterilidade | Passar | Passar | Passar |
| [requisitos USP < 71 >] |
Tabela 1: Resumo para três lotes de validação de dados de teste de controle de qualidade (QC). EOB = fim do bombardeio; EOS = final da síntese; ND = não detectado.
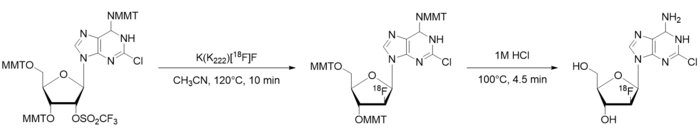
Figura 1: esquema de radiosynthesis [18F] CFA. MMT = Monomethoxytrityl. Clique aqui para ver uma versão maior desta figura.
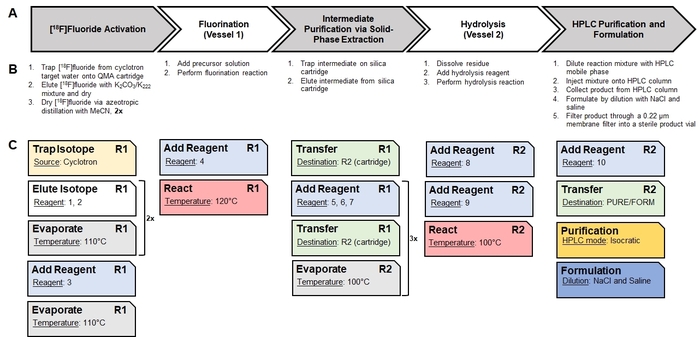
Figura 2: tradução de uma síntese manual em uma sequência automatizada de operações unitárias. (A), este painel fornece uma visão geral das etapas de alto nível na síntese manual de [18F] CFA. (B), este painel mostra os procedimentos básicos necessários para realizar cada uma das etapas de alto nível. (C) operações de unidade específicas do Radiosynthesizer usadas para executar os procedimentos básicos são mostradas como cartões. Cada operação de unidade tem seu próprio conjunto de valores de parâmetro (mostrado como sublinhado) que são configuradas através do software. A notação "R1" e "R2" indicam os vasos de reação #1 e #2, respectivamente. Os reagentes correspondentes aos números de reagente são identificados na Figura 4. A série de operações unitárias é salvo como uma sequência e executada pelo software para realizar a síntese automatizada. Clique aqui para ver uma versão maior desta figura.
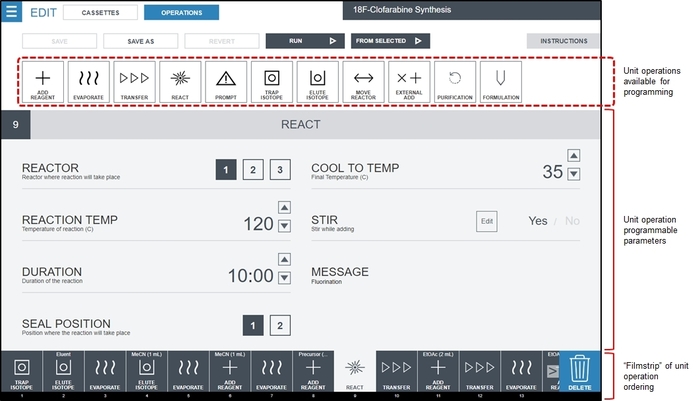
Figura 3: Screenshot da interface do software de radiosynthesizer (ELIXYS) para criar um programa de síntese. Operações unitárias são colocadas na ordem desejada em película de filme usando uma interface de arrastar e soltar. Neste screenshot, uma operação de unidade de reagir é selecionado, e seus valores de parâmetro editáveis são mostrados na parte principal da tela. Neste exemplo, a reação de fluoração realizarão no recipiente de reação #1 (selado) a 120 ° C por 10 min com agitação ativa. A embarcação será refrigerada a 35 ° C após decorrido o tempo de reação. Detalhes dos valores de parâmetro que podem ser programados para outras operações unitárias são mostradas no Material complementar, seção 3. Clique aqui para ver uma versão maior desta figura.
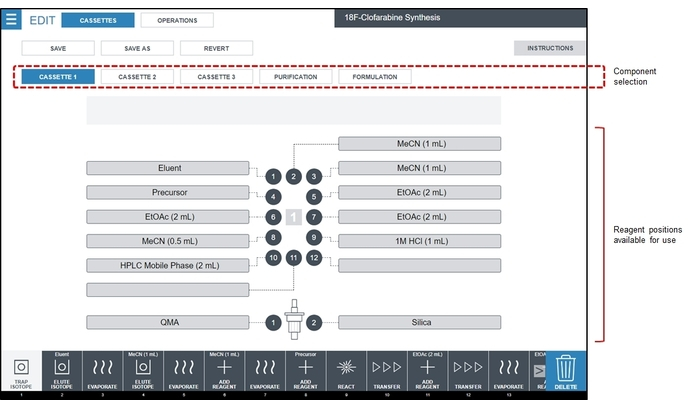
Figura 4: Screenshot da tela de configuração do reagente. Para a sequência de síntese [18F] CFA, todos os reagentes são carregados na gaveta descartável #1, que é mostrada em destaque na área de seleção do componente. Para a síntese CFA [18F] descrita aqui, eluente é de 1,0 mg de K2CO3 + 5,0 mg de K222 em 0,4 mL de H2O/0.5 mL de MeCN, Precursor é de 6 mg de precursor CFA em 0,6 mL de MeCN e Fase móvel de HPLC é v 85:15 álcool etílico: acetato de amónio /v 25 mM. Clique aqui para ver uma versão maior desta figura.
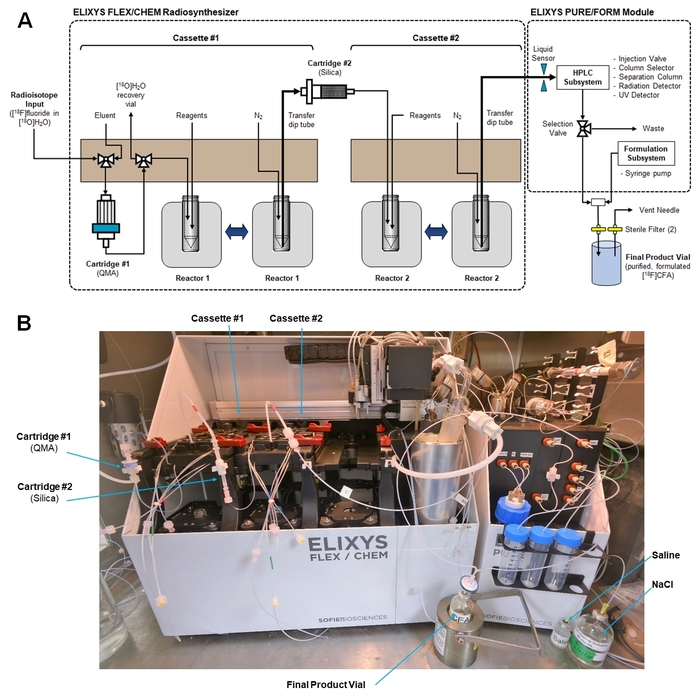
Figura 5: Configuração de Radiosynthesizer para a síntese de [18F] CFA. (A) isto é um esquema mostrando caminhos fluido de gaveta, conexões para cartuchos e a conexão para transferir produto bruto final do módulo de radiosynthesis para o módulo de purificação/formulação. (Ambos os módulos são controlados com uma única interface de computador e software). (B) esta é uma fotografia do radiosynthesizer dentro de uma célula quente após o preparo para a síntese CFA [18F]. Clique aqui para ver uma versão maior desta figura.
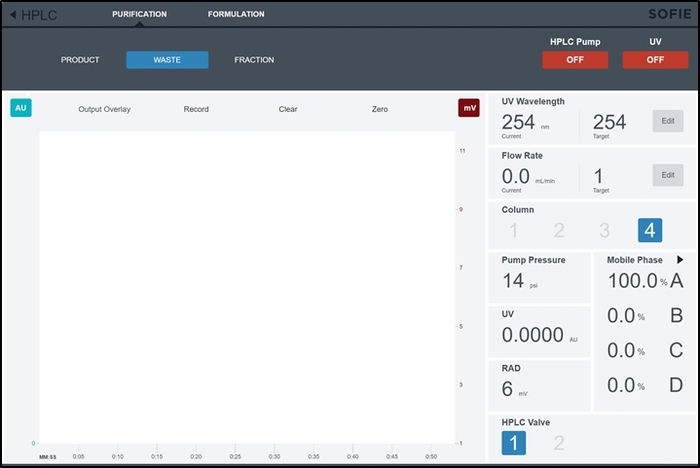
Figura 6: Screenshot da interface de controle do módulo de purificação/formulação. Esta tela é acessada pelo operador controlar manualmente os subsistemas HPLC e formulação durante a configuração de síntese. Clique aqui para ver uma versão maior desta figura.
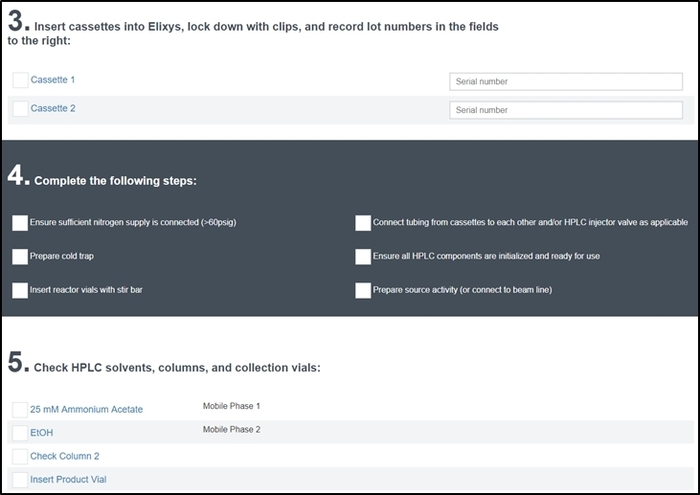
Figura 7: tela de lista de verificação pré-execução. O operador insere o número de série das fitas instalado no sistema e deve marcar cada item para garantir que o sistema foi corretamente configurado e preparado para a síntese. Além destas seções, o operador é também será solicitado um nome e uma descrição da síntese executam (seção 1) e muitos números para todos os reagentes utilizados (seção 2) e é convidado a verificar todos os feeds de vídeo do reator estão funcionando corretamente (secção 6). Clique aqui para ver uma versão maior desta figura.
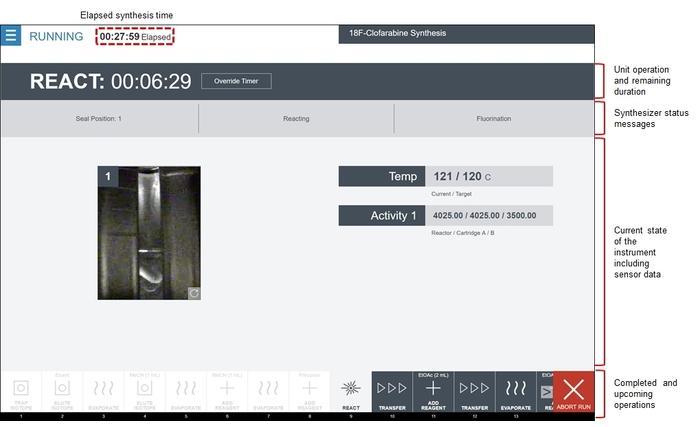
Figura 8: Screenshot do software enquanto executa a sequência de síntese do CFA [18F] radiosynthesizer. O software exibe a ordem de operações unitárias na área de película fotográfica. Operações concluídas estão a cinzento e destacadas em branco, a operação atual é destaque em cinza e operações futuras são mostradas em cinza escuro. Na área central da tela mostra o status da operação unidade ativa, incluindo qual subcomando está sendo executado, bem como o status atual do sistema (feeds de vídeo do reator e dados do sensor). Este particular reagir operação de unidade é a reação de fluoretação. Na área de temperatura , a temperatura atual do reator é mostrada ao lado a temperatura-alvo (programado). Abaixo, a área de atividade exibe os valores de sensor de radiação dos três sensores associados com a etapa de reação. Finalmente, a imagem da esquerda mostra uma exibição ao vivo do frasco reator. Clique aqui para ver uma versão maior desta figura.
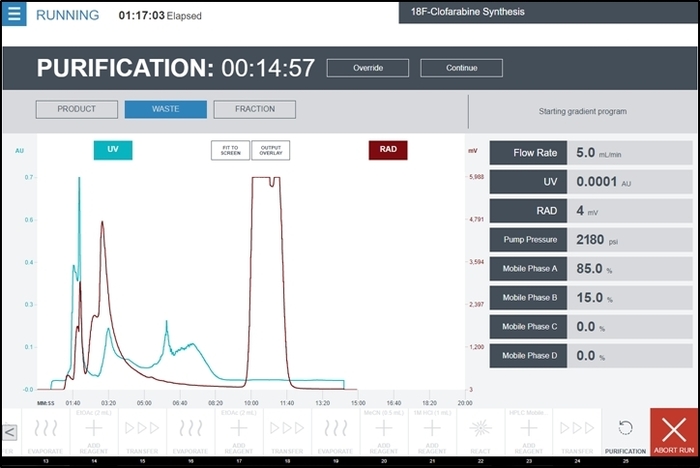
Figura 9: Captura de tela da interface de usuário enquanto estiver executando a operação de unidade de purificação durante a síntese de [18F] radiosynthesizer CFA. Detector de UV a e detector de radiação saídas do módulo de purificação/formulação são exibidas no gráfico central em tempo real. Comentários adicionais da bomba HPLC e detectores são mostradas no lado direito da tela. O operador recolhe o pico de produto temporariamente selecionando o produto quando o pico começa a aparecer e depois mudar para resíduos após o pico completo tem sido visto. Clique aqui para ver uma versão maior desta figura.
Discussão
Esse protocolo define as etapas básicas que devem ser tomadas quando automatizando um protocolo de síntese manual para atingir a produção de formulação de marcador clínico da classe. O ciclo de desenvolvimento inteiro, incluindo o desenvolvimento de controle de qualidade, é exemplificado o radiotracer [18F] CFA (para a imagem da atividade dCK). Foi dada especial atenção para modificar a síntese automatizada para assegurar a adequação do traçador para uso clínico. A síntese implica processos básicos como a ativação de flúor [18F], radiofluorination da molécula precursora, purificação de cartucho intermediário, remoção de grupo protegendo e semipreparativa purificação de HPLC e formulação para a injeção. Esses processos básicos compõem um repertório padrão que é suficiente para a síntese da vasta maioria dos marcadores de 18F-rotulado de PET.
Ao projetar a síntese, a escolha dos reagentes e sua garantia de qualidade é de particular importância para uso clínico. Assegurar a correta programação e conexões adequadas, realizando uma síntese simulada (somente solventes) é imperativo para eliminar erros inesperados quando a síntese é realizada com radioactividade. As otimizações de síntese subsequente (solventes, volumes, montantes, temperaturas, tempos de reação e condições de purificação) dependem do tracer PET específico em desenvolvimento. Durante estas experiências, especial destaque deve ser brilhou na pureza radioquímica e química do produto final que pode ser alcançado, como estes devem atender a requisitos rigorosos para uso clínico. Uma síntese que confiantemente produz um produto puro do rendimento mais baixo mas suficiente atividade é geralmente preferida por um processo de maior rendimento que tem um risco de falha esporadicamente. Uma vez que a síntese foi adequadamente otimizada, o processo final precisa se submeter a testes de validação (um requisito regulador) para garantir a adequação clínica. O método de síntese validado então pode ser usado para produzir o palpador de PET para uso clínico. Ao sintetizar um traçador de PET de acordo com um método validado, procedimentos operacionais normalizados devem ser cuidadosamente seguidos. Para garantir a conformidade, o software é programado para ter o operador a confirmar a conclusão de etapas-chave através de uma lista de verificação pré-execução após clicar em executar para iniciar a síntese. Enquanto o sistema irá realizar a síntese em uma forma automatizada, a etapa de purificação requer intervenção manual. O operador deve, portanto, observar de perto a tela cromatográfica durante a etapa de purificação de HPLC e introduzir manualmente em tempo real quando para iniciar e parar de coletar a fração do produto.
Dentro de nossos esforços de automação e otimização para a síntese CFA [18F], Ajustámos o método de purificação de HPLC semipreparativa da mistura de produto usando um sistema solvente injetável consistindo de solução de acetato de amónio e EtOH ; nosso método anterior necessária uma etapa adicional para trocar o solvente após purificação16. A formulação posterior processo, assim, só precisa reduzir o teor de EtOH da fração coletado níveis tolerados e assegurar a sua isotonicity, ambos os quais podem ser realizados por diluição. A etapa de formulação foi realizada usando um segundo programa consiste em uma única operação de unidade de formulação para permitir adições de volume variável de NaCl-soluções para o produto purificado fração através do módulo de formulação contabilizar a variável volume obtido após a purificação de HPLC. Se o volume da fração produto coletado foi definido para ser constante em vez disso, a operação de unidade de formulação poderia ser incluída no programa de síntese principal, evitando a necessidade de um programa independente. Uma abordagem alternativa para evitar a intervenção manual seria usar a funcionalidade completa do módulo de formulação (por exemplo, diluir o palpador purificado com água, armadilha em um cartucho de extração de fase sólida C18, lavá-lo, elui-lo com um volume fixo de EtOH e finalmente, dilui-lo com um volume fixo de solução salina).
A técnica aqui apresentada para automatizar e validação de um protocolo de síntese para uso clínico, destina-se a ser bastante geral. Através da escolha de radiosynthesizer (ELIXYS), uma ampla gama de sínteses pode ser automatizada e validada. Isso inclui o complexos 3-pote sínteses, ou sínteses que envolvem altas temperaturas de solventes voláteis. Otimizando a síntese pode ser alcançado ao alterar os parâmetros do programa de software. O sintetizador tem recursos para monitorar o impacto das mudanças, tais como os vasos de reação para a remoção de amostras para análise de radio-TLC ou rádio-HPLC de posicionamento. No entanto, sem modificações no sistema, o sistema atualmente não permite a manipulação de volumes de reagente muito baixa (~ 5-20 µ l), destilação do produto intermédio ou a manipulação de [18F] AlF, 68Ga, ou outros radiometals. Se a síntese manual para ser automatizado contém tais etapas e eles não podem ser contornados, automação e validação com outra plataforma de radiosynthesizer podem ser apropriados.
Embora este trabalho centrou-se no desenvolvimento de um protocolo para a produção automatizada de [18F] CFA para uso clínico, a síntese de muitos outros traçadores de PET pode ser automatizado de modo adequado para a produção de clínica, seguindo a mesma lógica e métodos. Seguindo o método apresentado aqui, também adaptámos a síntese automática de 9-(4-[18F] fluoro - 3-[hidroximetil] butil) guanina ([18F] FHBG) e é validado para uso clínico. Protocolos estabelecido pelo usuário podem ser carregados em e baixado a SOFIE rede sonda, um portal web para programas de síntese de compartilhamento e associados documentação entre diferentes radiopharmacy sites27. Isso pode evitar uma duplicação de esforços na Comunidade e facilitar multi-centro estudos clínicos envolvendo a imagem do PET.
Divulgações
Os regentes da Universidade da Califórnia têm licenciou a tecnologia para SOFIE que foi inventado por Jeffrey Collins, R. Michael van Dam e tomaram a capital em SOFIE como parte da transação licenciamento. Além disso, R. Michael van Dam é fundador e consultor da SOFIE. Os termos desse acordo foram revistos e aprovados pela Universidade da Califórnia, Los Angeles, em conformidade com suas políticas de conflito de interesses. Eric Schopf e Christopher Drake são empregados e acionistas da SOFIE.
Agradecimentos
Este trabalho foi apoiado em parte pelo Instituto Nacional de câncer (R44 CA216539) e a Fundação de UCLA de uma doação feita por Ralph e Marjorie Crump para o UCLA Crump Instituto de imagem Molecular.
Materiais
| Name | Company | Catalog Number | Comments |
| ELIXYS FLEX/CHEM | Sofie (Culver City, CA, USA) | 1010001 | Radiosynthesizer |
| Radiosynthesizer cassette | Sofie (Culver City, CA, USA) | 1861030400 | Cassette for ELIXYS FLEX/CHEM |
| ELIXYS PURE/FORM | Sofie (Culver City, CA, USA) | 1510001 | Radiosynthesizer purification module |
| [O-18]H2O | IBA RadioPharma Solutions (Reston, VA, USA) | IBA.SP.065 | >90% isotopic purity |
| [F-18]fluoride in [O-18]H2O | UCLA | N/A | Produced in a cyclotron (RDS-112; Siemens; Knoxville, TN, USA) by the (p,n) reaction of [O-18]H2O. Bombardment at 11 MeV using a 1 mL tantalum target with havar foil. |
| Deionized water | UCLA | N/A | Purified to 18 MΩ and passed through 0.1 µm filter |
| Acetonitrile (MeCN) | Sigma-Aldrich (St. Louis, MO, USA) | 271004 | Anhydrous, 99.8% |
| Ethanol (EtOH) | Decon Laboratories, Inc. (King of Prussia, PA, USA) | 2701 | Anhydrous, 200 proof |
| Sodium hydroxide (NaOH) solution | Merck (Burlington, MA, USA) | 1.09137.1000 | 1M solution |
| Hydrochloric acid (HCl) solution | Fisher Chemical (Hampton, NH, USA) | SA48-500 | 1M solution |
| Ethyl acetate (EtAc) | Fisher Chemical (Hampton, NH, USA) | E195SK-4 | HPLC grade |
| Sodium chloride (NaCl) | Fisher Chemical (Hampton, NH, USA) | S-640-500 | USP grade |
| Ammonium acetate | Fisher Chemical (Hampton, NH, USA) | A639-500 | HPLC grade |
| Potassium carbonate (K2CO3) | Fisher Chemical (Hampton, NH, USA) | P-208-500 | Certified ACS |
| CFA precursor | CalChem Synthesis (San Diego, CA, USA) | N/A | Custom synthesis |
| Cryptand 222 (K222; Kryptofix 2.2.2) | ABX Advanced Biochemical Compounds (Radeberg, Germany) | 800.1000 | >99% |
| Sodium chloride (NaCl) solution (saline) | Hospira (Lake Forest, IL, USA) | 0409-4888-02 | 0.9%, for injection, USP grade |
| Silica cartridge | Waters (Milford, MA, USA) | WAT051900 | Sep-pak Classic |
| Quaternary methylammonium (QMA) cartridge | Waters (Milford, MA, USA) | WAT023525 | Sep-pak Light Plus |
| Sterile syringe filter (0.22 µm) | Millipore Sigma (Burlington, MA, USA) | SLGSV255F | Millex-GV |
| Glass V-vial (5 mL) | Wheaton (Millville, NJ) | W986259NG | Used for reaction vessels |
| Septa | Wheaton (Millville, NJ) | 224100-072 | Used for reagent vials |
| Crimp cap | Wheaton (Millville, NJ) | 224177-01 | Used for reagent vials |
| Amber serum vial (2 mL) | Voigt (Lawrence, KS, USA) | 62413P-2 | Used for reagent vials |
| Magnetic stir bar | Fisher Scientific (Hampton, NH, USA) | 14-513-65 | Used for reaction vessels |
Referências
- Phelps, M. E. Positron emission tomography provides molecular imaging of biological processes. Proceedings of the National Academy of Sciences. 97 (16), 9226-9233 (2000).
- Kitson, S., Cuccurullo, V., Ciarmiello, A., Salvo, D., Mansi, L. Clinical Applications of Positron Emission Tomography (PET) Imaging in Medicine: Oncology, Brain Diseases and Cardiology. Current Radiopharmaceuticalse. 2 (4), 224-253 (2009).
- Sengupta, D., Pratx, G. Imaging metabolic heterogeneity in cancer. Molecular Cancer. 15, 4 (2016).
- Rabinovich, B. A., Radu, C. G. Imaging Adoptive Cell Transfer Based Cancer Immunotherapy. Current Pharmaceutical Biotechnology. 11 (6), 672-684 (2010).
- Matthews, P. M., Rabiner, E. A., Passchier, J., Gunn, R. N. Positron emission tomography molecular imaging for drug development. British Journal of Clinical Pharmacology. 73 (2), 175-186 (2012).
- Hargreaves, R. The Role of Molecular Imaging in Drug Discovery and Development. Clinical Pharmacology & Therapeutics. 83 (2), 349-353 (2008).
- Keng, P. Y., Esterby, M., van Dam, R. M., Hsieh, C. -. H. Emerging Technologies for Decentralized Production of PET Tracers. Positron Emission Tomography - Current Clinical and Research Aspects. , 153-182 (2012).
- Lazari, M., Irribarren, J., Zhang, S., van Dam, R. M. Understanding temperatures and pressures during short radiochemical reactions. Applied Radiation and Isotopes. , 82-91 (2016).
- Lazari, M., et al. ELIXYS - a fully automated, three-reactor high-pressure radiosynthesizer for development and routine production of diverse PET tracers. European Journal of Nuclear Medicine and Molecular Imaging (EJNMMI) Research. 3 (1), 52 (2013).
- Claggett, S. B., Quinn, K., Lazari, M., Esterby, J., Esterby, M., van Dam, R. M. A new paradigm for programming and controlling automated radiosynthesizer. Journal of Nuclear Medicine. 53 (suppl. 1), 1471-1471 (2012).
- Claggett, S. B., Quinn, K. M., Lazari, M., Moore, M. D., van Dam, R. M. Simplified programming and control of automated radiosynthesizers through unit operations. European Journal of Nuclear Medicine and Molecular Imaging (EJNMMI) Research. 3, 53 (2013).
- Lazari, M., et al. Fully Automated Production of Diverse 18F-Labeled PET Tracers on the ELIXYS Multireactor Radiosynthesizer Without Hardware Modification. Journal of Nuclear Medicine Technology. 42 (3), 203-210 (2014).
- Lazari, M., et al. Fully-automated synthesis of 16β-18F-fluoro-5α-dihydrotestosterone (FDHT) on the ELIXYS radiosynthesizer. Applied Radiation and Isotopes. 103, 9-14 (2015).
- Collins, J., et al. Production of diverse PET probes with limited resources: 24 18F-labeled compounds prepared with a single radiosynthesizer. Proceedings of the National Academy of Sciences. 114 (43), 11309-11314 (2017).
- Drake, C., et al. Enzymatic Radiofluorination of Biomolecules: Development and Automation of Second Generation Prosthetic on ELIXYS Radiosynthesizer. Journal of Nuclear Medicine. 58 (supplement 1), 1 (2017).
- Gobbi, L. C., et al. Identification of Three Novel Radiotracers for Imaging Aggregated Tau in Alzheimer's Disease with Positron Emission Tomography. Journal of Medicinal Chemistry. 60 (17), 7350-7370 (2017).
- Ippisch, R., Maraglia, B., Sutcliffe, J. Automated production of [18F]-F-Py-peptides. Journal of Nuclear Medicine. 57, 275 (2016).
- Chen, H., et al. AMG 580: A Novel Small Molecule Phosphodiesterase 10A (PDE10A) Positron Emission Tomography Tracer. Journal of Pharmacology and Experimental Therapeutics. 352 (2), 327-337 (2015).
- Waldmann, C. M., et al. An Automated Multidose Synthesis of the Potentiometric PET Probe 4-[18F]Fluorobenzyl-Triphenylphosphonium ([18F]FBnTP). Molecular Imaging and Biology. 20 (2), 205-212 (2018).
- Ravert, H. T., et al. An improved synthesis of the radiolabeled prostate-specific membrane antigen inhibitor, [18F]DCFPyL. Journal of Labelled Compounds and Radiopharmaceuticals. 59 (11), 439-450 (2016).
- Betthauser, T. J., et al. Characterization of the radiosynthesis and purification of [18F]THK-5351, a PET ligand for neurofibrillary tau. Applied Radiation and Isotopes. 130, 230-237 (2017).
- Shu, C. J., et al. Novel PET probes specific for deoxycytidine kinase. Journal of Nuclear Medicine. 51 (7), 1092-1098 (2010).
- Kim, W., et al. [18F]CFA as a clinically translatable probe for PET imaging of deoxycytidine kinase activity. Proceedings of the National Academy of Sciences. 113 (15), 4027-4032 (2016).
- Barrio, M. J., et al. Human Biodistribution and Radiation Dosimetry of 18F-Clofarabine, a PET Probe Targeting the Deoxyribonucleoside Salvage Pathway. Journal of Nuclear Medicine. 58 (3), 374-378 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados