Method Article
Um modelo de linfoma de célula B Syngeneic Mouse para avaliação pré-clínica de pilhas de T de carro CD19
Neste Artigo
Resumo
Aqui, apresentamos um protocolo para a produção e testes pré-clínicos de murino células CD19 carro T por transdução retroviral e utilização como uma terapia contra linfoma de célula B A20 syngeneic estabelecida em camundongos BALB/c com ou sem lymphodepleting pré-condicionamento.
Resumo
O surpreendente sucesso clínico da terapia de células T do CD19 antígeno quimérico do receptor (carro) levou à aprovação dos receptores de antígeno quimérico dois de segunda geração (carros) para linfoma de leucemia linfoblástica aguda (LLA) andnon-Hodgkin (NHL). O foco do campo está agora em emulando estes sucessos em outras malignidades hematológicas, onde observam-se taxas de resposta completa menos impressionantes. Mais engenharia de células T de carro ou a co-administração de outras modalidades de tratamento com êxito pode superar os obstáculos ao sucesso terapia em outras configurações de câncer.
Portanto, apresentamos um modelo em que os outros podem conduzir testes pré-clínicos de células CD19 carro T. Resultados neste modelo de linfoma de célula B bem testados são susceptíveis de ser informativa terapia de células-T de carro em geral.
Este protocolo permite a produção reprodutível de rato células T de carro através de fosfato de cálcio transfection das pilhas de produtor Plat-E com construções retrovirais MP71 e pCL-Eco do plasmídeo de embalagem seguido pela coleção de partículas retrovirais segregadas e transdução usando centrifugação e fragmento de fibronectina humana recombinante. Validação de transdução retroviral e confirmação da habilidade de células T do carro para matar alvo linfoma células ex vivo, através da utilização de citometria de fluxo, luminometry e imunoenzimático do ensaio (ELISA), também é descrita.
Protocolos para testar o carro T células na vivo em lymphoreplete e lymphodepleted syngeneic ratos, linfoma sistêmica, estabelecida de rolamento são descritos. Atividade anti-câncer é monitorada por no vivo bioluminescência e doença progressão. Nós mostramos resultados típicos de erradicação de linfoma de célula B estabelecida quando utilizando 1st ou geração 2nd carros em combinação com lymphodepleting pré-condicionamento e uma minoria de ratos atingir remissão de longo prazo quando utilizando carro T células expressando IL-12 em ratos lymphoreplete.
Estes protocolos podem ser usados para avaliar as células CD19 carro T com diferentes modificações adicionais, combinações de células T de carro e outros agentes terapêuticos ou adaptados para o uso de células T de carro contra antígenos de destino diferente.
Introdução
Terapia de células T antígeno quimérico do receptor (carro) mostrou-se surpreendente sucesso clínico no tratamento de CD19+ malignidades, levando à aprovação do tisagenlecleucel para leucemia linfoblástica aguda recaíram1 e axicabtagene ciloleucel para progressiva grandes células B linfoma não-Hodgkin2 em 2017.
A importância das interações entre câncer e o sistema imunológico na progressão da doença e mecanismos terapêuticos está se tornando cada vez mais reconhecido3,4,5. Por exemplo, está bem documentado que o microambiente do tumor (TME) está inundada de fatores que podem suprimir as funções efetoras de células do sistema imunológico6,7,8. Como alternativa, escorva de células do sistema imune endógenas e epitope propagação pode ser chave na erradicação do tumor e a resistência de longo prazo para tumor desafio9,10. Ambos estes fenômenos não podem ser avaliados em xenogénicas modelos que não possuem um sistema imunológico. Da mesma forma, sistemas que utilizam proteínas transgênicas não refletir com precisão o desafio de quebra de tolerância imunológica, que é necessária para o epítopo espalhando11,12. Um modelo syngeneic com um sistema imune completamente funcional é, portanto, fundamental para estes importantes aspectos da terapêutica de progressão e imune de doença câncer de modelagem.
Uma ressalva importante da terapia de células-T de carro é que lymphodepleting pré-condicionamento é necessário para o sucesso terapêutico13,14. Isto é conseguido geralmente em pacientes através da administração de quimioterapia antes da infusão de carro T células15,16. Como um método padrão, a fim de imitar lymphodepletion usado na configuração da paciente, administramos 5 Gy irradiação de corpo total (TBI) para alcançar a lymphodepletion antes da administração de terapêuticas células T de carro aos ratos linfoma de célula B A20 sistêmica do rolamento.
Enquanto lymphodepleting pré-condicionado não é um problema para a maioria dos pacientes, toxicidade que vem com agentes quimioterápicos significa que pacientes do status de baixo desempenho não são elegíveis para a terapia de células-T de carro. Para criar um sistema de teste que representa os pacientes não elegíveis para lymphodepletion, nós estabelecemos um modelo de mouse syngeneic de lymphoreplete no qual usamos modelos de terapia com carro T-células do linfoma. Nesse modelo, nós mostramos que a secreção de IL-12, de dentro das células T de carro pode levar à erradicação de linfoma estabelecida com uma taxa de sucesso de ~ 25%17. Além disso, mostramos que células do sistema imune endógenas estavam envolvidas na erradicação do câncer.
Aqui descrevemos detalhadamente o protocolo para a produção de pilhas de T do carro do rato, estabelecimento de linfoma em ratos syngeneic e o tratamento de linfoma de células T de carro com ou sem o uso de pré-condicionamento lymphodepleting. Isso pode ser usado para estudos de combinação de células T de carro com outros agentes, testes de células T de carro com outras transgenes ou para o uso de outras estratégias de terapia ou imunoterapia adotiva célula contra linfoma.
Protocolo
Todas as experiências em animais foram realizadas sob os auspícios da lei de animais (procedimentos científicos) 1986 e sob UK Coordinating Committee para orientações de pesquisa do câncer. Todos os estudos em animais foram conduzidos no Instituto CRUK-Manchester e aprovados pelo bem-estar dos animal local e ética rever corpo (CRUK-MI AWERB).
1. preparações
- PMP71 de Maxiprep retroviral construir plasmídeo e pCL-Eco retrovírus embalagem plasmídeos18.
Nota: pMP71 codifica mCherry e separadas por uma sequência de FMDV2A o carro. Isto é intercambiável com outras construções retrovirais. pCL-Eco codifica gag, pol e as proteínas do envelope ecotropic. - Prepare o suporte de célula T completa (TCM) para cultivo de células de rato T usando meio RPMI 1640, FCS de 10%, 1% 100 x penicilina-estreptomicina-glutamina (PSG).
Nota: A solução contém penicilina 100 UI/mL, 100 mg/mL de estreptomicina e 2mm da L-glutamina), 50 μM β-Mercaptoetanol e 25mm 4-(2-hydroxyethyl)-1-piperazineethanesulfonic ácido (HEPES). - Cultura de células A20 em RPMI 1640, 10% FCS e β-Mercaptoetanol de 0,05 mM a 37 ° C, 5% de CO2.
- Cultura das células de platina-E (Plat-E) no meio de eagle modificado de Dulbecco completa (DMEM) (DMEM com soro fetal bezerro de 10% (FCS), 2 mM L-glutamina, 1 puromicina μg/mL e 10 μg/mL blasticidin) a 37 ° C, 5% CO2.
Nota: Plat-E as células são derivadas de células 293T e expressam proteínas retrovirais de gag, pol e ecotropic envelope. - Prepare a transfeccao soluções de mídia 1 e 2 imediatamente antes do transfection. Prepare a solução 1 (pH 7.9) para conter DMEM + 10% FCS + 25mm HEPES, solução 2 (pH 7,1) para conter DMEM + 25mm HEPES.
- Prepare-se 10 μg/mL de solução de fragmento de fibronectina humana recombinante diluindo com solução salina tampão fosfato (PBS) e armazenar a-20 ° C até o uso.
- Todos os meios de filtro de estéril através de 0,2 μm filtros antes do uso (excluindo fibronectina humana recombinante fragmento).
2. retroviral transdução de células T
- Dia 1: Preparação para transfeccao
- Semente de 7,5 x 106 Platinum-E (Plat-E) células em pratos de cultura de tecidos de2 de 15 cm em 18 mL de DMEM completa e incubar durante uma noite a 37 ° C, 5% de CO2.
- Dia 2: Transfection da linha de celular de empacotamento retroviral Plat-E
- Prepare 20.4 μg de vetor de empacotamento de pcl-Eco DNA, 39,6 μg de DNA de plasmídeo codificação retroviral construção de carro e 150 μL de 1 M CaCl2 para volume final de 3 mL de solução de transfeccao 2 por prato de2 de 15 cm a transfected. Vórtice 10 s e resto por 5 min
- Remova a mídia DMEM pratos de2 a 15 cm e substitua com 12 mL de solução de transfeccao 1.
Cuidado Ao alterar os meios de comunicação, pratos de2 a 15 cm podem secar no centro. Isso pode causar morte substancial de células transfectadas de Plat-E. Trabalhar rapidamente e retire mídia apenas 1-2 chapas de cada vez. - Adicione 3 mL de solução de transfeccao 2 contendo DNA e CaCl2 para cada prato de2 15 cm drop-wise, uniformemente através de cada placa. Suavemente de placas de pedra com um movimento lateral para 10 s. Incubar a 37 ° C, 5% CO2 durante a noite.
- Dia 3: Preparação de vírus contendo sobrenadante para transdução
- Substituir os meios de comunicação de células transfectadas de prato-E com 18 mL concluir TCM e retornam para a incubadora.
Cuidado Quando os mídia 15cm2 pratos mudam pode secar no centro. Isso pode causar morte substancial de células transfectadas de Plat-E. Trabalhar rapidamente e retire mídia apenas 1-2 chapas de cada vez.
- Substituir os meios de comunicação de células transfectadas de prato-E com 18 mL concluir TCM e retornam para a incubadora.
- Dia 3: Isolamento e em vitro a ativação de células T no baço de rato
- Remover baços de ratos BALB/c 6-8-week-old conforme descritos por Parkinson et al 19 e mergulhe-os em estéreis e gelada, PBS em um tubo cónico de 50 mL.
- Use uma pinça para transferir um baço para um tubo de microcentrifugadora de 1,5 mL e homogeneizar usando um pilão com força mínima.
- Usar uma pipeta de 1000 μL e ~ 800 μL PBS para transferir homogeneizado para um coador de célula de poros 100 μm Aposto em um tubo de 50 mL contendo 5 mL de PBS para atingir uma suspensão de célula única. Repita a etapa 2.4.2 para os baços adicionais. Não exceda 3 baços por tubo.
Cuidado Splenocytes passada filtro podem formar aglomerados se fica de pé. Manualmente do redemoinho tubos intermitentemente se processando vários baços para evitar a aglutinação de células. Restantes fragmentos sobre o filtro de célula podem ser ainda mais purê usando um êmbolo de uma seringa de 5 mL, utilizando a força mínima. - Superior a 20 mL com PBS. Camada a suspensão de células de 20 mL com cuidado na 20 mL de mídia de gradiente de densidade (Tabela de materiais) em um tubo de 50 mL. Centrifugar a suspensão resultante sobreposta a 800 x g por 20 min com nenhum freio aplicado.
- Colheita de células na camada de interface usando uma pipeta Pasteur esterilizada e transfira para um tubo de 50 mL. Top com PBS e centrifugar 800 x g durante 10 minutos para lavar até 50 mL. Desprezar o sobrenadante e ressuspender as células em TCM completa.
- Conte o número de células usando um hemocytometer.
- Cultura de células em uma densidade de 5 x 106 células/mL em TCM completa com anticorpo de anti-CD3ε 30 ng/mL (Clone 145-2 C 11), 30 anticorpo anti-CD28 de ng/mL (Clone 37.51), 100 U/mL recombinante humano Il-2 e recombinação de 2 ng/mL murino IL-7. Use um frasco de cultura de tecidos de tamanho adequado para o volume das células colhidas.
Nota: Apresenta células antígeno–são necessárias para a ativação de células T por anticorpos CD3 e CD28, se trabalhando com células purificadas de T é necessário para placas de revestimento com anticorpos, ou usam grânulos magnéticos (Tabela de materiais) - Incube o rato splenocytes a 37 ° C, 5% CO2 durante a noite.
- Dia 3: Elaboração de placas de transdução
- Casaco-tecido-cultura 6-poços chapas com 2 mL de 10 μg/mL de fibronectina humana recombinante fragmentam e incubam durante a noite a 4 ° C.
- Dia 4: Transdução de pilhas do rato T
- Transferi o fragmento recombinante humano fibronectina de placas revestidas fresco-tecido-cultura 6-poços chapas. Incube a estas placas durante a noite a 4 ° C, para o 2º round de transdução.
- Adicionar 2 mL de TCM para cada poço de placas com revestimento em fragmento recombinante fibronectina humana original e deixe por 30 min à temperatura ambiente para bloquear a ligação não-específica.
- Retrovírus contendo sobrenadante de células transfectadas de Plat-E em pratos de cultura de tecidos de 15 cm e substituir com 18 mL de TCM total da colheita.
Cuidado Trabalha rapidamente para evitar a secagem das células Plat-E.
Nota: Sucesso do transfection pode ser verificado, nesta fase, por microscopia de fluorescência se utilizando um gene marcador fluorescente como mCherry (Figura 1). - Filtre o sobrenadante contendo retrovírus 0,45 μm filtro para remover os resíduos de célula. Retire TCM fibronectina humana recombinante fragmento-revestido 6-poços chapas e adicionar 2,5 mL de filtrado retrovírus contendo sobrenadante ou a cada poço (uso completo TCM para transfeccao simulado). Etiquete cada bem como para a adição de retrovírus ou mídia simulada.
- Centrifugar as placas a 1200 x g durante 30 min à temperatura ambiente.
- Enquanto as placas estão girando, coletar células T ativadas e contar usando um hemocytometer.
- Transdução é realizada com 5 x 106 ativado splenocytes num total de 5 mL/poço. Granule o número necessário de splenocytes para simulação/transdução em tubos separados por centrifugação a 500 x g durante 5 min.
- Re-suspenda splenocytes em uma densidade de 5 x 106 células por 2,5 mL de filtrado retrovírus contendo sobrenadante da etapa 2.6.4 ou TCM como controlo negativo. Adicione Il-2 humana recombinante (LIS-2) e o rato recombinante IL-7 (mIL-7) a uma concentração final de 200 UI/mL e 4 ng/mL respectivamente.
- Coletar as placas 6-poços de centrífuga após a conclusão da etapa 2.6.5 e adicione 2,5 mL/bem re-suspensos splenocytes em poços apropriados para fazer um volume final de 5 mL/bem e uma concentração final de 100 U/mL hIL-2 e 2 ng/mL. o mIL-7.
- Centrifugar as placas a 1200 x g, durante 90 min à temperatura ambiente. Após a centrifugação, Incube as placas a 37 ° C, 5% CO2 durante a noite.
- Dia 5: Round 2 de transdução
- Recolha o fragmento recombinante humano fibronectina das placas como este pode ser re-utilizada. Repita os passos de 2.6.2 - 2.6.5.
- Enquanto as placas estão girando, colete células de 1st redondo de transdução usando uma pipeta Pasteur. Enxágue a cada poço com 2 mL de PBS, redemoinho e coletar as células restantes em cada poço.
Nota: Pipete para cima e para baixo re-suspender as células sedimentadas. Recolha cada grupo controle/transdução em tubos separados. - Tubos de centrífuga a 500 x g durante 5 min. Ressuspender as células em 2,5 mL por poço de transdução com 200 UI/mL IL-2 e IL-7 de 4 ng/mL. Repita as etapas 2.6.7 - 2.6.8.
- Remover células da centrífuga e incubar a 37 ° C, 5% de CO2 para células de 4 h. recolher transfectadas como em etapas 2.7.2-2.7.3.
- Contar as células, centrifugar a 500 x g por 5 min e ressuspender em TCM completa em uma densidade de 1 x 106 células/mL, com 100 U/mL hIL-2 e 2ng/mL mIL-7. Transferir para um balão de tamanho adequadamente cultura e incubar a 37 ° C, 5% de CO2.
- Adicionar mídia TCM fresca contendo 100U/mL hIL-2 e 2ng/mL mIL-7 cada 2 dias, mantendo uma densidade de células de 1 x 106 células/mL.
Nota: Splenocytes colhidos contêm uma variedade de tipos de células. Sob essas condições de cultura, as células T não morrem ao longo de 2-3 dias. Depois de ~ 4 dias em cultura de células, o número de células T é normalmente equivalente ao número total de splenocytes colhidos no dia 0.
3. medição da eficiência de transdução
- Na transdução de post do dia 4, colete uma amostra de células T transduzidas ou não-transfectadas (aproximadamente 3 x 105 células). Centrifugar a suspensão de eritrócitos a 500 x g por 5 min, desprezar o sobrenadante, lavar as células peletizadas uma vez com PBS e centrifugar novamente.
- Desprezar o sobrenadante e adicionar 100 μL de PBS contendo uma amina apropriado tintura reactiva (por exemplo, mancha ao vivo/morto, diluição de 1 em 100) por poço. Incube durante 15 minutos à temperatura ambiente no escuro.
- Lave duas vezes com PBS e centrifugar a 500 x g, durante 5 min. descartar o sobrenadante e incubar com 50 μL de tampão de FACS contendo anticorpos CD16/CD32 anti-rato receptor Fc bloqueio (diluição de 1 em 100). Incubar durante 10 minutos a 4 ° C.
- Diretamente adicione 50 μL do anticorpo que mancha mestre mistura contendo anti-rato BV786-CD4 e CD8-BV711 anticorpos (concentração final de 1 μL/poço no buffer de FACS). Incube durante 30 min a 4 ° C, no escuro. Repita a etapa de lavagem 3.3. Ressuspender as células em buffer PFA de 1% e manter no escuro a 4 ° C até análise por citometria de fluxo.
- Analise as células com equivalente citômetro apropriado usando BV711, BV785 e mCherry de fluorescência como marcadores de subconjunto de CD4 e CD8 e expressão de carro gating respectivamente como em (Figura 2).
4. in vitro células de validação de carro T atividade
- Sementes syngeneic alvo CD19+ células de tumor com ou sem expressão do luciferase em uma densidade de 1 x 104 células em 100 μL TCM/bem em um U-fundo de 96 poços placa de cultura de tecidos.
- Adicione 1 x 104 CD19 carro T células/poço em um volume de 100 μL/poço para alcançar um efetor à relação de destino (E:T) de 1:1.
Nota: Rácios de E:T devem ser estabelecidos para cada carro construir e linhagem de células-alvo. - Uso T células sozinho e sozinho como controles negativos de células tumorais e as células T estimuladas por phorbol myristate-acetato (PMA) (50 ng/mL) e ionomycin (1 μg/mL) como controle positivo para liberação de Interferon gama (relato). Células de cultura co a 37 ° C, 5% de CO2 para 16-24 h.
- Após co-cultura, Centrifugar as placas a 500 x g por 5 min e recolher o sobrenadante para posterior análise de relato e ELISA de IL - 12 p 70.
Nota: Isso pode ser armazenado a-80 ° C. - Re-suspenda pelotas de célula em 100 µ l de PBS contendo luciferina (concentração final de 1,5 mg/mL). Incubar as placas durante 10 minutos a 37 ° C. Em seguida medir a luminescência de cada poço com um apropriado luminómetro.
Nota: Tempos de exposição devem ser otimizados para densidade e linhas celulares. Resultados representativos são mostrados na Figura 3a. Ex-vivo citotoxicidade das células T de carro pode ser modificada para luciferina expressa por co-cultura com linhagens celulares expressando o antígeno alvo. Células T de carro matam células-alvo, luciferina é liberada, portanto uma redução no sinal de luminometry está correlacionada com a morte celular. Células transfectadas non muitas vezes podem ter um efeito sobre a viabilidade da célula alvo, particularmente durante períodos de incubação longos. Medir a concentração de murino relato e IL - 12p 70 no sobrenadante de acordo com protocolos de ELISA do fabricante. Resultados representativos são mostrados na (Figura 3b e 3C). Ex-vivo ativação de células T de carro por co-cultura com linhagens celulares expressando o antígeno alvo pode ser analisada através da análise de conteúdo sobrenadante usando ELISA. A proporção de células T de carro para células-alvo e duração do período de co-cultura devem ser otimizados para cada carro construção, linha de célula de destino e analito. Tratamento de PMA e ionomycin pode ser usado como um controle positivo para confirmar a qualidade de células T e sua capacidade de responder.
5. avaliar a atividade anti-câncer em ratos
-
Protocolo n º 1
- Realize 100 mg/kg por via intravenosa (IV) entrega ciclofosfamida em camundongos BALB/c de 6 a 8 semanas. Isso permite que a enxertia de tumor sem significativa lymphodepletion17 (Figura 4).
Nota: Que institui A20 linfoma pode levar mais de 2 meses com uma taxa de tomar suboptimal. Isso pode ser melhorado através da utilização de ciclofosfamida 1 dia antes da entrega das células do linfoma. A fim de estudar os ratos lymphoreplete, identificamos uma dose de ciclofosfamida que pode aumentar a eficiência de linfoma sem causar lymphodepletion. - No dia seguinte, injete 100 µ l de 5 x 105 syngeneic A20 células B linfoma células modificadas para expressar a proteína luciferase e verde fluorescente (GFP) em ratos por injeção intravenosa (IV).
- Permitir que os ratos desenvolver linfoma sistêmica para ~ 17 dias.
- Confirme a presença de linfoma sistêmica por injeção intraperitoneal de (IP) de 100 μL de Luciferina de 30 mg/mL e de imagem usando uma bioluminescência na vivo , sistema de imagem.
- Use separadores para evitar repercussões de sinal em camundongos adjacentes. Expor a ratos durante 1 min no lado ventral com uma região de tamanho constante de interesse.
- Exibir unidades de luz relativas (RLU) como fótons por segundo (p/s). As configurações devem ser otimizadas para cada modelo de tumor; Use uma exposição que pode pegar a deteção adiantada de tumores, mas não leva à saturação como tumores atingir pontos de extremidade.
- Registro RLU total para cada mouse com uma constante de porte região de interesse. (Figura 5a e b).
- Injete um linfoma de dose única de 1 x 106 células T de carro por injeção IV em camundongos lymphoreplete tendo estabelecido.
Nota: (importante) Níveis de dosagem deve ser estabelecido para cada carro construir usando um cronograma de escalonamento de dose para garantir que quaisquer possíveis toxicidades decorrentes de células T de carro são caracterizadas e podem ser abordadas. Apesar de células de anti-rato CD19 carro T não exibir toxicidades, células T de carro podem dar origem a toxicidade inesperada. Onde várias construções de carro e eficiências de transdução não são idênticas, o número total de células T administrado deve ser mantido igual pela adição das células T não-transformados em preparações da pilha. - Monitorar a progressão da doença semanalmente através da injeção de IP de 100 μL de Luciferina de 30 mg/mL e de imagem usando uma bioluminescência na vivo de imagem de sistema (Figura 5C).
- Estreitamente monitorar camundongos para sinais de toxicidade e a eutanásia em algum rato que mostram os primeiros sinais de paralisia de membro posterior (HLP) ou carga patológica do tumor antes de qualquer sofrimento pode surgir.
Nota: Toxicidades de A20 linfoma podem incluir paralisia do membro posterior através de invasão do tumor das meninges. Verifique regularmente se os primeiros sinais de alteração da marcha. Da mesma forma, grandes tumores IP podem surgir que pode levar a desconforto demonstrado pelo comportamento alterado. - Monitorar a sobrevivência dos ratos por 60-100 dias (Figura 5D). Realizar eutanásia por um método de programação-1 após a conclusão do experimento.
- Realize 100 mg/kg por via intravenosa (IV) entrega ciclofosfamida em camundongos BALB/c de 6 a 8 semanas. Isso permite que a enxertia de tumor sem significativa lymphodepletion17 (Figura 4).
-
Protocolo 2
- Entrega da ciclofosfamida 200 mg/kg de 6 a 8 - semana velhos camundongos BALB/c por cauda veia injeção de 100 µ l de PBS por rato.
- No dia seguinte, injete de 5 x 105 syngeneic A20 células B linfoma células expressando luciferase e GFP em 100 μL PBS através de cauda veia injeção.
- Permitir que os ratos desenvolver linfomas sistêmicos para ~ 7-14 dias
- Confirme o linfoma sistêmica por injeção de IP de 100 μL de Luciferina de 30 mg/mL e de imagem usando uma bioluminescência na vivo , sistema de imagem.
- Realize 5 Gy irradiação total do corpo (TBI) 0,02 Gy/min para lymphodepletion.
Nota: Pacientes submetidos a tratamentos de célula T carro passam por uma série de regimes para alcançar lymphodepletion, antes que a administração de células T de carro que aumenta significativamente a enxertia de enviaram transferido células T de carro. Isto pode ser replicado em camundongos com irradiação de corpo total (TBI) (Figura 6). - No dia seguinte, Injete 1 x 106 células T de carro em 100 μL de PBS através de cauda veia injeção em ratos tendo estabelecida tumores.
- Colete sangue amostras através de cauda veia sangra após 7 dias.
- Adicione o tampão de lise de eritrócitos para cada amostra de sangue e, em seguida, prepare-se para citometria de fluxo, conforme descrito na seção 3. Analise a persistência de célula T de carro na circulação por citometria de fluxo (Figura 2).
Nota: Adição de grânulos contando imediatamente antes da citometria permite a determinação do número de células T de carro por mililitro de sangue. - Monitorar o progresso da doença conforme descrito nas etapas 5.1.5 - 5.1.8 (Figura 7).
Resultados
Para transdução de alta eficiência de células T, é necessário obter partículas retrovirais frescas. Transfecção da linha celular com pCL-Eco produtor plasmídeo e pMP71 do plasmídeo de retrovírus Plat-E dá origem a secreção de partículas retrovirais para a célula sobrenadante. Quando um gene marcador fluorescente, tais como mCherry, é codificado em retrovírus, transfecção de sucesso pode ser confirmada por microscopia de fluorescência (Figura 1). Sobrenadante contendo vírus de células transfectadas de Plat-E é usado para transduce células T através de 2 voltas de rotação-fection em placas de fragmento-revestidas de fibronectina. A eficiência de transdução pode ser determinada por 4 dias post transdução através de citometria de fluxo. Transduzidas com sucesso células expressam o gene marcador codificado em retrovírus (Figura 2). Eficiências de transdução variam de ~ 50-90% de eficiência com receptores de primeira geração para ~ 10-40% com carro constrói perto da capacidade de empacotamento retroviral. Enquanto expressão de gene marcador mostra transdução retroviral bem-sucedida, é fundamental para mostrar a funcionalidade de células T de carro em cima de engajar-se com células esse antígeno alvo expressa na sua superfície. Linhas de célula alvo modificadas para luciferase express podem ser usadas em ensaios de luciferase para testar o grau de célula-matar por pilhas de T do carro diretamente (Figura 3A). A liberação de citocinas efetoras de células T de carro após a co-cultura com células-alvo, determinadas pela ELISA, também pode ser usada como uma medida indireta da citotoxidade de células T de carro (Figura 3B e 3C).
As pilhas de T do carro produzidas no presente protocolo podem ser avaliadas em camundongos lymphoreplete estabelecendo linfoma sistêmica de A20 com uma dose de 100 mg/kg de ciclofosfamida (injectada por via intravenosa), 1 dia antes da injeção IV de 5 x 105 A20 células (Figura 4). Injeção de IP com a luciferina e a imagem de captura usando um Imageador de bioluminescência em vivo pode ser usada para monitorar a carga do tumor usando um tempo ROI e exposição constante ao longo (Figura 5A-C). As pilhas de T de carro modificadas para IL-12 expresso são capazes de erradicar o linfoma sistêmica com lymphodepleting pré-condicionamento dando sobrevivência livre de doença em cerca de 25% dos ratos (Figura 5). Lymphodepleting pré-condicionamento, alcançado por 5 Gy TBI 1 dia antes da administração IV de células T de carro, melhora significativamente a enxertia (Figura 6). Neste modelo, as pilhas de T do carro de primeira geração são capazes de erradicar sistêmica A20 linfoma, geralmente induzindo a sobrevivência livre de doença em 100% dos ratos (Figura 7).
Figura 1. Confirmação da bem sucedida transfecção de células E Plat. Plat-E células transfectadas com construção de carro retroviral e pMP71 e pcl-Eco embalagem vector plasmídeo. Transfecção de sucesso é mostrada pela expressão do gene marcador fluorescente mCherry. A) microscopia de campo claro, B) microscopia de fluorescência e C) imagens mescladas são mostradas. Ampliação = 50 X. Clique aqui para ver uma versão maior desta figura.

Figura 2. Determinação de eficiência de transdução por citometria de fluxo. Citometria de fluxo é usada para determinar a eficiência de transdução das células do rato T na transdução de post do dia 4, usando o UV zumbi vivo/morto, mCherry, BV711 e BV785 para a detecção de ao vivo, carro construir, células CD4 e CD8, respectivamente. Resultados representativos de A) Non-transfectadas, B) mCherry.αmCD19.mCD3z e C) mCherry.αmCD19.mCD3z.mIL12 são mostrados com retenção de 1) camisolas 2) células 3 vivas) CD4 e CD8) 4 e 5) avaliação de células positivas mCherry, expressando o carro. Clique aqui para ver uma versão maior desta figura.
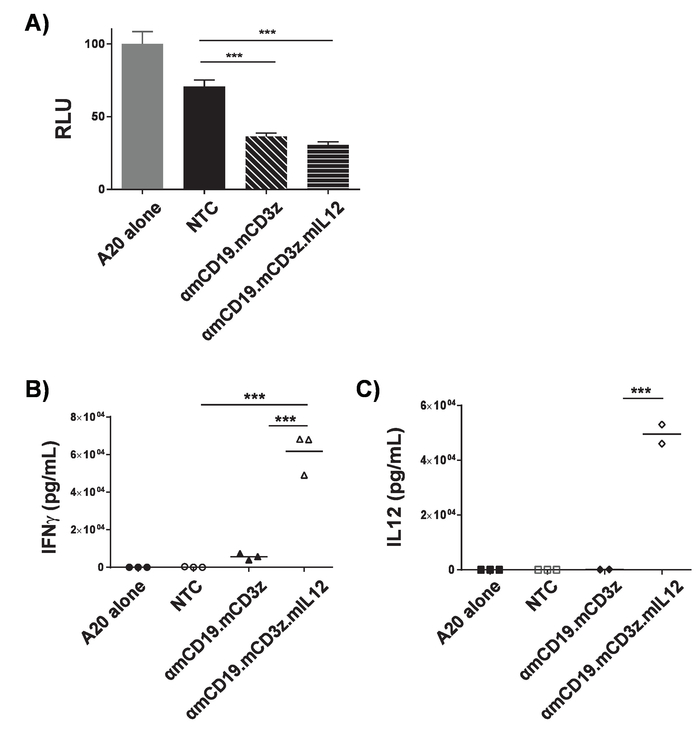
Figura 3. Validação da atividade de células T carro. ΑmCD19 carro T células foram co cultivadas com células do linfoma A20 modificadas para expresso do luciferase (1 x 104: 1 x 104) para 16 h em uma placa de fundo U 96. Depois da co-cultura, células foram peletizadas e sobrenadante foi coletado. A) células foram re-suspensas em PBS e luminometry foi usado para avaliar a viabilidade das células alvo. Sobrenadante da cultura co foi avaliada a presença de relato (B) e (C) de IL-12. A proporção de células T de carro para células-alvo e duração do período de co-cultura devem ser otimizados para cada carro construir e linhagem de células-alvo. Tratamento de PMA e ionomycin pode ser usado como um controle positivo para confirmar a qualidade de células T e suas células de capacidade para responder. Barras de erro mostram SD. estatística análise foi realizada utilizando ANOVA One-Way. p < 0,001). Esta figura foi modificada de17. Clique aqui para ver uma versão maior desta figura.
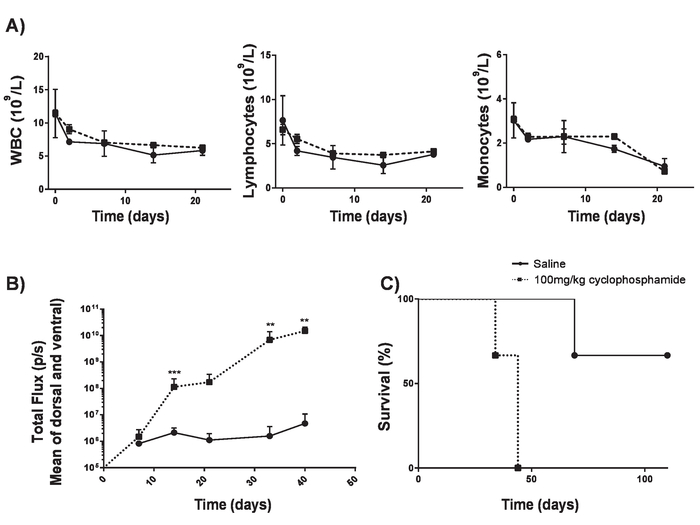
Figura 4. Que institui A20 linfoma sem lymphodepletion. Ciclofosfamida pode aumentar a eficiência da indução de linfoma sem causar lymphodepletion. A) contagens de sangue de camundongos BALB/c de 6-8-semana de idade após a entrega do IV de 100 mg/kg de ciclofosfamida. Barras de erro mostram SD B) fardo de linfoma de camundongos BALB/c 6-8-semanas após a entrega do IV de 100 mg/kg de ciclofosfamida ou solução salina no dia -1 e IV entrega de 5 x 105 A20 células no dia 0 medido utilizando um luminómetro. C) sobrevivência de ratos em B). Barras de erro mostram SD. estatística análise foi realizada utilizando 2-way ANOVA. * * p < 0,01, * * * p < 0,001). Esta figura foi modificada de Kueberuwa et al . 17. clique aqui para ver uma versão maior desta figura.
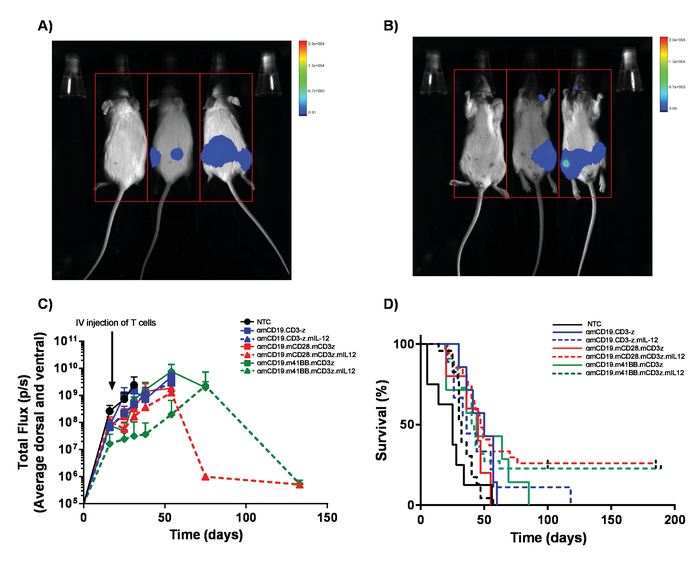
Figura 5. Monitoramento de carga de linfoma e sobrevivência. Os ratos linfoma A20 expressando luciferase de rolamento recebem 100 µ l intraperitoneal (IP) injeções de Luciferina de 30 mg/mL e foram fotografados usando uma bioluminescência na vivo , sistema de imagem. A) ratos foram expostos durante 1 min no lado ventral e imediatamente virou a imagem dorsal para pegar massas tumor em ambos os lados dos corpos (B). C) resultados representativos dos encargos de linfoma de camundongos BALB/c recebendo diferentes células T carro de αmCD19 sem lymphodepletion. Barras de erro mostram SEM. D) taxa de sobrevivência dos ratos mesmos. Esta figura foi modificada de Kueberuwa et al . 17. clique aqui para ver uma versão maior desta figura.
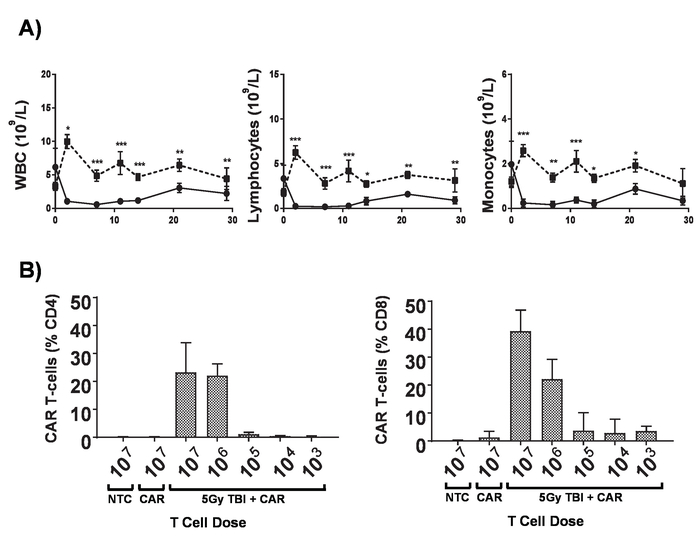
Figura 6. Efeitos da lymphodepletion. A) contagens de sangue de camundongos BALB/c de 6-8-semana de idade após ter recebido 5 Gy TBI em uma taxa de dose de 0,02 Gy/min; barras de erro mostram análise estatística de SD. por ANOVA de duas vias. p < 0.05, * * p < 0,01, * * * p < 0,001. B) monitoramento de CD4+ e CD8+ carro T células no sangue periférico de camundongos por citometria de fluxo para a administração de post de 7 dias de gene marcador mCherry. Barras de erro mostram SD Esta figura foi modificada de Kueberuwa et al . 17. clique aqui para ver uma versão maior desta figura.
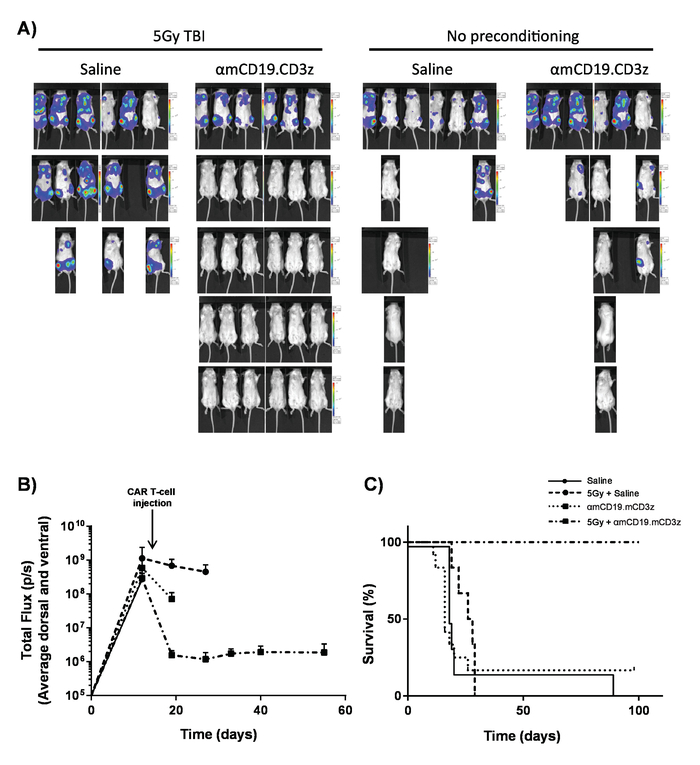
Figura 7. Atividade de células T de carro com pré-condicionamento lymphodepleting. Resultados típicos, mostrando o efeito de 5 Gy TBI o dia antes da administração de células-T de carro. A) exibições gráficas Imaging e (B) da imagem de ratos após 100 µ l intraperitoneal (IP) injeções de Luciferina de 30 mg/mL, usando uma bioluminescência na vivo , sistema de imagem. Barras de erro mostram SEM. C) sobrevivência dos ratos mesmos. Esta figura tem sido modificados fromKueberuwa et al . 17. clique aqui para ver uma versão maior desta figura.
Discussão
Syngeneic rato modelos permitem que o teste de progressão da doença e terapia, mantendo um sistema imunológico intacto. Isto é fundamental quando se trata de terapias que interagem com o sistema imunológico e, em especial para os agentes de imunoterapia.
O protocolo descrito aqui tem dois fluxos de trabalho críticos, o primeiro que é modificação genética de células T de rato para expressar carros. Isto requer 7 dias de iniciação para a validação da transdução. Concomitante com a produção de células T do carro é o estabelecimento de linfoma sistêmico em camundongos. Deve falhar a produção de células T de carro, ou ser de qualidade insuficiente, normalmente não há tempo suficiente para produzir células de substituição antes de ratos sucumbir ao linfoma. Portanto é fundamental que os pesquisadores usando estes modelos com precisão realizar estudos de progressão de doença e dosagem de tumor para tempo com sucesso a produção de células T de carro para administração de terapêutica.
Os motivos típicos para a baixa eficiência de transdução de células T inclui eficiência pobre transfecção de células de produtor, geralmente causado por plasmídeo pobre pureza ou imprecisa determinação do pH da mídia do transfection. Recomenda-se verificar a eficiência da transfecção de células produtor antes de prosseguir com o protocolo completo como pobre transfeccao limitará a eficiência da transdução de células T. Fragmentos de fibronectina humana recombinante podem ser coletados e armazenadas a-20 ° C para re-utilização, no entanto, vários resultados de congelamento-derreta em eficiência reduzida transdução. Processamento rápido de spleens do rato após coleção também é importante para a obtenção de alta rende de células viáveis de T.
Note-se que o protocolo descrito aqui utiliza células A20 expressando luciferase. Isto é preferido como ele fornece a capacidade de medir a carga sistêmica tumor por imagens de bioluminescência. No entanto, na presença de um sistema imune funcional, respostas a luciferase poderiam distorcer os resultados. Nós testamos anteriormente reações imunes de ratos para marcador transgenes17de sobreviver. É a chave para replicar experiências chaves usando células A20 livres de transgenes para validar que estes não desempenham um papel significativo na erradicação de tumor de células do sistema imunológico.
Enquanto agentes clínicos só podem ser usado na vivo em camundongos deficientes em imunológico, o uso de pilhas de T do carro do rato contra as células cancerosas do mouse permite-nos avaliar as contribuições do sistema imunológico para progressão de doença ou de eficácia terapêutica. Este protocolo poderia ser utilizado para a avaliação pré-clínica de carros visando linfoma de célula B ou outros carros com modificações adicionais, tais como a secreção de IL-12, conforme descrito aqui. Deve-se notar que embora a interação entre células do sistema imunológico pode ser avaliada em modelos do rato syngeneic, eles podem não precisão recapitular interação em seres humanos na vivo. Em especial Observe, humana e rato carros irá variar na estrutura que pode ter consequências a jusante; condições de cultura óptimas da ativação e célula para o crescimento de células T são diferentes20, distribuição tecidual de expressão do antígeno alvo pode variar entre humanos e ratos e experientes toxicidades podem ser radicalmente diferentes. É portanto essencial utilizar ex vivo e modelos xenogénicas para confirmar os resultados.
Em resumo, o lymphodepleted syngeneic e lymphoreplete modelo de linfoma recapitular os pacientes com e sem quimio/radioterapia prévia. Isto fornece um sistema de modelo em que imitar as configurações clínicas para permitir o teste de uma gama de estratégias terapêuticas que serão importantes com a onda de novos agentes de terapia imunológica.
Com o uso de pré-condicionamento, vai notar-se que todos os ratos normalmente claro a linfoma. Com até taxas de resposta completa de 90% nos seres humanos, isto é representante. No entanto, os desafios para a terapia de células T CD19 carro dependerá impedindo a alta frequência de recaídas observada que muitas vezes são CD19. As recidivas não foram observadas neste modelo até e muitas vezes além de 100 dias. Modificações para imitar as recaídas vistas na clínica poderiam ajudar com os desafios do futuro da terapia de células CD19 carro T.
Divulgações
David Gilham trabalha para Celyad que está envolvida na produção de células T de carro. O resto dos autores não têm nada para divulgar.
Agradecimentos
Gostaríamos de agradecer Bloodwise para o financiamento desta pesquisa (grant 13031) e as instalações do núcleo unidade, imagem latente e citometria e biologia molecular da recurso biológico do Manchester CRUK para apoiar este trabalho.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.2 µm syringe filter | Appleton Woods | FC121 | |
| 0.45 µm syringe filter | Appleton Woods | FC122 | |
| 1.5ml pestle and microtube | VWR | 431-0098 | |
| 100X penicillin-streptomycin-glutamine (PSG) | Gibco | 10378016 | |
| 2-Mercaptoethanol (50 mM) | Gibco | 31350-010 | |
| Blasticidine S hydrochloride | Sigma- Aldrich | 15205 | |
| Bottle Top Filter (0.2 µm) | Scientific Laboratory Supplies | FIL8192 | |
| Brilliant Violet 711 anti-mouse CD8a Antibody | BioLegend | 100759 | 1 in 100 staining dilution. Clone 53-6.7 |
| Brilliant Violet 785 anti-mouse CD4 Antibody | BioLegend | 100552 | 1 in 100 staining dilution. Clone RM4-5 |
| Calcium chloride dihydrate | Sigma- Aldrich | C7902 | |
| Cell counting beads – CountBright absolute counting beads | Molecular Probes | C36950 | |
| Cell Strainer 100μm | VWR | 734-0004 | |
| Cyclophosphamide Monohydrate | Merck | 239785-1GM | |
| Dulbecco’s Modified Eagle medium (DMEM) - High Glucose | Sigma Aldrich | D6546 | |
| Dynabeads | Gibco | 11131D | |
| Ficoll Paque Plus | GE Healthcare | GE17-1440-03 | Sold by Sigma- Aldrich |
| Flow cytometer - LSR Fortessa x20 | BD Biosciences | 658222R1 | |
| Foetal Bovine Serum | Gibco | 10270 | |
| Haemacytometer | Appleton Woods | HC001 | |
| HEPES solution | Sigma- Aldrich | H0887 | |
| IL-12 p70 Mouse Uncoated ELISA Kit | Invitrogen | 88-7121-76 | |
| IL2, Proleukin | Novartis | PL 00101/0936 | |
| in vivo bioluminescence imaging system – in vivo xtreme II imaging system | Bruker | T149094 | |
| Ionomycin Calcium Salt | Sigma- Aldrich | I0634 | |
| Live/dead stain - Zombie Violet Fixable Viability Kit | BioLegend | 423114 | 1 in 100 staining dilution |
| Luminometer - Lumistart Omega | BMG Labtech | 415-301 | |
| Murine IFN-γ ELISA kit | Diaclone | 861.050.010 | |
| Paraformaldehyde | Sigma- Aldrich | 16005 | |
| pCL-Eco | Novus Biologicals | NBP229540 | |
| Phorbol 12-myristate 13-acetate (PMA) | Sigma- Aldrich | P8139 | |
| Platinum E cell line | Cell Biolabs | RV-101 | (RRID:CVCL_B488) |
| Purified NA/LE Hamster Anti-Mouse CD28 | BD Biosciences | 553294 | Clone 37.51 |
| Purified NA/LE Hamster Anti-Mouse CD3ε | BD Biosciences | 553057 | Clone 145-2C11 |
| Purified Rat Anti-Mouse CD16/CD32 (Mouse BD Fc Block) | BD Biosciences | 553142 | 1 in 100 staining dilution. Clone 2.4G2 |
| Puromycin Dihydrochloride | Sigma- Aldrich | P8833 | |
| Recombinant human fibronectin fragment - RetroNectin Reagent | TaKaRa | T100B | |
| Recombinant Mouse IL-7 (carrier-free) | BioLegend | 577806 | |
| Red cell lysis buffer | eBioscience | 004-4333-57 | |
| RPMI 1640 Medium | Lonza | BE12-167F | |
| Trypsin - EDTA solution | Sigma- Aldrich | T3924 | |
| XenoLight D-Luciferin | Perkin Elmer | 122799 |
Referências
- . Food and Drugs Administration Biologics Licence Application Approval letter Available from: https://www.fda.gov/downloads/BiologicsBloodVaccines/CellularGeneTherapyProducts/ApprovedProducts/UCM574106.pdf (2017)
- . Food and Drugs Administration Biologics Licence Application Approval letter Available from: https://www.fda.gov/downloads/biologicsbloodvaccines/cellulargenetherapyproducts/approvedproducts/ucm581259.pdf (2017)
- Liu, Y., Zeng, G. Cancer and Innate Immune System Interactions: Translational Potentials for Cancer Immunotherapy. Journal of Immunotherapy. 35 (4), 299-308 (2012).
- Janssen, L. M. E., Ramsay, E. E., Logsdon, C. D., Overwijk, W. W. The immune system in cancer metastasis: friend or foe. Journal for ImmunoTherapy of Cancer. 5 (1), 79 (2017).
- Pandya, P. H., Murray, M. E., Pollok, K. E., Renbarger, J. L. The Immune System in Cancer Pathogenesis: Potential Therapeutic Approaches. Journal of Immunology Research. 2016, 13 (2016).
- Vinay, D. S., et al. Immune evasion in cancer: Mechanistic basis and therapeutic strategies. Seminars in Cancer Biology. 35, S185-S198 (2015).
- Gajewski, T. F., Meng, Y., Harlin, H. Immune Suppression in the Tumor Microenvironment. Journal of Immunotherapy. 29 (3), 233-240 (2006).
- Munn, D. H., Bronte, V. Immune suppressive mechanisms in the tumor microenvironment. Current opinion in immunology. 39, 1-6 (2016).
- Vanderlugt, C. L., Miller, S. D. Epitope spreading in immune-mediated diseases: implications for immunotherapy. Nature Reviews Immunology. 2, 85 (2002).
- Hardwick, N., Chain, B. Epitope spreading contributes to effective immunotherapy in metastatic melanoma patients. Immunotherapy. 3 (6), 731-733 (2011).
- Makkouk, A., Weiner, G. Cancer Immunotherapy and Breaking Immune Tolerance-New Approaches to an Old Challenge. Cancer research. 75 (1), 5-10 (2015).
- Jackson, S. R., Yuan, J., Teague, R. M. Targeting CD8(+) T-cell tolerance for cancer immunotherapy. Immunotherapy. 6 (7), 833-852 (2014).
- Brentjens, R. J., et al. Lymphodepletion and tumor burden govern clinical responses in patients with B-cell malignancies treated with autologous, CD19-targeted T cells. Journal of Clinical Oncology. 29 (15_suppl), 2534 (2011).
- Brentjens, R. J., et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood. 118 (18), 4817 (2011).
- Hay, K. A., et al. Kinetics and Biomarkers of Severe Cytokine Release Syndrome after CD19 Chimeric Antigen Receptor-modified T Cell Therapy. Blood. 130, 2295-2306 (2017).
- Zhang, T., et al. Efficiency of CD19 chimeric antigen receptor-modified T cells for treatment of B cell malignancies in phase I clinical trials: a meta-analysis. Oncotarget. 6 (32), 33961-33971 (2015).
- Kueberuwa, G., Kalaitsidou, M., Cheadle, E., Hawkins, R. E., Gilham, D. E. CD19 CAR T Cells Expressing IL-12 Eradicate Lymphoma in Fully Lymphoreplete Mice through Induction of Host Immunity. Molecular Therapy - Oncolytics. 8, 41-51 (2018).
- Engels, B., et al. Retroviral vectors for high-level transgene expression in T lymphocytes. Human Gene Therapy. 14 (12), 1155-1168 (2003).
- Parkinson, C. M., et al. Diagnostic Necropsy and Selected Tissue and Sample Collection in Rats and Mice. Journal of Visualized Experiments: JoVE. (54), e2966 (2011).
- Kueberuwa, G., et al. CCR7(+) selected gene-modified T cells maintain a central memory phenotype and display enhanced persistence in peripheral blood in vivo. Journal for Immunotherapy of Cancer. 5, 14 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados