É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Avaliação semi-quantitativa usando [18F] FDG Tracer em pacientes com lesão cerebral grave
Neste Artigo
Resumo
[18F]-fluorodeoxyglucose (FDG) positron emission tomography-tomografia computadorizada é útil para estudar o metabolismo da glicose relacionado a função cerebral. Aqui, apresentamos um protocolo para um tracer FDG [18F] set-up e avaliação semiquantitativa da análise de região de interesse para as áreas específicas do cérebro associado com manifestações clínicas em pacientes com traumatismo cranioencefálico grave.
Resumo
Pacientes com grave traumatismo crânio-encefálico (sTBI) têm dificuldade em saber se com precisão, eles estão expressando seus pensamentos e emoções por causa de distúrbios de consciência, interrompeu superior função e distúrbios verbais do cérebro. Como consequência uma capacidade insuficiente para se comunicar, avaliações objectivas são necessários de cuidadores, familiares e equipe médica. Uma tal avaliação é a avaliação do funcionamento de áreas do cérebro. Recentemente, imagens do cérebro multimodal serviu para explorar a função das áreas danificadas do cérebro. [18F]-fluorodeoxyglucose positron emission tomography-tomografia computadorizada ([18F] FDG-PET/CT) é uma ferramenta de sucesso para examinar a função cerebral. No entanto, a avaliação do metabolismo da glicose cerebral baseado em [18F] FDG-PET/CT não é padronizado e depende de vários parâmetros variados, bem como as condições do paciente. Aqui, descrevemos uma série de protocolos de avaliação semiquantitativa para uma análise de imagem região de interesse (ROI) usando traçadores FDG auto-produzido [18F] em pacientes com sTBI. O protocolo centra-se na seleção dos participantes, preparando o palpador FDG [18F] no laboratório quente, agendamento de aquisição de imagens do cérebro [18F] FDG-PET/CT e medir o metabolismo da glicose utilizando a análise ROI de uma área específica do cérebro.
Introdução
Pacientes com sTBI apresentam-se com dificuldades neurológicas imprevisíveis sobre o curso de reabilitação que incluem déficit motor, déficits sensoriais e instabilidade psiquiátrica1. Embora a avaliação clínica é geralmente realizada verbalmente, pacientes com sTBI tais como síndrome de vigília não responde ou estado minimamente consciente têm especial dificuldade em saber se eles estão com precisão expressando seus pensamentos e emoções por causa de distúrbios de consciência, interrompeu a função cerebral e distúrbios verbal2,3. Cuidadores, familiares e equipe médica às vezes são confundidos por imprevisíveis alterações neurológicas ou a falta de resposta que pode resultar de capacidade insuficiente informativos4,5.
Recentemente, imagens do cérebro multimodal tem sido usada para explorar regional cérebro função6,7,8,9. O cérebro é o principal consumidor de energia derivada de glicose, com o metabolismo da glicose, fornecendo cerca de 95% do trifosfato de adenosina (ATP) necessária para o cérebro a funcionar a10. A absorção de [18F]-fluorodeoxyglucose (FDG) é um marcador para a absorção de glicose pelo tecido cerebral. [18-F] FDG-PET/CT pode detectar captação FDG [18F] e é, portanto, uma ferramenta útil para examinar o cérebro função11. Em geral, análise de imagem FDG [18F] é dividido em duas categorias: ROI análise e análise baseada em voxel (VBA)12. Relatórios anteriores mostram que a análise ROI é preferencial para o estudo de regiões específicas da lesão traumática. Isto é porque o VBA (como estatístico paramétrico mapeamento [SPM]) requer coregistration e normalização de um cérebro padrão, que não funciona bem em casos de TCE devido a deformação do tecido cerebral como Atrofia cerebral, inchaço, alargamento e encolhimento da espaço ventricular7,12. Embora vários algoritmos e software foram desenvolvidos para analisar dados de ressonância magnética (MRI), metais usados em cirurgia ortopédica e neurocirurgia geram ruído artefatos7,12,13 . Recentemente, o uso de photomultipliers com dispositivos de PET/CT melhorou a resolução espacial de PET/CT-derivado de imagens cérebro14. O protocolo atual enfoca semi-quantitativamente medir glicose absorção através do ROI análise na utilização de FDG-PET/CT [18F] auto-produzido traçadores FDG [18F] em pacientes com sTBI.
Protocolo
Este estudo foi realizado em conformidade com o Conselho de revisão institucional (aprovação n º 07-01) e adere aos princípios da declaração de Helsinque. Obteve-se consentimento para utilização de imagem médica de registro e cérebro de representantes legais dos pacientes. O estudo foi realizado após aprovação pelo Comitê de ética institucional (2017-14). Este protocolo foi feito seguindo as orientações da sociedade japonesa de Medicina Nuclear e Associação Europeia de Medicina Nuclear como uma referência15,16.
1. a seleção dos participantes
- Obte o consentimento informado para usar os registros médicos e imagens do cérebro dos pacientes de representantes legais dos pacientes. Uma escala de Coma de Glasgow Pontuação ≤ 8 no momento do acidente foram registrada em registro médico17,18,19 do cada paciente.
- Segure Neurologia, psicologia e conferências de equipe multidisciplinar a cada seis meses para avaliar as manifestações clínicas.
Nota: Membros da conferência devem incluir a equipe médica, tais como médicos, enfermeiros, fisioterapeutas, terapeutas ocupacionais, fonoaudiólogos, nutricionistas e médicos assistentes sociais. Não se esqueça de verificar constantemente se os pacientes podem se comunicar (verbalmente ou através de) e tomar decisões por si mesmos, porque o estado de excitação e condição neurológica são tipicamente instáveis. - Realizar avaliação clínica da função auditiva, função visual, função motora, função oromotor/verbal, função de comunicação, estado de excitação, expressão facial e outras funções relevantes, usando baterias de avaliação padrão como o Coma Recuperação-revista em escala (CRS-R), a escala de Coma de nocicepção e a matriz de lesão de cabeça de Wessex de21,20,22.
- Agenda [18F] FDG-PET/CT varreduras para os pacientes que estão clinicamente estáveis e com segurança podem participar nos exames. Somente aqueles que forneceram consentimento informado agendar ou cujos representantes legais forneceram consentimento informado, tal como consta do formulário de consentimento informado. Programe a aquisição de imagens de FDG-PET/CT [18F] perto do dia de avaliação clínica.
2. preparação do traçador no laboratório quente FDG [18F]
- No laboratório de quente, começam a fabricar os kits de reagentes para a produção automatizada de FDG sob medida para o sintetizador FDG (ver Tabela de materiais). Certifique-se de usar o programa automático para verificar a mobilidade do sistema de bombeamento no sintetizador FDG e certifique-se de que o ar não vaze o reagente. Esterilize a área de contato da máquina (esta é a hora de início).
Nota: Certifique-se de verificar o monitor de radiação no laboratório quente e usar os dosímetros de radiação portátil para verificar os níveis de radiação de cada pessoa, antes de entrarem no laboratório quente. - Verifique o volume de [16Ó] - água e [18O] - água e o volume de hélio, hidrogênio e nitrogênio no tanque de gasolina. Verificar se a temperatura da água de torneira para resfriamento primário é abaixo de 25 ° C e para o resfriamento secundário é abaixo dos 22 ° C. Use toda a água em sistema fechado (30 min após o início) para a produção.
- Começar a irradiação preliminar de [16Ó]-água no ciclotron (1h após o início). Verifique o monitor para que 2-3 mL de [16Ó]-água é irradiada em condições ideais (por exemplo, 20 µA, 5 min) na área alvo do ciclotron. Após a irradiação, instalar o frasco de [16Ó]-água em um calibrador de dose de radioisótopos e medir o nível de radioatividade (ver Tabela de materiais).
Nota: O decaimento radioativo deve ser calculado usando a seguinte fórmula.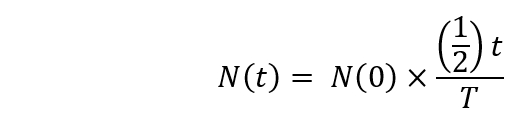
Aqui,
N(t) é os números núcleos radioativos em t = t segundos;
N(0) é os números núcleos radioativos em t = 0 segundos;
T = o Half-Life. - Começar a irradiação de [18O]-água no ciclotron (1 h 30 min após o início). Defina o tempo de bombardeio por até 20 min. e a energia dos prótons colidindo para 16,5 MeV.
- Inicie o sintetizador FDG de acordo com o operador manual22 (2h após o início). Um procedimento modificado é dada abaixo.
- Após a irradiação, usar gás hélio para transferir 2-3 mL da [18O]-água do ciclotron para o receptor do polypropylene do sintetizador FDG.
- Gancho de seringas para os drivers correspondentes de seringa, pressurizar frascos de reagente, dissolver o 1,3,4,6-Tetra-O-acetyl-2-O-trifluoromethanesulfonyl-β-D-mannopyranose em um frasco (7 ± 0,2 mL) de acetonitrilo (pureza ≥ 99.5%) e passe a fita com acetonitrilo.
- Após o bombardeio, transferir o irradiados [16Ó] - água e [18O] - água para o sintetizador de FDG.
Nota: Depois que a síntese foi iniciado, o irradiados [18O]-água se move através de um cartucho de troca de ânion (ver Tabela de materiais). Certifique-se de condição e converter o cartucho para o carbonato antes da síntese. - Após a transferência o eluente contendo a atividade [18F] sem líquido nos vasos da reação, permitem que o solvente evapore até secar. Durante o processo de secagem, adicionar pequenas quantidades de acetonitrilo para o recipiente de reação 3 x (de cada vez, adicione 80 µ l). Realize a evaporação a 95 ° C, sob vácuo e fluxo de nitrogênio.
- Adicione o precursor de manose trifluormetanosulfonato (25 mg) para o resíduo seco após dissolvendo-a em cerca de 3,5 mL de acetonitrilo (com uma pureza de ≥ 99.5%). Ocorre uma reação de substituição nucleofílica a 85 ° C no sintetizador FDG.
- Como uma purificação preliminar, misture a solução etiquetada com 26 mL de água destilada. Envie cerca de 4 mL da solução diluída rotulagem volta para o recipiente de reação para recuperar a restante actividade. Transferir a solução através do cartucho de fase reversa (ver Tabela de materiais). Enxágue o cartucho contendo o preso rotulada precursor 4 x usando 10 mL, 10 mL, mL 13 e 13 mL de água destilada sobre as sucessivas lavagens.
- Converta o composto acetilado (etiquetado precursor) em FDG dentro da cartucho através de hidrólise alcalina, usando 750 µ l de NaOH de N 2 por 2 min à temperatura ambiente.
- Após a hidrólise, recolher a solução alcalina de FDG em 7 mL de água e misture com a solução de neutralização (5 mL de tampão citrato e 1 mL de HCl de N 2).
- Purifica a solução resultante de FDG neutralizada.
- Transferir a solução FDG neutralizada através de um cartucho de reverso-fase segundo (ver Tabela de materiais), mantendo os compostos parcialmente hydrolyzed e subprodutos apolares.
- Passá-lo através de um cartucho de Alumina N (ver Tabela de materiais), mantendo os últimos traços de íons de flúor não tenha reagido [18F]. Em seguida, passá-lo através de um filtro de 0,22 µm.
- Enxaguar a gaveta e cartuchos, filtrar com 3 mL de água para recuperar o FDG residual que resta nas linhas e, em seguida, drenar o FDG para o frasco final, que contém 15-17 mL de líquido.
- Realizar uma análise qualitativa do traçador FDG [18F] (2 h 30 min após o início).
- Observe visualmente o frasco. Confirme que é transparente e que não inclui quaisquer partículas.
- Medir a quantidade de líquido usando o equilíbrio de um Roberval (deve ser de 15 a 17 mL).
- Medir a radioactividade e Half-Life, usando um calibrador de dose de radioisótopos (o mesmo que no passo 2.3, consulte Tabela de materiais) (critério: 105-115 min).
- Dispense a 0,5 mL do frasco. Realizar uma teste pureza radioquímica através de análise hidrato de carbono. Use colunas de 3,9 x 300 mm para cromatografia líquida de alta eficiência (consulte a Tabela de materiais) para detectar a radioatividade de pico (mais de 95).
Nota: Um único pico significa pureza elevada. - Medir o pH (pH 5.0-8.0), usando papel de teste de pH (veja a Tabela de materiais). Medir o residual 4,7,13,16,21,24-Hexaoxa-1,10-diazabiciclo [8.8.8] hexacosane (ver Tabela de materiais) (< 40 ppm) usando papel de teste (ver Tabela de materiais). Medir as endotoxinas com o dispositivo de medição da endotoxina apropriado através da medição de absorbância (ver Tabela de materiais) (0,25 EU/mL). Fazer um teste de esterilidade (não encontrando nenhuma bactéria depois d 8 a 37 ° C).
- Encha o frasco coberto por chumbo e o tungstênio com o localizador FDG [18F] a uma dosagem de 5 MBq/kg de peso corporal.
- Transferi o palpador FDG [18F] do laboratório quente para a sala de trabalho (3 h 25 min após o início).
3. tempo curso para aquisição de imagens cerebrais de FDG-PET/CT [18F]
- Agende os pacientes. Certifique-se de informar o pessoal para parar de nutrição e alimentação via gastrostomia. Não pare de fornecimento de água. Os pacientes devem rápida partida 7h antes da aquisição de imagem.
- Prepare a via venosa para administração de traçador FDG [18F]. Fixe uma agulha de 22 a 24-G com 5 mL de heparina de sódio (10 unidades/mL) em um dos membros inferiores antes de entrar na área de radiação controlada.
- Tenho pacientes deitar em uma maca de luz antes de entrar na área de radiação controlada. Trazer os pacientes para a área de radiação controlada e esperar por 30 min, em silêncio, enquanto a equipe médica está em stand by.
- Verifique novamente a desobstrução da via venosa por desenho o sangue com uma seringa de 10 mL. Medir os níveis de glicose no sangue com um medidor de glicose.
- Após a transferência do tracer FDG [18F] do laboratório quente para a sala de trabalho, configurá-lo no sistema de distribuição de auto e injeção (ver Tabela de materiais).
- Volte a verificar as seguintes informações (através da equipe médica): paciente número de ID, nome, aniversário, altura e peso corporal; o nome do traçador, a quantidade de traçador (água com 3,5 mL do tracer FDG [18F] + 12 mL de soro fisiológico), a radioatividade programada (5 MBq/kg), o tempo de injeção, o número de rastreamento-lote FDG [18F], a velocidade de injeção (normalmente, 0,3 mL/s) e o nível de radioatividade que foi medida no laboratório quente.
- A medição automática de radioactividade preinjected que aparece no visor do sistema de injeção e distribuição automática de registro.
- Injete o [18F] FDG rastreadoras através de via venosa preparada no passo 3.2 (3 h 30 min após o início).
- O volume residual do traçador FDG [18F], que é mostrado automaticamente no visor do sistema de injeção e distribuição automática de registro.
- Ter os pacientes esperar na sala de espera da área de radiação controlada por 50 min.
- Transferir os pacientes na sala de espera para a máquina de PET/CT (ver Tabela de materiais). Grave as imagens do cérebro por 10 min (4 h 30 min após o início).
Nota: Os parâmetros de imagem para imagens de FDG-PET/CT [18F] são o modo de lista de 10 min. Reconstrua os dados de caixas de 10 min. Os dados abaixo dos 3 min não são usados porque os sinais de baixa intensidade não são adequados. Definir parâmetros de reconstrução, a imagem: um algoritmo de reconstrução de maximização de expectativa regularizada sequencial bloco (ver Tabela de materiais); o tamanho da matriz = 192; o campo de visão = 25 cm; Β-valor: 100-200; filtro de eixo z: nenhum. - Depois de tomar as imagens, verifique a área de injeção de extravasamento. Descarte toda urina se o paciente tem um cateter de mictório com saco de urina.
- Remova o paciente da zona de radiação controlada (4 h 50 min após o início).
Nota: Consulte a Figura 1 para um diagrama esquemático do calendário de eventos (procedimento paciente e síntese do traçador FDG [18F]).
4. análise das imagens FDG-PET-CT [18F]
- Avaliar todos os dados de imagem para uma medição de valor (SUV) de absorção padronizado usando o software de imagem (consulte a Tabela de materiais).
- Selecione os pacientes.
- Atribua os dados no fluxo de trabalho de Oncologia MM .
- Clique no botão para Functional navegadores.
- Clique o VOI (volume de de interesse) limiar botão.
- Defina a esfera VOI para o navegador tridimensional.
Nota: O SUV máximo (SUVmax) e o SUV médio (SUVmean) automaticamente são medidos para o VOI de acordo com o limite de SUVmax escolhido. Certifique-se de desenhar uma borda ao redor do alvo VOI no navegador usando a esfera tridimensional, excluindo outros alvos, músculos extra-oculares e o couro cabeludo, porque eles tendem a perturbar o limite conjunto de SUV. Verifique a zona-alvo fatias axiais, coronais e sagitais. - Depois de selecionar todos os ajustes corretos, clique no botão Editar a medida .
- Altere o valor de limite (por exemplo, 50%) do VOI e clique Okey.
- Registro do SUVmax, SUVmean, volume de destino e limiar da área-alvo, que são medidos automaticamente.
- Para estericamente Visualizar o metabolismo da glicose da superfície do cérebro inteiro, use o software (consulte a Tabela de materiais) para definir um mapa de cores para as imagens de FDG-PET/CT [18F] com base na glicemia.
- Finalmente, compare a avaliação clínica com as imagens de FDG-PET/CT [18F].
Resultados
Um homem de 63 anos, que tinha sido atropelado por um carro enquanto o ciclismo foi trazido para a sala de emergência através de ambulância. O exame revelou uma pontuação da escala de Coma de Glasgow de 7 (abertura de olho = 1, melhor resposta verbal = 2, melhor resposta motora = 4), anisocoria (certo: 2 mm e esquerda: 3 mm) e uma resposta negativa da córnea17. A tomografia da cabeça mostrou hemorragia subaracnoide e intracraniana e uma fratura no c...
Discussão
Este protocolo fornece os meios para realizar uma série de cérebro-glicose avaliações metabólicas com a utilização de FDG-PET/CT [18F] auto-produziram traçador FDG [18F] em uma única instituição.
A produção do tracer FDG [18F] segue o procedimento descrito no manual do operador FDG sintetizador; no entanto, o cuidado é necessário em relação a três pontos. Em primeiro lugar, o bombardeamento tempo e energia (etapa 2.5) devem ser ajustadas de ac...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Os autores desejam agradecer Dr. Uchino no hospital de Sousen para todos os procedimentos. Os autores também agradecer Adam Phillips do grupo Emilia (www.edanzediting.com/ac) para a edição de um projecto deste manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 20ml syringe | Terumo | SS-20ESZ | |
| 10ml syringe | Terumo | SS-10ESZ | |
| 1ml syringe | Terumo | SS-01T | |
| Protective plug | Top | ML-KS | |
| Three-way cock L type 180° | Terumo | TS-TL2K | |
| Extension tube | Top | X1-50 | |
| Indwelling needle 22G or 24G | Terumo | SR-OT2225C | |
| Tegaderm transparent dressing | 3M | 1624W | |
| Hepaflash 10U/ml 10ml | Terumo | PF-10HF10UA | |
| Auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01 | |
| Fluid for auto dispensing and injection system | Universal Giken Co., Ltd. | UG-01-001 | |
| Millex-GS Syringe Filter Unit | Millipore | SLGSV255F | |
| Air needle | Terumo | XX-MFA2038 | |
| Check valve | Hakko | 23310100 | |
| Saline 500ml | HIKARI pharmaceutical Co., Ltd. | 18610155-3 | |
| Yukiban 25x7mm | Nitto | 3252 | |
| Elascot No.3 | Alcare | 44903221 | |
| Presnet No.3 27x20mm | Alcare | 11674 | |
| Steri Cotto a 4x4cm | Kawamoto | 023-720220-00 | |
| StatstripXp3 | Nova Biomedical | 11-110 | |
| Statstrip Glucose strips | Nova Biomedical | 11-106 | |
| JMSsheet | JMS | JN-SW3X | |
| Injection pad | Nichiban | No.30-N | |
| Stepty | Nichiban | No.80 | |
| Advantage Workstation | GE Healthcare | Volume Share 7. version 4.7 | |
| Discovery MI PET/CT | GE Healthcare | ||
| EV Insite | PSP | ||
| GE TRACERlab MXFDG synthesizer reagent kit | ABX | K-105TM | |
| TRACERlab MXFDG cassette | GE Healthcare | P5150ME | |
| Extension tube | Universal Giken Co., Ltd | AT511-ST-001 | |
| TSK sterilized injection needle 18x100 | Tochigiseiko | AT511-ST-004 | |
| TSK sterilized injection needle 18x60 | Tochigiseiko | AT511-ST-002 | |
| TSK sterilized injection needle 21x65 | Tochigiseiko | AT511-ST-003 | |
| Seal sterile vial -N 5ml | Mita Rika Kogyo Co., Ltd. | SSVN5CBFA | |
| k222 TLC plate | Universal Giken Co., Ltd. | AT511-01-005 | |
| Anion-cation test paper | Toyo Roshi Kaisha | 7030010 | |
| Endospecy ES-24S set | Seikagaku corporation | 20170 | |
| Sterile evacuated vial | Gi phama | 10214 | |
| 5ml syringe | Terumo | SS-05SZ | |
| Extension tube | Top | X-120 | |
| Finefilter F | Forte grow medical Co.Ltd. | F162 | |
| Millex FG | Merck | SLFG I25 LS | |
| Vented Millex GS | Merck | SLGS V25 5F | |
| Injection needle 18x38 | Terumo | NN-1838R | |
| Injection needle 21x38 | Terumo | NN-2138R | |
| Water-18O | Taiyo Nippon Sanso | F03-0027 | |
| Distilled water | Otsuka phrmaceutical | ||
| Hydrogen gas G1 | Hosi Iryou Sanki | ||
| Helium gas G1 | Hosi Iryou Sanki | ||
| Nitrogen G1 | Hosi Iryou Sanki | ||
| TRACERlabMXFDG | GE Healthcare | ||
| Sep-Pak Light Accell Plus QMA | WATERS | ||
| Sep-Pak Plus tC18 | WATERS | ||
| Sep-Pak Plus Alumina N | WATERS | ||
| HPLC with 3.9 X 300 mm columns | WATERS | ||
| US-2000 | Universal Giken CO. Ltd. | ||
| Kryptofix222 | Merck | ||
| EG Reader SV-12 | Seikagaku Corporation | ||
| UG-01 | Universal Giken Co., Ltd. | ||
| syngo.via | Siemens Healthineers | ||
| Advantage Workstation Volume Share 7, version 4.7 | GE Healthcare | ||
| Q clear | GE Healthcare | ||
| CRC-15PET dose calibrator | CAPINTEC, INC. |
Referências
- Godbolt, A. K., et al. Disorders of consciousness after severe traumatic brain injury: a Swedish-Icelandic study of incidence, outcomes and implications for optimizing care pathways. Journal of Rehabilitation Medicine. 45 (8), 741-748 (2013).
- Klingshirn, H., et al. Quality of evidence of rehabilitation interventions in long-term care for people with severe disorders of consciousness after brain injury: A systematic review. Journal of Rehabilitation Medicine. 47 (7), 577-585 (2015).
- Fischer, D. B., Truog, R. D. What is a reflex? A guide for understanding disorders of consciousness. Neurology. 85 (6), 543-548 (2015).
- Klingshirn, H., et al. RECAPDOC - a questionnaire for the documentation of rehabilitation care utilization in individuals with disorders of consciousness in long-term care in Germany: development and pretesting. BMC Health Services Research. 18 (1), 329 (2018).
- Stéfan, A., Mathé, J. F. SOFMER group. What are the disruptive symptoms of behavioral disorders after traumatic brain injury? A systematic review leading to recommendations for good practices. Annals of Physical and Rehabilitation. 59, 5-17 (2016).
- Liu, S., et al. Multimodal neuroimaging computing: a review of the applications in neuropsychiatric disorders. Brain Informatics. 2 (3), 167-180 (2015).
- Wong, K. P., et al. A semi-automated workflow solution for multimodal neuroimaging: application to patients with traumatic brain injury. Brain Informatics. 3 (1), 1-15 (2016).
- Chennu, S., et al. Brain networks predict metabolism, diagnosis and prognosis at the bedside in disorders of consciousness. Brain. 140 (8), 2120-2132 (2017).
- Di Perri, C., et al. Neural correlates of consciousnes s in patients who have emerged from a minimally conscious state: a cross-sectional multimodal imaging study. The Lancet Neurology. 15 (8), 830-842 (2016).
- Erecińska, M., Silver, I. A. ATP and brain function. Journal of Cerebral Blood Flow & Metabolism. 9 (1), 2-19 (1989).
- Lundgaard, I., et al. Direct neuronal glucose uptake heralds activity-dependent increases in cerebral metabolism. Nature Communications. 6, 6807 (2015).
- Byrnes, K. R., et al. FDG-PET imaging in mild traumatic brain injury: a critical review. Frontiers in Neuroenergetics. 5, 13 (2014).
- Mortensen, K. N., et al. Impact of Global Mean Normalization on Regional. Glucose Metabolism in the Human Brain. Neural Plasticity. , 6120925 (2018).
- Wagatsuma, K., et al. Comparison between new-generation SiPM-based and conventional PMT-based TOF-PET/CT. Physica Medica. 42, 203-210 (2017).
- Fukukita, H., et al. Japanese guideline for the oncology FDG-PET/CT data acquisition protocol: synopsis of Version 2.0. Annals of Nuclear Medicine. 28 (7), 693-705 (2014).
- Varrone, A., et al. EANM procedure guidelines for PET brain imaging using [18F]FDG, version 2. European Journal of Nuclear Medicine and Molecular Imaging. 36 (12), 2103-2110 (2009).
- Teasdale, G., Jennett, B. Assessment of coma and impaired consciousness. A practical scale. The Lancet. 2 (7872), 81-84 (1974).
- Valadka, A. B., Moore, E. J., Feliciano, D. V., Moore, E. E. Injury to the cranium. Trauma. , 377-399 (2000).
- Carney, N., et al. Guidelines for the Management of Severe Traumatic Brain Injury, Fourth Edition. Neurosurgery. 80 (1), 6-15 (2017).
- Giacino, J. T., Kalmar, K., Whyte, J. The JFK Coma Recovery Scale-Revised: measurement characteristics and diagnostic utility. Archives of Physical Medicine and Rehabilitation. 85 (12), 2020-2029 (2004).
- Schnakers, C., et al. The Nociception Coma Scale: a new tool to assess nociception in disorders of consciousness. Pain. 148 (2), 215-219 (2010).
- Shiel, A., et al. The Wessex Head Injury Matrix (WHIM) main scale: a preliminary report on a scale to assess and monitor patient recovery after severe head injury. Clinical Rehabilitation. 14 (4), 408-416 (2000).
- GE Healthcare. . TRACERlabMXFDG operator manual, Version 1. , (2003).
- Yamaki, T., et al. Association between uncooperativeness and the glucose metabolism of patients with chronic behavioral disorders after severe traumatic brain injury: a cross-sectional retrospective study. BioPsychoSocial Medicine. 12, 6 (2018).
- Schwaiger, M., Wester, H. J. How many PET tracers do we need?. Journal of Nuclear Medicine. 52, (2011).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados