Method Article
Um ensaio de alta produtividade para avaliar e quantificar a formação de neutrófilos extracelular armadilha
Neste Artigo
Resumo
Este protocolo descreve um ensaio de neutrófilos armadilha extracelular (NET) altamente sensível e alta taxa de transferência para a quantificação semi-automático de ex vivo NET formação pela microscopia confocal tridimensional de imunofluorescência. Este protocolo pode ser usado para avaliar a formação de líquido e degradação após estímulos diferentes e pode ser usado para estudar terapias NET-alvo potenciais.
Resumo
Neutrófilos armadilhas extracelulares (redes) são imunogênicas extracelulares estruturas de DNA que podem ser liberadas por neutrófilos em cima de uma grande variedade de gatilhos. As redes foram demonstradas para servir como um mecanismo de defesa do hospedeiro importante que prende e mata os microorganismos. Por outro lado, eles têm sido implicados em diversas doenças auto-imunes sistêmicas. As redes são estruturas imunogênicas e tóxicas que contêm um pool de auto-antigénios relevantes, incluindo os anticorpos anti-neutrófilos (ANCA)-associado a vasculite (AAV) e Lúpus eritematoso sistémico (SLE). Diferentes formas de redes podem ser induzidas dependendo do estímulo. A quantidade de redes pode ser quantificada utilizando técnicas diferentes, incluindo a liberação de DNA sobrenadantes, DNA-complexado com NET-moléculas como a mieloperoxidase (MPO) ou neutrófilos elastase (NE), a presença de citrulinado de medição de medição de medição histonas por microscopia de fluorescência, ou detecção de cytometric fluxo de NET-componentes que todos têm características diferentes em relação a sua especificidade, sensibilidade, objetividade e quantidade. Aqui é um protocolo para quantificar ex vivo NET formação em uma maneira altamente sensível, elevado-throughput usando microscopia confocal imunofluorescência tridimensional. Este protocolo pode ser aplicado para resolver diversas questões de investigação sobre a formação de líquido e degradação na saúde e na doença.
Introdução
A formação de neutrófilos armadilhas extracelulares (redes) é o processo no qual os neutrófilos liberar seu DNA em um extracelular web de tridimensional (3D) como a estrutura, complexado com uma grande variedade de moléculas antimicrobianas e perigosas, granulares e citoplasmáticas enzimas, peptídeos e proteínas. Estas estruturas imunogênicas e tóxicas têm um importante papel fisiológico na defesa imune inata de indivíduos saudáveis por interceptação e matando patógenos infecciosos1. No entanto, eles têm também demonstrados para ser envolvido em trombose2 e várias doenças sistêmicas auto-imunes, incluindo os anticorpos anti-neutrófilos (ANCA)-associado a vasculite (AAV)3, Lúpus eritematoso sistémico (SLE )4,5, síndrome antifosfolípide (APS)2,6, artrite reumatoide (ar), psoríase e gota7,8,9.
Formação NET in vitro tem sido estudada extensamente com o phorbol composto químico 12-miristato 13-acetato (PMA), que induz a formação maciça de líquido. No entanto mais estímulos fisiológicos induzem a níveis muito baixos de formação líquida10. Para estudo NET-gatilhos em, por exemplo, uma definição de doença auto-imune, um ensaio quantitativo padronizado, sensível, elevado-throughput é necessária para detectar e quantificar a formação líquida. Quantificação de redes tem provado para ser desafiador e atualmente é executada por métodos diferentes, cada um com suas próprias vantagens e limitações de11. Um método comumente usado é a detecção de DNA nos sobrenadantes12, qual é o objectivo mas não discrimina entre a origem do ADN (apoptose, necrose, redes) e, portanto, não é muito específico para as redes. Em segundo lugar, ensaios de enzima-lig da imunoabsorção (ELISA) de DNA-complexado com proteínas específicas NET, por exemplo, mieloperoxidase (MPO) ou neutrófilos elastase (NE), são uma abordagem mais específica para detectar redes e foram demonstrados para correlacionar bem com citrulinado histona-3 (CitH3) positivo redes13. No entanto, não se sabe se esse método é sensível o suficiente para pegar todas as redes (por exemplo, MPO, NE e CitH3 redes negativas). Uma terceira abordagem é a microscopia de imunofluorescência que é usada para detectar a localização co de moléculas associadas a NET (NE, MPO, CitH3) com DNA extracelular para quantificar as redes. Este método é geralmente específico para as redes, mas não pode ser aplicado como um método de alta produtividade e não é objetivo devido ao viés do observador. Além disso, este método não leva em conta MPO-, NE-, redes CitH3-negativo que estão frequentemente presentes dependendo do usado NET-gatilho14,15. Abordagens de citometria de fluxo detectam redes através de uma dispersão de frente/lateralmente alterada (FSC/SSC) indicando o inchaço do núcleo na NET-ting neutrófilos16. Este método não leva em conta as diferentes formas de formação líquida que foram identificados, o que não pode envolver o inchaço do núcleo, tais como a formação de líquido vital17. Por último, microscopia confocal da imunofluorescência foi aplicada para visualizar e quantificar a formação líquida pela coloração diretamente DNA extracelular com uma tintura célula-impermeável que manchas extracelular DNA12,18. Em geral, 5 a 10 campos de alta potência manualmente escolheu e avaliados, que cobre 15% de cada poço de uma placa de 96 poços11,17. Seleção manual de imagens nem sempre é objetiva, propenso a polarização e não atraente para análise de alta produtividade. Um ensaio de quantificação NET automatizada, de alta produtividade foi recentemente desenvolvido, que fotografaram a 11% do poço de forma 3D, abrangendo 13 µm através de microscopia confocal imunofluorescência Z-empilhados, levando assim a uma técnica altamente sensível para avaliar redes em comparação com os métodos convencionais de10. O presente relatório descreve o protocolo mais recente para quantificar a formação de líquido através de um ensaio automatizado, altamente sensível, utilizando microscopia confocal 3D, que atinge uma área total de imagem de 45% de cada poço e abrange 27 µm em Z-pilhas. Este protocolo é apropriado para quantificar, com uma sensibilidade elevada, baixos níveis de formação líquida de forma objectiva e imparcial.
Protocolo
Todos os pacientes e controles saudáveis consentiram em participar do Biobanco LUMC. Ambos os estudos biobanking foram aprovados pelo Comitê de ética LUMC.
1. isolamento de neutrófilos saudáveis
- Obter 20 mL de sangue periférico de um doador saudável em dois tubos de EDTA-revestidos de 10ml.
- Colocar 10 mL de sangue em um tubo estéril 50 mL e adicionar salina tamponada fosfato (PBS) até 32,5 mL.
-
Adicione o gradiente de densidade (por exemplo,., Ficoll-amidotrizoaat) sob as células.
- Leve até 14 mL de densidade gradiente com uma pipeta de 10 mL e pipeta controlador.
- Coloca a pipeta no fundo do tubo de 50 mL.
- Leve o controlador de pipeta fora a pipeta, permitindo que o gradiente de densidade flua para fora da pipeta por gravidade até o máximo for alcançado pelo efeito capilar (1-2 mL será left), sem usar o motor.
- Retire a pipeta colocando o polegar na parte superior da pipeta, evitando assim o gradiente de densidade de vazar durante a remoção da pipeta.
- Gire os tubos por 20 min em 912 x g e temperatura (RT) sem aceleração ou freio.
Nota: Glóbulos vermelhos (RBC) e neutrófilos têm uma alta densidade e na parte inferior do tubo de 50 mL. Células mononucleares de sangue periférico (PBMC) são separados e ainda por cima o gradiente de densidade como um anel branco. PBS-diluídos plasma será acima do PBMC. Se necessário, PBMCs podem ser isolados, transferir o anel branco para um novo tubo de 50 mL com etapas de lavagem adicional com PBS. - Remova cuidadosamente o anel branco contendo PBMCs primeiro, seguido de remoção do plasma PBS diluída e, por último, a camada de gradiente de densidade tanto quanto possível.
-
Para isolar os neutrófilos da mistura neutrófilos/eritrócitos, Lise eritrócitos por água destilada estéril e fria.
- Tome fria garrafa de água destilada estéril e uma 10x concentrado frasco de PBS da geladeira.
- Trabalhar rapidamente para esta etapa. Adicione 36 mL de água destilada estéril fria, diretamente sobre a pelota e misturar cuidadosamente uma vez. Adicionar 4 mL de PBS de x 10 após 20 s para fazer uma solução isotônica. Misture cuidadosamente uma vez.
- Gire o tubo por 5 min a 739 x g e 4 ° C (para a remoção de glóbulos vermelhos). Os neutrófilos será o sedimento branco.
- Cuidadosamente, desprezar o sobrenadante. Execute a etapa 1.6.2 novamente e certifique-se que o sedimento é suspensa corretamente.
- Girar o tubo por 5 min a 328 x g e 4 ° C.
- Retire o sobrenadante cuidadosamente e resuspenda o pellet em 5 mL de PBS. Contar os neutrófilos e mantê-los no gelo.
Nota: Rendimento previsto de 1 tubo de sangue (10 mL) é aproximadamente 15 milhões de neutrófilos.
2. vermelha fluorescente célula rotulagem de neutrófilos
- Faça uma suspensão dos neutrófilos de 10 milhões de neutrófilos em 2 mL de PBS em um tubo de 15 mL.
- Fazer uma solução de 2 mL de PBS com 4 µ l de vinculador de célula fluorescente vermelha 2 µM (ver Tabela de materiais) em um tubo de 15ml diferentes. Adicionar este suavemente à suspensão dos neutrófilos e misturar cuidadosamente.
- Incube no escuro para exatamente 25 min a 37 ° C, a rotular os neutrófilos com o vinculador célula fluorescente vermelha.
- Inativar a rotulagem adicionando inativada de meio RPMI 1640 contendo calor 10% de soro fetal bovino (FCS) em RT até 15 mL e misturar cuidadosamente uma vez. Certifique-se que o sedimento é cuidadosamente resuspended se formou uma bolinha.
- Girar o tubo durante 5 min à 328 x g e RT
- Remover o sobrenadante e ressuspender em 5 mL de vermelho de fenol-livre RPMI 1640 médio contendo FCS 2% e 10% P/S em RT. contar os neutrófilos.
Nota: Uma perda de células de 50% pode ocorrer após a célula fluorescente vermelha rotulagem.
3. indução de formação de neutrófilos extracelular armadilha
- Fazer uma suspensão de células de 0,42 x 106 células/mL de vermelho de fenol livre RPMI 1640 médio contendo FCS de 2% e 10% P/S.
- Adicione 37.500 neutrófilos em 90 µ l por alvéolo em uma placa de fundo preto de 96 poços, plana.
- Adicione 10 µ l do estímulo escolhido (por exemplo, o soro de paciente) em triplicado para atingir uma concentração de 10% no poço. Sempre inclua um controle negativo (médio) em triplicado.
- Incube no escuro a 37 ° C durante o tempo desejado, que variam de 30 min para 2, 4 ou 6 h. Incubar por 4h é sugerido.
- Calcule o volume necessário para adicionar 25 µ l de DNA impermeáveis de 5 µM tingir (ver Tabela de materiais), para atingir uma concentração final de 1 µM no poço. Faça uma pré diluição se necessário em RPMI 1640 médio contendo FCS de 2% e 10% P/S para obter uma concentração de 5 µM.
- Adicione 25 µ l de 5 µM impermeable DNA tintura 15 min antes do final do tempo de incubação. Continue a incubação por mais 15 minutos a 37 ° C, no escuro.
- Remover o sobrenadante (~ 125 µ l) com muito cuidado e armazenar se necessário. Adicione 100 µ l de paraformaldeído 4% (PFA). Manter no escuro e imediatamente, continue com o passo 4.
4. líquida visualização com microscopia Confocal 3D de alta resolução, alto teor imunofluorescência
-
Defina as configurações para o microscópio de imunofluorescência confocal clicando sobre a configuração de aquisição.
- Clique na guia Configurar .
- Selecione o objetivo e a câmera. Escolha o objetivo X Apo Lambda 10 com um modo de aquisição de um confocal 60 µm pinhole.
- Clique na placa e escolher a placa plástica de 96 poços. Selecione os locais a visitar e escolher um número fixo de sites. Preencha 3 colunas e 3 linhas sem sobreposição (0 µm), que cobrem um total de 45% do poço.
- Clique na aquisição. Selecione Ativar baseados em Laser com foco. Se necessário, selecione Adquirir Z série/séries .
- Clique no Site Autofocus.
- Clique em foco na placa inferior | Off-Set pela espessura do fundo. Para encontrar a amostra, escolha o primeiro poço, o poço inicial adquiridos. Para o autofocus do local, escolha todos os sites.
- Clique em comprimentos de onda.
- Para o número de comprimentos de onda, escolha 2. Para o nível de refinamento de correção do TL sombreamento, escolha 2.
- Para o comprimento de onda 1, selecione Vermelho Texas.
- Para as opções de focagem automática, selecione laser com deslocamento Z, post laser deslocamento 1.1 µm. uso Z-pilha com um intervalo personalizado de 200-10.
- Para o comprimento de onda 2, selecione FITC.
- As opções de focagem automática, selecione a laser com deslocamento Z de w1 0 µm. uso Z-pilha com um intervalo personalizado de 200-10.
- As opções de aquisição, selecione a série Z e imagem 2D projeção máxima. As opções de aquisição, selecione correção sombreamento | Fora.
- Selecione a série Z. Selecione o número de passos: 10. Selecione o tamanho de etapa: 3mm (intervalo total será de 27 µm).
-
Colocar a placa na microscopia confocal da imunofluorescência.
- Clique na aba executar .
- Preencha a descrição e o nome do prato e escolher o local de armazenamento.
- Selecione os poços que precisam ser adquiridos.
- Clique na aba executar .
- Escolha o tempo de exposição para Texas Red e FITC.
- Clique na Placa de adquirir para iniciar a aquisição, o que levará cerca de 1 h por placa.
5. análise da formação líquida
- Use uma programa projetado para análise de imagens multidimensionais científicas (ver Tabela de materiais) para analisar a formação de rede de processamento de imagem.
- Transferi os dados de imagem adquirida para um disco rígido separado.
-
Selecione a cor adicionando ferramenta.
- Selecione w1 e escolher a pasta no disco rígido onde os dados são armazenados.
- Selecione w2 e escolher a pasta no disco rígido onde os dados são armazenados.
Nota: Use uma macro padrão que usa w1 no nome do arquivo para adicionar a cor vermelha para as imagens de Texas Red e usa w2 para adicionar a cor verde para as imagens FITC.
-
Selecione a Macro de análise.
- Selecione w1, escolha o valor de limiar (limiar de intensidade), que normalmente é 10. Selecione o valor de pixel desejado (limite de tamanho, por exemplo, 100).
- Selecione w2, escolha o valor de limiar (limiar de intensidade), que normalmente é 10. Selecione o valor de pixel desejado (limite de tamanho, por exemplo, 500).
- Escolha o destino para o arquivo de planilha, executar análise e salvar arquivos de log depois.
- Analise os dados em uma planilha.
Resultados
Formação dos neutrófilos armadilha extracelular (NET) é quantificada de forma 3D através da quantificação de DNA extracelular manchada sobre 10 Z-pilhas com 3 µm distância, começando no plano focal em cada poço. Medindo a área cumulativa, a sensibilidade dos aumentos do ensaio (figura 1A). Os neutrófilos isolados têm uma pureza média de 98,7% com desvio padrão (SD) de 1,10%, medido em 14 diferentes amostras de diferentes isolamentos. O percentual médio de glóbulos vermelhos é 1,04% ± 1,1% SD e a percentagem média de monócitos é 0,085% ± 0,17% SD (dados não mostrados). A área total de neutrófilos manchadas fotografada são quantificados apenas no plano focal em cada poço, que correlacionam significativamente com a contagem total de neutrófilos em cada poço com um coeficiente de correlação de Pearson de 0,99 (intervalo de confiança de 95% [CI] 0.985-0.997, p < 0,0001) (figura 1B). O resultado representativo da quantificação da formação líquida em neutrófilos estimulados com 10% de soros de pacientes AAV ou médio (MED) como controlo negativo, expressado como cumulativa área manchada de DNA extracelular mais de 10 pilhas de Z por imagem neutrófilos (Figura 1 C). Snapshots de imagens representativas de neutrófilos unstimulated (Figura 2A) e de redes em neutrófilos estimulados a AAV (Figura 2B) são mostrados.
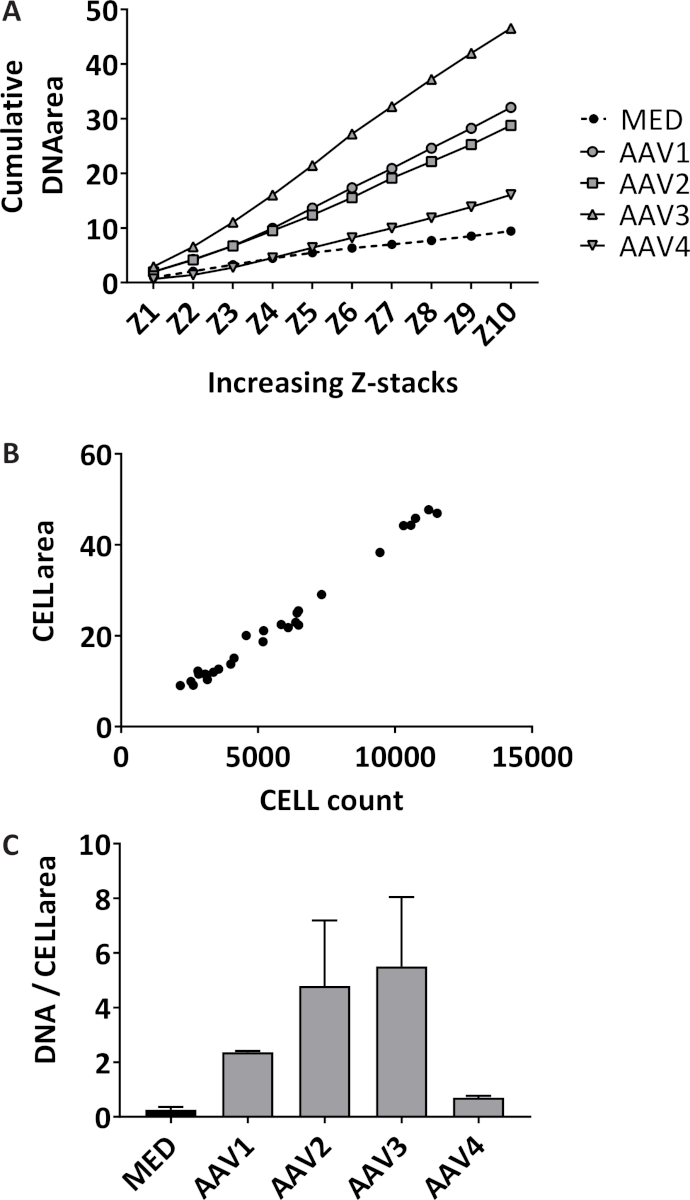
Figura 1: quantificação da formação líquida medindo DNA extracelular e contagem de neutrófilos. (A) área cumulativamente é quantificada sobre os Z 10-pilhas para cada bem para unstimulated neutrófilos (MED) e para os neutrófilos estimulados com 10% de soro de vasculite ANCA associada pacientes (AAV) (n = 4) quantificada com um programa de processamento de imagem. Cada estímulo foi testado em triplicado, cada ponto representa o valor mediano. (B) vermelho fluorescente etiquetado área e célula glóbulos foram quantificados no plano focal de cada poço pelo programa de processamento de imagem (R2 = 0.99, p < 0,0001). (C) formação de líquido é expresso como área cumulativa por imagem neutrófilos (área de celular). Média ± erro padrão da média (SEM) de cada triplicado é plotado por estímulo. Clique aqui para ver uma versão maior desta figura.
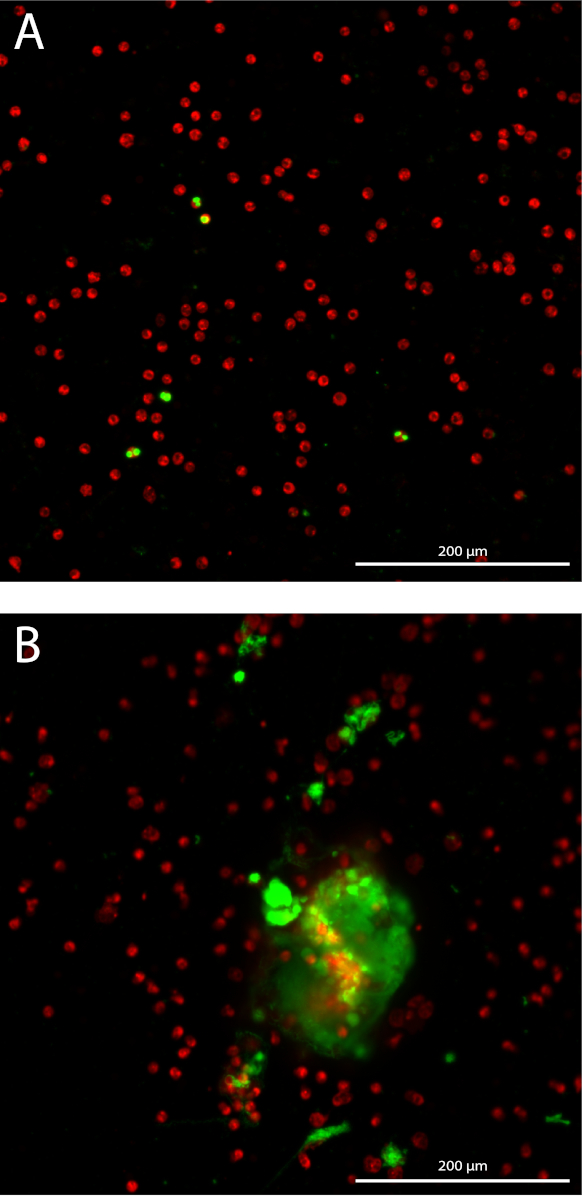
Figura 2: instantâneos do ensaio de quantificação NET. Neutrófilos rotulados fluorescentes são mostrados em vermelho e manchado DNA extracelular é mostrado em verde. 10 x objetivo planejar Apo Lambda. (A) Unstimulated neutrófilos. (B) neutrófilos estimulados com soro AAV. Clique aqui para ver uma versão maior desta figura.
Discussão
A parte mais crítica do presente ensaio é a necessidade de usar neutrófilos recém isolados para cada experimento porque os neutrófilos são de curta duração e morrem quando congelado. Isso requer um doador saudável de cada vez, o que poderia implicar algumas variações devido às características do doador. Dentre essas variações é o status de ativação dos neutrófilos. Os neutrófilos podem ser ativados já in vivo antes do isolamento. Além disso, os neutrófilos podem ser ativados durante as etapas de isolamento notavelmente durante a lise de eritrócitos, portanto um experiente manipulador de neutrófilos é necessário para minimizar a ativação de neutrófilos. Em geral, isolamento de neutrófilos deve ser realizado logo que possível após o sangue de desenho e o experimento não deve ser interrompido para evitar a excessiva ativação espontânea. Em segundo lugar, deve ser evitado o manuseio indevido de neutrófilos. Como tal, a vantagem notável do protocolo descrito é as intervenções de pipetagem mínimas quando os neutrófilos são semeados em uma placa de 96 poços. Importante, o status de ativação de neutrófilos a é melhor avaliado no estado unstimulated, no qual este ensaio com sensibilidade pode detectar níveis baixos de formação líquida. Outro fator que pode influenciar o ensaio é o uso de FCS no meio. A porcentagem de FCS tem sido diminuiu de 10% para 2% para evitar a possível supressão de formação líquida de19,de atividade antioxidante20 ou a possível ativação dos neutrófilos apesar de inactivação de calor. Cultura sem FCS ou com os uso de diferentes tipos de mídia não foi julgada. Um controle unstimulated ou médio é sempre levado ao realizar o ensaio para indicação do sinal de fundo (por exemplo,, status da ativação de neutrófilos a). O aumento de dobra para cada estímulo em comparação com a amostra unstimulated é exibido para alcançar resultados consistentes ao longo de diferentes experiências utilizando o mesmo estímulo.
Um fator importante para um possível fundo elevado é coloração de DNA extracelular que está relacionada com o processo de formação de líquido. O presente ensaio tenta reduzir isto removendo a coloração de DNA extracelular imediatamente após o período de incubação curto de 15 min e analisando a placa diretamente após a fixação. Portanto, é essencial usar um microscópio confocal avançado que tenha bastante velocidade e poder analítico para capturar a placa de 96 poços dentro de 1 a 2 h automatizada, recomenda-se a configuração do tempo de exposição e foco. Como tal, o ajuste do microscópio pode variar entre cada amostra e experimentar com respeito o limiar de intensidade de cor que é necessário para qualidade de imagem ideal em geral. As último influências a eventual capacidade de quantificar corretamente os neutrófilos e redes e a configuração ideal, portanto, deve ser confirmada por meio de amostras múltiplas de controle (por exemplo, o soro de controles saudáveis). Durante a análise de imagens capturadas, o uso de um pixel limite e limite de tamanho do programa de análise permite uma melhor seleção de formação líquida.
DNA extracelular derivada da formação de líquido pode ser o resultado de percursos distintos de morte, incluindo NETosis, necroptosis, pyroptosis, ferroptosis ou até mesmo não-lítica processo de formação de líquido vital1. Como tal, uma limitação do presente ensaio é que pela coloração somente para DNA extracelular não há nenhuma diferenciação possível entre formação líquida e outras vias de morte celular relevantes. É possível obter isso usando ambos inibidores seletivos de percursos distintos de morte para discriminar entre as diferentes formas que sustentam a formação líquida ou confirmar por separado immunostainings a presença de marcadores específicos de líquidos, tais como citH3 e NE, co localizados com DNA. A localização co do DNA extracelular com citH3 e NE recentemente foi confirmada para este ensaio10. A vantagem de evitar líquidos marcadores específicos neste ensaio, permite avaliar todas as formas de formação líquida levando a extrusão do DNA por neutrófilos tão completo e tão objectiva quanto possível com o potencial de seleção da elevado-produção. A aplicabilidade do presente protocolo foi mostrada no estudo de baixa nível líquido da indução mediada por complexos imunes em doença auto-imune em que a capacidade de detectar diferenças qualitativas e quantitativas pode ser mais importante do que o tipo de processo envolvidos10,21,22. Ilustrando o que este ensaio de quantificação NET romance pode ser de valor acrescentado para diferentes pesquisadores investigar vários aspectos da formação líquida. Pequenos ajustes para o ensaio são facilmente implementados: ajuste do período de estimulação, o uso de um marcador de NET favorito para concentrar-se no caminho de uma morte específicos levando a formação de líquido, o uso de uma ampliação diferente ou o uso de diferentes critérios de líquido em a quantificação e análise.
Em conclusão, o protocolo fornecido é um ensaio de amplamente aplicável de altamente sensível para a quantificação semi-automático de formação líquida para a avaliação da indução ex vivo de redes mediante diferentes estímulos.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
O trabalho de Eline J. Arends e YK Onno Teng é suportado pela rim holandesa Foundation (17OKG04), Fellowship clínico da organização do Países Baixos para a investigação científica (90713460). Trabalho da Laura S. van Dam é apoiado pela Fundação para a pesquisa em Reumatologia (FOREUM).
Materiais
| Name | Company | Catalog Number | Comments |
| Aqua Sterile H2O | B. Braun, Melsungen, Germany | 12604052 | |
| Fetal bovine serum (FCS) | Bodinco, Alkmaar, The Netherlands | Used in high concentrations it could influcence NET formation | |
| Ficoll 5.7% - amidotrizoaat 9% density 1.077 g/mL | LUMC, Leiden, The Netherlands | 97902861 | |
| Immunofluorescence confocal microscope | Image Xpress Micro Confocal (Molecular Devices, Sunnyvale, CA, USA) | ||
| Neutralization PBS (10x) | Gibco, Paisley, UK | 70011-036 | |
| Penicillin/streptomycin (p/s) | Gibco, Paisley, UK | 15070063 | |
| Phenol red free RPMI 1640 (1x) | Gibco, Paisley, UK | 11835-063 | Phenol red can interfere with the immunofluorescence signal |
| Phosphate-buffered saline (PBS) | B. Braun, Melsungen, Germany | 174628062 | |
| PKH26 2 μM Red fluorescent cell linker | Sigma Aldrich Saint-Louis, MO, USA | PKH26GL-1KT | PKH are patented fluorescent dyes and a cell labeling technology named after their discoverer Paul Karl Horan |
| Program for scientific multidimensional images analysis | ImageJ, Research Services Branch, National Institute of Mental Health, Bethesda, Maryland, USA | ||
| RPMI medium 1640 (1x) | Gibco, Paisley, UK | 52400-025 | |
| Sytox green 5 mM Impermeable DNA dye | Gibco, Paisley, UK | 57020 | |
| Trypan blue stain 0.4% | Sigma Aldrich, Germany | 17942E | |
| 96 well, black, flat bottom, tissue culture treated plate | Falcon, NY, USA | 353219 |
Referências
- Jorgensen, I., Rayamajhi, M., Miao, E. A. Programmed cell death as a defence against infection. Nature Reviews Immunology. 17 (3), 151-164 (2017).
- Rao, A. N., Kazzaz, N. M., Knight, J. S. Do neutrophil extracellular traps contribute to the heightened risk of thrombosis in inflammatory diseases?. World Journal of Cardiology. 7 (12), 829-842 (2015).
- Kessenbrock, K., et al. Netting neutrophils in autoimmune small-vessel vasculitis. Nature Medicine. 15 (6), 623-625 (2009).
- Garcia-Romo, G. S., et al. Netting neutrophils are major inducers of type I IFN production in pediatric systemic lupus erythematosus. Science Translational Medicine. 3 (73), 73ra20 (2011).
- Lande, R., et al. Neutrophils activate plasmacytoid dendritic cells by releasing self-DNA-peptide complexes in systemic lupus erythematosus. Science Translational Medicine. 3 (73), 73ra19 (2011).
- Meng, H., Yalavarthi, S., et al. In Vivo Role of Neutrophil Extracellular Traps in Antiphospholipid Antibody-Mediated Venous Thrombosis. Arthritis & Rheumatology. 69 (3), 655-667 (2017).
- Desai, J., et al. Particles of different sizes and shapes induce neutrophil necroptosis followed by the release of neutrophil extracellular trap-like chromatin. Scientific Reports - Nature. 7 (1), 15003 (2017).
- Desai, J., et al. PMA and crystal-induced neutrophil extracellular trap formation involves RIPK1-RIPK3-MLKL signaling. European Journal of Immunology. 46 (1), 223-229 (2016).
- Apel, F., Zychlinsky, A., Kenny, E. F. The role of neutrophil extracellular traps in rheumatic diseases. Nature Reviews Rheumatology. , (2018).
- Kraaij, T., et al. A novel method for high-throughput detection and quantification of neutrophil extracellular traps reveals ROS-independent NET release with immune complexes. Autoimmunity Reviews. 15 (6), 577-584 (2016).
- Masuda, S., et al. NETosis markers: Quest for specific, objective, and quantitative markers. Clinica Chimica Acta. 459, 89-93 (2016).
- Brinkmann, V., Goosmann, C., Kuhn, L. I., Zychlinsky, A. Automatic quantification of in vitro NET formation. Frontiers in Immunology. 3, 413 (2012).
- Nakazawa, D., et al. Enhanced formation and disordered regulation of NETs in myeloperoxidase-ANCA-associated microscopic polyangiitis. Journals of the American Society of Nephrology. 25 (5), 990-997 (2014).
- Konig, M. F., Andrade, F. A Critical Reappraisal of Neutrophil Extracellular Traps and NETosis Mimics Based on Differential Requirements for Protein Citrullination. Frontiers in Immunology. 7, 461 (2016).
- Kenny, E. F., et al. Diverse stimuli engage different neutrophil extracellular trap pathways. Elife. 6, (2017).
- Zhao, W., Fogg, D. K., Kaplan, M. J. A novel image-based quantitative method for the characterization of NETosis. Journal of Immunological Methods. 423, 104-110 (2015).
- Pilsczek, F. H., et al. A novel mechanism of rapid nuclear neutrophil extracellular trap formation in response to Staphylococcus aureus. The Journal of Immunology. 185 (12), 7413-7425 (2010).
- Tanaka, K., et al. In vivo characterization of neutrophil extracellular traps in various organs of a murine sepsis model. PLoS One. 9 (11), e111888 (2014).
- Fuchs, T. A., et al. Novel cell death program leads to neutrophil extracellular traps. Journal of Cell Biology. 176 (2), 231-241 (2007).
- von Köckritz-Blickwede, M., Chow, O., Nizet, V. Fetal calf serum contains heat-stable nucleases that degrade neutrophil extracellular traps. Blood. 114 (25), 5245-5246 (2009).
- Kraaij, T., et al. Excessive neutrophil extracellular trap formation in ANCA-associated vasculitis is independent of ANCA. Kidney International. , (2018).
- Kraaij, T., et al. The NET-effect of combining rituximab with belimumab in severe systemic lupus erythematosus. Journal of Autoimmunity. , (2018).
- Hahn, J., Schauer, C., et al. Aggregated neutrophil extracellular traps resolve inflammation by proteolysis of cytokines and chemokines and protection from antiproteases. The FASEB Journal. (Aug 21), (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados