Method Article
Um dispositivo de posicionamento para a colocação de camundongos durante a entrega de siRNA intranasal ao sistema nervoso central
Neste Artigo
Resumo
Aqui, nós apresentamos um protocolo usando um dispositivo de posicionamento do rato que permita a colocação apropriada dos ratos para a administração intranasal de uma formulação do peptide-siRNA do cérebro-alvejando permitindo o silenciamento de gene eficaz no sistema nervoso central.
Resumo
A entrega da droga intranasal (IN) ao cérebro emergiu como um método prometedor para contornear a barreira do sangue-cérebro (BBB) para a entrega das drogas no sistema nervoso central (CNS). Os estudos recentes demonstram o uso de um peptide, RVG9R, incorporando o domínio receptor-obrigatório mínimo da glicoproteína do vírus de raiva, em eliciando a entrega de siRNA em neurônios no cérebro. Neste protocolo, a formulação do peptídeo-siRNA é entregada intranasal com uma pipeta na mão dominante, quando o rato anestesiado for contido pelo scruff com a mão nondominante em uma "posição para baixo e para a frente da cabeça" para evitar a drenagem no pulmão e estômago após a inalação. Esta preensão exata dos ratos pode ser aprendida mas não é fácil e exige a prática e a habilidade de conduzir à tomada eficaz do CNS. Além disso, o processo é longo-desenhado, exigindo cerca de 45 min para a administração de um volume total de ~ 20-30 μL de solução em 1-2 μL de volumes de gotas por inalação, com períodos de repouso de 3-4 min entre cada inalação. O objetivo deste estudo é divulgar um dispositivo de posicionamento do rato que permita a colocação apropriada de ratos para eficiente na administração da formulação do peptide-siRNA. As características múltiplas são incorporadas no projeto do dispositivo, tal como quatro ou oito cadeiras de posicionamento com altura e inclinação ajustáveis para conter os ratos anestesiados na posição para baixo e para diante da cabeça, permitindo a visualização fácil das narinas dos ratos e de um almofada de aquecimento incorporado para manter as temperaturas do corpo dos ratos durante o procedimento. Importante, a habilidade de tratar quatro ou oito ratos simultaneamente com os complexos de RVG9R-siRNA desta maneira permite estudos em uma escala de tempo muito mais rápida, para o teste de um na aproximação terapêutica do siRNA. Em conclusão, este dispositivo permite o posicionamento apropriado e controlado da cabeça do rato para na aplicação de RVG9R-siRNA e de outras moléculas terapêuticas, tais como nanopartículas ou anticorpos, para a entrega do CNS.
Introdução
O BBB previne moléculas administradas sistemicamente de > 400-600 da de entrar no cérebro, representando um desafio significativo para a entrega de biomoléculas terapêuticas para doenças que afetam o SNC e o cérebro1. A entrega direta da droga ao cérebro pode ser conseguida pela injeção stereotactic; no entanto, isso requer experiência cirúrgica e é altamente restrito ao parto para áreas proximais ao local da injeção, tornando-o inadequado para uso clínico de rotina2. Na entrega ao cérebro também pode resultar em entrega cerebral direta por ignorando o BBB, permitindo a transferência direta e rápida de uma variedade de substâncias para o cérebro3,4. Esta transferência é pensada para ocorrer por mecanismos do transporte através dos nervos olfactory e do trigeminal que conectam a passagem nasal ao cérebro, ao líquido cerebrospinal, e aos sistemas linfáticos5. Como a rota direta nariz-a-cérebro não envolve órgãos e tecidos periféricos, reduz substancialmente os efeitos colaterais sistêmicos e melhora a potência. NA administração é uma alternativa não invasiva promissora para as rotas locais e sistêmicas para a entrega cerebral de agentes terapêuticos e pode representar uma abordagem poderosa para combater distúrbios neurológicos, incluindo a doença de Alzheimer, a doença de Parkinson, e câncer cerebral, e está sendo explorado em vários ensaios clínicos6,7,8.
Vários fatores experimentais, como o volume e o método de inoculação, bem como o pH da formulação, influenciam fortemente a entrega do fármaco ao SNC através da via do nariz para o cérebro9. Em estudos com camundongos, o sucesso da IN na entrega da droga depende fortemente do posicionamento adequado da cabeça, o que é crítico para o depósito cerebral eficiente e para evitar a drenagem de drogas no ambiente externo ou nas vias aéreas. Notavelmente, a maioria dos estudos de roedores empregam uma posição de cabeça para trás (supina) com uma inclinação de 70 °-90 ° para a entrega de fármacos ao epitélio olfativo, embora o posicionamento da cabeça a 0 ° possa favorecer a drenagem na traquéia9. NA entrega de drogas em camundongos que estão acordados resulta em redução do depósito cerebral em comparação com qualquer aplicação na posição supina, principalmente devido à incapacidade dos cientistas para segurar os ratos na posição desejada por longos períodos de tempo. Além disso, a posição de cabeça para baixo exigida pelo método do aperto da pele empregada para ratos acordados conduz ao depósito da droga predominante no nervo de trigeminal e no bulbo olfactory, assim como órgãos periféricos, tais como rins e pulmões, dentro de 30 minutos pós-inoculação10. A posição corporal mais adequada para a realização da terapêutica através dos nervos olfatório ou trigeminal em animais maiores, como primatas não humanos em estudos clínicos, parece ser a posição de cabeça para baixo e para frente (ou seja, a chamada "orando para Meca posição ")11. No entanto, esta posição não foi bem estudada no modelo do rato, e a posição supina é mais amplamente utilizada em estudos de roedores.
Previamente, nós mostramos que o RVG9R, um peptide projetado baseado no domínio obrigatório do receptor mínimo do vírus da raiva, indica o tropismo às pilhas que expressam subunidades nicotínico do receptor da acetilcolina como neurônios e macrófagos e Medeia o entrega intracelular de siRNA por um mecanismo envolvendo o acoplamento do receptor e a delocalização temporária da membrana plasmática no local da agregação do receptor12,13. Importante, a administração intravenosa sistemática de complexos de RVG9R-siRNA permite a entrega escapamento do siRNA no CNS14. No entanto, a via sistêmica dilui a quantidade de siRNA entregue ao SNC, e os dados recentes demonstram que a administração de IN de RVG9R: complexos de siRNA para camundongos posicionados na posição de cabeça para baixo e para frente provoca knockdown de gene alvo de grande propagação em várias regiões do cérebro15. Importante, este nível de knockdown foi conseguido com tão pouco quanto 13,5 μg de siRNA administrado ao longo de um regime de quatro doses, 2 dias, enquanto a via IV requer uma dose de ~ 5 vezes maior por injeção para conseguir knockdown comparável. A única lacuna da abordagem IN é que é um procedimento árduo, exigindo o uso de ambas as mãos durante a administração da solução, enquanto continuamente segurando os camundongos alternativamente na cabeça para baixo e para a frente e em posições descontraídas entre cada inalação por um período considerável de tratamento prolongado (um procedimento de 30-45 min para a absorção efetiva de um volume de ~ 20-30 μL por rato). Usando o dispositivo de posicionamento do mouse apresentado aqui permite a colocação adequada de camundongos com pouca coação física para os animais e o pessoal que executa o protocolo, bem como o tratamento de múltiplas coortes de camundongos dentro de um período de tempo razoável, permitindo um estudo aprofundado sobre o uso de siRNAs como terapêutica para a encefalite do Nilo Ocidental em camundongos em estágios tardios da doença15.
Protocolo
Todos os experimentos foram realizados em conformidade com as diretrizes e protocolos aprovados pelo Comitê de cuidado e uso de animais da Universidade de Hanyang. Neste protocolo, foram utilizados camundongos Balb/c de 6 semanas de idade, pesando 20-25 g (n = 3 por grupo). Os animais foram alojados em uma instalação livre de patógenos com 12 h de luz/ciclos escuros em um nível de temperatura e umidade controlada com acesso livre à água e alimentos.
1. montagem do dispositivo
- Monte as partes individuais do dispositivo de posicionamento como mostrado na Figura 1a.
Nota: o dispositivo é fornecido em peças individuais que podem ser facilmente montadas e desmontadas.
2. configuração do material
Nota: a administração IN de medicamentos liquefeitos requer as seguintes etapas de pré-tratamento.
- Prepare os materiais exigidos, incluindo o dispositivo de posicionamento, uma micropipeta de 10 μL, 10 pontas da micropipeta do μL, uma solução do tratamento (por exemplo, complexo de RVG9R-siRNA), um pulso de disparo do temporizador, e 70% etanol (refira a Figura 2a).
- Ligue o código de alimentação para ligar o sistema de aquecimento do dispositivo, pelo menos, 15-20 min antes do experimento. A temperatura ideal para experimentos com animais é mantida automaticamente a ~ 37 ° c.
- Prepare a anestesia cetamina: xilazina: solução salina tamponada por fosfato (PBS) em uma proporção de 1:0,5:8,5 e anestesie cada rato com uma única injeção intraperitoneal (i.p.) em um volume final de 200 μL por rato de 20 g.
Nota: por favor, note que qualquer medicamento otimizado para garantir a condição de anestesia por um período de 30-45 min pode ser usado.
3. posicionamento do mouse
- Avaliar o nível de anestesia por pedal Reflex (firme Toe pinch) para manter o plano cirúrgico.
- Coloc o dispositivo de posicionamento em uma distância e em uma altura apropriadas para fornecer o acesso conveniente a todos os reagentes exigidos.
- Uma vez que os ratos são devidamente anestesiados, levante suavemente cada rato pelo scruff de seu pescoço com o dedo polegar e ponteiro e colocá-lo na cadeira designada.
- O posicionamento apropriado do rato na cadeira é muito importante nesta fase. Coloque a parte traseira do rato paralela ao apoio traseiro da cadeira, e em 90 ° ao assento da cadeira. Levante as mãos do rato e deixe que o animal se deite naturalmente na posição de cabeça para baixo e para a frente, sem empurrar ou pressionar, como mostrado na Figura 2b. Certifique-se de que os membros anteriores do mouse forneçam suporte natural enquanto o animal está nesta posição relaxada, sem qualquer desconforto para o mouse.
- Uma vez que os ratos são posicionados corretamente, cinta os ratos com o cinto da cadeira, e imediatamente iniciar a inoculação.
4. entrega intranasal
Observação: Este protocolo descreve o IN entrega de RVG9R: siRNA complexos usando o dispositivo de posicionamento do mouse. Usando este protocolo, um máximo de 20-30 μL de solução pode ser facilmente administrado a cada rato em 2 μL de gotas. Este volume é inferior ao da cavidade nasal do rato, que é de 0, 32 cm3, de modo que o procedimento não resulta em obstrução da narina letal ou asfixia. Este protocolo permite a inoculação simultânea de pelo menos quatro camundongos e um máximo de oito camundongos por dispositivo, resultando em otimização de tempo e redução da variabilidade.
- Tome a micropipeta de 10 μL e ajuste-a para 2 μL.
- Carregar a micropipeta com 2 μL de RVG9R: solução complexa de siRNA (por exemplo, 5,2 μg de siCy5 complexado com 104 μg de RVG9R para o experimento de parto e 13,5 μg de siSOD1 complexado com 270 μg de RVG9R para o experimento de silenciamento, em um volume final de 25 μL de PBS contendo 5% de glicose.
- Enquanto segura a pipeta na mão dominante, ajuste a posição colocando um cotovelo na parte superior do banco. Apoie a mão segurando a pipeta com a outra mão para evitar movimentos descontrolados durante a administração.
- Coloque uma gota de ~ 2 μL muito perto de uma narina para que o rato possa inalar diretamente a gota (consulte a Figura 2b). Se uma pequena gota não for facilmente formada, substitua a ponta da pipeta por uma nova e repita a operação. Use o cronômetro para verificar o intervalo de tempo entre as inoculações.
- Este dispositivo permite o tratamento de pelo menos quatro ratos de cada vez. Se outro grupo de camundongos for necessário para repetir a etapa 4,4, defina outra barra com quatro cadeiras acima ou abaixo da primeira barra com quatro cadeiras para acomodar até oito camundongos por vez no dispositivo.
- Repita a etapa 4,4 com a outra narina após 3-4 min da primeira inoculação. Este intervalo de tempo é suficiente para o rato para completar a inalação da primeira dose e restaurar a respiração normal. Se uma gota da solução inalada for desalojada devido a um ronco acidental das Naris do rato, reocultar um adicional de 2 μL de solução.
- Repita todo o processo com narinas alternadas até que a dose de 20-30 μL esteja terminada. Levará ~ 30-45 min para completar todo o procedimento de inoculação.
- Põr a pomada molhada sobre os olhos dos ratos antes de retornar os ratos de volta a suas gaiolas designadas.
Nota: não deixe os ratos desacompanhado até que tenham recuperado a consciência suficiente para manter a recumbência esternal.
5. análise de dados
- Para confirmar a deposição cerebral de fluor-rotulados RVG9R, anestesiam os camundongos (conforme descrito na etapa 2,3) e isolam o cérebro, bem como outros órgãos periféricos, como pulmão, fígado, baço e rim. Coloque cada órgão no ImageStation e visualize a fluorescência usando o ImageStation.
- Para visualizar a fluorescência devido ao Cy5-Label, Prepare 20 Cryosections μm-grossos, costained com Hoechst 33342, e realize a exploração do cheio-cérebro com um microscópio confocal.
- Para avaliar o silenciamento genético, extraia o RNA de várias regiões cerebrais, como o bulbo olfativo, o córtex, o hipocampo, o tálamo, o hipotálamo, o cerebelo e o tronco cerebral, com um kit de purificação de RNA, transcrito-reverso em cDNA usando um cDNA Kit de síntese, e executar qPCR com pares de primer como descrito anteriormente15.
Resultados
A posição principal durante a administração de IN é uma influência principal na eficiência da entrega da droga ao cérebro. Aqui nós descrevemos a posição de cabeça para baixo e para frente usando um dispositivo de posicionamento do mouse para a administração de uma formulação de peptídeo-siRNA de segmentação cerebral para a entrega da mistura ao CNS do mouse. Para verificar a entrega através da rota, utilizou-se o peptídeo RVG9R, previamente mostrado para ligar eficientemente às células neuronais tanto in vitro como in vivo14,15.
Primeiro testamos a entrega de nariz para cérebro do peptídeo RVG9R rotulado com Alexa fluor 488 (RVG9R-A488) usando o dispositivo de posicionamento do mouse descrito aqui. Em 48 h pós-inoculação, vários órgãos, incluindo o cérebro, o seio, os pulmões, o fígado, o baço e os rins foram extirpado para medir a fluorescência de488 associada ao tecido. Um488 isoladamente, ou um peptídeo de controle (RVM9R-a488)14 que não liga Nachr, foram usados como controles negativos. Como esperado, nem um488 nem RVM9R-a488 foram detectados em nenhum dos órgãos em 48 h pós-inoculação (Figura 3a, esquerda). Por outro lado, um forte sinal fluorescente A488 foi detectado exclusivamente no cérebro do grupo INOCULADO com RVG9R. Além disso, comparamos esta posição de colocação do rato ao método de posição supina que tem sido utilizada anteriormente17, bem como ao método acordado, para a eficácia. Inoculamos uma quantidade fixa de RVG9R-A488 (100 μg) e biodistribuição ensaiada a 48 h de pós-inoculação. Os resultados indicaram que o posicionamento dos camundongos cabeça para baixo e para frente melhorou a penetrância e deposição de RVG9R-A488 em todo o tecido cerebral (Figura 3a, direita). Em contrapartida, os animais inoculados em posição supina resultaram na entrega de RVG9R-a488 ao cérebro, mas não tão forte como visto com o método de posicionamento do dispositivo. Para confirmar ainda mais a entrega do siRNA ao cérebro, nós executamos a exploração do completo-cérebro após uma única administração de in de RVG9R complexado a 400 pmol (5,2 μg) de Cy5-etiquetado siRNA. Em contraste com a PBS ou RVM9R, complexando com RVG9R resultou em um forte acúmulo de siRNA nas principais regiões cerebrais, incluindo o bulbo olfativo, o córtex, o hipocampo, o tálamo, o hipotálamo, o midbrain e o cerebelo (Figura 3B ).
Finalmente, empregamos a análise de RT-qPCR para verificar a entrega intracelular de siRNA funcional visando o gene superóxido dismutase-1 (SOD1). Os camundongos foram inoculados intranasalmente por 3 vezes em dias consecutivos com RVG9R: siSOD1 (13,2 μg de siRNA), e a expressão de mRNA SOD1 foi analisada 24 horas após a última inoculação. RVG9R: siSOD1 administração resultou em uma redução substancial da expressão SOD1 no bulbo olfativo (63%), no córtex (47%), no hipocampo (61%), no tálamo (53%), no hipotálamo (55%), no midbrain (39%) e no cerebelo (30%) (Figura 4). Em conclusão, o uso de um dispositivo de posicionamento permite uma fácil IN inoculação de RVG9R-complexed siRNA em camundongos, resultando em cérebro-específico de parto siRNA induzindo silenciamento funcional do gene alvo.
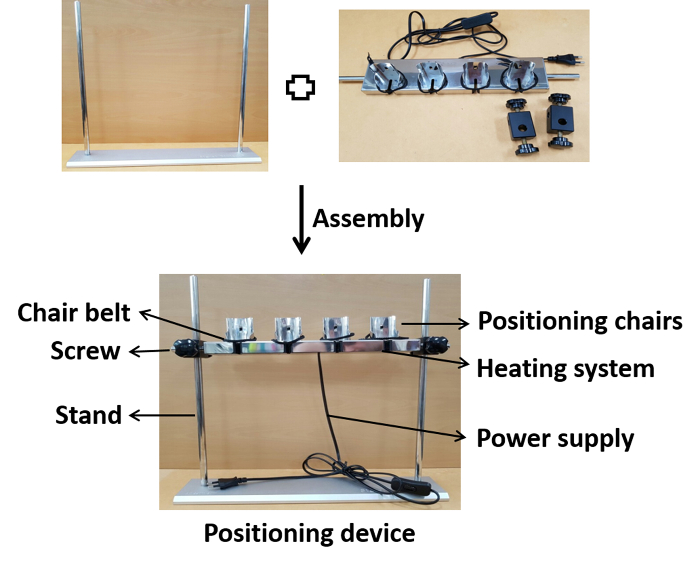
Figura 1 : Apresentação fotográfica da montagem do dispositivo. As cadeiras de posicionamento são montadas no suporte na altura apropriada com parafusos. Após a montagem, o dispositivo é conectado a uma fonte de alimentação para o aquecimento à temperatura fisiológica durante a inoculação. Por favor clique aqui para ver uma versão maior desta figura.

Figura 2 : Apresentação fotográfica do procedimento de inoculação in utilizando o dispositivo de posicionamento. A) equipamento experimental necessário para a inoculação in. B) os animais na posição de cabeça para baixo e para a frente sentados no dispositivo (à esquerda) e a deposição de uma gota de 2 μl para a inoculação in (direita). Por favor clique aqui para ver uma versão maior desta figura.
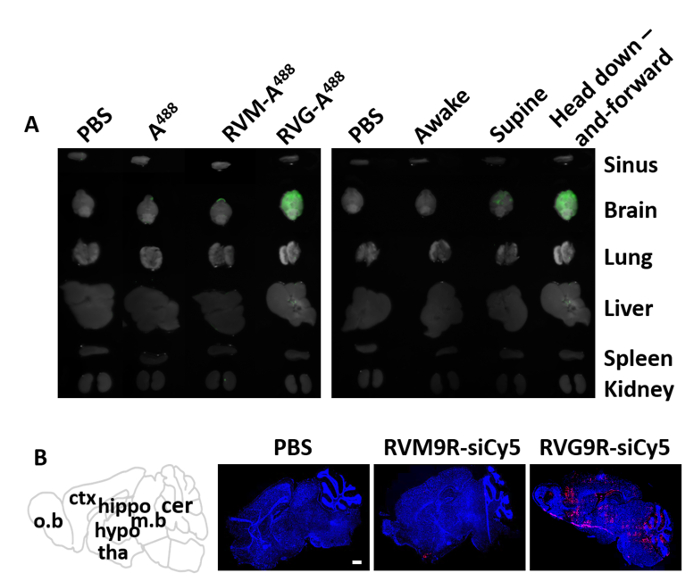
Figura 3 : Distribuição de peptídeo com rótulo fluorescentamente e siRNA após administração de in. (A) biodistribuição do PEPTÍDEO RVG9R inoculado intranasalmente a 48 h após uma única inoculação de in. O cérebro e outros órgãos periféricos foram avaliados quanto à presença de fluorescência em camundongos inoculados com soro fisiológico (PBS), A488, RVM-a488e rvg-a488 (esquerda). Imagem dos camundongos tratados como mencionado acima, enquanto eles estão acordados, na posição supina, e no posicionamento do mouse conceber na posição de cabeça para baixo e para a frente (direita). (B) biodistribuição do complexo RVG9R: siRNA no cérebro (n = 3 por grupo). A distribuição de siRNA Cy5-etiquetada foi visualizada em Cryosections cheios do cérebro com um microscópio confocal do laser nos animais inoculados com o soro fisiológico (PBS), o siRNA complexado com peptide do controle (RVM9R-siCy5), ou o peptide do cérebro-alvejando RVG9R (RVG9R-siCy5). A barra de escala representa 1 mm. abreviaturas: o. b = bulbo olfatório; CTX = córtex; hipopótamo = hipocampo; hipo = hipotálamo; Tha = tálamo; m. b = midbrain; cer = cerebelo. Por favor clique aqui para ver uma versão maior desta figura.
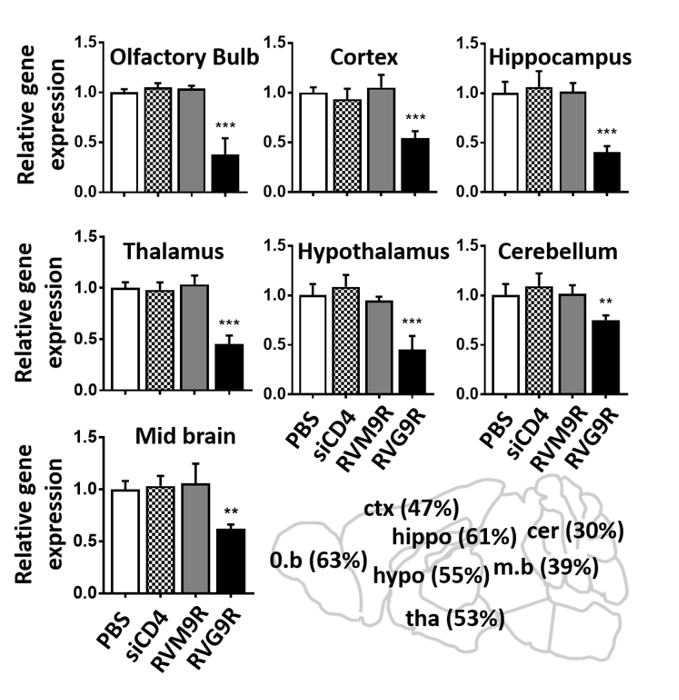
Figura 4 : Em aplicação de RVG9R: siSOD1 induz o silenciamento do gene alvo em várias regiões do cérebro. análise de qPCR para o mRNA murino SOD1 em regiões cerebrais indicadas 24 h após a última inoculação de soro fisiológico (PBS), RVG9R: siCD4 (siCD4), RVM9R: siSOD1 (RVM9R) e RVG9R: siSOD1 (RVG9R). O silenciamento relativo de SOD1 no bulbo olfativo, o córtex, o hipocampo (superior), o tálamo, o hipotálamo, o cerebelo (médio) e o midbrain (inferior) são mostrados. Os dados representam a média ± DP em relação ao GAPDH após a normalização com os dados correspondentes de camundongos tratados com soro fisiológico (n = 3 por grupo). Os desenhos animados que descrevem a percentagem de SOD1 mRNA na região cerebral indicada após a inoculação IN é mostrada (inferior direito). * *P < 0, 1, * * *p < 0, 1. Abreviaturas: o. b = bulbo olfatório; CTX = córtex; hipopótamo = hipocampo; hipo = hipocampo; Tha = tálamo; m. b = midbrain; cer = cerebelo. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Nós desenvolvemos um dispositivo de posicionamento do rato para os ratos de posicionamento otimamente para a entrega do nariz-à-cérebro da terapêutica. O dispositivo é equipado com as funcionalidades diferentes, assegurando a manipulação simultânea fácil dos animais. Também é equipado com almofadas de aquecimento para a manutenção das temperaturas corporais fisiológicas dos animais durante a experimentação. Os camundongos anestesiados podem ser mantidos na posição de cabeça para baixo e para frente por meio de cadeiras especificamente projetadas, com mínimo desconforto para os animais. A altura das cadeiras de posicionamento pode ser ajustada em tal maneira como é o melhor para visualizar narinas animais ao administrar drogas.
NO parto cerebral tem várias limitações intrínsecas, incluindo a pequena área superficial das narinas (permitindo volumes máximos de 20-30 μL por administração), irritação nasal, dano do epitélio e absorção limitada em todo o epitélio nasal18. A administração in de medicamentos para camundongos colocados na posição supina tem sido usada para a entrega do cérebro, soltando drogas líquidas em narinas alternativos dos animais através de pipeta ou tubo de poliuretano (24 G x 19 mm) ligado a seringas de microlitro19, 20. embora o uso de sistemas de tubos para liberar drogas perto do epitélio olfativo é uma abordagem potencialmente adequada, provoca irritação ou inflamação nasal após a administração repetitiva. Além disso, o pequeno tamanho da cavidade nasal limita essa abordagem, especialmente em camundongos que podem ser superados por repetição, bem como por formulações de fármacos que persistem na mucosa nasal. Outra opção é a administração IN de terapêutica para camundongos acordados10. No entanto, esta abordagem requer procedimentos qualificados para a manipulação de animais durante a inoculação. Além disso, provoca estresse animal e, portanto, não é ideal para modelos de doenças, especialmente modelos de doenças infecciosas. Além disso, a dosagem inconsistente pode facilmente resultar da drenagem da droga nos pulmões ou no estômago devido à preensão animal imperfeita. A abordagem aqui apresentada permite que os cientistas superem essas barreiras técnicas. A posição de cabeça para baixo e para frente reduz a possibilidade de vazamento de drogas do nariz para os pulmões ao inalar, favorecendo a entrega de siRNA direta e seletiva ao cérebro. NA entrega usando o dispositivo de posicionamento do rato não exige nenhuma técnica especializada para segurar ou prender os animais durante a inoculação. Quatro animais de cada vez podem ser tratados por um período de pelo menos 30-45 min. O procedimento pode ser ampliado, incluindo uma barra de quatro cadeiras adicionais, permitindo a fácil gestão de até oito camundongos na mesma sessão experimental. Conseqüentemente, seguindo este método, um único operador pode induzir a entrega da droga aos cérebros de grandes grupos de animais sobre períodos de tempo prolongados.
A estrutura anatômica da cavidade nasal influencia fortemente a entrega do nariz ao cérebro (como revisada por Merkus et al.11 e Ruigrok e de Lange21). A área de superfície relativa da cavidade nasal em camundongos é 15 vezes maior do que a dos seres humanos e a área de superfície relativa do epitélio olfativo é 6 vezes maior. Embora existam diferenças significativas na anatomia da cavidade nasal em humanos para roedores, há aproximadamente 45 ensaios clínicos em andamento usando a abordagem IN para tratar vários distúrbios cerebrais (www.clinicaltrials.gov). O estudo aqui apresentado indica que, ao usar IN na entrega de terapêutica, os cientistas devem considerar vários fatores, como a posição da cabeça, dormindo e agentes de entrega adequados.
Nós mostramos a deposição eficiente e específica de siRNA fluorescentamente rotulado para o cérebro do mouse. Além disso, a diminuição significativa na expressão do gene SOD1 observada após IN siRNA entrega confirmou efeitos funcionais. Nós mostramos previamente consistentemente que a administração de IN dos complexos de RVG9R-siRNA que visam o vírus do Nilo Ocidental (WNV) o RNA exerce um efeito terapêutico forte na encefalite15de WNV. Notavelmente, a entrega do siRNA do nariz-à-cérebro exigiu um ligante Cell-Targeting (RVG) e uma molécula positivamente carregada (9R) ao siRNA complexo. Na ausência desses elementos, as moléculas foram limpas através do circuito sistêmico e vasos linfáticos 48 h pós-tratamento (Figura 3a)15. Conseqüentemente, na instalação experimental descrita aqui, nós examinamos a localização do peptide/siRNA 48 h após a inoculação à imagem somente os níveis retidos especificamente no cérebro. Essa abordagem poderia ser facilmente implementada para a entrega de outras moléculas, como proteínas, peptídeos e nanopartículas, ou outras terapêuticas, para o tratamento de um número de distúrbios cerebrais.
Divulgações
Os S.K.L. são cofundadores da Signet Biotech. A PK é coinventor da patente PCT/US07/12152, que em parte inclui reivindicações relativas a RVG9R. I.U., KC, PK e S.K.L. são listados como coinventores de uma patente submetida (PCT/KR2016/014220), que inclui reivindicações relacionadas a um dispositivo de posicionamento do mouse.
Agradecimentos
Este trabalho foi apoiado pelo Ministério da saúde da Coréia & bem-estar (HI17C1046) para S.K.L.
Materiais
| Name | Company | Catalog Number | Comments |
| Comercial assays | |||
| iScript cDNA synthesis kit | BioRad | Cat# 1708891 | |
| RNAiso plus | TaKaRa Bio | Cat# 9108 | |
| SYBR Premix ExTaq | TaKaRa Bio | Cat# RR420A | |
| Dyes | |||
| Alexa fluor 488 | ThermoFisher | Cat# A30052 | |
| Mouse strain | |||
| Balb/c | Orient Bio | N/A | 6-8 week old, 20-30g |
| Oligonucleotides and primers | |||
| Human CD4 | ST Pharm | N/A | Sense: 5’-GAUCAAGAGACUCCUCAGU-3’ |
| siSOD1 | ST Pharm | N/A | Sense: 5’-GGUGGAAAUGAAGAAAGUA-3’ |
| GAPDH primers | ST Pharm | N/A | F: 5’-AACTTTGGCATTGTGGAAGG-3’ R: 5’-GGAGACAACCTGGTCCTCAG-3’ |
| SOD1 primers | ST Pharm | N/A | F: 5’-CCAGTGCAGGACCTCATTTT-3’ R: 5’-CACCTTTGCCCAAGTCATCT-3’ |
| Peptides | |||
| RVG9R | Peptron | N/A | YTIWMPENPRPGTPCDIFTNSR GKRASNGGGGRRRRRRRRR |
| RVM9R | Peptron | N/A | MNLLRKIVKNRRDEDTQKSS PASAPLDGGGGRRRRRRRRR |
| Software, algorithms and devices | |||
| FlowJo software 4.3 | FlowJO, LLC | N/A | http://docs.flowjo.com/vx/ |
| Mouse positioning device | Signet Biotech | N/A | |
| Prism software | Graphpad | N/A | https://www.graphpad.com/scientificsoftware/prism/ |
| Prism software | Graphpad | N/A | https://www.graphpad.com/scientificsoftware/prism/ |
Referências
- Pardridge, W. M. The blood-brain barrier: bottleneck in brain drug development. NeuroRx. 2, 3-14 (2005).
- Glascock, J. J., et al. Delivery of therapeutic agents through intracerebroventricular (ICV) and intravenous (IV) injection in mice. Journal of Visualized Experiments. (56), e2968(2011).
- Khan, A. R., Liu, M., Khan, M. W., Zhai, G. Progress in brain targeting drug delivery system by nasal route. Journal of Controlled Release. 268, 364-389 (2017).
- Meredith, M. E., Salameh, T. S., Banks, W. A. Intranasal delivery of proteins and peptides in the treatment of neurodegenerative diseases. The AAPS Journal. 17, 780-787 (2015).
- Pardeshi, C. V., Belgamwar, V. S. Direct nose to brain drug delivery via integrated nerve pathways bypassing the blood-brain barrier: an excellent platform for brain targeting. Expert Opinion on Drug Delivery. 10, 957-972 (2013).
- Agrawal, M., et al. Nose-to-brain drug delivery: An update on clinical challenges and progress towards approval of anti-Alzheimer drugs. Journal of Controlled Release. 281, 139-177 (2018).
- Van Woensel, M., et al. Formulations for intranasal delivery of pharmacological agents to combat brain disease: a new opportunity to tackle GBM. Cancers. 5, 1020-1048 (2013).
- Kulkarni, A. D., et al. Nanotechnology-mediated nose to brain drug delivery for Parkinson's disease: a mini review. Journal of Drug Targeting. 23, 775-788 (2015).
- Dhuria, S. V., Hanson, L. R., Frey, W. H. Intranasal delivery to the central nervous system: mechanisms and experimental considerations. Journal of Pharmaceutical Sciences. 99, 1654-1673 (2010).
- Hanson, L. R., Fine, J. M., Svitak, A. L., Faltesek, K. A. Intranasal administration of CNS therapeutics to awake mice. Journal of Visualized Experiments. (74), e4440(2013).
- Merkus, P., Ebbens, F. A., Muller, B., Fokkens, W. J. Influence of anatomy and head position on intranasal drug deposition. European Archives of Oto-Rhino-Laryngology and Head & Neck. 263, 827-832 (2006).
- Zeller, S., et al. Attachment of cell-binding ligands to arginine-rich cell-penetrating peptides enables cytosolic translocation of complexed siRNA. Chemistry & Biology. 22, 50-62 (2015).
- Kim, J., et al. Silencing CCR2 in macrophages alleviates adipose tissue inflammation and the associated metabolic syndrome in dietary obese mice. Molecular Therapy-Nucleic Acids. 5, (2016).
- Kumar, P., et al. Transvascular delivery of small interfering RNA to the central nervous system. Nature. 448, 39(2007).
- Beloor, J., et al. Small interfering RNA-mediated control of virus replication in the CNS is therapeutic and enables natural immunity to West Nile virus. Cell Host & Microbe. 23, 549-556 (2018).
- Ullah, I., et al. Trileucine residues in a ligand-CPP-based siRNA delivery platform improve endosomal escape of siRNA. Journal of Drug Targeting. 25, 320-329 (2017).
- Yu, D., Li, G., Lesniak, M. S., Balyasnikova, I. V. Intranasal delivery of therapeutic stem cells to glioblastoma in a mouse model. Journal of Visualized Experiments. (124), e55845(2017).
- Mittal, D., et al. Insights into direct nose to brain delivery: current status and future perspective. Drug Delivery. 21, 75-86 (2014).
- Renner, D. B., Frey, W. H., Hanson, L. R. Intranasal delivery of siRNA to the olfactory bulbs of mice via the olfactory nerve pathway. Neuroscience Letters. 513, 193-197 (2012).
- Serralheiro, A., Alves, G., Fortuna, A., Falcão, A. Intranasal administration of carbamazepine to mice: a direct delivery pathway for brain targeting. European Journal of Pharmaceutical Sciences. 60, 32-39 (2014).
- Ruigrok, M. J., de Lange, E. C. Emerging insights for translational pharmacokinetic and pharmacokinetic-pharmacodynamic studies: towards prediction of nose-to-brain transport in humans. The AAPS Journal. 17, 493-505 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados