Method Article
Um guia para construir um altamente inclinado varreu o microscópio de telha para a imagem latente de único-molécula campo de visão alargado
Neste Artigo
Resumo
Uma instrução detalhada é descrita em como construir um altamente inclinado varrido telha (HIST) microscópio e seu uso para a imagem latente de único-molécula.
Resumo
Imagem de único-molécula avançou grandemente nossa compreensão dos mecanismos moleculares em estudos biológicos. No entanto, tem sido um desafio para obter imagens grandes do campo de visão, alto contraste em grossas células e tecidos. Aqui, apresentamos a microscopia de telha varrida altamente inclinado (HIST) que resolve este problema. Um par de lentes cilíndricas foi implementado para gerar um feixe de excitação alongada que foi verificado em uma grande área de imagem através de um espelho galvo rápido. Uma configuração de 4f foi usada para posicionar os componentes ópticos. Uma câmera científico semicondutor de óxido metálico complementar detectou o sinal de fluorescência e bloqueou o fundo fora de foco com uma fenda confocal dinâmica sincronizada com a varrição de feixe. Apresentamos um passo a passo instruções sobre o microscópio HIST com todos os componentes básicos de construção.
Introdução
Imagem de único-molécula fluorescência desempenha um papel importante em muitos estudos biológicos que revelam ultrastructures, dinâmica e a quantidade de biomoléculas1,2,3. No entanto, isso tem sido desafiador para estudar single-moléculas no interior das células ou tecidos. Microscopia confocal fornece alta corte capacidade4, não é apropriado para a imagem latente de único-molécula devido à severo fotobranqueamento pela excitação de alta intensidade ou velocidade lenta de imagem. Microscopia Widefield usa iluminação mais fraca, mas sofre de um sinal de fundo ratio (SBR)5. Microscopia de luz-folha, por outro lado, poderia mostrar bom corte e baixa fotobranqueamento6; no entanto, a disponível abertura numérica (NA) é grandemente limitada pela exigência de objectivos colocados ortogonalmente7. Alternativamente, requer especiais iluminadores e amostra câmaras8,9.
Por estas razões, a microscopia folha óptica altamente inclinado e laminado (HILO) tem sido amplamente utilizada para 3D único-molécula de imagem10. Quando um feixe inclinado encontra uma interface de dois meios (vidro e água, por exemplo), o feixe é refratado de acordo com a lei de Snell. Importante, o feixe refratado fica mais fino, e sua espessura é descrita como dz = R/tan(θ), onde R é o diâmetro do feixe inclinado e θ é o ângulo de refração do feixe transmitido. Essa implementação simples resulta em uma boa capacidade de corte. No entanto, esta relação indica que uma iluminação fina (ou seja, alta capacidade corte) requer um pequeno R e/ou um θ grande. Por exemplo, quando R = 20 µm e θ = 72 graus, um pode obter dz = 6,5 µm. Desde que há um limite prático para aumentar o ângulo de refração para dentro de células de imagem e evitar a reflexão interna total, há um acoplamento forte de diâmetro a iluminação e a espessura do feixe. Por esta razão, as imagens de HILO mostram um relativamente pequeno campo de visão (FOV) que restringe consideravelmente suas aplicações em imagiologia multicelular.
Recentemente, ultrapassámos esse problema por microscopia de telha varrida altamente inclinado (HIST) onde o FOV é desassociado a espessura do feixe em uma maneira muito simples de11. Primeiro, um feixe alongado em uma direção é gerado através de um par de lentes cilíndricas. Este feixe, denominado como um azulejo, produz uma iluminação fina com dz ~ 4 µm enquanto sua FOV é 130 x 12 µm2. Em seguida, a telha é varreu a amostra usando um espelho rotativo do galvo. Enquanto isso, a imagem de fluorescência é gravada em uma câmera de científico de semicondutor de óxido metálico complementar (sCMOS) que filtra o fundo fora de foco com eficiência, operando em um modo de obturador de rolamento que serve como detecção de fenda confocal ajustáveis. Desta forma, HIST microscopia permite imagem de único-molécula com um maior campo de visão (~ 130 x 130 µm2) e uma iluminação mais fina do que a imagem do HILO. Nós aplicamos esta imagem nova técnica para detectar os transcritos de RNA com um único teste em células ou com alguns testes nos tecidos do cérebro de rato, que tem um potencial significativo para o estudo de doenças e expressão gênica. Ao contrário de outras abordagens, HIST emprega apenas um objectivo único abertura numérica elevada sem um iluminador adicional ou objectivos de detecção remota e é totalmente compatível com microscópios invertidos. Estas vantagens junto com um grande FOV e alto contraste fará HIST microscopia uma ferramenta proeminente em biologia e medicina. Apresentamos instruções detalhadas sobre instrumentação de microscópio HIST e como testar e calibrar seu desempenho como abaixo.
Protocolo
1. configurar as ferramentas de microscópio, lasers e alinhamento
- Antes de construir o microscópio, preparem-se todos os componentes necessários, incluindo a óptica, optomechanics e eletrônica conforme listado na Tabela de materiais.
- Preparar um corpo de microscópio composto principalmente de duas partes: um objetivo titular com uma porta de segmentação RMS e um piezo-palco montado em um bloco de alumínio (Figura 1A).
Nota: O corpo feito por microscópio é usado para a conveniência e a flexibilidade da instrumentação12. Qualquer organismo microscópio comercialmente disponível pode ser usado para a microscopia HIST. - Combinando múltiplas linhas de laser e acoplamento-los para uma fibra de modo único
- Instalar 405, 561, 638 lasers de nm para a óptica da tabela e combinar as vigas através de um divisor de feixe polarizador e um espelho dicroico-passe longo, como mostrado na Figura 1B. Certifique-se de que todos os feixes de laser passam por buracos na ferramenta de alinhamento. Inserir placas de meia onda para ajuste de potência.
Nota: Use óculos de segurança para proteção dos olhos e use o feixe-blocos para absorver raios laser indesejados. - Instalar uma lente de acoplamento de fibra (f = 4.5 mm) e um adaptador de fibra realizada no Tradutor de eixo z com um sistema de gaiola.
- Conecte o adaptador de fibra, uma fibra de modo múltiplo (MMF, Ø 62.5 µm). Ajuste cada par de espelho a direção e o z-Tradutor até que a eficiência de acoplamento de cada laser é superior a 95%. O feixe de saída tem um perfil de Gaussian em forma de perto com os padrões do salpico.
- Tirar a fibra multimoda e conectar uma fibra monomodo (SMF). Semelhante ao MMF, afinar e maximizar a eficiência de acoplamento de três lasers.
- Instalar 405, 561, 638 lasers de nm para a óptica da tabela e combinar as vigas através de um divisor de feixe polarizador e um espelho dicroico-passe longo, como mostrado na Figura 1B. Certifique-se de que todos os feixes de laser passam por buracos na ferramenta de alinhamento. Inserir placas de meia onda para ajuste de potência.
- Monte uma fonte de luz colimada que será usada para o alinhamento do feixe pelos caminhos da excitação e deteção. Este dispositivo é composto por uma fonte de luz coerente temporalmente (561 nm) conectado à SMF, adaptador de fibra, lente acromática (f = 60 mm), íris e Ø1 "tubo espaçador em um sistema de gaiola (Figura 1C). Ajuste a distância entre o adaptador de fibra e a lente usando um interferómetro corte para garantir a colimação.
- Prepare uma ferramenta de alinhamento de feixe (Figura 1D). Este é um par de posts de alumínio com furos em 2" altura da superfície de mesa óptica, que permite o alinhamento do feixe rápidas e precisas.
- Montar um sistema de duplo orifício que consiste de dois Ø1 "discos de alinhamento do vidro à terra em cada extremidade e duas Ø1" lente tubos (a de baixo é entalhada) como mostrado na Figura 1,E.
2. configurar o caminho de deteção
- Retire o objectivo e instalar a fonte de luz colimada. Ajuste os botões do espelho (M1) sob o titular objetivo para que o feixe de saída do microscópio é aproximadamente paralelo à tabela óptica em altura e alinhada com furos roscados na mesa. Consulte a Figura 2 para posições detalhadas de cada componente óptico.
- Inserir um espelho dicroico multibanda (DM) e refletir o feixe em 90 graus. Usar o tamanho máximo da íris e certifique-se de que o feixe passa através do centro do espelho dicroico sem corte.
- Use o feixe gotejante, passando através do espelho dicroico para guiar o alinhamento do caminho da deteção. Coloque uma câmera de sCMOS para o feixe e certifique-se que o raio do centro do chip câmera usando dois espelhos (M2 e M3).
- Inserir um tubo de lente (TL; f = 300 mm) aproximadamente 300 mm de distância da câmera.
- Remover a fonte de luz colimada e ajustar a distância relativa entre o tubo da lente e a câmera, até que um padrão no teto é claramente resolvido pela câmera.
- Inserir um filtro passa faixa multi (BF) perante a objectiva de tubo para a imagem latente de fluorescência de cor multi.
3. configurar o caminho da excitação
- Reinstale a fonte de luz colimada no suporte da objetiva. Coloque um espelho-dobra (M4) para redirecionar a saída do feixe do microscópio por 90 graus. Ajuste os botões do espelho dicroico e dobra-espelho iterativamente até que o feixe passa através de furos na ferramenta de alinhamento do feixe.
- Desconectar a fonte de luz colimada e instalá-lo em cima da mesa, em que o feixe aponta para o corpo do microscópio. Alinhe o feixe usando uma ferramenta de alinhamento do feixe e um sistema de duplo vórtice.
- Inserir uma lente L4 (f = 400mm; Ø = 2") para o caminho óptico aproximadamente 400 milímetros longe o titular objetivo. Instalar a lente objetiva e ajuste a posição de L4 ao longo do eixo óptico até um padrão perfeito disco de Airy é formado no teto.
Nota: Ao inserir a lente, a posição do feixe passando através da lente deve ser mantida inalterada. A lente L4 tem um thread de SM2 que permite que ele seja anexado/desanexado da 60 mm placa de gaiola SM2-rosca facilmente. - Desaperte o objectivo e reinstalar a fonte de luz colimada com uma íris aberta. Rastreamento para a saída do feixe do microscópio com um cartão de visita. Montar um espelho M5, no lugar onde o tamanho do feixe é o menor e aproximadamente 400 milímetros longe L4, que é um plano de imagem conjugados (cIP).
- Instalar um espelho M6 e refletir o feixe em 90 graus. Com a ferramenta de alinhamento de feixe ajuste iterativamente M5 e M6.
- Inserir uma lente L3 (f = 150 mm) aproximadamente 150 mm do M5. Use um interferômetro de corte para garantir a colimação do feixe de saída.
- Temporariamente tire L4 e rastrear o feixe para encontrar a posição focal de L3. Coloque um espelho do único eixo galvo neste ponto, que é um avião de volta focal conjugado (cBFP). Fonte 0 volts para o espelho do galvo e girar o titular do galvo espelho que reflete o feixe em 90 graus.
- Coloque um espelho dobra M7. Coloque corretamente L2 (f = 100 mm) da mesma maneira como passo 3.6.
- Remova a fonte de luz colimada o titular do objeto. Instalar uma lente de colimação L1 (f = 100 mm), adaptador de fibra e íris. Conectar o adaptador de uma fibra de modo único e enviar o feixe através do sistema de imagem.
- Reinsira a L4 e afinar o sistema até que um padrão perfeito disco Airy aparece no teto.
4. configurar as lentes cilíndricas
- Inserir uma lente cilíndrica (CL1, f = 400mm) depois L1 e certifique-se de que a lente cilíndrica centra-se viga ao longo do eixo x.
- Inserir uma outra lente cilíndrica (CL2, f = 50 mm) para o caminho do feixe. Use um interferômetro de corte para garantir que o feixe de saída é colimado.
Nota: A distância entre as duas lentes cilíndricas é 450 mm. O feixe de saída tem uma taxa de compressão de 8 e um padrão de alongado oval em forma de disco Airy é formado no teto.
5. teste de imagem latente da telha
- Prepare a amostra de hidrogel 3D. Mix 20 nm Crimson grânulos com uma solução de hidrogel, que consiste em 12% acrylamide:bisacrylamide (29:1), 0,2% (v/v) TEMED e persulfato de amónio 0,2% (p/v) em 0,75 x TAE buffer. Injete 50 µ l da solução misturada em uma câmara de fluxo, conforme descrito em outro lugar11. Depois de 10 min, a amostra de hidrogel 3D está pronta para a imagem latente.
- Coloque a amostra no porta-amostras. Ligue 638 nm do laser e ajustar o poder de < 1 mW para a excitação da amostra.
- Execute o software de controle de câmera. No painel de configuração-aquisição de câmera, selecione interno no modo de gatilho e clique em fazer um vídeo grátis executando o modo.
- Ligeiramente, ajuste a posição da câmera para que a imagem está localizada no centro da câmara quando 0 volts é aplicado ao espelho galvo.
- Gire o botão horizontal do espelho M5 para conseguir uma iluminação altamente inclinada.
Nota: Com o aumento do ângulo de iluminação, a imagem de hidrogel torna-se mais clara do que a imagem de Epi como o feixe fica mais fino. No entanto, a imagem continua quase a mesma posição. - Grave a imagem de telha. Calcule a largura de iluminação eficaz11. Por exemplo, a Figura 3 mostra a largura de iluminação eficaz de 12 µm.
6. HIST de imagem
- Prepare uma placa de aquisição de dados conectada com um bloco de terminais. Conecte o conector BNC 1 usuário com P0.0 através de um fio elétrico. Use 1 usuário como uma saída digital para o acionamento externo da câmera sCMOS. Conectar um analógico AO0 de saída para um driver de espelho galvo.
- Gerar trens de pulso TTL de P0.0 usando um programa feito sob medido (Figura 4A) e defina o período de tempo = 400 ms e t_ON = 2 ms. verificar os pulsos gerados de 1 usuário terminal BNC por um osciloscópio digital e em seguida, conecte o cabo BNC para a câmera Porto de gatilho externo.
Nota: O software de controle usado neste documento está disponível mediante pedido. Quando a imagem latente em taxas de quadro de câmera diferentes, o período de tempo deve ser ajustado em conformidade. - Comecem a varrer um espelho galvo através do programa feito sob medido. Ajustar Vmin a-500 mV e Vmáx 500 mV para a imagem latente de FOV completo. Observe que no âmbito desta operação, amostras de hidrogel 3D ainda mostram fundo elevado semelhante ao Epi-iluminação.
- Alterar a definição de aquisição de câmera.
- Selecione externo em modo de disparo e para baixo (sequencial) no menu drop-down de LightScan Plus como mostrado na Figura 4B.
Nota: Neste cenário, a câmara não aceita imagens a menos que um sinal de gatilho está ativado. - Clique em Controle de velocidade de varredura para janela altura e linha exposição tempo de controle e defina os valores como 180 linhas e 28 ms, respectivamente.
Nota: Quando uma telha largura (WFEP) é de 180 linhas (12 µm) e um tempo de integração por linha (Tint) é 28 ms, um tempo de atraso entre as linhas (TD) é determinado como TD = Tint/wFEP = MS. 0.156 para imagem x 2.048 2.048 pixels, o tempo de aquisição total é de 2.048 x TD + Tint = 346 ms, correspondente a ~2.9 fps.
- Selecione externo em modo de disparo e para baixo (sequencial) no menu drop-down de LightScan Plus como mostrado na Figura 4B.
- Um pouco ajustemáximo V e Vmin para obter imagens mais claras.
- Obter imagens de pilha 3D usando o programa feito por comutação em pilha 3D ON e especificando o número de pilhas e o tamanho do passo.
Resultados
Como exemplo, single-stranded DNA marcado com Atto647N foi fotografada com um comprimento de onda de excitação de 638 nm em um hidrogel 3D. DNA foi ancorado à rede através de um grupo de acrydite hydrogel durante a polimerização do gel. As imagens foram tiradas em 5 mm acima da superfície, conforme mostrado na Figura 5um. A imagem HIST mostrou muito menos fundo em comparação com a imagem de Epi, do qual o sinal à relação de fundo foi calculado para ser 1,9 ± 0,7 para a imagem HIST, enquanto a maioria dos pontos única molécula mal podia ser detectado pelo Epi.
Fluorescência de RNA único-molécula hibridação in situ (smFISH) foi realizada com 4 sondas de peixe. Figura 5 b exibe imagens do smFISH de EEF2 (factor de alongamento eucariótico Tradução 2) rotuladas com AlexaFluor 647 A549 células em um buffer de imagem (consulte nosso trabalho anterior sobre a preparação de amostra11). Realizou-se uma projeção de intensidade máxima em 20 z-pilhas correspondente a 5 µm de espessura. A imagem HIST mostrou não só SBR melhorou muito, mas também mais iluminação uniforme em comparação com a imagem de Epi. Para a imagem latente de Epi, o tempo de exposição foi 400 ms, enquanto para HIST a integração de imagem tempo por linha foi 32 ms, que ambos tinham o mesmo poder de iluminação de 7,5 mW medido antes o objectivo. As velocidades da imagem latente de Epi e HIST foram 2,5 fps.

Figura 1 . Ferramentas de corpo, lasers e alinhamento de microscópio. (A) objectivo e titular da amostra. (B) foto de sistemas laser. LP, espelho dicroico passe longo; Placas λ/2, de meia-onda; PBS, refletores polarizador. (C) fonte de luz Collimated. (D) ferramenta de alinhamento de feixe com dois furos inseríveis. (E) sistema de duplo vórtice. Clique aqui para ver uma versão maior desta figura.
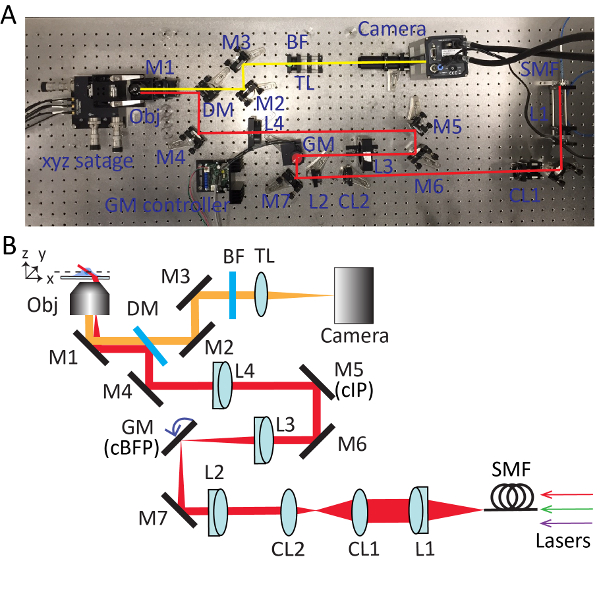
Figura 2 . Configuração detalhada para microscopia de telha varrida altamente inclinado (HIST). Foto (A) e esquema (B) do sistema de microscópio HIST. BF, filtro passa faixa multi; Lentes CL1-2, cilíndricas; DM, espelho dicroico; GM, galvo espelho; BF, filtro passa-banda; M1-7, espelhos; L1-4, lentes; SMF, fibra de modo único; TL, tubo de lente; cIP, plano de imagem conjugados; cBFP, conjugados plano focal volta. Clique aqui para ver uma versão maior desta figura.
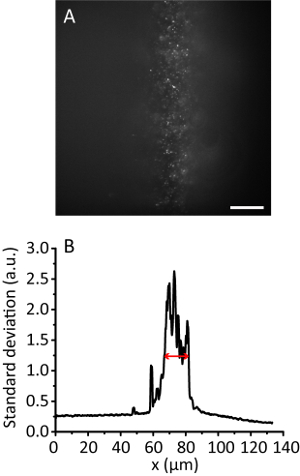
Figura 3 . Telha de iluminação com uma taxa de compressão de 8. (A) imagem de fluorescência de 20 grânulos nm em um hidrogel 3D. Barra de escala, projeção 20 µm. (B) desvio-padrão ao longo da direção y de A, suavizada por pontos de 10 dados. A seta vermelha indica uma largura de iluminação eficaz de 12 µm. clique aqui para ver uma versão maior desta figura.
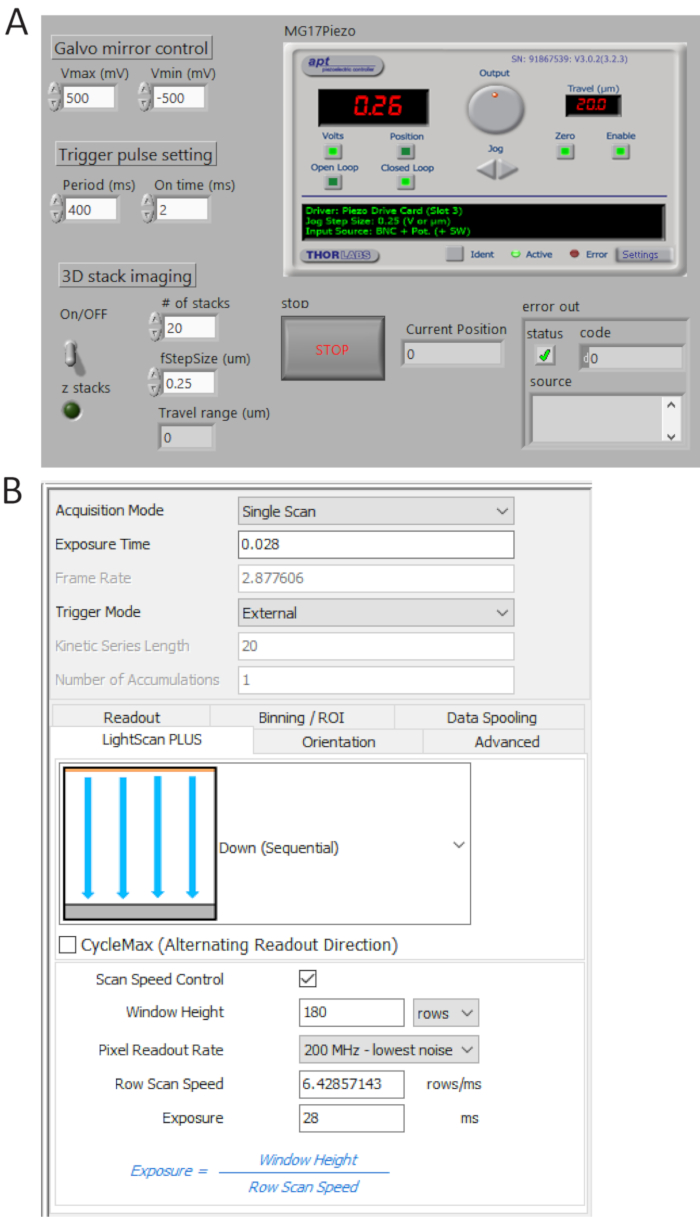
Figura 4 . Controle e software de imagem frontal painéis. (A), A medida LabView programa sincronicamente controla a varredura de espelho galvo, a aquisição inicial da câmera de sCMOS e o movimento da fase de piezo. Painel de controle (B) definição de aquisição de câmera. Clique aqui para ver uma versão maior desta figura.
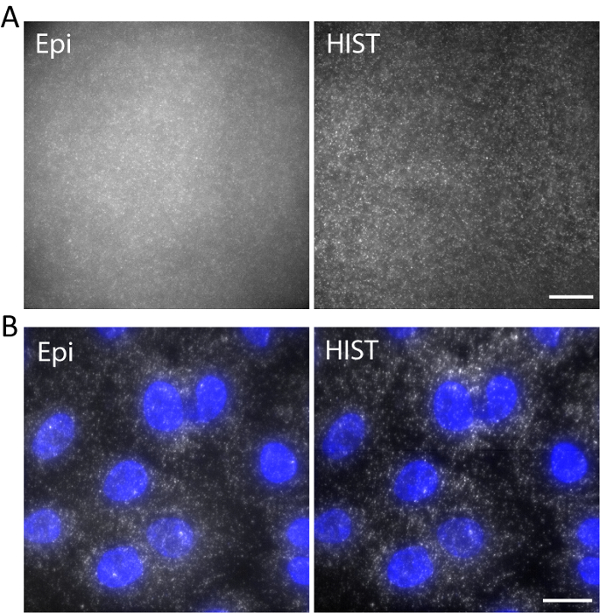
Figura 5. (A) imagens de Atto647N-etiquetada do ADN em um hidrogel 3D com iluminação Epi e HIST. (B) smFISH imagens de EEF2 usando 4 peixes sondas A549 células por microscopia Epi e HIST. Mancha DAPI é mostrada em azul. Escala de bares, 20 µm. clique aqui para ver uma versão maior desta figura.
Discussão
Há duas etapas críticas neste protocolo. A primeira é a colocação apropriada do L4 na etapa 3.3, garantindo que o feixe incidente passa através do centro da lente e um padrão perfeito disco de Airy é formado no teto. A posição de L4 determina a colocação de todos os outros componentes ópticos, incluindo L2, L3, GM e M5. O segundo passo crítico é o processo de sincronização. Para rejeitar a fora do plano de foco, pixels ativos cuja largura de detecção eficaz é igual à largura da telha devem ser sincronizados com a varrição de feixe. Portanto, é necessário medir a largura de iluminação eficaz de um feixe de telha (etapa 5.6) e parâmetros de ajuste de câmera em conformidade na etapa 6.4.
Quando imagem com FOV muito grande, o método apresentado mostra um aumento do fundo de um lado, em comparação com o outro lado. Isto é atribuído ao ligeiramente alterados ângulos de iluminação em diferentes posições da imagem latente. Implementar um segundo espelho galvo em vez de M5 alivia este problema como demonstrado antes, sincronicamente, ajustando a posição e o ângulo varredura11. Em vez de criação acromáticas parelhas, uma lente de varredura de telecêntrico será também útil. No entanto, para uma área de imagem < 8.080 µm2, galvo único espelho varrição era suficiente. Microscopia HIST tem um limite da profundidade da imagem, no entanto, é capaz de obter um bom SBR quando até ~ 15 µm com um feixe de telha 12 µm e uma de lente objetiva de imersão111,45 nd óleo de imagem.
Neste protocolo, fazíamos uma taxa de compressão do feixe de 8 um feixe de telha. Uma iluminação mais fina pode ser usada em microscopia HIST para alcançar maior SBR, que pode ser poderosa para tecido único-molécula de imagem11. No entanto, neste caso, fotobranqueamento efeito deve ser considerado por uma intensidade maior excitação enquanto a atual taxa de compressão do feixe mostrou fotobranqueamento reduzido em imagem em 3D em comparação com Epi11. Em comparação com microscópios de luz-folha com dois objectivos colocados ortogonalmente, microscopia HIST é simples de implementar e compatível com as preparações convencionais de amostra. A SBR reforçada e grande FOV de microscopia HIST é apropriado para estudar as interações e dinâmica de biomoléculas única em várias células e pode ser usado mais em Super-resolução imaging e rastreamento único-molécula.
Divulgações
Universidade de Florida Central entrou com um pedido de patente, cobrindo o trabalho descrito neste artigo.
Agradecimentos
Este trabalho foi financiado pela Defense Advanced Research Projects Agency (DARPA) (HR00111720066) e National Science Foundation (NSF) (1805200). Agradecemos a Michael Serge em Andor tecnologia para emprestar-se generosamente a câmera sCMOS.
Materiais
| Name | Company | Catalog Number | Comments |
| 1" Achromatic doublet | Thorlabs | AC254-060-A-ML | Collimator |
| 1" Achromatic doublet | Thorlabs | AC254-100-A-ML | L1,L2 |
| 1" Achromatic doublet | Thorlabs | AC254-300-A-ML | TL |
| 1" Broadband Dielectric Mirrors | Thorlabs | BB1-E02-10 | M1~M7 |
| 1" Cylindrical Lenses | Thorlabs | LJ1363RM-A | CL1 |
| 1" Cylindrical Lenses | Thorlabs | LJ1695RM-A | CL2 |
| 1" square kinematic mount | Edmund Optics | 58-857 | For dichroic mirror mounting |
| 1" Threaded Cage Plate | Thorlabs | CP02 | For holding other lenses |
| 2" Achromatic doublet | Thorlabs | AC508-150-A-ML | L3 |
| 2" Achromatic doublet | Thorlabs | AC508-400-A-ML | L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01 | For holding L4 |
| 2" Threaded Cage Plate | Thorlabs | LCP01T | For holding L3 |
| 2% Bis Solution | Bio Rad | 64085292 | hydrogel component |
| 20 nm fluorescent beads | Thermo Fisher | F8782 | For testing imaging |
| 30 mm Cage Right-Angle Kinematic Mirror Mount | Thorlabs | KCB1 | For objective & camera mounting |
| 30mm Cage System Iris | Thorlabs | CP20S | |
| 3-Axis NanoMax Stage | Thorlabs | MAX311D | |
| 40% Acrylamide Solution | Bio Rad | 64148001 | hydrogel component |
| 405 nm laser | Cobolt | Cobolt 06-MLD | |
| 50x TAE buffer | Bio-Rad | 161-0743 | hydrogel component |
| 561 nm laser | Cobolt | Cobolt 06-DPL | |
| 638 nm laser | Cobolt | Cobolt 06-MLD | |
| Ammonium persulfate | Sigma | A3678-25G | hydrogel component |
| Beam alignment tool | custom made | ||
| BNC terminal blocks | Natural Instruments | BNC-2110 | |
| Cage plate with M9 x 0.5 internal threads | Thorlabs | CP1TM09 | For holding aspheric lens |
| Cage System Rods | Thorlabs | SR series | |
| Cell culture & smFISH | See a reference [11] | ||
| Double side tape | Scotch | 515182 | Flow chamber |
| Epoxy | Devcon | 14250 | Flow chamber |
| Galvo mirror | Thorlabs | GVS211 | GM |
| Galvo System Linear Power Supply | Thorlabs | GPS011 | |
| Half wave plate | Thorlabs | WPH10M-405/561/633 | Power adjustment |
| long-pass dichroic mirror | Chroma | T550lpxr | For combining lasers |
| Microscope slides | Fisherbrand | 12549-3 | Flow chamber |
| Mikroskopische Deckglaser | Hecht Assistent | 990/5024 | Flow chamber |
| Mounted Frosted Glass Alignment Disk | Thorlabs | DG10-1500-H1-MD | For double pinhole system |
| Mounted rochester aspheric lens | Thorlabs | A230TM-A | |
| Multi-band dichroic mirror | Semrock | Di03-R405/488/561/635-t3 | DM; 3 mm thickness |
| Multi-band filter | Semrock | FF01-446/523/600/677-25 | BF |
| Multimode fiber | Thorlabs | M31L02 | MMF |
| N,N,N',N'-tetramethyl ethylenediamine | Sigma | T7024-25ML | hydrogel component |
| NI-DAQ board | Natural Instruments | PCI-6733 | |
| Ø1" Kinematic Mirror Mount | Thorlabs | KM100 | For holding mirrors |
| Objective lens | Olympus | PLANAPO N 60X | 60X 1.45NA oil |
| Pedestal Base Clamping Forks | Newport | 9916 | |
| Pedestal Pillar Posts | Thorlabs | RS1P8E | |
| Piezo controller | Thorlabs | BPC303 | |
| Polarized beam splitter | Thorlabs | PBS251 | For combining lasers |
| RMS-SM1 adapter | Thorlabs | SM1A3TS | For objective lens |
| Rod holder | custom made | ||
| Rotation cage mount | Thorlabs | RSP1/CRM1/CRM1P | For HWP & cylindrical lens mounting |
| sCMOS camera | Andor | Zyla-4.2P-CL10 | |
| Shearing interferometer | Thorlabs | SI100 | Beam collimation test |
| Single mode fiber | Thorlabs | P5-405BPM-FC-2 | SMF |
| SM1 Lens Tubes | Thorlabs | SM1S25 | For double pinhole system |
| SM1 Slotted Lens Tube | Thorlabs | SM1L30C | For double pinhole system |
| Stage mount | custom made | ||
| threaded fiber adapter | Thorlabs | SM1FC | |
| Z-Axis Translation Mount | Thorlabs | SM1Z | Fiber coupling |
Referências
- Sigal, Y. M., Zhou, R., Zhuang, X. Visualizing and discovering cellular structures with super-resolution microscopy. Science. 361, 880-887 (2018).
- Lerner, E., et al. Toward dynamic structural biology: Two decades of single-molecule Forster resonance energy transfer. Science. 359, (2018).
- Raj, A., van Oudenaarden, A. Single-Molecule Approaches to Stochastic Gene Expression. Annual Review of Biophysics. 38, 255-270 (2009).
- Wilson, T. Resolution and optical sectioning in the confocal microscope. Journal of microscopy. 244, 113-121 (2011).
- Sase, I., Miyata, H., Corrie, J. E., Craik, J. S., Kinosita, K. Real time imaging of single fluorophores on moving actin with an epifluorescence microscope. Biophysical Journal. 69, 323-328 (1995).
- Huisken, J., Swoger, J., Del Bene, F., Wittbrodt, J., Stelzer, E. H. K. Optical Sectioning Deep Inside Live Embryos by Selective Plane Illumination Microscopy. Science. 305, 1007-1009 (2004).
- Cella Zanacchi, F., et al. Live-cell 3D super-resolution imaging in thick biological samples. Nature Methods. 8, 1047 (2011).
- Galland, R., et al. 3D high- and super-resolution imaging using single-objective SPIM. Nature Methods. 12, 641 (2015).
- Gustavsson, A. K., Petrov, P. N., Lee, M. Y., Shechtman, Y., Moerner, W. E. 3D single-molecule super-resolution microscopy with a tilted light sheet. Nature Communications. 9, 123 (2018).
- Tokunaga, M., Imamoto, N., Sakata-Sogawa, K. Highly inclined thin illumination enables clear single-molecule imaging in cells. Nature Methods. 5, 159-161 (2008).
- Tang, J., Han, K. Y. Extended field-of-view single-molecule imaging by highly inclined swept illumination. Optica. 5, 1063-1069 (2018).
- Han, K. Y., Kim, S. K., Eggeling, C., Hell, S. W. Metastable Dark States Enable Ground State Depletion Microscopy of Nitrogen Vacancy Centers in Diamond with Diffraction-Unlimited Resolution. Nano Letters. 10, 3199-3203 (2010).
- Sinkó, J., Szabó, G., Erdélyi, M. Ray tracing analysis of inclined illumination techniques. Optics Express. 22, 18940-18948 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados