Method Article
Prever em cargas entrega Vivo usando uma Tumor-barreira sangue-cérebro em um prato
Neste Artigo
Resumo
Direcionamento de drogas para tumores do sistema nervoso central é um grande desafio. Aqui descrevemos um protocolo para produzir um mímico in-vitro do tumor-barreira sangue-cérebro usando células murino e/ou humanas e discutir sua relevância para a previsibilidade do sistema nervoso central tumor direcionamento em vivo.
Resumo
Altamente seletivo por natureza, a barreira hemato - encefálica (BBB) é essencial para a homeostase do cérebro em condições fisiológicas. No entanto, no contexto de tumores cerebrais, a seletividade molecular do BBB também protege as células neoplásicas, bloqueando a entrega de agentes quimioterápicos administrados perifericamente. O desenvolvimento de novos medicamentos (incluindo nanopartículas) alvejando tumores cerebrais malignos idealmente requer o uso de modelos animais pré-clínicos para estudar o efeito do remédio transcytosis e eficácia antitumoral. De conformidade com o princípio do 3R (refinar, reduzir e substituir) para reduzir o número de animais de laboratório na configuração experimental e realizar a seleção da elevado-produção de uma grande biblioteca de agentes antitumorais, desenvolvemos um humano in vitro podem ser reproduzido e mímico murino do tumor-barreira sangue-cérebro (BBTB) usando culturas de três camadas de células endoteliais, astrócitos e esferas de glioblastoma paciente-derivado. Para maior escalabilidade e reprodutibilidade, linhas comerciais de célula ou células imortalizadas têm sido utilizadas em condições sob medidas para permitir a formação de uma barreira que se assemelha o BBB real. Aqui descrevemos um protocolo para obter uma mímica BBTB por células endoteliais em contacto com astrócitos em densidades de célula específica em inserções de cultivo. Este mímico BBTB pode ser usado, por exemplo, para a quantificação e a imagem latente confocal da passagem de nanopartículas através das barreiras endoteliais e hamartomas, além da avaliação da célula de tumor como alvo dentro o mesmo ensaio. Além disso, mostramos que os dados obtidos podem ser usados para prever o comportamento de nanopartículas em modelos animais pré-clínicos. Em uma perspectiva mais ampla, este modelo in vitro pode ser adaptado para outras doenças neurodegenerativas, para a determinação da passagem de novas moléculas terapêuticas através do BBB e/ou ser suplementado com cérebro organoids diretamente, avaliar a eficácia de drogas.
Introdução
A unidade neurovascular é composta de neurônios, astrócitos e o BBB, formado pela intrincada conexões entre pericitos, astrócitos, células endoteliais e a membrana basal associada, formando o cérebro microvasculatura1. Esta apertado parede celular formada pelos navios contínuos, nonfenestrated finamente regula o movimento de íons e moléculas (incluindo hormônios, nutrientes ou medicamentos), mas também de células1em circulação. O transcytosis notavelmente baixa através do BBB de moléculas de alto peso molecular, tais como anticorpos terapêuticos, conjugados de drogas ou nanocompounds, restringe dramaticamente os avanços na descoberta de drogas para doenças neurológicas, incluindo maligno gliomas2. Na verdade, oralmente ou por via intravenosa entregues quimioterapias alcançar o parênquima cerebral frequentemente em inadequadamente baixas concentrações para induzir um efeito antitumoral ou são simplesmente incapazes de atravessar o BBTB para alcançar as células neoplásicas3. Vários estudos pré-clínicos e clínicos não tem lidado com a questão de penetração de BBTB mas tentaram perturbar o BBTB transitoriamente, por exemplo, usando o ultra-som focalizado4,5, ou para contorná-la pelo direto em situ entrega de drogas6. No entanto, nenhuma destas técnicas foram capazes de neutralizar a expansão do tumor inevitável ou ter uma recaída. Portanto, ao desenvolvimento de novas terapias antiglioma, a difusão através da BBTB deve ser considerada como um dos aspectos críticos para o sucesso na entrega dos agentes terapêuticos7.
Devido à complexidade das interacções célula dentro do BBTB, estudos in vivo em animais de laboratório parecem ser a escolha óbvia quando estudando a passagem das moléculas do sangue para o cérebro. No entanto, alta escala métodos in vivo são relativamente complexos para estabelecer e, portanto, não permitem o rastreio da elevado-produção de moléculas em um tempo razoável a um custo razoável. Ainda mais importante, experimentação animal tem de seguir a orientação ética 3R definida como i) refinam, ii) reduzir e, de relevância para o contexto atual, iii) substituir pelos protocolos alternativos (por exemplo, nos métodos de vitro/in silico). Portanto, recriando a BBTB in vitro aparece como uma possibilidade interessante e atraente, mas também constitui uma tarefa complexa, desafiada por várias limitações. Muitas tentativas de recriar este complexo compartimento com culturas primárias de células ou linhas de células de caninos, suínos, origem murino e até mesmo humana foram publicados (como comentado por reis et al.8 e Helms et al.9). Estes modelos incluem microfluidic tridimensional sistemas10, BBB-em-um-microplaqueta11,12, e multidões de variantes baseadas sobre as culturas co clássicas em insere sistemas. No entanto, sistemas microfluídicos e chip atuais são ou não adequados para estudos de validação droga rápida, alta produtividade13,14 ou são atualmente incompatível com estudos de entrega da droga para tumores cerebrais. Além disso, a revisão de 155 modelos publicados usando células primárias, células-tronco pluripotentes inducible (iPSC) ou linhas de células comerciais todas as inserções co cultivadas na mostraram uma tendência para interstudy discrepância em suas medições e/ou conclusões8. Esta falta de reprodutibilidade interlaboratorial poderia ser correlacionada com as condições de cultura i) não normalizada, por exemplo com o revestimento opcional com proteínas da matriz da membrana basal no vaso cultura celular, ii) um aumento do número de subcultura e uso de soro contendo mídia, os dois principais pilotos de modificações genéticas e fenotípicas da célula linhas15, ou iii) a dificuldade reproducibly recriar o equilíbrio certo entre o Ralevic e endoteliais componentes em um prato. Embora o uso de células imortalizadas ou célula comercial linhas para estabelecer um modelo in vitro de BBB carece de algumas das propriedades em relação aos modelos similares que usam apenas as células primárias, no método descrito, mostramos que a combinação certa de células exposições um muito desempenho comparável à publicação de estudos em outros modelos de referência16,17. Eventualmente, a falta de um modelo robusto e reprodutível para estudar a passagem de compostos terapêuticos alvejando tumores cerebrais através da BBTB motivou-na desenvolver os métodos descritos aqui.
Desde que o objetivo era usar o modelo para prever a entrega em vivo de nanopartículas em modelos animais pré-clínicos, nós primeiro validado o modelo BBTB, utilizando pastilhas contendo células endoteliais murino em contacto com astrócitos murino. Além disso, nós também aperfeiçoamos o modelo para usar certas linhas de células humanas. Uma vez estabilizado, as barreiras de célula são transferidas para culturas com esferas de glioblastoma paciente-derivado ou linhas de células de glioma comercial. Posteriormente, o transcytosis de nanopartículas e direcionamento de células do tumor podem ser visualizados por microscopia confocal e quantificada através da recolha de amostras ao longo do tempo. Importante, resultados obtidos usando a BBTB imita podem confiantemente prever o comportamento das nanopartículas em vivo, suportando o uso do prior BBTB imitar a validação pré-clínica.
Protocolo
As experiências com animais foram aprovadas pelo Comitê de Animal experimentos de distrito do Sul da Finlândia (ESAVI/6285/04.10.07/2014).
1. estabelecimento de imita o BBTB
Nota: Meio de cultura celular e suplementos são detalhados na tabela de materiais.
- Preparação de astrócitos
Nota: Os volumes seguintes são adequados para um prato de Petri de 10 cm ou um frasco de cultura celular T75.- Sob uma capa de cultura de células estéreis, Lave cuidadosamente os astrócitos cultivados com 5 mL de salina tampão fosfato (PBS). Suavemente, descartar a PBS usando uma bomba de vácuo e adicionar 2 mL de reagente de dissociação de célula por 5 min (a 37 °C, consulte a Tabela de materiais) para separar as células. Verifica o desprendimento de células sob o microscópio. Não exceda 5 min. de incubação para limitar a pressão sobre as células.
- Adicione 10 mL de meio de cultura celular estéril astrocyte completa (ABM +) para o navio para inibir a atividade do eritrócito de dissociação. Use uma pipeta estéril e serológica para transferir as células desanexadas do navio para um tubo estéril 15 mL. Centrifugar a suspensão de eritrócitos por 3 min em 250 rcf (aceleração: 9 rcf/s, desaceleração: rcf/s 5) à temperatura ambiente (RT).
- Enquanto isso, preparar as inserções (consulte a Tabela de materiais): utilizar Pinças esterilizadas, coloque as inserções com a cérebro para cima (figura 1A) na tampa de uma estéril 6 placa (figura 1B). Verificar de antemão que a placa pode ser colocada de cabeça para baixo sobre as inserções sem tocar ou mover as inserções durante o processo.
Nota: A colocação apropriada das pastilhas permite a compressão da suspensão astrocyte entre a membrana e o fundo do poço. - Depois de centrifugado, cuidadosamente descartar o sobrenadante da suspensão de células; resuspenda o pellet de astrocyte em 1 mL de ABM + por resuspending suavemente a pelota no tubo's de parede até 5x. Evite pipetagem excessiva das células para limitar a pressão sobre as células. Contar as células e ajustar a densidade de suspensão celular de 1,5 x 105 células, em 400 µ l de ABM + / inserir.
- Coloque a suspensão de células no meio do cérebro-lado da inserção da'membrana s (figura 1B) e espalhá-lo com muito cuidado, usando a força capilar com uma ponta de pipeta estéril. Evite o contato direto como a membrana é particularmente frágil.
- Com o lado do cérebro das pastilhas ainda em cima, coloque as inserções da placa 6. Isso garante que a suspensão de eritrócitos está preso entre a membrana e o fundo real do poço (Figura 1). Evite bolhas de ar na suspensão de célula, como vai evitar a propagação homogênea dos astrócitos na membrana.
- Coloque a placa e inserções, com o lado do cérebro, na incubadora (37 °C com 5% CO2) para permitir a aderência de célula para um mínimo de 2 h (astrócitos imortalizados murino) e até 6 h (astrócitos primárias humanas).
Nota: Como as inserções são mantidas de cabeça para baixo, a visualização da adesão celular não é possível sob um microscópio. Portanto, recomenda-se uma embarcação de cultura de célula normal separado da semente e a aderência de célula no vaso de controle ao longo do tempo. Manipulação cuidadosa da membrana é uma obrigação, como os resultados serão confiáveis quando as membranas estão danificadas. - No final do tempo de incubação, verificar a ausência de fugas de suspensão celular fora da área de propagação e descartar as inserções se eles estão com vazamento. Reverta a placa de 6 para sua posição normal, com inserções que agora terá o lado de sangue para cima (figura 1A). Adicione 2,6 mL de ABM + a cada poço. Despeje a 2,5 mL do meio de astrocyte completa em cada inserção e coloque a placa na incubadora (37 °C com 5% CO2).
- Preparação de células endoteliais
Nota: Para as cérebro murino microvascular células endoteliais (bEND3), as células devem chegar a confluência de 100% para garantir contatos celular máxima, provocando a expressão da proteína ideal junção apertada no dia do experimento. Isto não se aplica para as células endoteliais da veia umbilical humana (HuAR2T) como a presença de astrócitos é necessária uma junção apertada na expressão de proteínas para essas células.- Proceda como descrito anteriormente para os astrócitos (etapas 1.1.1 e 1.1.2.). Depois de centrifugado, cuidadosamente descartar o sobrenadante; Ressuspender as células endoteliais em 1 mL de meio de cultura de células endoteliais completa (EBM +) pipetando lentamente a suspensão de eritrócitos no tubo's de parede até 5x. Evite pipetagem excessiva das células para limitar a pressão sobre as células. Contar as células e ajustar a densidade de suspensão celular de 2 x 105 células em 2,5 mL/inserção do meio de cultura de células endoteliais desprovido de soro (EBM-) e fator de crescimento vascular endotelial-(VEGF-A).
- Retire a placa contendo as inserções, cuidadosamente descartar o meio do lado de sangue e substituí-lo com 2,5 mL de suspensão de células endoteliais. Devolve a chapa para a incubadora (37 °C com 5% CO2) e deixá-lo durante a noite para as células endoteliais aderir à membrana.
- No dia seguinte, prepare uma placa 6 estéril pela transferência de 3 mL de meio de astrocyte isento de soro escaldadas (ABM-) para cada poço. Manipulando as inserções com pinça estéril, cuidadosamente descartar o meio completo endotelial do lado de sangue, coloque a inserção da nova placa contendo ABM- e adicionar 2,5 mL de EBM-.
Nota: O uso de EBM - é fundamental para o estabelecimento da barreira endotelial (por favor, consulte a seção de discussão). - Embora as inserções na incubadora (37 °C com 5% CO2) com o mínimo de perturbação físico e variações de temperatura durante 5 dias, permitindo a produção da membrana basal endotelial, astrocyte contatos com células endoteliais e, eventualmente, a formação de BBTB imitar. Substituir o medium no dia da transferência em culturas de células de glioma (consulte a seção 1.4).
- Medição da permeabilidade de imitar BBTB (opcional)
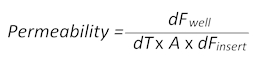
- Difusão passiva de sódio-fluoresceína a tintura fluorescente de pequeno peso molecular (at-Fl) ao longo do tempo do sangue para o lado do cérebro das pastilhas permite o cálculo dos valores de permeabilidade de acordo com a seguinte fórmula:
Aqui, dFbemé o valor de fluorescência medido no poço em um certo ponto do tempo menos o valor de autofluorescência de meio de cultura celular, dT é o tempo em segundos, A é a superfície da barreira em centímetros quadrados e dF,Inserir é o valor de fluorescência medido na inserção no mesmo ponto em tempo menos o valor médio de autofluorescência). - Coletar 100 µ l do meio de tanto sangue e os lados do cérebro de imitar o BBTB e transferir cada um da uma placa de 96 poços de fundo chato, preta separada para medições de fluorescência subsequentes. Use a mídia simples como o espaço em branco para corrigir a autofluorescência.
- Prepare-se 2,5 mL por bem do at-Fl (50 µM) em EBM-. Escaldar a solução at-Fl 37 ° c. Substitua a mídia do lado das pastilhas de sangue com a mídia que contém at-FL. iniciar um timer, assim como o meio é substituído.
- Cuidadosamente, coletar 100 µ l de mídia de tanto sangue e o lado do cérebro das pastilhas no 5, 30, 60 e 120 min. transferir cada amostra para separar os poços da placa de 96 poços de preto.
- Por conseguinte, substitua a mídia coletada de inserções para manter o equilíbrio de volume entre os dois lados. Coloque as inserções de volta na incubadora entre cada coleta de amostra para minimizar as variações de temperatura.
- Quantificar a fluorescência das amostras coletadas, utilizando um leitor com o filtro definido em 480/560 nm (excitação e emissão, respectivamente).
Nota: Fluorescência do lado do cérebro é quase indetectável no ponto de tempo de 5 min. Valores altos em comparação com o espaço em branco indicam uma fuga de / danos para a inserção de's membrana ou a barreira; Portanto, exclua estes de mais análises. Valores esperados de permeabilidade at-Fl para o BBTB será a 10-5 a 10-6 cm/s gama (tabela 1).
- Difusão passiva de sódio-fluoresceína a tintura fluorescente de pequeno peso molecular (at-Fl) ao longo do tempo do sangue para o lado do cérebro das pastilhas permite o cálculo dos valores de permeabilidade de acordo com a seguinte fórmula:
- Preparação de células de glioma
Nota: Apesar de glioblastoma paciente-derivado de esferas são usadas aqui, o seguinte protocolo pode ser facilmente adaptado para células de glioblastoma aderentes, comercialmente disponível como U - 87 MG.- Opcionalmente, para a imagem latente de imunofluorescência, coloque até quatro redondo borosilicato estéril de lamelas (ø 0,9 cm) por bem em uma placa de 6 contendo 2 mL de poli-D-lisina (0,01%). Incube a temperatura ambiente por 30 min.
- Entretanto, transferi com cuidado as esferas do tumor da nave cultura celular a um tubo estéril de 15 mL, usando uma pipeta estéril e serológica. Centrifugar as esferas de tumor por 3 min em 250 rcf.
- Desprezar o sobrenadante, delicadamente Resuspenda as esferas em 1 mL de bFGF/EGF-free (GBM) glioma celular médio e contar as células. Ajuste a densidade da célula para aproximadamente 104 esferas/mL (105 células/mL) em GBM-.
- Descartar o poli-D-lisina dos poços e enxaguá-los 3x com PBS estéril. A placa com 3ml/bem de suspensão de esferoide de tumor de sementes e transferir as inserções com a mímica do BBB sobre a suspensão de células de tumor.
- Incubar durante uma noite (37 °C com 5% CO2) para permitir que o equilíbrio entre o sangue e o cérebro lados de tumor do ensaio. No dia seguinte, substitua a mídia no lado de sangue com EBM-suplementado com as moléculas/drogas/nanopartículas de interesse. As amostras são coletadas ao longo do tempo para a quantificação directa conforme descrito na seção anterior. As células são fixadas em um ponto preciso de tempo para a imagem latente de fluorescência (por favor, consulte as seções 2.1 e 2.2).
2. High-Resolution Imaging Confocal da BBTB
Nota: 4% paraformaldeído (PFA, pH 7,4, 6 mL por replicar BBTB) está sempre preparado fresco em PBS. Mantê-lo no gelo.
Atenção: PFA é cancerígeno. Use luvas de nitrilo para lidar com PFA e preparar a solução sob uma coifa de química.
-
Expressão endotelial de BBTB das proteínas de junção apertada
- Lave os dois lados da membrana com PBS gelado (3 x por 5 min, 2,5 mL/inserir, 3ml/bem). Descartar a PBS e adicionar 3 mL e 2,5 mL de gelado 4% PFA no poço e na inserção, respectivamente. Incubar no gelo por 10 min. descarte o PFA (de acordo com a instituição'eliminação de químicos perigosos s) e lavar 3x com PBS em RT (informativo 2,5 mL, 3 mL/poço).
Nota: Depois de fixadas, as amostras podem ser armazenadas em PBS (informativo 2,5 mL, 3 mL/poço) a 4 °C por uma semana. - Use um cotonete para limpar o lado do cérebro da inserção e remover os astrócitos. Usando um bisturi afiado, cuidadosamente, corte a membrana em quatro partes iguais, fazendo dois cortes perpendiculares, formando uma cruz. Em seguida, inserir o bisturi no ponto onde a membrana é fixada na parede de inserir e girar a inserção com a outra mão para libertar quatro amostras. Usando uma pinça fina, transferi com cuidado cada amostra para uma placa de 24 contendo 200 µ l de PBS/bem, com a sangue para cima em cada poço.
- Bloquear as membranas com 10% soro fetal bovino em PBS (por 30 min em RT, 200 µ l/poço). Preparar a solução de anticorpo de 1° para o immunostaining da junção apertada proteínas (Figura 1) (zonula occludens-1, claudin-5; por favor consulte a Tabela de materiais) em 200 µ l de solução/poço de bloqueio. Opcionalmente, célula endotelial identidade é verificada pela adição de um anticorpo contra a molécula de adesão de célula endotelial de plaquetas (PECAM1 ou CD31; por favor consulte a Tabela de materiais) para cada solução de anticorpo junção apertada. Descartar a solução de bloqueio e incubar com os anticorpos primários' O/N a 4 °C.
- No dia seguinte, descartar os anticorpos primários e lave-as com 200 µ l de PBS (3 x por 5 min em RT). Incube-os com apropriado anticorpos secundarios conjugados fluoróforo espécie-específicos (diluição 1: 500, 200 µ l/poço, diluído em solução de bloqueio; por favor consulte a Tabela de materiais) por 2 h no RT
- Descartar os anticorpos secundários, enxaguar com 200 µ l de PBS (3 x por 5 min em RT). Remover a PBS e counterstain os núcleos de células usando um 4', solução de 6-diamidino-2-phenylindole (DAPI) em uma concentração final de 1 µg/mL em água destilada pura H2O (dH2O; 200 µ l/poço; por favor consulte a tabela de materiais ). Incubar durante 7 min na RT. Remove o DAPI e lavar as membranas 3 x com dH2O (200 µ l/poço).
- Coloque uma gota de meio de montagem (ver a Tabela de materiais) em um vidro de microscópio. Usando uma pinça fina, cuidadosamente pegue a membrana do poço e mantendo a orientação, retirar o excesso de dH2O e coloque-o sobre a entrega do meio de montagem. Adicionar mais uma gota de meio de montagem na parte superior da membrana e cobri-lo cuidadosamente com um vidro borosilicato. Certifique-se de que não há nenhuma bolha de ar aprisionado. Armazene as amostras a 4 °C e longe da luz até observações de microscopia confocal.
Nota: Astrocyte coloração pode ser executada, colocando as peças das membranas na placa de 24 com o lado do cérebro para cima e com o uso de anticorpos de astrocyte específicos selecionados (por exemplo, dirigido contra a proteína ácida fibrilar glial [GFAP]) (Figura 1E ).
- Lave os dois lados da membrana com PBS gelado (3 x por 5 min, 2,5 mL/inserir, 3ml/bem). Descartar a PBS e adicionar 3 mL e 2,5 mL de gelado 4% PFA no poço e na inserção, respectivamente. Incubar no gelo por 10 min. descarte o PFA (de acordo com a instituição'eliminação de químicos perigosos s) e lavar 3x com PBS em RT (informativo 2,5 mL, 3 mL/poço).
-
Fluorescência BBTB coloração para detectar transcytosis de nanopartículas
- Executar ao vivo-celular lisossoma rotulagem (por exemplo, usar fluorescente sondas [consulte a Tabela de materiais]). Diluir o corante fluorescente lisossoma numa concentração de trabalho de 50 nM em escaldadas EBM - (2.5 mL/inserção) ou com escaldadas ABM - 75 mm (3 mL/poço) para a lisossoma rotulagem de células endoteliais e astrócitos, respectivamente. Incube as celulas por 45 min (37 °C com 5% CO2); em seguida, enxágue 3x com PBS gelado (informativo 2,5 mL, 3 mL/poço).
- Descartar a PBS e adicionar 3 mL e 2,5 mL de gelado 4% PFA para o bem e para a inserção, respectivamente. Incube-los no gelo durante 10 min. descarte o PFA e enxágue as células 3 x com PBS (em RT, informativo 2,5 mL, 3 mL/poço).
Nota: Depois de fixadas, as amostras podem ser armazenadas em PBS (informativo 2,5 mL, 3 mL/poço) a 4 ° C por uma semana. - Remover a PBS e counterstain os núcleos de células usando uma solução DAPI em uma concentração final de 1 µ g/mL em dH2O (1 mL/insert, 1 mL/poço). Incube-os por 7 min em RT. Remove o DAPI e lavar as membranas 3 x com dH2O (informativo 2,5 mL, 3 mL/poço).
- Cortar a membrana, Retire cuidadosamente o excesso de dH2O e coloque-a sobre uma gota de meio de montagem (ver a Tabela de materiais) em um vidro de microscópio. Adicionar mais uma gota de meio de montagem do outro lado da membrana e cobri-lo cuidadosamente com um vidro borosilicato. Evite bolhas de ar aprisionado. Armazenar as amostras a 4 °C e mantê-los protegidos de luz até imagem de microscopia confocal.
-
Fluorescência de coloração de células tumorais
- Usando uma pinça fina, transferi com cuidado as lamelas redondas contendo as esferas do tumor para uma placa de 24 repleto de PBS gelado. Proceder com live-celular lisossoma rotulagem utilizando sondas fluorescentes lisossoma em 75 nM em escaldadas GBM - (200 µ l/poço). Incubar as amostras por 45 min; em seguida, enxágue-os 3x com PBS gelado (200 µ l/poço).
- Descartar a PBS e adicionar 200 µ l de PFA gelada por bem. Incubar no gelo por 10 min. descarte o PFA e enxágue as amostras 3 x com PBS (na RT).
Nota: Depois de fixadas, as amostras podem ser armazenadas em PBS (200 µ l) a 4 ° C, durante uma semana. - Remover a PBS e counterstain os núcleos de células usando uma solução DAPI em uma concentração final de 1 µ g/mL em dH2O (200 µ l/poço). Incube-os por 7 min em RT. Remove o DAPI e lavar as lamelas 3 x com dH2O (200 µ l/poço).
- Usando uma pinça fina, retire a lamela, retirar o excesso de dH2O e coloque-a sobre uma gota de meio de montagem (ver a Tabela de materiais) em um vidro de microscópio. Evite entrapping quaisquer bolhas de ar. Armazenar as amostras a 4 °C e mantê-los protegidos de luz até observações de microscopia confocal.
3. in Vivo estudo comparativo
- Gravação no local de difusão de sódio-fluoresceína através do BBB
- Prepare 150 µ l de uma solução de at-Fl 50 nM em uma solução fisiológica. Manter a solução a 37 °C no momento da entrega por via venosa.
- Anestesia um rato com uma injeção intraperitoneal de uma cetamina/xilazina cocktail (300 µ l de 100 mg/kg quetamina e 10 mg/kg de xilazina em PBS). Uma vez estabelecida anestesia profunda, coloque o animal em uma almofada de aquecimento para manter a sua temperatura de corpo.
Nota: Dez semanas Naval Medical Research Institute (NMRI) nude imunocomprometidos ratos fêmeas têm foi usados para obter os dados apresentados na Figura 2. No entanto, este protocolo é adaptado para camundongos imunocompetentes e imunodeprimidos. O método de anestesia/analgesia é o cientista'critério s. No entanto, anestesia por inalação como o isoflurano não é recomendada, pois aumenta significativamente a permeabilidade BBB18. - Coloque o mouse em uma armação estereotáxica (consulte a Tabela de materiais) e realizar uma incisão longitudinal do couro cabeludo com tesoura fina, seguida por gentil dilaceração do tecido conjuntivo, usando uma pinça fina, para revelar o crânio. Usando movimentos circulares com uma microdrill bem, retire uma peça circular de crânio ø 0,3 mm no osso parietal esquerdo ou direito. Proceda com extrema cautela durante a perfuração e ao remover o pedaço do crânio para evitar ferir o tecido subjacente meníngeo e vasos sanguíneos.
- Coloque uma gota de solução fisiológica sobre o tecido exposto. Usando dois pares de pinças bem, Retire cuidadosamente o tecido meníngeo para acessar o córtex cerebral. O tecido cerebral nunca deve ser em contato direto com o ar.
Nota: Hemorragias menores de lesão meníngea podem ser paradas usando esponjas hematológicas (por favor, consulte a Tabela de materiais). - Uma vez que o tecido meníngeo é removido e o córtex está completamente exposto, armou uma gota de solução fisiológica entre o córtex e uma lamela de borosilicato ø 0,5 mm. Proteja a área de observação com uma gota de cola de cianoacrilato (consulte a Tabela de materiais) espalhou a lamela com uma agulha. Deixe a cola secar durante 1 min.
- Prepare o cateter implantável para a injeção de veia de cauda (Figura 2A). Quebrar a ponta de uma agulha 25g usando pinça Rochester-Ochsner e insira a ponta de um tubo poliuretano PE20 de 10 cm de comprimento (consulte a Tabela de materiais) (Figura 2A).
- Inserir o cateter na veia lateral da cauda do rato, utilizando grampos de buldogue para a manipulação do cateter e inserção (consulte a Tabela de materiais) (Figura 2B). Fixe a agulha inserida com uma gota de cola de cianoacrilato. Deixe a cola secar durante 20 s antes de remover o grampo de buldogue. Cuidadosamente, conecte a outra extremidade do cateter com uma agulha 25g conectada a uma seringa contendo a solução de at-Fl (Figura 2B).
- Nota: Não fixar a cauda com a braçadeira de buldogue; Só é usado para manipulação de cateter precisos. Inserção de cateter apropriado pode ser confirmada pelo refluxo de sangue para o tubo transparente.
- Colocar o animal sob o microscópio estereoscópico (consulte a Tabela de materiais). Usando a autofluorescência de baixo nível no canal verde (480 nm), concentre-se em uma região que contém relativamente grandes vasos sanguíneos (eles aparecem mais escuros devido à absorção de hemoglobina de luz neste comprimento de onda) e pequenos capilares (Figura 2). Inicie a aquisição de lapso de tempo brevemente antes de injetar o corante fluorescente para obter uma medida da fluorescência do fundo.
Nota: Alternativamente, a gravação de lapso de tempo pode ser substituída por imagens de instantâneo de T0 e de qualquer outro predeterminado pontos de tempo. - Injetar a solução em um ritmo lento e contínuo, ou alternativamente, usar um sistema automatizado de infusão. A at-Fl fluorescência detectada no sangue deve permanecer estável (Half-Life no sangue: 286 min), que permite que uma gravação de difusão BBB pela janela craniana durante vários minutos. Uma vez concluída a aquisição, cuidadosamente remova o cateter e eutanásia do animal por deslocamento cervical.
- Determinação in vivo da permeabilidade do BBB
Nota: Valores são obtidos a partir de qualquer software de processamento de imagem, como o ImageJ, permitindo a medição da intensidade da fluorescência sinal dentro de uma região personalizada de interesse (ROI).- Usando a ferramenta de anotação, desenhar um ROI em forma de retângulo fora de um vaso sanguíneo, no tecido cerebral, em cerca de 5 µm distância de qualquer visíveis vasos cheios at-FL. nota as dimensões do ROI e a intensidade de fluorescência medidos no T0 em que ROI, que é usado como em branco para o tecido's autofluorescência. Sem deslocando o ROI, avance para um tempo de postinjection ponto (por exemplo, para o muito último quadro gravado quando a solução inteira tenha sido injectada ao animal) e observe os valores precisos de tempo e fluorescência medidos dentro o ROI (Figura 2).
- Mover o ROI em um vaso sanguíneo visível (Figura 2) e observe o valor de autofluorescência T0 do sangue. Sem deslocando o ROI, avance para o mesmo ponto de tempo conforme definido na etapa 3.2.1. e observe o valor de fluorescência medido dentro o ROI (Figura 2).
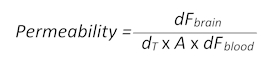
- Use a seguinte fórmula (adaptada de seção 1.3) para determinar a permeabilidade do BBB:
- Aqui, dFcérebro é o valor de intensidade de fluorescência menos o valor em branco T0 no cérebro, dT é o ponto de aquisição de tempo em segundos, A é a área de superfície aproximada embarcação, tomada como área de ROI em centímetros quadrados e dF sangue é o valor de intensidade de fluorescência menos o valor de T0 em branco no sangue.
Nota: Valores de permeabilidade esperado para o BBB devem ser no intervalo 10-6 cm/s (tabela 1).
- Tecido de processamento para a detecção de nanopartículas fluorescentes no cérebro murino
- Implante o paciente-derivado glioblastoma esferas (5 x 104 células em 5 µ l de PBS estéril) em anestesiados 6 semanas de idade NMRI nus camundongos fêmeas no corpo caloso. Localize esta região do cérebro nas seguintes coordenadas estereotáxicos, a partir do Bregma: ântero-posterior + 0,5 mm, esquerda para a direita + 2,5 mm, dorsoventral + 3 mm. permitir que o tumor de cérebro a crescer durante 2 semanas.
- Injetar as nanopartículas por via intravenosa (100 µ g em 100 µ l de solução fisiológica estéril) e lhes permitem circular para 8 h. injetar os ratos controle por via intravenosa com 100 µ l de solução fisiológica estéril.
- Eutanásia em ratos por deslocamento cervical e coletar o cérebro rapidamente para snap-congelamento em isopentano mantido em gelo seco (1 min-50 °C). Armazene o cérebro a-80 °C até o processamento do tecido.
- Seções de coronal do cérebro com um cryomicrotome de corte. Localize a implantação intracraniana a cicatriz formou-se no córtex e cortar 9 µm de espessura seções dessa área para as lâminas de microscópio apropriado (consulte a Tabela de materiais).
- Mergulhe as seções do cérebro que são imobilizadas nos slides em PBS gelado (2 x por 5 min) e, em seguida, corrigi-los na gelada 4% PFA (por 5 min). Lavar as lâminas em PBS (3 x por 5 min em RT). Coloque as lâminas na horizontal e pipetar o bloqueio solução contendo 10% bovina soro fetal em PBS sobre o tecido das seções cobrindo toda a superfície (por 1h no RT, 500 µ l/slide). Preparar o anticorpo CD31 (consulte a Tabela de materiais) em 250 µ l de solução/slide de bloqueio. Substitua a solução de bloqueio com o anticorpo e incubar durante uma noite a 4 °C em uma câmara umidificada.
- No dia seguinte, mergulhe os slides em PBS (3 x por 5 min em RT) e incube-os com o correspondente fluoróforo conjugado anticorpo secundário (1: 500 em 250 µ l de PBS durante 2 h em RT). Lavar 3x com PBS (na RT) e counterstain o núcleo de células usando uma solução DAPI em uma concentração final de 1 µ g/mL em dH2O (250 µ l/slide). Incubar as amostras por 7 min em RT. Remove a solução DAPI e lavar os slides 3 x com dH2O.
- Em cada seção de tecido, adicionar uma gota de meio de montagem (consulte a Tabela de materiais) e fixe as amostras com uma lamela. Evite entrapping bolhas de ar. Armazenar as amostras a 4 °C e mantê-los protegidos de luz até observações de microscopia confocal.
Resultados
Imagem latente confocal dos imitam murino de BBTB mostra a expressão e a localização celular da junção apertada proteínas zonula occludens-1 (ZO-1) e claudin-5 em bEND3. Os contactos entre as células endoteliais e astrócitos claramente induziram a deslocalização das ZO-1 e claudin-5 para os contatos de célula-célula endotelial em comparação com as monoculturas de bEND3 (Figura 1). Usando a mancha para visualizar os astrócitos GFAP-expressando ao cérebro-lado da membrana, é possível observar e estudar os processos hamartomas e ponta-pés entrando em contato com as células endoteliais através da membrana (Figura 1E ). Os contatos astrocyte-endothelial da pilha são conhecidos por promover e estabilizar o aperto da barreira celular e estão associados com valores mais baixos de permeabilidade dos BBB19. Em conformidade com isso, observamos uma diminuição substancial na permeabilidade de mímica BBTB o rato para o at-Fl de 27.63 (± 3,45) x 10-6 cm/s em caso de monoculturas para 6,74 (± 3,01) x 10-6 cm/s quando co cultivadas com o hypoxia-inducible fator nocaute astrócitos (HIFko) (tabela 1). O HuAR2T imortalizado formam barreiras celulares altamente permeáveis (104.92 ± 27,1 x 10-6 cm/s, tabela 1). Semelhante ao modelo murino, medimos significativamente mais baixa permeabilidade do BBTB para at-Fl, nomeadamente 47,4 (± 14,32) x 10-6 cm/s, quando as células de HuAR2T foram co cultivadas com os humanos astrócitos primários (tabela 1).
Em murino e humana imita BBTB, a presença das esferas paciente-derivado glioblastoma induzido um ligeiro aumento nos valores de permeabilidade em comparação com as culturas de co astrocyte-célula endotelial sozinho (tabela 1). Este fenómeno é observado com vários, mas nem todos o paciente glioma sphere modelos. Isto pode ser devido o VEGF-A que é secretada por algumas dessas células do paciente-derivado.
Para comparar os valores de permeabilidade do imita BBTB in vitro com o BBB em vivo, nós fotografada a difusão em tempo real do at-Fl através de uma janela craniana implantado em camundongos. Usando um microscópio de fluorescência, a difusão de at-Fl de vasos sanguíneos capilares derivar os principais vasos sanguíneos pial foi gravado antes, durante e após a injeção sistêmica da sonda (Figura 2). Medições dos valores de fluorescência diferencial da circulação do sangue e cérebro do parênquima cortical ao longo do tempo nos permitiram calcular os valores aproximados da permeabilidade do mouse nude's BBB para at-Fl (5,57 ± 2,19 x 10-6 cm/s, Tabela 1).
Para ilustrar como este mímico BBTB pode ser usado para visualização da passagem de compostos a partir para o lado do sangue para o lado do cérebro, comparou-se o transcytosis de ø 110 nm (NP110) e ø 350 nm (NP350) nanopartículas direcionamento paciente-derivado glioblastoma esferas. Os resultados obtidos in vitro foram então comparados com o transcytosis in vivo. No exemplo apresentado, nanopartículas foram revestidos na superfície com o peptídeo tumor-direcionamento CooP20 em carregado com o corante fluorescente (FITC) para facilitar a visualização. Nós rotulado as células usando a tintura dos lisossomos e counterstained com DAPI 24 h após a adição das nanopartículas FITC do lado do sangue de BBTB a imitar e adquiriu confocal micrografias em diferentes níveis (por exemplo, o lado do sangue, a membrana, o lado do cérebro, e as esferas de glioblastoma paciente) (Figura 3A). O sinal fluorescente associadas NP110 colocalized com os lisossomos nas células endoteliais, astrócitos e células tumorais. Além disso, NP110s foram detectados no meio das células endoteliais e astrócitos, passando através dos poros da membrana da inserção (Figura 3A).
A passagem do NP110s foi quantificada medindo-se a fluorescência das amostras coletadas de lado o sangue e o cérebro. Esses valores de permeabilidade foram comparados àqueles determinados para as nanopartículas de ø 350 nm (NP350). Os resultados mostram que apenas NP110 era capaz de atravessar a imita BBTB (Figura 3B). NP350 permaneceu do lado do sangue da mímica BBTB, o que resultou em valores mais baixos de permeabilidade para essas nanopartículas.
Para destacar a relevância da BBTB imita em comparação com os modelos in vivo, camundongos por via intravenosa foram injetados com nanopartículas de NP110 ou NP350 revestido com o peptídeo tumor-direcionamento CooP e conjugados com corante vermelho fluorescente (TRITC) para a deteção. Tecidos colhidos em vários pontos de tempo revelaram que após 8 h, BBB-permeável nanopartículas tem extravasado para o parênquima cerebral, enquanto o nonpermeable aqueles que ficaram na circulação principalmente foram retirados com a circulação sistêmica em vivo. Portanto, recolhidos os cérebros e quantificado o número de nanopartículas por milímetro quadrado postinjection de 8 h. Em conformidade com os resultados in vitro, NP110, mas não NP350, com sucesso extravasado para o parênquima cerebral (Figura 3). Imagens de alta ampliação da localização de nanopartículas no cérebro mostraram que NP110 era homogeneamente distribuídas no parênquima cerebral fora os capilares sanguíneos e adaptadores de rede com êxito para as células de glioblastoma implantado (Figura 3D). Apesar de exibindo o tumor mesmo direcionamento moiety (CooP), NP350 era incapaz de extravasate para o parênquima cerebral e só foi detectado dentro do lado luminal do cérebro dos vasos sanguíneos (Figura 3E), semelhantes aos resultados obtidos in vitro.
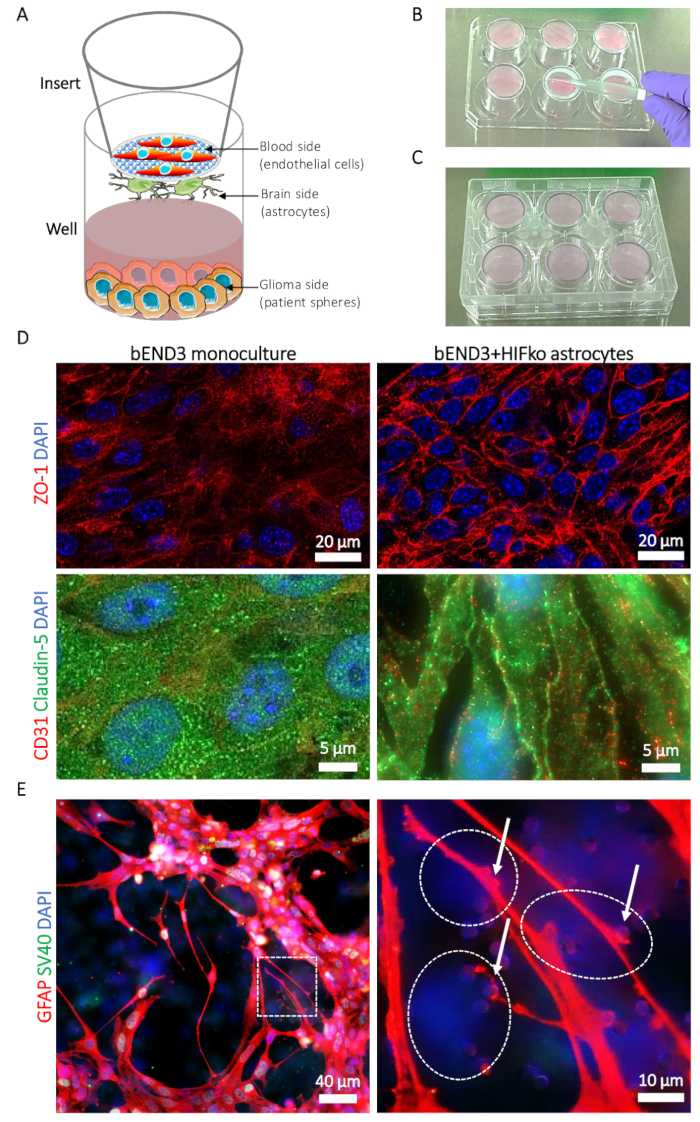
Figura 1: Descrição do modelo de tumor-(BBTB) a barreira sangue-cérebro. (A) representação esquemática das posições dos diferentes tipos de células. (B) ilustração da inserção colocação sobre a tampa da placa de 6-poços e a técnica de semeadura para os astrócitos do lado do cérebro da inserção da'membrana s. (C) ilustração do estágio 6 placa permitindo a adesão astrocyte. (D) micrografias de imunofluorescência da junção apertada proteínas zonula occludens-1 (linha ZO-1, superior, vermelho) e claudin-5 (linha inferior, verde). A expressão da proteína é comparada com as cérebro murino microvascular células endoteliais (bEND3) cultivadas no lado de sangue do BBTB sozinho, como uma monocultura (coluna esquerda) ou com murino imortalizado HIFko astrócitos (coluna direita). Núcleo de células é counterstained com DAPI (azul). (E) Micrografia de imunofluorescência mostrando a proteína ácida fibrilar glial (GFAP, vermelho) em astrócitos HIFko cultivados ao lado de BBTB o cérebro. A imagem de alta ampliação mostra processos astrocyte e ponta-pés (setas) entrar em contato com as células endoteliais através da membrana poros (painel direito). A identidade de astrócitos o HIFko foi verificada pela mancha da imunofluorescência do simian virus 40 grande T antígeno (SV40 grande T, verde) utilizado para o immortalization das células. Células endoteliais expressam a GFAP nem o T grande SV40 e, portanto, podem ser parcialmente observadas através do transparente, em frente ao lado da membrana como DAPI somente células coradas (linhas tracejadas). Núcleo de células é counterstained com DAPI (azul). Clique aqui para ver uma versão maior desta figura.
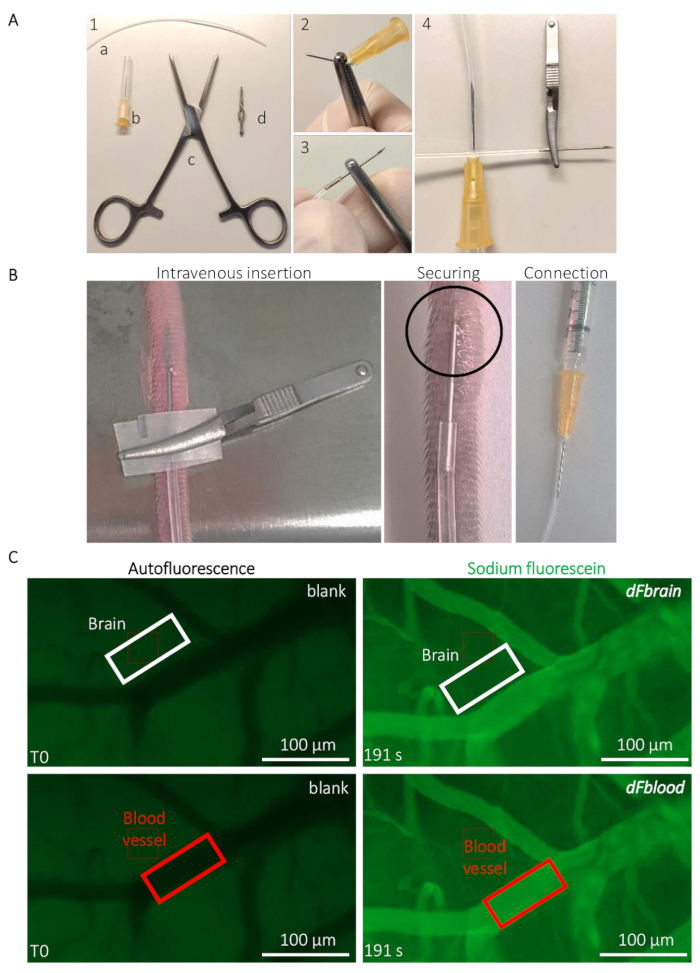
Figura 2: Intravital determinação ao vivo do mouse permeabilidade BBB. (A) preparação do cateter implantável veia caudal. (1) ferramentas e equipamentos são os seguintes: (a) um PE20 tubo de polietileno (b) dois 25 G agulhas (c), Rochester-Ochsner fórceps e (d) um pequeno buldogue braçadeira. (2) A 25 G de agulha é removida por diversas torções usando a pinça e (3) cuidadosamente inserido no tubo. (4), do outro lado do tubo é conectado a outra agulha 25g. (B) orientação para a implantação do cateter e posicionamento para administrar a solução de sódio-fluoresceína na veia da cauda de um rato. A área de um círculo indica a área onde uma gota de cola de cianoacrilato é colocada para fixar o cateter. A pinça bulldog é usada para manipular o cateter e removida quando o cateter está segura. (C) representante imaging e quantificação método para determinar os valores de permeabilidade do sódio-fluoresceína. Antes da infusão de sódio-fluoresceína (coluna esquerda), mede-se a autofluorescência/em branco dentro de uma região de interesse (ROI) colocada sobre o cérebro (retângulo de painel superior, branco) e áreas de vaso sanguíneo (retângulo de fundo do painel, vermelho). Durante a infusão de sódio-fluoresceína (coluna direita), a intensidade da fluorescência é medida em ambos os ROIs, permitindo o cálculo da permeabilidade do BBB. Clique aqui para ver uma versão maior desta figura.
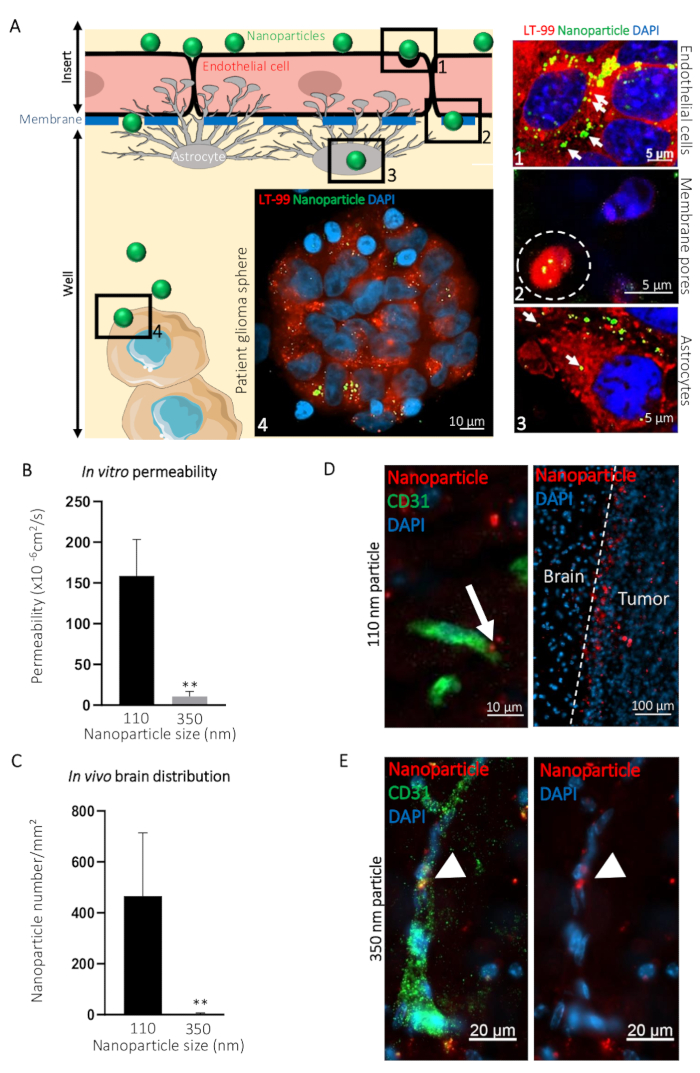
Figura 3: previsão do transcytosis intracerebral de nanopartículas através de BBB in vivo usando o modelo in vitro de BBTB. (A) representação gráfica do ensaio BBTB com imagens confocal representante obtidos nos diferentes níveis do modelo murino BBTB indicados. Nanopartículas de 110 nm de diâmetro (NP110) e conjugado com FITC (verde) foram adicionados ao sangue foram rotulados de lado das células BBTB com a sonda dos lisossomos (LT-99, vermelho). (1) Endothelial cells, (2) Endothelial transcytosis das nanopartículas através dos poros da membrana (linha branca tracejada), astrócitos (3), e (4) paciente glioblastoma esferas são identificadas no gráfico e correspondentes micrografias confocal (à direita). Encapsulamento dos lisossomos das nanopartículas (setas) sugere transcytosis ativo através das camadas endoteliais e astrocyte do BBTB. (B) quantificação da permeabilidade de nanopartículas indicado através do BBTB in vitro (n = 6). (C) quantificação da densidade nanopartículas indicado no tecido cerebral das seções, 8 h após a infusão de veia caudal dos camundongos nus (n = 3). (D) Confocal micrografias mostrando a distribuição da ø 110 nm nanopartículas (NP110, vermelho) em cortes de tecido de cérebro murino rotulado com um anticorpo de CD31 anti-rato (verde). A seta realça o transcytosis de nanopartículas (painel esquerdo). Nanopartículas acumularam ao redor das células de tumor de cérebro (tumor, painel direito) devido a CooP-direcionamento peptídeo apresentado em sua superfície. Nenhuma orientação significativa é observada no tecido do cérebro (cérebro). (E) Confocal micrografias mostram a distribuição da ø 350 nm nanopartículas (NP350, vermelho) em cortes de tecido de cérebro murino rotulados com um anticorpo de CD31 anti-rato (verde). Setas apontam para os NP350s que foram retidos no lúmen dos vasos sanguíneos e não foram capazes de atravessar o BBB, provavelmente devido a seu diâmetro maior, em comparação com o núcleo de células NP110s. são counterstained com DAPI (azul). P < 0,01. P-valores foram calculados usando um teste bicaudal, não paramétrico de Mann-Whitney U. As barras de erro representam o desvio padrão. Clique aqui para ver uma versão maior desta figura.
| murino mímico BBTB | bEND3 | bEND3 + HIFko como | bEND3 + GB | bEND3 + HIFko como + GB | In vivo |
| Permeabilidade (10-6 cm/s) | 27.63 | 6,74 | 26,8 | 10.83 | 5,57 |
| SD (10-6 cm/s) | 3.45 | 3.01 | 7.99 | 2,65 | 2.19 |
| mímica BBTB humana | HuAR2T | HuAR2T + hIAs | HuAR2T + GB | HuAR2T + hIAs + GB | |
| Permeabilidade (10-6 cm/s) | 104.92 | 47,4 | 89.08 | 48.24 | |
| SD (10-6 cm/s) | 27.1 | 14,32 | 10.21 | 13.07 |
Tabela 1: valores de permeabilidade de sódio-fluoresceína (at-Fl) (em centímetros por segundo) determinado em vitro nos sistemas de cultura co indicado e in vivo em camundongos NMRI. Dados de uma experiência representativa (n = 3 ratos).
Discussão
O surgimento do conceito de variabilidade de tumor interpatient rejuvenescido a pesquisa sobre o câncer personalizado medicina21. Esta variabilidade é também uma marca registrada de Neoplasias do sistema nervoso central. Devido à imprevisibilidade do tumor, resposta à quimioterapia adiciona o efeito de abrigo do BBB para a entrega da droga e completamente constitui maiores desafios na assistência ao paciente22. A fim de desenvolver terapias mais eficazes, muitas vezes é necessário grandes bibliotecas de tela de novas moléculas. Para avaliar a eficácia antitumoral e a capacidade dos novos contatos terapêuticos para chegar ao local do tumor, a melhor opção é o estudo pré-clínicos em células derivadas de paciente implantado no vivo em avatares pacientes murino. Devido a prática (recursos financeiros, de tempo, humanos e instalações) e razões éticas (o princípio do 3R ao usar animais de laboratório), o desenvolvimento de uma plataforma de triagem em vivo em grande escala tais muitas vezes não é possível e, portanto, os ensaios cell-based continuam a ser um modelo de escolha23. A razão principal para a seleção de estabeleceu linhas celulares e evitar as células primárias é facilitar a reprodutibilidade e reduzir o uso de animais de laboratório, que são a principal fonte para o isolamento e o estabelecimento de culturas primárias de murino. Os métodos de apresentar aqui, cumprindo firmemente com a 3R, poderiam descartar eficientemente nanopartículas de uma ainda mais investigação pré-clínica sobre o critério de sua incapacidade de atravessar o modelo BBTB. Como um prova de princípio, descreveremos aqui as conclusões obtidas durante o desenvolvimento e validação do BBTB. Fomos capazes de confirmar os resultados in vitro in vivo, por exemplo, ao avaliar a difusão passiva de um 376 Da sódio-fluoresceína.
O protocolo descrito neste documento descreve a preparação de células endoteliais, cocultured com astrócitos para formar uma sangue-cérebro tumor barreira-interface em uma configuração in vitro. Uma vez estabelecido um contato físico entre esses tipos de duas células, a camada de células endoteliais apresenta semelhanças com o BBB (por exemplo, uma célula superfície expressão de proteínas de junção apertada e relativamente baixa permeabilidade). Curiosamente, a mímica BBTB murino parecia fornecer valores de permeabilidade at-Fl particularmente semelhantes aos obtidos com o mouse em vivo BBB permeabilidade medições24. Portanto, o desempenho de imita o BBTB será vinculado diretamente à escolha das células usados para formar a barreira. As células endoteliais bEND3 se originam do cérebro e são sabidas para ser bem sucedido na formação barreiras quando cocultured com astrócitos25. No entanto, temos vindo a utilizar o imortalizado de astrócitos HIFko26 para gerar a mímica BBTB. Devido à sua falta de hypoxia-inducible factor, não produzem estes astrócitos VEGF-A, que é por excelência na estabilização a mímica BBTB descrita aqui. Astrócitos foram identificados como moduladores da permeabilidade do BBB, por exemplo através da liberação de VEGF-A, em resposta ao neuroinflammation27. Ativação dos receptores de fator de crescimento endotelial vascular (VEGFRs) é um regulador chave da permeabilidade vascular endotelial/tanto em vitro28 e29de in vivo. Portanto, suplementos de VEGF-A no meio de ativam o VEGFR2 sobre as células endoteliais, que induz a fosforilação de proteínas de junção aderente como VE caderina30. A perda de contatos de célula-célula endotelial gera altamente permeáveis dos vasos sanguíneos. Da mesma forma, tanto a propriedade mitogênico forte e composição desconhecida do fetal bovino sera usado em ensaios de cultura a célula causam grandes questões na reprodutibilidade de estabilização e ensaio de barreira.
Células endoteliais da veia umbilical humana (HX) são por vezes utilizadas para formar o BBB em vitro31; no entanto, significativamente diferem as células endoteliais microvascular do cérebro, tais como a célula D3/hCMEC linha32, em termos de expressão gênica e formadoras de barreira Propriedades. No entanto, a permeabilidade relativamente mais elevada valores obtidos com as células de HuAR2T crescidas sozinhos em comparação com o bEND3 foram reduzido por coculturing-los com astrócitos primários humanos. Embora as células endoteliais são necessários para formar a parede celular, é claro que os astrócitos têm um papel igualmente importante para a formação de BBTB e estabilização.
Quando esferas de paciente-derivado glioma foram adicionadas a esta equação, a mímica BBTB de rato recapitulada algumas das características de xenografts murino, tais como a difusão de drogas através da vasculatura cerebral e o direcionamento de célula de tumor. A imita BBTB discutida aqui conseguiram, por exemplo, espelhando o comportamento in vivo quando nós selecionados vários nanopartículas com diâmetros diferentes. Para ilustrar o paralelismo entre os modelos in vitro e in vivo, usamos o silicato de mesoporos descrito anteriormente nanopartículas33 com célula-penetrante propriedades34 conjugada com o peptídeo tumor-direcionamento CooP na sua surface20. As CooP-direcionamento casas de peptídeos às células do tumor invasivo através da ligação específica ao inibidor crescimento mamário-derivado (MDGI). Vários tipos de câncer, incluindo gliomas, são superexpressão MDGI em comparação com o tecido normal,35, que torna o CooP um moiety tumor-direcionamento muito eficiente capaz de aumentar a entrega de uma carga de20. As nanopartículas usadas aqui foram mostradas anteriormente para se espalham o parênquima cerebral (27547955), e quando acrescida com Taxol, estes nano-cargas foram bem sucedidos em reduzir o crescimento de glioma em modelos pré-clínicos36. A adição de resíduos de polietileno glicol (PEG) na superfície das nanopartículas também manteve sua carga estática para valores positivos (em torno de + 4 mV), permitindo melhor interação com o neurovascular unidade37 e também aumentar sua estabilidade em circulação. Nos dados apresentados, 3 kDa de PEG foi conjugado com NP110s, enquanto NP350s foram revestidas com kDa 10 de PEG. No entanto, aumentado-peso molecular PEG também resultou em um aumento significativo do diâmetro de nanopartículas, portanto, suas capacidades físicas para cruzar o BBB. Portanto, verificamos se as dimensões físicas das partículas impediram sua passagem através do BBTB e se estas observações podem ser espelhadas em vivo.
Em conformidade com as observações anteriormente publicadas, observamos que NP110s extravasado através a BBTB in vitro e o BBB de ratos rolamento tumores intracranianas, enquanto NP350s retidos no lado luminal de imitar o BBTB e nos vasos sanguíneos dos ratos. Estes resultados semelhantes sugerem fortemente que o modelo BBTB previu a capacidade in vivo de nanopartículas para atravessar o BBB e chegar ao cérebro.
A relevância dos modelos de celulares do BBB é frequentemente discutida, até mesmo para a central entrega de nanopartículas38. Mostramos aqui que primário astrócitos e células endoteliais, ambos considerados como as mais relevantes ferramentas in vitro, podem ser substituídas por células imortalizadas e/ou comercialmente disponíveis, garantindo a reprodutibilidade e maior escalabilidade. A próxima geração da in-vitro BBB imita poderia ser desenvolvida, incorporando os dispositivos microfluídicos, permitindo neurovascular maravilhosamente formado unidades estruturalmente semelhantes a real BBB12,14. No entanto, tais modelos são atualmente inadequados para o rastreio da elevado-produção de moléculas entregado aos gliomas, devido a limitações técnicas no seguimento do entrega14. É realmente difícil capturar a complexidade fisiológica do BBB em um prato, e a eventual falta de algumas proteínas/receptores, conhecido por ser expressa pelo BBB, poderia comprometer a interpretação dos resultados. Outro argumento refere-se a grande variabilidade na expressão gênica entre condições in vivo e in vitro, bem como da linha de uma célula para outra, especialmente considerando as células endoteliais. No entanto, pode também ser alegado que a unidade neurovascular não é uma entidade uniforme dentro do cérebro de39. Investigação científica em biologia atingiu uma humana era onde o bem-estar animal, responsabilidade ética e o custo de utilização de vidas animais são sempre considerados antes de projetar um experimento. Portanto, para oferecer suporte a substituição de animais, um número crescente de estudos recentes mostra que a consciência das limitações dos modelos e a seleção cuidadosa dos modelos de celular para estabelecer a barreira — com destaque para os astrócitos — garante um correspondência entre os resultados obtidos em um prato e em animal modelos40. Com a metodologia descrita aqui, temos um passo para reduzir o número de animais utilizados para fins de transcytosis BBB para terapêutica potencial de rastreio.
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Esta pesquisa foi apoiada por concessões das organizações finlandês de câncer, Jane & Aatos Erkko Foundation e Sigrid Juselius Foundation (a paixao e V.L.J.), o Swiss National Science Foundation (Advanced Postdoc.Mobility conceder n: P300PB_164732, a S. K.), a Fundação de pesquisa de Orion (a S.K.), a Maud Kuistila Memorial Foundation (de S.K.) e a Academia da Finlândia (VILJAA 2017, conceder n: 314 498). A unidade de imagem Biomedicum (Helsínquia) é reconhecida por fornecer a microscopia facilidade do núcleo de imagem.
Materiais
| Name | Company | Catalog Number | Comments |
| Cells | |||
| bEND3 | ATCC | CRL-2299 | Cultured in: DMEM (1g/L glucose) supplemented with 10% FBS, 5 mL L-glutamine and 5 mL penicillin/streptomycin |
| HIFko immortalized mouse astrocytes | Isolated in Dr. Gabriele Bergers Lab | https://doi.org/10.1016/S1535-6108(03)00194-6 | Cultured in: BME-1 supplemented with 5% FBS, 5 mL 1 M HEPES, 5 mL 100 mM sodium pyruvate, 3 g D-glucose and 5 mL penicillin/streptomycin |
| HuAR2T | Isolated in Dr. Dagmar Wirth Lab | https://doi.org/10.1089/ten.tea.2009.0184 | Cultured in: EBM-2 with SupplementMix |
| normal human primary astrocytes | Lonza | CC-2565 | Cultured in: ABM with SingleQuots |
| Material and reagents | |||
| 100 mm x17 mm Dish, Nunclon Delta | ThermoFisher Scientific | 150350 | |
| 10 mL serological pipet | ThermoFisher Scientific | 170361 | |
| 15 mL Conical Sterile Polypropylene Centrifuge Tubes | ThermoFisher Scientific | 339650 | |
| ABM Basal Medium, 500 mL | Lonza | CC-3187 | For primary human astrocytes. ABM+: contains all the additives from the supplement mix. ABM-:all the additives except for rhEGF and FBS |
| Accutase Cell Detachment Solution | Corning | 25-058-CI | |
| AGM SingleQuots Supplements and Growth Factors | Lonza | CC-4123 | |
| B27 supplement | Gibco | 17504-044 | for both GBM + and - medium |
| Basal Medium Eagle | ThermoFisher Scientific | 21010046 | BME-1 |
| Corning Costar TC-Treated 6-Well Plates | Sigma-Aldrich | CLS3506 | |
| Corning Transwell polyester membrane cell culture inserts | Sigma-Aldrich | CLS3452 | |
| D-glucose | Sigma-Aldrich | G8270 | dissolve in 50 mL of BME-1 and sterile filter before adding to the medium |
| Dulbecco's Modified Eagle's Medium/Nutrient F-12 Ham | Gibco | 21331-020 | Specific to the culture of the patient-derived spheres isolated in our lab, may vary for other glioma cell lines |
| EBM-2 growth Medium SupplementMix | PromoCell | c-39216 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Endothelial Basal Medium 2 (EBM-2) | PromoCell | c-22211 | EBM+: contains all the additives from the supplement mix. EBM-:all the additives except for VEGF-A and FBS |
| Fetal Bovine Serum (FBS), qualified, heat inactivated, E.U.-approved, South America Origin | ThermoFisher Scientific | 10500056 | |
| Fluorescein sodium salt | Sigma-Aldrich | F6377 | |
| Greiner CELLSTAR 96 well plates | Sigma-Aldrich | Greiner 655090 | black polystyrene wells flat bottom (with micro-clear bottom) |
| Menzel-Gläser 0.9 cm round borosilicate Cover Slips | Thermo Scientific | 10313573 | |
| PBS tablets | Medicago | 09-9400-100 | one tablet per liter of dH2O, then sterilize the solution by autoclaving |
| Poly-D-lysine hydrobromide | Sigma-Aldrich | P6407 | |
| Recombinant Human EGF | Peprotech | GMP100-15 | for GBM+ medium |
| Recombinant Human FGF-basic (154 a.a.) | Peprotech | 100-18B | for GBM+ medium |
| Immunofluorescence | |||
| Paraformaldehyde | Sigma-Aldrich | 158127 | |
| 24 mm x 60 mm microscope slide cover glass | ORSAtec | 0224601-D | |
| AlexaFluor 488 and 594 secondary antibodies | ThermoFisher Scientific | dilution: 1/500 | |
| Anti-Claudin-5 antibody | Abcam | ab15106 | dilution: 1/150 |
| Anti-GFAP antibody clone GF5 | Abcam | ab10062 | dilution: 1/150 |
| Anti-Mouse CD31 antibody Clone MEC 13.3 | BD Biosciences | 550274 | dilution 1/800 |
| Anti-SV40 T-antigen antibody | Abcam | ab16879 | dilution: 1/150 |
| Anti-Zonula Occludens-1 | Abcam | ab96587 | dilution: 1/200 |
| DAPI | TOCRIS | 5748 | |
| Fluoromount Aqueous Mounting Medium | Sigma-Aldrich | F4680 | |
| LysoTracker Red DND-99 | ThermoFisher Scientific | L7528 | |
| Animal procedures | |||
| 10 cm curved dissecting scissors | World Precision Instruments | 14394 | |
| BD Microlance 25 G needles | Becton Dickinson | 300600 | |
| Fine Forceps (12.5 cm) | World Precision Instruments | 503283 | for tissue dissociation |
| Intramedic Polyethylene tubing PE20 | Becton Dickinson | 427406 | |
| Ketaminol vet 50 mg/mL | Intervet | Vnr511485 | Ketamine |
| Mains Powered microdrill | World Precision Instruments | 503599 | |
| Menzel-Gläser 0.5 cm round borosilicate Cover Slips | Thermo Scientific | 11888372 | |
| Micro Bulldog clamp | World Precision Instruments | 14119 | |
| Physiological saline solution | Mustela | Sterile single dose vials 20 x 5 mL / 40 x 5 mL - Medical device class | |
| Rochester-Oschner forceps | World Precision Instruments | 501709 | |
| Rompun vet 20 mg/mL | Intervet | Vnr148999 | Xylazine |
| Stereotaxic adapter | World Precision Instruments | 502063 | |
| Sugi Sponge Points | Kettenbach | 31603 | |
| Equipment | |||
| Axio Zoom.V16 fluorescence stereo zoom microscope | Carl Zeiss | ||
| FLUOstar Omega microplate reader | BMG Labtech | ||
| ORCA-Flash 4.0 digital sCMOS camera | Hamamatsu Photonics | ||
| Universal 320 tabletop centrifuge | Hettich | Cat. No. 1401 | |
| ZEISS LSM 880 with Airyscan confocal microscope | Carl Zeiss |
Referências
- Daneman, R., Prat, A. The blood-brain barrier. Cold Spring Harbor Perspectives in Biology. 7 (1), a020412 (2015).
- Quail, D. F., Joyce, J. A. The Microenvironmental Landscape of Brain Tumors. Cancer Cell. 31 (3), 326-341 (2017).
- Wang, Z., Sun, H., Yakisich, J. S. Overcoming the blood-brain barrier for chemotherapy: limitations, challenges and rising problems. Anticancer Agents in Medicinal Chemistry. 14 (8), 1085-1093 (2014).
- Alkins, R. D., Brodersen, P. M., Sodhi, R. N., Hynynen, K. Enhancing drug delivery for boron neutron capture therapy of brain tumors with focused ultrasound. Neuro Oncology. 15 (9), 1225-1235 (2013).
- Alli, S., et al. Brainstem blood brain barrier disruption using focused ultrasound: A demonstration of feasibility and enhanced doxorubicin delivery. Journal of Controlled Release. 281, 29-41 (2018).
- Ashby, L. S., Smith, K. A., Stea, B. Gliadel wafer implantation combined with standard radiotherapy and concurrent followed by adjuvant temozolomide for treatment of newly diagnosed high-grade glioma: a systematic literature review. World Journal of Surgical Oncology. 14 (1), 225 (2016).
- Guishard, A. F., Yakisich, J. S., Azad, N., Iyer, A. K. V. Translational gap in ongoing clinical trials for glioma. Journal of Clinical Neurosciences. 47, 28-42 (2018).
- Rahman, N. A., et al. Immortalized endothelial cell lines for in vitro blood-brain barrier models: A systematic review. Brain Research. 1642, 532-545 (2016).
- Helms, H. C., et al. In vitro models of the blood-brain barrier: An overview of commonly used brain endothelial cell culture models and guidelines for their use. Journal of Cerebral Blood Flow & Metabolism. 36 (5), 862-890 (2016).
- Wang, J. D., Khafagy, e. l. -. S., Khanafer, K., Takayama, S., ElSayed, M. E. Organization of Endothelial Cells, Pericytes, and Astrocytes into a 3D Microfluidic in Vitro Model of the Blood-Brain Barrier. Molecular Pharmaceutics. 13 (3), 895-906 (2016).
- Phan, D. T., et al. Blood-brain barrier-on-a-chip: Microphysiological systems that capture the complexity of the blood-central nervous system interface. Experimental Biology and Medicine (Maywood). 242 (17), 1669-1678 (2017).
- Bang, S., et al. A Low Permeability Microfluidic Blood-Brain Barrier Platform with Direct Contact between Perfusable Vascular Network and Astrocytes. Scientific Reports. 7 (1), 8083 (2017).
- Wilhelm, I., Krizbai, I. A. In vitro models of the blood-brain barrier for the study of drug delivery to the brain. Molecular Pharmacology. 11 (7), 1949-1963 (2014).
- Campisi, M., et al. 3D self-organized microvascular model of the human blood-brain barrier with endothelial cells, pericytes and astrocytes. Biomaterials. 180, 117-129 (2018).
- Pirsko, V., et al. An Effect of Culture Media on Epithelial Differentiation Markers in Breast Cancer Cell Lines MCF7, MDA-MB-436 and SkBr3. Medicina (Kaunas). 54 (2), (2018).
- Stebbins, M. J., et al. Differentiation and characterization of human pluripotent stem cell-derived brain microvascular endothelial cells. Methods. 101, 93-102 (2016).
- Canfield, S. G., et al. An isogenic blood-brain barrier model comprising brain endothelial cells, astrocytes, and neurons derived from human induced pluripotent stem cells. Journal of Neurochemistry. 140 (6), 874-888 (2017).
- Cao, Y., et al. Hypoxia-inducible factor-1alpha is involved in isoflurane-induced blood-brain barrier disruption in aged rats model of POCD. Behavioural Brain Research. 339, 39-46 (2018).
- Abbott, N. J. Astrocyte-endothelial interactions and blood-brain barrier permeability. Journal of Anatomy. 200 (6), 629-638 (2002).
- Kinnari, P. J., et al. Tumour homing peptide-functionalized porous silicon nanovectors for cancer therapy. Biomaterials. 34 (36), 9134-9141 (2013).
- Levin, V. A. Personalized medicine in neuro-oncology. CNS Oncology. 5 (2), 55-58 (2016).
- Weathers, S. S., Gilbert, M. R. Toward Personalized Targeted Therapeutics: An Overview. Neurotherapeutics. 14 (2), 256-264 (2017).
- O'Duibhir, E., Carragher, N. O., Pollard, S. M. Accelerating glioblastoma drug discovery: Convergence of patient-derived models, genome editing and phenotypic screening. Molecular and Cellular Neuroscience. 80, 198-207 (2017).
- Kaya, M., Ahishali, B. Assessment of permeability in barrier type of endothelium in brain using tracers: Evans blue, sodium fluorescein, and horseradish peroxidase. Methods in Molecular Biology. 763, 369-382 (2011).
- Yang, S., et al. Identification of two immortalized cell lines, ECV304 and bEnd3, for in vitro permeability studies of blood-brain barrier. PLoS One. 12 (10), e0187017 (2017).
- Blouw, B., et al. The hypoxic response of tumors is dependent on their microenvironment. Cancer Cell. 4 (2), 133-146 (2003).
- Argaw, A. T., et al. Astrocyte-derived VEGF-A drives blood-brain barrier disruption in CNS inflammatory disease. Journal of Clinical Investigation. 122 (7), 2454-2468 (2012).
- Miao, Z., et al. VEGF increases paracellular permeability in brain endothelial cells via upregulation of EphA2. The Anatomical Record (Hoboken). 297 (5), 964-972 (2014).
- Heinolainen, K., et al. VEGFR3 Modulates Vascular Permeability by Controlling VEGF/VEGFR2 Signaling. Circulation Research. 120 (9), 1414-1425 (2017).
- Claesson-Welsh, L. Vascular permeability--the essentials. Upsala Journal of Medical Sciences. 120 (3), 135-143 (2015).
- Adriani, G., Ma, D., Pavesi, A., Goh, E. L., Kamm, R. D. Modeling the Blood-Brain Barrier in a 3D triple co-culture microfluidic system. Conference Proceedings - IEEE Engineering in Medicine and Biology Society. 2015, 338-341 (2015).
- Weksler, B., Romero, I. A., Couraud, P. O. The hCMEC/D3 cell line as a model of the human blood brain barrier. Fluids and Barriers of the CNS. 10 (1), 16 (2013).
- Paatero, I., et al. Analyses in zebrafish embryos reveal that nanotoxicity profiles are dependent on surface-functionalization controlled penetrance of biological membranes. Scientific Reports. 7 (1), 8423 (2017).
- Prabhakar, N., et al. Stimuli-responsive hybrid nanocarriers developed by controllable integration of hyperbranched PEI with mesoporous silica nanoparticles for sustained intracellular siRNA delivery. International Journal of Nanomedicine. 11, 6591-6608 (2016).
- Hyvonen, M., et al. Novel target for peptide-based imaging and treatment of brain tumors. Molecular Cancer Therapeutics. 13 (4), 996-1007 (2014).
- Feng, X., et al. Mammary-Derived Growth Inhibitor Targeting Peptide-Modified PEG-PLA Nanoparticles for Enhanced Targeted Glioblastoma Therapy. Bioconjugate Chemistry. 26 (8), 1850-1861 (2015).
- Nance, E. A., et al. A dense poly(ethylene glycol) coating improves penetration of large polymeric nanoparticles within brain tissue. Science Translational Medicine. 4 (149), 149rA119 (2012).
- Berg, C. Quantitative analysis of nanoparticle transport through in vitro blood-brain barrier models. Tissue Barriers. 4 (1), e1143545 (2016).
- Noumbissi, M. E., Galasso, B., Stins, M. F. Brain vascular heterogeneity: implications for disease pathogenesis and design of in vitro blood-brain barrier models. Fluids and Barriers of the CNS. 15 (1), 12 (2018).
- Heymans, M., Sevin, E., Gosselet, F., Lundquist, S., Culot, M. Mimicking brain tissue binding in an in vitro model of the blood-brain barrier illustrates differences between in vitro and in vivo methods for assessing the rate of brain penetration. European Journal of Pharmaceutics and Biopharmaceutics. 127, 453-461 (2018).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados