Method Article
Estudos alvejados usando a cara de bloco de série e a microscopia focalizada da varredura do feixe de íon
Neste Artigo
Resumo
Aqui, nós apresentamos um protocolo para combinar eficientemente a cara de bloco de série e a microscopia de elétron de varredura focalizada do feixe de íon para alvejar uma área de interesse. Isso permite a pesquisa eficiente, em três dimensões, e a localização de eventos raros em um grande campo de visão.
Resumo
Este protocolo permite a imagem latente eficiente e eficaz de amostras da pilha ou do tecido em três dimensões a nível da definição da microscopia de elétron. Por muitos anos a microscopia de elétron (EM) remanesceu uma técnica inerentemente bidimensional. Com o advento de técnicas de digitalização de imagens de microscopia eletrônica de varredura (volume EM), usando um micrótomo integrado ou feixe de íons focados para fatiar, em seguida, Ver os tecidos incorporados, a terceira dimensão torna-se facilmente acessível. A microscopia eletrônica de varredura da face do bloco de série (SBF-SEM) usa um ultramicrotome fechado na câmara de SEM. Ele tem a capacidade de lidar com grandes espécimes (1.000 μm x 1.000 μm) e imagem grandes campos de visão em pequeno X, Y tamanho do pixel, mas é limitado na dimensão Z pela faca de diamante. O feixe de íon focalizado SEM (FIB-SEM) não é limitado na definição 3D, (os voxels isotropic de ≤ 5 nanômetro são realizáveis), mas o campo de visão é muito mais limitado. Este protocolo demonstra um fluxo de trabalho para combinar as duas técnicas para permitir a localização de regiões individuais de interesse (ROIs) em um campo grande e, em seguida, imagem o volume de destino subsequente em alta resolução de VOXEL isotrópico. Preparar células fixas ou tecidos é mais exigente para as técnicas de volume EM devido ao contraste extra necessário para a geração de sinal eficiente na imagem SEM. Tais protocolos são demorados e trabalhoso. Este protocolo também incorpora processamento de tecido assistido por microondas facilitando a penetração de reagentes, o que reduz o tempo necessário para o protocolo de processamento de dias a horas.
Introdução
Este protocolo descreve um fluxo de trabalho para a segmentação eficiente de alta resolução, microscopia eletrônica tridimensional (EM) para uma região específica de interesse (ROI). Desde os seus primórdios na década de 1930, a EM tem sido uma técnica essencialmente bidimensional. As primeiras imagens publicadas foram de tecidos inteiros ou células, mas que logo deu lugar a seções que foram cortadas à mão usando um ultramicrotome e imaged usando um microscópio eletrônico de transmissão (TEM). A TEM produz micrografias de alta resolução, onde mesmo as menores estruturas celulares são claramente perceptível. Entretanto, a magreza da seção necessária para que o tecido seja imaged pelo feixe de elétron fêz a informação na dimensão de Z mínima. Como as células são estruturas tridimensionais, as interações entre estruturas celulares e superfícies celulares tiveram que ser inferidas a partir de dados limitados. Isso elevou o potencial de má interpretação, especialmente em estruturas complexas. Alguns microscopistas conseguiram obter estruturas 3D mais precisas por células de corte Serial e tecidos e, em seguida, meticulosamente reconstruí-los a partir de imagens individuais TEM1. Este foi um processo muito trabalhoso e antes do advento da imagem digital e renderização de computador os resultados também foram difíceis de Visualizar. Nos últimos anos, foram introduzidas duas técnicas que se tornaram coletivamente conhecidas como microscopia eletrônica de volume (volume EM)2 que fizeram em três dimensões acessíveis a mais laboratórios.
A idéia de obter uma pilha de imagens de um bloco incorporado dentro de um microscópio de elétron pode ser traçada de volta a 1981 quando Steve Leighton e Alan Kuzirian construíram um micrótomo diminuto e coloc o na câmara de um microscópio de elétron de varredura3 (SBF-sem) . Este protótipo foi eventualmente copiado e melhorado 23 anos mais tarde por Denk e Horstmann4 e posteriormente comercializado. Em aproximadamente o mesmo tempo os cientistas biológicos tornaram-se cientes de uma outra tecnologia usada primeiramente na ciência dos materiais, o feixe focalizado do íon. Esta técnica usa um feixe de íons de algum tipo (gálio, plasma) para remover uma quantidade muito pequena de material de superfície de uma amostra (FIB-SEM)5. Ambas as técnicas empregam o seccionamento seguido pela imagem latente que fornece uma série de imagens que podem ser combinadas em um X, Y, Z, pilha. Ambas as técnicas fornecem informações 3D, mas em diferentes escalas de resolução. SBF-SEM é limitado pelas propriedades físicas da faca do diamante às fatias nenhum diluidor do que 50 nanômetro para funcionamentos de série longos da imagem latente; no entanto, o tamanho do bloco amostral que pode ser seccionado é grande, até 1 mm x 1 mm x 1 mm. devido ao grande formato de aquisição digital do detector de elétrons dispersos de volta (32K x 32K pixels) que recebe um sinal da face do bloco , os tamanhos de pixel de imagem podem ser tão pequenos quanto 1 nm. Isso resulta em voxels não isotrópicos onde a dimensão X, Y é freqüentemente menor que a Z. Devido à precisão do feixe de íons, FIB-SEM tem a capacidade de coletar imagens com voxels isotrópicos ≤ 5 nm. No entanto, a área total que pode ser imaged é bastante pequena. Uma tabela sumária de várias amostras e volumes imaged com as duas técnicas foi publicada previamente3.
A preparação do tecido para o volume em é mais difícil do que para o tem ou o sem padrão porque as amostras devem ser manchadas para fornecer a geração de sinal adequada no sem. freqüentemente, os colorações precisam de ser aperfeiçoados não somente para o tipo particular do tecido mas igualmente para adicionar contraste com certas estruturas celulares para facilitar a identificação e a reconstrução. O protocolo usado aqui é baseado no padrão NCMIR6. A coloração adicional geralmente significa etapas adicionais do protocolo. Assim, para o volume EM, os protocolos padrão precisam ser estendidos para garantir tempo suficiente para que os reagentes penetrem na amostra. O processamento assistido por microondas pode reduzir o tempo necessário para a coloração de horas para minutos e torna a preparação da amostra EM volume mais eficiente7. Este método é aplicável a todos os tipos8 da pilha e do tecido e para pesquisar perguntas onde a inhomogeneidade do tecido faz a amostragem de uma área específica essencial9.
Uma vez que uma pilha de dados é obtida pode ser alinhada e as estruturas de interesse segmentadas a partir do resto dos dados e modelada em 3D. Embora a automatização de imagens muitas fatias de tecido fez aquisição de imagem relativamente simples, o processo de reconstrução digital e visualizando os dados é uma tarefa demorada. O software para esta finalidade ainda não está integrado nem totalmente automatizado. Uma vez que grande parte do trabalho precoce usando o volume EM foi direcionado para a neurociência, as técnicas de coloração e segmentação digital de estruturas como axônios é bastante avançada em comparação com outras células e organelas. Enquanto a literatura sobre outros tecidos não-neuronais está crescendo rapidamente, estruturas não lineares ou irregulares exigem mais entrada manual.
O uso de SBF-SEM e FIB-SEM é uma abordagem útil para direcionamento e criação de imagens específicas, não homogêneas, estruturas teciduais em alta resolução em 3D. Combinando isso com processamento de tecido assistido por microondas que diminui vastamente o tempo necessário para a preparação da amostra. Juntos, esse fluxo de trabalho tornará a geração de conjuntos de dados de imagem de VOXEL isotrópicos de alta resolução de estruturas finas um processo eficiente e mais rápido.
Protocolo
1. fixação e processamento da amostra para microscopia eletrônica
- Correção de mudas de Arabidopsis Arabidopsis thaliana cultivadas em placas de agar em 0,5% paraformaldeído, 2,5% de glutaraldeído em 0,1 M de tampão fosfato (PB) pH 6,8 para 2 h à temperatura ambiente (RT).
PRECAUÇÃO: os aldeídos são irritantes e corrosivos e têm potencial carcinogénico, mutagénico e teratogénico. Todas as soluções devem ser tratadas com equipamento de proteção apropriado e em uma capa de fumaça. - Corte pontas da raiz da planta crescidas na etapa 1,1 e põr 2-3 pontas nos tubos de 0,5 ml que contêm o mesmo fixador durante a noite em 4 ° c.
Nota: o volume deste e de todas as soluções nas etapas restantes é determinado pelo volume de amostra; uma proporção mínima de amostra para solução é 10:1. As amostras maiores do que 1 milímetro em toda a dimensão serão difíceis de manchar, assim que trabalhar com blocos maiores do tecido é mais difícil. Nem todos os tecidos têm as mesmas características; por exemplo, folhas de plantas e hastes podem ser difíceis de manchar. Se forem desejadas amostras maiores ou tipos de tecido difíceis, a otimização do processamento de amostras deve ser realizada antes de passar para a coleta de dados. - Prepare a solução de tiocarbohidrazida (TCH), necessária fresca e disponível antes do passo 1,7. Adicionar 0,1 g de tiocarbohidrazida a 10 mL de água destilada dupla (ddH2o) e dissolver por aquecimento a 60 ° c no forno durante 1 h. Antes de utilizar, filtre a solução TCH utilizando um filtro de seringa de 0,22 μm.
- Remova o fixador dos tubos e substitua-o por 0,1 M PB pH 6,8. Coloque os tubos em uma mesa de agitação orbital em 100 RPM e lave por 10 min. Repita a lavagem usando PBS fresco 5 vezes.
- Post fixar as pontas da raiz, substituindo PB com 2% de tetróxido de ósmio (OsO4) e 0,2% de vermelho rutênio em 0,1 M pb pH 6,8. Coloque os tubos no microondas com as tampas abertas e inicie o programa 9 (tabela 1).
Cuidado: o ósmio é extremamente perigoso em caso da ingestão, muito perigoso em caso da inalação, e perigoso em caso do contato de pele. Manuseie sempre com o equipamento de protecção adequado e numa capa de fumos.
Nota: durante todo o protocolo, as tampas dos tubos estão sempre abertas durante as etapas de microondas. - Lave as pontas da raiz duas vezes com ddH2o por 5 min cada no benchtop. Para o terceiro e quarto ddH2o lavagem uso programa 15 no microondas (tabela 1). Após a primeira lavagem 40 ddH2o, tirar amostras do microondas e substituir o tampão com DDH fresco2o. Coloque as amostras de volta no microondas e continuar o programa.
Nota: o microondas irá soar um alarme quando o buffer precisa ser atualizado. Certifique-se de que a tampa da câmara de vácuo é substituída correctamente de cada vez. - Incubar amostras em solução de TCH previamente preparada em RT por 2 min no banco e para posterior incubação use o programa de microondas 8 (tabela 1). Não mude a solução entre o banco e o microondas.
- Lave as amostras conforme descrito no passo 1,6.
- Coloque amostras em 1% OsO4 em DDH2O para O programa de microondas 9 (tabela 1).
- Lave as amostras conforme descrito no passo 1,6.
- Incubar amostras em acetato de uranilo a 1% em DDH2o utilizando o programa de microondas 16 (tabela 1).
PRECAUÇÃO: o acetato de Uranyl é tóxico, um irritante e tem potencial cancerígeno, mutagénico e teratogénico. Manuseie sempre com o equipamento de protecção adequado. - Lave as amostras conforme descrito no passo 1,6.
- Prepare a solução de chumbo de Walton para uso na etapa 1,14. Primeiro faça uma solução de estoque de ácido L-aspático, adicionando 0,998 g de ácido L-aspático a 250 mL de ddH2O e ajustando o pH para 3,8 com 1 M Koh. Em seguida, dissolva 0, 66 g de nitrato de chumbo em 10 mL de solução de estoque de ácido L-aspático e ajuste o pH para 5,5. Deixar a solução no forno a 60 ° c durante 30 min.
Nota: não precipitados devem formar. - Incubar amostras na solução de chumbo de Walton por 30 min no forno a 60 ° c.
- Lave as amostras conforme descrito no passo 1,6.
- Desidrata amostras em EtOH em etapas graduadas de 50%, 70%, 90% em ddH2O, e então 2x em 100% EtOH. Use o programa de microondas 10 (tabela 1) e o microondas irá alertar os usuários a cada 40 s para substituir a solução com a próxima etapa EtOH. Este é o último passo feito no microondas.
- Mais desidratar em 100% de óxido de propileno 2x por 10 min cada um na RT no banco, substituindo a solução entre as etapas.
Nota: o óxido de propileno pode dissolver alguns plásticos tais como polystyrenes; ou use frascos de vidro para esta etapa ou plásticos do pre-teste para a resistência.
Cuidado: o óxido de propileno é altamente inflamável. Manuseie sempre com o equipamento de protecção adequado e numa capa de fumos. - Inicie a infiltração de pontas de raiz incubando em 50% da resina de Spurr em óxido de propileno (mín. 2 h).
Cuidado: os componentes da resina de Spurr são irritantes. Manuseie sempre com o equipamento de protecção adequado e numa capa de fumos. - Substitua a solução por 100% de Spurr e deixe durante a noite no RT.
- Mude para a resina fresca de 100% Spurr 2 vezes (min 2 incubações h).
- Coloc amostras em um molde de incorporação, contendo outra vez a resina fresca de 100% Spurr e polimerize em um forno em 65 ° c para 36 − 48 h.
Nota: o molde de incorporação usado depende do tipo de tecido e da aproximação usada para a imagem latente. Utilizou-se um molde de incorporação de silicone plano (Figura 1a).
2. Prepare amostras incorporadas para imagens
- Retire as amostras do forno, retire a resina do molde de incorporação (Figura 1b).
- Usando uma lâmina de barbear, cerca de aparar a amostra para um bloco de máximo 0,5 mm x 0,5 mm x 0,5 mm (Figura 1C).
Nota: para evitar o carregamento em SBF-SEM, é importante aparar o máximo de resina nua possível e tornar a amostra tão plana/fina quanto possível. Idealmente todos os lados do bloco contêm o tecido já, mas o mais importante o lado que será unido ao pino do metal (veja a etapa 2,3) tem que conter o tecido exposto de modo que o tecido esteja no contato direto com o metal condutor. - Retire a amostra da resina estranha e prenda-a a um pino metálico (Figura 1D) com resina epóxi condutora, certificando-se de que parte do tecido está tocando o pino metálico. Deixe a epóxi curar durante a noite no forno a 65 ° c.
Nota: Certifique-se de que a amostra está posicionada no centro do pino, pois o movimento do palco no SB-SEM é limitado. Removendo a resina muito pequena envolto amostra de resina extra pode ser difícil como a pequena amostra terá uma tendência a voar afastado quando destacado. Uma solução simples e eficaz para isso é cobrir a amostra com uma folha de filme de parafina, como mostrado no filme complementar de referência1. - Prenda a transportadora no suporte para o ultramicrotome. Use uma lâmina de barbear para remover qualquer excesso de epóxi e usar o ultramicrotome e uma faca de diamante para suavizar o rosto e os lados do bloco, formando uma pirâmide. Certifique-se de que pelo menos alguns dos tecidos já estão expostos na face do bloco.
Nota: a etapa extra de usar uma faca do diamante é opcional mas faz o bloco resultante mais fácil aproximar-se no SBF-SEM porque a sombra da faca na cara do bloco é mais desobstruída assim fazendo estimar a distância entre a cara da faca e do bloco mais fácil determinar. - Coloque o bloco de amostra cortado no coater de Sputter e revele a amostra com uma camada fina (2 − 5 Nm) de platina (pt).
Nota: a platina no bloco-face será cortada durante a aproximação no SBF-SEM (veja abaixo), mas a platina nos lados da pirâmide fornecerá a condutibilidade adicional. Neste exemplo, a amostra foi revestida com platina, mas ouro, ou ouro/paládio também é eficaz; Entretanto, o revestimento com ouro conduziu aos restos aumentados na bloco-cara durante uma execução da imagem latente.
3. imagem latente no SBF-SEM
- Insira a transportadora no microscópio SBF-SEM e aproxime a faca da superfície da amostra. Usando a guarnição da faca do diamante fora da parcela superior da amostra de modo que a camada do pinta estêve removida já e pelo menos parte do tecido é expor.
Nota: uma vez que este processo é diferente para cada microscópio SBF-SEM, nem todas as etapas são especificadas aqui. Contanto que a superfície da amostra é livre de pt e pronto para a imagem, os próximos passos será possível. - Inicie a imagem em baixa resolução e tempos de permanência curtos para obter uma visão geral da amostra e localizar uma região de interesse (Figura 1e).
Nota: aqui, 512 x 512 pixels e 1 μs tempo de permanência foram utilizados para a rápida digitalização e posicionamento do palco e 2.000 x 2.000 pixels com tempo de permanência de 1 μs foram utilizados para otimizar a janela de imagem e ajustar o foco. - Usando uma tensão de aceleração de 1.5-2.0 kV em uma corrente de 80 − 100 pA, Capture uma imagem do tecido.
Nota: o exemplo mostrado aqui foi imaged em um sistema do vácuo elevado onde a corrente do feixe precisa de ser ajustada para minimizar o carregamento, que é muito dependente da amostra. Tipicamente, o feixe de elétron é ajustado a 1.5 − 2.0 kV mas este será dependente da amostra. Em ampliações mais elevadas (geralmente > 10, 000x) a resina é afetada demasiado pelo feixe para garantir o corte liso, tão tipicamente pixel-Size é ajustado a 8 − 20 nanômetro em um tamanho da imagem de 8000 − 10000 x 8000 − 10000 pixéis com as ampliações correspondentes de 430- 1, 400x e tamanhos de campo de 64 X 64 mm e 200 x 200 mm respectivamente. - Determine uma região de interesse e decida quantas seções são necessárias para cobrir o volume de interesse e iniciar a execução de imagem, usando o detector de elétrons dispersos de volta.
Nota: no exemplo apresentado aqui, 500 secções de 80 nm foram fotografadas a 10 Nm pixels e 10.000 x 10.000 pixel imagens (tempo de permanência 1 μs). O microscópio foi ajustado para 1,6 kV e 100 pA. Em geral, o número de seções depende da amostra e do tamanho do ROI e pode variar de 100 s a 1.000 s de seções consecutivas. O conjunto de dados resultante consiste em imagens únicas de cada seção. Essas imagens precisam ser convertidas em uma pilha 3D.
4. processamento de dados de SBF-SEM
- Usando Fiji, selecione a seqüência de arquivo-importação-imagem e localize a pilha de imagem para carregar as imagens. Dependendo do tamanho do conjunto de dados, marque a caixa ' usar pilha virtual '.
Nota: se o conjunto de dados é realmente grande, primeiro convertê-lo para 8 bits (se recolhidos em 16 bits) e se necessário bin os dados até que ele tem um tamanho viável. - Usando o botão Play na parte inferior da imagem, percorra o conjunto de dados para ver se a execução de imagem foi bem-sucedida. Verifique se há artefatos típicos de imagem para SBF-SEM, como seções caindo da faca na face do bloco, carregando em áreas de resina nua, artefatos de corte da faca (linhas horizontais na imagem).
- Usando as propriedades de imagem de comando, ajuste o tamanho do pixel e a profundidade do VOXEL (ou seja, a espessura da seção) usada durante a execução. Se os dados já estiverem em binned, leve isso em conta.
- Usando o comando plugins-registro-alinhamento de pilha linear com o SIFT para registrar os dados.
Nota: o registro de dados de SBF-SEM é necessário porque pode haver um movimento ligeiro da amostra durante a imagem latente devido ao carregamento ou à tração da amostra. Como este é apenas um movimento mínimo em XY, apenas a tradução é necessária. - Verifique o alinhamento rolando pelo conjunto de dados e, se OK, use o comando Save no menu arquivo para salvar o conjunto de dados alinhado como um arquivo 3D-TIF.
- Analise o conjunto de dados cuidadosamente para ver se o ROI está incluído e contém as informações necessárias para a pergunta biológica. Na última imagem da pilha (= a face do bloco atual), selecione um novo ROI para a imagem FIB-SEM.
Nota: se não há nenhuma boa região para a imagem latente FIB-SEM atual na bloco-cara atual, mais seções podem ser cortadas do bloco (que está ainda no SBF-SEM) até que um ROI apareça. Há um limite para o volume que pode ser imaged com o FIB. O ROI na imagem de SBF-SEM pode ser máximo em X, Y de 30-40 μm x 15-20 μm.
5. imagem latente no FIB-SEM
- Tome imagens de visão geral da amostra no SBF-SEM, idealmente incluindo uma ou mais bordas da amostra que são então reconhecíveis no FIB-SEM (Figura 2a, C).
Nota: neste exemplo, as imagens de visão geral SBF-SEM foram tiradas a 10 Nm pixel tamanho, 8.000 x 8.000 pixels em 1 μs tempo de permanência. O microscópio ainda estava fixado em 1,6 kV e 100 pA. - Retire a amostra do SBF-SEM e coloque-a no coater de Sputter. Cubra a amostra com platina ≥ 20 nm para a imagem FIB-SEM.
- Carregue a amostra em FIB-SEM e usando detector de elétrons secundário a 15 kV, 1 nA localize o ROI identificado no SBF-SEM na face do bloco (Figura 2b, D).
Nota: a imagem latente em 15 quilovolts é necessária para ver com o revestimento da platina. - Coloque o ROI na amostra no ponto de coincidência dos feixes FIB e SEM, movendo e inclinando o palco (Figura 3a).
Nota: a coluna FIB é normalmente montada um ângulo (Figura 3a). Isto significa que toda a amostra precisa de ser inclinada de tal maneira que a superfície a ser imaged e seccionada está posicionada paralela ao feixe de FIB. A superfície a ser imaged agora é inclinada em relação ao feixe de SEM e uma trincheira de tecido precisa ser removida antes do SEM é capaz de imagem do ROI (Figura 3e) - Usando o sistema de injeção de feixe e gás FIB, deposite uma camada protetora de platina de 1 mm na superfície acima do ROI (Figura 3C). Em seguida, usando uma baixa corrente de moagem (50-100 pA), fresar linhas finas no depósito de platina para focagem automática e rastreamento 3D durante a execução de imagem (Figura 3D). Usando a coluna FIB e o injetor de gás do carbono, cubra estas linhas com depósito do carbono.
Nota: o tamanho do ROI aqui corresponde ao tamanho do ROI na imagem de SBF-SEM e o tamanho máximo pode assim ser 30-40 μm x 15-20 μm. Neste exemplo um ROI de 17 μm x 8 μm foi imaged. O depósito de carbono é necessário para a proteção das linhas e para criar um contraste preto-branco entre o carbono e a platina que é ideal para o auto-focalização. As correntes de fresagem utilizadas para cada etapa podem ser encontradas na tabela 2. - Usando uma corrente de fresagem alta, moinho de uma trincheira de 30 μm em frente ao ROI, criando a superfície de imagem para o feixe de SEM (Figura 3E).
Nota: o feixe FIB é inerentemente destrutivo, ainda mais em correntes elevadas. Certifique-se manter a imagem latente em correntes elevadas a um mínimo e a uma imagem na baixa ampliação e em velocidades rápidas da varredura para evitar derreter a resina no ROI. - Alise a superfície da imagem latente com uma corrente de trituração mais perto da corrente usada durante a execução da imagem latente. Pare de polir quando todas as marcas de foco automático e de rastreamento 3D estiverem claramente visíveis na superfície de imagem (Figura 3F). O progresso do FIB pode ser seguido por imagem a superfície com o EM (usando um detector de elétrons dispersos para trás) durante o polimento.
- Determine a área a ser imaged na superfície recém-criada e defina os parâmetros de imagem. Certifique-se de que o feixe de elétrons está focado na superfície, defina o brilho e o contraste e defina o tamanho do pixel e a espessura da seção. Mantenha o tempo de imagem abaixo de 1 minuto ajustando o tempo de permanência e a média da linha.
Nota: é importante usar uma baixa tensão para a imagem latente com o feixe de elétron para assegurar-se de que somente a superfície do bloco esteja imaged (isto é, que nenhuns elétrons de mais profundamente na amostra são imaged). Isto é feito mantendo a tensão abaixo de 2 quilovolts e usando um detetor de elétron dispersado traseiro com uma tensão da grade, permitindo que somente os elétrons da alta energia sejam imaged. Neste exemplo, o feixe de elétron foi ajustado em 1,5 quilovolts e 1 nA com uma tensão da grade de 1,2 quilovolts no detetor de elétron dispersado traseiro. Também aqui, um pixel-tamanho de 5 nanômetro foi usado com seções 5nm para conduzir a um conjunto de dados com voxels isotrópico. Uma área de 17 μm x 10 μm foi imaged em 6,5 μs tempo de permanência e uma linha média de 1,0. - Defina as janelas para ajuste automático e rastreamento 3D, usando o mesmo tamanho de pixel, tempo de permanência e média de linha, conforme usado para a imagem.
Observação: esse processo será diferente para sistemas diferentes, portanto, somente a etapa é mencionada sem especificar as diferentes ações. - Comece a execução da imagem latente e monitore a estabilidade do processo durante as primeiras 50 − 100 seções. Uma vez que o sistema está funcionando lisamente, deixe o quarto e assegure-se de que haja tão pouco distúrbio ao quarto como possível.
Observação: a duração da execução e o número de seções dependerá do tamanho do ROI e da espessura da seção. Em FIB-SEM o eixo Z é na verdade a altura da caixa de ROI na imagem SBF-SEM (Max 15 − 20 μm; Figura 3E). - Registre os dados FIB-SEM da mesma forma como descrito acima para os dados SBF-SEM.
Resultados
As imagens do SBF-SEM proporcionam uma visão geral do tecido, dando informações sobre a orientação espacial das células e conexões intercelulares (figura 4a). A imagem latente de FIB-SEM subseqüente em uma região nova, que seja geralmente uma região do interesse determinada após a inspeção da corrida de SBF-SEM, adiciona o detalhe de alta resolução de pilhas e/ou de estruturas específicas (Figura 4B).
Figura 4C , D mostram a diferença na renderização dos voxels não isotrópicos dos dados do SBF-sem (Figura 4C) e dos dados isotrópicos do VOXEL FIB-sem (Figura 4D). A espessura z usada no SBF-SEM significa que a renderização mostra claramente as seções, resultando em um efeito de ' escadaria ' na superfície. Nos dados FIB-SEM as seções de 5 Nm garantem que a renderização pareça muito mais suave e as seções individuais se misturam completamente na superfície.
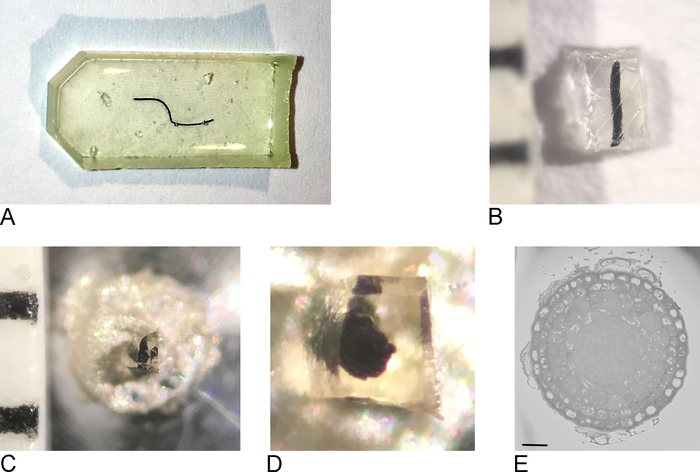
Figura 1: criação da face do bloco a partir de uma amostra de resina incorporada. (A) uma raiz-ponta encaixada na resina. (B) usando uma lâmina de barbear, o excesso de resina é cortado até que um bloco de 0,5 mm2 permaneça. (C, D) O bloco aparado é colado em um pino de metal e depois de uma noite no forno, os lados do bloco são cortados e a superfície suavizada com uma faca de diamante usando um ultramicrotome. (E) dentro do SBF-sem, a amostra é orientada de modo que o BLOCKFACE e ROI pode ser reconhecido, barra de escala = 20 μm. por favor clique aqui para ver uma versão maior desta figura.
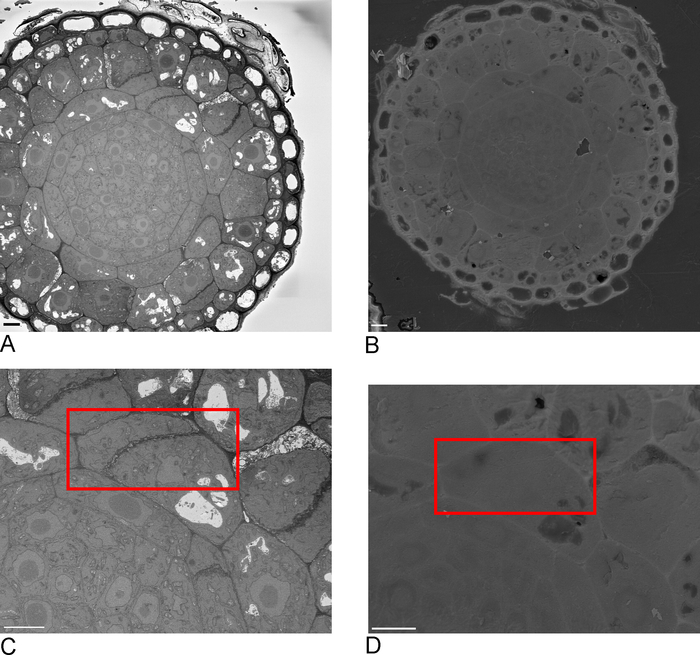
Figura 2: correlação entre SBF-sem e FIB-sem. Imagens de visão geral do bloco-face usando o SBF-SEM (a) eo FIB-sem (B), barra de escala = 5 μm. (C, D) zoom no ROI. A caixa vermelha delinea a região a ser imaged com FIB-SEM, barra da escala = 5 μm. please estale aqui para ver uma versão maior desta figura.
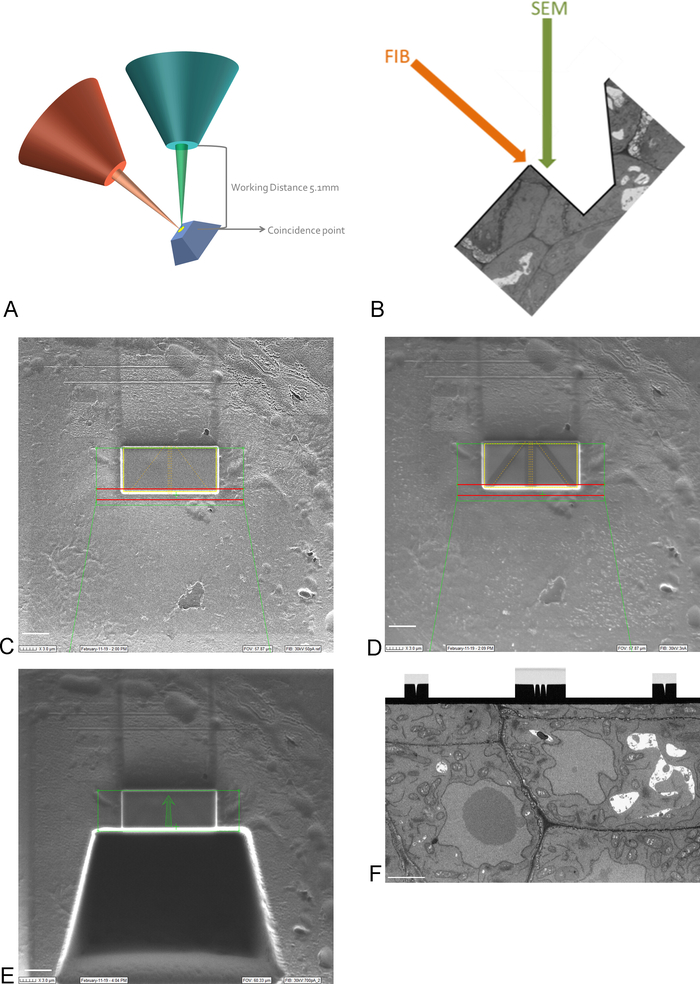
Figura 3: esquema FIB-sem e etapas de preparação. (A) esquema mostrando a orientação do feixe FIB, feixe de sem e amostra. A amostra precisa ser posicionada para o ponto de coincidência dos feixes FIB e SEM para ser capaz de moinho e imagem na mesma região. (B) desenho esquemático da trincheira necessária para a imagem sem das secções removidas pelo FIB. (C) imagem tirada com o feixe de FIB mostrando deposição de platina no ROI, barra de escala 5 μm. (D) imagem tirada com o feixe de FIB mostrando as linhas usadas para foco automático e rastreamento 3D. As linhas no meio são usadas para foco automático e as linhas externas fornecem rastreamento 3D. Deposição de carbono em cima das linhas fornece o contraste necessário (platina vs carbono) para executar essas tarefas, barra de escala 5 μm. (E) imagem tirada com o feixe de FIB após a moagem da trincheira, barra de escala 5 μm. (F) imagem tirada com o feixe de sem mostrando o região de interesse imaged durante a execução FIB-SEM, barra de escala 2 μm. por favor clique aqui para ver uma versão maior desta figura.
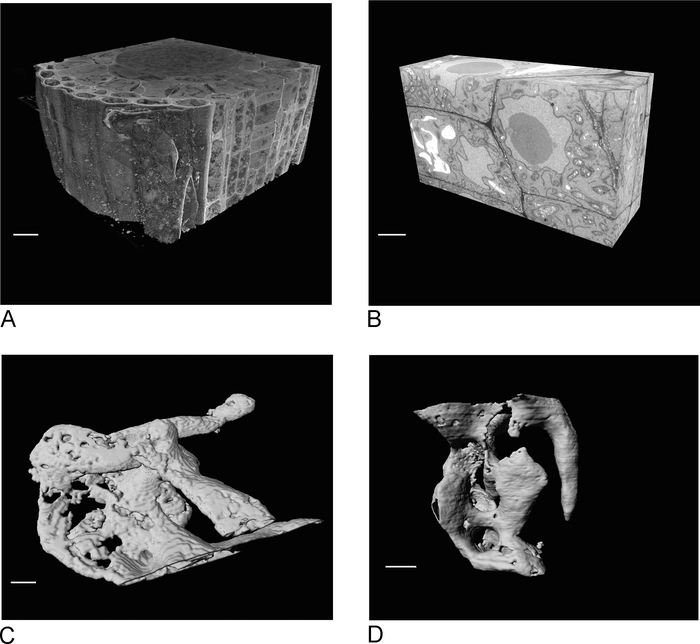
Figura 4: resultados de SBF-sem e FIB-sem antes e após a segmentação. (A) vista 3D do conjunto de dados SBF-SEM (100 x 100 x 40 μm, barra de escala = 10 μm), (B) vista 3D do conjunto de dados FIB-sem (17 x 10 x 5,4 μm, barra de escala = 2 μm), (C) vacúolos renderizados SEGMENTADOS a partir de dados SBF-sem por Thresholding, barra de escala = 2 μm D. grânulos renderizados seg dados FIB-SEM por Thresholding, barra de escala = 2 μm. por favor clique aqui para ver uma versão maior desta figura.
| Protocolo para processamento de microondas | |||||||||
| Programa # | Descrição | Prompt do usuário (on/off) | Tempo (hr: min: SEC) | Potência (watts) | Temp (° c) | Refrigerador da carga (fora de/auto/sobre) | Bomba de vácuo/Bubbler (off/bubb/VAC ciclo/VAC em/VAP) | Temp constante | |
| Bomba (on/off) | Temp (° c) | ||||||||
| 8 | Tch | FORA | 0:01:00 | 150 | 50 | FORA | CICLO DE VÁCUO | Em | 30 |
| FORA | 0:01:00 | 0 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
| FORA | 0:01:00 | 150 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
| 9 | Ósmio | FORA | 0:02:00 | 100 | 50 | FORA | CICLO DE VÁCUO | Em | 30 |
| FORA | 0:02:00 | 0 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
| FORA | 0:02:00 | 100 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
| FORA | 0:02:00 | 0 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
| FORA | 0:02:00 | 100 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
| 10 | 50% EtOH | Em | 0:00:40 | 150 | 50 | FORA | FORA | Em | 30 |
| 70% EtOH | Em | 0:00:40 | 150 | 50 | FORA | FORA | Em | 30 | |
| 90% EtOH | Em | 0:00:40 | 150 | 50 | FORA | FORA | Em | 30 | |
| 100% EtOH | Em | 0:00:40 | 150 | 50 | FORA | FORA | Em | 30 | |
| 100% EtOH | Em | 0:00:40 | 150 | 50 | FORA | FORA | Em | 30 | |
| 15 | 0.1 M CACODYLATE | Em | 0:00:40 | 250 | 50 | FORA | CICLO DE VÁCUO | Em | 30 |
| 0.1 M CACODYLATE | Em | 0:00:40 | 250 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | |
| 15 | ddH2O | Em | 0:00:40 | 250 | 50 | FORA | CICLO DE VÁCUO | Em | 30 |
| ddH2O | Em | 0:00:40 | 250 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | |
| 16 | Acetato de uranyl | FORA | 0:01:00 | 150 | 50 | FORA | CICLO DE VÁCUO | Em | 30 |
| FORA | 0:01:00 | 0 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
| FORA | 0:01:00 | 150 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
| FORA | 0:01:00 | 0 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
| FORA | 0:01:00 | 150 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
| FORA | 0:01:00 | 0 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
| FORA | 0:01:00 | 150 | 50 | FORA | CICLO DE VÁCUO | Em | 30 | ||
Tabela 1. Protocolo detalhado para o processamento da microonda.
| Passo | Atual | Tempo estimado |
| Deposição Platinum | 3N A | 10-15 minutos |
| Moagem Autotune e marcas de rastreamento | 50-100 pA | 4-6 minutos |
| Deposição de carbono | 3 nA | 5-10 minutos |
| Trincheira grossa de trituração | 15-30 nA | 30-50 minutos |
| Superfície de polimento | 1.5-3 nA | 15-20 minutos |
| Execução de imagens | 700 pA-1,5 nA | Horas-dias |
Tabela 2. Correntes de trituração de FIB usadas para a preparação da amostra e o funcionamento da imagem
Discussão
A microscopia eletrônica de volume é mais desafiadora e demorada do que SEM ou TEM convencional. Devido à necessidade de manchar tecidos ou células em bloco, as etapas de processamento devem ser longas o suficiente para garantir a penetração dos reagentes em toda a amostra. Usar a energia da microonda para facilitar a penetração faz para um processamento mais curto, mais eficiente e melhora a mancha. Porque a preparação para EM é muito mais rigorosa do que para a microscopia de luz todas as soluções e reagentes devem ser rigorosamente controlados de qualidade. Alterações no pH, tonicidade, uso de reagentes impuros e introdução de contaminantes devido à má técnica podem ter efeitos deletérios na imagem final.
O volume EM também requer protocolos adaptados individualmente para cada tipo de amostra diferente. Tecidos de mamíferos de diferentes tipos: plantas, células individuais como levedura, tripanossomas, C. elegans, etc., todos precisam de suas próprias variações para alcançar resultados ideais. A fixação e a coloração devem ser projetadas de modo a preservar a integridade estrutural e manter a amostra o mais próxima possível da sua morfologia in vivo. A fixação dos tecidos à temperatura fisiológica, pH e tonicidade é fundamental para tornar a amostra como a vida como pode ser. Congelamento de alta pressão (HPF) de amostras pode ajudar a preservar uma situação mais semelhante à vida, (ou talvez apenas produzir artefatos diferentes), mas para além de células e tecidos muito finos HPF falhará como gelo vítreo só pode ser gerado em pequenos volumes. Conseqüentemente para muitas perguntas a fixação química é a única opção. Não importa se a fixação é HPF ou química, em qualquer experimento em os resultados estruturais precisam ser cuidadosamente comparados com resultados semelhantes de células ao vivo ou imagem de tecido para ver se eles são consistentes. A coloração também deve ser otimizada, considerando a questão específica que precisa ser atendida e o protocolo que será usado para visualização das imagens digitais.
Ter um sistema SBF-SEM e FIB em estreita proximidade é uma grande vantagem em muitos experimentos. O grande campo de visão e alta X, Y resolução de SBF-SEM faz encontrar estruturas individuais/células/eventos simples e fornece uma orientação espacial geral das células nos tecidos. Além disso, sua capacidade de permitir imagens através de uma amostra em Z é muito poderosa; no entanto, reconstruções que exigem detalhes geométricos finos podem falhar ou produzir artefatos usando essa técnica devido aos voxels não isotrópicos que ele gera. O FIB é limitado pela física do processo a um campo de imagem menor, mas sua resolução 3D é suficiente para reconstruções muito precisas. Combinando as duas técnicas é simples como as amostras podem se mover de SBF-SEM para FIB sem mais processamento ou preparação. Reconhecemos que usar o SBF-SEM para pesquisar através de uma amostra para encontrar uma determinada área é um uso muito caro de uma ferramenta muito mais capaz. No entanto, a capacidade de ver imediatamente o novo blockface e determinar se o ROI foi atingido é uma grande vantagem. Adicionalmente, as alternativas de usar seções semifinas seriais de LM (0,5 μm) podem remover estruturas pequenas antes que estejam detectadas, e inspecionar um bloco usando únicas seções do TEM que têm que ser cortadas, põr sobre uma grade e vista então em um TEM ingualmente caro não é como eficiente como o método apresentado.
Como muitos programas existem para segmentar e renderizar os dados, e as necessidades de uma determinada estrutura podem não ser melhor atendidas por um único aplicativo, nenhum fluxo de trabalho padrão pode ser proposto. Algumas estruturas simples podem ser segmentadas com um algoritmo de limiarização se elas se enquadram em valores de escala cinza muito estreitos. As estruturas neuronal podem ser segmentadas semiautomaticamente usando um programa tal como ilastik11 mas será menos útil em organelas dados forma mais aleatórios ou complexos tais como o er. Microscopia Image browser é um programa muito flexível que pode alinhar, segmentar e renderizar dados de volume EM, mas requer interação significativa do usuário12. Como regra geral, a quantidade de tempo necessária para visualizar digitalmente os resultados excederá muito o tempo para preparar a amostra e a imagem.
As técnicas de volume EM têm aberto a terceira dimensão à análise ultraestrutural. Outros métodos de obtenção de EM 3D têm limitações em seu volume (tomografia TEM), ou sua eficiência (seção serial TEM). Embora para a maior parte das técnicas de volume EM são muito complexas e dispendiosas para ser implementado em laboratórios individuais, o número de instalações compartilhadas núcleo oferecendo-lhes tem crescido e o número de tipos de amostra com sucesso imaged aumentou rapidamente. Para aqueles com uma pergunta específica e um tecido particular é provável que alguém será capaz de oferecer conselhos e instruções sobre a sua preparação e imagem. O equipamento EM volume pode ser melhorado para incluir a capacidade de manusear amostras maiores no SBF-SEM e a capacidade de fresagem de ROIs maiores com o FIB. Software que é capaz de segmentar estruturas de interesse de uma forma mais automatizada irá simplificar muito o processo de análise dos dados e melhorias na velocidade de computação reduzirá o tempo necessário para fazê-lo. Apesar de suas limitações atuais, o volume EM ainda é uma ferramenta útil e a combinação de SBF-SEM e FIB-SEM fornece um fluxo de trabalho eficiente para identificar eventos raros e imagens em alta resolução.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
O equipamento para o volume EM foi fornecido por uma concessão generosa do governo de Flanders.
Materiais
| Name | Company | Catalog Number | Comments |
| 3View 2XP | Gatan | NA | In chamber ultramicrotome for SBFI |
| Cacodylate buffer 0.2M solution | EM Sciences | 11652 | |
| Conductive epoxy resin (circuit works) | RS components | 496-265 | |
| Diatome Histo 4.0mm diamond knife | EM Sciences | 40-HIS | |
| Digitizing tablet | Wacom | DTV-1200W | No longer available |
| Eppendorf tubes | Eppendorf | 0030 120.094 | |
| Flat Embedding Mold | EM Sciences | 70900 | |
| Gluteraldehyde 25% solution | EM Sciences | 16220 | |
| High MW Weight Tannic Acid | EM Sciences | 21700 | |
| Lead Citrate | Sigma-Aldrich | 22861 | |
| NaCl | Sigma-Aldrich | 746398 | |
| Osmium Tetroxide 4% solution | EM Sciences | 19170 | |
| Paraformaldehyde | Sigma-Aldrich | P6148 | |
| Pelco Biowave Pro + | Ted Pella | 36700 | |
| Potassium Ferrocyanide | Sigma-Aldrich | P3289 | |
| Quorum Q150T ES sputter coater | Quorum Technologies | 27645 | |
| Reichert-Jung Ultracut ultramicrotome | NA | NA | No longer available |
| Sodium Cacodylate 0.2M | EM Sciences | 11653 | |
| Spurrs Resin kit | EM Sciences | 14300 | |
| Uranyl Acetate | EM Sciences | 22400 |
Referências
- Linberg, K. A., Fisher, S. K. An ultrastructural study of interplexiform cell synapses in the human retina. Journal of Comparative Neurology. 243, 561-576 (1986).
- Peddie, C. J., Collinson, L. M. Exploring the third dimension: volume electron microscopy comes of age. Micron. 61, 9-19 (2014).
- Leighton, S. SEM images of block faces, cut by a miniature microtome within the SEM – A technical note. Scanning Electron Microscopy. (pt 2), 71-76 (1981).
- Denk, W., Horstmann, H. Serial block-face scanning electron microscopy to reconstruct three dimensional tissue nanostructure. PLoS Biology. 11, 329 (2004).
- Heymann, J. A., Hayles, M., Gestmann, I., Giannuzzi, L. A., Lich, B., Subramaniam, S. Site specific 3D imaging of cells and tissues with a dual beam microscope. Journal of Structural Biology. 155 (1), 63-73 (2006).
- . NCMIR Methods for 3D EM: A new protocol for preparation of biological specimens for serial block face scanning electron microscopy. V7_01_10 Available from: https://ncmir.ucsd.edu/sbem-protocol (2019)
- Giberson, R. T., Austin, R. L., Charlesworth, J., Adamson, G., Herrera, G. A. Microwave and digital imaging technology reduce turnaround times for diagnostic electron microscopy. Ultrastructural Pathology. 27 (3), 187-196 (2003).
- Kremer, A., et al. Developing 3D EM in a broad biological context. Journal of Microscopy. 259 (2), 80-96 (2015).
- Vanslembrouck, B., Kremer, A., Pavie, B., van Roy, F., Lippens, S., van Hengel, J. Three-dimensional reconstruction of the intercalated disc including the intercellular junctions by applying volume scanning electron microscopy. Journal of Histochemistry and Cell Biology. 149, 479-490 (2018).
- Russel, M. R., et al. 3D correlative light and electron microscopy of cultured cells using serial blockface scanning electron microscopy. Journal of Cell Science. 130 (1), 278-291 (2017).
- Sommer, C., Strähle, C., Köthe, U., Hamprecht, F. A. ilastik: Interactive Learning and Segmentation Toolkit. Eighth IEEE International Symposium on Biomedical Imaging (ISBI). Proceedings. , 230-233 (2011).
- Belevich, I., Joensuu, M., Kumar, D., Vihinen, H., Jokitalo, E. Microscopy Image Browser: A Platform for Segmentation and Analysis of Multidimensional Datasets. PLoS Biology. 14 (1), e1002340 (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados