Method Article
Programa de autópsia abrangente para indivíduos com esclerose múltipla
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A esclerose múltipla é uma doença desmielinante inflamatória sem cura. A análise do tecido cerebral fornece indícios importantes para a compreensão da patogênese da doença. Aqui nós discutimos a metodologia e a análise a jusante do tecido do cérebro do MS coletado através de um programa rápido original da autópsia na operação na clínica de Cleveland.
Resumo
Nós descrevemos um programa rápido da doação do tecido para indivíduos com esclerose múltipla (MS) que exige cientistas e técnicos ser em-chamada 24/7, 365 dias um o ano. Os participantes consentem em doar seu cérebro e medula espinhal. A maioria dos pacientes foi seguida por neurologistas no centro de Cleveland Clinic Mellen para tratamento e pesquisa em MS. Seus cursos clínicos e deficiências neurológicas são bem caracterizados. Logo após a morte, o corpo é transportado para o MS Imaging Center, onde o cérebro é escaneado in situ por 3 T ressonância magnética (RM). O corpo é então transferido para a sala de autópsia, onde o cérebro ea medula espinhal são removidos. O cérebro é dividido em dois hemisférios. Um hemisfério é imediatamente colocado em uma caixa de fatiamento e as fatias alternadas de 1 cm de espessura são fixadas em paraformaldeído a 4% por dois dias ou rapidamente congeladas em gelo seco e 2-metilbutano. As fatias curtas-fixas do cérebro são armazenadas em uma solução da criopreservação e usadas para análises histológicas e deteção Immunocytochemical de antígenos sensíveis. As fatias congeladas são armazenadas em-80 ° c e usadas para estudos moleculares, Immunocytochemical, e in situ do espaço da hibridação/RNA. O outro hemisfério é coloc no paraformaldeído de 4% por diversos meses, coloc na caixa de fatiamento, re-digitalizados no varredor da ressonância magnética de 3 T (Sr.) e cortado em fatias do centímetro-grosso. As imagens de RM in situ pós-morte (MRIs) são coregistradas com fatias cerebrais de 1 cm de espessura para facilitar as correlações da ressonância magnética. Todas as fatias do cérebro são fotografadas e as lesões da branco-matéria do cérebro são identificadas. A medula espinhal é cortada em segmentos de 2 cm. Segmentos alternativos são fixados em 4% paraformaldeído ou rapidamente congelados. A aquisição rápida de tecidos do MS pós-morte permite análises patológicas e moleculars de cérebros de MS e de cordas espinais e de correlações patológicas de anomalias do cérebro MRI. A qualidade destes tecidos pós-morte ràpida-processados (geralmente dentro de 6 h da morte) é de grande valor à pesquisa de MS e conduziu a muitas descobertas High-Impact.
Introdução
Uma das melhores maneiras de estudar uma doença é examinar o próprio tecido doente. Isso apresenta desafios àqueles que estudam doenças do sistema nervoso central (SNC). As biópsias do cérebro doente e da medula espinal são extremamente raras e envolvem geralmente casos atípicos. As taxas da autópsia para indivíduos com doenças do CNS diminuíram dramàtica nos últimos anos, e quando executadas, frequentemente não fornecem a aquisição rápida dos tecidos. Esses desafios resultaram no estabelecimento de bancos cerebrais centrados na doença, incluindo vários focados na coleta de tecidos de indivíduos com esclerose múltipla (SM). MS é uma doença mediada por inflamação do SNC que destrói mielina, oligodendrócitos (células de formação de mielina), neurônios e axônios. A maioria dos pacientes com SM tem um curso de doença bi-fásica que começa com crises de incapacidade neurológica com recuperação variável que eventualmente evolui para uma doença gradualmente progressiva que é provavelmente neurodegenerativa na natureza1. Para a maioria dos cérebros doados do MS, os intervalos pós-morte (PMI) entre o processamento do óbito e do tecido excedem 24 h. Quando estes tecidos forneceram a informação valiosa a respeito das mudanças patológicas nos cérebros do MS, não são seridos para uns estudos moleculars mais avançados que possam fornecer introspecções poderosas na patofisiologia da doença. Isto é particularmente o caso para estudos de perfilamento do gene, que exigem o RNA intacto.
Para superar as limitações discutidas acima, nós desenvolvemos um programa rápido da doação do tecido que permita MRI/correlações patológicas. Este protocolo fornece os tecidos bem preservados apropriados para estudos moleculars modernos e permite a comparação direta da patologia do cérebro e das anomalias de MRI em cérebros do MS. O programa de doação de tecido de esclerose múltipla de Cleveland Clinic existe há mais de 20 anos. Este programa rápido da doação do tecido adquire cérebros e os cabos espinais dos indivíduos com MS e outras circunstâncias neurológicas auto-imunes associadas. O programa tem como objetivo obter MRIs in situ dentro de 6 h de óbito, seguidos pela remoção do cérebro e da medula espinhal para processamento tecidual.
Recrutamento
As doações são obtidas por meio de um consentimento ante mortem obtido diretamente de pacientes (pré-consentiu) ou de parentes próximos após a morte. Os pacientes pré-consentiram são identificados tipicamente da população clínica no centro de Mellen para o tratamento e a pesquisa da esclerose múltipla em Cleveland, Ohio. Embora a preferência no recrutamento no programa rápido da doação do tecido seja dada aos pacientes que foram seguidos em estudos longitudinais da pesquisa, está aberto a todos os pacientes vistos no centro. Os participantes que se inscreverem antes da morte recebem instruções para que os membros da família ou prestadores de cuidados contactem a equipa de investigação, seja no momento da morte ou quando se pensa que a morte é iminente. O segundo método para que os indivíduos entrem no programa de doação de tecidos é no momento da morte através do consentimento de parentes próximos. O estado de Ohio exige que as mortes sejam encaminhada a uma organização de contratação de órgãos federalmente mandatada denominada LifeBanc, que opera em 20 municípios do nordeste de Ohio. LifeBanc telas todas as mortes para um diagnóstico do MS, que seja uma exclusão para a doação do órgão. Os arranjos foram feitos para que o LifeBanc notifique investigadores do programa da doação do tecido do MS para todas as mortes com um diagnóstico associado do MS que ocorre dentro de um raio 75-Mile da clínica de Cleveland. Próximo de parentes e funcionários do hospital são então contatados pela equipe do programa de doação de tecidos e consentimento é obtido para doação de tecidos cerebrais e da medula espinhal. Estes dois métodos de recrutamento ante-mortem e post-mortem através de LifeBanc resultam em aproximadamente 10-12 doações cerebrais por ano. Os ajustes são feitos para o limite de idade superior da morte para gerenciar o número de encaminhamentos derivados do LifeBanc.
Aquisição de doações
O programa requer cobertura de 24 h, 365 dias por ano por membros do programa de doação de tecidos para suprimento de tecidos. Um e-mail de notificação de doação de tecido centralizado/pager/dispositivo móvel sistema de notificação de texto é usado pela equipe clínica cobrindo doações de tecidos. LifeBanc é fornecido números para contactar pessoal de plantão para o programa de doação de tecidos. Os membros são notificados de morte por prestadores de serviços hospitalares/parentes próximos (pré-consentiu) ou por LifeBanc e outras fontes de referência. Em primeiro lugar, é feita uma determinação do tempo de morte e a viabilidade da doação de tecidos. As mortes são então rastreadas para condições que potencialmente resultam em tecido de má qualidade, incluindo hipóxia pré-morte prolongada, tecido cerebral destrutivo maciço (por exemplo, hemorragia intracraniana grande, traços bi-hemisféricos extensos, tumor extenso (> 3 dias) e uso prolongado de agentes vasoativos (> 3 dias) antes da morte. Quando um examinador médico está envolvido em uma morte, o neurologista do estudo pode falar com o examinador médico para explorar uma maneira de receber tecidos oportunos sem comprometer a responsabilidade do examinador médico. Se o tecido viável é sentida para estar presente, então o consentimento escrito é obtido (se não for obtido pré-morte) e preparações são feitas para o transporte do corpo. Um serviço de transporte falecida previamente contratado é então contactado para o transporte para as instalações de ressonância magnética na Cleveland Clinic. O cuidado é tomado para assegurar-se de que o corpo permaneça na temperatura ambiente e não seja coloc no refrigeration, porque umas mais baixas temperaturas de corpo são associadas com as alterações em características do sinal de MRI.
História clínica
A história clínica inclui detalhes sobre o diagnóstico de SM, início dos sintomas, tratamentos utilizados, resultados de testes clínicos e paraclínicos (potenciais evocados, resultados do fluido cefalorraquidiano, tomografia de coerência óptica), composto funcional de esclerose múltipla , e a escala expandida do status da inabilidade (EDSS; real ou estimada), que são coletadas do registro médico (onde disponível), e entrevista direta do parente seguinte. A RM pré-morte também é coletada.
Protocolo
Este protocolo foi aprovado pelo Conselho de revisão institucional da Cleveland Clinic e segue as diretrizes do Comitê de ética em pesquisa humana da Cleveland Clinic.
1. MRI in situ
- Leve o corpo do doador para a suíte de ressonância magnética e realize um protocolo de ressonância magnética de 2 h no MS Imaging Facility. Conduza MRI em um Imager de 3 T ou de 7 T.
Nota: Prioridade é dada a 3T como a maioria dos dados legados foi realizada em 3 T, mas quando não disponível, a imagem é conduzida com 7T. As sequências centrais designadas são executadas para todos os casos (tabela 1) e sequências adicionais que dependem dos interesses atuais da pesquisa são executadas se o tempo permitir (restringido conseguindo a fixação do tecido menos de 12 h após a morte). A tabela 1 descreve as sequências principais.
2. autópsia
Nota: Após a RM in situ, o corpo é transportado para o necrotério para extração do cérebro e da medula espinhal por um Diener e processamento de tecido por membros do laboratório.
- Realize as seguintes etapas antes da chegada do corpo no necrotério. Duas horas antes, prepare 3 L de paraformaldeído a 4% (PFA) e recipientes de etiquetas e sacos para armazenamento de tecidos. Preparar 3 L de 8% de PFA e diluir 1,5 L de 8% de PFA a 4% de PFA. Coloque o restante 8% PFA em 4 ° c para o dia 2.
- Antes de viajar para o necrotério, encha 2 refrigeradores de viagem para 50% de capacidade com gelo seco (grandes blocos quebrados para caber e pequenas Pelotas).
- No necrotério, encha um recipiente de aço inoxidável a meio caminho com 2-metilbutano e gelo seco e cubra com uma tampa em preparação para encaixar o congelamento do tecido.
- Pesar e fotografar o cérebro, uma vez removido pelo Diener.
- Coloc toda a dura unida em um recipiente enchido com o PFA.
- Separe o cerebelo e o tronco cerebral do cérebro e fotografe o encéfalo.
- Identifique os nervos óticos, o quiasma, e os intervalos e separe-os usando uma ponta de prova e uma pinça. Resect a estrutura com um bisturi.
Nota: O segmento distal de um lado do nervo óptico é marcado usando a tinta de Higgins para identificação. - Separe os hemisférios cerebrais longitudinalmente e fotografe cada hemisfério individualmente.
- Tinta do córtex motor primário (PMC) para o hemisfério esquerdo, re-fotografá-lo, e colocá-lo em um recipiente de 3,3 L para Long-fixação. Documente a hora de início para a fixação cerebral.
- O PMC para o hemisfério direito pode ser Inked ou extirpado.
- Se estiver sendo extirpado, Remova primeiramente as meninges da coberta.
- Re-fotografe ou extirpada PMC.
- Se PMC é extirpado, corte em 6 seções ingualmente-feitas medida.
- Tinta o aspecto rostral de cada seção.
- Coloque seções ímpares em contêineres cheios de PFA para fixação curta.
- Encaixe-congele seções mesmo-numeradas e coloc em sacos fechados do congelador no refrigerador #1.
- Corte o hemisfério direito anterior ao posterior em seções coronais de 1 cm de espessura.
- Documentar anormalidades brutas (por exemplo, artefato de corte, hemorragia e lesões).
- Coloque seções ímpares em contêineres preenchidos com PFA para fixação curta.
- Encaixe-congele seções mesmo-numeradas e coloc em sacos fechados do congelador.
- Fim do documento do tempo de fixação cerebral.
- Separe o tronco cerebral do cerebelo e coloque-o em um recipiente cheio de PFA para a curto-fixação.
- Separe os hemisférios Cerebelares longitudinalmente.
- Corte cada hemisfério em 4 seções sagital ingualmente grossas.
- Fotografia de vistas medial e lateral.
- Coloque as fatias hemisféricas Cerebelares esquerdas em um recipiente enchido com o PFA para a curto-fixação.
- Encaixe-congele fatias hemisféricas Cerebelares direitas e coloc em sacos selados do congelador no refrigerador #1.
- Obter a medula espinhal com raízes nervosas do Diener.
- Remover dura-máter da medula espinhal e armazenar dura em um recipiente com PFA.
- Separe as raízes do nervo anterior e posterior esquerda e direita. Corte as raizes de nervo anteriores e posteriores esquerdas cortadas da medula espinal e coloc em um recipiente enchido PFA para a curto-fixação.
- Corte as raízes do nervo anterior e posterior direita da medula espinhal, snap-Freeze, coloque em sacos de freezer selado, e depois coloque no refrigerador #2.
- Fotografe o caudal-mais de 20 cm da medula espinhal. Documentar a localização do alargamento lombar.
- Corte secções transversais de 2 cm do cabo procedendo de caudal a rostral.
- Tinta o aspecto rostral de cada seção de corte.
- Coloque seções ímpares em contêineres preenchidos com PFA para fixação curta.
- Encaixe-congele seções mesmo-numeradas, lugar em sacos fechados do congelador, e coloc então no refrigerador #2.
- Documentar a hora de início para a fixação da medula espinhal e quaisquer anomalias brutas.
- Fotografe a porção rostral remanescente da medula espinhal.
- Documentar a posição do alargamento cervical. Siga os passos 2.13.5 – 2.13.8 para a medula espinhal remanescente.
- Depois do lugar necrotério tecido congelado em caixas rotuladas em-80 freezers ° c. Armazene o tecido fixo a 4 ° c.
- Em 24 h após a autópsia (dia 2) diluir o restante 8% PFA para 4%.
- Substitua 4% de PFA em recipientes de fixação com 4% de PFA recém-diluídos.
- Em 60 h pós-autópsia preparar soluções de 2,5% de glutaraldeído em 4% PFA de glutaraldeído, PFA, dH2o e Sorenson tampão (preparado pela mistura em seqüência: 0,2 M tampão fosfato pH 7,4, polyvinylpyrolidone 1% w/v, sacarose 30% w/v, e etileno glicol 30% v/v).
- Remover usado 4% PFA de recipientes de fixação curta.
- Enxague o tecido no tampão de Sorenson e coloque-o na solução de crioproteção (glicerol 20%, 0,4 M de Sorenson tampão 20%, e 0, 2% azida sódica em dH2O).
- Fotografar fatias cerebrais de curto-fixo, cerebelo, tronco encefálico e córtex motor (se aplicável).
- Com uma lâmina de bisturi cortada cortes transversais grossos de 2 milímetros de cada seção Short-fixada da medula espinal de 2 cm.
- Coloque secções em frascos de 2 mL de cintilação e encha com solução de 2,5% de glutaraldeído em 4% de PFA.
- Retorne a seção restante para o frasco de cintilação original de 20 mL. Enxague a seção com o tampão de Sorenson e substitua com a solução crioproteção.
3. patologia
Nota: As fatias Short-fixas do hemisfério direito assim como o hemisfério esquerdo longo-fixado (coloc em 4% PFA por diversos meses) são cortadas em seções de 30 μm (referidas como livre-flutuando) ou encaixadas na parafina e cortadas como seções de 12 – 14 μm (referidas como embebido em parafina). Estas seções são processadas geralmente com proteína proteolipid (PLP) para detectar lesões Demyelinating e o complexo principal II do histocompatibilidade (MHC-II) para a atividade imune usando o método do diaminobenzidina (DAB). Esses protocolos foram padronizados e utilizados em diversas publicações2,3,4,5,6,7, 8,9 , 10 de , 11 anos de , doze anos.
-
Livre-flutuante (30 μm) DAB-avidina-biotina complexo (ABC) mancha de tecido
- Remova seções da solução câmera, transfira seções a uma placa de seis poços, e lave-os 3x por 5 minutos cada um em 2 ml do pH fisiológico tamponado do fosfato 1x 7,0 (PBS). Ao transferir para o próximo poço na placa de seis poços, use o cuidado para não rasgar o tecido. Durante cada etapa da lavagem e da incubação, coloc a placa de seis poços em um abanador e permita que o tecido agite delicadamente.
Nota: As seções do tecido incubadas em volumes menores e em placas maiores (isto é, placas de 12 e 24 poços) tendem a expor a superfície e a borda que rasgam. - Realize a recuperação do antígeno por seções de microondulação em uma taça de vidro contendo aproximadamente 30 mL de tampão do citrato de 10 mM (pH 6,0). Assegure-se de que os tecidos não sejam dobrados manipulando com um pincel e seções de microondas por 2 – 3 min ou até que o tampão citrato comece a ferver. Permitir que as secções esfriem até à temperatura ambiente (~ 20 min).
- Transfira as secções de volta para uma placa de seis poços e lave as secções 3x durante 5 min cada em 2 mL de PBS/0,3% Triton X-100. Bloqueie peroxidases endógenas por secções incubantes em 2 mL de 3% H2O2/0,3% Triton X-100/PBS durante 30 min à temperatura ambiente (RT).
- Lave as secções 3x durante 5 min cada em 2 mL de PBS/0,3% Triton X-100. Secções de blocos em 2 mL de 3% de soro de cabra normal/0,3% de Triton X-100/1X PBS por 1 h em RT.
- Incubar seções durante a noite a 5 dias (dependendo do anticorpo) em anticorpos preliminares dirigidos de encontro aos resumos do microglia e do mielina para detectar a inflamação (mhcii) e o demyelination (PLP) (veja a tabela dos materiais) em 4 ° c.
Nota: Assegure-se de que as seções não sejam dobradas ao incuar nesta etapa ou em etapas subseqüentes porque esta conduzirá às áreas dentro das seções que estão sendo nulas da mancha. - Lave as secções 3x durante 5 min cada uma em 2 mL de 1X PBS. Em seguida, incubar seções em anticorpos biotinilados secundários (ver a tabela de materiais) para 1 h em RT. Prepare a solução do complexo de avidin-biotina (ABC) durante a incubação aproximadamente 45 minutos antes da etapa seguinte da lavagem para permitir que os complexos do ABC formem.
- Lave as secções 3x durante 5 min cada uma em 2 mL de 1X PBS. Em seguida, incubar seções no ABC por 1 h em RT.
- Lave as secções em 2 mL de 1X PBS três vezes durante 5 min cada. Incubar secções em DAB filtrado (2 mL/poço/Secção) contendo H2o2 (1:500 diluição de 30% h2o2 em DAB) até que a cor se desenvolva adequadamente (~ 3 – 8 min).
- Lave as secções 3x durante 5 min cada uma em 2 mL de 1X PBS. Para aumentar o sinal (opcional), osmicate usando 0, 4% OsO4 (~ 30 s).
- Lave as secções três vezes durante 5 min cada em 1X PBS. Individualmente, transfira cada seção da placa de seis poços a um recipiente pequeno completamente de 1X PBS e posicione a seção do tecido em uma corrediça de vidro tão horizontalmente como possível.
- Levante delicadamente a corrediça fora do PBS ao assegurar-se de que a seção do tecido seja tão lisa como possível. Usando duas escovas de pintura, aplainam delicadamente e esticam o tecido para fora na corrediça e DAB afastado o excesso de água com toalha de papel. Monte as seções do tecido com glicerol (ou um meio de montagem equivalente) e sele o lamela com lustrador de prego desobstruído.
- Remova seções da solução câmera, transfira seções a uma placa de seis poços, e lave-os 3x por 5 minutos cada um em 2 ml do pH fisiológico tamponado do fosfato 1x 7,0 (PBS). Ao transferir para o próximo poço na placa de seis poços, use o cuidado para não rasgar o tecido. Durante cada etapa da lavagem e da incubação, coloc a placa de seis poços em um abanador e permita que o tecido agite delicadamente.
4. seções hemisféricas parafina-encaixadas: mancha do DAB
- Derreter a parafina nas lâminas num forno a 60 ° c durante 5 – 10 min.
- Seções de-paraffinize incubando em xileno 3x por 5 min cada.
- Rehidrate o tecido em etanol graduado em 100% (2x por 5 min cada), 95% (2x por 5 min), 70% (2x por 5 min cada), e 50% (1x por 5 min cada). Lâminas de cobertura em PBS.
- O antígeno recupera por corrediças de microondulação em uma taça do tampão do citrato de 10 milímetros (pH 6,0).
- Lave as lâminas em 1X PBS (3x por 5 min cada) uma vez arrefecido à temperatura ambiente. Bloquear peroxidases endógenas pelo tecido incubador em 3% H2O2/1% Triton-X 100/PBS por 30 min.
- Lave o tecido em 1X PBS três vezes por 5 min cada. Tecido de bloco com 6% de soro de cabra normal em PBS por 1 h.
- Incubar seções no anticorpo preliminar (veja a tabela dos materiais) em PBS na temperatura ambiente (RT) durante a noite (máximo 20 h).
- Lave as secções 3x durante 5 min cada em 1X PBS. Em seguida, incubar seções no anticorpo secundário correspondente (ver a tabela de materiais) em PBS para 1 h em RT.
- Prepare a solução ABC aproximadamente 45 min antes da próxima etapa de lavagem durante a incubação.
- Lave as secções 3x durante 5 min cada em 1X PBS e, em seguida, incubar no ABC durante 1 h em RT.
- Lave a secção 3x durante 5 min cada em 1X PBS.
- Incubar secções filtradas (tamanho de poros do filtro de 0,45 μm) DAB contendo H2o2 (1:500 diluição de 30% h2o2 em DAB) até que a cor se desenvolva adequadamente (~ 3-8 min).
- Secções de lavagem (3x 5 min) em 1X PBS. Para aumentar o sinal, osmicate usando 0, 4% de tetróxido de ósmio (OsO4; aproximadamente 30 s).
- Secções de lavagem (3x 5min) em 1X PBS.
- Deshidratar o tecido em uma série graduada de etanol 50% (1x 5min), 70% (1x 5min), 95% (2x 5min), 100% (2x 5 min), e 100% xileno (1x 5min). Permitir que os xilenos evaporem.
- Monte seções com mídia de montagem seca rápida à base de tolueno. Formulações que contenham anti-oxidantes são recomendadas para evitar o branqueamento de manchas. Remova o excesso de suportes de montagem das bordas do slide com uma navalha para armazenamento subsequente.
5. correlações de RM/patologia
Nota: Para correlacionar MRI com patologia, nós executamos primeiramente o ex vivo MRI do hemisfério intacto longo-fixado do cérebro (etapa 2,9 acima) em uma caixa ajustável com os marcadores MRI-visíveis que indicam entalhes de fatiamento. Nós, então, cortar o cérebro e fotografar as fatias de 1 cm para permitir o coregisto de MRIs in situ para as fatias cerebrais individuais. Nós podemos então executar análises MRI-guiadas, onde as regiões do interesse (ROIs) são identificadas em MRI para dirigir a análise do tecido. Também podemos realizar análises guiadas por histopatologia, onde os ROIs são identificados no tecido (por exemplo, lesões de matéria branca, matéria branca sem desmielinização, etc.) e, em seguida, caracterizados pelas medidas colocalizadas de RM (tabela 1).
-
Identificação de ROIs baseados em RM
Nota: em estudos prévios, identificamos Rois na matéria branca11,12,13,14,15 e matéria cinzenta16,17, 18. o exemplo abaixo é para análise de matéria branca.- Segmento T2 lesões hiperintensas em MRIs in situ (a partir do passo 1,1), inicialmente processado por um algoritmo automático, e, em seguida, corrigido manualmente por usuários experientes.
- Segmento T1 lesões hipointensas dentro de lesões T2 como voxels com uma intensidade de sinal menor ou igual a 80% da intensidade do sinal do tecido cerebral de aparência normal circundante.
- Segmentar áreas hipointensas em mapas de taxa de transferência de magnetização (MTR) com um limiar de 80%.
- Crie três classificações usando as segmentações acima: (a) as lesões T2-only que são anormais em varreduras de T2-weighted/FLAIR mas normais em T1-weighted ou em varreduras de MTR, (b) lesões T2T1MTR, que são anormais em todas as varreduras de T2-weighted/FLAIR, de T1, e de MTR; e (c) normal-aparecendo a matéria branca (NAWM), que são normais em todas as varreduras de T2-weighted/FLAIR, de T1-weighted, e de MTR.
Nota: Nossa seleção de fatias é baseada na existência de todos os três tipos de regiões de interesse (T2-only, T2T1MTR e NAWM) nas mesmas fatias. - Calcule intensidades normalizadas para cada ROI para minimizar a variabilidade decorrente de diferentes cérebros e localizações cerebrais diferentes.
-
Co-registro de RM in situ em fatias cerebrais
- Escaneie o hemisfério cerebral fixo em uma caixa de corte personalizada com quatro linhas de marcadores sensíveis à ressonância magnética localizando os slots onde uma faca pode ser inserida para cortar o cérebro. Realize uma aquisição de MPRAGE 3D ponderada em T1 com resolução isotrópica de 1 mm cobrindo o cérebro fixo e todos os marcadores.
Nota: Isto é chamado MRI da borne-fixação e é usado somente como uma etapa intermediária para o coregisto dos MRIs in situ às fatias do cérebro. - Imediatamente após a digitalização, corte o hemisfério cerebral em slots localizados a 1 cm de distância, resultando em aproximadamente 15 fatias.
- Fotografe as fatias cerebrais em ambos os lados anterior e posterior.
- Registre a RM in situ e as fotografias de fatias cerebrais com as etapas a seguir.
- Para a segmentação de pós-fixação e MPRAGE in situ, pré-processo tanto pós-fixação quanto MPRAGE in situ para não uniformidade de intensidade19.
- Segmentar o cérebro e quatro fileiras de marcadores do pré-processado pós-fixação MPRAGE.
- Segmentar o hemisfério correspondente à RM20,21 pós-fixação do mprage in situ pré-processado.
- Coregistre os MRIs in situ e pós-fixação extraídos do cérebro por meio de uma série de processos de registro linear até 12 graus de liberdade (registro afim) usando o FSL FLIRT22. Os componentes de dimensionamento e corte respondem pelo efeito do encolhimento da fixação.
- Encontre a direção normal do plano de corte minimizando a soma das intensidades máximas projetadas usando os marcadores segmentados. Esses ângulos de reorientação são incorporados na matriz de transformação obtida a partir da etapa anterior.
- Combine visualmente imagens de RM com fotografias de fatias de cérebro posteriores fixas usando um visualizador de imagens em casa que permite alterar a profundidade e a orientação dos vetores normais. Pequenas modificações são necessárias porque o corte cerebral é imperfeito.
- Aplique a transformação de imagem AFFINE13 para cada fatia para transformar os MRIs in situ nos mesmos locais de fatiamento que as fotografias das fatias cerebrais.
- Para a segmentação de pós-fixação e MPRAGE in situ, pré-processo tanto pós-fixação quanto MPRAGE in situ para não uniformidade de intensidade19.
- Escaneie o hemisfério cerebral fixo em uma caixa de corte personalizada com quatro linhas de marcadores sensíveis à ressonância magnética localizando os slots onde uma faca pode ser inserida para cortar o cérebro. Realize uma aquisição de MPRAGE 3D ponderada em T1 com resolução isotrópica de 1 mm cobrindo o cérebro fixo e todos os marcadores.
Resultados
Como mencionado acima, quase metade do hemisfério cerebral está congelado e disponível para estudos moleculares usando DNA, RNA, ou proteína. Historicamente, estudos que utilizam tecidos cerebrais pós-morte mostraram-se afetados por condições pré-morte, idade, sexo, pH tecidual, integridade de mRNA (RIN), intervalo pós-morte (PMI), segurança diagnóstica, uso de comorbidades e tratamento prévio de medicação estado23. Com base em estudos que utilizam tecidos cerebrais, o DNA e a proteína parece ser afetado em menor grau em comparação com o RNA. Com base em nossa experiência, o isolamento de RNA e a análise a jusante, no entanto, foram encontrados para ser mais afetados pelas condições pré-morte e intervalo pós-morte do tecido cerebral. Nós discutimos conseqüentemente algumas das circunstâncias a ser seguidas para conduzir a análise baseada RNA usando tecidos pós-morte do MS.
Para todos os nossos estudos, após o cérebro é coletado na autópsia, é cortado (1 cm de espessura) e, em seguida, fixado em 4% paraformaldeído para estudos morfológicos ou rapidamente congelado para análise bioquímica. Todos os blocos do tecido são caracterizados para o demyelination pela imunocoloração usando PLP como descrito acima. Um esquema de análise representativo é mostrado na Figura 1. As secções teciduais são examinadas para a presença de lesões de matéria branca (Figura 1a). As regiões selecionadas são coradas para a atividade imune (Figura 1b) e desmielinização (Figura 1C). O tecido congelado é montado no criostat (Figura 1D) e as seções congeladas de 30 μm são cortadas. Isto é seguido pela coleção de 3-4 seções subseqüentes, pela separação dos tecidos adjacentes, e pelo armazenamento para o ADN, o RNA, ou o isolamento da proteína. Usando este protocolo, Nós isolamos com sucesso o ADN24,25, RNA5,6,7,8,9 assim como proteínas26. Quando os resultados principais de alguns dos estudos que analisam o RNA dos cérebros do MS são discutidos, estão aqui algumas das edições relativas à análise de cérebros pós-morte do RNA MS.
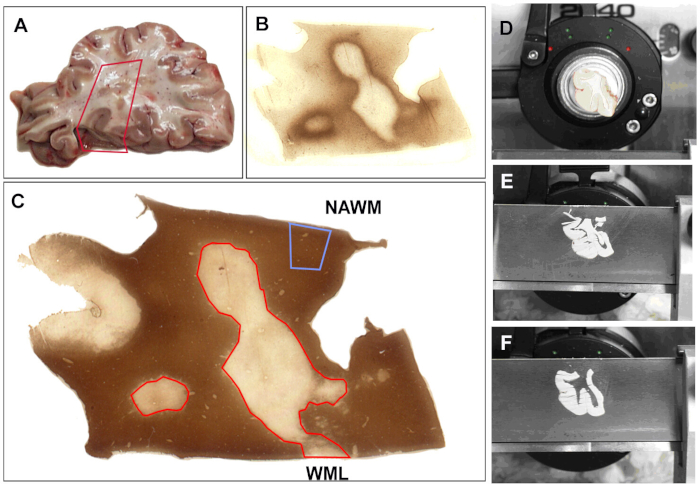
Figura 1: coleta de amostra para análise de mRNA. (A) o tecido da autópsia é selecionado para a análise. Áreas de tecido são selecionadas e uma porção de tecido é extirpada. Todas as seções são manchadas com (B) o anticorpo de MHC-II (complexo principal do histocompatibilidade (MHC) classe II HLA-DR CR3/43) para detectar a atividade inflamatório e com (C) a proteína do proteolipid (PLP) para determinar o status do mielina usando protocolos publicados. Com base no status de mielina, o bloco é marcado por um bisturi (D). As secções (60 μm) são cortadas (e) e as áreas que foram previamente marcadas são removidas, separadas em tubos e rotuladas (F). As manchas de PLP e de MHC-II são repetidas após cada 5 seções para assegurar a coleção apropriada do tecido. A matéria branca aparecendo normal (NAWM) é anotada e as lesões da matéria branca (WML) são esboçadas no vermelho. Por favor clique aqui para ver uma versão maior desta figura.
Transecção axonal nas lesões de MS10. Um foco científico inicial deste programa foi sobre a caracterização de componentes celulares de lesões de matéria branca desmiyelinated. Entre os antígenos localizados estavam os neurofilamentos não fosforilados (NFs). A maioria dos NFs são fosforilados em axônios mielinizadas. Após a desmielinização, os axônios são dephosphorylated. Detectamos a expressão esperada de NFs não fosforilado em axônios desmiyelinados. Em lesões agudas de SM, muitos desses axônios desmielados terminaram como bulbos de retração axonal (Figura 2a), que refletem as extremidades proximais dos axônios transected. Os axônios transected excedem 11.000 milímetros3 nas lesões agudas comparadas às regiões normais adjacentes10. Essas observações ajudaram a catalisar uma mudança de paradigma na pesquisa em MS que moveu o campo para caracterizar a neurodegeneração como a principal causa de incapacidade neurológica permanente em indivíduos com SM.
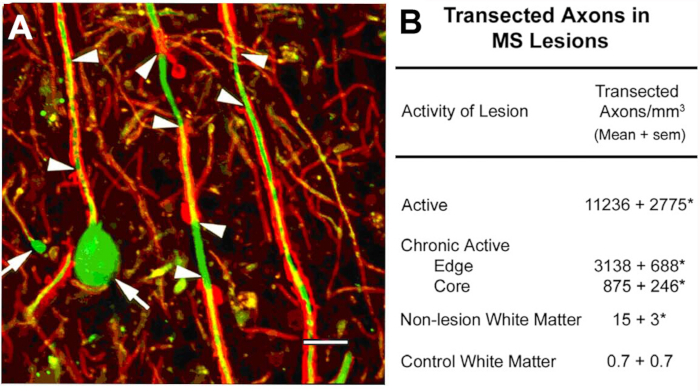
Figura 2: transecção axonal durante a desmielinização inflamatória. A transecção axonal ocorre durante a desmielinização inflamatória (a, pontas de seta) e induz a formação de ovoides axonais terminais (a, setas). Quando quantificados (B), os axônios transected são abundantes em lesões de MS e parecem correlacionar-se com a atividade inflamatória da lesão. Painel A reproduzido de Trapp et al.10 com permissão. Vermelho: proteolipid proteína, verde: anti nonphosphorylated Neurofilamento. Por favor clique aqui para ver uma versão maior desta figura.
Remyelination em cérebros crônicos do MS3. A remielinização pode ser robusta durante os estágios iniciais da SM. Muitas lesões crônicas do MS, entretanto, não são remyelinated. Nós investigamos se a presença de pilhas do progenitor do oligodendrocyte (OPCS) ou a geração de oligodendrócitos novos limita o remielinização de lesões cronicamente demyelinated da branco-matéria. Quando a densidade do OPC foi diminuída frequentemente, estiveram atuais em todas as lesões cronicamente-demyelinated3. Oligodendrócitos recentemente-gerados estava igualmente atual em muitas lesões crônicas do MS. Os processos oligodendrocyte associaram, mas não mieliniam os axônios demyelinated (Figura 3). Estes estudos indicam que os OPCS e sua habilidade de produzir oligodendrócitos novos não são limitar o remielinização de lesões crônicas da branco-matéria. Nós supor que os axônios cronicamente-demyelinated, que apareceram frequentemente distróficos, não eram receptivos ao remielinização por oligodendrocytes recentemente-produzidos.
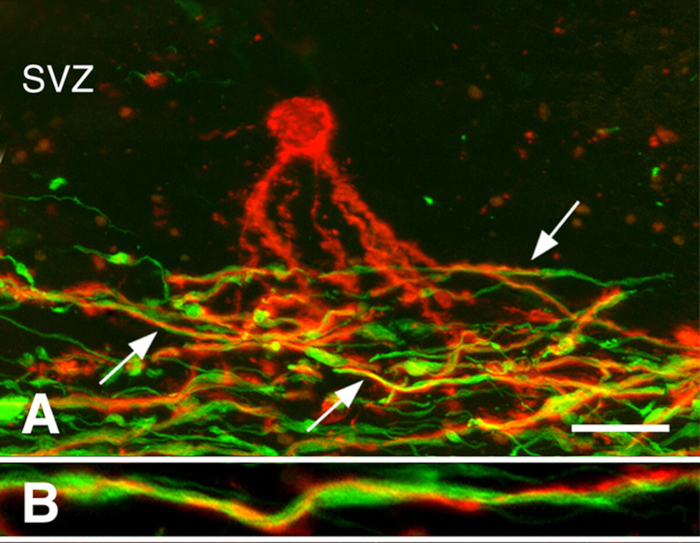
Figura 3: processos de oligodendrócitos pré-mielinantes associados a axônios. Os micrografias confocal das lesões do MS manchadas com os anticorpos de PLP (vermelho nos painéis a, b) e os anticorpos de Neurofilamento (verde nos painéis a, b) são mostrados. Um oligodendrocyte pre-myelinating (vermelho no painel a) na zona zona (SVZ) estendeu processos na região de axônios demyelinated (verde no painel a) em uma lesão crônica do MS. Muitos desses processos (setas no painel A) espiralados em torno de axônios, como mostrado em maior ampliação (painel B). As barras de escala representam 20 μm (A) e 5 μm (B). Reproduzido a partir de Chang et al.3 com permissão. Por favor clique aqui para ver uma versão maior desta figura.
Disfunção mitocondrial em MS6. Nós executamos uma busca imparcial para mudanças neuronal do gene no córtice de motor ràpida-congelado obtido dos pacientes crônicos do MS (figura 4a). Uma pesquisa imparcial deste conjunto de dados identificou reduções significativas em 23 mRNAs mitocondrial com codificação nuclear em SM (Figura 4B). Os estudos de credenciamento utilizando imunocioquímica e hibridação in situ indicaram que esses genes foram altamente enriquecidos em neurônios de projeção cortical (Figura 4C) e que as mitocôndrias isoladas dos axônios de projeção apresentam redução da glicólise ( Figura 4D). Este papel catalítico um foco na deficiência orgânica mitochondrial e reduziu a produção do ATP como um contribuinte principal à degeneração axonal no MS.
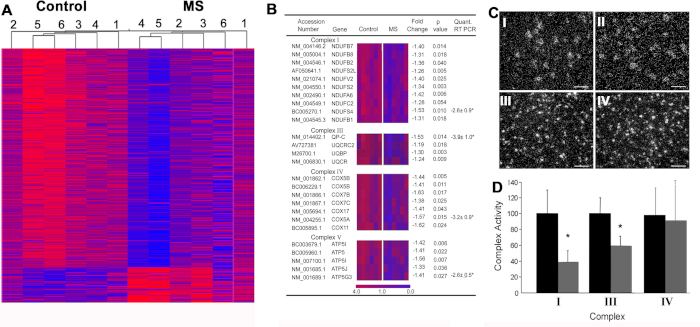
Figura 4: dados de Microarray e técnicas de validação a jusante realizadas no córtex motor MS. (A) agrupamento hierárquico de transcrições significativamente alteradas de amostras de córtex motor de controle (C1-C6) e SPMS (MS1-MS6), apoiando separadamente padrões de expressão gênica relacionados à doença. Entre as transcrições diminuídas no córtex motor MS, vinte e seis pertenciam à cadeia de transporte de elétrons (B). O complexo mitochondrial I (NDUFA6) mRNA foi diminuído nos neurônios (n = 55-130) no córtice de motor do MS (CII) comparado ao controle (CI), visto que as densidades de PLP mRNA eram similares entre o córtice cerebral do controle (CIII) e do MS (CIV). A atividade dos complexos de transporte de elétrons I e III foi diminuída em frações enriquecidas por mitocondrial do córtex motor de pacientes com SM (n = 3) (D). Reimpresso de Dutta et al.6 com permissão. Barras de erro representam SEM; A barra de escala em CI-IV é 25 μm. * p < 0, 5 teste tde estudantes. Por favor clique aqui para ver uma versão maior desta figura.
Patogénese da deficiência orgânica cognitiva em MS8. 40 a 60% dos pacientes com SM têm declínio cognitivo e função executiva reduzida. Nós identificamos o hipocampo, que é um local funcional da memória/aprendizagem, como um local comum para o demyelination em MS. Nós comparou em seguida a expressão de gene neuronal em hipocampo myelinated e demyelinated e encontrou reduções significativas em proteínas de codificação dos mRNAs neuronal envolvidas na memória/aprendizagem. Nós estendemos estes dados demonstrando que os microRNAs seleto estão aumentados no hipocampo demyelinated e que estes microRNAs podem diminuir a expressão de receptores do glutamato. Reproduzimos e ampliamos essas observações em modelos de roedores. Nós comparamos em seguida a expressão de gene neuronal em hipocampo myelinated e demyelinated e encontramos reduções significativas no mRNA neuronal que codifica proteínas envolvidas na memória/aprendizagem.
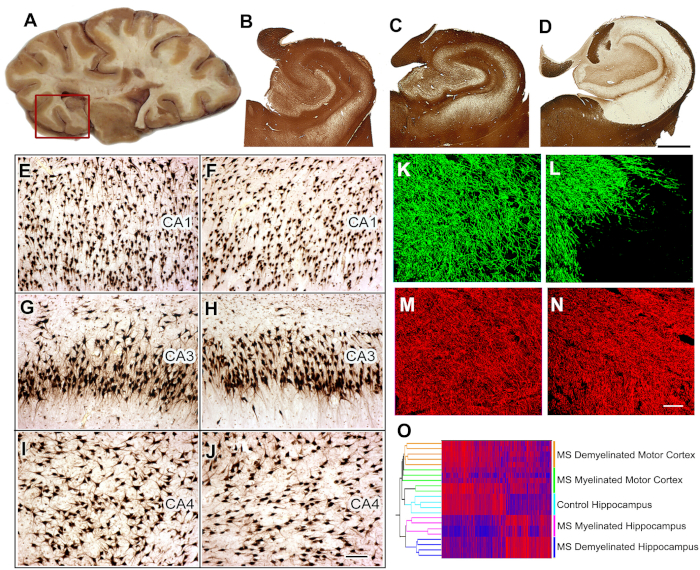
Figura 5: coleta de tecido, análise histológica e estudos de expressão gênica em hipocampo de MS. As fatias do cérebro que contêm o hipocampo são selecionadas durante a autópsia (a) e o hipocampo e a região adjacente são removidos (caixa vermelha) para uma análise mais adicional. A imunocoloração para PLP mostrou preservação da mielina em todos os controles (B) e 40% dos HIPOCAMPI de MS (C). O demyelination extensivo foi detectado em ~ 60% de MS hipocampo (D). Quando comparado ao controle dos hipocampi (E, G, I), a perda neuronal significativa não foi detectada em CA1, em CA4, ou em regiões de HIPOCAMPI Demyelinated do MS (F, H, J) como mostrado por HuR immunohistochemistry. A imunofluorescência da dobro-rotulagem para o mielina (proteína básica do mielina (MBP), verde) e os axônios (SMI32, vermelhos) mostraram a perda de mielina (L) com preservação relativa dos axônios (N) no hipocampo demyelinated do MS comparado ao hipocampo do controle ( MBP, K; SMI32, M). O agrupamento duplo de níveis da expressão de mRNA arranjou amostras em conjuntos discretos baseados no status do mielina (myelinated e demyelinated) e na posição (Hippocampus contraOcórtice do motor) (O). Altos níveis de mRNA são indicados por vermelho e azul denota baixos níveis de expressão. Painéis C-O adaptado de Dutta et al.8 com permissão. B-D: 2 mm, E-J: 100 μm, K-N: 50 μm. por favor clique aqui para ver uma versão maior desta figura.
Os correlatos patológicos de MRI mudam12. Quando MRI for um indicador avaliado do diagnóstico e da resposta do MS ao tratamento, e é igualmente um preditor da progressão da doença do MS, os correlacionados patológicos de mudanças de MRI são compreendidos mal. Nossos estudos pós-morte de MRI focalizaram em dois MRI ROIs. ROIs da matéria branca cerebral que eram somente T2 hyperintense (T2 somente) e ROIs que tiveram uma combinação do hypointensity T1, do hyperintensity do T2, e da relação reduzida da transferência da magnetização (MTR) (T2T1MTR). Aproximadamente 45% dos ROIs de T2-only de matéria branca cerebral foram mielinizadas, confirmando sua natureza não específica. Em contraste, 83% dos T2T1MTR ROIs foram cronicamente desmielados e apareceram como buracos negros. Os valores de T1 e MTR são semiquantitativos e seus valores variaram extensivamente nos T2T1MTR ROIs. Se a perda do mielina é o único contribuinte a estas mudanças de MRI, a seguir os valores devem ser constantes. Os axônios demyelinated inchados correlacionaram com os valores T1 e MTR.
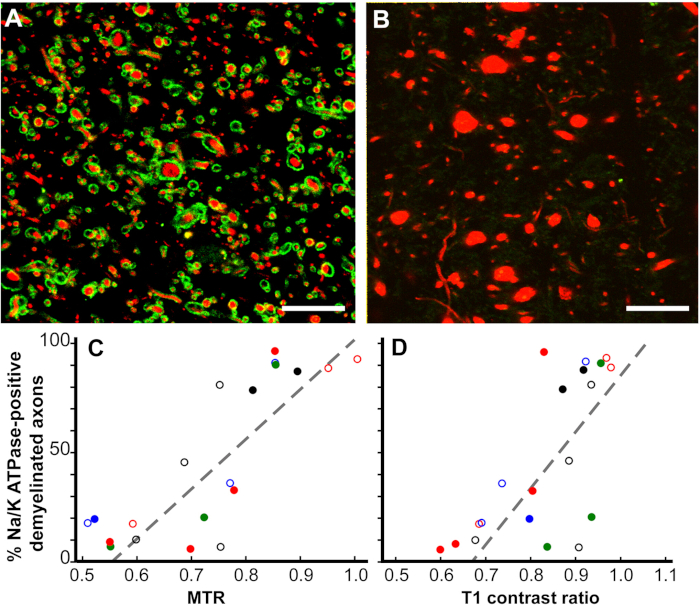
Figura 6: as proporções de transferência de magnetização (MTR) e as proporções de contraste T1 linearmente correlacionam-se com a percentagem de axônios na+/K+ ATPase-positive em lesões crônicas de SM. As lesões cronicamente-demyelinated manchadas para na+/K+ ATPase (verde) variaram de quase 100% (a) a zero (B) no Neurofilamento (vermelho). Muitos axônios sem na+/K+ ATPase apresentaram diâmetros aumentados (B). Uma comparação do percentual de na+/K+ ATPase-positivo AXÔNIOS em lesões de MS cronicamente desmiyelinated correlacionou-se com as proporções quantitativas pós-morte de MTR (p < 0, 1, C) e T1 (p < 0, 6, D). Cada ponto de dados é de uma única lesão e cada combinação de símbolo de cor única denota um dos cérebros estudados. Barras de escalas = 5 μm. reproduzido de Young et al.12 com permissão. Por favor clique aqui para ver uma versão maior desta figura.
Neurodegeneração independente de desmielinização11. Historicamente, a neurodegeneração em MS tem sido pensado para resultar de desmielinização. Os estudos da imagem latente de cérebro, entretanto, levantaram a possibilidade que o neurodegeneração e o demyelination podem ser eventos independentes. Nós identificamos recentemente uma subpopulação de pacientes do MS que têm o demyelination da medula espinal e do córtice cerebral, mas não da matéria branca cerebral. Nós cunhamos este SubType do MS como o MS myelocortical (MCMS). Os casos de MCMS forneceram uma plataforma para investigar a relação entre o demyelination cerebral da branco-matéria e a perda neuronal cortical. Comparado aos córtices do controle, a perda neuronal cortical era significativamente maior em córtices de MCMS do que em córtices típicos do MS. O tecido cerebral de controle foi obtido do departamento de patologia da Cleveland Clinic. Este estudo fornece a primeira evidência patológica para o neurodegeneração na ausência de demyelination.
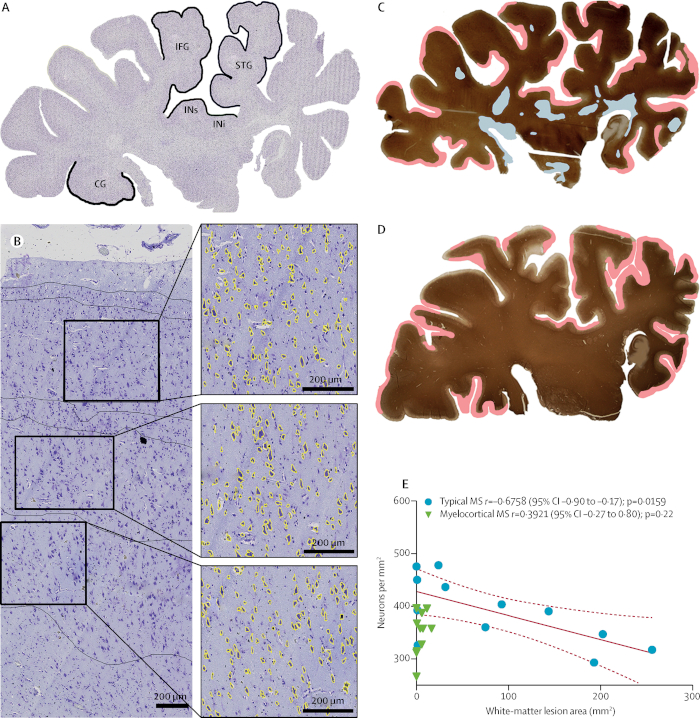
Figura 7: perda neuronal na ausência de desmielinização cerebral de matéria branca. Uma seção hemisférica coronal cresil violeta-manchada de um indivíduo classificado como tendo o MS típico (A). As densidades neuronal foram comparadas nas camadas corticais III, V e VI em cada uma das cinco áreas rotuladas. Os neurônios com uma área superior a 60 μm2 (amarelo) são mostrados em uma imagem representativa do córtex temporal superior (B). A rotulagem para o PLP e a distribuição de lesões desmielinizadas (descoloração de matéria branca é destacada em azul; a desmielinização subpial é destacada em rosa) em secções hemisféricas de indivíduos com MS (C) e mielocortical MS (D ) são mostrados. Uma correlação significativa entre A densidade neuronal cortical reduzida e o volume cerebral aumentado da lesão da branco-matéria foi encontrada em MS típico, mas não no MS myelocortical (E); linhas tracejadas indicam 95% de intervalo de confiança (IC). IFG = giro frontal inferior. STG = giro temporal superior. INi = Insula inferior. INs = Insula superior. CG = giro cingulado. Reproduzido a partir de Trapp et al.11 com permissão. Por favor clique aqui para ver uma versão maior desta figura.
| Duração da sequência | Descrição da sequência | Uso de sequência |
| 0:09 | Localizer | Localização para sequências subsequentes |
| 9:14 | Magnetização 3D preparou o eco rápido do inclinação (MPRAGE) | Imagem estrutural estimativa volumétrica de estruturas cerebrais |
| 5:14 | recuperação de inversão atenuada do fluido 3D (FLAIR) | Identificação da lesão segmentação lesão avaliação volumétrica da lesão |
| 2:35 | 2D T2 ponderada | Identificação da lesão segmentação lesão avaliação volumétrica da lesão |
| 5:12 | 3D gradiente-lembrou Echo com transferência de magnetização pre-Pulse, (MT-ON) | Medida purported do índice do mielina no tecido aparecendo e lesional normal |
| 5:12 | 3D gradiente-lembrou Echo sem magnetização transferência pre-Pulse, (MT-OFF) | |
| 0:27 | Mapeamento de campo de imagem de tensor de difusão (DTI) | Medida da difusão da água no tecido cerebral pensado para refletir a integridade do tecido cerebral. |
| 10:27 | Multi-escudo da imagem latente do tensor da difusão (DTI) | |
| 1:18 | Multi-escudo da imagem latente do tensor da difusão (DTI) | |
| 39:48:00 | SUBTOTAL: NÚCLEO |
Tabela 1: protocolo de imagem pós-morte.
Discussão
Nós descrevemos um protocolo que seja usado para rapidamente adquirir e processar o tecido de sobre 150 indivíduos com MS. Uma característica importante deste protocolo é que os cientistas que utilizam o tecido também estão encarregados de estabelecer o protocolo e realizar a coleta de tecido. Isso proporciona flexibilidade para atender às necessidades científicas de projetos de pesquisa individuais. Vários aspectos deste protocolo aumentam sua utilidade. Os pacientes geralmente são bem caracterizados antes da morte, pois muitos deles foram seguidos por neurologistas em nosso centro. Um passo crítico é o processamento de doações de tecidos logo após a morte, o que aumenta a qualidade do tecido congelado em comparação com alguns outros bancos cerebrais. Isto permite que os estudos moleculars que são do grande valor em descrever mudanças em produtos transcricional e translacional do gene, que são essenciais para o fundamentação de observações histológicas e Immunocytochemical. O aproveitamento de dados morfológicos/imunociquímicos e moleculares em vários casos aumenta a confiabilidade das conclusões. Isto é ilustrado melhor por nossa descrição de mudanças mitochondrial do gene no córtice cerebral e em mudanças neuronal do gene em hippocampi demyelinated. Os protocolos novos do perfilamento do gene estão sendo desenvolvidos em uma taxa rápida e o tecido congelado em nosso banco deve fornecer o RNA de alta qualidade para a análise do tecido e da único-pilha.
Outro aspecto valorizado do nosso protocolo é o curto-corrigido fatias cerebrais. Estes tecidos são cortados em 30 μm-grossos, seções Free-Floating. Estas seções são ideais para usar a microscopia confocal para analisar dois ou mais antígenos em três dimensões. Os bons exemplos incluem a interação de processos pre-myelinating do oligodendrocyte com axônios distróficos em lesões crônicas do MS, assim como a identificação de únicas conexões axonal aos bulbos de retração axonal transected. Isso está em contraste com o uso rotineiro de seções de parafina de 7 μm de espessura, onde as imagens 3D não são viáveis. Os tecidos embebidos em parafina têm grande valor para algumas questões, especialmente a quantificação de densidades neuronais em seções hemisféricas de 7 μm de espessura. Nossos protocolos de processamento de tecidos, portanto, são diversificados e proporcionam flexibilidade para assegurar tecidos fixos e rapidamente congelados.
Uma outra característica original de nosso protocolo é o cérebro in situ pós-morte MRI. Os MRIs cerebrais são um biomarcador insubstituível da doença de MS. É essencial, conseqüentemente, estabelecer os correlacionados patológicos de sinais anormais de MRI. Nossos estudos estabeleceram que ambos os T2 somente e T2T1MTR ROIs são frequentemente myelinated. Este achado suporta a necessidade de modalidades de imagem mais específicas que diferenciam confiantemente entre a matéria branca cerebral mielinated e demyelinated. MRI parece ser sensível para a deteção do myelin, mas nossos estudos demonstram que mesmo uma combinação de T1/T2/MTR não é específica para identificar o myelination. Nosso protocolo pós-morte fornece uma plataforma ideal para testar a habilidade de novas modalidades de imagem para distinguir entre a matéria branca cerebral mielinated e demyelinated. MRI igualmente fornece o veículo ideal para a tradução de resultados básicos da ciência na prática clínica, dado o uso de MRI em nossa pesquisa translacional e em seu uso clínico generalizado em pacientes vivos.
Enquanto o corte de curto e longo-fixo, bem como fatias congeladas oferece uma vantagem para o processamento de tecido em vários modos para diferentes estudos, existem algumas limitações com este método. Avaliar a totalidade de uma estrutura pode ser limitada, pois partes dele podem ser processadas de forma diferente em fatias adjacentes. O grande volume do banco de tecidos, no entanto, oferece a capacidade de investigar uma estrutura de interesse em vários assuntos para melhorar a amostragem. Outra limitação geral aos estudos que utilizam tecidos pós-morte é que são transversais. As conclusões relativas ao calendário e à progressão das alterações devem ser interpretadas dentro deste contexto. Pode haver um viés de seleção para pacientes que doam seus tecidos, o que pode limitar a generalização dos dados a todos os pacientes com SM. Desde que a maioria de doadores morrem das complicações de MS avançado, não pode ser apropriado extrapolar resultados destes pacientes àqueles em estágios mais adiantados de MS. No entanto, recebemos tecidos de pacientes mais jovens que morreram de condições não relacionadas ao MS (ou seja, infarto agudo do miocárdio, overdose de drogas, suicídio). O escopo do nosso protocolo não inclui amostragem de outros órgãos (por exemplo, gastrointestinais e medula óssea) que foram implicados na SM. Acreditamos que os pontos fortes do programa superam muito suas limitações.
Divulgações
Os autores não declaram conflitos de interesse.
Agradecimentos
Os autores também gostariam de agradecer ao Dr. Christopher Nelson pela assistência editorial. O programa de autópsia é apoiado em parte por R35 conceder NS097303 a BDT. O trabalho no laboratório de RD é apoiado por subvenções da NINDS (NS096148) e da sociedade nacional de esclerose múltipla, EUA (RG 5298).
Materiais
| Name | Company | Catalog Number | Comments |
| Antibodies | |||
| Biotinylated goat anti-mouse IgG | Vector Laboratories | BA-9200 | 1:500 dilution for hemispheric; 1:1,000 for 30µm free-floating. RRID: AB_2336171 |
| Biotinylated goat anti-rabbit IgG | Vector Laboratories | BA-1000 | 1:500 dilution. |
| Biotinylated goat anti-rat IgG | Vector Laboratories | BA-9400 | 1:500 dilution for hemispheric; 1:1,000 for 30µm free-floating. RRID: AB_2336208 |
| Glial fibrillary acid protein (GFAP) | Dako | Z0334 | 1:700 dilution for hemispheric. RRID: AB_10013382 |
| HuR, mouse IgG, 3A2 clone | Santa Cruz | SC-5261 | 1:500 for 30µm free floating. RRID: AB_627770 |
| Major histocompatibility complex (MHC) class II HLA-DR CR3/43 | Dako | Mo746 | 1:250 dilution for hemispheric; 1:500 for 30 µm free floating. RRID: AB_2313661 |
| Non-phosphorylated neurofilament (SMI32) | Biolegend | 801701 | 1:5,000 dilution for hemispheric; 1:2,500 for 30 µm free-floating. RRID: AB_2564642 |
| Phosphorylated neurofilament (SMI31) | Biolegend | 801601 | 1:5,000 dilution for hemispheric; 1:2,500 for 30 µm free-floating. RRID: AB_2564641 |
| Proteolipid protein (PLP) | Gift from Wendy Macklin | 1:250 dilution for IHC; alternative anti-PLP antibodies commercially available. | |
| Reagents | |||
| 125 mm filter paper | Whatman | 1452-125 | For filtering PFA. |
| 50% Glutaraldehyde | Electron Microscopy Sciences | 16320 | Electron microscopy grade. |
| Cytoseal | ThermoScientific | 8310-16 | |
| Ethylene glycol | Fisher Chemical | BP230-4 | |
| Glycerol | Sigma-Aldrich | G7893 | 400 mL/2 L Cryoprotection solution. |
| Millex-HV Syringe Filter Unit, 0.45 µm, PVDF, 33 mm, gamma sterilized | Millipore-Sigma | SLHV033RB | |
| Paraformaldehyde | Electron Microscopy Sciences | 19200 | Prills form. |
| Polyvinylpyrolidone (PVP-40) | Fisher Chemical | BP220-212 | |
| Sodium azide | Fisher Chemical | S227I | 2 g/2 L Sorenson's buffer. |
| Sodium phosphate dibasic | Sigma-Aldrich | S0876 | 98.8 g/2 L Sorenson's buffer. |
| Sodium phosphate mono basic monohydrate | Sigma-Aldrich | S9638 | 14.352 g/2 L Sorenson's buffer. |
| Sucrose | Sigma-Aldrich | PVP40-500G | |
| VectaStain ABC Kit | Vector Laboratories | PK-6100 | 1:1,000 dilution of A and B. RRID: AB_2336819 |
| Waterproof drawing black ink | Higgins | 44201 | |
| Xylene | Fisher Chemical | X3S | Histological grade. |
| Equipment | |||
| 3T MRI Magnetom Prisma | Siemens Healthineers | ||
| 7T MRI Agilent 830AS | Siemens Healthineers |
Referências
- Trapp, B. D., Nave, K. A. Multiple sclerosis: an immune or neurodegenerative disorder?. Annual Review of Neuroscience. 31, 247-269 (2008).
- Chang, A., Nishiyama, A., Peterson, J., Prineas, J., Trapp, B. D. NG2-positive oligodendrocyte progenitor cells in adult human brain and multiple sclerosis lesions. Journal of Neuroscience. 20, 6404-6412 (2000).
- Chang, A., Tourtellotte, W. W., Rudick, R., Trapp, B. D. Premyelinating oligodendrocytes in chronic lesions of multiple sclerosis. New England Journal of Medicine. 346, 165-173 (2002).
- Chang, A., et al. Neurogenesis in the chronic lesions of multiple sclerosis. Brain. 131, 2366-2375 (2008).
- Chang, A., et al. Cortical remyelination: A new target for repair therapies in multiple sclerosis. Annals of Neurology. 72, 918-926 (2012).
- Dutta, R., et al. Mitochondrial dysfunction as a cause of axonal degeneration in multiple sclerosis patients. Annals of Neurology. 59, 478-489 (2006).
- Dutta, R., et al. Activation of the ciliary neurotrophic factor (CNTF) signalling pathway in cortical neurons of multiple sclerosis patients. Brain. 130, 2566-2576 (2007).
- Dutta, R., et al. Demyelination causes synaptic alterations in hippocampi from multiple sclerosis patients. Annals of Neurology. 69, 445-454 (2011).
- Dutta, R., et al. Hippocampal demyelination and memory dysfunction are associated with increased levels of the neuronal microRNA miR-124 and reduced AMPA receptors. Annals of Neurology. 73, 637-645 (2013).
- Trapp, B. D., et al. Axonal transection in the lesions of multiple sclerosis. New England Journal of Medicine. 338, 278-285 (1998).
- Trapp, B. D., et al. Cortical neuronal densities and cerebral white matter demyelination in multiple sclerosis: a retrospective study. Lancet Neurology. 17, 870-884 (2018).
- Young, E. A., et al. Imaging correlates of decreased axonal Na+/K+ ATPase in chronic multiple sclerosis lesions. Annals of Neurology. 63, 428-435 (2008).
- Fisher, E., et al. Imaging correlates of axonal swelling in chronic multiple sclerosis brains. Annals of Neurology. 62, 219-228 (2007).
- Moll, N. M., et al. Imaging correlates of leukocyte accumulation and CXCR4/CXCL12 in multiple sclerosis. Archieves of Neurology. 66, 44-53 (2009).
- Moll, N. M., et al. Multiple sclerosis normal-appearing white matter: pathology-imaging correlations. Annals of Neurology. 70, 764-773 (2011).
- Nakamura, K., Chen, J. T., Ontaneda, D., Fox, R. J., Trapp, B. D. T1-/T2-weighted ratio differs in demyelinated cortex in multiple sclerosis. Annals of Neurology. 82, 635-639 (2017).
- Chen, J. T., et al. Clinically feasible MTR is sensitive to cortical demyelination in MS. Neurology. 80, 246-252 (2013).
- Nakamura, K., Fox, R., Fisher, E. CLADA: cortical longitudinal atrophy detection algorithm. Neuroimage. 54, 278-289 (2011).
- Sled, J. G., Zijdenbos, A. P., Evans, A. C. A nonparametric method for automatic correction of intensity nonuniformity in MRI data. IEEE Transactions of Medical imaging. 17, 87-97 (1998).
- Fisher, E., Cothren, J. R. M., Tkach, J. A., Masaryk, T. J., Cornhill, J. F. Knowledge-based 3D segmentation of the brain in MR images for quantitative multiple sclerosis lesion tracking. Proc. SPIE 3034, Medical Imaging. , 19-25 (1997).
- Avants, B. B., Epstein, C. L., Grossman, M., Gee, J. C. Symmetric diffeomorphic image registration with cross-correlation: evaluating automated labeling of elderly and neurodegenerative brain. Medical Image Analysis. 12, 26-41 (2008).
- Jenkinson, M., Bannister, P., Brady, M., Smith, S. Improved optimization for the robust and accurate linear registration and motion correction of brain images. Neuroimage. 17, 825-841 (2002).
- Lewis, D. A. The human brain revisited: opportunities and challenges in postmortem studies of psychiatric disorders. Neuropsychopharmacology. 26, 143-154 (2002).
- Chomyk, A. M., et al. DNA methylation in demyelinated multiple sclerosis hippocampus. Scientific Reports. 7, 8696 (2017).
- Huynh, J. L., et al. Epigenome-wide differences in pathology-free regions of multiple sclerosis brains. Nature Neuroscience. , (2014).
- Ishii, A., et al. Human myelin proteome and comparative analysis with mouse myelin. Proceedings of the National Academy of Sciences. U. S. A. 106, 14605-14610 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados