É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Functionalization dos Cantialavancos do microscópio da força atômica com únicas-células de T ou único-partícula para a espectroscopia imunológica da força da único-pilha
Neste Artigo
Resumo
Nós apresentamos um protocolo para funcionalizar cantialavancas do microscópio de força atômica (AFM) com uma única pilha de T e partícula do grânulo para estudos imunológicos. Os procedimentos para sondar a ligação Cell-dendritic do único-par célula T por AFM e monitorar a resposta celular em tempo real dos macrófagos a uma única partícula contínua pelo AFM com imagem latente da fluorescência são mostrados.
Resumo
A microscopia de força atômica baseou a espectroscopia da força da única pilha (AFM-SCFS) é uma ferramenta poderosa para estudar Propriedades biofísicas de pilhas vivas. Esta técnica permite a sondagem de pontos fortes e dinâmicas de interação em uma membrana celular viva, incluindo aquelas entre células, receptores e ligantes, e ao lado de muitas outras variações. Igualmente trabalha como um mecanismo para entregar um estímulo físico ou bioquímico em únicas pilhas em uma maneira spatiotemporally controlada, assim permitindo a ativação específica da pilha e os eventos celulares subseqüentes a ser monitorados no tempo real quando combinados com a viver-pilha imagem latente da fluorescência. O passo chave nessas medições AFM-SCFS é a funcionalização do AFM-cantilever, ou seja, anexar um assunto de interesse ao cantilever. Aqui, nós apresentamos métodos para modificar cantialavancas de AFM com uma única pilha de T e um único grânulo do poliestireno respectivamente para estudos imunológicos. O primeiro envolve uma colagem biocompatível que acopla únicas pilhas de T à ponta de um cantilever liso em uma solução, quando o último depender em uma colagem da cola Epoxy para a única aderência do grânulo no ambiente do ar. Duas aplicações imunológicas associadas a cada modificação do cantilever são fornecidas também. Os métodos descritos aqui podem ser facilmente adaptados a diferentes tipos de células e partículas sólidas.
Introdução
A microscopia da força atômica (AFM), uma ferramenta versátil, encontrou muitas aplicações na pesquisa da biologia da pilha1,2,3,4,5. Aparte de sua capacidade de imagem latente de alta resolução, a característica da força-sondagem nativa permite que as propriedades biofísicas de pilhas vivas sejam investigadas diretamente in situ no nível da único-pilha6,7. Estes incluem a rigidez de estruturas subcelulares ou mesmo células inteiras8,9,10,11,12, ligante específico/receptor de forças de ligação no nível de molécula única na superfície celular13, e forças de aderência entre pares de partículas sólidas e células ou entre duas células1,2,14,15. Os dois últimos são frequentemente categorizados como espectroscopia de força de célula única (SCFS)16. Devido aos cantialavancos prontamente disponíveis com vária mola constante, a escala da força acessível a AFM é rather larga de alguns piconewtons (pN) aos micronewtons (μN), que cobre adequadamente a escala inteira de eventos celulares que envolvem forças de algumas dezenas de pN, como ligação de molécula única baseada em receptores, a nN, como eventos celulares fagocíticos15. Esta grande escala dinâmica da força faz AFM vantajoso sobre outras técnicas da forçar-sondagem tais como pinças óticos/magnéticos e uma ponta de prova da força do biomembrana, porque são mais apropriadas para medidas da fraco-força, com força tipicamente menos do que 200 PN17 , 18. Além disso, AFM pode funcionar como um manipulador de alta precisão para entregar vários estímulos em células individuais em uma forma espaciotemporalmente definida4,19. Isso é desejável para os estudos de ativação de célula única em tempo real. Combinada com a imagem latente da fluorescência da vivo-pilha, a resposta celular subseqüente ao estímulo específico pode ser monitorada simultaneamente, assim fazendo o SCFS AFM-baseado excessivamente robusto como a imagem latente ótica que fornece uma ferramenta prática para sondar a sinalização celular. Por exemplo, AFM foi utilizado para determinar as cepas necessárias para provocar transientes de cálcio em osteoblastos20. Neste trabalho, os transientes do cálcio foram controlados cDNAs com a imagem latente ratiométrica do cálcio após a aplicação de forças localizadas em osteoblastos cultivados com uma ponta de AFM. Recentemente, AFM foi empregado para esticar as fibrilas do colagénio em que as pilhas stellate hepatic (HSC) estiveram crescidas e esta ativação mechano-transaculada de HSC era tempo real monitorado por um biosensor fluorescente do src, cuja o fosforilação como representado pelo a intensidade da fluorescência do biosensor é correlacionada com a ativação de HSC3.
Em experimentos SCFS baseados em AFM, a funcionalização adequada de cantimanhas AFM é um passo fundamental para medições bem-sucedidas. Desde que nosso interesse da pesquisa centra-se sobre a ativação das pilhas imunes, nós funcionamos rotineiramente cantialavancas com matérias particuladas tais como únicas partículas contínuas que podem provocar o fagocitose e/ou respostas imunes fortes4,14 , 15 e células T únicas que podem formar uma sinapse imune com células apresentadoras de antígeno, como células dendríticas ativadas (DC)2. As únicas partículas contínuas são acopladas normalmente a um cantilever através de uma colagem da cola Epoxy no ambiente do ar, visto que as únicas pilhas de T, devido a sua natureza não-adesiva, são funcionalizadas a um cantilever através de uma colagem biocompatível na solução. Aqui, descrevemos os métodos para executar esses dois tipos de modificação cantilever e dar duas aplicações associadas também. A primeira aplicação é sondar interações de T Cell/DC com AFM-SCFS para compreender o mecanismo supressor de células T reguladoras do ponto de vista da mecânica celular. O segundo envolve a combinação de AFM com a imagem latente da fluorescência da vivo-pilha para monitorar a resposta celular do macrófago a uma partícula contínua no tempo real para revelar o mecanismo molecular do fosfatidilinositol receptor-independente 4, 5-bisphosphate (PIP2)- Moesin mediou a fagocitose. O objetivo deste protocolo é fornecer um quadro de referência para que pesquisadores interessados projetem e implementem seus próprios parâmetros experimentais com análise de células simples baseadas em AFM para pesquisa imunológica.
Protocolo
O protocolo da experimentação do rato segue as directrizes do cuidado animal da Universidade de Tsinghua
1. funcionalização do cantilever com únicas pilhas de T
- Preparação das pilhas do spleen do rato
- Sacrifique o rato (8-16 semanas de idade (ou sexo); por exemplo, C57BL/6 estirpe) utilizando dióxido de carbono, seguido de luxação cervical.
- Limpe o rato com 75% de etanol e faça uma incisão cutânea de linha média seguida de esplenectomia.
- Homogeneizar o baço em 4 mL de PBS contendo 2% de soro bovino fetal (FBS) usando lâminas de vidro e remover agregados e detritos, passando a suspensão celular através de um filtro de nylon de malha de 70 μm.
- Centrifugue a suspensão celular em 500 x g por 5 min, descarte o sobrenadante e reressuscitem as células em 2 ml de tampão de lise de glóbulos vermelhos (equilibrado à temperatura ambiente) por 5 min. termine a reação de Lise adicionando 8 ml de solução de PBS.
- Centrifugue a suspensão celular a 500 x g durante 5 min e reressuscitem as células com uma densidade de 1 x 108 células/ml em PBS contendo 2% de FBS e 1 mm de EDTA (rotulados como solução a), tipicamente 0,25-2 ml, dependendo da densidade celular. Transfira as células ressuscipended para um tubo de poliestireno redondo de 5 mL (12 x 75 mm).
- Preparação das pilhas de T do rato CD4 +
- Adicionar 50 μL/mL de soro de rato (ver tabela de materiais) e 50 μL/ml de um cocktail de isolamento de células T CD4 + (ver tabela de materiais) à amostra de células obtida a partir do passo 1.1.5. Misture e incubar por 10 min à temperatura ambiente.
- Vórtice a solução de partícula magnética revestida com streptavidina (ver tabela de materiais) por 30 s ou até que as partículas apareçam uniformemente dispersas.
- Adicionar 75 μL/mL de partículas magnéticas revestidas com streptavidina à amostra de células. Misture e incubar por 2,5 min à temperatura ambiente.
- Adicione a solução a para cima da amostra de célula para 2,5 mL e misture suavemente com pipetagem para cima e para baixo por 2-3 vezes.
- Coloque o tubo de amostra (sem tampa) no íman (ver tabela de materiais) e incubar durante 5 min à temperatura ambiente. Despeje cuidadosamente a suspensão de células enriquecidas em um novo tubo de poliestireno redondo de 5 mL.
- Centrifugue a suspensão da pilha em 500 x g por 5 min. descarte o sobrenadante e reressuscite as células T enriquecidas em 500 ΜL de solução a.
Nota: as células T CD4 + enriquecidas contêm células T convencionais e regulamentares.
- Separação das células t regulatórias das células T convencionais
- Adicionar 25 μL de bloqueador de FcR (ver tabela de materiais) à amostra de células T enriquecida obtida a partir do passo 1.2.6. Misture e incubar por 5 min à temperatura ambiente.
- Adicionar 25 μL de cocktail de seleção positiva de célula T regulamentar (ver tabela de materiais) à amostra de célula t. Misture e incubar por 10 min à temperatura ambiente.
- Adicionar 10 μL de cocktail de seleção PE (ver tabela de materiais) à amostra de célula T. Misture e incubar por 5 min à temperatura ambiente.
- Vórtice a solução de partículas magnéticas revestida com Dextran (ver tabela de materiais) por 30 s ou até que as partículas apareçam uniformemente dispersas.
- Adicionar 10 μL de partículas magnéticas revestidas de Dextran à amostra de célula T. Misture e incubar por 5 min à temperatura ambiente.
- Adicione a solução a para cima da amostra de célula T para 2,5 mL e misture suavemente com pipetagem para cima e para baixo por 2-3 vezes.
- Coloque o tubo de amostra da célula T (sem tampa) no íman e incubar durante 5 min à temperatura ambiente. Despeje cuidadosamente o sobrenadante para um novo tubo.
Nota: o sobrenadante contém as células T CD4 + convencionais enriquecidas. - Centrifugue as células T CD4 + convencionais enriquecidas a 500 x g durante 5 min. descarte o sobrenadante e reressuscite as células em 4 ml de RPMI1640 contendo 10% de fbs, 0, 5 mm β-Mercaptoetanol, 0, 1 M de HEPES e 1% de penicilina/estreptomicina (rotulados como meio B).
- Retire o tubo em que as células T reguladoras são enriquecidas a partir do íman. Adicionar 2,5 mL de solução a ao tubo e misturar suavemente com pipetagem para cima e para baixo durante 2-3 vezes. Coloque o tubo de volta no ímã, incubar por 5 min, e depois despeje com cuidado e descarte o sobrenadante. Repita este passo mais três vezes.
- Ressuscitar as células T reguladoras enriquecidas em 2 mL de meio B.
- Incubar as células T convencionais purificadas e as células T reguladoras com 100 U/mL hIL-2 durante a noite ou por pelo menos 4 h a 37 ° c em uma incubadora humidificada com 5% de CO2 antes de ser utilizada para a funcionalização do cantilever.
- Preparação de células dendríticas
- Prepare a solução de piranha, uma mistura de 30% H2O2 (30%) e 70% H2so4 (conc) (v/v). Despeje lentamente 3 mL de H2O2 em 7 ml de h2para4 em constante agitação e resfriamento.
Cuidado: a solução de piranha é altamente corrosiva, e pode queimar e destruir os tecidos do corpo. Portanto, é mais seguro usar a solução de piranha um capô e usar equipamentos de segurança adequados, pois a mistura irá espirrar em torno do béquer. Neutralize a solução com NaOH a pH 7 após o uso. - Mergulhe a lamínula de vidro de 24 mm de diâmetro na solução de piranha por 30 min e enxague completamente depois com a água ultrapura estéril.
- Mergulhe um par de pinças pontiagudas em 75% de etanol por 30 min para desinfecção a frio.
- Introduza as coberturas de vidro limpas em uma placa de cultura de 6 poços pela pinça.
- Incline um prato de cultura plástica de 6 cm em que as células DC 2.4 foram pré-cultivadas com 4 mL de meio B e aspiram todo o meio. Adicionar 2 mL de PBS no prato de cultura para enxaguar as células DC 2.4 e descartar PBS. Repita este passo de enxaguadela mais duas vezes.
- Adicionar 1 mL de 0,25% de tripsina EDTA ao prato de cultura durante 2 min. Adicione 1 mL de B médio a este prato para terminar a reacção de digestão da enzima. Transfira a suspensão de células digeridas para um tubo de 15 mL.
- Centrifugue a suspensão da pilha em 500 x g por 5 minutos e ressuscitem as pilhas da c.c. 2.4 em uma densidade de 2 x 105 Cells/ml no meio B.
- As células DC 2.4 das sementes nas coberturas de vidro preparadas na etapa 1.4.4 e incubar as células durante a noite em uma câmara humidificada a 37 ° c com 5% CO2.
Nota: a fim medir forças de interação entre duas únicas pilhas, uma concentração relativamente baixa de pilhas da C.C. 2.4 (isto é, < 10% confluency) é necessário ter um afastamento apropriado entre pilhas.
- Prepare a solução de piranha, uma mistura de 30% H2O2 (30%) e 70% H2so4 (conc) (v/v). Despeje lentamente 3 mL de H2O2 em 7 ml de h2para4 em constante agitação e resfriamento.
- Preparação para cantilever AFM
Nota: os Cantialavancos que são apropriados para experimentos de espectroscopia de força de célula única são aqueles com constantes de baixa mola, tipicamente na faixa de 0,01-0,06 N/m. Aqui, os cantialavancos macios da ponta-menos são preferidos para únicas pilhas e única funcionalização das partículas contínuas.- Limpe as cantialavancas por piranha tratamento ou plasma ou UV-ozônio limpeza.
- Monte o cantilever limpo na cabeça de digitalização AFM.
- Prepare uma câmara limpa da amostra enchida com a água pura e calibre o cantilever na solução da água primeiramente executando uma curva da força no substrato de vidro para obter a sensibilidade (a inclinação do ajuste linear sobre a parte repulsiva da curva de aproximação) e então gravação de um espectro de ruído térmico para extrair a constante de mola de acordo com o manual de instruções do AFM.
- Retire a cabeça de digitalização AFM da solução, lave o cantilever montado com algumas gotas de etanol puro, e mantenha o cantilever seco na cabeça de digitalização.
- Anexando células T únicas ao cantilever
- Pré-aqueça o invólucro do ambiente de células vivas com 5% de CO2 a 37 ° c.
- Monte o lamela de vidro com as pilhas da c.c. 2.4 crescidas nela da etapa 1.4.8 a um conjunto da câmara da amostra, adicione 600 μl do meio B à câmara imediatamente, e põr então o conjunto sobre o estágio da amostra de AFM.
- Adicionar hIL-2 células T CD4 + incubadas (células T convencionais ou regulamentares) na câmara da amostra.
Nota: o volume total da amostra não deve exceder 1 mL. - Aguarde até que as células T CD4 + adicionadas sejam totalmente liquidadas na parte inferior da lamínula.
Nota: bolhas de ar vai causar grande perturbação para o experimento, portanto, é aconselhável evitar quaisquer bolhas de ar na etapa 1.6.2 e 1.6.3. - Adicione uma gota de 2 μL de cola biocompatível na extremidade do cantilever montado com uma pipeta como mostrado na Figura 1 e, em seguida, coloque a cabeça de digitalização na fase da amostra rapidamente, permitindo assim que o cantilever revestido com a cola biocompatível mergulhe no Solução.
Atenção: não toque no bloco de vidro ou no cantilever com a ponta da pipeta. Desde que a colagem biocompatível usada aqui é propensa à oxidação no ar, esta etapa deve ser feita o mais rapidamente possível. - Localize uma célula T saudável a ponta do cantilever grosseiramente o microscópio, movendo o estágio de amostra e, em seguida, ajuste finamente o posicionamento movendo a cabeça de digitalização.
Nota: uma célula T CD4 + saudável normalmente tem um tamanho relativamente grande, bordas lisas e opticamente transmissiva na imagem de campo brilhante. - Abaixe o cantilever manualmente com passo-tamanhos que partem de 50 μm então a 10, a 5, a 2 e a 0,5 μm gradualmente controlando os motores deslizantes. Segure a posição dos motores de passo e ajuste o posicionamento da cabeça de digitalização para melhor alinhamento entre a ponta do cantilever e a célula, uma vez que o cantilever faz um contato firme com a célula T alvo como indicado por um pequeno deslocamento do feixe de laser posição no fotodetector correspondente a uma faixa de força típica de 0,5-1,5 nN.
Nota: esta etapa também pode ser feita executando uma medida de força única em que Set-Point (a força aplicada à célula) e tempo de contato pode ser bem definido no software. Entretanto, devido à natureza não-adesiva de pilhas de T, a aproximação manual fornece mais flexibilidade em controlar apontar, posicionar, e o tempo de contato do que faz a aproximação automática e trabalha confiantemente para a adesão da pilha de T. Futuros experimentalistas devem tentar tanto o manual e automático se aproximando para descobrir o que funciona melhor para seus sistemas de interesse. - Retrair o cantilever após 30 s de contato.
Observação: se a célula se move com o cantilever, o anexo é bem-sucedido. Se não, repita a etapa 1.6.6 mas em uma célula T diferente. A cola biocompatível é facilmente oxidado. Step 1.6.5-1.6.7 deve ser concluída dentro de 5 min. Além, se o mesmo cantilever falha três vezes para o acessório da pilha de T, um cantilever novo deve ser usado, e o procedimento do acessório deve começar da etapa 1.5.2 outra vez.
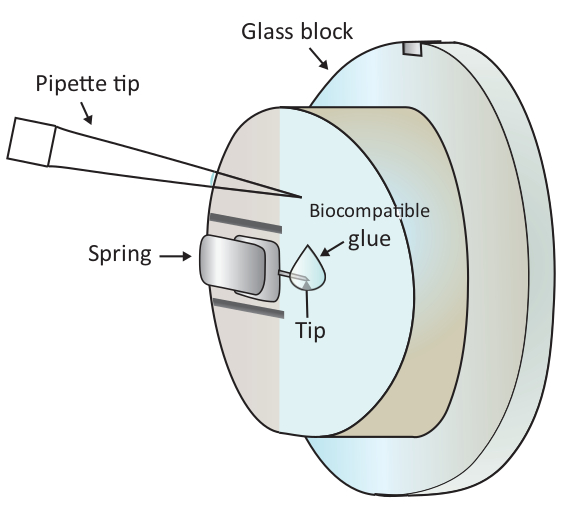
Figura 1: representação esquemática da adição de uma pequena gota de cola biocompatível no cantilever montado. O cantilever é montado através de uma mola de aperto no suporte do vidro-bloco que é instalado na cabeça da exploração AFM (não desenhada aqui). Quando a cabeça de digitalização está em uma superfície nivelada, o cantilever é orientado verticalmente como mostrado no desenho. Cerca de 2 μL de cola biocompatível podem ser adicionados à ponta do cantilever com uma micropipeta. Por favor clique aqui para ver uma versão maior desta figura.
- Espectroscopia de força de célula T de par único/interação dendrítica de células
Nota: para sondar interações da pilha/pilha, um AFM com um Z-escala maior do que o μm 10-15 convencional é exigido a fim separar inteiramente as duas pilhas. O AFM usado aqui tem um Z-escala de 100 μm, que é adequado separar a pilha de T da pilha dendríticas após o contato da pilha/pilha.- Posicione a célula T anexada acima de uma célula DC 2.4 separada movendo o estágio de amostra e/ou a cabeça de digitalização (veja a Figura 2).
- Definir parâmetros adequados e executar espectroscopia de força.
Nota: as seguintes definições de chave são normalmente utilizadas: SetPoint 0,5 nN, puxando o comprimento 50 μm, movimento Z velocidade constante, estender velocidade 5 μm/s, tempo de contato 10 s, modo de atraso força constante. Para cada par T-DC, são coletadas 20 repetições de curvas de força e um mínimo de 14 curvas de força são usadas para análise posterior. - Monte um novo cantilever limpo, calibrá-lo em água pura como no passo 1.5.3, e voltar para a mesma amostra de células T-DC para repetir a etapa 1,6 e 1,7 para um par de T-DC diferente. Sonda pelo menos 5 pares para cada condição.
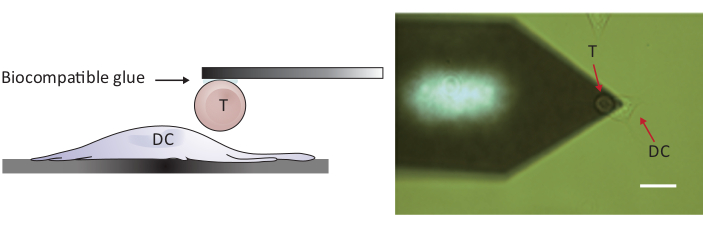
Figura 2: configuração experimental da força-sondagem entre uma única célula T e DC. (A) desenho esquemático da configuração experimental na qual uma célula T anexada ao cantilever é trazida para um DC cultivado no substrato para sondagem de força. (B) imagem de campo brilhante de um cantilever de célula T funcionalizada e um DC. Barra de escala, 20 μm. por favor clique aqui para ver uma versão maior desta figura.
2. funcionalização cantilever com grânulos de poliestireno único
- Única preparação dos grânulos
- Diluir a suspensão de estoque de grânulos de poliestireno de 6 μm em etanol a 100%.
Nota: a concentração da solução de grânulos diluídos deve ser suficientemente baixa para que, quando adicionada a uma superfície de lamínula de vidro, as contas individuais sejam bem separadas sem aglomeração significativa após a evaporação do solvente. - Limpe a cobertura de vidro de 24 mm de diâmetro com etanol e remova qualquer poeira pelo fluxo de ar N2 .
- Monte o lamela de vidro limpado a um conjunto da câmara da amostra e põr o conjunto sobre o microscópio.
- Põr uma gota da solução diluída dos grânulos ao lado esquerdo mas perto do centro da lamínula (veja Figura 3) e verific o afastamento entre os grânulos após a evaporação solvente no brilhante-campo o microscópio com um objetivo 20x. Avance para o passo seguinte se as contas individuais estiverem bem separadas.
- Mergulhe uma ponta de micropipeta ou um palito em uma cola epóxi bem misturado e, em seguida, transfira uma pequena quantidade de tal colagem para três pontos separados com sucessivos toques suaves no lado direito, mas perto do centro da lamínula.
Nota: os três pontos de colagem devem ser alinhados verticalmente (veja a Figura 3). O último ponto com a menor quantidade de cola será usado mais tarde.
- Diluir a suspensão de estoque de grânulos de poliestireno de 6 μm em etanol a 100%.
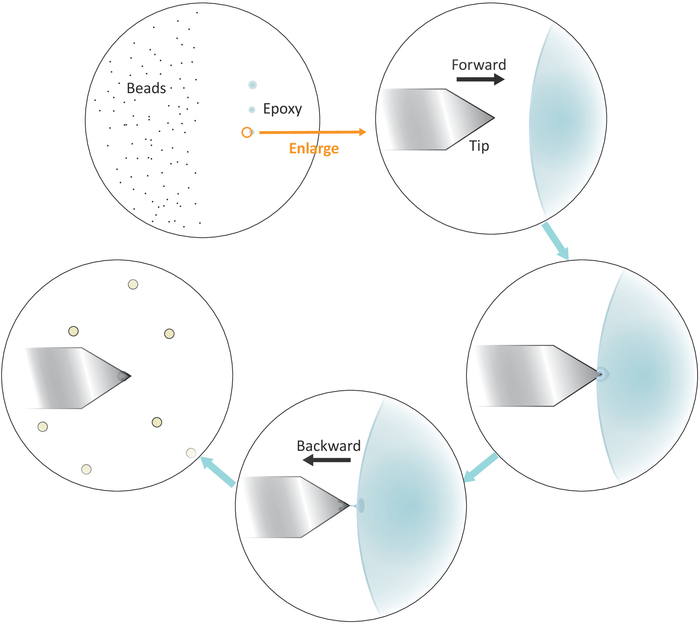
Figura 3: representação esquemática do fluxo de trabalho para a funcionalização de grânulos simples no cantilever. Os grânulos Micron-feitos medida bem separados são preparados no lado esquerdo da carcaça e uma quantidade minúscula de colagem da cola Epoxy é transferida no lado direito da carcaça com 3 toques suaves sucessivos, tendo por resultado 3 pontos da colagem. Apenas o último ponto com a menor quantidade de cola (indicado por um círculo) é usado para revestir a extremidade do cantilever. Aproxime o cantilever na colagem da esquerda e mova então o cantilever para trás uma vez que é imergido na colagem para confinam a colagem na extremidade muito do cantilever. Traga o talão alvo embaixo do cantilever e alinhe-os corretamente antes de fazer um contato firme (tipicamente 2-5 nN) para a aderência do cordão. Quando o cordão é funcionalizado com sucesso no cantilever, um novo cantilever pode ser montado para iniciar um novo ciclo de funcionalização. Por favor clique aqui para ver uma versão maior desta figura.
- Preparação para cantilever AFM
- Monte um cantilever limpo da ponta-menos à cabeça da exploração de AFM.
- Calibre este cantilever no ar com uma superfície limpa para obter a constante da mola.
- Anexando grânulos simples ao cantilever
- Posicione a ponta do cantilever sobre o limite esquerdo do último ponto de cola epóxi, como mostrado na Figura 3.
- Traga o cantilever perto da colagem lentamente abaixando os motores deslizantes com tamanhos pequenos da etapa.
- Puxe o cantilever afastado rapidamente da cola lateralmente, movendo a cabeça de digitalização AFM para trás (para a esquerda) manualmente uma vez que a ponta é imersa na cola.
Nota: Certifique-se de que apenas uma pequena quantidade da cola adere ao final da ponta. Se houver cola excessiva na ponta, é possível reduzir a quantidade de cola tocando seguido deslizando a ponta em uma superfície vazia. - Mova a ponta do cantilever sobre uma única pérola bem isolada.
- Aproxime o cantilever ao único grânulo lentamente e faça um contato firme com o grânulo (como indicado pelo deslocamento da posição do feixe de laser no fotodetector que corresponde a uma escala de força típica de 2-5 NN) por aproximadamente 10 s durante que um ajuste fino do t IP de posicionamento lateralmente vai ajudar a localizar melhor o talão no final da ponta. Retraia a ponta no final do contato.
Nota: o desaparecimento do talão muito do plano focal original indica um evento aderente bem-sucedido. - Demount o cantilever grânulo-modificado com cuidado e armazene-o em uma caixa do cantilever durante a noite para a solidificação cheia da colagem.
- Imagem latente da fluorescência da resposta celular do macrófago a um único grânulo entregado por AFM.
Nota: a imagem latente da fluorescência foi executada em um objetivo-tipo Home-feito microscópio de fluorescência interno total da reflexão baseado em um carrinho comercial do microscópio. Este sistema da imagem latente é equipado com as 4 fontes do laser (405 nanômetro, 488 nanômetro, 561 nanômetro, 647 nanômetro), um visor do divisor para a deteção da dois-cor, e um elétron que multiplica o dispositivo acoplado carga (EMCCD) para a imagem latente do largo-campo- Cresça pilhas 264.7 cruas em um lamela de vidro em 37 ° c em uma câmara umidificada de 5% co2 .
- Transfect Moesin-EGFP e PLCδ-PH-mCherry às pilhas 264.7 cruas usando um jogo do transfection (veja a tabela de materiais) como por o protocolo do fabricante para visualizar fluoresin e fosfatidylinositol 4, 5-BIFOSFATO (PIP2) moléculas Respectivamente.
Nota: Moesin tem um motivo ITAM que pode ativar SYK, um jogador chave na fagocitose. PIP2 é conhecido por recrutar Moesin para a membrana celular. - Coloque a lamínula de vidro com células em um conjunto de câmara de amostra e monte o conjunto na fase de amostra AFM.
- Monte o cantilever modificado por talão na cabeça de digitalização AFM.
- Execute uma curva de força em uma área vazia e calibre a força com a sensibilidade desta curva e a constante de mola medida na etapa 2.2.2.
- Encontre uma célula bem isolada com intensidades de fluorescência apropriadas em canais de verde (Moesin-EGFP) e vermelho (PLCδ-PH-mCherry) com excitações de 488/561 nm.
- Entregue o grânulo despido do poliestireno de 6 μm com AFM à superfície da pilha com 1 força constante do nN e tempo de contato de 500 s.
- Grave a série da imagem da fluorescência da pilha no contato com o grânulo para a análise (tipicamente 10 frames/s).
Nota: para reduzir o fotobranqueamento dos fluoróforos, uma potência de excitação relativamente baixa deve ser utilizada para procurar as células de interesse. Além, um esquema intermitente da excitação pode ser empregado para prolongar os traços do tempo da fluorescência se a dinâmica de respostas da pilha estiver em uma escala do tempo lento.
Resultados
A figura 4a mostra curvas de força-distância típicas da interação de ligação entre a célula single-T e o single-DC em um ciclo de retração de abordagem. A curva vermelha clara é a curva da extensão e o vermelho escuro um é a curva da retração. Desde que a curva da extensão é usada tipicamente para o recuo ou a rigidez-análise, aqui somente a curva da retração é concernida para a adesão da pilha. O valor mínimo (o círculo verde) na curv...
Discussão
A espectroscopia da força da único-pilha baseada em AFM evoluiu para ser uma ferramenta poderosa para endereçar as propriedades biofísicas de pilhas vivas. Para essas aplicações, o cantilever precisa ser funcionalizada corretamente, a fim de sondar interações específicas ou propriedades sobre as células de interesse. Aqui, os métodos para acoplando a única pilha de T e a única grânulo Micron-feitos medida ao modilhão Tip-less são descritos respectivamente. Para prender uma única pilha de T ao cantilever,...
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Este trabalho é apoiado pela Fundação Nacional de ciências naturais do programa geral da China (31370878), programa de chave estatal (31630023) e programa de grupo de pesquisa inovadora (81621002).
Materiais
| Name | Company | Catalog Number | Comments |
| Material | |||
| 10 μl pipette tip | Thermo Fisher | 104-Q | |
| 15 ml tube | Corning | 430791 | |
| 6 cm diameter culture dish | NALGENE nunc | 150462 | |
| 6-well culture plate | JET | TCP011006 | |
| AFM Cantilever | NanoWorld | Arrow-TL1-50 | tipless cantilever |
| β-Mercaptoethanol | Sigma | 7604 | |
| Biocompatible glue | BD Cell-Tak | 354240 | |
| CD4+ T cell isolation Cocktail | STEMCELL | 19852C.1 | |
| DC2.4 cell line | A gift from K. Rock (University of Massachusetts Medical School, Worcester, MA) | ||
| Dextran-coated magnetic particles | STEMCELL | SV30010 | |
| EDTA | GENEray | Generay-E1101-500 ml | |
| Epoxy | ERGO | 7100 | |
| Ethanol | twbio | 00019 | |
| FBS | Ex Cell Bio | FSP500 | |
| FcR blocker | STEMCELL | 18731 | |
| Glass coverslip | local vender (Hai Men Lian Sheng) | HX-E37 | 24mm diameter, 0.17mm thinckness |
| Glass slides | JinTong department of laboratory and equipment management, Haimen | N/A | customized |
| H2O2 (30%) | Sino pharm | 10011218 | |
| H2SO4 | Sino pharm | 80120892 | |
| HEPES | Sigma | 51558 | |
| Magnet | STEMCELL | 18000 | |
| Mesh nylon strainer | BD Falcon | REF 352350 | |
| Moesin-EGFP | N/A | cloned in laboratory | |
| Mouse CD25 Treg cell positive isolation kit | STEMCELL | 18782 | Component: FcR Blocker,Regulatory T cell Positive Selection Cocktail, PE Selection Cocktail, Dextran RapidSpheres, |
| Mouse CD4+ Tcell isolation kit | STEMCELL | 19852 | Component:CD4+T cell isolation Cocktail, Streptavidin RapidSpheres, Rat Serum |
| NaOH | Lanyi chemical products co., LTD? Beijing | 1310-73-2 | |
| PBS | Solarbio | P1022-500 | |
| PE selection cocktail | STEMCELL | 18151 | |
| Penicillin-Streptomycin | Hyclone | SV30010 | |
| PLCδ-PH-mCherry | Addgene | 36075 | |
| Polystyrene microspheres 6.0μm | Polysciences | 07312-5 | |
| polystyrene round bottom tube | BD Falcon | 352054 | |
| Rat serum | STEMCELL | 13551 | |
| RAW264.7 | ATCC | ||
| Recombinant Human Interleukin-2 | Peprotech | Peprotech, 200-02-1000 | |
| Red blood cell lysis buffer | Beyotime | C3702 | |
| Regulatory T cell positive selection cocktail | STEMCELL | 18782C | |
| RPMI 1640 | Life | C11875500BT | |
| Sample chamber | Home made | ||
| Streptavidin-coated magnetic particles | STEMCELL | 50001 | |
| Transfection kit | Clontech | 631318 | |
| Trypsin 0.25% EDTA | Life | 25200114 | |
| Tweezers | JD | N/A | |
| Name | Company | Catalog Number | Comments |
| Equipment | |||
| 20x objective NA 0.8 | Zeiss | 420650-9901 | Plan-Apochromat |
| Atomic force microscope | JPK | cellHesion200 | |
| Centrifuge | Beckman coulter | Allegra X-12R | |
| Fluorescence imaging | home-made objective-type total internal reflection fluorescence microscop based on a Zeiss microscope stand | ||
| Humidified CO2 incubator | Thermo Fisher | HERACELL 150i | |
| Inverted light microscope | Zeiss | Observer A1 manual |
Referências
- Benoit, M., Gabriel, D., Gerisch, G., Gaub, H. E. Discrete interactions in cell adhesion measured by single-molecule force spectroscopy. Nature Cell Biology. 2 (6), 313-317 (2000).
- Chen, J., et al. Strong adhesion by regulatory T cells induces dendritic cell cytoskeletal polarization and contact-dependent lethargy. Journal of Experimental Medicine. 214 (2), 327-338 (2017).
- Liu, L., et al. Mechanotransduction-modulated fibrotic microniches reveal the contribution of angiogenesis in liver fibrosis. Nature Materials. 16 (12), 1252-1261 (2017).
- Mu, L. B., et al. A phosphatidylinositol 4,5-bisphosphate redistribution-based sensing mechanism initiates a phagocytosis programing. Nature Communications. 9, (2018).
- Qi, C., et al. Pathology-targeted cell delivery via injectable micro-scaffold capsule mediated by endogenous TGase. Biomaterials. 126, 1-9 (2017).
- Muller, D. J., Helenius, J., Alsteens, D., Dufrene, Y. F. Force probing surfaces of living cells to molecular resolution. Nature Chemical Biology. 5 (6), 383-390 (2009).
- Muller, D. J., Dufrene, Y. F. Atomic force microscopy: a nanoscopic window on the cell surface. Trends in Cell Biology. 21 (8), 461-469 (2011).
- Radotic, K., et al. Atomic force microscopy stiffness tomography on living Arabidopsis thaliana cells reveals the mechanical properties of surface and deep cell-wall layers during growth. Biophysics Journal. 103 (3), 386-394 (2012).
- Kuznetsova, T. G., Starodubtseva, M. N., Yegorenkov, N. I., Chizhik, S. A., Zhdanov, R. I. Atomic force microscopy probing of cell elasticity. Micron. 38 (8), 824-833 (2007).
- Scheuring, S., Dufrene, Y. F. Atomic force microscopy: probing the spatial organization, interactions and elasticity of microbial cell envelopes at molecular resolution. Molecular Microbiology. 75 (6), 1327-1336 (2010).
- Berdyyeva, T. K., Woodworth, C. D., Sokolov, I. Human epithelial cells increase their rigidity with ageing in vitro: direct measurements. Physics in Medicine and Biology. 50 (1), 81-92 (2005).
- Sokolov, I., Dokukin, M. E., Guz, N. V. Method for quantitative measurements of the elastic modulus of biological cells in AFM indentation experiments. Methods. 60 (2), 202-213 (2013).
- Bozna, B. L., et al. Binding strength and dynamics of invariant natural killer cell T cell receptor/CD1d-glycosphingolipid interaction on living cells by single molecule force spectroscopy. Journal of Biological Chemistry. 286 (18), 15973-15979 (2011).
- Flach, T. L., et al. Alum interaction with dendritic cell membrane lipids is essential for its adjuvanticity. Nature Medicine. 17 (4), 479-487 (2011).
- Ng, G., et al. Receptor-independent, direct membrane binding leads to cell-surface lipid sorting and Syk kinase activation in dendritic cells. Immunity. 29 (5), 807-818 (2008).
- Helenius, J., Heisenberg, C. P., Gaub, H. E., Muller, D. J. Single-cell force spectroscopy. Journal of Cell Science. 121 (11), 1785-1791 (2008).
- Litvinov, R. I., Shuman, H., Bennett, J. S., Weisel, J. W. Binding strength and activation state of single fibrinogen-integrin pairs on living cells. Proceedings of the National Academy of Sciences of the United States of America. 99 (11), 7426-7431 (2002).
- Evans, E., Ritchie, K., Merkel, R. Sensitive Force Technique to Probe Molecular Adhesion and Structural Linkages at Biological Interfaces. Biophysics Journal. 68 (6), 2580-2587 (1995).
- Lamprecht, C., Hinterdorfer, P., Ebner, A. Applications of biosensing atomic force microscopy in monitoring drug and nanoparticle delivery. Expert Opinion on Drug Delivery. 11 (8), 1237-1253 (2014).
- Charras, G. T., Horton, M. A. Single cell mechanotransduction and its modulation analyzed by atomic force microscope indentation. Biophysics Journal. 82 (6), 2970-2981 (2002).
- Sun, M. Z., et al. Multiple membrane tethers probed by atomic force microscopy. Biophysics Journal. 89 (6), 4320-4329 (2005).
- Yan, J. C., Liu, B., Shi, Y., Qi, H. Class II MHC-independent suppressive adhesion of dendritic cells by regulatory T cells in vivo. Journal of Experimental Medicine. 214 (2), 319-326 (2017).
- Hao, J. J., et al. Phospholipase C-mediated hydrolysis of PIP2 releases ERM proteins from lymphocyte membrane. Journal of Cell Biology. 184 (3), 451-462 (2009).
- Rodriguez, R. M., et al. Lymphocyte-T Adhesion to Fibronectin (Fn) - a Possible Mechanism for T-Cell Accumulation in the Rheumatoid Joint. Clinical and Experimental Immunology. 89 (3), 439-445 (1992).
- Kimura, A., Ersson, B. Activation of Lymphocytes-T by Lectins and Carbohydrate-Oxidizing Reagents Viewed as an Immunological Recognition of Cell-Surface Modifications Seen in the Context of Self Major Histocompatibility Complex Antigens. European Journal of Immunology. 11 (6), 475-483 (1981).
- Miller, K. The Stimulation of Human Lymphocyte-B and Lymphocyte-T by Various Lectins. Immunobiology. 165 (2), 132-146 (1983).
- Vitte, J., Pierres, A., Benoliel, A. M., Bongrand, P. Direct quantification of the modulation of interaction between cell- or surface-bound LFA-1 and ICAM-1. Journal of Leukocyte Biology. 76 (3), 594-602 (2004).
- Beaussart, A., et al. Quantifying the forces guiding microbial cell adhesion using single-cell force spectroscopy. Nature Protocols. 9 (5), 1049-1055 (2014).
- Shu, F., et al. Cholesterol Crystal-Mediated Inflammation Is Driven by Plasma Membrane Destabilization. Frontiers in Immunology. 9, (2018).
- Hosseini, B. H., et al. Immune synapse formation determines interaction forces between T cells and antigen-presenting cells measured by atomic force microscopy. Proceedings of the National Academy of Sciences of the United States of America. 106 (42), 17852-17857 (2009).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados