Method Article
Métodos funcionais e fisiológicos de avaliação da regeneração do nervo mediano no rato
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Apresenta-se um protocolo para produzir diferentes tipos de lesões nervosas medianas (MN) e reparar no rato. Além disso, o protocolo mostra como avaliar a recuperação funcional do nervo utilizando vários testes comportamentais não invasivos e medidas fisiológicas.
Resumo
O principal objetivo desta investigação é mostrar como criar e reparar diferentes tipos de lesões nervosas medianas (MN) no rato. Além disso, são apresentados diferentes métodos de simulação da fisioterapia pós-operatória. Múltiplas estratégias padronizadas são utilizadas para avaliar a recuperação motora e sensorial utilizando um modelo MN de lesão e reparação do nervo periférico, permitindo assim fácil comparação dos resultados. Várias opções estão incluídas para fornecer um ambiente de fisioterapia pós-operatória para ratos que sofreram lesões de MN. Por fim, o artigo fornece um método para avaliar a recuperação do MN utilizando vários testes não invasivos (ou seja, teste de apreensão, teste de picada de pino, teste de caminhada de escada, teste de subida de corda e análise de pista de caminhada) e medidas fisiológicas (termografia infravermelha, eletroeuromiografia, avaliação de força de flexão e determinação do peso muscular flexor carpi radialis). Assim, esse modelo parece particularmente apropriado para replicar um cenário clínico, facilitando a extrapolação dos resultados para a espécie humana.
Embora o nervo ciático seja o nervo mais estudado na pesquisa do nervo periférico, a análise do rato MN apresenta várias vantagens. Por exemplo, há uma incidência reduzida de contraturas articulares e automutilação do membro afetado em estudos de lesão de MN. Além disso, o MN não é coberto por massas musculares, tornando sua dissecção mais fácil do que a do nervo ciático. Além disso, a recuperação de MN é observada mais cedo, porque o MN é mais curto que o nervo ciático. Além disso, o MN tem um caminho paralelo para o nervo ulnar no braço. Assim, o nervo ulnar pode ser facilmente usado como enxerto nervoso para reparar lesões de MN. Finalmente, o MN em ratos está localizado no membro dianteiro, semelhante ao membro superior humano; em humanos, o membro superior é o local da maioria das lesões nervosas periféricas.
Introdução
Lesões nervosas periféricas ocorrem regularmente como resultado de trauma, infecção, vasculite, autoimunidade, malignidade e/ou radioterapia1,2. Infelizmente, o reparo do nervo periférico continua a apresentar resultados clinicamente imprevisíveis e frequentemente decepcionantes3,4. Há um consenso generalizado de que ainda é necessária uma pesquisa básica e translacional considerável para melhorar a perspectiva dos afetados4,5,6,7.
O rato MN apresenta grandes semelhanças com o dos seres humanos8,9 (Figura 1). Originário do plexo braquial na região axilar, este nervo desce para o aspecto medial do braço, atingindo o cotovelo, e ramificando-se para a maioria dos músculos no compartimento ventral do antebraço. O MN alcança a mão, onde inerva os músculos tenar e os dois primeiros músculos lumbrical, bem como parte da pele da mão do rato9 (Figura 1).
Utilizando o rato MN, é possível replicar adequadamente lesões nervosas periféricas em humanos10,,11,12. Este nervo tem várias vantagens potenciais de pesquisa em relação ao nervo ciático habitualmente usado. Como o MN está localizado no membro dianteiro dos ratos (semelhante aos membros superiores humanos), ele pode ser danificado experimentalmente com um impacto muito menor no bem-estar do rato, em comparação com o nervo ciático, que inerva uma porção substancial do membro pélvico13. Além disso, em humanos a maioria das lesões clínicas ocorre no membro superior, que corresponde ao membro dianteiro do rato10,,11,12,14,15,16.
Este artigo mostra como produzir diferentes tipos de lesões de MN no rato. Além disso, são apresentadas diferentes formas de simular fisioterapia pós-operatória. Por fim, são descritos testes para avaliar a recuperação funcional do MN. Existem múltiplas estratégias padronizadas disponíveis para avaliar a recuperação motora e sensorial utilizando um modelo MN de lesão e reparação do nervo periférico, permitindo assim uma fácil comparação dos resultados. O modelo MN é particularmente adequado para replicar o cenário clínico, facilitando a extrapolação dos resultados para a espécie humana.
Protocolo
Todos os procedimentos envolvendo animais foram aprovados pelo Comitê institucional de Cuidados e Uso de Animais e Comitê de Ética da Faculdade de Medicina da Universidade Nova, lisboa, Portugal (08/2012/CEFCM).
1. Cirurgia nervosa mediana
NOTA: Siga a técnica asséptica durante a cirurgia. Use instrumentos de proteção individual (EPI) e use um vestido cirúrgico estéril17. Autoclave todos os instrumentos cirúrgicos necessários antes da cirurgia (ver a Tabela de Materiais).
- Use ratos Wistar de 12 semanas. Forneça-lhes comida e água ad libitum com ciclos de 12 h de luz-escura 7 dias antes da cirurgia. Antes da anestesia, pesar o rato para determinar a quantidade de anestésico necessária.
- Anestesiar o rato com uma injeção intraperitoneal de uma mistura de cetamina (40-80 mg/kg de peso corporal) e xilazina (5-10 mg/kg de peso corporal). Verifique a profundidade da anestesia pela falta de resposta a um pinça do dedo do dedo e observando a taxa de respiração durante todo o procedimento18,19. Fornecer analgesia adicional se uma taxa respiratória acima de 110 ciclos/min ou resposta motora à pinça do dedo for observada18,20.
- Injete 1 mg/kg de meloxicam subcutâneamente para fornecer analgesia preventiva20,21.
- Para evitar a abrasão da córnea durante a cirurgia, aplique gel oftálmico em ambos os olhos.
- Use um creme depilatório para remover o cabelo sobre o aspecto medial à direita. Uma vez feito, lave com salina quente para remover o creme17.
- Coloque o rato em posição supina em uma almofada de aquecimento. Aplique um esfregão cirúrgico à base de iodo ou cloexidina sobre o local operatório. Deixe por pelo menos 15 s e depois limpe com etanol. Repita a aplicação 3x. Certifique-se de que o esfoliante esteja em contato com a pele por pelo menos 2 min antes de prosseguir com a cirurgia.
NOTA: Entre em contato com a autoridade de controle de infecções em sua unidade de pesquisa para obter protocolos alternativos para prevenir a infecção no local cirúrgico19. - Drape a área cirúrgica17.
NOTA: Realizar todos os procedimentos sob condições assépticas rigorosas19. - Incise a pele no aspecto medial do braço direito e região peitoral para o plano fascial profundo, usando uma lâmina de bisturi número 15. Cauterize cuidadosamente qualquer vaso sanguíneo usando um cauterismo elétrico.
- Divida cuidadosamente a fáscia braquial, que apresenta como uma bainha esbranquiçada cobrindo os músculos, usando um termocautery ou um par de tesouras contundentes, tomando cuidado para não danificar as estruturas vasculares e nervosas no aspecto medial do braço.
- Abra uma tesoura sem rodeios sob a inserção terminal do músculo peitoral maior, a fim de provocar este músculo longe da artéria axilar subjacente e veia, bem como dos ramos terminais do plexo braquial.
- Divida a inserção do músculo peitoral com um cauterismo elétrico. Exponha e sese o músculo peitoral menor.
- Dissecar sem rodeios o MN dos vasos braquiais e do nervo ulnar a partir da região axilar até o cotovelo. Isso permite a exposição dos diferentes ramos terminais do plexo braquial, ou seja, a mediana, o ulnar, o radial, o axilar e os nervos musculocutâneos(Figura 2).
- Separe diferentes grupos experimentais como descrito abaixo.
- Crie o grupo Sham apenas dissecando o MN.
- Crie o grupo Crush comprimindo o MN na porção média do braço para 15 s usando um fórceps de microcirurgia número 5, ou um instrumento semelhante22,23.
- Crie o grupo de excisão usando uma tesoura de microcirurgia para extirpar um segmento de 10 mm de comprimento da parte central do MN no braço. Liga o toco proximal do nervo com uma sutura de nylon 8/0 para evitar o crescimento axonal.
- Crie o grupo enxerto utilizando o segmento de 10 mm de comprimento do MN descrito na última etapa e girando-o 180°. Sutura os tocos proximais e distais do MN seccionado para o enxerto nervoso usando pontos de nylon interrompidos 10/0.
- Feche a ferida da pele com pontos de nylon interrompidos5/0 10,24.
- Fornecer analgesia pós-operatória com 7 mL de acetaminofeno com sabor de cereja misturado com 43 mL de água da torneira25 para obter uma concentração de 4,48 mg/mL em garrafas de água plástica de 50 mL disponibilizadas aos ratos ad libitum por 3 dias25.
2. Habitação e fisioterapia
- Permitir que os ratos tenham contato com os aparelhos de fisioterapia 2-4 semanas antes da cirurgia, a fim de garantir uma adaptação mais fácil e rápida aos ajustes do exercício. Realize os exercícios seguindo os procedimentos detalhados abaixo.
- Uma vez por dia, coloque cada rato dentro de uma esfera individual de fisioterapia e, posteriormente, coloque a esfera em uma sala com poucos obstáculos. Deixe o rato ambular e explorar o quarto livremente por meia hora.
- Abrigar os ratos individualmente em gaiolas solitárias com rodas de corrida incorporadas para ajudá-los a se exercitar.
- Formar grupos de 4 a 5 animais e abrigar esses grupos em gaiolas personalizadas. Personalize as gaiolas incluindo escadas, cordas, rodas de corrida e outros elementos enriquecedores ambientais.
- Devolva ratos individuais para gaiolas personalizadas no dia seguinte à cirurgia.
- Retomar os exercícios de fisioterapia 3 dias após a cirurgia.
3. Testes funcionais
- Uma semana antes de começar a realizar os testes funcionais, familiarize os ratos com as guloseimas alimentares para serem usadas como reforço positivo. Forneça este reforço após a conclusão bem sucedida de cada teste, antes e depois da cirurgia. Após o período inicial de treinamento de 3 semanas, retome todos os exames uma semana após a cirurgia.
- Faça os testes à noite, quando os ratos são naturalmente mais ativos. Retomar os exames uma semana após a cirurgia.
- Realize o Teste de Apreensão colocando o rato em uma grade e levante-o pela cauda, deixando-o agarrar a grade com suas patas dianteiras11,26. Atribua uma pontuação "Positiva" se o rato conseguir pegar a grade com as duas patas dianteiras. Atribua uma pontuação "Negativa" se o rato não conseguir pegar a grade com a pata machucada.
NOTA: Um teste de apreensão positivo indica que o componente do motor do MN está funcionando16,27. - Realize um teste de picada de pino28,,29.
- Faça uma plataforma de plástico com um padrão de grade quadrada de 4 mm x 4 mm. Forneça suporte a esta grade com uma estrutura metálica de 21 cm de comprimento.
- Coloque o rato na plataforma e cubra a grade com uma caixa de plástico transparente de 15,5 cm x 15,5 cm x 11 cm. Aguarde alguns minutos até que as atividades normais (por exemplo, exploratórias e de limpeza principal) diminuam.
- Comece o teste quando o rato estiver parado e em pé sobre suas quatro patas.
- Com a ajuda de um espelho, insira um estesiómetro (por exemplo, o cabelo número 4 Von Frey com uma força de dobra de 25 g) através da malha e cutuque o aspecto palmar da pata dianteira no território da pele do MN(Figura 1). Repita a avaliação 5x em cada pata alternativa, esperando alguns segundos após cada avaliação.
- Verifique a dobra do filamento Von Frey30 para a avaliação correta. Marque as respostas de retirada da seguinte forma: "0" para nenhuma resposta de retirada, "1" se o rato remover lentamente a pata do filamento, "2" se o rato responder rapidamente ao estímulo e remover a pata ou lamber a pata.
NOTA: Se forem observadas ambulatolas e mordidas do filamento, repitam o estímulo, pois são consideradas respostas ambíguas.
- Sessões de treinamento
NOTA: Treine os ratos diariamente por 3 semanas antes de realizar a cirurgia à noite em um ambiente com pouca luz. As sessões de treinamento são recomendadas especialmente para os testes de subida de corda, degrau de escada e trilhas de caminhada. Estes podem ser feitos na ordem apresentada antes, começando com o teste de subida de corda, degrau da escada e, finalmente, teste de trilhas de caminhada. Deixe o mesmo animal alguns minutos de descanso antes de um novo teste.- Durante a primeira semana, coloque o rato no último terço da escada/corda/corredor, perto da entrada da caixa. Condicione o animal a mover-se em direção à abertura da caixa tocando suavemente e/ou puxando a ponta de sua cauda. Forneça ao rato um alimento uma vez que ele entra na caixa, permitindo-lhe alguns segundos de descanso antes de repetir o teste. Repita 5x por dia durante 5 dias.
- Durante a segunda semana, coloque o animal no segundo terço da escada/corda/corredor Repita os degraus em 3.5.1.
- Durante a terceira semana, coloque o rato na parte inferior da escada/corda/corredor, no lado oposto da entrada da caixa. Repita as etapas em 3.5.1, mas só recompense o animal quando ele concluir o teste corretamente.
- Realize o Teste de Rung de Escada.
NOTA: Este teste é utilizado para avaliar a força do membro dianteiro, a estaca, a colocação e a coordenação31.- Coloque o rato na parte inferior da escada (120 cm x 9 cm x 2 cm com 18 passos 1,5 cm de espessura, espaçado 4 cm de distância) e toque suavemente na cauda do rato. Certifique-se de que a escada é colocada a uma inclinação de 10° e leva a uma abertura de 13,20 cm x 11 cm em uma caixa de madeira escura de 31,5 cm x 35 cm x 35 cm.
- Inicie o temporizador assim que o rato começar a subir a escada e pare o temporizador quando o foceu do rato cruzar a entrada da caixa.
- Registre o tempo e repita o teste 3x, cada um separado pelo menos por um intervalo de 1 min.
- Escalada de corda
NOTA: Este teste é utilizado para avaliar a força de apreensão, que depende da recuperação de MN32.- Coloque o rato no fundo da corda e convença-o a subir tocando suavemente sua cauda. Inicie o temporizador assim que o animal começar a subir e pare-o assim que o foceu dos ratos cruzar a entrada da plataforma.
- Para cada teste, registre o tempo que se passa para subir à plataforma e o número de deslizamentos da pata ferida enquanto o rato sobe a corda. Considere o teste válido se o animal não hesitar durante a tarefa ou não parar de subir. Forneça ao rato um lanche depois de executar a tarefa corretamente.
- Registre o tempo e repita o teste 3x, cada um separado pelo menos por um intervalo de 1 minuto.
- Trilhas ambulantes
NOTA: Este teste é utilizado para a avaliação da recuperação do motor do membro dianteiro33,34.- Montar um aparelho que consista em uma passarela confinada de 16,5 cm de altura x 8,7 cm de largura x 43 cm de comprimento. Certifique-se de que isso leva a uma abertura retangular de 8,8 cm x 8,2 cm em uma das paredes de uma caixa de madeira preta de 23 cm x 36 cm x 28 cm. Inclua uma porta deslizante vertical para fechar a entrada da caixa rapidamente. Inclua um topo removível a ser usado para recuperar o rato33,34.
- Coloque um pedaço de papel gráfico no chão do corredor. Pegue o rato pela cauda e deixe-o segurar um pincel de pintura embebido em azul de metileno. Posicione o rato na entrada do corredor para fazê-lo andar dentro da caixa. Remova o papel gráfico do chão do corredor e repita o teste até obter uma boa impressão representativa de ambas as patas dianteiras.
- A partir das impressões obtidas, selecione uma com impressões claras sucessivas de patas dianteiras, fotografe-as em um formato tiff ou jpeg e meça os seguintes parâmetros usando o software de acesso aberto FIJI35.
NOTA: Primeiro, calibrar cada imagem usando as marcas no papel gráfico (Analisar | Definir escala) Segundo, converta cada imagem em um formato de 8 bits(Imagem | Tipo | 8 bits). Posteriormente, use a Ferramenta de Seleção Retangular para selecionar a impressão da pata. Corte esta parte da imagem (Imagem | Cultura). Em cada imagem, destaque as patas e remova o fundo, thresholding da imagem (Imagem | Ajuste | Limiar).- Meça o fator de postura medindo a área de impressão da pata. Use a Ferramenta de Seleção Retangular para selecionar a impressão da pata e pressione Control + M.
- Meça o fator de comprimento de impressão medindo o comprimento mais longo da impressão da pata (para as etapas 3.8.3.2-3.3.3.6, use a Ferramenta de Seleção em Linha Reta para selecionar os dois pontos mais distantes e pressione Control + M).
- Meça o fator de disseminação do dedo medindo a largura mais ampla da impressão da pata.
- Meça o fator de disseminação do dedo intermediário medindo a largura mais larga entre o segundo e o terceiro dedos.
- Meça o comprimento do passo medindo a distância entre pontos homólogos de sucessivas impressões de patas em um determinado lado.
- Medir a base do suporte medindo a distância perpendicular entre a porção central da impressão da pata e a direção do movimento29,33,36.
NOTA: Realizar as duas últimas medições em dois pares de impressões de patas bilaterais representativas33.
4. Medidas fisiológicas
- Termografia infravermelha (IRT)37,38,39.
- Certifique-se de que a temperatura da sala onde as medições serão realizadas esteja entre 18 °C e 25 °C usando um termômetro digital normal com resolução térmica de 0,1 °C. Certifique-se de que não existam fontes de calor significativas (por exemplo, computadores ou geladeiras).
- Aclimate os ratos levando-os para a sala de avaliação 2h antes da avaliação. Antes de iniciar o experimento, anestesiar o rato conforme descrito acima (etapas 1.3-1.6) ou seguir o protocolo da instituição. Verifique a falta da resposta a um pinça do dedo do dedo antes de iniciar o experimento.
- Ligue a câmera termográfica infravermelha 15 min antes da aquisição e não a desligue durante as avaliações. Defina o parâmetro de emissividade da câmera para coincidir com o da pele do rato (ε = 0,98)37,40,41.
- Coloque o rato em seu dorso sobre uma superfície limpa e estável com uma esponja de polietileno. Certifique-se de que não há materiais reflexivos e outras possíveis fontes de artefatos. Fixar suas patas dianteiras cuidadosamente em supinação com fita de cola dupla face. Insira um termômetro digital de 2 cm dentro do reto para monitorar a temperatura central do rato durante todas as avaliações.
- Segure a câmera termográfica em um ângulo de 90° e 30 cm de distância do rato. Concentre a câmera no corpo do animal inteiro. Obter três imagens de termografia infravermelha espaçadas 30 s de distância.
- Transfira os termogramas adquiridos para um computador e analise-os usando software de análise. Defina a temperatura da superfície plantar de ambas as patas dianteiras utilizando uma região de interesse retangular fixa (por exemplo, 9 x 11 pixels) no território plantar do MN, por exemplo, no centro da primeira almofada de pé metacarppal(Figura 1). Usando o software livre FLIR Tools, selecione a termografia clicando duas vezes nele. Na barra de ferramentas esquerda, selecione o botão "Adicionar ferramenta de medição de caixa" e desenhe um retângulo de 9 * 11 pixels sobre a área plantar de ambas as patas dianteiras. Ao ajustar o retângulo sua dimensão em pixels pode ser confirmado. Executá-lo em ambas as patas dianteiras. No lado direito da imagem encontram as temperaturas máxima, mínima e média.
- Sobre o ROI desenhado anteriormente, clique com o botão direito do mouse e selecione exportar. As temperaturas médias, máximas e mínimas, bem como uma matriz de temperaturas do ROI são então exportadas para um documento .csv. Esses dados podem ser explorados posteriormente usando software de análise de dados.
- Avaliação de Electroneuromiographic (ENMG)
- Configure um estimulador elétrico. Tape um par de agulhas descartáveis de acupuntura (0,25 mm x 25 mm) com uma impedância insignificante [<1 Ω]) e 25 mm entre elas para criar eletrodos para estimulação. Agora conecte o estimulador e o eletrodo a uma unidade de aquisição de dados para pegar os sinais de entrada e convertê-los em sinais digitais que podem ser processados com o software do computador.
- Realizar as avaliações na mesma sala, e sempre sob as mesmas condições ambientais controladas42,43,44. Aperte a pata dianteira para garantir que os ratos estejam profundamente anestesiados antes de iniciar a aquisição de dados.
NOTA: A anestesia profunda é de suma importância para minimizar a variabilidade associada aos movimentos voluntários e/ou involuntários dos ratos43. - Exponha o MN em ambos os lados sob o microscópio cirúrgico conforme descrito nas etapas 1.8-1.13. Use uma lâmina de bisturi número 15 para prolongar as incisões braquial nos antebraços com uma incisão da linha média ventral.
- Exponha o aspecto superficial dos músculos flexor digitorum sublimis separando sem rodeios a fáscia antebraquial sobreposta usando uma tesoura de íris. Insira a agulha moída no músculo quadríceps femoris do membro traseiro esquerdo para conectar o plugue de solo do sinal.
- Comece com a pata dianteira direita e coloque os eletrodos de gravação na barriga do músculo flexor digitorum sublimis da pata dianteira e o eletrodo de estimulação proximal ao local da lesão no MN. Umedecer esses eletrodos com soro.
- Certifique-se de que o software está definido da seguinte forma: porta de entrada de canal 1 (CH1) – estimulador de 0-10 V; e porta de entrada de canal 2 (CH2) - EMG a 30-1.000 Hz. Comece escolhendo uma amplitude de estimulação de 10 mV e registre os potenciais de ação muscular composta cmaps taxa de amostragem de 50 kHz para uma duração de 40.000 ms. Aumente gradualmente a amplitude de estimulação em 10 mV passos até atingir 2.000 mV. Repita o mesmo para a pata esquerda42,,43,,44.
NOTA: O sinal é amplificado para 1.000x e filtrado usando uma banda de 30-1.000 Hz. A saída de estimulação é definida para um único pulso com uma duração de 1 ms42,43,44. - Abra o arquivo gravado no software do aparelho de gravação.
NOTA: Por padrão, a tela mostrará janelas de reboque em cima em vermelho, os pulsos do estimulador e abaixo em azul os ENMGs do gravador. Deslizar a barra de rolagem horizontal sob a escala de tempo permite visualizar o registro completo. As duas ferramentas principais, ferramenta Zoom e ferramenta I-Beam, estão no lado inferior direito do painel. Utilizando a ferramenta Zoom, é possível otimizar a visualização dos CMAPs e explorar os gráficos. Para garantir um bom encaixe na tela de visualização, pode ser necessário ajustar o display após o zoom. Para isso, selecione Display| Formas de onda de escala automática. A ferramenta i-beam permite a seleção de áreas específicas dos gráficos e o desempenho das medidas desejadas. No topo dos gráficos, há três pequenas janelas onde as medidas são exibidas. P-P mostra o valor médio de amplitude da área selecionada em volts (tanto no registro estimulador quanto em ENMGs), enquanto Delta-T mostra o intervalo de tempo dessa seleção. - Medir os parâmetros do potencial de ação muscular composta (CMPAs, descrito na Tabela 1) usando as ferramentas de medição homônimas do plugue de software "Toolbox para classificação não supervisionada de MUAPs e potenciais de ação em EMG"45.
- Para cada rato, determine um valor mínimo de tensão de estimulação após o qual a amplitude dos CMAPs não aumenta ainda mais. Comece a partir de um estímulo de 0,05 mV, e dê sucessivos estímulos crescentes em tensões incrementais de 0,05 mV.
- Aplique um estímulo 20% acima dessa tensão para obter um valor de estimulação supramaximal.
- Após a determinação do último valor e o estímulo correspondente aplicado, registre os próximos parâmetros cmaps.
- Avaliação da força da flexão
- Use o mesmo estimulador e eletrodos de estimulação para estimular eletricamente o MN como na etapa 4.2. Ajuste o canal de entrada CH1 como o estimulador (0-10 V) e as configurações de saída para a duração de estímulos de 30 s com pulsos de 1 ms de duração e 1 Hz de frequência. Vincule um dinamômetro, com uma resolução de d = 0,001 N a um computador.
NOTA: A visualização em tempo real dos dados pode ser obtida através da construção de um gráfico de força por tempo (N/s) usando o software previamente instalado no computador e vinculado a um dinamômetro46. - Coloque o rato conforme descrito na etapa 4.1.4. Coloque um laço de sutura de seda 5/0 através do segundo espaço interosseous de ambas as patas dianteiras. Conecte o laço de sutura ao gancho do dinamômetro e à pata dianteira alinhada com o dinamômetro sem colocar pressão excessiva na linha de sutura.
- Fixar a pata contralateral com fita para evitar interferências de movimento espúrio nas leituras do dinamômetro.
- Defina o dinamômetro como zero clicando no botão ZERO.
- Ajuste o estimulador a uma estimulação de amplitude supramaximal de 1,5 V ajustando o nó de tensão.
- No PC, abra o software AFH-01. Abra o separador "Device" e selecione o dispositivo FH5. Criar um novo arquivo ("Measurements1" é o nome dado por padrão) e renomear o arquivo.
- Coloque o eletrodo na parte proximal do MN, clique em jogar na parte inferior do programa, grave a tração no dinamômetro para 30 s.
- Importar os valores obtidos para um software de análise de dados. Calcular os valores máximos e médios de força e a área sob a curva (AUC) para o gráfico de força x tempo para cada avaliação.
- Repita para a pata esquerda.
- Use o mesmo estimulador e eletrodos de estimulação para estimular eletricamente o MN como na etapa 4.2. Ajuste o canal de entrada CH1 como o estimulador (0-10 V) e as configurações de saída para a duração de estímulos de 30 s com pulsos de 1 ms de duração e 1 Hz de frequência. Vincule um dinamômetro, com uma resolução de d = 0,001 N a um computador.
- Peso muscular
- Eutanize os ratos sob anestesia geral por exsanguinação47,48.
- Colher o músculo flexor carpi radialis de ambos os antebraços, dissecando o músculo desde sua origem até sua inserção do tendão distal, usando uma lâmina de bisturi número 15.
- Pesar os músculos com uma balança de precisão9,49.
Resultados
Um total de 34 ratos foram divididos aleatoriamente nos seguintes grupos: Sham (n = 17), Excisão (n = 17) e Enxerto Nervoso (n = 10) para a operação. Todos os ratos sobreviveram à cirurgia e ao pós-operatório sem intercorrências. Uma semana após a cirurgia e nos 100 dias seguintes, todos os animais foram submetidos aos testes funcionais descritos acima uma vez por semana. Os resultados representativos de cada um desses testes são descritos abaixo.
Teste de apreensão
A porcentagem de ratos com uma resposta positiva no teste de apreensão foi maior para o grupo Sham. Esse valor aumentou gradualmente ao longo do tempo em ratos dos grupos Crush e Nerve Graft (Figura 3).
Teste de pino
Os ratos do grupo Sham tiveram as melhores pontuações no teste acumulado de picada de pino em relação aos ratos do grupo enxerto nervoso. Ambos tiveram melhores pontuações do que os ratos do grupo Excision (Figura 4).
Teste de corrida de escada
A velocidade dos ratos no teste de corrida de escada foi mais alta no grupo Sham do que nos ratos submetidos à lesão de MN. Entre estes últimos, o tempo de execução da escada tende a diminuir com o tempo, paralelamente à recuperação de MN (Figura 5).
Teste de corda
Como no teste de corrida de escada, o tempo que os ratos levaram para subir a corda foi menor no grupo Sham em comparação com os grupos em que o MN foi ferido. A velocidade dos ratos neste teste aumentou quando o MN foi autorizado a recuperar (Figura 6).
Análise de pista de caminhada
A análise das faixas a pé tende a apresentar alterações na morfologia das pegadas (Figura 7). Essas alterações foram frequentemente mais acentuadas em lesões de esmagamento do que em lesões do nervo segmental50.
Termografia infravermelha
A termografia foi útil ao examinar as diferenças de temperatura entre as patas dianteiras nos primeiros 30 dias após a cirurgia. As diferenças de temperatura foram mais perceptíveis em ratos com MN mais gravemente ferido, como nos do grupo Excision (Figura 8 e Figura 9).
Electroneuromiografia
A Tabela 1 resume a importância biológica das medições de eletroneuromiografia, proporcionando resultados representativos para os diferentes grupos experimentais. Vários padrões foram observados com a eletroneuromiografia. Um CMAP normal foi típico de um rato do grupo Sham, enquanto um CMAP polifásico foi associado com um grau variável de lesão do MN, como no Crush e nos grupos de enxerto nervoso (Figura 10). No grupo excision, não foram observados CMAPs.
Força de flexão do pulso
Dado que a flexão do pulso depende principalmente do MN, este teste foi utilizado para avaliar a recuperação motora no território deste nervo. A força de flexão do pulso foi mais próxima do normal quando a recuperação foi máxima (Figura 11).
Peso muscular e morfologia
O peso e a morfologia do músculo flexor carpis radialis dependiam da recuperação de MN, pois este músculo é inervado exclusivamente pelo MN9,10. Assim, o peso normal e a morfologia foram observados no grupo Sham. Observou-se perda de peso e tropismo muscular nos grupos Esmagamento, Enxerto Nervosoe Excisão (Figura 12).
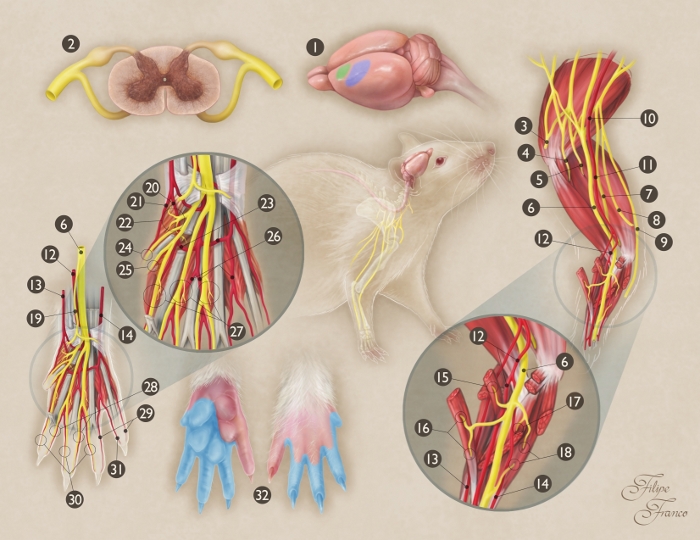
Figura 1: Representação esquemática da anatomia do nervo mediano do rato.
(1) Origem e término do nervo mediano no cérebro de rato (área verde = área motora primária; área azul = área sensorial primária). (2) Seção transversal da medula espinhal a nível de segmento C7; (3) Nervo axilar; (4) Nervo musculocutâneo; (5) Nervo radial; (6) Nervo mediano; (7) Nervo ulnar; (8) Ramo cutâneo medial do braço; (9) Ramo cutâneo medial do antebraço; (10) Artéria axilar; (11) Artéria braquial; (12) Artéria mediana; (13) Artéria radial superficial; (14) Artéria ulnar; (15) Ramo motor do nervo mediano para o músculo pronador teres; (16) Ramo motor do nervo mediano para o músculo flexor carpis radialis; (17) Ramo motor do nervo mediano para o músculo flexor digitorsuperficial superficialis; (18) Ramo motor do nervo mediano para o músculo flexor digitorum profundus; (19) Ramo sensorial do nervo mediano para a região ternar; (20) Artéria palmar comum do primeiro espaço interosseous; (21) Artéria digital palmar radial do primeiro dígito; (22) Ramo motor do nervo mediano para os músculos do ternar; (23) Arco arterial palmar; (24) Nervo digital palmar radial do primeiro dígito; (25) Nervo digital palmar ulnar do primeiro dígito; (26) Artéria palmar comum do terceiro espaço interassérea; (27) Ramificações motoras das divisões terminais do nervo mediano para os três primeiros músculos lumbrical; (28) Nervos digitais palmarulnar do segundo, terceiro e quarto dígitos; (29) Artérias digitais palmarulnar para o quarto e quinto dígitos; (30) Nervos digitais palmares radiais do segundo, terceiro e quarto dígitos; (31) Artéria digital palmar radial do quinto dígito; (32) Território da pele do nervo mediano na pata dianteira (região de sombreado azul). Clique aqui para ver uma versão maior desta figura.
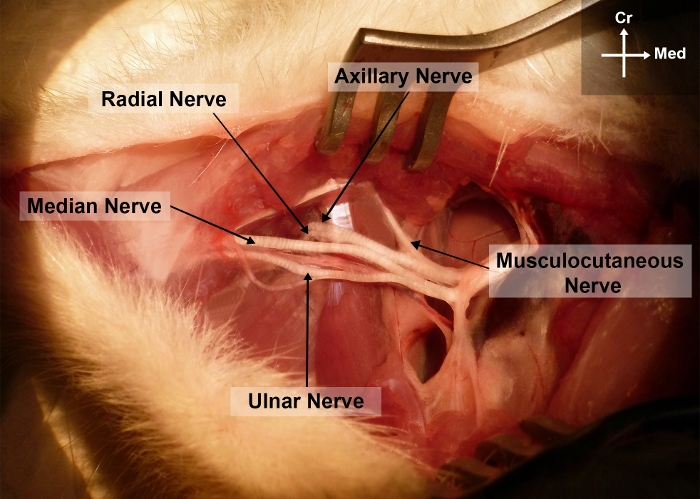
Figura 2: Fotografia do membro dianteiro direito do rato mostrando a anatomia cirúrgica do nervo mediano no braço e nas regiões axilares.
Cr, cranial; Eu, medial Clique aqui para ver uma versão maior desta figura.
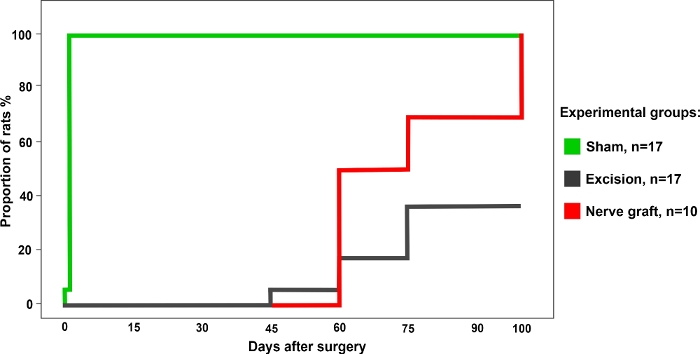
Figura 3: Percentual de ratos com teste de apreensão positivo no grupo experimental diferente durante um período de 100 dias após a cirurgia. Clique aqui para ver uma versão maior desta figura.
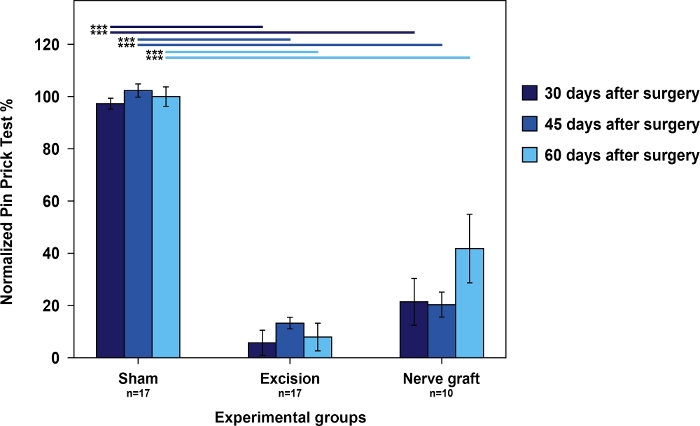
Figura 4: Avaliação da nocicepção utilizando resultados cumulativos de pino na pata dianteira operada normalizada na pata contralateral nos diferentes grupos experimentais.
As barras verticais representam intervalos de confiança de 95%. As linhas horizontais na parte superior da figura indicam diferenças estatisticamente significativas entre os grupos experimentais, ***p<0,001. Clique aqui para ver uma versão maior desta figura.
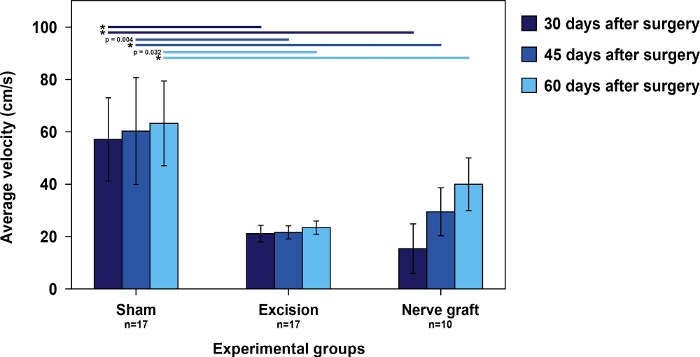
Figura 5: Velocidade média no teste de corrida de escada nos diferentes grupos experimentais.
As barras verticais representam intervalos de confiança de 95%. Os asteriscos na parte superior do número indicam diferenças estatisticamente significativas entre os grupos, *p<0,001. Clique aqui para ver uma versão maior desta figura.
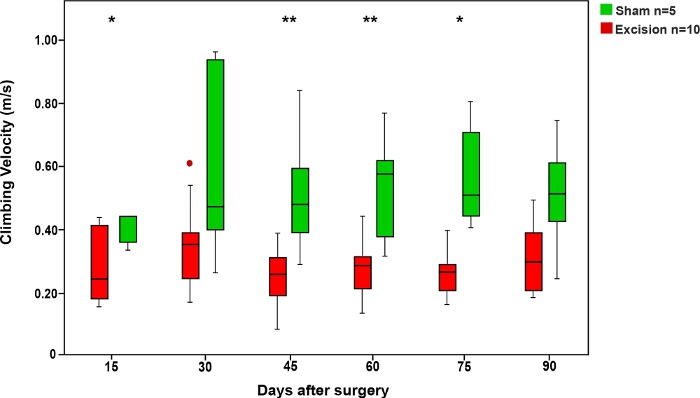
Figura 6: Velocidade média de subida no teste de corda nos grupos Sham e Excision.
As barras verticais representam intervalos de confiança de 95%. Os asteriscos na parte superior da figura mostram diferenças estatisticamente significativas entre os grupos, *p<0,05; **p<0,01. Clique aqui para ver uma versão maior desta figura.
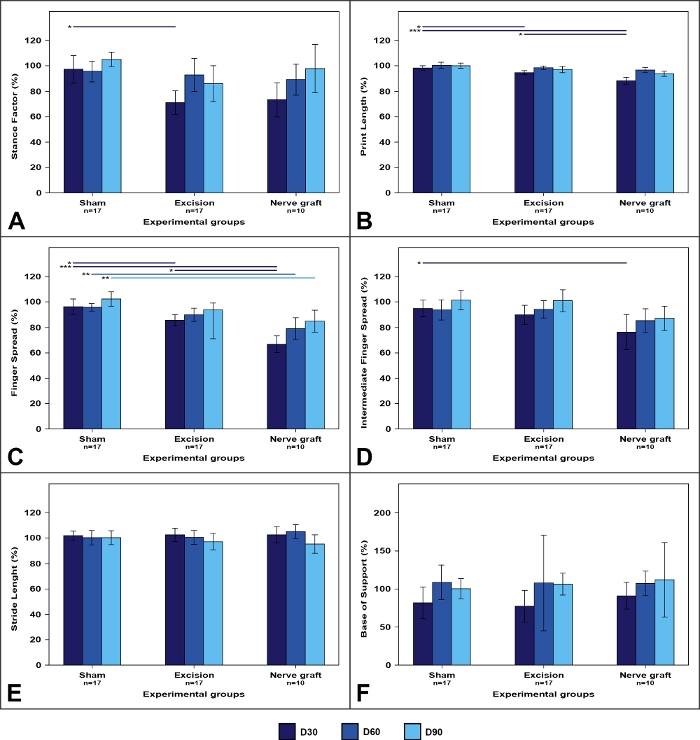
Figura 7: Parâmetros de pista de caminhada nos diferentes grupos experimentais.
Os valores no membro operado são expressos como percentuais de meios normalizados para o membro contralateral. (A)Fator de postura; (B) Comprimento de impressão; (C) Fator de disseminação de dedos; (D) Fator de disseminação de dedos intermediários; (E) Comprimento do passo; (F)Base de apoio. As barras verticais representam intervalos de confiança de 95%. As linhas horizontais na parte superior da figura indicam diferenças estatisticamente significativas entre os grupos experimentais. D30, D60, D90 = 30, 60 e 90 dias após a cirurgia, *p<0,05; **p<0,01; p<0,001. Clique aqui para ver uma versão maior desta figura.
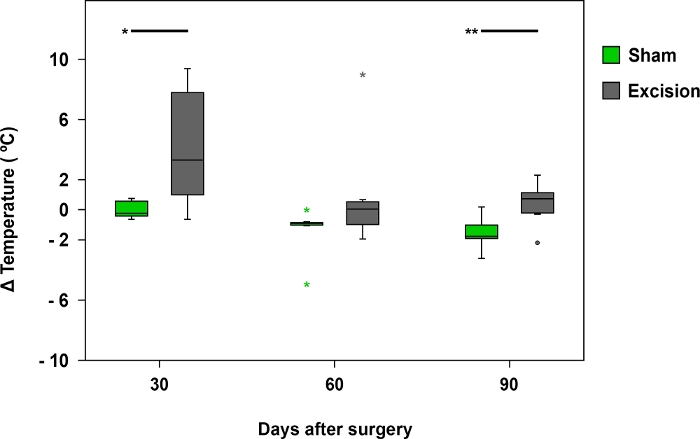
Figura 8: Diferença média de temperatura registrada pela termografia infravermelha.
As parcelas da caixa representam a diferença de temperatura entre a região palmar do nervo mediano no lado operado (lado direito) e o lado contralateral (esquerda) nos grupos Sham (n = 17) e Excisão (n = 17), *p<0,05; **p<0,01. Clique aqui para ver uma versão maior desta figura.
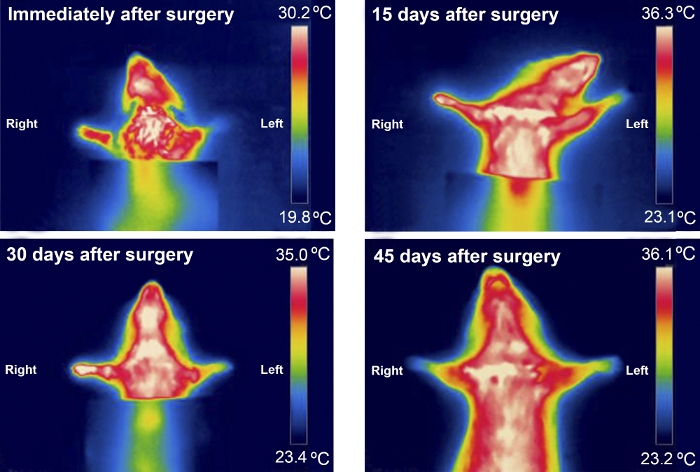
Figura 9: Padrão típico de termografia infravermelha de um animal do grupo de excisão durante os primeiros 45 dias após a cirurgia. Clique aqui para ver uma versão maior desta figura.
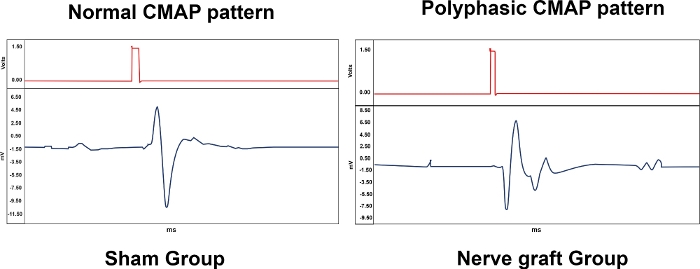
Figura 10: Padrões típicos de Potenciais de Ação Muscular Composta (CMAPs) de um animal dos grupos Sham e Nerve Graft 90 dias após a cirurgia. Por favor, clique aqui para ver uma versão maior desta figura.
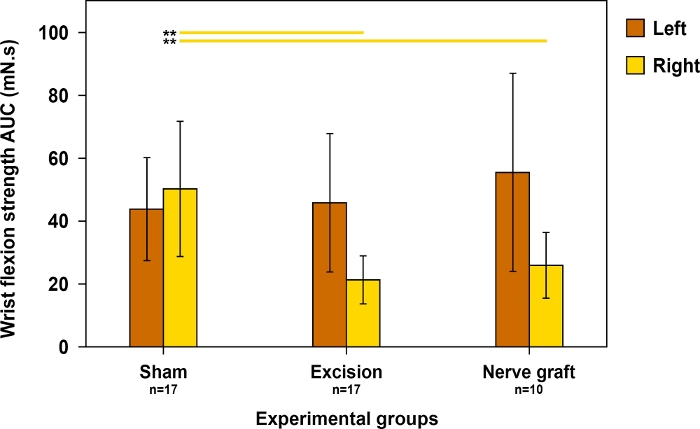
Figura 11: Avaliação da força de flexão do pulso em ambas as patas dianteiras 90 dias pós-operatórios em diferentes grupos experimentais.
A força de flexão do pulso foi avaliada utilizando-se a área sob a curva (AUC) durante um período de tempo de 30 s e utilizando estimulação supratetânea. Linhas verticais denotam intervalos de confiança de 95%. As linhas horizontais na parte superior da figura destacam diferenças estatisticamente significativas entre os grupos, **p<0,01. Clique aqui para ver uma versão maior desta figura.
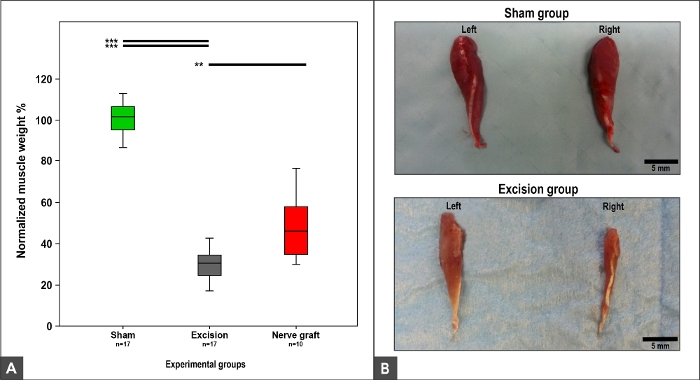
Figura 12: Flexor carpi radialpeso muscular e aparência macroscópica 100 dias após a cirurgia.
(A) Parcelas de caixa que retratam o peso muscular flexor carpi radialis normalizado em diferentes grupos experimentais, **p<0.01; p<0,001. (B) Fotografias dos músculos dos lados direito e esquerdo nos grupos experimentais Sham e Excision. Clique aqui para ver uma versão maior desta figura.
| Parâmetro | Significância do parâmetro | Grupo Sham | Grupo de excisão | Grupo NG |
| Limiar de estimulação neurológica (%) | Avaliação da regeneração nervosa, pois há um número mínimo de fibras nervosas necessárias para produzir um CMAP ou uma contração muscular visível12 | 281,63 ± 271,65 | 5359,98 ± 3466,52 | 2108,12 ± 2115,13 |
| Limiar de estimulação motora (%) | Avaliação da regeneração nervosa, pois há um número mínimo de fibras nervosas necessárias para produzir um CMAP ou uma contração muscular visível12 | 462,52 ± 118,91 | 1694,10 ± 503,24 | 1249,50 ± 503,24 |
| Latência (%) | Avaliação da velocidade de condução nervosa nas fibras nervosas mais rápidas, ou seja, as maiores fibras mielinadas44 | 113,55 ± 25,04 | N/A | 132,80 ± 69,95 |
| Velocidade de transdução neuromuscular (%) | Avaliação da velocidade de condução nervosa nas fibras nervosas mais rápidas, ou seja, as maiores fibras mielinadas44 | 92,01 ± 20,88 | N/A | 91,30 ± 26,51 |
| Amplitude de CMAPs (%) | Avaliação do número de unidades motoras reinervadas34 | 110,63 ±45,66 | N/A | 41,60 ± 24,84 |
| Duração dos CMAPs (%) | Avaliação da sincronia da inervação muscular, que depende do grau de reinervação muscular e mielinação das fibras motoras interiores44,45 | 101,12 ± 23,92 | N/A | 151,06 ± 54,52 |
|
NG, enxerto nervoso CMAPs, potencial de ação muscular composta. N/A,não aplicável Todos os parâmetros são expressos como percentuais dos valores médios contralaterais. As variáveis numéricas são expressas como média ± desvio padrão. | ||||
Tabela 1: Avaliação eletroeuromiográfica no final do experimento.
Discussão
Este artigo apresenta um protocolo para criar diferentes tipos de lesões de MN e reparar no rato. Além disso, ilustra como avaliar a recuperação funcional desse nervo utilizando vários testes comportamentais não invasivos e medidas fisiológicas.
Notavelmente, vários dos testes funcionais descritos neste artigo, ou seja, o Teste de Corrida de Escada e o Teste da Corda, dependem significativamente da disposição do rato para realizar a tarefa com a expectativa de obter a recompensa alimentar51,52,53. Deve-se notar que certas cepas de ratos são mais passíveis de treinamento e realização reprodutivelmente neste tipo de testes51,52,53. Por exemplo, os ratos de Lewis têm um desempenho ruim nestes testes tanto na fase de treinamento quanto,posteriormente,51,52,53.
A habitação de ratos deve permitir ampla liberdade de movimento de acordo com seu comportamento exploratório natural, além de permitir que os animais experimentais se familiarizem com alguns dos elementos presentes nos testes funcionais19. Portanto, diferentes formas de moradia que permitem maior liberdade de movimento são mostradas. As gaiolas grandes são personalizadas com elementos de enriquecimento que são posteriormente utilizados nos testes funcionais (por exemplo, cordas e escadas).
Indiscutivelmente, esses elementos enriquecedores, bem como as gaiolas com rodas de corrida incorporadas e as esferas de treinamento individuais fornecem uma forma de fisioterapia pós-operatória semelhante à oferecida aos pacientes humanos operados no sistema nervoso periférico10.
Significativamente, embora alguns autores defendam dissecar os tecidos subcutâneos e as fáscias musculares sem rodeios ou por corte limpo com um bisturi número 15, recomenda-se o uso de termocauterismo ao dissecar essas estruturas para minimizar o risco de hematoma pós-operatório.
Deve-se notar que inúmeros testes foram elaborados para testar diferentes aspectos da reparação do nervo periférico no rato, ou seja, regeneração axonal, reinervação de alvo e recuperação funcional, alguns dos quais estão além do escopo deste estudo29,54,55,56. Por exemplo, a análise cinemática29,36,55 e avaliação histomorfométrica29,36,57 são amplamente empregadas por múltiplos autores. Além disso, vários desses testes envolvem variações para maximizar a eficiência e/ou reprodutibilidade54. Por exemplo, a algisemetria mecânica (ou seja, avaliação de respostas a estímulos mecânicos dolorosos) pode ser avaliada qualitativamente usando um dado filamento von Frey, como descrito no presente artigo, ou semiquantitativamente usando filamentos von Frey sucessivamente mais fortes, ou mesmo quantitativamente usando dispositivos eletrônicos que aplicam pressões crescentes até que uma resposta de retirada seja observada30,54.
Da mesma forma, embora vários autores utilizem a análise de pista de caminhada para avaliar o reparo do nervo de membros dianteiros no rato, outros autores argumentam que lesões únicas de MN frequentemente não produzem alterações reprodutíveis nas patas10,58,59. Além disso, alguns afirmaram que essas alterações podem não ser proporcionais à recuperação muscular10,60. Tendo isso em mente, alguns pesquisadores têm defendido o uso da análise de pista de caminhada na pata dianteira principalmente na avaliação da recuperação após esmagamento das lesões de neve e não após reconstrução do nervo segmental10,50,61.
O Teste de Apreensão é amplamente utilizado para avaliar a recuperação motora dos músculos controlados pelo MN16,27. Para garantir a uniformidade e a reprodutibilidade dos dados obtidos com este teste, recomenda-se a aplicação do Teste de Apreensão utilizando a metodologia bem estabelecida proposta por Bertelli et al.16. No entanto, o protocolo atual difere na forma de não imobilizar rotineiramente a pata contralateral para evitar estresse indevido11,27. Deve-se notar também que outros autores, após imobilizar a pata ilesa, avaliam quantitativamente o Teste de Apreensão utilizando um dinamômetro ou uma escala27,56. No entanto, essa avaliação quantitativa pode ser afetada pela força que o pesquisador aplica à cauda do rato26. Além disso, é difícil distinguir entre a força gerada pelos músculos flexores digitais (unicamente inervados pelo MN no rato e o objeto do Teste de Apreensão9) da força produzida pelos flexores de pulso, que incluem o flexor carpi ulnaris que recebe sua inervação do nervo ulnar9,10,27. Para tentar contornar esses vieses potenciais, este protocolo utiliza uma escala ordinal semelhante à Escala do Conselho de Pesquisa Médica comumente usada para classificar a força muscular em humanos10,11,62. Alternativamente, outros autores descreveram uma avaliação detalhada da apreensão usando análise de vídeo e um sistema de pontuação baseado em vídeo11,63.
Uma desvantagem potencial do uso do MN em comparação com o nervo ciático é que uma maior quantidade de informação está disponível em relação ao último nervo. Isso, por sua vez, pode fazer comque os dados obtidos com o MN com os de trabalhos experimentais anteriores mais difíceis46,48,64. Além disso, o tamanho menor do MN em relação ao nervo ciático torna a manipulação cirúrgica mais desafiadora8,12,27,56,65.
Ao contrário da metodologia descrita neste artigo, a avaliação da eletroneuromiografia pode ser realizada utilizando eletrodos monopolares transcutâneos colocados no braço e nas regiões ternar51. Apesar de menos invasivo, este método apresenta o risco de confusão potencial devido à possibilidade de coestimulação do nervo ulnar na região do braço9,51.
A maioria dos autores concorda que nem todos os testes utilizados no rato fornecem resultados concordantes, pois a reparação do nervo periférico depende de uma complexa gama de fatores, compreendendo a sobrevivência dos neurônios, alongamento e poda axonal, sinaptogênese, recaptura bem sucedida dos órgãos sensoriais e unidades motoras denervadas, e plasticidade cerebral7,10,50,66,67.
Finalmente, deve-se notar que uma ressalva significativa dos modelos de roedores é que os nervos periféricos de ratos estão muito mais próximos de seus órgãos finais e têm áreas transversais muito menores do que as estruturas humanas homólogas. No entanto, essa diferença de tamanho garante dados experimentais mais rápidos em roedores, e melhores resultados gerais em ratos em comparação com humanos são esperados68. De fato, vários autores alertam que o cuidado deve ser utilizado ao tentar extrapolar dados experimentais obtidos na reparação de nervos periféricos usando roedores para humanos7,69. Modelos primatas são considerados mais comparáveis70. No entanto, seu uso está associado a restrições éticas, logísticas e orçamentárias vexatórias71.
Embora o nervo ciático seja o nervo mais comumente usado na pesquisa do nervo periférico, o rato MN apresenta múltiplas vantagens. Por exemplo, as lesões de MN estão associadas a uma menor incidência de contraturas articulares e automutilação da pata afetada11,,12,,16,56. Significativamente, a autotomia subseqüente à transsecção do nervo ciático aflige 11-70% dos ratos. Isso pode tornar as avaliações atuais como o índice ciático impossível14. Isso, por sua vez, faz com que a estimativa do número de animais necessários para obter um determinado poder estatístico seja complicada15.
Além disso, como o MN é mais curto que o nervo ciático, a recuperação nervosa é observada mais cedo58,72,73,74,75,76. Além disso, o MN não é coberto por massas musculares, tornando sua dissecção tecnicamente mais fácil do que a do nervo ciático16. Além disso, o MN tem um caminho paralelo para o nervo ulnar no braço. Assim, o nervo ulnar pode ser facilmente usado como enxerto nervoso para reparar lesões de MN. Finalmente, em humanos, a maioria das lesões nervosas periféricas ocorrem no membro superior, o que suporta ainda mais o uso desse nervo no rato77,78.
Indiscutivelmente, os roedores são os animais experimentais mais comumente utilizados no reino da reparação do nervo periférico48,79. Como mostrado, o rato MN é um modelo conveniente de lesão e reparação do nervo periférico. De fato, existem múltiplas estratégias padronizadas disponíveis para avaliar a recuperação motora e sensorial, permitindo uma comparação mais fácil dos resultados36,,46,,60,,80,,81,,82. Muitos desses métodos são não invasivos, permitindo uma avaliação diária.
Além disso, a fisioterapia faz parte do padrão de atendimento dos pacientes que se recuperam de lesões nervosas periféricas. Como demonstrado neste artigo, existem múltiplas estratégias para fornecer um ambiente pós-operatório de fisioterapia a ratos submetidos às lesões de MN4,5. Assim, este modelo é particularmente adequado para replicar o cenário clínico, facilitando a extrapolação dos resultados para a espécie humana12,27,48,56,58,83.
Como mostrado neste artigo, várias estratégias padronizadas estão disponíveis para avaliar a recuperação motora e sensorial no modelo MN do rato. A maioria deles são procedimentos não invasivos, permitindo avaliação frequente. Além disso, como a maioria das lesões nervosas periféricas na espécie humana ocorre no membro superior, as configurações de fisioterapia experimental mencionadas podem imitar mais adequadamente a recuperação no contexto clínico. Indiscutivelmente, isso pode facilitar a extrapolação de resultados para a espécie humana, validando ainda mais o uso deste nervo no rato.
Divulgações
Os autores não têm nada para revelar.
Agradecimentos
Diogo Casal recebeu uma bolsa do Programa de Educação Médica Avançada, que tem o patrocínio da Fundação Calouste Gulbenkian, Fundação Champalimaud, Ministério da Saúde e Fundação para a Ciência e Tecnologia, Portugal. Os autores são muito gratos ao Sr. Filipe Franco pelo desenho ilustrativo na Figura 1. Os autores agradecem a ajuda técnica do Sr. Alberto Severino na filmagem e edição do vídeo. Por fim, os autores agradecem à sra. Sara Marques pela ajuda em todos os aspectos logísticos relativos à aquisição e manutenção dos animais.
Materiais
| Name | Company | Catalog Number | Comments |
| Acetaminophen | Amazon | https://www.amazon.com/Childrens-Tylenol-grape-flavor-ages/dp/B0051VVVZG | |
| Acland clamps | Fine Science Tools | 00398 V | http://www.merciansurgical.com/aclandclamps.pdf |
| Acland Single Clamps B-1V (Pair) | Fine Science Tools | 396 | http://www.merciansurgical.com |
| Biogel Surgical Gloves | Medex Supply | 30465 | https://www.medexsupply.com |
| BSL Analysis | BIOPAC Systems | https://www.biopac.com/ | |
| Castroviejo needle holders | Fine Science Tools | 12565-14 | http://s-and-t.ne |
| Clamp applicator | Fine Science Tools | CAF-4 | http://www.merciansurgical.com/acland-clamps.pdf |
| Constante voltage stimulator | BIOPAC Systems | STM200 | https://www.biopac.com/product/constant-voltage-stimulator-unipolar-pulse/ |
| Cutasept skin disinfectant | Bode Chemie | http://www.productcatalogue.bode-chemie.com/products/skin/cutasept_f.php | |
| Dafilon 10-0 | G1118099 | http://www.bbraun.com/cps/rde/xchg/bbraun-com/hs.xsl/products.html?prid=PRID00000816 | |
| Derf Needle Holders 12 cm TC | Fine Science Tools | 703DE12 | http://www.merciansurgical.com |
| Dry heat sterilizer | Quirumed | 2432 | http://www.quirumed.com/pt/material-de-esterilizac-o/esterilizadores |
| Dynamometer | SAUTER | FH5 | https://www.sauter.eu/shop/en/measuring-instruments/force-measurement/FH-S/ |
| Electroneuromiography setup | BIOPAC Systems | MP36 | https://www.biopac.com/product/biopac-student-lab-basic-systems/ |
| Ethilon 5-0 | W1618 | http://www.farlamedical.co.uk/ | |
| FLIR Software | FLIR | ||
| Graeffe forceps 0.8 mm tips curved | Fine Science Tools | 11052-10 | http://www.finescience.de |
| Graph paper | Ambar | ||
| Heat Lamp HL-1 | Harvard Apparatus | 727562 | https://www.harvardapparatus.com/webapp/wcs/stores/servlet/haisku3_10001_11051_39108_-1_HAI_ProductDetail_N_37610_37611_37613 |
| Heparin Sodium Solution (Heparin LEO 10000IU/ml) | Universal Drugstore | http://www.universaldrugstore.com/medications/Heparin+LEO/10000IU%2Fml | |
| High-Temperature Cautery | Fine Science Tools | AA03 | http://www.boviemedical.com/products_aaroncauteries_high.asp |
| Homeothermic Blanket System with Flexible Probe | Harvard Apparatus | 507220F | https://www.harvardapparatus.com/webapp/wcs/stores/servlet/haisku3_10001_11051_39108_-1_HAI_ProductDetail_N_37610_37611_37613 |
| Infrared camera | FLIR | E6 | http://www.flir.eu/instruments/e6-wifi/ |
| Instrapac - Adson Toothed Forceps (Extra Fine) | Fine Science Tools | 7973 | http://www.millermedicalsupplies.com |
| Iris Scissors 11.5 cm Curves EASY-CUT | Fine Science Tools | EA7613-11 | http://www.merciansurgical.com |
| Ketamine hydrochloride/xylazine hydrochloride solution | Sigma- Aldrich | K113 | https://www.sigmaaldrich.com/catalog/product/sigma/k113?lang=pt®ion=PT |
| Lacri-lube Eye Ointment 5g | Express Chemist | LAC101F | http://www.expresschemist.co.uk/lacri-lube-eye-ointment-5g.html |
| Mayo Scissors 14 cm Straight Chamfered Blades EASY-CUT | Fine Science Tools | EA7652-14 | http://www.merciansurgical.com |
| Meloxicam | Recropharma | Mobic | https://www.recropharma.com/product-pipeline/meloxicam |
| Methylene Blue solution | Sigma- Aldrich | https://www.sigmaaldrich.com/catalog/product | |
| Micro Jewellers Forceps 11 cm straight 00108 | Fine Science Tools | JF-5 | http://www.merciansurgical.com |
| Micro Jewellers Forceps 11cm angulated 00109 | Fine Science Tools | JFA-5b | http://www.merciansurgical.com |
| Micro retractor | Fine Science Tools | RS-6540 | http://www.finescience.de |
| Micro Scissors Round Handles 15 cm Straight | Fine Science Tools | 67 | http://www.merciansurgical.com |
| Micro-vessel dilators 11 cm 0.3 mm tips 00124 | Fine Science Tools | D-5a.2 | http://www.merciansurgical.com |
| Monosyn 5-0 | 15423BR | http://www.mcfarlanemedical.com.au/15423BR/SUTURE-MONOSYN-5_or_0-16MM-70CM-(C0023423)-BOX_or_36/pd.php | |
| Normal saline for irrigation | Hospira, Inc. | 0409-6138-22 | http://www.hospira.com/en/search?q=sodium+chloride+irrigation%2C+usp&fq=contentType%3AProducts |
| Operating microscope | Leica Surgical Microsystems | http://www.leica-microsystems.com/products/surgical-microscopes/ | |
| Skin Skribe Surgical Skin Marker | Moore Medical | 31456 | https://www.mooremedical.com/index.cfm?/Skin-Skribe-Surgical-Skin-Marker/&PG=CTL&CS=HOM&FN=ProductDetail&PID=1740&spx=1 |
| Snacks | Versele-Laga | Complete Crock-Berry | http://www.versele-laga.com/en/complete/products/complete-crock-berry |
| Straight mosquito forcep | Fine Science Tools | 91308-12 | http://www.finescience.de |
| Surgical drapes | Barrier | 800430 | http://www.molnlycke.com/surgical-drapes/ |
| Veet Sensitive Skin Hair Removal Cream Aloe Vera and Vitamin E 100 ml | Veet | http://www.veet.co.uk/products/creams/creams/veet-hair-removal-cream-sensitive-skin/ |
Referências
- Lad, S. P., Nathan, J. K., Schubert, R. D., Boakye, M. Trends in median, ulnar, radial, and brachioplexus nerve injuries in the United States. Neurosurgery. 66 (5), 953-960 (2010).
- Murovic, J. A. Upper-extremity peripheral nerve injuries: a Louisiana State University Health Sciences Center literature review with comparison of the operative outcomes of 1837 Louisiana State University Health Sciences Center median, radial, and ulnar nerve lesions. Neurosurgery. 65 (4), 11-17 (2009).
- Dy, C. J., Isaacs, J., Dy, C. J., Isaacs, J. . American Society for Surgery of the Hand surgical anatomy: nerve reconstruction Vol. 1. , (2017).
- Trehan, S. K., Model, Z., Lee, S. K. Nerve Repair and Nerve Grafting. Hand Clinics. 32 (2), 119-125 (2016).
- Boyd, K. U., Fox, I. K., Mackinnon, S. E. . Nerve surgery Vol. 1. , 75-100 (2015).
- Geuna, S., et al. Update on nerve repair by biological tubulization. Journal of Brachial Plexius Peripheral Nerve Injury. 9 (1), 3 (2014).
- Sulaiman, W., Gordon, T. Neurobiology of peripheral nerve injury, regeneration, and functional recovery: from bench top research to bedside application. Ochsner Journal. 13 (1), 100-108 (2013).
- Angelica-Almeida, M., et al. Brachial plexus morphology and vascular supply in the wistar rat. Acta Medica Portuguesa. 26 (3), 243-250 (2013).
- Bertelli, J. A., Taleb, M., Saadi, A., Mira, J. C., Pecot-Dechavassine, M. The rat brachial plexus and its terminal branches: an experimental model for the study of peripheral nerve regeneration. Microsurgery. 16 (2), 77-85 (1995).
- Casal, D., et al. Reconstruction of a 10-mm-long median nerve gap in an ischemic environment using autologous conduits with different patterns of blood supply: A comparative study in the rat. PLoS One. 13 (4), 0195692 (2018).
- Stößel, M., Rehra, L., Haastert-Talini, K. Reflex-based grasping, skilled forelimb reaching, and electrodiagnostic evaluation for comprehensive analysis of functional recovery-The 7-mm rat median nerve gap repair model revisited. Brain and Behavior. 7 (10), 00813 (2017).
- Manoli, T., et al. Correlation analysis of histomorphometry and motor neurography in the median nerve rat model. Eplasty. 14, 17 (2014).
- Ronchi, G., et al. The Median Nerve Injury Model in Pre-clinical Research - A Critical Review on Benefits and Limitations. Frontiers in Cellular Neuroscience. 13, 288 (2019).
- Weber, R. A., Proctor, W. H., Warner, M. R., Verheyden, C. N. Autotomy and the sciatic functional index. Microsurgery. 14 (5), 323-327 (1993).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. Journal of Pharmacology & Pharmacotherapeutics. 4 (4), 303-306 (2013).
- Bertelli, J. A., Mira, J. C. The grasping test: a simple behavioral method for objective quantitative assessment of peripheral nerve regeneration in the rat. Journal of Neuroscience Methods. 58 (1-2), 151-155 (1995).
- Casal, D., et al. A Model of Free Tissue Transfer: The Rat Epigastric Free Flap. Journal of Visualized Experiments. (119), e55281 (2017).
- Bertens, A. P. M. G., Van Zuthphen, L. F., Baumas, V., Beymen, A. C. Anaesthesia, analgesia and euthanasia. Principles of Laboratory Animal Science. , 277-311 (2001).
- Pritchett-Corning, K. R., Luo, Y., Mulder, G. B., White, W. J. Principles of rodent surgery for the new surgeon. Journal of Visualized Experiments. (47), e2586 (2011).
- Lee-Parritz, D. Analgesia for rodent experimental surgery. Israel Journal of Veterinary Medicine. 62 (3), 74 (2007).
- Roughan, J. V., Flecknell, P. A. Evaluation of a short duration behaviour-based post-operative pain scoring system in rats. European Journal of Pain. 7 (5), 397-406 (2003).
- Bauder, A. R., Ferguson, T. A. Reproducible mouse sciatic nerve crush and subsequent assessment of regeneration by whole mount muscle analysis. Journal of Visualized Experiments. (60), e3606 (2012).
- Ronchi, G., et al. Functional and morphological assessment of a standardized crush injury of the rat median nerve. Journal of Neuroscience Methods. 179 (1), 51-57 (2009).
- Matsumine, H., et al. Vascularized versus nonvascularized island median nerve grafts in the facial nerve regeneration and functional recovery of rats for facial nerve reconstruction study. Journal of Reconstructive Microsurgery. 30 (2), 127-136 (2014).
- Mickley, A. G., Hoxha, Z., Biada, J. M., Kenmuir, C. L., Bacik, S. E. Acetaminophen Self-administered in the Drinking Water Increases the Pain Threshold of Rats (Rattus norvegicus). Journal of the American Association for Laboratory Animal Science. 45 (5), 48-54 (2006).
- Mandillo, S., et al. Reliability, robustness, and reproducibility in mouse behavioral phenotyping: a cross-laboratory study. Physiological Genomics. 34 (3), 243-255 (2008).
- Papalia, I., Tos, P., Stagno d'Alcontres, F., Battiston, B., Geuna, S. On the use of the grasping test in the rat median nerve model: a re-appraisal of its efficacy for quantitative assessment of motor function recovery. Journal of Neuroscience Methods. 127 (1), 43-47 (2003).
- Costa, L. M., Simoes, M. J., Mauricio, A. C., Varejao, A. S. Chapter 7: Methods and protocols in peripheral nerve regeneration experimental research: part IV-kinematic gait analysis to quantify peripheral nerve regeneration in the rat. International Reviews in Neurobiology. 87, 127-139 (2009).
- Geuna, S., Varejao, A. S. Evaluation methods in the assessment of peripheral nerve regeneration. Journal of Neurosurgery. 109 (2), 360-362 (2008).
- Howard, R. F., Hatch, D. J., Cole, T. J., Fitzgerald, M. Inflammatory pain and hypersensitivity are selectively reversed by epidural bupivacaine and are developmentally regulated. Anesthesiology. 95 (2), 421-427 (2001).
- Metz, G. A., Whishaw, I. Q. Cortical and subcortical lesions impair skilled walking in the ladder rung walking test: a new task to evaluate fore- and hindlimb stepping, placing, and co-ordination. Journal of Neuroscience Methods. 115 (2), 169-179 (2002).
- Thallmair, M., et al. Neurite growth inhibitors restrict plasticity and functional recovery following corticospinal tract lesions. Nature Neuroscience. 1 (2), 124-131 (1998).
- Brown, C. J., et al. Self-evaluation of walking-track measurement using a Sciatic Function Index. Microsurgery. 10 (3), 226-235 (1989).
- Hruska, R. E., Kennedy, S., Silbergeld, E. K. Quantitative aspects of normal locomotion in rats. Life Science. 25 (2), 171-179 (1979).
- Ferreira, T., Rasband, W. ImageJ user guide. ImageJ/Fiji. 1, 155-161 (2012).
- Dijkstra, J. R., Meek, M. F., Robinson, P. H., Gramsbergen, A. Methods to evaluate functional nerve recovery in adult rats: walking track analysis, video analysis and the withdrawal reflex. Journal of Neuroscience Methods. 96 (2), 89-96 (2000).
- Ludwig, N., Formenti, D., Gargano, M., Alberti, G. Skin temperature evaluation by infrared thermography: Comparison of image analysis methods. Infrared Physics & Technology. 62, 1-6 (2014).
- Bennett, G. J., Ochoa, J. L. Thermographic observations on rats with experimental neuropathic pain. Pain. 45 (1), 61-67 (1991).
- Wakisaka, S., Kajander, K. C., Bennett, G. J. Abnormal skin temperature and abnormal sympathetic vasomotor innervation in an experimental painful peripheral neuropathy. Pain. 46 (3), 299-313 (1991).
- Muntean, M. V., et al. Using dynamic infrared thermography to optimize color Doppler ultrasound mapping of cutaneous perforators. Medical Ultrasonography. 17 (4), 503-508 (2015).
- Shterenshis, M. Challenges to Global Implementation of Infrared Thermography Technology: Current Perspective. Central Asian Journal of Global Health. 6 (1), 289 (2017).
- Wilbourn, A. J., Mackinnon, S. E. . Nerve surgery Vol. 1. , 59-74 (2015).
- Wu, Y., Martínez, M. &. #. 1. 9. 3. ;. M., Balaguer, P. O., Turker, H. . Electrodiagnosis in New Frontiers of Clinical Research. , (2013).
- Werdin, F., et al. An improved electrophysiological method to study peripheral nerve regeneration in rats. Journal of Neuroscience Methods. 182 (1), 71-77 (2009).
- Sedghamiz, H., Santonocito, D. Unsupervised Detection and Classification of Motor Unit Action Potentials in Intramuscular Electromyography Signals. 2015 E-health and Bioengineering Conference IEEE. , 1-6 (2015).
- Hadlock, T. A., Koka, R., Vacanti, J. P., Cheney, M. L. A comparison of assessments of functional recovery in the rat. Journal of the Peripheral Nervous System. 4 (3-4), 258-264 (1999).
- Carstens, E., Moberg, G. P. Recognizing pain and distress in laboratory animals. Ilar Journal. 41 (2), 62-71 (2000).
- Tos, P., et al. Chapter 4: Methods and protocols in peripheral nerve regeneration experimental research: part I-experimental models. International Reviews in Neurobiology. 87, 47-79 (2009).
- Galtrey, C. M., Fawcett, J. W. Characterization of tests of functional recovery after median and ulnar nerve injury and repair in the rat forelimb. Journal of the Peripheral Nervous System. 12 (1), 11-27 (2007).
- Giusti, G., et al. Return of motor function after segmental nerve loss in a rat model: comparison of autogenous nerve graft, collagen conduit, and processed allograft (AxoGen). Journal of Bone and Joint Surgery American. 94 (5), 410-417 (2012).
- Stossel, M., Rehra, L., Haastert-Talini, K. Reflex-based grasping, skilled forelimb reaching, and electrodiagnostic evaluation for comprehensive analysis of functional recovery-The 7-mm rat median nerve gap repair model revisited. Brain and Behavior. 7 (10), 00813 (2017).
- Nikkhah, G., Rosenthal, C., Hedrich, H. J., Samii, M. Differences in acquisition and full performance in skilled forelimb use as measured by the 'staircase test' in five rat strains. Behavioral Brain Research. 92 (1), 85-95 (1998).
- Whishaw, I. Q., Gorny, B., Foroud, A., Kleim, J. A. Long-Evans and Sprague-Dawley rats have similar skilled reaching success and limb representations in motor cortex but different movements: some cautionary insights into the selection of rat strains for neurobiological motor research. Behavioral Brain Research. 145 (1-2), 221-232 (2003).
- Navarro, X. Functional evaluation of peripheral nerve regeneration and target reinnervation in animal models: a critical overview. European Journal of Neuroscience. 43 (3), 271-286 (2016).
- Costa, L. M., Simões, M. J., Maurício, A. C., Varejão, A. S. P. . International Review of Neurobiology. 87, 127-139 (2009).
- Ronchi, G., et al. Functional and morphological assessment of a standardized crush injury of the rat median nerve. Journal of Neuroscience Methods. 179 (1), 51-57 (2009).
- Raimondo, S., et al. Chapter 5: Methods and protocols in peripheral nerve regeneration experimental research: part II-morphological techniques. International Reviews in Neurobiology. 87, 81-103 (2009).
- Bontioti, E. K. M., Dahlin, L. B. Regeneration and functional recovery in the upper extermity of rats after various types of nerve injuries. Journal of the Peripheral Nervous System. 8, 159-168 (2003).
- Schönfeld, L. M., Dooley, D., Jahanshahi, A., Temel, Y., Hendrix, S. Evaluating rodent motor functions: Which tests to choose. Neuroscience & Biobehavioral Reviews. 83, 298-312 (2017).
- Urbancheck, M. S. Rat walking tracks do not reflect maximal muscle force capacity. Journal of Reconstructive Microsurgery. 15 (2), 143-149 (1999).
- Cudlip, S. A., Howe, F. A., Griffiths, J. R., Bell, B. A. Magnetic resonance neurography of peripheral nerve following experimental crush injury, and correlation with functional deficit. Journal of Neurosurgery. 96 (4), 755-759 (2002).
- Wang, Y., Sunitha, M., Chung, K. C. How to measure outcomes of peripheral nerve surgery. Hand Clinics. 29 (3), 349-361 (2013).
- Wang, H., Spinner, R. J., Sorenson, E. J., Windebank, A. J. Measurement of forelimb function by digital video motion analysis in rat nerve transection models. Journal of the Peripheral Nervous System. 13 (1), 92-102 (2008).
- Yanase, Y., Tamai, S., Usui, M., Yoshizu, T. . Experimental and Clinical Reconstructive Microsurgery. , 44-51 (2004).
- Barton, M. J., et al. Morphological and morphometric analysis of the distal branches of the rat brachial plexus. Italian Journal of Anatomy and Embryology. 121 (3), 240-252 (2016).
- Vincent, R., Slutsky, D. J., Hentz, V. R. Adult and obstetrical brachial plexus injuries. Peripheral Nerve Surgery: Practical applications in the upper extremity. , 299-317 (2006).
- Dahlin, L. B., Slutsky, D. J., Hentz, V. R. . Peripheral Nerve Surgery: Practical Applications in the Upper Extremity. , 1-22 (2006).
- Vargel, I., et al. A comparison of various vascularization-perfusion venous nerve grafts with conventional nerve grafts in rats. Journal of Reconstructive Microsurgery. 25 (7), 425-437 (2009).
- Grinsell, D., Keating, C. Peripheral nerve reconstruction after injury: a review of clinical and experimental therapies. BioMed Research International. 2014, 698256 (2014).
- Wang, D., et al. A simple model of radial nerve injury in the rhesus monkey to evaluate peripheral nerve repair. Neural Regeneration Research. 9 (10), 1041-1046 (2014).
- Casal, D., et al. Unconventional Perfusion Flaps in the Experimental Setting: A Systematic Review and Meta-Analysis. Plastic Reconstructive Surgery. 143 (5), 1003-1016 (2019).
- Bontioti, E. . End-to-side nerve repair. A study in the forelimb of the rat. , (2005).
- Bodine-Fowler, S. C., Meyer, R. S., Moskovitz, A., Abrams, R., Botte, M. J. Inaccurate projection of rat soleus motoneurons: a comparison of nerve repair techniques. Muscle Nerve. 20 (1), 29-37 (1997).
- Valero-Cabre, A., Navarro, X. H reflex restitution and facilitation after different types of peripheral nerve injury and repair. Brain Research. 919 (2), 302-312 (2001).
- Wall, P. D., et al. Autotomy following peripheral nerve lesions: experimental anaesthesia dolorosa. Pain. 7 (2), 103-111 (1979).
- Bertelli, J. A., Taleb, M., Saadi, A., Mira, J. C., Pecot-Dechavassine, M. The rat brachial plexus and its terminal branches: an experimental model for the study of peripheral nerve regeneration. Microsurgery. 16, 77-85 (1995).
- Wood, M. J., Johnson, P. J., Myckatyn, T. M., Mackinnon, S. E., Yee, A. . Nerve Surgery Vol. 1. , 1-40 (2015).
- Rosberg, H. E. Epidemiology of hand injuries in a middle-sized city in southern Sweden - a retrospective study with an 8-year interval. Scandinavian Journal of Plastic and Reconstructive Surgery and Hand Surgery. 38, 347-355 (2004).
- Gordon, T., Borschel, G. H. The use of the rat as a model for studying peripheral nerve regeneration and sprouting after complete and partial nerve injuries. Experimental Neurology. 287, 331-347 (2017).
- Bertelli, J. A., Ghizoni, M. F. Concepts of nerve regeneration and repair applied to brachial plexus reconstruction. Microsurgery. 26 (4), 230-244 (2006).
- Bertelli, J. A., Mira, J. C. Behavioural evaluating methods in the objective clinical assessment of motor function after experimental brachial plexus reconstruction in the rat. Journal of Neuroscience Methods. 46, 203-208 (1993).
- Bertelli, J. A., Mira, J. C. The grasping test: a simple behavioral method for objective quantitative assessment of peripherla nerve regeneration in the rat. Journal of Neuroscience Methods. 58 (1-2), 151-155 (1995).
- Ronchi, G., et al. Standardized crush injury of the mouse median nerve. Journal of Neuroscience Methods. 188 (1), 71-75 (2010).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados