É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ajustando a acidez dos catalisadores pt/CNTs para Hidrodesoxigenação de éter difenílico
Neste Artigo
Resumo
Um protocolo para a síntese de HNbWO6, hnbmoo6, htawo6 nanosheet ácido sólido modificado pt/cnts é apresentado.
Resumo
Apresentamos aqui um método para a síntese de HNbWO 6, hnbmoo6, htawo6 Nanosheet de ácido sólido modificado pt/cnts. Variando o peso de vários nanosheets ácidos sólidos, uma série de pt/xHMNO6/cnts com diferentes composições de ácido sólido (x = 5, 20 WT%; M = NB, ta; N = mo, W) foram preparados por pré-tratamento de nanotubos de carbono, troca protônica, esfoliação ácida sólida, agregação e finalmente impregnação de partículas pt. O pt/xHMNO6/cnts é caracterizado por difração de raios X, microscopia eletrônica de varredura, microscopia eletrônica de transmissão e dessorção programada de3temperaturas do NH. O estudo revelou que hnbwo6 nanofolhas foram anexados em cnts, com algumas bordas das nanofolhas que estão sendo dobradas na forma. A resistência ácida dos catalisadores pt suportados aumenta na seguinte ordem: pt/CNTs < pt/5HNbWO6/cnts < pt/20HNbMoO6/cnts ≪ pt/20hnbwo6/cnts < pt/20htawo6/cnts. Além disso, foi investigada a hidroconversão catalítica do composto modelo derivado de lignina: éter difenilo utilizando o catalisador pt/20HNbWO6 sintetizado.
Introdução
Muitos processos industriais para a fabricação de produtos químicos envolvem o uso de ácido inorgânico aquoso. Um exemplo típico é o processo H2so4 convencional para a hidratação do ciclohexano para produzir ciclohexanol. O processo envolve um sistema bifásico, sendo o ciclohexano na fase orgânica e o produto ciclohexanol na fase aquosa ácida, dificultando assim o processo de separação por simples destilação. Aparte da dificuldade na separação e na recuperação, o ácido inorgânico é igualmente altamente tóxico e corrosivo ao equipamento. Por vezes, o uso de ácido inorgânico gera subprodutos que baixarão o rendimento do produto e devem ser evitados. Por exemplo, a desidratação de 2-ciclohexeno-1-ol para produzir 1,3-ciclohexadieno usando H2so4 levará a subprodutos de polimerização1. Assim, muitos processos industriais mudam para o uso de catalisadores de ácidos sólidos. Os vários ácidos contínuos tolerantes à água são usados para resolver o problema acima e para maximizar os rendimentos do produto, tais como o uso de HZSM-5 e de Amberlyst-15. O uso do zeólita hzsm-5 da elevado-sílica foi mostrado para substituir H2assim4 na produção de ciclohexanol do benzeno2. Uma vez que a zeólita está presente na fase aquosa neutra, o produto vai para a fase orgânica exclusivamente, simplificando assim o processo de separação. Entretanto, devido à formação aduto ácido-base de Lewis de moléculas de água aos locais ácidos de Lewis, os materiais zeólitico ainda demonstraram uma mais baixa seletividade devido à presença de locais inativos3. Entre todos estes ácidos sólidos, NB2o5 é um dos melhores candidatos que contêm tanto Lewis e Brønsted sites de ácido. A acidez do NB2o5∙ NH2o equivale a uma solução de 70% H2assim4 , devido à presença dos prótons lábil. A acidez de Brønsted, que é comparável aos materiais Protonic do zeólita, é muito elevada. Esta acidez vai se transformar em Lewis acidez após a eliminação da água. Na presença de água, NB2o5 forma o tetraédrico NBO4-H2o Adducts, que pode diminuir na acidez de Lewis. Entretanto, os locais ácidos de Lewis são ainda eficazes desde que o NBO4 tetraédricos ainda tem cargas positivas eficazes4. Tal fenômeno foi demonstrado com sucesso na conversão da glicose em 5-(hydroxymethyl) furfural (HMF) e no allylation do benzaldeído com lata do tetraallyl na água5. Os catalisadores tolerantes à água são, portanto, cruciais na conversão de biomassa em aplicações de energias renováveis, especialmente quando as conversões são realizadas em solventes ambientais benignos, como água.
Entre os muitos catalisadores de ácidos sólidos benignos ambientais, os nanomateriais de carbono funcionalizados usando grafeno, nanotubos de carbono, nanofibras de carbono, materiais de carbono mesoporosos têm desempenhado um papel importante na valorização da biomassa devido à porosidade sintonável, área de superfície específica extremamente elevada, e hidrofobicidade excelente6,7. Os derivados sulfonados são materiais catalíticos protónicos particularmente estáveis e altamente ativos. Podem ser preparados por carbonização incompleta de compostos aromáticos sulfonados8 ou por sulfonação de açúcares incompletamente carbonizados9. Eles provaram ser catalisadores muito eficientes (por exemplo, para a esterificação de ácidos graxos mais elevados) com atividade comparável ao uso do líquido H2so4. Os grafenos e CNTs são materiais de carbono com uma grande área de superfície, excelentes propriedades mecânicas, boa resistência ácida, distribuições de tamanho de poros uniformes, bem como resistência ao depósito de coque. O grafeno sulfonado foi encontrado para catalisar eficientemente a hidrólise do acetato de etilo10 e os catalisadores bifuncionais do grafeno foram encontrados para facilitar a conversão do um-potenciômetro do ácido levullinic ao γ-valerolactone11. Os metais bifuncionais apoiados em cnts também são catalisadores muito eficientes para aplicação na conversão de biomassa12,13, como a oxidação aeróbia altamente seletiva de HMF para 2,5-diformylfuran sobre o vo2-Pani/CNT catalisador14.
Aproveitando as propriedades únicas de NB2o5 de ácido sólido, funcionalizados cnts e metal bifuncional apoiado em cnts, nós relatamos o protocolo para a síntese de uma série de NB (ta)-baseado nanosheet ácido sólido modificado pt/cnts com um alto área de superfície por um método de agregação de nanofolhas. Além disso, Nós demonstramos que pt/20hnbwo6/cnts, em conseqüência do efeito sinérgica de partículas bem dispersas do pinta e de locais ácidos fortes derivados de nanosheets de hnbwo6 , exibem a melhor atividade e seletividade em converter compostos de modelo derivado de lignina em combustíveis por hidrodesoxigenação.
Protocolo
PRECAUÇÃO: para os métodos de manuseamento adequados, as propriedades e as toxicidades dos produtos químicos descritos neste artigo, consulte as fichas de dados de segurança de material (MSDS) relevantes. Alguns dos produtos químicos utilizados são tóxicos e carcinogénicos e cuidados especiais devem ser tomados. Os nanomateriais podem potencialmente representar riscos de segurança e efeitos para a saúde. Deve-se evitar a inalação e o contacto com a pele. As precauções de segurança devem ser exercidas, tais como a realização da síntese do catalizador no exaustor e a avaliação do desempenho do catalizador com reatores da autoclave. Equipamento de protecção pessoal deve ser usado.
1. pré-tratamento de CNTs13
- Mergulhe 1,0 g de CNTs em 50 mL de ácido nítrico em um copo de 100 mL.
- SONICATE a solução em 25 ° c para 1,5 h para remover impurezas de superfície e para realçar o efeito de ancoragem do catalizador.
- Transfira a solução para um balão de fundo redondo de 100 mL.
- Refluxo a solução em uma mistura de ácido nítrico (65%) e ácido sulfúrico (98%) a 60 ° c durante a noite. Defina a proporção de volume em 3:1. Isto criará defeitos de superfície no CNTs.
- Filtre a solução para obter o sólido de nanotubos de carbono multiparede. Lave o sólido com água deionizada.
- Seque o sólido a 80 ° c por 14 h.
2. preparação de HNbWO6 nanofolhas de ácido sólido15 por troca protônica seguida de esfoliação
- Misture quantidades estequiométricas de Li2co3 (0,9236 g) e óxidos metálicos NB2O5 (3,3223 g) e wo3 (5,7963 g) em uma relação molar de 1:1:2.
- Calcine a mistura contínua em 800 ° c para 24 h com uma moedura intermediária.
- Colocar 10,0 g de LiNbWO6 pó em 200 ml de solução aquosa de 2 M HNO3 a 50 ° c e agitar a mistura de solução durante 5 dias (120 h) com uma substituição do ácido a 60 h.
- Troque o líquido ácido todos os dias e repita o passo 2,3.
- Filtre o sólido e lave o sólido com água deionizada 3x.
- Seque o sólido a 80 ° c durante a noite.
- Adicione uma quantidade de 25 WT.% TBAOH (Tetra (n-butilamónio) hidróxido) solução para 150 mL de solução de água desionizada com 2,0 g de composto protonado obtido na etapa 2,6 até que o pH atinja 9,5 – 10,0.
- Mexa a solução acima por 7 dias.
- Centrifugue a solução acima e colete a solução sobrenadante que contém as nanofolhas dispersas.
3. preparação de nanofolhas de ácido sólido HNbMO6
Observação: o procedimento é semelhante ao da etapa 2, exceto para a primeira e terceira etapas.
- Misture quantidades estequiométricas de Li2co3 e óxidos metálicos NB2O5 e Moo3 em uma proporção molar de 1:1:2.
- Calcine as misturas contínuas acima em 800 ° c no ar para 24 h com uma moedura intermediária.
- Coloc 10,0 g do pó de LiNbMoO6 em 200 ml da solução aquosa de 2 M HNO3 em 50 ° c e mexa a mistura da solução por 5 dias (120 h) com uma recolocação do ácido em 60 h.
4. preparação de htawo6 nanofolhas ácidos sólidos
Observação: o procedimento é semelhante ao da etapa 2, exceto para a primeira e terceira etapas.
- Misture quantidades estequiométricas de Li2co3 e óxidos metálicos ta2O5 e wo3 em uma proporção molar de 1:1:2.
- Calcine as misturas contínuas acima em 900 ° c no ar para 24 h com uma moedura intermediária.
- Colocar 10,0 g de LiTaWO6 pó em 200 ml de solução aquosa de 2 M HNO3 a 50 ° c e agitar a mistura de solução durante 5 dias (120 h) com uma substituição do ácido a 60 h.
5. preparação de HNbWO6/Mwcnts pelo método de agregação de nanofolhas
- Adicionar 2,0 g de CNTs multiparede obtidos na etapa 1 a uma solução de 100 mL de nanofolhas de HNbWO6 em um balão de fundo redondo de 250 ml.
- Adicionar 100 mL de 1,0 M HNO3 solução aquosa no balão de fundo redondo Dropwise. Isso agregará as amostras de nanofolhas.
- Continuar a agitar a solução a 50 ° c durante 6 h.
- Filtre o sólido e lave o sólido com água deionizada 3x.
- Seque o sólido a 80 ° c durante a noite.
- Pesar o sólido seco e gravar o% de carga do ácido sólido sobre o MWCNT.
6. preparação de pt/20HNbWO6/cnts pelo método da impregnação
- Dissolver o H2PTCL6∙ h2o em água (1,0 g/100 ml).
- Impregnar as nanofolhas preparadas com materiais CNTs modificados com 1,34 mL da solução aquosa pt acima.
- Seque os materiais dos nanofolhas cnts em 80 ° c, e calcinar os materiais em 400 ° c por 3 h.
- Obter as nanofolhas de ácido sólido com base em NB (ta) modificadas catalisadores pt/CNTs.
7. hidrodesoxigenação do éter aromático derivado da lignina
Nota: o éter aromático derivado de lignina escolhido é o éter difenilo neste experimento. O éter aromático derivado de lignina escolhido é o éter difenilo neste experimento. A atividade de pt/20HTaWO6/cnts (88,8% de conversão, não mostrada neste artigo) é menor que pt/20HNbWO6/cnts (99,6%), assim o rendimento de ciclohexano diminui. Assim, porém, maior seletividade do ciclohexano foi obtida sobre pt/20HTaWO6/cnts, menor conversão de éter difenílico limita sua utilização. Usando o equipamento de proteção apropriado e a capa das emanações para executar a reação usando reagentes carcinogénicos.
- Diluir 0, 5 gramas de catalisador em 5 mililitros de areia de quartzo. Carregue a solução no meio de um reator fixo da cama entre dois descansos da lã de quartzo.
- Reduza o catalisador em H2 (40 ml/min) a 300 ° c durante 2 h.
- Bombeie as matérias-primas do éter do difenil (que incluem o reagente do WT.% 5,0 no n-decane e 2,0 WT.% n-dodecane como um padrão interno para a análise da cromatografia de gás) no reator fixo da cama em taxas de fluxo diferentes (0.05-0.06 ml/min)
- Colete os produtos em diferentes tempos de espaço definidos como a razão entre a massa do catalisador W (g) e a vazão do substrato F (g/min).
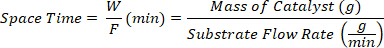
- Identificar os produtos líquidos por um GC (HP-5, 30 m x 0,32 mm x 0,25 μm) com 5977A MSD e analisar off-line por cromatografia gasosa (GC 450, FID, FFAP coluna capilar 30 m x 0,32 mm x 0,25 μm).
- Determinar a conversão de reagentes (conv.%), seletividade em relação ao produto i (Si %) e rendimento do produto i (Yi %) usando as seguintes equações:
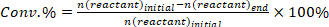 1
1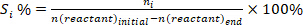 2
2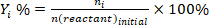 3
3
Resultados
Os testes padrões da difração de raio X (XRD) foram estudados para o precursor LiNbWO6 e o correspondente Proton-trocaram a amostra HNbWO6 do catalizador para determinar a fase (Figura 1 e Figura 2). A dessorção programada de3temperaturas do NH (NH3-TPD) foi utilizada para sondar a acidez superficial das amostras de catalisador (Figura 3). Microscopia eletrônica d...
Discussão
O pré-tratamento de CNTs com ácido nítrico aumenta significativamente a área de superfície específica (SBet). Os CNTs crus têm uma área de superfície específica de 103 m2/g quando após o tratamento, a área de superfície foi aumentada a 134 m2/g. Conseqüentemente, tal pré-tratamento para criar defeitos na superfície de CNT terá um efeito positivo na área de superfície específica nos catalisadores após a modificação ácida contínua e a impregnação da partícula da ...
Divulgações
Não temos nada a revelar.
Agradecimentos
O trabalho descrito neste artigo foi integralmente apoiado por uma subvenção do Conselho de auxílios à pesquisa da região administrativa especial de Hong Kong, China (UGC/FDS25/E09/17). Nós também reconhecemos com gratidão a National natural Science Foundation da China (21373038 e 21403026) para fornecer instrumentos analíticos para a caracterização do catalisador e reator de leito fixo para a avaliação de desempenho do catalisador. Dr. Hongxu QI gostaria de agradecer para o Assistantship da pesquisa concedido pelo Conselho de concessões da pesquisa de Hong Kong (UGC/FDS25/E09/17).
Materiais
| Name | Company | Catalog Number | Comments |
| Carbon nanotubes (multi-walled) | Sigma Aldrich | 724769 | |
| Nitric acid (65%) | Sigma Aldrich | V000191 | |
| sulphuric acid (98%) | MERCK | 100748 | |
| Lithium carbonate (>99%) | Aladdin | L196236 | |
| Niobium pentaoxide (99.95%) | Aladdin | N108413 | |
| Tungsten trioxide (99.8%) | Aladdin | T103857 | |
| Molybdenum trioxide (99.5%) | Aladdin | M104355 | |
| Tantalum oxide (99.5%) | Aladdin | T104746 | |
| Chloroplatinic acid hexahydrate, ≥37.50% Pt basis | Sigma Aldrich | 206083 | |
| tetra (n-butylammonium) hydroxide 30-hydrate | Aladdin | D117227 | |
| Diphenyl ether, 98% | Aladdin | D110644 | |
| 2-Bromoacetophenone,98% | Aladdin | B103328 | |
| Diethyl ether,99.5% | Sinopharm | 10009318 | |
| n-Decane,98% | Aladdin | D105231 | |
| n-Dodecane,99% | Aladdin | D119697 | |
| Autoclave Reactor | CJF-0.05—0.1L (Dalian Tongda Equipment Technology Development Co., Ltd) | ||
| Tube furnace | SK2-1-10/12 (Luoyang Huaxulier Electric Stove Co., Ltd) |
Referências
- Jensen, J. L., Uaprasert, V., Fujii, C. R. Acid-Catalyzed Hydration of Dienes. 2. Changes in Activity Coefficient Ratios, Enthalpy, and Entropy as a Function of Sulfuric Acid Concentration. Journal of Organic Chemistry. 41 (10), 1675-1680 (1976).
- Ishida, H., Ono, M., Kaji, S., Watanabe, A. Synthesis of 1,3-Cyclohexadiene through Liquid Phase Dehydration of 2-Cyclohexen-1-ol in Aqueous Solution using Zeolite Catalyst. Nippon Kagaku Kaishi. 4, 267-275 (1997).
- Ishida, H. Liquid-phase hydration process of cyclohexene with zeolites. Catalysis Surveys from Japan. , 241-246 (1997).
- Ushikubo, T., Iizuka, T., Hattori, H., Tanabe, K. Preparation of highly acidic hydrated niobium oxide. Catalysis Today. 16, 291-295 (1993).
- Nakajima, K., et al. Nb2O5.nH2O as a heterogeneous catalyst with water-tolerant Lewis acid sites. Journal of the American Chemical Society. 133 (12), 4224-4227 (2011).
- Lam, E., Luong, J. H. T. Carbon Materials as Catalyst Supports and Catalysts in the Transformation of Biomass to Fuels and Chemicals. ACS Catalysis. 4 (10), 3393-3410 (2014).
- Sudarsanam, P., et al. Functionalised heterogeneous catalysts for sustainable biomass valorisation. Chemical Soceity Review. 47 (22), 8349-8402 (2018).
- Hara, M., et al. A carbon material as a strong protonic acid. Angewandte Chemie International Edition English. 43 (22), 2955-2958 (2004).
- Toda, M., et al. Biodiesel made with sugar catalyst. Nature. 438 (7065), (2005).
- Ji, J., et al. Sulfonated graphene as water-tolerant solid acid catalyst. Chemical Science. 2 (3), 484-487 (2011).
- Wang, Y., et al. Graphene-Based Metal/Acid Bifunctional Catalyst for the Conversion of Levulinic Acid to γ-Valerolactone. ACS Sustainable Chemistry & Engineering. 5 (2), 1538-1548 (2016).
- Ma, Q., et al. Catalytic depolymerization of lignin for liquefied fuel at mild condition by rare earth metals loading on CNT. Fuel Processing Technology. , 220-225 (2017).
- Rahzani, B., Saidi, M., Rahimpour, H. R., Gates, B. C., Rahimpour, M. R. Experimental investigation of upgrading of lignin-derived bio-oil component anisole catalyzed by carbon nanotube-supported molybdenum. RSC Advances. 7 (17), 10545-10556 (2017).
- Guo, Y., Chen, J. Bicomponent Assembly of VO2and Polyaniline-Functionalized Carbon Nanotubes for the Selective Oxidation of Biomass-Based 5-Hydroxymethylfurfural to 2,5-Diformylfuran. ChemPlusChem. 80 (12), 1760-1768 (2015).
- He, J., et al. Characterization of HNbMoO6, HNbWO6 and HTiNbO5 as solid acids and their catalytic properties for esterification reaction. Applied Catalysis A: General. , 145-152 (2012).
- Tagusagawa, C., Takagaki, A., Hayashi, S., Domen, K. Characterization of HNbWO6 and HTaWO6 Metal Oxide Nanosheet Aggregates As Solid Acid Catalysts. Journal of Physical Chemistry C. 113, 7831-7837 (2009).
- Niwa, M., Katada, N., Sawa, M., Murakami, Y. Temperature-Programmed Desorption of Ammonia with Readsorption Based on the Derived Theoretical Equation. Journal of Physical Chemistry. 99, 8812-8816 (1995).
- Leiva, K., et al. Conversion of guaiacol over supported ReOx catalysts: Support and metal loading effect. Catalysis Today. , 228-238 (2017).
- Deng, W., Liu, M., Tan, X., Zhang, Q., Wang, Y. Conversion of cellobiose into sorbitol in neutral water medium over carbon nanotube-supported ruthenium catalysts. Journal of Catalysis. 271 (1), 22-32 (2010).
- Huang, B., Huang, R., Jin, D., Ye, D. Low temperature SCR of NO with NH3 over carbon nanotubes supported vanadium oxides. Catalysis Today. 126 (3-4), 279-283 (2007).
- Takagaki, A., Tagusagawa, C., Hayashi, S., Hara, M., Domen, K. Nanosheets as highly active solid acid catalysts for green chemical syntheses. Energy & Environmental Science. 3 (1), 82-93 (2010).
- Hu, L. -. F., et al. Structure and photocatalytic performance of layered HNbWO6nanosheet aggregation. Journal of Nanophotonics. 9 (1), (2015).
- Geim, A. K. Graphene: Status and Prospects. Science. 324, 1530-1534 (2009).
- Golberg, D., et al. Boron Nitride Nanotubes and Nanosheets. ACS Nano. 4 (6), 2979-2993 (2010).
- Wilson, J. A., Yoffe, A. D. The transition metal dichalcogenides discussion and interpretation of the observed optical, electrical and structural properties. Advances in Physics. 18 (73), 193-335 (1969).
- Ma, R., Sasaki, T. Nanosheets of oxides and hydroxides: Ultimate 2D charge-bearing functional crystallites. Advanced Materials. 22 (45), 5082-5104 (2010).
- Pope, T. R., Lassig, M. N., Neher, G., Weimar Iii, R. D., Salguero, T. T. Chromism of Bi2WO6 in single crystal and nanosheet forms. Journal of Materials Chemistry C. 2 (17), 3223-3230 (2014).
- Yu, Y., et al. Controlled scalable synthesis of uniform, high-quality monolayer and few-layer MoS2 films. Scientific Reports. 3, 1866 (2013).
- Prasomsri, T., Shetty, M., Murugappan, K., Román-Leshkov, Y. Insights into the catalytic activity and surface modification of MoO3 during the hydrodeoxygenation of lignin-derived model compounds into aromatic hydrocarbons under low hydrogen pressures. Energy & Environmental Science. 7 (8), 2660-2669 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados