Method Article
Agarose reticulada ativada para o rápido desenvolvimento de resinas de cromatografia de afinidade-captura de anticorpos como um estudo de caso
Neste Artigo
Resumo
Neste procedimento, um ligante de epítopo baseado em DsRed é imobilizado para produzir uma resina de afinidade altamente seletiva para a captação de anticorpos monoclonais de extratos de plantas brutas ou sobrenadantes de cultura celular, como uma alternativa à proteína A.
Resumo
A purificação de anticorpos monoclonais (mAbs) é comumente alcançada por cromatografia de afinidade protein A, que pode ser responsável por até 25% dos custos gerais do processo. As etapas de captura alternativas e rentáveis são, portanto, valiosas para a produção em escala industrial, onde são produzidas grandes quantidades de um mAb único. Aqui nós apresentamos um método para a imobilização de um ligante dsred-baseado do epítopo mapeado a uma resina Cross-linked do agarose permitindo a captação seletiva do anticorpo 2f5 do HIV-neutralizing dos extratos crus da planta sem usar a proteína a. O epítopo linear ELDKWA foi primeiramente fundido geneticamente para a proteína fluorescente DsRed e a proteína de fusão foi expressa em plantas de tabaco transgênica (Nicotiana tabacum) antes da purificação por cromatografia de afinidade de íons metálicos imobilizados. Além disso, um método baseado no agarose reticulado ativado foi otimizado para alta densidade de ligantes, acoplamento eficiente e baixos custos. O pH e a composição tampão e a concentração de ligante solúvel foram os parâmetros mais importantes durante o procedimento de acoplamento, o que foi melhorado usando uma abordagem de design de experimentos. A resina de afinidade resultante foi testada por sua capacidade de ligar seletivamente o mAb alvo em um extrato de planta bruta e o tampão de eluição foi otimizado para alta recuperação de mAb, atividade do produto e estabilidade da resina de afinidade. O método pode ser facilmente adaptado a outros anticorpos com epítopos lineares. As novas resinas permitem condições de eluição mais suaves do que a proteína A e também podem reduzir os custos de uma etapa de captura inicial para a produção de mAb.
Introdução
Os produtos biofarmacêuticos são importantes para o tratamento de um amplo espectro de doenças em quase todos os ramos da medicina1. Os anticorpos monoclonais (mAbs) dominam o mercado biofarmacêutico, com as vendas mundiais esperadas alcançar quase $110000000000 em 20202. A plataforma de expressão favorecida para mAbs são as linhagens de células de ovário de hamster chinês, que tipicamente produzem altos títulos de MAB de até 10 g ∙ L-1 no sobrenadante de cultura3,4. No entanto, a produção de mAbs em culturas de células de mamíferos é dispendiosa devido ao alto custo do meio e à necessidade de fermentação estéril5. As plataformas de expressão alternativa, como as plantas, potencialmente oferecem uma abordagem mais rápida, simples, menos dispendiosa e mais escalável para a manufatura industrial6,7.
Além dos custos associados às culturas de células de mamíferos, o uso generalizado de cromatografia de afinidade protein A para captação de produtos é um importante condutor de custos para a produção industrial de mAbs. A proteína a é encontrada naturalmente na superfície de pilhas de Staphylococcus aureus e liga-se à região cristalizável do fragmento (FC) de determinados anticorpos murino e humanos, agindo desse modo como um mecanismo da defesa para evadir o sistema imune humoral8. A proteína A tornou-se o padrão de ouro da indústria para a captura de mAbs de sobrenadantes de cultura celular e também é amplamente utilizado pela comunidade de pesquisa porque é altamente seletivo, tipicamente conseguindo puridades de mAb de ~ 95% em um único passo8. Sem surpresa, as vendas de proteína A nas últimas duas décadas têm espelhado de perto as vendas de mAbs8. Dependendo da escala de produção, os custos da proteína a podem corresponder a mais de 25% dos custos totais do processo e, assim, afetam o preço de mercado dos mAbs terapêuticos, que podem ser até $2000 g-15,6. Portanto, resinas de cromatografia alternativa com um desempenho de purificação semelhante têm o potencial de reduzir substancialmente os custos de produção, tornando as terapias baseadas em anticorpos acessíveis para um maior número de pacientes10,11 ,12. Tais alternativas também podem contornar as desvantagens da cromatografia de proteína A, incluindo as condições de eluição duras em pH baixo (tipicamente < 3,5) que podem potencialmente causar mAbs a sofrer alterações conformacionais que promovem a agregação13 . Importante, a proteína A é seletiva somente para a região de FC de determinadas subclasses de IgG, assim que as moléculas não-funcionais com domínios de ligação truncados podem co-purify com o produto intacto5, visto que Derivaties do MAB tais como fragmentos da variável da único-cadeia Não se ligam à proteína A.
Aqui, nós descrevemos uma resina alternativa da cromatografia da afinidade para a captação do MAB 2f5 de neutralização do HIV usando seu epítopo mapeado linear eldkwa (um código do ácido aminado da letra)5,14. Nós fundimos genetically o epítopo 2f5 ao C-Terminus da proteína fluorescente dsred, que funcionou como uma molécula do portador e do repórter, e produziu a proteína resultante Dsred-2F5-Epitope (DfE) no tabaco transgênicas ( Tabacum de Nicotiana) plantas. A DFE foi purificada por cromatografia de afinidade de íons metálicos imobilizados de passo único (IMAC). A imobilização do ligante purified da afinidade de DFE em uma resina Cross-linked do agarose foi conseguida pelo acoplamento químico usando colunas Cross-linked do Agarose do N-Hydroxysuccinimide (NHS)-lig. Os experimentos estatísticos experimentais foram utilizados para otimizar o procedimento de imobilização e a eficiência de acoplamento15. A estratégia de purificação para o MAB 2f5 foi avaliada em termos de pureza do anticorpo, rendimento e estabilidade do ligante. Em contraste com a proteína A, que liga a região FC, DFE vinculado à região de determinação de complementaridade de 2F5, assegurando a purificação de moléculas com um paratope intacto. Nosso conceito pode facilmente ser adaptado a todo o MAB com um epítopo linear ou a outros ligantes peptide-baseados da afinidade que podem facilmente ser identificados por estudos do microarray16.
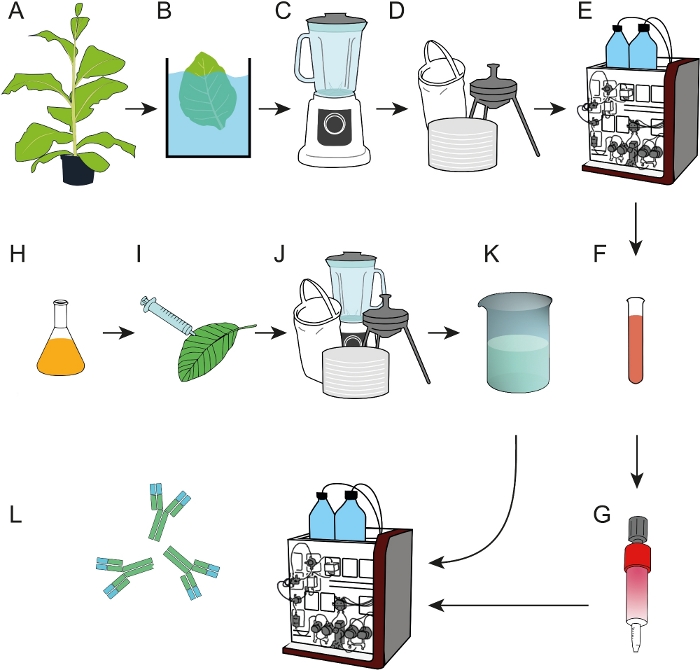
Figura 1: esquema de fluxo do processo para a preparação de resinas de afinidade epítopo mapeado que podem ser utilizadas para a captação de mAbs de extratos de plantas brutas ou sobrenadantes de cultura celular. (A) o ligante de afinidade DFE foi expressado em plantas de tabaco transgénicas. Uma etapa de precipitação do calor (B) foi incluída antes que as folhas colhidas fossem homogeneizadas (C). (D) o extrato de planta bruta foi esclarecido por filtração de saco, filtração de profundidade e filtração estéril de 0,2 μm. (E) o DFE foi então purificado pelo iMac. (F, G) O ligante purified da afinidade de DFE foi imobilizado em colunas de agarose reticuladas EDC/NHS-ativadas. (H) culturas bacterianas portadoras de anticorpos de codificação T-DNA 2f5 foram utilizadas para expressão transitória em plantas de N. javanica (I) cultivadas em fitontron. (J) as folhas de N. javanica foram colhidas e processadas conforme descrito em D. (K) Mab 2f5 foi purificada a partir do extrato esclarecido utilizando as colunas de afinidade DFE (L). Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
1. cultivar as plantas de tabaco transgênicas
Nota: O projeto da proteína de fusão DFE e a geração de plantas transgênicas são descritos em outros lugares5,17.
- Germinar as mudas transgênicas de tabaco no solo. Irrigar as plantas com um 1,0 g · L-1 solução de fertilizante. Transfira as plantas para únicos, 100 milímetros x 100 milímetros x 60 milímetros (comprimento, largura, altura) potenciômetros quando crescem a um diâmetro de ~ 0, 4 m.
- Cultivar as plantas de tabaco transgênicas em estufa com fotoperíodo de 16 h (25/22 ° c/regime de temperatura escura), com 70% de umidade relativa e adubação automatizada com 1,0 g · L-1 solução de fertilizante para 15 min a cada hora.
- Após 7 semanas, colher todas as folhas, exceto as quatro folhas de cotilédonas na base da haste da planta. Processe imediatamente as folhas colhidas como descrito abaixo.
2. precipitação do calor de proteínas de célula hospedeira
- Configurar um banho de água com um volume de trabalho de 20 L em uma embarcação aquecida de aço inoxidável (0,3 m x 0,3 m x 0,3 m). No início, coloque uma bomba magnética no banho de água para agitar o líquido permanentemente com um fluxo de 5 L min-1. Monte um termostato ajustável no banho de água para o controle de temperatura (etapas 2,4 e 2,8).
Atenção: Todos os seguintes passos até 2,10 envolvem a manipulação de líquido quente. Use equipamentos de proteção individual adequados, incluindo luvas e óculos de proteção térmicos. - Adicione 15 L de água desionizada ao banho de água e aqueça o líquido a 70 ° c.
- Coloque um balde de 10 L preenchido com 5 L de água desionizada num agitador magnético. Adicionar fosfato de sódio a uma concentração final de 120 mM. Ajuste o pH para 8,14 usando ácido clorídrico de 10 M. Quando todos os componentes se dissolveram, adicione o tampão de branqueamento concentrado resultante (5 litros) ao banho de água da etapa 2,2.
- Agitar o banho de água até que a temperatura atinja 70 ° c. Use o ácido clorídrico de 10 M para ajustar o pH a 8,14 se necessário. Continue agitando por pelo menos 15 minutos após a temperatura exigida e o pH é alcangado para assegurar-se de que a montagem inteira esteja no equilíbrio térmico.
- Prepare um balde de 20 L (0,3 m x 0,3 m x 0,3 m) preenchido com água deionizada a uma temperatura de ~ 17 ° c (necessário para o passo 2,9).
- Prepare 400 g de alíquotas das folhas de tabaco colhidas do passo 1,3. Colocar uma alíquota numa cesta perfurada (0,2 m x 0,2 m x 0,2 m; largura do poro pelo menos 0, 2 m x 0, 2 m). Evite encher demais a cesta com material vegetal ou embalando as folhas muito firmemente para evitar danificar o tecido.
- Mergulhe totalmente a cesta no buffer de branqueamento quente da etapa 2,4 e certifique-se de que todas as folhas permaneçam a superfície líquida. Use uma colher termotérmica de silicone para segurar as folhas a superfície, se necessário.
- Incubar as folhas de tabaco por 1,5 min no fluido de branqueamento enquanto a bomba ainda está agitando o líquido. Monitore a temperatura líquida durante todo o período de incubação. Evite bloquear a entrada da bomba com folhas de tabaco.
- Retire a cesta de folhas de tabaco do tampão de branqueamento e escorra o tampão residual das folhas por 30 s. Transfira a cesta para o balde preenchido com água fria (da etapa 2,5) e mergulhe as folhas por 30 s. Retire a cesta e drenar a água residual do Le para 30 s antes da homogeneização (passo 3).
- Repita os passos 2,6 a 2,9 com alíquotas frescas de 2,6 até que toda a biomassa colhida seja processada. Monitore e ajuste constantemente o pH e a temperatura do tampão de branqueamento no banho de água.
Nota: O material de planta descascado pode ser armazenado no gelo por até 30 minutos quando vários ciclos de branqueamento são necessários para processar toda a biomassa. As folhas descascadas podem igualmente ser armazenadas em sacos vácuo-selados em-80 ° c por pelo menos 3 semanas. No entanto, o processamento imediato é recomendado porque o armazenamento prolongado pode reduzir o rendimento de DFE.
3. extração e clarificação de proteínas
Atenção: As etapas a seguir envolvem um liquidificador com lâminas rotativas. Não trabalhe no recipiente do liquidificador quando alimentado ou montado na unidade do motor.
- Coloque 150 g (massa úmida) de folhas de tabaco blanched (passo 2,9) no vaso liquidificador e adicione 450 mL de tampão de extração (50 mM de fosfato de sódio, 500 mM de cloreto de sódio, 10 mM de disulfito de sódio, pH 7,5). Feche a tampa do liquidificador firmemente para evitar o derramamento de material vegetal ou tampão.
- Homogeneizar as folhas para 3x por 30 s, com intervalos de 30 s entre cada pulso. Assegure-se de que todas as folhas são homogeneizadas e que nenhuma vara à parte superior da embarcação do misturador. Se necessário, abra o liquidificador durante as pausas e empurre as folhas que se enfiam na parte superior da embarcação, usando uma colher de silicone limpa.
- Após a homogeneização, tomar uma amostra de 1,0 mL do homogeneizar para posterior análise (passo 7).
- Recolher o homogeneato em um recipiente de tamanho adequado (por exemplo, se trabalhar com uma biomassa total de 1,0 kg, use um vaso com uma capacidade de pelo menos um 5 L). Repita os passos 3,1 a 3,3 até que toda a biomassa descascada seja homogeneizada.
- Monte um filtro de saco em uma montagem de filtro e coloque outra embarcação de tamanho adequado (ver 3,4) abaixo da montagem. Aplique o homogeneate ao filtro do saco em uma taxa de ~ 0,15 L min-1. Tome amostras do filtrado do saco após cada litro para a análise subseqüente (etapa 7) e meça o turbidez da associação do filtrado do saco como uma diluição 1:10 no amortecedor da extração usando um turbidímetro ou um dispositivo similar.
- Ainda mais esclarecer o saco de filtração piscina usando 0, 2 m2 de um K700 (Top) e KS50 (inferior) profundidade camada de filtro de combinação por litro de saco de filtração de piscina. Aplique uma vazão de 3,0 L min-1· m-2 até uma pressão máxima de 0,2 MPa. Em seguida, retire as partículas residuais passando o filtrado clarificado através de um filtro estéril de 0,2 μm, conforme descrito anteriormente5.
4. purificação do ligand da afinidade de DFE
- Prepare um sistema rápido de cromatografia líquida de proteínas por rubor com tampão de eluição (fosfato de sódio 10 mM, imidazol 300 mM, pH 7,4), tampão de lavagem (fosfato de sódio a 10 mM, pH 7,4) e tampão de equilíbrio (fosfato de sódio a 20 mM, cloreto de sódio a 500 mM, pH 7,4). Monte uma coluna contendo ~ 50 mL de resina de agarose reticulada quelante por quilograma de biomassa foliar (~ 2,5 L de filtrado de profundidade).
- Carregue a coluna com íons de níquel aplicando 5 volumes de coluna (CV) de solução de sulfato de níquel a 200 mM e lave-o com 5 CV de tampão de eluição. Use uma taxa de fluxo de 50 cm h-1 e monitore os sinais UV em 260, em 280 e em 558 nanômetro para todas as etapas subseqüentes da cromatografia.
- Equilibrar a coluna com 10 CV de tampão de equilibração. Em seguida, carregue 50 CV do extrato vegetal clarificado (da etapa 3,6) para a coluna condicionada.
- Lave a coluna com 10 CV de tampão de lavagem. Elute a proteína de fusão DFE com 5 tampão de eluição CV e recolher a fração contendo produto uma vez que os sinais UV em 280 nm e 558 nm aumentaram para mais de 5 mAU acima da linha de base.
- Pegue uma amostra de 0,2 mL da fração de eluição para medir a concentração de proteína solúvel total (TSP) (etapa 7,1), concentração de DFE (etapas 7,2 e 7,3) e pureza de DFE (etapa 7,4).
- Monte uma coluna contendo ~ 50 mL de resina de dextrano reticulada em um sistema de cromatografia. Equilibrar a coluna com 5 CV de tampão de acoplamento (200 mM HEPES, 500 mM cloreto de sódio, pH 8,5). Injete 10 mL da fração de eluição de DFE (passo 4,4) para troca de tampão e monitore a absorvância UV em 280 e 558 nm.
- Colete a fração contendo DFE uma vez que os sinais UV em 280 nm e 558 nm aumentaram para mais de 5 mAU acima da linha de base. Tome uma amostra de 0,2 mL e determine a concentração do TSP, a concentração de DFE, e a pureza de DFE (etapa 7).
- Concentre a amostra purificada de DFE (da etapa 4,7) a 15 g L-1 usando um tubo centrífugo do concentrador em 3.000 x g em 4 ° c por 30 minutos em uma centrífuga. Continuar com a reacção de acoplamento (passo 5).
Nota: Armazene a solução DFE a 4 ° c se as etapas de concentração ou acoplamento não puderem ser executadas imediatamente.
5. acoplamento DFE à resina de agarose reticulada ativada
Nota: Não substitua o isopropanol usado para o armazenamento de colunas ativadas pelo NHS até que todos os equipamentos e soluções para acoplamento estejam prontos. Nunca deixe as colunas secarem.
- Configurar um modelo de experimentos (DoE) para otimizar o acoplamento de DFE para a resina ativada, com pH, composição tampão e concentração de DFE como fatores. Os detalhes do método DoE são descritos em outros lugares15.
- Prepare a solução do ligante da afinidade (da etapa 4,8) em uma escala da concentração de 0.5-15 g · L-1 ou conforme definido na Doe e armazená-lo no gelo até que a reação de acoplamento esteja pronta (etapa 5,5). Encha pelo menos dez seringas de 2 mL com a solução de DFE e prepare um adaptador para montar as seringas nas colunas de agarose reticuladas NHS-ativadas com um volume de cama de 1,0 mL.
- Para cada 10 colunas utilizadas para acoplamento, prepare 30 mL de solução de desactivação (0,5 M de etanolamina, 0,5 M de cloreto de sódio, pH 8,3), 30 mL de solução de pH baixo (0,1 M de acetato de sódio, 0,5 M de cloreto de sódio, pH 4,0) e 10 mL de solução de armazenamento (0, 5 M fosfato dissódico , 0,1% (m/v) azida sódica, pH 7,0).
- Prepare 20 mL de ácido clorídrico de 1 mM num tubo e incubar-o no gelo durante, pelo menos, 20 min. Prepare uma balança de precisão para monitorizar as frações de fluxo para todas as etapas durante a reacção de acoplamento (passo 5,7).
- Abra uma coluna de agarose reticulada ativada pelo NHS selada e monte o adaptador da seringa na entrada da coluna. Evite que qualquer ar que entra na coluna aplicando uma gota de tampão na entrada do adaptador antes de conectá-lo à seringa.
- Lave a coluna com 6 mL de ácido clorídrico gelado de 1 mM (a partir do passo 5,4) a um caudal de < 1 mL min-1 e avance imediatamente para o passo 5,7.
- Injete 1,5 mL de solução de DFE (passo 5,2) utilizando uma seringa de 2 mL a um caudal de < 1 mL min-1 e recolha a fração de fluxo através de uma balança de precisão (passo 5,4) para análise subsequente (passo 7). Selar a coluna em ambas as extremidades e incubar por 15 – 45 min a 22 ° c, dependendo da configuração DoE.
- Injete 6 mL de solução de desactivação seguida de 6 mL de solução de pH baixo a uma vazão de < 1 mL min-1 para remover ligantes não covalentemente encadernados da resina. Em seguida, injete 6 mL de solução de desativação e incubar a coluna durante 15 min.
- Injete 6 mL de solução de pH baixo na coluna, seguida de 6 mL de solução de desativação. Em seguida, injete mais 6 mL de solução de pH baixo na coluna.
- Injete 2 mL de solução de armazenamento na coluna e armazene a 4 ° c.
6. testando a purificação de mAbs de extratos esclarecidos das plantas
- Prepare 100 mL de extrato de planta esclarecido contendo 2F55 ou o sobrenadante do sistema de expressão preferencial baseado em células, também contendo 2f5.
- Prepare tampão de equilíbrio (fosfato de sódio de 20 mM, cloreto de sódio a 500 mM, pH 7,4), tampão de eluição de baixo pH (citrato de 0, 5 M, cloreto de sódio a 0, 5 M, pH 4,0 – 3,25) e tampão de eluição de alta resistência iônica (1,0 – 4,0 M de cloreto de magnésio, 0,1 M HEPES, pH 8,0)
- Lave o sistema de cromatografia com os buffers. Montar uma coluna de afinidade DFE (da etapa 5,10) no sistema de cromatografia e equilibrar com 5 CV de tampão de equilíbrio a um caudal de 1,0 mL min-1. Monitore a absorvância UV em 280 nm.
Nota: O extrato da planta do carregamento ou o sobrenadante da cultura da pilha na coluna podem causar um aumento na contrapressão. Defina um alerta de alta pressão em 0,2 MPa para evitar danos ao sistema de cromatografia ou coluna DFE. - Carregar 80 mL do extrato da planta clarificada ou sobrenadante (passo 6,1) para a coluna a uma vazão de 0,5 mL min-1 para garantir um tempo de contato de 2 min. colete as amostras de fluxo em frações de 2 ml para reconstrução da curva de avanço (etapa 7,3). Armazene as amostras de fluxo a 4 ° c se a análise imediata da amostra não for possível.
- Lave a coluna com 6 CV de tampão de equilibração. Colete uma amostra da lavagem no início, meio e fim desta etapa.
-
Elute mAb 2F5 com 5 CV de tampão de eluição de baixo pH ou tampão de eluição de alta resistência iônica (0,1 M HEPES, cloreto de magnésio 1,25 M, pH 8,0). Colete a fração DFE quando o sinal UV 280 nm aumentou para 5 mAU acima da linha de base.
- Otimize o tampão de eluição para cada par de epítopo – anticorpo. Para 2f5, o cloreto de magnésio de 1,25 M alcançou um contrapeso óptimo entre a recuperação do produto e a estabilidade do ligante.
Nota: A solução de cloreto de magnésio é propensa a precipitação. Portanto, dissolver o cloreto de magnésio em ~ 700 mL de água. Dissolva separadamente o HEPES em 100 mL de água e ajuste o pH para 8,0. Adicione a solução de cloreto de magnésio dissolvido à solução HEPES e adicione água a um volume final de 1,0 L. Não ajuste o pH após dissolver o cloreto de magnésio, pois isso causará precipitação.
- Otimize o tampão de eluição para cada par de epítopo – anticorpo. Para 2f5, o cloreto de magnésio de 1,25 M alcançou um contrapeso óptimo entre a recuperação do produto e a estabilidade do ligante.
- Analise todas as amostras colhidas durante as etapas 6.4 – 6.6 usando o método de Bradford, a eletroforese em gel de poliacrilamida de dodecilsulfato de lítio (LDS-PAGE) e a espectroscopia de ressonância Plasmon de superfície (SPR) (etapa 7).
7. análise da amostra
- Medir a concentração de TSP usando o método de Bradford18,19.
- Em Triplicate, pipeta 2,5 μL de cada amostra em um único poço de uma placa de 96 poços. Utilizar oito níveis de albumina sérica bovina (BSA) em triplicado cobrindo o intervalo 0 – 2000 mg · L-1.
- Adicionar 200 μL de reagente de Bradford a cada poço e misturar suavemente com pipetagem para cima e para baixo. Mantenha o nível de pipeta para evitar a formação de bolhas que distorcem a leitura subsequente.
- Incubar a placa durante 10 min a 22 ° c e medir a absorvância a 595 nm num Espectrofotômetro. Calcule a concentração de TSP nas amostras com base em uma curva padrão através dos pontos de referência BSA.
- Quantificar a DFE por fluimetria
- Em triplicado, Pipetar 50 μL de cada amostra em poços únicos de uma placa de meia área preta 96-bem. Inclua seis padrões DsRed cobrindo o intervalo 0 – 225 mg · L-1.
- Meça a fluorescência duas vezes usando um filtro de excitação de 530 ± 30 nm e um filtro de emissão de 590 ± 35 nm em um espectrofotômetro. Calcule a concentração de DFE nas amostras com base em uma curva padrão através dos pontos de referência DsRed.
- Meça a concentração 2F5 pela espectroscopia SPR20.
- Prepare o tampão running de HBS-EP (10 milímetros 4-(2-Hydroxyethyl)-1-piperazineetanoesulfonic ácido (HEPES), ácido ethylenediaminetetraacético de 3 mM (EDTA), cloreto de sódio 150 mM, 0, 5% v/v Tween-20, pH 7,4) e filtro esterilizá-lo, passando-o através de um vácuo de 0,2 μm filtro do frasco-parte superior. Degas o tampão por 15 min.
- Conecte o tampão running de HBS-EP ao instrumento de SPR antes de acoplar um chip de superfície reticulada dextrano e de equilibrar o sistema usando a função principal. Inicie uma execução manual com uma vazão de 30 μL Min-1 e condicione a superfície do chip alternadamente injetando ácido clorídrico de 30 mm e 25 mm de hidróxido de sódio (duas injeções cada) sobre as células de fluxo 1 e 2 a uma vazão de 30 μl Min-1 por 1 min.
- Preparar 300 μL de um 500 mg · Solução de L-1 proteína A em acetato de sódio A 10 mm (pH 4,0). Thaw frascos contendo 0,4 M 1-etil-3-(3-dimethylaminopropyl) carbodiimida cloridrato (EDC) e 0,1 M NHS e centrífuga em 16.000 x g por 1 min antes de misturar 70 ΜL de EDC e 70 ΜL de NHS.
- Transfira a mistura EDC/NHS e a solução de proteína a para frascos de amostra de plástico de 7 mm e coloque no rack de amostra. Ative a superfície da microplaqueta do dextrano reticulada injetando a mistura de EDC/NHS sobre as pilhas de fluxo 1 e 2 em uma taxa de fluxo de 10 μL Min-1 por 10 minutos.
- Acople a proteína a à superfície reticulada ativada do dextrano injetando a solução da proteína a sobre a pilha de fluxo 2 em uma taxa de fluxo de 15 μl Min-1 por 15 minutos.
- Ao acoplar a proteína A, descongelar um frasco para injetáveis de 1,0 M de cloridrato de etanolamina (pH 8,5) e centrifugar a 16.000 x g durante 1 min. transferir 150 μl para um frasco de plástico de 7 mm e colocar no instrumento. Quando a etapa 7.3.5 estiver completa, desative a superfície da microplaqueta injetando a solução do etanolamina sobre as pilhas de fluxo 1 e 2 em uma taxa de fluxo de 10 μL Min-1 por 7 minutos.
- Condicionar a superfície da microplaqueta alternadamente injetando o ácido clorídrico de 30 milímetros e o hidróxido de sódio de 25 milímetros (duas injeções cada) sobre as pilhas de fluxo 1 e 2 em uma taxa de fluxo de 30 μL Min-1 para 0,5 minutos.
- Prepare padrões de anticorpos 2F5 no tampão running HBS-EP a uma concentração de 500 μg · L-1 e amostras diluidas contendo 2F5 em HBS-EP para uma concentração final na faixa de 20 – 1000 μg · L-1. Injete amostras e padrões sobre as células de fluxo 1 e 2 a uma vazão de 30 μL Min-1 por 3 min. Injete um padrão 2f5 após cada 15 amostras.
- Subtrair o sinal de unidades relativas (RU) da célula de fluxo 1 (célula de referência) do sinal da célula de fluxo 2 (célula de medição) para cada amostra e calcular a concentração de anticorpos com base no sinal de RU de 2F5 injeções padrão.
- Após cada amostra ou injeção padrão, regenerar a superfície da microplaqueta injetando o ácido clorídrico de 30 milímetros em uma taxa de fluxo de 30 μL Min-1 para 0,5 minutos sobre as pilhas de fluxo 1 e 2.
- Plotar a concentração de 2F5 para cada amostra de fluxo através da etapa 6,4 contra o fluxo através do volume para obter a curva de avanço 2F5. Calcule a quantidade de 2F5 injetado quando 10% da concentração de carregamento 2F5 foi alcançada para obter a capacidade de ligação dinâmica de 10% (DBC).
- Analise amostras de proteínas por LDS-PAGE.
- Abra um gel de poliacrilamida de 4 – 12% de BisTris LDS pronto para uso e coloque-o em um módulo de eletroforese. Transferir 800 mL de tampão de corrida (50 mM MES, 50 mM TRIS base, 0,1% (m/v) SDS, 1 mM EDTA, pH 7,3) no módulo e adicionar 0,5 mL de solução antioxidante.
- Num tubo de reacção de 1,5 mL, misture 10 μL de tampão de carga com 4 μL de agente redutor e 26 μL da amostra de proteína. Incubar o tubo em um bloco de calor por 10 min a 80 ° c. Centrifugue o tubo a 500 x g por 30 s.
- Carregue o gel de poliacrilamida Sud (10 μL de amostra por via) e carregue 5 μL de padrão proteico pré-manchado (10 – 180 kDa) em uma pista separada.
- Feche a câmara de electroforese e ligue a fonte de alimentação. A eletroforese deve funcionar por 40 min e em constante 200 V.
- Retire o gel da câmara de electroforese. Abra o gel sheathing e lave o gel por 15 min em água em uma coqueteleira a 19 rpm. Manchar o gel para 1 h na solução de coloração em uma coqueteleira a 19 rpm.
- Destain o gel para 1 h na água em um abanador em 19 rpm. Escaneie o gel usando um scanner de filme.
Resultados
Expressão e purificação do ligante da afinidade
A proteína de fusão DFE foi expressa em plantas de tabaco transgênicas cultivadas em estufa. O rendimento foi de ~ 120 mg · kg-1 massa foliar com uma biomassa média de ~ 130 g por planta. A pureza da DFE foi de < 5% de TSP em extratos de plantas brutas antes do branqueamento, mas aumentou para ~ 40% após o tratamento térmico a 70 ° c por 1,5 min, que precipitou > 97% das proteínas da célula hospedeira. A etapa de branqueamento foi facilmente integrada na rotina de colheita e extração (Figura 1) e demorou menos de 2 h de tempo extra, incluindo a criação do banho de água. A recuperação total do DFE foi de 23,5 mg kg1 com uma pureza de > 90%. As etapas responsáveis pela perda do produto foram branqueamento, filtração de profundidade e IMAC, com perdas específicas de 40%, 27% e 45%, respectivamente. A capacidade do filtro de profundidade foi, em média, 135 ± 36 L m-2 (± DP, n = 3) e, portanto, na faixa superior de valores relatados na literatura21. O rendimento de DFE aumentou com a idade da planta (Figura 2).
Imobilização da ligadura de afinidade em colunas de cromatografia ativadas pelo NHS
Durante os testes iniciais de acoplamento, verificou-se que o tampão HEPES (pH 8,3) aumentou a eficiência de acoplamento para 89 ± 6% (± DP, n = 3) em comparação com 78 ± 9% (± DP, n = 3) para o tampão de bicarbonato recomendado pelo fabricante. Conseqüentemente, HEPES foi usado para todos os experimentos subseqüentes do acoplamento. Uma aproximação da DoE foi selecionada para aperfeiçoar a eficiência do acoplamento de DFE à resina Cross-linked NHS-ativada do agarose. A quantidade absoluta de DFE imobilizou na resina aumentada com a massa de DFE injetada na coluna e plateaued em ~ 15 g · L-1 Considerando que o rendimento do acoplamento diminuiu continuamente à medida que mais DFE foi injetado (Figura 2). O rendimento de acoplamento também foi > 50% menor em um tampão ácido, indicando a necessidade de se procurar condições de acoplamento adequadas para cada ligantes caso a caso. As condições ideais em termos de rendimento de acoplamento, quantidade absoluta de DFE imobilizada e custos de coluna foram identificadas usando a ferramenta de otimização numérica do software DoE. As condições mais desejáveis (pH 9,0 e 7,0 mg de DFE por 1 mL de resina de agarose reticulada) foram localizadas em um grande planalto e, portanto, robustas. As moléculas de DFE mantiveram sua fluorescência vermelha mesmo após o acoplamento, e a intensidade da cor correspondeu à quantidade total de DFE imobilizada (Figura 2). Portanto, a cor da coluna pode ser usada como um parâmetro de controle de qualidade simples para estimar a eficiência de acoplamento e a qualidade da coluna. A fluorescência igualmente confirmou que a proteína de fusão de DFE montou no estado tetramérica de dsred nativo.
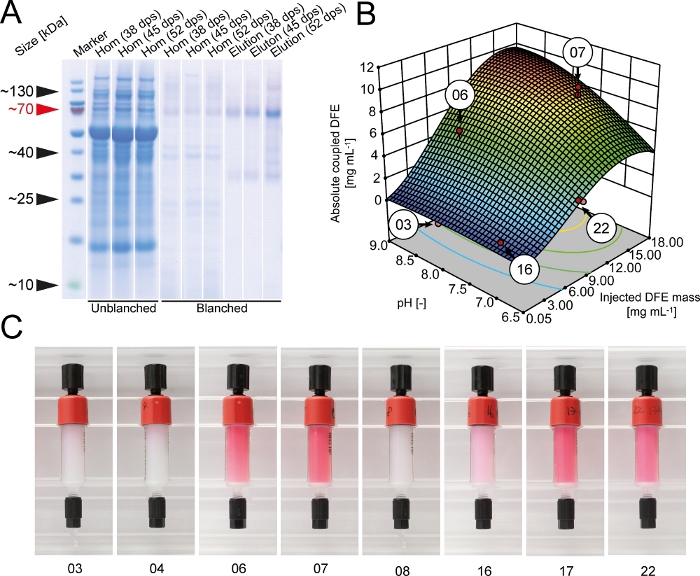
Figura 2: otimização da imobilização da DFE para a resina de agarose reticulada ativada pelo NHS. (A) gel de LDS-PAA com a sobreposição ocidental do borrão de amostras do homogeneate e da eluição dos extratos transgênicas bucho e descascados da planta de DFE. A colheita das plantas foi realizada 38, 45 ou 52 dias após a semeadura. Os borrões ocidentais foram executados usando um anti-his6-anticorpos5. (B) quantidade total de ligantes da afinidade de DFE acoplada na dependência se o pH do acoplamento e a massa total de DFE purified injetaram em colunas Cross-linked ativadas NHS do agarose. Os pontos vermelhos indicam os experimentos reais realizados para construir o modelo de superfície de resposta. (C) colunas de afinidade DFE após o procedimento de acoplamento. Os números correspondem às condições de acoplamento destacadas no painel B. DPS = dias após a semeadura. Por favor clique aqui para ver uma versão maior desta figura.
Testando o isolamento de 2F5 usando a resina de afinidade DFE
O anticorpo de recombinação 2f5 foi produzido transientemente em plantas de Nicotiana javanica cultivadas em um fitontron5. A captura de 2F5 do extrato de planta bruta foi testada usando colunas de afinidade acopladas com ~ 7,0 mg de DFE purificada (etapa 6). A eluição das resinas protein A geralmente envolve um tampão ácido (pH ~ 3,3)13. Conseqüentemente, nós avaliamos inicialmente os bufferes diferentes da eluição do baixo-pH (pH 6.0 – 3.25) para as colunas de DFE. A eluição de 2F5 foi bem-sucedida em valores de pH abaixo de 4,5 com a maior recuperação de ~ 35% em pH 3,25. Entretanto, a eluição do baixo-pH inativou o anticorpo (como confirmado pela espectrometria de SPR) e o ligante de DfE (como indicado pela perda de cor e pelo DBC mais baixo, Figura 3). O último foi antecipado dado que as desnatura nativas de dsred em pH < 4.022,23. Para evitar a desnaturação de produtos e ligantes, testamos o cloreto de magnésio como um agente de eluição alternativo, pois já foi usado para eluir mAbs de outras resinas de afinidade24. A concentração de cloreto de magnésio de 1,25 M foi suficiente para eluir 2f5 da resina de afinidade DFE com uma recuperação de 105 ± 11% (± DP, n = 3) e uma pureza de 97 ± 3% (± DP, n = 3). Esse desempenho foi comparável às resinas de proteína a25,26. A constante do dissociação do equilíbrio (KD) do anticorpo DFE-purified 2f5 e do ligante sintético fuzeon era 791 PM visto que que de uma contraparte proteína a-purified era 763 PM5. Além disso, nenhuma perda substancial da cor foi observada na resina sobre um total de 25 ciclos do ligamento-e-elute. O DBC da resina da afinidade de DFE no avanço de 10% 2F5 declinou linearmente sobre o curso de 25 ciclos a ~ 15% do valor inicial (Figura 3).
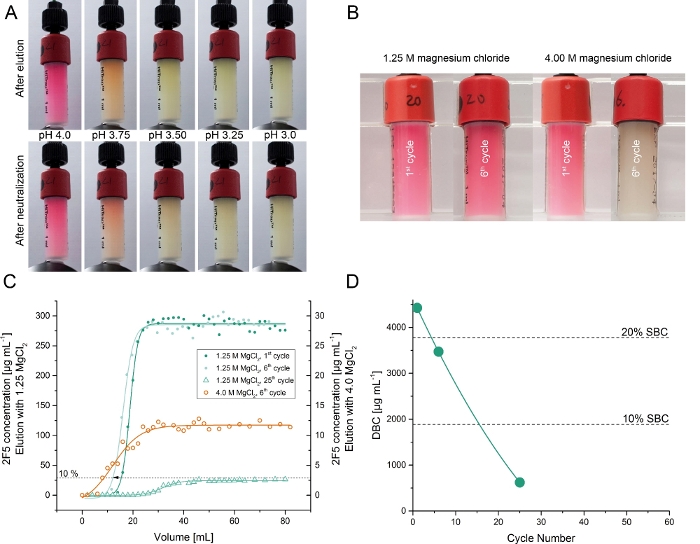
Figura 3: testando o isolamento de 2F5 de extratos de plantas esclarecidos usando as resinas de afinidade DFE. (A) resinas de afinidade DFE após um ciclo de eluição usando buffers com diferentes valores de pH na faixa de 4,0 – 3,0 e as mesmas resinas após uma etapa de neutralização em pH 6,0. (B) resinas de afinidade DFE após um e seis ciclos de purificação de 2f5 usando 1,25 m ou 4, 0 m de cloreto de magnésio como eluente. (C) cromatogramas de experimentos de carregamento frontal (curvas de ruptura) para determinar a capacidade de ligação dinâmica dependente do ciclo da resina DFE usando cloreto de magnésio como eluente. As curvas de ruptura foram medidas para os buffers de eluição de cloreto de magnésio 4,0 M e 1,25 M e vários números de ciclo. (D) capacidade de ligação dinâmica dependente do ciclo de DFE utilizando cloreto de magnésio 1,25 M como eluente. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Aplicações da resina nova da afinidade
Nós mostramos que as resinas personalizadas da cromatografia da afinidade para a captação de mAbs podem ser manufacturados imobilizando um ligante que contem um epítopo mAb-específico ao agarose Cross-linked NHS-ativado. Para projetar tal resina, era necessário saber a seqüência do epítopo e usar um epítopo linear. As resinas resultantes são vantajosas para a captura de mAbs porque poderiam potencialmente substituir as etapas de cromatografia de afinidade de proteína A dispendiosas. A interação entre 2f5 e DFE em nosso estudo de caso foi mediada pela ligação do epítopo-paratope, assim que nosso ligante deve ser mais seletivo do que a proteína a, que liga à região de FC da maioria de iggs murino e humano. Porque os ligantes individuais são necessários para cada MAB, nosso método pode inicialmente parecer apropriado principalmente para os anticorpos que são produzidos em uma escala muito grande. Entretanto, combinando nossa aproximação com a expressão transiente rápida planta-baseada da proteína, os ligantes novos da afinidade podem ser preparados em menos de 2 semanas27 com esforço mínimo28. Assim, o método também é adequado para a purificação de mAb de pequena escala.
Produção e melhorias potenciais do ligante da afinidade
As plantas oferecem uma plataforma de produção rápida e segura para ligantes de afinidade5,29,30, como a proteína de fusão DFE apresentada no nosso estudo de caso. Blanching o material de planta reduziu extremamente a quantidade de proteínas de pilha do anfitrião em uma única etapa e foi integrado facilmente em uma rotina padrão do esclarecimento. No entanto, a recuperação do ligante foi baixa na configuração atual, provavelmente devido à sua estabilidade térmica moderada e alguma ligação não específica às camadas filtrantes, conforme relatado para outros produtos31,32,33. A engenharia o portador para aumentar sua estabilidade térmica pode conseqüentemente ajudar a melhorar o rendimento do ligante no futuro, como descrito para o candidato vacinal da vacina da malária, a enzima antitumoral ppadi ou um β-glucosidase mesófilos34, 35,36. O mesmo vale para a etapa de filtração de profundidade, onde a engenharia de proteínas pode ajudar a reduzir a ligação não específica ao material filtrante37. Os custos de produção para DFE e ligantes semelhantes também podem ser reduzidos melhorando a eficiência geral de esclarecimento utilizando floculantes ou aditivos filtrantes38,39.
Quando dsred é usado como um portador, dá forma a um complexo tetramérica. Isso é vantajoso porque aumenta o número de epítopos por ligantes, mas também pode tornar o ligador mais suscetível à desmontagem ou desnaturação durante a cromatografia de afinidade. Uma proteína transportadora monomérica como a mCherry pode, portanto, ser preferível, pois é estável em pH baixo40, e a inclusão de repetições em tandem do epítopo aumentaria a avidez do ligador e, assim, aumentará a capacidade da resina5, 26 anos de , 41. para as proteínas simples do portador-epitope (isto é, aquelas sem ligações do dissulfeto ou modificações borne-translational) os sistemas de produção microbianos podem reduzir os custos de fabricação e fazer os ligantes mais competitivos com proteína a. Por exemplo, a proteína verde fluorescente tem sido expressa em células bacterianas com um rendimento de ~ 1 g · kg-1 de biomassa, o que reduziria significativamente os custos de produção de ligantes42.
Independentemente do hospedeiro de expressão, foi necessário um ligante de afinidade purificada durante o acoplamento para minimizar a imobilização de proteínas de células hospedeiras ou componentes de mídia que, de outra forma, podem reduzir a seletividade e capacidade da resina. A inclusão de uma etiqueta poli-histidina para a purificação do iMac aumentou a pureza para ~ 90% em uma única etapa, facilitando a produção rápida e barata de ligante5,43,44. Entretanto, a posição da etiqueta da fusão é importante porque tem o potencial para obstruir aberta a ligação do epítopo mapeado ou para induzir o clivagem da etiqueta ou do epítopo do portador45,46.
Imobilização da ligadura de afinidade em colunas de cromatografia ativadas pelo NHS
A imobilização foi realizada manualmente ou por meio de um sistema de cromatografia. Os pequenos volumes de buffer por coluna pareciam favorecer o manuseio manual (por exemplo, devido aos volumes mínimos de desperdício). No entanto, se forem necessárias colunas múltiplas/maiores, o sistema de cromatografia torna as condições de acoplamento mais fáceis de controlar (por exemplo, taxas de fluxo reguladas) e, portanto, é mais provável que consiga resultados reprodutíveis em termos de DBC. Nossos dados sugerem que o tampão de acoplamento e o pH têm um efeito importante na eficiência do acoplamento e nos custos totais da coluna. Fatores de triagem que influenciam a reação de acoplamento e ajustá-los para cada proteína transportadora (ou mesmo para cada transportadora – ligand Fusion) poderia, portanto, melhorar a eficiência de acoplamento e desempenho de resina, e recomendamos esta abordagem.
Testando o isolamento de 2F5 usando a resina de afinidade DFE
O rendimento e a pureza do produto são aspectos importantes do desempenho da resina e, no caso da DFE, obteve-se um rendimento de 105 ± 11% (± DP, n = 3) e uma pureza de 97 ± 3% (± DP, n = 3), o que é comparável ao desempenho das resinas de benchmark protein A25 ,26. Outro indicador-chave de desempenho para resinas em geral (e particularmente para aqueles baseados em ligantes de afinidade) é o DBC a 10% de avanço do produto, porque este parâmetro afeta a quantidade de resina necessária para um processo específico e, portanto, os custos. Para o ligand de DFE, o DBC inicial era ~ 4 g · L-1 resina, que é ~ 13% do valor correspondente para a proteína A em condições semelhantes (apenas 2 min tempo de contato)25,47 mas cerca de 15 vezes maior em comparação com outras resinas de afinidade personalizada, como o ligantes anti-FSH-imunoafinidade utilizando o mesmo tempo de permanência de 2 min48. O DBC de DFE declinou a 15% do valor começar após 25 ciclos do BIND-e-elute, visto que mais de 50 ciclos são exigidos para a mesma perda de DBC em resinas comerciais de A da proteína A49. No entanto, é importante notar que o nosso transportador ainda não foi otimizado na mesma medida que a proteína A, que tem sido exaustivamente investigado e melhorado ao longo das últimas quatro décadas8.
Até o momento, melhoramos a estabilidade da resina e a recuperação do produto, alternando de um tampão de eluição de baixo pH para uma alta concentração de cloreto de magnésio (Figura 3), como recomendado em estudos anteriores13. A cor vermelha característica do ligante de afinidade não se desvaneceu substancialmente durante os 25 ciclos de ligamento-e-elute, então nós especulamos que as proteases endógenas de plantas nos extratos de plantas esclarecidas31 podem ter truncado e, assim, inativado o epítopo da o ligand. Conseqüentemente, projetar os linkers protease-resistentes para conectar o portador e o epítopo pode ajudar a manter o DBC inicial sobre um número prolongado de ciclos. Dada a rápida e simples expressão e purificação do ligador DFE, seu acoplamento direto às resinas de cromatografia comercial, e seu excelente rendimento e pureza do produto, acreditamos que nosso método oferece uma alternativa adequada à proteína a para o purificação de mAbs e derivados de anticorpos que não se ligam à proteína a, especialmente se as melhorias para o portador e Linker pode melhorar a estabilidade do DBC e ligante. Esta suposição foi apoiada pela diferença pequena na constante da dissociação de DFE-purified e de proteína A-purified o anticorpo5de 2f5, indicando que nosso ligante novo da afinidade permite a recuperação de mAbs de alta qualidade.
Benefícios e limitações atuais do método
Produzindo o ligante da afinidade como uma fusão genética com uma proteína do portador aumenta a solubilidade em amortecedores aquosos e assim a compatibilidade com condições típicas do acoplamento do ligante. Em contrapartida, peptídeos em branco derivados da síntese de peptídeos em fase sólida podem ter solubilidade limitada nestas condições devido à sua sequência50, que não pode ser alterada porque é ditada pela sequência de aminoácidos do epítopo reconhecida pelo MAB para ser purificada. Outros usaram conseqüentemente uma síntese da em-resina de ligantes do peptide51. A capacidade de ligação estática da resina resultante foi alta (~ 80 g · L-1), mas o processo de preparo da resina é demorado, não foi relatada uma capacidade de ligação dinâmica e a pureza e recuperação obtidas foram menores do que em nossa abordagem. Uma vantagem adicional de um ligante da proteína da fusão na escala do laboratório é que o ligante e as variações dele podem ràpida ser produzidos, purified e testado com esforço mínimo em um sistema Easy-to-use da expressão da elevado-através de52.
As duas limitações atuais do método apresentado aqui são a baixa capacidade de ligação dinâmica de 3 g · L-1 e sua redução de 90% ao longo do ciclo de 25 ciclos de ligação e elute5. Essas limitações podem ser abordadas no futuro, aplicando condições de carga menos rigorosas e substituindo a transportadora DsRed atual por uma variante projetada e mais estável, respectivamente. Por exemplo, dobrar o tempo de contato atual de 2 a 4 minutos tem o potencial de dobrar a capacidade de ligação dinâmica como foi mostrado para algumas resinas protein A26.
Solucionando problemas
A tabela a seguir destaca os possíveis problemas que podem ser encontrados durante este protocolo e fornece dicas sobre como resolvê-los (tabela 1).
| Tabela 1: problemas potenciais que podem ser encontrados e possíveis correções. | |||
| Etapa do protocolo | Problema | Couse | Corrigir |
| 1 | As plantas não crescem | Condições de crescimento comprometidas | Verifique o pH e a condutividade do fertilizante |
| Verifique as condições de temperatura e luz | |||
| 2 e 3 | Grandes quantidades de proteínas de células hospedeiras estão presentes após a extração | Precipitação incompleta | Verifique a temperatura durante a branqueamento |
| Verifique a agitação no banho de branqueamento | |||
| 2 e 3 | Nenhum produto encontrado no extrato da planta | Temperatura de blanching demasiado elevada | Verifique a temperatura e o pH durante o branqueamento |
| pH no tampão de branqueamento muito baixo | |||
| 3 | As grandes partes da haste ou da folha permanecem após a extração | Mistura incompleta no liquidificador | Certifique-se de que o material vegetal não é um plugue no liquidificador |
| 3 | Aumento rápido da pressão durante a filtração da profundidade | Seleção e/ou orientação incorreta do filtro | Verifique o tipo de filtro e a orientação |
| 4 | Pouca proteína de fusão durante a eluição/um monte de proteína de fusão em fluxo-através de | A resina IMAC não foi carregada com íons metálicos | Verifique se a resina IMAC foi corretamente carregada com íons |
| A proteína de fusão perdeu a tag de afinidade | Evite a luz solar intensa e altas temperaturas durante o cultivo da planta | ||
| 4 | Proteína de fusão perdida durante a concentração | Proteína de fusão ligada à membrana | Verifique o tipo de membrana |
| Certifique-se que o factor de concentração não foi demasiado elevado | |||
| 5 | Baixo rendimento do acoplamento | Seqüência incorreta de adição de reagente de acoplamento | Verifique os rótulos dos reagentes e a sequência de adição |
| Preparação incorreta das colunas antes do acoplamento | Verifique as condições da coluna preparaiton | ||
| 5 e 6 | Baixo rendimento de mAb | Baixa expressão de mAb na biomassa vegetal | Teste de expressão de mAb em biomassa |
| Baixa densidade do ligante | Verifique a pureza da preparação da proteína de fusão | ||
| 7 | Concentrações de proteínas muito baixas/elevadas no ensaio de Bradford | Formação de bolhas durante a pipetagem | Verifique se há bolhas no 96-bem palte |
| 7 | Baixa concentração de mAb durante a medição da SPR | Microplaqueta comprometida da proteína A | Compare com os resultados do mAb padrão com concentração conhecida |
| Diluição incorrecta da amostra | Verifique a taxa de diluição e o tampão | ||
Tabela 1: problemas de disparo.
Divulgações
Os autores não têm conflitos de interesse para divulgar.
Agradecimentos
Nós gostaríamos de reconhecer Ibrahim Al Amedi para cultivar as plantas de tabaco transgénicas e Dr. Thomas Rademacher para fornecer o vetor da expressão do tabaco. Os autores desejam agradecer ao Dr. Richard M. Twyman pela assistência editorial e Markus Sack por discussões frutíferas sobre a estrutura ligante de afinidade da DFE. Este trabalho foi financiado em parte pelos programas internos da Fraunhofer-Gesellschaft o n º Grant. Atraia 125-600164 e o estado de Norte-Rhine-Westphalia o Grant do Leistungszentrum no. 423 rede, produção adaptável. Este trabalho foi apoiado pelo Deutsche Forschungsgemeinschaft (DFG) no âmbito do grupo de formação de investigação "Drug-alvo de entrega de medicamentos" subvenção 331065168. A GE Healthcare apoiou a publicação de acesso aberto deste artigo.
Materiais
| Name | Company | Catalog Number | Comments |
| 10 L/20 L Bucket | n/a | n/a | Blanching equipment |
| 2100P Portable Turbidimeter | Hach | 4650000 | Turbidimeter |
| ÄKTApure | GE Helthcare | 29018226 | Chromatography system |
| Allegra 25R | Beckman Coulter | 369434 | Centrifuge |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Amine Coupling Kit | GE Healthcare | BR100050 | SPR chip coupling kit |
| Antibody 2G12 | Fraunhofer IME | n/a | Standard for SPR quantification |
| Blender | Waring | 800EG | Blender |
| BP-410 | Fuhr | 2632410001 | Bag filter |
| CanoScan 5600F | Canon | 2925B009 | Scanner |
| Centrifuge tube 50 mL self-standing | Labomedic | 1110504 | Reaction tube |
| Chelating Sepharose FF | GE Helthcare | 17-0575-01 | Chromatography resin |
| Cond 3320 | WTW | EKA 3338 | Conductometer |
| Design-Expert(R) 8 | Stat-Ease, Inc. | n/a | DoE software |
| Discovery Compfort | Gilson | F81029 | Multichannel pipette |
| Disodium phosphate | Carl Roth GmbH | 4984.3 | Media component |
| Diverse bottles | Schott Duran | n/a | Glas bottles |
| Dri Block DB8 | Techne | Z381373 | Heat block |
| DsRed | Fraunhofe IME | n/a | Standart |
| EDTA | Carl Roth GmbH | 8043.2 | Buffer component |
| EnSpire | Perkin Elmer | 2390-0000 | Plate reader |
| ETHG-912 | Oregon Scientific | 086L001499-230 | Thermometer |
| F9-C | GE Helthcare | 29027743 | Fraction collector |
| Ferty 2 Mega | Kammlott | 5.220072 | Fertilizer |
| Forma -86C ULT freezer | ThermoFisher | 88400 | Freezer |
| HEPES | Carl Roth GmbH | 9105.3 | Buffer component |
| Hettich Centrifuge Mikro 200 | Hettich | 2400 | Centrifuge |
| HiPrep 26/10 | GE Helthcare | GE17-5087-01 | Chromtography column |
| HiTrap NHS-activated Sepharose HP, 1 mL | GE Helthcare | 17-0716-01 | Chromatography columns |
| Hydrochloric acid | Carl Roth GmbH | 4625.1 | Buffer component |
| Imidazole | Carl Roth GmbH | 3899.2 | Buffer component |
| K700 | Pall | 5302305 | Depth filter layer |
| KM02 basic | IKA | n/a | Magnetic stirrer |
| KS50P 60D | Pall | B12486 | Depth filter layer |
| L/S 24 | Masterflex | SN-06508-24 | Tubing |
| Lauda E300 | Lauda Dr Wobser GmbH | Z90010 | Immersion circulator |
| Magnesium chloride | Carl Roth GmbH | KK36.2 | Buffer component |
| Masterflex L/S | Masterflex | HV-77921-75 | Peristaltic pump |
| Minisart 0.2 µm | Sartorius | 16534K | Filter unit |
| Nalgene Rapid-Flow PES bottle top filter | Thermo Fischer Scientific | 595-4520 | Vacuum filtration of SPR buffers |
| Nickel sulphate | Carl Roth GmbH | T111.1 | Buffer component |
| Novex NuPAGE 4-12% BisTris LDS gels | Invitrogen | NP0336BOX | LDS-PAA gels |
| Novex X-cell Mini Cell | Invitrogen | EI0001 | PAGE chamber |
| NuPAGE 20x running buffer | Invitrogen | NP0002 | Buffer concentrate |
| NuPAGE antioxidant | Invitrogen | NP0005 | Antioxidant |
| PageRuler protein ladder (10-180 kDa) | Invitrogen | 26616 | Protein standart |
| Perforated bucked | n/a | n/a | Blanching |
| PH 3110 | WTW | 2AA110 | PH meter |
| PowerPac HC | Biorad | 1645052 | Electrophoresis module |
| Protein A from Staphylococcus aureus | Sigma-Aldrich | P7837-5MG | Coating of SPR chips |
| Sephadex G-25 fine, cross linked dextran | GE Helthcare | 17003301 | Chromatography resin |
| Silicone spoon | n/a | n/a | Spoon |
| Simply Blue SafeStain | Invitrogen | LC6060 | Gel staining solution |
| Sodium acetate | Carl Roth GmbH | 6773.1 | Buffer component |
| Sodium acetate | Carl Roth GmbH | X891.1 | Media component |
| Sodium azide | Sigma Aldrich | S2002-100G | Media component |
| Sodium chloride | Carl Roth GmbH | P029.2 | Buffer component |
| Sodium citrate | Carl Roth GmbH | HN13.2 | Buffer component |
| Sodium bisulfite | Carl Roth GmbH | 243973-100G | Media component |
| Sodium phosophate | Carl Roth GmbH | T877.2 | Media component |
| SPR Affinity Sensor - High Capacity Amine | Sierra Sensors GmbH/Bruker Daltonics | SPR-AS-HCA | SPR chip |
| SPR-2/4 Surface Plasmon Resonance Analyzer | Sierra Sensors GmbH/Bruker Daltonics | n/a | SPR device |
| SSM3 | Stuart | 10034264 | Mini Gyro-rocker |
| Heated vessel, 20 L | Clatronic | n/a | Blanching chamber |
| Sterile syringes, 2 mL | B. Braun | 4606027V | Syringes |
| Syringe adpter (Union Luer F) | GE Helthcare | 181112-51 | Syringe adapter |
| TE6101 | Sartorius | TE6101 | Precision scale |
| Tween-20 (Polysorbate) | Merck | 8170721000 | Buffer component |
| Unicorn 6.4 | GE Helthcare | 29056102 | Chromatography software |
| Vacuum bags | Ikea | 203.392.84 | Plant storge |
| VelaPad 60 | Pall | VP60G03KNH4 | Filter housing |
| Vortex-Genie 2 | Scientific industries | SI-0236 | Vortex |
| XK-26/20 column housing | GE Helthcare | 28-9889-48 | Chromtography column |
Referências
- Kesik-Brodacka, M. Progress in biopharmaceutical development. Biotechnology and Applied Biochemistry. 65 (3), 306-322 (2018).
- Ecker, D. M., Jones, S. D., Levine, H. L. The therapeutic monoclonal antibody market. MAbs. 7 (1), 9-14 (2015).
- Jayapal, K., Wlaschin, K. F., Hu, W. S., Yap, M. G. S. Recombinant Protein Therapeutics from CHO Cells - 20 Years and Counting. Chemical Engineering Progress. 103, 40-47 (2007).
- Kunert, R., Reinhart, D. Advances in recombinant antibody manufacturing. Applied Microbiology and Biotechnology. 100 (8), 3451-3461 (2016).
- Rühl, C., Knödler, M., Opdensteinen, P., Buyel, J. F. A linear epitope coupled to DsRed provides an affinity ligand for the capture of monoclonal antibodies. Journal of Chromatography A. 1571, 55-64 (2018).
- Edgue, G., Twyman, R. M., Beiss, V., Fischer, R., Sack, M. Antibodies from plants for bionanomaterials. Nanomedicine and Nanobiotechnology. 9 (6), e1462 (2017).
- Buyel, J. F., Fischer, R. Very-large-scale production of antibodies in plants: The biologization of manufacturing. Biotechnology Advances. 35 (4), 458-465 (2017).
- Bolton, G. R., Mehta, K. K. The role of more than 40 years of improvement in protein A chromatography in the growth of the therapeutic antibody industry. Biotechnology Progress. 32 (5), 1193-1202 (2016).
- Kelley, B. Industrialization of mAb production technology: the bioprocessing industry at a crossroads. MAbs. 1 (5), 443-452 (2009).
- Brochier, V., Ravault, V. High throughput development of a non protein A monoclonal antibody purification process using mini-columns and bio-layer interferometry. Engineering in Life Sciences. 16 (2), 152-159 (2016).
- Arakawa, T., Futatsumori-Sugai, M., Tsumoto, K., Kita, Y., Sato, H., Ejima, D. MEP HyperCel chromatography II: binding, washing and elution. Protein Expression and Purification. 71 (2), 168-173 (2010).
- Barroso, T. B., Aguiar-Ricardo, R. J., Roque, A. C. Structural evaluation of an alternative Protein A biomimetic ligand for antibody purification. Journal of Computer-aided Molecular Design. 28 (1), 25-34 (2014).
- Mazzer, A. R., Perraud, X., Halley, J., O'Hara, J., Bracewell, D. G. Protein A chromatography increases monoclonal antibody aggregation rate during subsequent low pH virus inactivation hold. Journal of Chromatography A. 1415, 83-90 (2015).
- Sack, M., et al. Functional analysis of the broadly neutralizing human anti-HIV-1 antibody 2F5 produced in transgenic BY-2 suspension cultures. FASEB Journal. 21 (8), 1655-1664 (2007).
- Buyel, J. F., Fischer, R. Characterization of Complex Systems Using the Design of Experiments Approach: Transient Protein Expression in Tobacco as a Case Study. Journal of Visualized Experiments. (83), 51216 (2014).
- Trasatti, J. P., Woo, J., Ladiwala, A., Cramer, S., Karande, P. Rational design of peptide affinity ligands for the purification of therapeutic enzymes. Biotechnology Progress. 34 (4), 987-998 (2018).
- Buyel, J. F., Gruchow, H. M., Boes, A., Fischer, R. Rational design of a host cell protein heat precipitation step simplifies the subsequent purification of recombinant proteins from tobacco. Biochemical Engineering Journal. 88, 162-170 (2014).
- Simonian, M. H., Smith, J. A. Spectrophotometric and colorimetric determination of protein concentration. Current Protocols in Molecular Biology. 76 (Chapter 10), (2006).
- Buyel, F. J., Kaever, T., Buyel, J., Fischer, R. Predictive models for the accumulation of a fluorescent marker protein in tobacco leaves according to the promoter/5'UTR combination. Biotchnology and Bioengeneering. 110 (2), 471-483 (2013).
- Piliarik, M., Vaisocherova, H., Homola, J. Surface plasmon resonance biosensing. Methods in Molecular Biology. 503, 65-88 (2009).
- Buyel, J. F., Fischer, R. Scale-down models to optimize a filter train for the downstream purification of recombinant pharmaceutical proteins produced in tobacco leaves. Biotechnology Journal. 9 (3), 415-425 (2014).
- Baird, G. S., Zacharias, D. A., Tsien, R. Y. Biochemistry, mutagenesis, and oligomerization of DsRed, a red fluorescent protein from coral. Proceedings of the National Academy of Sciences, USA. 97 (22), 11984-11989 (2000).
- Vrzheshch, P. V., Akovbian, N. A., Varfolomeyev, S. D., Verkhusha, V. V. Denaturation and partial renaturation of a tightly tetramerized DsRed protein under mildly acidic conditions. FEBS Letters. 487 (2), 203-208 (2000).
- Firer, M. A. Efficient elution of functional proteins in affinity chromatography. Journal of Biochemical and Biophysical Methods. 49 (1-3), 433-442 (2001).
- Pabst, T. M., et al. Engineering of novel Staphylococcal Protein A ligands to enable milder elution pH and high dynamic binding capacity. Journal of Chromatography A. 1362, 180-185 (2014).
- Müller, E., Vajda, J. Routes to improve binding capacities of affinity resins demonstrated for Protein A chromatography. Journal of Chromatography B. 1021, 159-168 (2016).
- Shamloul, M., Trusa, J., Vadim, M., Vidadi, Y. Optimization and Utilization of Agrobacterium-mediated Transient Protein Production in Nicotiana. Journal of Visualized Experiments. (86), 51204 (2014).
- Rademacher, T., et al. Plant cell packs: a scalable platform for recombinant protein production and metabolic engineering. Plant Biotechnology Journal. , (2018).
- Saxena, L., Iyer, B. K., Ananthanarayan, L. Purification of a bifunctional amylase/protease inhibitor from ragi (Eleusine coracana) by chromatography and its use as an affinity ligand. Journal of Chromatography. B. 878 (19), 1549-1554 (2010).
- Kurppa, K., Reuter, L. J., Ritala, A., Linder, M. B., Joensuu, J. J. In-solution antibody harvesting with a plant-produced hydrophobin-Protein A fusion. Plant Biotechnology Journal. 16 (2), 404-414 (2018).
- Menzel, S., et al. Optimized Blanching Reduces the Host Cell Protein Content and Substantially Enhances the Recovery and Stability of Two Plant-Derived Malaria Vaccine Candidates. Frontiers in Plant Science. 7 (159), 1-7 (2016).
- Yigzaw, Y., Piper, R., Tran, M., Shukla, A. A. Exploitation of the adsorptive properties of depth filters for host cell protein removal during monoclonal antibody purification. Biotechnology Progress. 22 (1), 288-296 (2006).
- Menzel, S., et al. Downstream processing of a plant-derived malaria transmission-blocking vaccine candidate. Protein Expression and Purification. 152, 122-130 (2018).
- Vöpel, N., Boes, A., Edgü, G., Beiss, V. Malaria vaccine candidate antigen targeting the pre-erythrocytic stage of Plasmodium falciparum produced at high level in plants. Biotechnology Journal. 9 (11), 1435-1445 (2014).
- Lee, C. W., Wang, H. J., Hwang, J. K., Tseng, C. P. Protein thermal stability enhancement by designing salt bridges: a combined computational and experimental study. PLoS ONE. 9 (11), e112751 (2014).
- Zhu, L., Cheng, F., Piatkowski, V., Schwaneberg, U. Protein engineering of the antitumor enzyme PpADI for improved thermal resistance. Chembiochem. 15 (2), 276-283 (2014).
- Khanal, O., et al. Contributions of depth filter components to protein adsorption in bioprocessing. Biotechnology and Bioengineering. 115 (8), 1938-1948 (2018).
- Buyel, J. F., Fischer, R. Downstream processing of biopharmaceutical proteins produced in plants: the pros and cons of flocculants. Bioengineered. 5 (2), 138-142 (2014).
- Buyel, J. F. Procedure to Evaluate the Efficiency of Flocculants for the Removal of Dispersed Particles from Plant Extracts. Journal of Visualized Experiments. (110), e53940 (2016).
- Fink, D., et al. Ubiquitous expression of the monomeric red fluorescent protein mCherry in transgenic mice. Genesis. 48 (12), 723-729 (2010).
- Gagnon, P. Technology trends in antibody purification. Journal of Chromatography A. 1221, 57-70 (2012).
- Figueira, M., Laramée, L., Murrell, J. C., Groleau, D., Míguez, C. Production of green fluorescent protein by the methylotrophic bacterium Methylobacterium extorquens. FEMS Microbiology Letters. 193 (2), 195-200 (2001).
- Bornhorst, J. A., Falke, J. J. Purification of proteins using polyhistidine affinity tags. Methods in enzymology. 326, 245-254 (2000).
- Sainsbury, F., Jutras, P. V., Vorster, J., Goulet, M., Michaud, D. A. Chimeric Affinity Tag for Efficient Expression and Chromatographic Purification of Heterologous Proteins from Plants. Frontiers in Plant Science. 7, 141-141 (2016).
- Krupka, M., et al. The Position of His-Tag in Recombinant OspC and Application of Various Adjuvants Affects the Intensity and Quality of Specific Antibody Response after Immunization of Experimental Mice. PLoS ONE. 11 (2), e0148497 (2016).
- Goel, A., et al. Relative position of the hexahistidine tag effects binding properties of a tumor-associated single-chain Fv construct. Biochimica et Biophysica Acta. 1523 (1), 13-20 (2000).
- Tustian, A. D., et al. Development of a novel affinity chromatography resin for platform purification of bispecific antibodies with modified protein a binding avidity. Biotechnology Progress. , (2018).
- Zandian, M., Jungbauer, A. An immunoaffinity column with a monoclonal antibody as ligand for human follicle stimulating hormone. Journal of Separation Science. 32 (10), 1585-1591 (2009).
- Kelley, B. Very large scale monoclonal antibody purification: the case for conventional unit operations. Biotechnology Progress. 23 (5), 995-1008 (2007).
- Petrou, C., Sarigiannis, Y., S, K. o. u. t. s. o. p. o. u. l. o. s. Ch. 1. Peptide Applications in Biomedicine, Biotechnology and Bioengineering. , 1-21 (2018).
- Menegatti, S., et al. Design of protease-resistant peptide ligands for the purification of antibodies from human plasma. Journal of Chromatography A. 1445, 93-104 (2016).
- Rademacher, T., et al. Plant cell packs: a scalable platform for recombinant protein production and metabolic engineering. Plant Biotechnology Journal. , 1-7 (2019).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados