Method Article
Implante crônico de matrizes flexíveis múltiplas do elétrodo do polímero
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
É descrito abaixo um método para a implantação de matrizes múltiplas do elétrodo do polímero através das regiões anatomicamente distantes do cérebro para a gravação eletrofisiológicos crônica em ratos livremente moventes. A preparação e a implantação cirúrgica são descritas detalhadamente, com ênfase nos princípios de design para orientar a adaptação desses métodos para uso em outras espécies.
Resumo
Gravações simultâneas de grandes populações de neurônios individuais em regiões do cérebro distribuídas ao longo de meses a anos permitirão novas avenidas de desenvolvimento científico e clínico. O uso de matrizes flexíveis do elétrodo do polímero pode suportar a gravação duradouro, mas as mesmas propriedades mecânicas que permitem a longevidade da gravação fazem inserções múltiplas e a integração em um implante crônico um desafio. Está aqui uma metodologia por que as matrizes múltiplas do elétrodo do polímero podem ser alvejadas a um jogo relativamente espacialmente unrestringido de áreas do cérebro.
O método utiliza os dispositivos do polímero da fino-película, selecionados para seus biocompatibilidade e capacidade conseguir interfaces de gravação electrophysiologic a longo prazo e estáveis. O implante resultante permite direcionamento preciso e flexível de regiões anatomicamente distantes, estabilidade física por meses e robustez ao ruído elétrico. A metodologia suporta até dezesseis dispositivos serialmente inseridos em oito alvos anatômicos diferentes. Como demonstrado anteriormente, a metodologia é capaz de gravar a partir de 1024 canais. Destes, os 512 canais nesta demonstração utilizados para a gravação de neurônio único rendeu 375 unidades individuais distribuídas em seis locais de gravação. Importante, este método também pode gravar unidades individuais por pelo menos 160 dias.
Esta estratégia de implantação, incluindo temporariamente preparando cada dispositivo com uma canela retrátil de inserção de silício, envolve tethering de dispositivos em suas profundidades alvo para uma peça base de plástico crânio-aderido que é personalizado-projetado para cada conjunto de gravação alvos, e estabilização/proteção dos dispositivos dentro de uma caixa plástica silicone-enchida, costume-projetada. Também é coberto a preparação de dispositivos para implantação, e princípios de design que devem orientar a adaptação a diferentes combinações de áreas cerebrais ou projetos de matriz.
Introdução
Um implante neural ideal registraria de um número muito grande de neurônios individuais em áreas distribuídas do cérebro durante semanas a meses. As matrizes flexíveis do elétrodo do polímero fornecem gravações electrofisiológicas com a longevidade para gravar por meses e a estabilidade para seguir neurônios individuais1,2,3. No entanto, as mesmas propriedades mecânicas que reduzem o dano de cisalhamento4 e conferem a capacidade de biocompatibilidade e gravação2,3,5,6,7, 8 pose um desafio a sua inserção no cérebro relativo a seus contrapartes rígidos. O trabalho anterior realizou um máximo de arrays de 4 32 canais, mas o rendimento total de neurônios únicos classificados putativos é nãorelatado 2,3,9. Por outro lado, matrizes de eletrodos à base de silício têm sido usadas em implantes de alta densidade, multiregião, mas essas tecnologias não têm a capacidade de gravar picos de neurônios ao longo de meses (longevidade) ou para rastrear os mesmos neurônios (estabilidade) nessa escala temporal, ou a densidade para gravar a partir de centenas de neurônios individuais em várias regiões cerebrais. O método apresentado aqui supera o baixo número de inserções em métodos atuais baseados em array de eletrodos de polímero, proporcionando assim meios para a gravação eletrofisiológica de grande número de neurônios individuais em múltiplas regiões anatomicamente distantes para meses, com a estabilidade para gravar a partir dos mesmos neurônios individuais em muitos dias.
Há algum debate a respeito da importância de usar um substrato de polímero em vez de estratégias baseadas em microfio ou silício. Como demonstrado por Dhawale et al.10, os microfios são efetivamente capazes de gravações estáveis de meses de duração em roedores, embora os implantes tenham sido limitados a 16 tetrodes em uma única região. Escalar acima o tamanho do implante do Microwire alcanga um limite superior relativamente elevado, com os até 1792 canais implantados conseguidos em um primata não-humano11. No entanto, a construção das matrizes de microfios é incompatível com os processos de nanofabricação de silício e é, portanto, extremamente demorado, exigindo manuseio manual de cada canal individualmente durante a construção12,13 ,14. Como tal, não é claro se esta tecnologia poderia suportar uma ordem de aumento de magnitude nos canais de gravação.
Os dispositivos atuais do silicone podem coloc centenas ou mesmo sobre mil elétrodos em um único dispositivo monolítico15,16,17,18,19. Os mais recentes processos de fabricação de silício geram dispositivos com áreas transversais menores, independentemente do material, resultando em menor ativação glial20,21,22,23 ,24 e mais dispositivos complacentes. Há uma variabilidade nos relatórios da longevidade da gravação da único-unidade da sonda do silicone, com o algum que indica que as sondas de silício relativamente grandes podem fornecer a gravação a longo prazo25,26. Notavelmente, os mais recentes dispositivos de silício comercialmente disponíveis17 têm a longevidade para gravar por vários meses e têm áreas transversais muito semelhantes às hastes utilizadas no método descrito aqui (Jun et al. 201717: 70 μm x 20 μm, dispositivos descritos aqui e em Chung et al. 20191: 68 μm – 80 μm x 14 μm). Devido à diferença na estabilidade, esta ponta de prova não foi demonstrada para poder gravar dos mesmos neurônios sobre semanas. Isto é provável devido a alguma combinação do uso do silicone rígido assim como o tethering direto ao crânio, sabido para causar o MicroMotion, a instabilidade, e o gliosis na relação do array-cérebro27,28. Para construir um dispositivo que possa mover-se com o tecido neural, os materiais que são macios5,29 e7 flexíveis são exigidos. Muitos polímeros disponíveis (ver Geddes e Roeder30, fattahi et al.31, e weltman et al.32 para revisões) têm a flexibilidade e estabilidade de microfios e também são compatíveis com os processos de nanofabricação, que permitem a embalagem densa de dispositivos de silício.
Várias questões de implante neural são específicas para o uso de matrizes flexíveis de eletrodos de polímero. O primeiro deles é a inserção da matriz, como matrizes flexíveis falta a rigidez para ser avançado para o cérebro como silício ou Microwire-based estratégias. A maioria das estratégias de inserção para dispositivos flexíveis depende de um endurecimento temporário do substrato, como é feito neste método (ver Weltman et al.32 para revisão). Há cinco estratégias notáveis que não fazem uso de um ônibus rígido. Em primeiro lugar, existem métodos que fazem uso de materiais que transitem de rígida para complacente na implantação33,34. Um inconveniente desta estratégia é que exige uma área transversal relativamente grande para conseguir a força exigida para a penetração do tecido de cérebro antes de flambagem como ditada pelo cálculo de força de flambagem de Euler35. Esse aumento na área de corte transversal impactará negativamente a saúde do tecido circundante20,21,22,23,24. Em segundo lugar é o uso de uma estrutura de apoio removível acima do cérebro36, embora isso requer a remoção demorada ou dissolução de andaimes para manter um comprimento mínimo sem suporte (e força de flambagem alta). Alternativamente, exigiria a matriz a ser inserida com um comprimento sem suporte mais longo, exigindo assim um substrato de matriz mais rígida ou uma área de seção transversal de matriz maior. O terceiro é pre-Penetration para abrir um furo para que a disposição flexível seja introduzida dentro depois de35. Isto exige o realinhamento preciso ou o diâmetro relativamente grande da pre-penetração, e a rigidez da disposição do elétrodo e a área transversal para permitir a inserção não suportada. Quarto é o uso de revestimentos dissolúveis para endureçar o dispositivo flexível. Isso aumenta significativamente a área transversal e os danos agudos causados pela inserção, mesmo quando são tomadas precauções especiais para preservar a ponta afiada de um dispositivo37. Quinto é a injeção da matriz de polímero. Esta estratégia teve sucesso na realização de implantes com até 4 32-ch inserções2, mas requer a utilização de uma área transversal muito maior para a inserção, um 250 μm-1,5 mm diâmetro exterior do tubo capilar de vidro9, causando maior dano agudo. Em contraste, usando uma canela removível, ao adicionar a área transversal à inserção aguda, permite o uso dos materiais os mais rígidos possíveis, e pode, conseqüentemente, ser o tamanho mínimo teórico ao introduzir um dispositivo arbitrariamente flexível. Assim, a inserção usando um shuttle rígido é atualmente a opção mais atrativa para a inserção de dispositivos flexíveis.
Há duas exigências de toda a aproximação da canela da inserção: um substrato apropriadamente duro e uma maneira de acoplá-lo o dispositivo flexível ao substrato. Os materiais da canela da inserção são tipicamente silicone38,39,40,41, aço inoxidável8,42, ou tungstênio43,44, 45, com materiais mais rígidos que permitem áreas transversais menores. Estes são tipicamente afixados usando um adesivo tal como o polietileno glicol (PEG)8,38,39,42,43, forças eletrostáticas40, ou dirigem acoplamento físico45,46. Em todos os casos, os desafios são o alinhamento e acoplamento da matriz do eletrodo e da canela de inserção antes da inserção e desacoplamento após a inserção. Recounted abaixo é um refinamento do método introduzido por Felix et al.39 para cinta temporariamente a disposição do elétrodo com uma canela da inserção do silicone, unida usando o Peg, que é removida após a inserção da disposição a sua profundidade do alvo.
Um segundo desafio apresentado por dispositivos flexíveis dentro de um implante crônico é aquele de estabilizar o dispositivo dentro do cérebro ao ainda permitir que o dispositivo seja integrado em um implante anexado ao crânio. O cérebro se move em relação ao crânio devido a pulsações naturais, alterações edematosas pós-traumáticas, impacto e outras causas, e a matriz de eletrodos deve, portanto, ser pelo menos um pouco livre para se mover em relação a onde é afixada ao crânio e hardware de gravação. Isto é conseguido usando uma parte base plástica 3D-impressa, costume-projetada para cada jogo de alvos do implante, que tem funções múltiplas: um reservatório fisiológico durante a implantação, posição para amarrar as matrizes do polímero, e carcaça para o gel do silicone. A posição tethering acima do crânio e do gel do silicone trabalha junto para criar um raio maior da curvatura para a disposição e permite desse modo para forças compressivas maiores na disposição. Isso, por sua vez, permite o movimento do cérebro em relação aos pontos de ancoragem da matriz (crânio) para ser traduzido em carga de flambagem.
Os desafios adicionais incluem a necessidade de abrigar matrizes múltiplas e de fornecer o relevo de tensão amplo para que o animal se comporte livremente sem transferência das vibrações ou das forças do impacto aos arrays do elétrodo, que podem causar o movimento relativo ao tecido neural. As adaptações às soluções que foram usadas em aplicações similares onde o cérebro deve ser estável em relação a uma janela de gravação rígida abordaram este desafio. Um gel dural artificial do silicone do vedador (tabela dos materiais), que foi demonstrado previamente para ser não-tóxico e para impedir o escapamento47do CSF, fornece o Counter-pressure ao cérebro para impedir o inchamento exterior e para estabilizar a disposição em a superfície do cérebro. Uma camada adicional de proteção é adicionada às fitas do dispositivo pelo elastómetro do silicone da médio-viscosidade, da classe cirúrgica, demonstrado previamente para o uso em selar os implantes neurais crônicos do elétrodo48. Finalmente, o implante e o headstage silicone-tamponados são envoltos com as partes 3D-Printed projetadas para manter um baixo centro de massa para a redução mínima da mobilidade normal do animal.
Este protocolo começa com um arranjo flexível do microelétrodo do polímero montado a um shuttle da inserção do silicone. Prossegue com a montagem do dispositivo da disposição-canela às partes 3D-Printed da inserção, descreve a técnica cirúrgica e os passos da construção do implante exigidos para implantar com sucesso um animal, e são capazes de suportar o multi-elétrodo do polímero dezesseis matrizes implantadas em oito regiões anatomicamente distantes em um único rato1.
Este protocolo assume os materiais de partida de matrizes de eletrodos de polímero anexado pelo polietileno glicol (PEG) adesivo biodissolúvel a um transporte de inserção de silício, como mostrado em Felix et al.39, e pelo menos duas inserção independente móvel peças: uma para a qual o vaivém de silício será colado e um para o qual o conector da matriz do eletrodo será aderido. Este protocolo igualmente usa uma terceira parte da inserção para unir mais firmemente as duas partes da inserção a um micromanipulador da mícron-escala. Todos os arquivos para impressão 3D podem ser encontrados em: https://github.com/jasonechung/PolymerProbe3DParts
Cada arranjo do elétrodo do polímero, usado neste método é compreendido de dois a quatro Shanks da gravação, uma fita que transmita os traços elétricos, e, na extremidade da fita, um conector da ferragem ou uma placa de circuito impresso. A disposição e a fita do elétrodo são fixadas sobre a canela do silicone com PEG. Cada fita tem um 2 cm de comprimento x 1 mm de espessura tubo de poliimida anexado à fita através de epóxi curável UV, estendendo perpendicular ao comprimento da fita. Cada dispositivo (matriz de eletrodos e transporte de inserção) deve ser carregado nas peças de inserção impressas em 3D que serão usadas para inserir o array no cérebro e retrair a canela (Figura 1). Neste projeto, o micromanipulador hidráulico da inserção (verde, tabela dos materiais) move o instrumento inteiro da inserção (parte 1, parte 2 e o micromanipulador da retração, alaranjado) a sua profundidade do alvo. Uma vez que o array foi destacado do aparelho de inserção e fixo, o segundo, o micromanipulador de retração (laranja) retraí parte 1 e o vaivém anexado independentemente do resto do aparelho de inserção, removendo o vaivém sem deslocar a matriz.

Figura 1: componentes do inseridor.
(A) as peças 1 e 2 são temporariamente fixadas entre si com um parafuso removível e serão posteriormente encaixadas no pistão do micromanipulador de retração (laranja). (B) a disposição e a canela da inserção são aderiram à parte 1 e o conector da disposição é Unido à parte 2 com fita frente e verso. A parte 3 conecta o micromanipulador da retração e as partes 1 e 2 ao micromanipulador da inserção (verde). O micromanipulador da inserção é fixado a um adaptador stereotactic para o posicionamento do implante. As partes 1-3 são retratadas em seus tamanhos relativos. A parte 4 é uma parte de estabilização para o alinhamento apropriado da canela da inserção. Por favor clique aqui para ver uma versão maior desta figura.
Protocolo
Todos os protocolos envolvidos em animais descritos neste manuscrito foram aprovados pelo Comitê institucional de cuidado e uso de animais da UCSF.
1. preparação de matrizes do elétrodo do polímero para a inserção (~ 30 minutos)
- Colocar a peça 1 na peça 2 inserindo um parafuso através de furos alinhados verticalmente, para fixar as peças juntas (Figura 2). Segure estas duas peças em um vício. Anexar fita dupla face (tabela de materiais) ao topo da peça 2. Colocar a peça estabilizadora 4 no fim da peça 1. Ele será mantido no lugar por atrito.

Figura 2: montagem para alinhamento do array-shuttle.
(A) montagem das peças 1, 2, e estabilização da peça na preparação do acessório de transporte de inserção. B) peças 1 e 2 mantidas em conjunto com o parafuso do polegar. Por favor clique aqui para ver uma versão maior desta figura.
- Com a mão, alinhe a matriz do eletrodo e fixe a canela de inserção com o segmento de extremidade estreita da peça 1. Quando a sonda estiver alinhada com o eixo longitudinal da peça 1, adira o conector da matriz à fita dupla face poliimida na porção plana da peça 2.
- Com o fórceps derrubado plástico, contatando somente a asa do polyimide unida à fita da disposição, levante a ponta do dispositivo da disposição do shuttle-elétrodo da inserção fora da parte 1, ao exterior da parte estabilizando (Figura 3a).
- Aplique uma pequena quantidade de cianoacrilato (tabela de materiais) ou outro adesivo (~ 10 μL) ao final da peça 1. Muito pouco não vai aderir fortemente o transporte de inserção para a peça 1, arriscando descolamento durante a inserção ou retração. Demasiado riscos transbordando a canela e aderindo a disposição própria à parte 1.
- Usando o fórceps derrubado plástico, contatando somente a asa do polyimide unida à fita da disposição, Realinhe o dispositivo com o segmento estreito da parte 1, com a aba quadrada da canela da inserção (e somente o shuttle) sobre a colagem (Figura 3B). Faça pequenos ajustes de alinhamento manipulando o lado do transporte de silício ou o PEG. Evite aplicar força excessiva à fita ou às hastes.

Figura 3: alinhamento, fixação e esterilização do array-shuttle.
(A) orientação apropriada do dispositivo da disposição do shuttle-elétrodo da inserção para a aplicação da colagem na estação de encaixe da parte 1. Dois-Shank array-Shuttle mostrado. (B) arranjo do elétrodo do polímero e Shuttle da inserção montados na parte da inserção, com a parte estabilizando provisória para o alinhamento. Dois-Shank array-Shuttle mostrado. (C) dispositivo de inserção encerrado em caixa plástica para proteção durante a esterilização. Por favor clique aqui para ver uma versão maior desta figura.
- Aplique a pressão descendente delicada com o fórceps em ambos os lados da parte de estabilização e remova-o do conjunto sem mover a disposição.
- Retire o conjunto do dispositivo montado (peças 1 e 2, matriz, shuttle de inserção e conector de matriz) do vício e adira-o com fita dupla face à base de uma pequena caixa plástica para esterilização por óxido de etileno (Figura 3C). A esterilização a vapor não é adequada para estes dispositivos.
2. projeto da parte baixa
- Determine os tamanhos da craniectomia para alvos stereotactic selecionados assim como posições de parafusos do crânio e de parafusos à terra. O tamanho da craniectomia é determinado pela pegada da matriz, com algumas centenas (~ 300) de circunferência do mícron para ajustes da colocação para evitar o vasculature de superfície.
- Usando um software de design (por exemplo, CAD), projetar a pegada da peça base para cercar as craniectomias planejadas e caber dentro do perímetro definido pelo cume temporal e parafusos do crânio, maximizando a área de superfície do crânio que estará fora da peça de base para que o cimento de cimentação adesivo pode ligar para aderir o implante ao crânio.
- Contorno da superfície inferior da peça de base para que ele possa ser aderido ao crânio sem lacunas, reduzindo a chance de infecção e impedindo a salina ou elastômero de silicone de escoar para fora.
- Defina a altura da peça base para 3-7 mm, suficientemente alta para segurar o elastômero de soro fisiológico e silicone, mas suficientemente baixo para não impedir a visibilidade durante a (s) inserção (ões) da matriz.
Nota: a peça de base pode ser projetada com postes verticais ou características semelhantes às quais as asas de poliimida podem ser amarradas em um ponto mais alto acima do crânio. Não permita que os pontos do acessório impeçam a vista. - imprimir em 3D a peça de base (Figura 4) e esterilizar a peça de base antes da implantação.
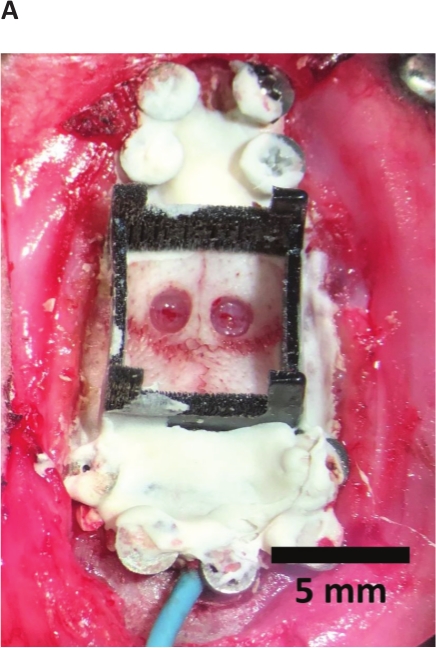
Figura 4: crânio preparado para implante.
Durectomies completo com parafusos do crânio, camada acrílica base, e a parte baixa reparada ao crânio.
3. preparação do crânio (~ 2 h)
- Selecione um rato 400 g ou superior para suportar o peso do implante. Foram utilizados ratos machos Long-Evans, aos 6-12 meses de idade.
- Anestesiem o rato. Coloque o animal em uma câmara de anestesia. Ligue 5% de isoflurano.
- Injete uma dose intraperitoneal de cetamina (50 mg/kg), xilazina (6 mg/kg) e atropina (0,14 mg/kg).
- Monitore a profundidade da anestesia a cada 20 min durante todo o procedimento verificando se não há retirada da pinça da pata e a frequência respiratória permanece 50-75 respirs/min.
- Aplique pomada ocular ao rato.
- Raspar a cabeça do rato.
- Coloque o animal no suporte estereotódico.
- Prepare o local cirúrgico esfregando com três esfrega alternadas cada um de esfoliação cirúrgica de iodo-povidona, seguida de soro fisiológico estéril.
- Injete 0,2 cc de lidocaína a 0,5% no couro cabeludo.
- Faça uma incisão sagital na linha média do crânio expondo pelo menos 3 mm anterior à Bregma e 3 mm posterior ao lambda.
- Retire o periósteo usando cotonetes de algodão.
- Marque a inserção e os locais da craniectomia marcando o crânio com um bisturi usando um plano cartesiano coordenado zerado no Bregma com um instrumento stereotactic.
- Perfure sítios craniectomizados, deixando uma fina camada de osso que pode ser removida com fórceps. Não exponha a dura. Isto permite a limpeza do crânio da poeira óssea sem interromper a dura-máter.
- Perfurar e inserir os parafusos ósseos, um de cada vez, para evitar que a poeira óssea entre nos furos. Use generosa irrigação isotónica para remover a poeira óssea. Para um implante de aproximadamente 50 gramas, use 10-12 parafusos. Os parafusos titanium permitem a osseointegração49.
- Avance os parafusos para uma profundidade que penetra totalmente no crânio sem impactar o cérebro.
- Conecte pelo menos um parafuso do osso a um fio eletricamente condutor para funcionar como uma terra do circuito.
- Depois que toda a perfuração é completa, limpe o crânio da poeira de osso com uma lavagem salina.
- Seque o crânio com cotonetes do algodão ou outros absorventes e aplique uma camada inicial de cimento de cimentação adesivo (tabela dos materiais) aos parafusos (não use o esmalte Etchant no crânio do roedor). Este adesivo preliminar que cimentação a camada do cimento aumentará a adesão do implante e diminui o trabalho em etapas mais atrasadas da adesão.
- Remova a camada fina de osso restante em cada local da craniectomia.
- Incise dura usando uma agulha de 30 Gauge com uma ponta dobrada, evitando qualquer vasculatura. O comprimento da incisão coincide com as dimensões do transporte de inserção.
- Se houver sangramento, irrigar manualmente com uma gota salina suave e não continuar até que o sangramento parou.
- Se várias durectomias estão sendo executadas, manter os locais húmidos com espuma de gel ou outro método, tais como irrigação regular a cada poucos minutos com soro de temperatura corporal.
- Seque o crânio novamente com cotonetes de algodão ou outros absorventes em preparação para a aderência do cimento de cimentação da peça de base ao crânio.
- Posicione a peça base estéril. Se a peça de base cobrirá a Bregma, marque outro local a uma distância conhecida como um proxy.
- Aplique o cimento de cimentação adesivo em torno do perímetro da parte baixa. Encha a parte de base aderente com soro fisiológico; identificar e corrigir qualquer vazamento com o cimento de cimentação adesivo na interface entre a peça de base e a interface do crânio (Figura 5).
Nota: é crucial que a peça de base seja completamente fixada ao crânio para evitar fugas do gel de silicone de selante dural artificial, pois isso impedirá a adesão adequada do implante ao crânio. O animal está pronto para ter matrizes inseridas.
4. inserções seriais de matrizes e retrações de vaivéns (~ 1 h por matriz)
Observação: este procedimento deve ser pilotado com um dispositivo não viável, especialmente para implantes de matriz múltipla, onde um dispositivo pode interferir com a implantação de dispositivos subseqüentes.
- Coloque as peças 1 e 2 no pistão do micromanipulador de retração. Ajuste o micromanipulador da peça 1 para uma posição estendida e o micromanipulador da peça 3 para uma posição retraído. O pistão irá deslizar para uma profundidade terminal dentro da peça 1. A parte 2 cabe dentro da parte superior da parte 3, com os furos alinhados.
- Colocar a peça 3 no êmbolo do micromanipulador de inserção e fixar com um parafuso no lado de baixo da peça 3 (Figura 5a, B).
- Carregar e aparafusar peças 2 e 3 juntas, de modo que a movimentação do micromanipulador de inserção mova todo o aparelho de inserção (Figura 5C).
- Retire o parafuso que mantém as peças 1 e 2 juntas. A parte 1 move-se independentemente da parte 2, para permitir a retração separada da canela da inserção do instrumento.
- Insira este parafuso no orifício lateral da peça 1, perpendicular à faixa de pistão, até que o parafuso aplique pressão sobre o pistão. Isto assegura que a parte 1 se mova de acordo com o pistão de retracção, como visto na Figura 5D. Certifique-se de escolher o orifício lateral que não impedirá a visão quando o aparelho estiver montado no instrumento estereotáxico.

Figura 5: montagem do inseridor.
(A) montagem da peça 3 aos Micromanipuladores. B) fixação das peças 1 e 2 no aparelho de inserção. (C) peças de inserção com eletrodo montado arranjo-dispositivo de transporte de inserção. (D) parafuso do polegar segurando a peça 1 e 2 juntas removidas. Por favor clique aqui para ver uma versão maior desta figura.
- Retire qualquer gel-espuma das craniectomias. Use a Bregma real ou proxy para segmentação estereotáxica. Ao mover o dispositivo para o local de inserção, mantenha uma altura de pelo menos alguns centímetros acima do crânio.
- Evite períodos prolongados do dispositivo de transporte de matriz perto do crânio ou do cérebro para diminuir as chances de que a condensação desanexará a matriz do transporte de inserção antes ou durante a inserção. Se isso ocorrer, tente elevar o dispositivo de transporte de matriz alto acima do cérebro e crânio e esperar para secar e re-aderir.
- Ajuste as coordenadas do implante para evitar a vasculatura superficial. Como durante a craniectomia e a durectomia, evite penetrar os vasos diretamente.
- Insira o aparelho de forma rápida (~ 25 μm/s), diminuindo com o instrumento estereotáxica até que o dispositivo entre no cérebro. O dispositivo não penetrará o cérebro imediatamente. O grau de resistência e ondulação dependerá do local de destino e do design do dispositivo (por exemplo, dois contra quatro hastes, ângulo de ponta), mas a ondulação geralmente não excede 1 mm (Figura 6).
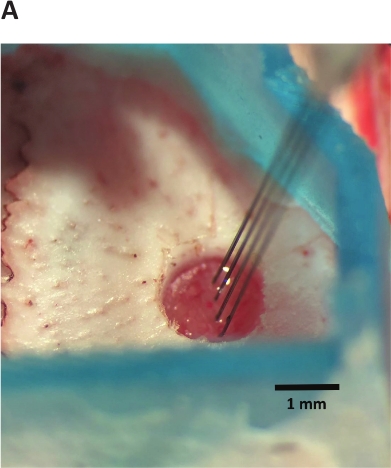
Figura 6: inserção do array-shuttle.
Array-Shuttle é avançado para o cérebro para a profundidade alvo. Quatro-shank array-Shuttle mostrado.
- Uma vez no cérebro, abaixe com o micromanipulador, diminuindo a velocidade na aproximação à profundidade do alvo:
- Use o braço estereotáxico para começar a inserir a 25 μm/s.
- Use o micromanipulador para inserir a 10 μm/s quando 2 mm a 1 mm acima da profundidade alvo.
- Inserção lenta com micromanipulador a 5 μm/s quando 1 mm a 500 μm acima da profundidade alvo.
- Inserção lenta mais a 1-2 μm/s durante a 500 μm final ao alvo.
- Visualize as asas do dispositivo (tubulação horizontal do polyimide) e o ponto da inserção durante abaixar para evitar o destacamento prematuro do shuttle-array.
- Quando a profundidade alvo foi atingida (Figura 7a), ancorar bilateralmente as asas de poliimida para os locais de fixação da peça de base através de acrílico leve-curável ou outro adesivo, como cianoacrilato (tabela de materiais). Seque, se necessário, as asas ou o ponto de fixação na peça de base, como a condensação pode coletar nestas superfícies e evitar a aderência. Se a visibilidade ou outras limitações de espaço exigirem, ancorar em somente uma asa do polyimide é tipicamente suficiente.
- Antes da dissolução, o PEG aparecerá como uma massa globular sentada no topo da interface de transporte de matriz e inserção (Figura 7a). Dissolver PEG delicadamente gotejamento corpo-temperatura de soro na matriz no ponto onde ele é aderido ao shuttle. O período de tempo necessário dependerá do peso molecular do PEG selecionado e a dissolução completa pode ser verificada com visualização direta. Quando o PEG tiver dissolvido totalmente os limites das matrizes será completamente perceptível a partir do shuttle e parte 1 (Figura 7B).
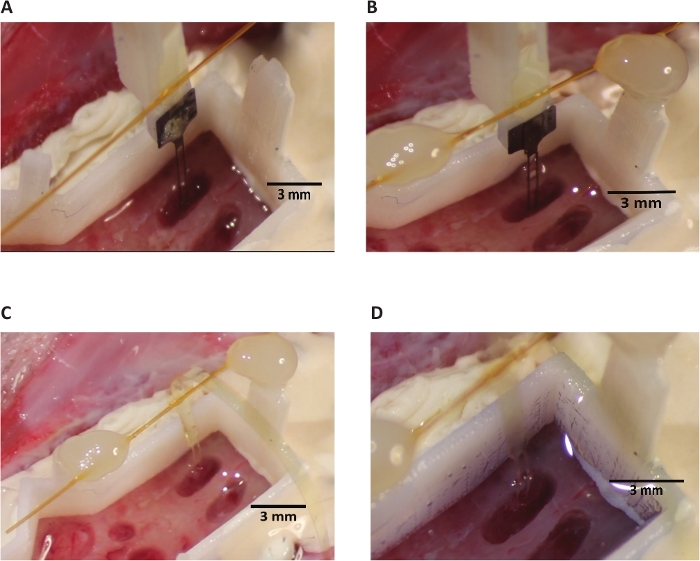
Figura 7: retração do vaivém.
(A) tethering das asas antes da retração. Matriz e shuttle de duas hastes mostrados. (B) dissolução do Peg e aderência da asa com característica da pata (circulado, azul) que permite a confirmação visual da dissociação bem sucedida da disposição e da canela durante a retração. (C) uma inserção bem sucedida da disposição depois que o Shuttle da inserção foi recolhido. (D) a parte baixa com gel do silicone enche-se para uma única inserção da disposição da dois-pata. O gel de silicone de baixa viscosidade utilizado tem uma tonalidade azul. Por favor clique aqui para ver uma versão maior desta figura.
- Usando o micromanipulador de retração, retire lentamente a canela de inserção. Continuar a irrigação salina (~ 1 gota/s) para a matriz a ser retraído. Use velocidades de retração que são as mesmas que a velocidade de inserção em distâncias relevantes da profundidade do alvo:
- Retraia usando o micromanipulador em 1-2 μm/s da profundidade do alvo a-500 μm.
- Acelere a retração usando o micromanipulador a 5 μm/s quando-500 μm a-1 mm.
- Acelere a retração usando o micromanipulador a 10 μm/s quando-1 mm a-2 mm.
- Retraia usando o braço estereotáxica a 25 μm/s de-2 mm do alvo e para cima.
- Visualize a interface entre a matriz e a shuttle de inserção durante a retração. A matriz de polímero se separará visivelmente do vaivém e aparecerá translúcida, pois a canela é retraído na junção semicircular entre as hastes do vaivém de inserção (Figura 7B).
- Remova o conector de matriz da parte 2 e mova para um local que não interferirá com inserções subseqüentes. A matriz de eletrodos de polímero está agora no cérebro e não está mais conectada ao instrumento estereotáxico (Figura 7C). Remova o transporte de inserção e outro hardware de inserção.
- Para várias inserções, repita as etapas 4.1-4.9; Não mova para a próxima seção até que todas as matrizes desejadas sejam inseridas. É mal aconselhado a inserir dois dispositivos dentro de 250 μm uns dos outros, como a ligeira curvatura da fita do dispositivo entre o cérebro e as asas na região de alívio de tensão pode estender pelo menos até aqui.
5. construção do implante (~ 2 h)
- Após a inserção final da matriz, solução salina vazia da peça de base usando uma pipeta ou cotonete, tendo cuidado para não interromper as matrizes ou fitas implantadas.
- Encha as craniectomias e a peça de base com elastômero de silicone de baixa viscosidade, ou outro selante dural artificial. Deixe-a curar (Figura 7D). Com várias inserções, coloque os conectores de hardware onde eles não interferem (figura 8a). Orientar apropriadamente os conectores da matriz, e construir o implante, assim que as fitas estão em sua posição desejada final.
- Cubra as matrizes, fitas de matriz e conectores em elastômero de silicone de viscosidade média. Dê a atenção especial à relação do polímero-conector, porque esta relação macia-dura do material é propensa a dano. Cubra as fitas da disposição completamente tais que quando as curas do silicone da médio-viscosidade, estão imobilizadas.
- Coloque os dispositivos cobertos de elastômeros no estojo projetado.
- Reforçar a base do implante com acrílico dental. Não permita que o acrílico venha no contato direto com as fitas da disposição porque a expansão do acrílico quando cura puder danificar os traços condutores.
- Aplique Bupivicaína e bacitracina pomada ao redor da incisão.
- Feche a incisão usando 4-0 suturas de nylon e cola de pele.
6. recuperação e cuidados de implante
- Remova o animal do instrumento stereotactic e coloc em seu lado em uma almofada de aquecimento.
- Dê injeção subcutânea de solução de Ringer quente (5 – 10 mL) para hidratar o animal.
- Uma vez que o animal está a locomoção (10 – 60 min), transfira para uma gaiola com metade da gaiola uma almofada de aquecimento a 37 ° c por 2-3 dias.
- uma almofada de aquecimento, dar acesso a alimentos e água amolecida.
- Injectar animais com 2 mg/kg de Meloxicam a cada 24 h (administração subcutânea ou oral) durante 1 semana, conforme necessário para o controlo da dor.
- Permitir que o rato 1-2 semanas para curar e ajustar o peso do implante (Figura 8B).
- Realize a lavagem regular de clorexidina do tecido ao redor do implante e a inspeção diária para irritação, infecção ou deiscência.
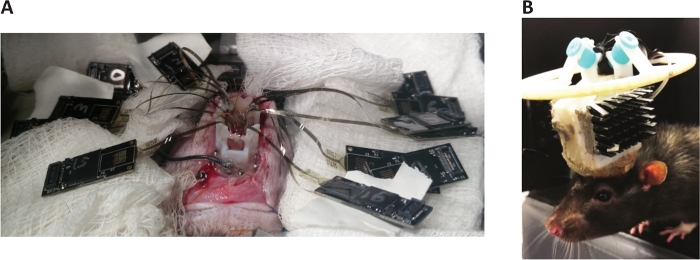
Figura 8: várias matrizes inseridas e Rat após a recuperação da implantação. (A) conectores de hardware em locais para não interferir com inserções subsequentes. (B) um 1.024-canaleta, implante crônico da disposição do polímero. Reproduzido com permissão de Neuron [figura suplementar 1H]1. Por favor clique aqui para ver uma versão maior desta figura.
Resultados
Seguindo este protocolo, uma gravação de implante neural de 1.024 canais rendeu 375 unidades individuais1 (classificadas com mountainsort50, sobreposição de ruído < 0, 3, isolamento > 0,96, 512 canais usados para gravação de unidade única, Figura 9A). Este protocolo pode ser usado para implantar diferentes números de dispositivos, com diferentes contagens de canais e especificações, para diferentes combinações de alvos de gravação. Usando o mesmo protocolo, a longevidade de gravação de unidade única foi demonstrada por pelo menos 160 dias1 em dados de 19 dispositivos (dispositivos de canal 18 32 em córtices pré-frontais, dispositivo de 1 64 canais no córtex orbitofrontal) em três ratos diferentes ( Figura 9B). Um dos três animais teve uma falha elétrica digital tendo por resultado uma inabilidade gravar de quatro dispositivos. Dos restantes 15/19 dispositivos, houve uma média de rendimento de gravação de ~ 1 unidade única por canal. Os dispositivos individuais tinham rendimentos de apenas algumas unidades individuais até ~ 2 unidades por canal. É típico ver rendimentos muito diferentes em dispositivos implantados no mesmo animal na mesma região.
Além, uma equipe cirúrgica diferente que segue o protocolo descrito aqui implantou seis animais adicionais cada um com uma combinação de dispositivos 4-6 32-Channel alvejados ao córtice orbitofrontal e ao núcleo accumbens, e a um hiperdrive tetrode (implante total peso aproximado de 50 g). Um animal teve um implante desanexar dentro de um mês da cirurgia. Um segundo animal morreu durante o período de recuperação pós-operatória, provavelmente não relacionado às etapas do protocolo descritas aqui. Os quatro animais restantes permaneceram saudáveis com implantes estáveis que para o comprimento do experimento, que durou 4-11 meses. As contagens da única unidade eram similares àquelas relatadas previamente para dispositivos 32-Channel.
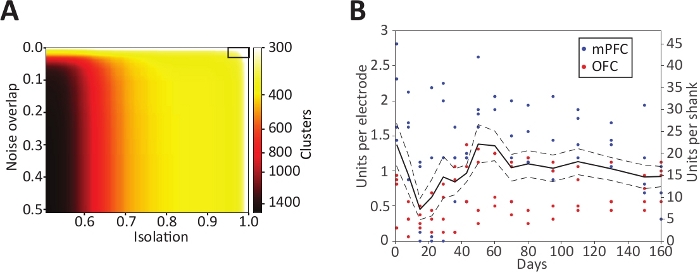
Figura 9: rendimento de unidade única e longevidade de gravação.
(A) número de clusters putativos de unidade única de 512 canais (do implante de canal 1.024), estratificados por limiares métricos de qualidade. A Curação automatizada usando o MountainSort (sobreposição de ruído 0, 3, isolamento 0,96, caixa preta no canto superior direito) resultou na identificação de 375 unidades individuais dos canais 512. Reproduzido com permissão de Neuron [Figura 2A]1. (B) rendimento unitário único para matrizes poliméricas por canal (eixo y esquerdo) ou por haste de 16 canais (eixo y direito) acima de 160 dias após a implantação (eixo x) em ratos. A linha contínua é o rendimento médio da pilha através de 8 hastes, linhas pontilhadas ± 1 SE. pontos de tempo individuais por haste são mostrados como pontos codificados por cor por região. Reproduzido com permissão de Neuron [figura 3A]1. Por favor clique aqui para ver uma versão maior desta figura.
Discussão
Este é um método para a implantação de matrizes múltiplas do elétrodo do polímero às áreas distribuídas do cérebro para a gravação de únicas unidades sobre meses. Este método representa um aumento de 8x nos canais de gravação e 4x aumento no número de inserções do sistema de polímero-array mais próximo em grande escala2,3. Esse sistema utilizou um sistema baseado em injeção de malha de polímero no mouse, mas não relata um número absoluto de unidades únicas putativas e, portanto, não é possível comparar a produtividade de um único neurão.
O método de inserção de um dispositivo flexível é baseado em um protocolo anterior de Felix et al.39, com modificações importantes: um aparelho de inserção de três peças para o movimento independente do vaivém de silício durante a retração, e tethering da matriz em sua profundidade do alvo antes da retração do Shuttle, que eliminam junto a necessidade para a retirada rápida descrita no protocolo original. Estas mudanças minimizam dano de tecido e mantêm a estabilidade da disposição durante a retração do transporte. Outras estratégias de implantação de dispositivo flexíveis, como dispositivos de endurecimento temporário com materiais biosolúveis, são compatíveis com as etapas subsequentes neste protocolo. Protegendo os dispositivos dentro do implante necessitado integrando estratégias previamente validadas para cobrir o cérebro e protegendo as fitas delicadas do dispositivo.
Devido a sua fragilidade, o cuidado e a atenção são exigidos evitar diretamente contatar ou de outra maneira transmitir a força aos arrays do elétrodo do polímero e aos ônibus da inserção do silicone. Particularmente ao trabalhar com vários dispositivos, a inserção deve ser observada um microscópio para evitar a interferência de um dispositivo com outro. Em geral, é possível lidar com uma matriz de eletrodos suavemente com fórceps de plástico derrubado, evitando os traços. Essa estratégia é apropriada, por exemplo, se a matriz de eletrodos de polímero começar a se retrair com a canela de inserção. Isso pode ocorrer se a PEG não estiver completamente dissolvida, ou devido à tensão superficial de soro fisiológico ou LCR entre o polímero e o silício.
Um dos erros recuperáveis mais comuns é o destacamento de matriz do shuttle de inserção. Isto pode ocorrer na inserção, porque as covinhas e a pressão do cérebro na ponta do dispositivo aumentam, se a disposição e a canela são alinhadas imperfeitamente ou se a condensação dissolveu parcialmente o PEG. Para re-aderir uma matriz, levantá-lo tão alto quanto possível acima da superfície do cérebro e esperar por ele para secar (aproximadamente 5 min).
Um aspecto crítico do planejamento de uma cirurgia de implantação de vários array é o projeto da peça base para acomodar todos os alvos do implante e sentar-se sem lacunas contra o contorno do crânio. A parte baixa é uma parte plástica pequena que seja fixada ao crânio após a limpeza do crânio, a colocação do parafuso, e as craniectomias parciais, antes da inserção das matrizes. Tem três funções: 1) para prender o soro fisiológico para dissolver o PEG que segue a inserção da disposição mas antes da retração da canela do silicone, 2) para fornecer uma posição acima da superfície do crânio a que as matrizes podem ser unidas por asas do polyimide, permitindo desse modo o relevo de tensão ao longo da fita acima de seu ponto de inserção no cérebro, e 3) para prender o vedador dural artificial, que estabiliza e protege as matrizes e o cérebro. A peça de base pode ser formada à mão ou 3D-impresso. Observou-se que drenar e secar a parte de base de soro fisiológico são muito importantes a inserção anterior do dispositivo. Estas etapas impedem a condensação e a separação da disposição e da canela da inserção. Secar a parte baixa é igualmente crítica a encher a parte baixa com o vedador dural artificial. É igualmente importante que a parte baixa não escape, porque uma película do gel do silicone é difícil de remover do crânio e impedirá a adesão do acrílico dental para o acessório crônico de confiança do implante ao crânio. Espera-se que qualquer elastômero de silicone de baixa viscosidade e biocompatível possa ser usado para preencher as craniectomias e a peça de base, com um elastômero de silicone de maior viscosidade ao seu redor e as fitas de matriz de polímero expostas.
Os avanços na nanofabricação de polímeros traduzem-se em matrizes de eletrodos à base de polímero, reduzindo os tamanhos de feição e aumentando o possível número de eletrodos em uma matriz mais próxima aos dos dispositivos de silício15,16,17 ,18,19. Da mesma forma, as áreas transversais de dispositivos poliméricos irão se encolher ao lado dos tamanhos de feição, proporcionando ainda melhor biocompatibilidade8. Mais uma vez, como está sendo realizado com dispositivos de silício, integração com amplificar, digitalização, e chips de multiplexação17 irá permitir ainda maior escala de gravação neural.
Divulgações
J. e. C e L.M.F. são inventores em uma patente pendente relacionada com o trabalho descrito aqui.
Agradecimentos
Este trabalho foi apoiado por NINDS conceder U01NS090537 para L. M. F e V.M.T., NIMH conceder F30MH109292 para J. E. C, e NIMH conceder F30MH115582 para H.R.J. J.E.C. e H.R.J. também são apoiados por NIGMS MSTP conceder #T32GM007618. O Instituto Flatiron é uma divisão da Fundação Simons.
Materiais
| Name | Company | Catalog Number | Comments |
| 3D Printed Stereotax Adapter Parts (3) and Base Piece (1) | N/A | N/A | 3d print parts, suggest <30 μm resolution for minimal hand finishing of parts. Files available at: |
| https://github.com/jasonechung/PolymerProbe3dParts | |||
| Dental Acrylic (Hygenic Repair Resin, Coltene type II quick set) | Colten/Whaledent | 8886784, 8881627 | Dental acrylic for use during implant construction |
| Hydraulic Micromanipulator (x2) | Narishige Group | MO-10 | 1-axis micromanipulator |
| Kapton Polyimide Tape | Bertech | PPTDE-1/2 | Double-sided tape |
| Kopf Stereotax Arm | Kopf Instruments | 103088R, 103088L | Standard rodent stereotax |
| Light Curable Dental Acrylic, Vivid Flow | Coltene/Whaledent | D33-01-00 | Light curable dental acrylic for use during implant construction |
| Loctite Gel Control | Henkel Corp. | 234790 1364076 1735574 1752699 | Cyanoacrylate for adhering silicon shuttle to corresponding 3d printed part |
| Metabond Quick Cement | Parkell | S380 | For direct application to skull to create strong connection between skull and implant |
| Polymer Electrode Arrays and Silicon Insertion Shuttles | Lawrence-Livermore National Laboratory | N/A | Fabricated at Lawrence-Livermore National Laboratory, polyimide electrode arrays, silicon insertion shuttle |
| Silicone Gel Kit, Low Viscosity | Dow Corning | 03/80 | Low-viscosity silicone gel for filling of 3d printed base piece |
| Silicone, Medium-Viscosity Kit | World Precision Instruments | Kwik-Sil | Medium-viscosity silicone gel for protection of polymer electrode arrays |
Referências
- Chung, J. E., et al. High-Density, Long-Lasting, and Multi-region Electrophysiological Recordings Using Polymer Electrode Arrays. Neuron. 101 (1), 21-31 (2019).
- Fu, T. M., Hong, G., Viveros, R. D., Zhou, T., Lieber, C. M. Highly scalable multichannel mesh electronics for stable chronic brain electrophysiology. Proceedings of the National Academy of Sciences of the United States of America. 114 (47), E10046-E10055 (2017).
- Fu, T. M., et al. Stable long-term chronic brain mapping at the single-neuron level. Nature Methods. 13 (10), 875-882 (2016).
- Gilletti, A., Muthuswamy, J. Brain micromotion around implants in the rodent somatosensory cortex. Journal of Neural Engineering. 3 (3), 189-195 (2006).
- Jeong, J. W., et al. Soft Materials in Neuroengineering for Hard Problems in Neuroscience. Neuron. 86 (1), 175-186 (2015).
- Kim, T. I., et al. Injectable, cellular-scale optoelectronics with applications for wireless optogenetics. Science. 340 (6129), 211-216 (2013).
- Lee, H. C., et al. Histological evaluation of flexible neural implants; flexibility limit for reducing the tissue response?. Journal of Neural Engineering. 14 (3), (2017).
- Luan, L., et al. Ultraflexible nanoelectronic probes form reliable, glial scar-free neural integration. Science Advances. 3 (2), (2017).
- Schuhmann, T. G., et al. Syringe-injectable Mesh Electronics for Stable Chronic Rodent Electrophysiology. Journal of Visualized Experiments. (137), (2018).
- Dhawale, A. K., et al. Automated long-term recording and analysis of neural activity in behaving animals. Elife. 6, (2017).
- Schwarz, D. A., et al. Chronic,wireless recordings of large-scale brain activity in freely moving rhesus monkeys. Nature Methods. 11 (6), 670-676 (2014).
- Kloosterman, F., et al. Micro-drive array for chronic in vivo recording: drive fabrication. Journal of Visualized Experiments. (26), (2009).
- Lu, L., Popeney, B., Dickman, J. D., Angelaki, D. E. Construction of an Improved Multi-Tetrode Hyperdrive for Large-Scale Neural Recording in Behaving Rats. Journal of Visualized Experiments. (135), (2018).
- Nguyen, D. P., et al. Micro-drive array for chronic in vivo recording: tetrode assembly. Journal of Visualized Experiments. (26), (2009).
- Herbawi, A. S., Kiessner, L., Paul, O., Ruther, P. High-Density Cmos Neural Probe Implementing a Hierarchical Addressing Scheme for 1600 Recording Sites and 32 Output Channels. , 20-23 (2017).
- Raducanu, B. C., et al. Time Multiplexed Active Neural Probe with 1356 Parallel Recording Sites. Sensors (Basel). 17 (10), (2017).
- Jun, J. J., et al. Fully integrated silicon probes for high-density recording of neural activity. Nature. 551 (7679), 232-236 (2017).
- Lopez, C. M., et al. A Neural Probe With Up to 966 Electrodes and Up to 384 Configurable Channels in 0.13 mu m SOI CMOS. Ieee Transactions on Biomedical Circuits and Systems. 11 (3), 510-522 (2017).
- Scholvin, J., et al. Close-Packed Silicon Microelectrodes for Scalable Spatially Oversampled Neural Recording. Ieee Transactions on Biomedical Engineering. 63 (1), 120-130 (2016).
- Bernatchez, S. F., Parks, P. J., Gibbons, D. F. Interaction of macrophages with fibrous materials in vitro. Biomaterials. 17 (21), 2077-2086 (1996).
- Sanders, J. E., Stiles, C. E., Hayes, C. L. Tissue response to single-polymer fibers of varying diameters: Evaluation of fibrous encapsulation and macrophage density. Journal of Biomedical Materials Research. 52 (1), 231-237 (2000).
- Seymour, J. P., Kipke, D. R. Neural probe design for reduced tissue encapsulation in CNS. Biomaterials. 28 (25), 3594-3607 (2007).
- Szarowski, D. H., et al. Brain responses to micro-machined silicon devices. Brain Research. 983 (1-2), 23-35 (2003).
- Thelin, J., et al. Implant Size and Fixation Mode Strongly Influence Tissue Reactions in the CNS. PLoS One. 6 (1), (2011).
- Mols, K., Musa, S., Nuttin, B., Lagae, L., Bonin, V. In vivo characterization of the electrophysiological and astrocytic responses to a silicon neuroprobe implanted in the mouse neocortex. Science Reports. 7 (1), 15642 (2017).
- Okun, M., Lak, A., Carandini, M., Harris, K. D. Long Term Recordings with Immobile Silicon Probes in the Mouse Cortex. PLoS One. 11 (3), e0151180 (2016).
- Kim, Y. T., Hitchcock, R. W., Bridge, M. J., Tresco, P. A. Chronic response of adult rat brain tissue to implants anchored to the skull. Biomaterials. 25 (12), 2229-2237 (2004).
- Biran, R., Martin, D. C., Tresco, P. A. The brain tissue response to implanted silicon microelectrode arrays is increased when the device is tethered to the skull. Journal of Biomedical Materials Research. Part A. 82 (1), 169-178 (2007).
- Lacour, S. P., Courtine, G., Guck, J. Materials and technologies for soft implantable neuroprostheses. Nature Reviews Materials. 1 (10), (2016).
- Geddes, L. A., Roeder, R. Criteria for the selection of materials for implanted electrodes. Annals of Biomedical Engineering. 31 (7), 879-890 (2003).
- Fattahi, P., Yang, G., Kim, G., Abidian, M. R. A Review of Organic and Inorganic Biomaterials for Neural Interfaces. Advanced Materials. 26 (12), 1846-1885 (2014).
- Weltman, A., Yoo, J., Meng, E. Flexible, Penetrating Brain Probes Enabled by Advances in Polymer Microfabrication. Micromachines. 7 (10), (2016).
- Ware, T., et al. Fabrication of Responsive, Softening Neural Interfaces. Advanced Functional Materials. 22 (16), 3470-3479 (2012).
- Harris, J. P., et al. Mechanically adaptive intracortical implants improve the proximity of neuronal cell bodies. Journal of Neural Engineering. 8 (6), (2011).
- Rousche, P. J., et al. Flexible polyimide-based intracortical electrode arrays with bioactive capability. Ieee Transactions on Biomedical Engineering. 48 (3), 361-371 (2001).
- Patel, P. R., et al. Insertion of linear 8.4 mu m diameter 16 channel carbon fiber electrode arrays for single unit recordings. Journal of Neural Engineering. 12 (4), (2015).
- Xiang, Z. L., et al. Ultra-thin flexible polyimide neural probe embedded in a dissolvable maltose-coated microneedle. Journal of Micromechanics and Microengineering. 24 (6), (2014).
- Felix, S., et al. Removable silicon insertion stiffeners for neural probes using polyethylene glycol as a biodissolvable adhesive. Conference Proceedings of the IEEE Engineering in Medicine and Biology Society. 2012, 871-874 (2012).
- Felix, S. H., et al. Insertion of flexible neural probes using rigid stiffeners attached with biodissolvable adhesive. Journal of Visualized Experiments. (79), (2013).
- Kozai, T. D. Y., Kipke, D. R. Insertion shuttle with carboxyl terminated self-assembled monolayer coatings for implanting flexible polymer neural probes in the brain. Journal of Neuroscience Methods. 184 (2), 199-205 (2009).
- Joo, H. R., Fan, J. L., Chen, S., et al. A microfabricated, 3D-sharpened silicon shuttle for insertion of flexible electrode arrays through dura mater into brain. J Neural Eng. , (2009).
- Sohal, H. S., et al. The sinusoidal probe: a new approach to improve electrode longevity. Frontiers in Neuroengineering. 7, 10 (2014).
- Kim, B. J., et al. 3D Parylene sheath neural probe for chronic recordings. Journal of Neural Engineering. 10 (4), (2013).
- Zhao, Z., et al. Parallel, minimally-invasive implantation of ultra-flexible neural electrode arrays. Journal of Neural Engineering. , (2019).
- Richter, A., et al. A simple implantation method for flexible, multisite microelectrodes into rat brains. Frontiers in Neuroengineering. 6, 6 (2013).
- Hanson, T. L., Diaz-Botia, C. A., Kharazia, V., Maharbiz, M. M., Sabes, P. N. The “sewing machine” for minimally invasive neural recording. bioRxiv. , (2019).
- Jackson, N., Muthuswamy, J. Artificial dural sealant that allows multiple penetrations of implantable brain probes. Journal of Neuroscience Methods. 171 (1), 147-152 (2008).
- Gage, G. J., et al. Surgical implantation of chronic neural electrodes for recording single unit activity and electrocorticographic signals. Journal of Visualized Experiments. (60), (2012).
- Bothe, R. T., Beaton, K. E., Davenport, H. A. Reaction of Bone to Multiple Metallic Implants. Surgery, Gynecology and Obstetrics. 71, 598-602 (1940).
- Chung, J. E., et al. A Fully Automated Approach to Spike Sorting. Neuron. 95 (6), 1381-1394 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados