Method Article
Uso de um microarray do antígeno da gripe para medir a amplitude de anticorpos do soro através dos subtypes do vírus
Neste Artigo
Resumo
Nós apresentamos um protocolo para usar um microarray da proteína construído imprimindo antígenos da gripe em corrediças nitrocelulose-revestidas para sonda simultaneamente o soro para isotipos múltiplos do anticorpo de encontro a mais de 250 antígenos das tensões diferentes do vírus, assim permitindo a medida da amplitude de anticorpos do soro através dos subtypes do vírus.
Resumo
O vírus da gripe continua a ser uma causa significativa de mortalidade em todo o mundo devido à eficácia limitada das vacinas atualmente disponíveis. Um desafio fundamental para o desenvolvimento de vacinas contra a gripe universal é a alta diversidade antigênica resultante da deriva antigênica. Superar esse desafio requer novas ferramentas de pesquisa para medir a amplitude de anticorpos séricos direcionados contra muitas cepas de vírus em diferentes subtipos antigênicos. Aqui, nós apresentamos um protocolo para analisar a amplitude de anticorpos do soro de encontro às tensões diversas do vírus da gripe usando um microarray da proteína de antígenos da gripe.
Este microarray do antígeno da gripe é construído imprimindo antígenos purificados do hemaglutinina e do neuraminidase em uma membrana nitrocelulose-revestida usando uma impressora do Microarray. Os soros humanos são incubados no microarray para ligar anticorpos contra os antígenos da gripe. Os anticorpos secundários Quantum-dot-conjugados são usados para detectar simultaneamente os anticorpos de IgG e de IgA que ligam a cada antígeno no microarray. A ligação quantitativa do anticorpo é medida como a intensidade da fluorescência usando um Imager portátil. Os resultados representativos são mostrados para demonstrar a reprodutibilidade do ensaio na medição de anticorpos de gripe subtipo-específicos e de reação cruzada em soro humano.
Comparado aos métodos tradicionais tais como Elisa, o microarray do antígeno da gripe fornece uma aproximação multiplexada da taxa de transferência elevada capaz de testar centenas de soros para isotipos múltiplos do anticorpo de encontro às centenas de antígenos em um frame de tempo curto, e tem assim aplicações em sero-vigilância e desenvolvimento de vacinas. Uma limitação é a incapacidade de distinguir anticorpos de ligação de anticorpos neutralizantes.
Introdução
O vírus da gripe é responsável por uma perda de 20 milhões anos de vida anualmente por morte ou incapacidade, incluindo 1% de todas as mortes em todo o mundo a cada ano, com impactos desproporcionados sobre os idosos e populações nos trópicos e mundo em desenvolvimento1, 2,3. Além da carga de doença das epidemias sazonais, o surgimento de novas cepas de influenza por meio de re-sortimento genético, seja naturalmente em hospedeiros comuns ou artificialmente para o bioterrorismo, pode levar a pandemias mundiais com disseminação rápida e alta letalidade 4. º , 5. enquanto numerosas vacinas contra a gripe estão atualmente disponíveis, a sua eficácia é limitada pela especificidade do subtipo6, criando a necessidade de desenvolver vacinas contra a gripe universal que conferem imunidade duradoura contra múltiplos vírus estirpes7.
Um desafio fundamental para o desenvolvimento de vacinas contra a gripe universal é a alta diversidade antigênica em todas as cepas. A especificidade antigênica das vacinas atuais combinadas com a variação antigênica de vírus circulantes cria uma incompatibilidade entre cepas vacinais e cepas circulantes. Isso confere uma vantagem evolutiva favorecendo uma maior deriva genética das cepas vacinais durante uma epidemia, limitando a eficácia vacinal frequentemente a menos de 50%8,9. Uma fonte adicional de incompatibilidade antigênica é mutações virais adaptativas ao ovo geradas durante o fabrico de vacinas, que levam a anticorpos que se ligam mal aos vírus circulantes10,11.
Superar este desafio da diversidade antigénica elevada exigirá ferramentas novas da pesquisa caracterizar a amplitude de respostas imunes pre-existing e eliciadas através das variações antigénicas clìnica relevantes em espécimes do soro e da mucosa. Os métodos atualmente disponíveis, incluindo a inibição da hemaglutinação (HAI), a microneutralização (MN) e o ELISA tradicional, limitam-se a detectar anticorpos contra uma única estirpe de vírus de cada vez, pelo que a sua utilização para a detecção de múltiplos isótipos de anticorpos contra múltiplas cepas de vírus esgota rapidamente os recursos clínicos disponíveis de espécimes e laboratórios. Além disso, o HAI e o MN exigem a cultura viva do vírus que está somente disponível em laboratórios especializados.
Microarrays proteicos, potencialmente constituídos por até milhares de antígenos impressos em lâminas revestidas com nitrocelulose, como mostrado na Figura 1, podem preencher essa necessidade12. Estes Microarrays podem ser produzidos e sondar em uma maneira elevada da taxa de transferência ao consumir quantidades pequenas de espécime clínico para determinar níveis quantitativos do isotipo/SubType do anticorpo de encontro a cada antígeno individual na disposição. Esta aproximação à descoberta do antígeno foi aplicada ao desenvolvimento diagnóstico e da vacina de encontro aos micróbios patogénicos infecciosos múltiplos13. Até à data, nós produzimos Microarrays de proteínas para mais de 35 patógenos, incluindo mais de 60.000 proteínas expressas totais e os utilizamos para sondar mais de 30.000 soros humanos de indivíduos infectados e de controle. Uma plataforma portátil recentemente desenvolvida da imagem latente para corrediças do microarray fêz esta metodologia mais acessível ao usuário final14.
Com base em extenso trabalho prévio de múltiplos contribuintes no campo15,16,17,18,19, foi recentemente desenvolvido um microarray de proteínas da gripe que contém mais de 250 variantes antigênicas purificadas de hemaglutinina (ha) com representação de todos os 18 subtipos12,20. Usando esta metodologia, uma infecção natural da gripe foi demonstrada para gerar anticorpos de IgG e de IgA extensamente reactivos de encontro aos subtypes phylogeneticamente relacionados do HA, quando uma vacinação intramuscular da gripe gerou somente o subtipo-específico IgG anticorpos21. No entanto, a adição de um adjuvante que ativa os receptores de pedágio para vacinas contra a gripe foi mostrado para ampliar a resposta de anticorpos IgG eliciados em subtipos de HA em estudos em animais22.
Este microarray está sendo usado atualmente para sondar soros coletados de um estudo de coorte prospectivo dos estudantes universitários que foram seguidos para a infecção da gripe. Aqui, a metodologia do microarray do antígeno da gripe com demonstração da reprodutibilidade do ensaio para detectar anticorpos subtipo-específicos e Cross-Reactive em um subconjunto dos espécimes deste estudo é relatada.
Protocolo
Todos os soros humanos são manuseados e eliminados de acordo com protocolos institucionais aprovados para a biossegurança com uso de equipamentos pessoais protetores. Todos os profissionais de laboratório que participam deste protocolo receberam treinamento em biossegurança e ética em pesquisa.
1. produza Microarrays do antígeno da gripe
-
Projete e obtenha o conjunto do antígeno para o microarray
- Obtenha antígenos protéicos expressos e purificados como pó liofilizado.
-
Imprima antígenos para slides de Microarray
- Reconstituir cada antígeno liofilizado para uma concentração de 0,1 mg/mL em solução salina tamponada com fosfato (PBS) com 0, 1% Tween-20 (T-PBS). Transfira 10 μL de cada antígeno reconstituído para poços individuais de uma placa de fundo plano 384-well não tratada.
- Imprima antígenos usando uma impressora de Microarray (a impressora de Microarray usada neste estudo não está mais disponível comercialmente, consulte discussão) com pinos de detecção de Microarray de baixo volume que aspiram o antígeno para o canal de amostra e depositam via Direct contato e ação capilar para lâminas de vidro revestidas com nitrocelulose de 16 pad.
- Programe o software de impressão (por exemplo, gridder) com a configuração da placa de origem e os parâmetros de impressão.
- Use o menu suspenso para selecionar o nome do tipo de placa que será usado com este método de impressão. Para este estudo, use uma placa de fundo liso 384-well não tratada.
- Selecione a caixa de texto ao lado de número de placas e digite o número de placas de amostra que serão usadas neste protocolo de impressão. Para este estudo, use 1 placa.
- Selecione uma configuração de pino para usar com este método. Para este estudo, use uma configuração de 8 pinos.
- Assegure-se de que os deslocamentos de origem sejam as distâncias (nas direções X e Y) entre a origem do slide (que é calibrada na seção administrativa) e o local onde os pinos de impressão começarão a imprimir nos slides.
- Usando a guia design da matriz , defina o tamanho e a forma das matrizes (espaçamento de ponto e número de pontos por subarray). Para este estudo, imprima 324 pontos (180 μm de diâmetro com espaçamento de 300 μm) para slides de 16 pad em um formato 18x18 usando 8 pinos.
- Selecione os parâmetros de como os pinos de impressão selecionam e dispensam amostras. Para este estudo, cada pino aspita 250 nL de solução de antígeno e imprime 1 nL em cada um dos 40 pontos (total de 20 slides para todos os 8 pinos)
- Configure o protocolo de limpeza de pino e o protocolo de blotting. Para este estudo, cada pino imprime O antígeno, é mergulhado no ddH estéril2O no recipiente sonicated da lavagem, e aspita então O antígeno seguinte.
- Defina a sequência na qual os blocos de exemplo são impressos nos slides. O software da matriz construirá um arquivo de índice de grade anotado (. Gal) para descrever a disposição de antígenos dentro de cada microarray.
Nota: a linha superior é usada para fiduciais (com fluorescência em todos os comprimentos de onda usados na imagem latente, por exemplo, mistura do conjugado do estreptavidina de qdot 585 nanômetro e do conjugado do estreptavidina de qdot 800 nanômetro neste estudo) para orientar grades durante a imagem latente. Para longas execuções de impressão, os antígenos na placa de origem podem ser periodicamente resuspensos por pipetagem para cima e para baixo e, em seguida, centrifugação, ou nova placa de fonte pode ser preparada e usada.
- Programe o software de impressão (por exemplo, gridder) com a configuração da placa de origem e os parâmetros de impressão.
- Coloc o microarray un-Probed desliza em uma caixa opaco e mantem-se em um armário do exsicador na temperatura ambiente para o armazenamento a longo prazo.
Observação: o protocolo pode ser pausado indefinidamente neste momento.
-
Executar verificação de controle de qualidade (requer Tags de poli-histidina)
- Prenda a corrediça às câmaras de sondagem e rehidrate com amortecedor de obstrução como descrito na etapa 2.1.1-2.1.2 e mostrado em Figura 2.
- Diluir o anticorpo monoclonal poli-his do rato 1:100 no tampão de obstrução filtrado 1x.
Nota: se antígenos proteicos não purificados (por exemplo, expressos em sistema de transcrição e tradução in vitro) são usados diretamente para imprimir Microarrays, adicionar componentes do sistema de expressão protéica (por exemplo, e. coli lysate) em uma proporção de 1:10 com o tampão de bloqueio usado para a diluição do soro a fim obstruir todos os anticorpos dirigidos de encontro a estes componentes. - Adicionar 100 μL de anticorpo poli-his diluído a cada câmara de slides contendo pad de matriz após aspiração e incubar durante 2 h à temperatura ambiente ou durante a noite a 4 ° c na coqueteleira. Lave 3x com o tampão T-TBS como descrito na etapa 2.2.1. Diluir o anticorpo secundário IgG do anti-rato da cabra conjugado com biotina 1:200 no tampão de obstrução, adiciona 100 μL por bem após a aspiração, e incubar para 1 h na temperatura ambiente no abanador. Lave 3x com tampão T-TBS.
- Diluir o conjugado Qdot 585 nm estreptavidina a 4 nM no tampão de bloqueio, adicionar 100 μL por poço após aspiração e incubar durante 1 h à temperatura ambiente na coqueteleira. Lave 3x com buffer T-TBS e, em seguida, uma vez com o buffer TBS (sem Tween).
- Dissimular e quantificar slides conforme descrito na etapa 2.2.5 – 3.1.2.
Nota: antígenos proteicos devem conter suas10 Tags para usar este protocolo de controle de qualidade. Alternativamente, se uma etiqueta diferente é incluída, a verificação do controle da qualidade pode ser executada com o anticorpo ou o ligante para essa etiqueta.
2. sonda soros para anticorpos influenza usando Microarrays
-
Incubar soros em Microarrays para ligação de anticorpos
- Anexe slides de Microarray a câmaras usando clipes e coloque em quadros, como mostrado na Figura 3.
Nota: Evite sempre tocar na almofada do microarray com as mãos e os instrumentos. Assegure-se de que as corrediças estejam orientadas com o lado da almofada acima e o entalhe pequeno no canto direito superior. - Rehidrate lâminas de Microarray com 100 μL por poço de tampão de bloqueio filtrado 1x e dilui o soro 1:100 em 100 μL de tampão de bloqueio (pode usar placas de 96-poço não tratadas ou 2 tubos de mL). Incubar ambas as lâminas de Microarray rehidratadas em quadros cobertos e soro diluído separadamente por 30 minutos à temperatura ambiente no agitador orbital a 100-250 rpm. Realize todas as etapas subseqüentes da incubação similarmente no abanador.
Nota: os soros devem ser aliquotados e congelados em-80 ° c para o armazenamento a longo prazo para minimizar ciclos Freeze-Thaw e devem ser vórtice para misturar e centrifugado para remover as partículas antes do uso. Observe cuidadosamente as câmaras de slides durante e após esta etapa para detectar qualquer vazamento que exija a remontagem de câmaras de slides. - Usando pontas da pipeta conectadas a uma linha do vácuo com o balão secundário da coleção, aspirado com cuidado obstruindo o amortecedor do canto de cada câmara sem almofadas de toque. Execute todas as etapas subseqüentes da aspiração similarmente. Adicionar soro diluído para almofadas rapidamente após a aspiração, a fim de não permitir que as almofadas para secar.
- Coloc frames cobertos nas bandejas dentro de um recipiente secundário cercado por toalhas de papel húmidas e selado para impedir a evaporação. Incubar durante a noite a 4 ° c no abanador de balanço (Alternativamente, pode incubar para 2 h na temperatura ambiente no abanador orbital em 100-250 rpm).
- Anexe slides de Microarray a câmaras usando clipes e coloque em quadros, como mostrado na Figura 3.
-
Anticorpos séricos associados ao rótulo com anticorpos secundários conjugados com ponto quântico
- Aspirar soros de câmaras cuidadosamente como descrito acima, adicionar 100 μL por poço de tampão T-TBS (20 mM Tris-HCl, 150 mM NaCl, 0, 5% Tween-20 em ddH2O ajustado para pH 7,5 e filtrado, pode ser obtido comercialmente), e incubar por 5 min em agitador orbital em 100-250 rpm. Repita este passo de lavagem um total de 3x (todas as etapas subsequentes da lavagem são executadas similarmente).
- Prepare a mistura de anticorpos secundários diluídos para 1 μM em tampão de bloqueio e misture bem com pipetagem antes e durante a utilização para manter a homogeneidade.
Observação: para manter a reprodutibilidade do ensaio, o mesmo lote de cada anticorpo secundário deve ser usado para todos os experimentos de sondagem para os quais a comparação quantitativa de dados em experimentos é planejada. A concentração específica de anticorpo secundário pode necessitar de ser variada dependendo da afinidade; Siga os protocolos do fabricante sempre que disponível. - Aspirar o tampão das câmaras após a lavagem final, adicione 100 μL por o poço da mistura secundária do anticorpo, e incubar para 2 h na temperatura ambiente no abanador.
- Aspire a mistura secundária do anticorpo 3x com amortecedor de T-TBS, e lave-a então uma vez com amortecedor de TBS (sem Tween).
- O microarray dissemble desliza das câmaras com cuidado para evitar tocar almofadas, enxaguar delicadamente com ddH filtrado2O, e secar coloc em 50 tubos do ml e centrifugação em 500 x g por 10 minutos.
- Coloc o microarray sondado desliza em uma caixa opaco e mantem-se em um armário do exsicador na temperatura ambiente para o armazenamento a longo prazo.
Observação: o protocolo pode ser pausado por até 1 semana neste momento.
3. quantificar a ligação do anticorpo aos antígenos dentro do microarray
-
Visualize slides de Microarray e quantifique a intensidade de fluorescência spot para medir a ligação de anticorpos
- Adquira imagens de slides microarray usando o Imager portátil com built-in software.
- Na guia Configurar Imager , selecione a configuração de slide adequada. Para este estudo, use slides de 16 pad.
- Na guia controle de imagem , selecione o canal fluorescente adequado e ajuste o ganho, o tempo de exposição e o tempo de aquisição, dependendo da reatividade dos soros para obter imagens ideais. Para este estudo, as canaletas fluorescentes para IgA e IgG eram 585 nanômetro e 800 nanômetro respectivamente, e os ajustes da imagem latente eram ganho de 50, tempo da exposição de 500 MS, e tempo da aquisição de 1 s.
- Clique em Capture para iniciar o processo de aquisição da imagem.
Nota: slides microarray pode ser re-imaged em várias configurações sem degradação do sinal, desde que eles são armazenados escuro e seco. Outros sistemas de imagem podem ser usados se for compatível com os slides.
- Detecte manchas de matriz usando grades orientadas com base nos marcadores de valor e medir a intensidade do ponto como mediana da intensidade do pixel menos o fundo medido em torno de manchas. Execute este algoritmo de quantificação em lote usando o software de Imager incorporado, que utiliza o arquivo. Gal construído na etapa 1.2.2 para conectar intensidades de spot a antígenos individuais em cada microarray.
- No painel informações do arquivo , carregue o arquivo. Gal selecionando a partir de sua pasta no computador e especifique a pasta onde os arquivos de saída da análise devem ser salvos na seção Opções de análise .
- Na guia controle de imagem , abra uma das imagens adquiridas a serem quantificadas e selecione o botão automático no canto superior direito.
- Na seção análise de matriz no canto inferior direito, crie um modelo de criação conforme instruído pelo software.
- Clique na análise de lote, selecione a pasta que contém as imagens a serem quantificadas e selecione o modelo de base que foi criado na etapa anterior. O software analisa cada imagem e quantifica a intensidade do spot.
Nota: esta etapa irá gerar um arquivo. csv contendo intensidades de spot quantificando anticorpos dentro de cada espécime de soro que se ligam a cada antígeno individual no microarray que posteriormente pode ser manipulado em software de manipulação ou análise de planilhas.
- Analise dados brutos para comparar a ligação de anticorpos entre antígenos e entre espécimes de soro. Para este estudo, anticorpos IgA e IgG medidos como 585 nm e 800 nm intensidades de spot fluorescentes foram comparados em todos os antígenos entre 2 funcionamentos independentes do experimento usando diferentes lâminas em dias diferentes, e análise de correlação foi realizada para reprodutibilidade do ensaio de medida.
Nota: para proteínas não purificadas impressas como mistura de expressão, a análise dos dados deve começar com a subtração de fundo de um controle sem DNA.
- Adquira imagens de slides microarray usando o Imager portátil com built-in software.
Resultados
Como demonstração do protocolo, os soros de base foram analisados a partir de 16 indivíduos dentro de um estudo de coorte prospectivo de estudantes universitários seguidos de infecção por influenza no microarray antigénio da gripe. Para demonstrar a reprodutibilidade do ensaio, estes espécimes foram sonados duas vezes, em diferentes lâminas e dias diferentes.
Para este estudo, antígenos de influenza purificados contendo suas10 Tags foram obtidos do vendedor comercial (ver tabela de materiais) e colaboradores. Esses antígenos incluem 251 antígenos de HA total, com 63 domínios de cabeça globular (HA1) e 186 proteínas de comprimento total (HA0), incluindo 96 proteínas monoméricas HA0 e 90 proteínas HA0 trimerizadas contendo Trimerização fundida ("foldon") domínio23. Uma lista completa de antígenos e controles usados neste estudo é incluída como um arquivo complementar. Para este estudo, os anticorpos secundários usados eram IgG anti-Human da cabra conjugados ao ponto do Quantum que emite-se em 800 nanômetro (GAH-IgG-Q800) e IgA anti-Human da cabra conjugada ao ponto do Quantum que emite-se em 585 nanômetro (GAH-IgA-Q585) para a deteção multiplex de anticorpos de IgG e de IgA como mostrada na Figura 3. A associação de anticorpos IgG e IgA a diferentes subtipos e formas moleculares de antígenos da influenza HA foi comparada para os soros obtidos da coorte clínica descrita acima.
O mapa de calor resultante é mostrado na Figura 4 com representação gráfica na Figura 5. Nestes números, apenas os subtipos clinicamente relevantes com alta representação na matriz são rotulados para economizar espaço, com "+" indicando todos os subtipos restantes de maior número, e subtipos menores ou menos bem representados incluídos como ordenados (por exemplo, H2 entre H1 e H3). Uma lista completa de cepas e subtipos na matriz é incluída como arquivo complementar. Estes dados demonstram que os anticorpos ao grupo principal de HA são SubType-específicos com quantidade elevada esperada de anticorpos às tensões clìnica prevalecentes (H1N1, H3N2, e B) e baixa quantidade de anticorpos a outras tensões. Entretanto, os anticorpos ao HA inteiro, que inclui o domínio do talo, são mais Cross-Reactive através dos subtypes, e este efeito parece ser aumentado quando o HA inteiro é trimerized. Este resultado não é inesperado, porque o HA inteiro inclui a região da haste, que é conservada altamente através dos subtypes. Conseqüentemente, os anticorpos às moléculas inteiras do ha dos subtipos não-clínicos (por exemplo, H5 e H7) representam provavelmente os anticorpos do anti-tronco eliciados originalmente de encontro aos subtipos clínicos (por exemplo, H1 e H3) que estão reagindo com as regiões do tronco dos outros subtipos do ha na matriz. Este ponto ilustra a importância de incluir a cabeça HA e a molécula inteira HA na disposição para distinguir entre anticorpos à cabeça e às regiões da haste que mostram perfis diferentes da reactividade.
O ensaio demonstra boa reprodutibilidade em ensaios de sondagem. A segunda execução mostra anticorpos IgG ligeiramente inferiores em todas as cepas, embora o padrão entre as cepas seja consistente. Esta diminuição ligeira da em--placa é provável devido à variabilidade do lote-à-grupo no anticorpo secundário, que foi mudada entre funcionamentos para IgG mas não para IgA. Assim, como observado no protocolo, recomenda-se usar o mesmo lote de cada anticorpo secundário para quaisquer experimentos entre os quais a comparação quantitativa é planejada. Se forem necessários diferentes lotes de anticorpos devido a um elevado número de amostras a serem testadas, é recomendável incluir amostras compartilhadas entre ensaios experimentais com diferentes lotes de anticorpos para permitir a comparação quantitativa com a correção.
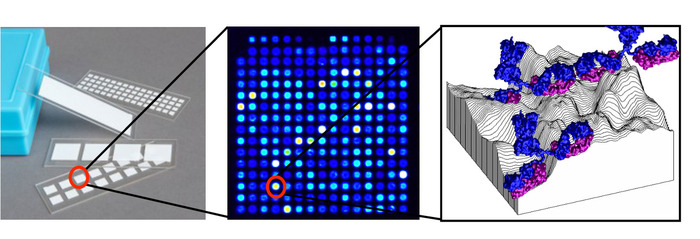
Figura 1: esquema de Microarranjo proteico. Cada slide contém múltiplas almofadas cada uma com uma única matriz, que consiste de centenas de antígenos impressos em manchas dispostas em uma grade, com cada ponto contendo um antígeno adsorto na topografia tridimensional da superfície de nitrocelulose a que anticorpos do soro são limitados. Por favor clique aqui para ver uma versão maior desta figura.
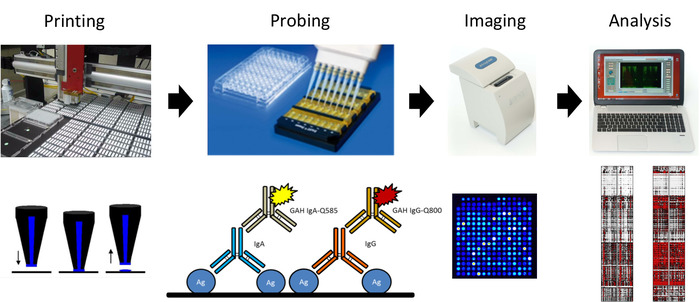
Figura 2: esquema da impressão do microarray do antígeno da gripe e do protocolo de sondagem. Da esquerda para a direita, o microarray é impresso usando-se em lâminas revestidas com nitrocelulose, que são usadas para sondar os soros para anticorpos IgG e IgA usando anticorpos secundários conjugados com ponto quântico, com lâminas imaged usando um gerador de imagens portátil, e os resultados analisados para gerar um mapa de calor. Por favor clique aqui para ver uma versão maior desta figura.

Figura 3: procedimento para prender a câmara de sondagem ao slide do Microarray. De a a F, a câmara de sondagem é colocada na parte superior do slide na orientação correta, anexada ao slide usando clipes horizontais nas laterais e colocada na bandeja de sondagem. Por favor clique aqui para ver uma versão maior desta figura.
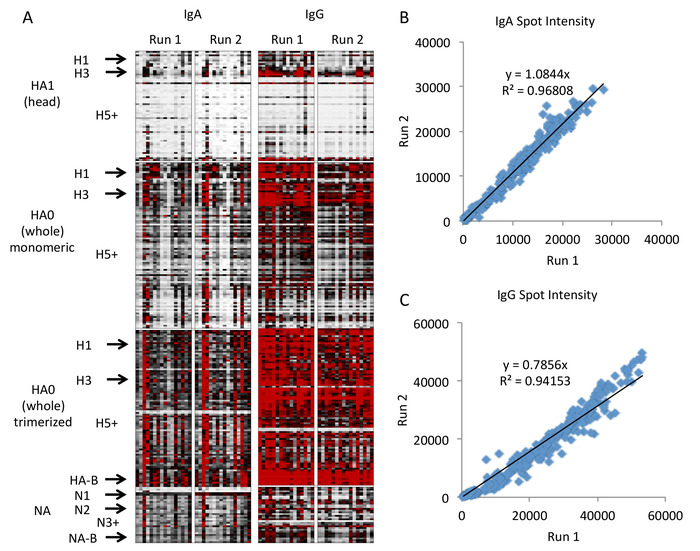
Figura 4: resultados representativos do Microarranjo do antígeno da gripe. Os mapas de calor representam respostas antígeno-específicas do anticorpo, com cada fileira que representa um único antígeno arranjado pela molécula, pelo SubType, e pela tensão, e por cada coluna que representa uma execução de sondagem de um único espécime, arranjada pelo isotipo e pelo funcionamento do anticorpo (a, branco = 0, preto = 20000, vermelho = 40000 intensidade de fluorescência). Os subtipos do antígeno que incluem todos os subtipos do hemaglutinina de 1 a 18 e todos os subtipos do neuraminidase de 1 a 10 são arranjados verticalmente e etiquetados na esquerda. Uma comparação da intensidade da fluorescência entre duas execuções demonstra boa reprodutibilidade do ensaio por regressão linear para IgA (B) e IgG (C). Por favor clique aqui para ver uma versão maior desta figura.

Figura 5: amplitude dos anticorpos séricos medidos no Microarranjo do antígeno da gripe. Os níveis séricos de IgA (A) e IgG (B) são agrupados por ha e na formas moleculares e subtipos para demonstrar alta especificidade de anticorpos de grupo de cabeça de ha para subtipos clínicos e alta reatividade cruzada de ha inteira e anticorpos de ha inteiros trimerizados com inclusão da região da haste. Por favor clique aqui para ver uma versão maior desta figura.
Arquivo suplementar: lista dos antígenos no microarray do antígeno da gripe. O conteúdo é mostrado para todos os 324 pontos na matriz, incluindo espaços em branco, fiducials, controles (IgG humana e IgA e IgG anti-humanos e IgA em 0,1 mg/mL e 0,3 mg/mL), e antígenos com informações sobre fonte, forma molecular, subtipo e estirpe. Abreviaturas são as seguintes: para a fonte, sino = sino biológico Inc., FKL = Florian Krammer laboratório; para a forma molecular, HA1 = HA de cabeça, HA0 = HA inteira, HA2 = haste HA, NP = nucleoproteína. Para os antígenos originados da sino Biological Inc., os números de catálogo são mostrados; para antígenos originados do laboratório de Krammer, os IDs do antígeno são alistados. Por favor, clique aqui para baixar este arquivo.
Discussão
O protocolo do microarray do antígeno da gripe descrito aqui é adaptável a todo o projeto que exija analisar respostas do anticorpo a muitos antígenos. A plataforma do microarray pode ser usada com todo o jogo desejado de antígenos da proteína expressado em todo o sistema que puder conseguir 0,1 mg/mL ou um rendimento mais elevado com ou sem purificação como descrito previamente12. Se antígenos proteicos não purificados (por exemplo, expressos em sistema de transcrição e tradução in vitro) são usados diretamente para imprimir Microarrays, componentes do sistema de expressão protéica (por exemplo, e. coli lysate) devem ser adicionados 1:10 ao bloqueio de buffer usado para diluição de soro e de anticorpos de controlo de qualidade, a fim de bloquear quaisquer anticorpos dirigidos contra estes componentes. As configurações de slide estão disponíveis com um número menor de almofadas maiores em cada slide para acomodar um número maior de antígenos por matriz. Para este estudo, utilizamos uma impressora de Microarray GeneMachines OmniGrid 100 que utiliza pinos que contatam diretamente a superfície de nitrocelulose para depositar manchas na matriz. Embora essa impressora de Microarray não esteja mais disponível comercialmente, outras impressoras de Microarray disponíveis comercialmente podem ser usadas neste protocolo, mas podem exigir Pins personalizados (entre em contato ou sem contato) e software e devem ter uma resolução de ponto suficiente e compatibilidade com slides e Imager. Dependendo da reatividade dos soros, as diluições de 1:50 a 1:400 podem ser usadas. O tampão soro-livre pode ser usado como um controle negativo, quando os anticorpos monoclonais conhecidos para se ligar ao antígeno podem ser usados como um controle positivo.
Os usuários devem estar cientes de alguns problemas de solução de problemas. O objetivo da verificação de controle de qualidade usando anticorpos para a sua Tag é verificar se há antígenos para os quais a impressão não foi bem-sucedida. Quaisquer manchas que consistentemente dão sinal baixo na verificação de controle de qualidade de várias matrizes provavelmente representam insuficiente antígeno impresso. As razões possíveis incluem a agregação ou a precipitação ou o antígeno na placa de fonte ou o contato pobre entre o pino da impressão e a corrediça do microarray devido à espessura variável da almofada da nitrocelulose. Neste ponto, não realizamos a normalização do ensaio com base em resultados quantitativos da verificação de controle de qualidade, uma vez que a ligação detectada de anticorpos anti-his pode ser influenciada pela disponibilidade desta tag, que depende da conformação tridimensional específico para cada antígeno.
O microarray do antígeno da gripe fornece diversas vantagens sobre métodos tradicionais tais como ELISA e é complementar aos ensaios funcionais tais como HAI e MN. O microarray da proteína de 16 tapetes de carro é uma tecnologia Sample-poupando com capacidade medir anticorpos de isotipos múltiplos simultaneamente de encontro a aproximadamente 300 antígenos de 1 μl do soro. O número de antígenos pode ser aumentado para os milhares, diminuindo o número de almofadas por slides. O ensaio multiplexado também poupa tempo de pessoal e recursos consumíveis, dado que centenas de soros podem ser sondados para anticorpos em 2 dias, e todos os materiais que não sejam lâminas e reagentes são reutilizáveis, por isso não geram grandes quantidades de resíduos plásticos.
Enquanto as impressoras de Microarray podem não ser amplamente distribuídas, os slides de Microarray podem ser impressos em um local centralizado e, em seguida, transportados para o usuário final para sondagem. O único equipamento exigido para sondar é o baixo custo e o Imager portátil. O objetivo de disseminar este protocolo é tornar a utilização desta técnica mais difundida.
As principais limitações do microarray antigénio da gripe são a incapacidade de caracterizar a função e a cinética dos anticorpos detectados. O microarray está detectando um conjunto policlonal de anticorpos de ligação para cada antígeno. Estes anticorpos podem ou não ser funcionais no vírus de neutralização em ensaios de HAI e de MN. No entanto, os ensaios de HAI e MN exigem cultura de vírus ao vivo com necessidade associada de instalações especializadas com armários de biossegurança de alto nível para testar anticorpos contra subtipos de gripe aviária, enquanto o microarray de proteínas não envolve vírus ao vivo componentes podem ser utilizados em qualquer laboratório básico. Em relação à cinética vinculativa, uma única diluição do soro sondado com uma matriz contendo uma única concentração de cada antígeno produz um único ponto de dados, que representa um composto de quantidade e afinidade somada sobre todos os anticorpos que se ligam ao antígeno . Para resolver completamente a cinética de ligação do antígeno-anticorpo, as concentrações múltiplas do antígeno e/ou as diluições seriais dos soros são exigidas.
Apesar destas limitações, o microarray do antígeno da gripe é uma ferramenta útil para caracterizar a amplitude de anticorpos da gripe através da paisagem antigénica que pode complementar os ensaios funcionais que são mais limitados na taxa de transferência e na disponibilidade.
Divulgações
Os autores não têm divulgações.
Agradecimentos
Os autores gostariam de reconhecer o Prof. Don Milton (Instituto de saúde pública aplicada, Universidade de Maryland, College Park, MD, EUA) para a coleta dos soros humanos a Universidade de Maryland protocolo IRB #313842 financiado pela DARPA N66001-18-2-4015 P00001. Os autores também gostariam de reconhecer o Prof. Florian Krammer (Icahn School of Medicine, Mt. Sinai, NY, EUA) por fornecer antígenos de HA e NA trimerizados financiados pela ODNI IARPA DJF-15-1200-K-0001725. S. Khan é parcialmente apoiado pelo Centro Nacional de recursos de pesquisa e o centro nacional de Ciências translacionais avançando, institutos nacionais de saúde, através da subvenção KL2 TR001416. O conteúdo é unicamente da responsabilidade dos autores e não representa necessariamente os pontos de vista oficiais da NIH.
Materiais
| Name | Company | Catalog Number | Comments |
| 16-pad nitrocellulose-coated glass slides | Grace Bio Labs | 305016 | |
| 1x GVS FAST blocking buffer | Fischer Scientific | 10485356 | |
| ArrayCam portable imager | Grace Bio Labs | 400S | Other imaging devices can be used to visualize slides if capable of achieving the resolution of the microarray spots and the excitation and emission wavelengths of the quantum dots. |
| Biotin-conjugated goat anti-mouse-IgG antibody | Thermo Fischer | 31800 | |
| HiBase 384-well plate | Greiner Bio-One | T-3037-11 | |
| Microarray pins | ArrayIt | GMP2 | Each different microarray printer may require its own custom microarray pins. |
| Mouse monoclonal poly-His antibody | Sigma-Aldrich | H1029 | |
| OmniGrid 100 microarray printer | GeneMachines | The version of the microarray printer used in this work is no longer commercially available, but the updated similar equipment is the OmniGrid Accent microarray printer from Digilab (Hopkinton, MA), and the same protocol can be carried out with most commercially available microarray printers. | |
| ProPlate slide chambers | Grace Bio Labs | 246890 | |
| ProPlate slide clips | Grace Bio Labs | 204838 | |
| ProPlate slide frames | Grace Bio Labs | 246879 | |
| Quantum dot 585 nm conjugated goat anti-human-IgA antibody | Grace Bio Labs | 110620 | |
| Quantum dot 585 nm streptavidin conjugate | Thermo Fischer | Q10111MP | |
| Quantum dot 800 nm conjugated goat anti-human-IgG antibody | Grace Bio Labs | 110610 |
Referências
- Murray, C. J., et al. Disability-adjusted life years (DALYs) for 291 diseases and injuries in 21 regions, 1990-2010: a systematic analysis for the Global Burden of Disease Study. Lancet. 380 (9859), 2197-2223 (2010).
- Renegar, K. B., Crouse, D., Floyd, R. A., Krueger, J. Progression of influenza viral infection through the murine respiratory tract: the protective role of sleep deprivation. Sleep. 23 (7), 859-863 (2000).
- Li, L., et al. Heterogeneity in Estimates of the Impact of Influenza on Population Mortality: A Systematic Review. American Journal of Epidemiology. 187 (2), 378-388 (2018).
- Fauci, A. S. Seasonal and pandemic influenza preparedness: science and countermeasures. Journal of Infectious Diseases. 194 Suppl 2, S73-S76 (2006).
- Duggal, A., Pinto, R., Rubenfeld, G., Fowler, R. A. Global Variability in Reported Mortality for Critical Illness during the 2009-10 Influenza A(H1N1) Pandemic: A Systematic Review and Meta-Regression to Guide Reporting of Outcomes during Disease Outbreaks. PLoS One. 11 (5), 2009-2010 (2016).
- Demicheli, V., Jefferson, T., Ferroni, E., Rivetti, A., Di Pietrantonj, C. Vaccines for preventing influenza in healthy adults. Cochrane Database Systematic Reviews. 2, CD001269 (2018).
- Erbelding, E. J., et al. A Universal Influenza Vaccine: The Strategic Plan for the National Institute of Allergy and Infectious Diseases. Journal of Infectious Diseases. , (2018).
- Xie, H., et al. H3N2 Mismatch of 2014-15 Northern Hemisphere Influenza Vaccines and Head-to-head Comparison between Human and Ferret Antisera derived Antigenic Maps. Scientific Reports. 5, 15279 (2015).
- Tricco, A. C., et al. Comparing influenza vaccine efficacy against mismatched and matched strains: a systematic review and meta-analysis. BMC Medicine. 11, 153 (2013).
- Katz, J. M., Webster, R. G. Efficacy of inactivated influenza A virus (H3N2) vaccines grown in mammalian cells or embryonated eggs. Journal of Infectious Disease. 160 (2), 191-198 (1989).
- Zost, S. J., et al. Contemporary H3N2 influenza viruses have a glycosylation site that alters binding of antibodies elicited by egg-adapted vaccine strains. Proceedings of the National Academy of Science. 114 (47), 12578-12583 (2017).
- Davies, D. H., et al. Profiling the humoral immune response to infection by using proteome microarrays: high-throughput vaccine and diagnostic antigen discovery. Proceedings of the National Academy of Science U. S. A. 102 (3), 547-552 (2005).
- Liang, L., Felgner, P. L. A systems biology approach for diagnostic and vaccine antigen discovery in tropical infectious diseases. Current Opinion in Infectious Diseases. 28 (5), 438-445 (2015).
- Jain, A., et al. Evaluation of quantum dot immunofluorescence and a digital CMOS imaging system as an alternative to conventional organic fluorescence dyes and laser scanning for quantifying protein microarrays. Proteomics. 16 (8), 1271-1279 (2016).
- Desbien, A. L., et al. Development of a high density hemagglutinin protein microarray to determine the breadth of influenza antibody responses. Biotechniques. 54 (6), 345-348 (2013).
- Mace, C. R., et al. Label-free, arrayed sensing of immune response to influenza antigens. Talanta. 83 (3), 1000-1005 (2011).
- Koopmans, M., et al. Profiling of humoral immune responses to influenza viruses by using protein microarray. Clinical and Microbiology Infections. 18 (8), 797-807 (2012).
- Bucukovski, J., Latorre-Margalef, N., Stallknecht, D. E., Miller, B. L. A Multiplex Label-Free Approach to Avian Influenza Surveillance and Serology. PLoS One. 10 (8), e0134484 (2015).
- Meade, P., Latorre-Margalef, N., Stallknecht, D. E., Krammer, F. Development of an influenza virus protein microarray to measure the humoral response to influenza virus infection in mallards. Emerging Microbes and Infection. 6 (12), e110 (2017).
- Vigil, A., Davies, D. H., Felgner, P. L. Defining the humoral immune response to infectious agents using high-density protein microarrays. Future Microbiology. 5 (2), 241-251 (2010).
- Nakajima, R., et al. Protein Microarray Analysis of the Specificity and Cross-Reactivity of Influenza Virus Hemagglutinin-Specific Antibodies. mSphere. 3 (6), (2018).
- Van Hoeven, N., et al. A Formulated TLR7/8 Agonist is a Flexible, Highly Potent and Effective Adjuvant for Pandemic Influenza Vaccines. Scientific Reports. 7, 46426 (2017).
- Krammer, F., et al. A carboxy-terminal trimerization domain stabilizes conformational epitopes on the stalk domain of soluble recombinant hemagglutinin substrates. PLoS One. 7 (8), e43603 (2012).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados